Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.47 no.2 Ensenada Abr./Jun. 2021 Epub 02-Dez-2022
https://doi.org/10.7773/cm.v47i2.3162
Artículos
Dinámica de cambios de uso de suelo y estimación de CO2 en manglares de la zona Marismas Nacionales, México
1Facultad de Biología, Universidad Autónoma de Sinaloa, 80007 Culiacán, Sinaloa, Mexico.
2Facultad de Ciencias de la Tierra y el Espacio, Universidad Autónoma de Sinaloa, 80007 Culiacán, Sinaloa, Mexico.
3Facultad de Geografía, Universidad Autónoma del Estado de México, 50110 Toluca de Lerdo, Mexico.
En los últimos años, se ha deforestado el 20% de manglar a nivel mundial. México es de los países con mayor pérdida de superficie de mangle, algo que contribuye a las emisiones de CO2 e impulsa el cambio climático. Sin embargo, falta conocimiento sobre los factores que influyen en la pérdida y la ganancia del manglar, las emisiones de CO2, y la dinámica de usos de suelo y cobertura vegetal a escala local y regional. Por tanto, los objetivos de este estudio fueron analizar la dinámica de uso de suelo en la zona de Marismas Nacionales (México) durante el periodo 1981-2015, determinar la tasa de deforestación y degradación anual del manglar y estimar las emisiones de CO2 derivadas de estos procesos utilizando técnicas de información geográfica. Para determinar los cambios de uso de suelo, con la matriz de tabulación cruzada, se adquirieron diversos parámetros de cambio que permitieron generar una ecuación para estimar la tasa de deforestación y degradación. Con los datos del Inventario Nacional de Emisiones de Gases y Compuestos de Efecto Invernadero (México), se estimaron las emisiones y las absorciones de CO2 (equivalente, CO2e) promovidas por deforestación, degradación, reforestación y recuperación natural de manglares. Para el periodo 1981-2005, la emisión estimada fue de 432.50 Gg de CO2e debido a una tasa anual de deforestación del 0.77%, y la degradación fue de 27.16 Gg de CO2e a una tasa anual de1 7.64%. Para el periodo 2005-2015, la emisión fue de 145.21 Gg de CO2e debido a una tasa anual de deforestación del 0.44%, y la degradación fue de 24.80 Gg de CO2e a una tasa anual del 4.94%. La mayor pérdida de manglar se debió a la transformación a suelos con categorías de agrícola-pecuario y desarrollo antrópico. La degradación sucedió por fenómenos naturales y actividades antropogénicas.
Palabras clave: manglar; tasa de deforestación; degradación; emisión de CO2
In recent years, 20% of mangroves have been lost to deforestation worldwide. Mexico is one of the countries with the greatest loss in mangrove surface area, contributing to CO2 emissions and promoting climate change. However, knowledge about the factors that influence the loss and gain in mangroves, CO2 emissions, and the dynamics of land use and vegetation cover at local and regional scales is lacking. Therefore, the objectives of this study were to analyze land use dynamics in the Marismas Nacionales area (Mexico) from 1981 to 2015, to determine the rate of mangrove deforestation and annual degradation, and to estimate the CO2 emissions derived from these processes using geographic information system techniques. To determine land use changes, we used the cross-tabulation matrix and obtained various change parameters that allowed generating an equation to estimate the rates of deforestation and degradation. We used data from the National Inventory of Emissions of Greenhouse Gases and Compounds (Mexico) to estimate CO2 emissions and absorptions (equivalent, CO2e) prompted by mangrove deforestation, degradation, reforestation, and natural recovery. For the 1981-2005 period, the emissions estimate was 432.50 Gg of CO2e due to the annual mangrove deforestation rate of 0.77%, and degradation was 27.16 Gg of CO2e, with an annual rate of 7.64%. For the 2005-2015 period, the emissions estimate was 145.21 Gg of CO2e due to an annual deforestation rate of 0.44%, and degradation was 24.80 Gg of CO2e, with an annual rate of 4.94%. The greatest mangrove loss was due to transformation into land in the agricultural-livestock and anthropic development categories. Degradation was due to natural phenomena and anthropogenic activities.
Key words: mangrove; deforestation rate; degradation; CO2 emission
Introducción
Los manglares, que se encuentran en la franja costera de las zonas tropicales y subtropicales, cumplen diversas funciones ecológicas y socioeconómicas, tales como proteger las pesquerías ribereñas y de altamar, controlar la erosión del suelo, ser un corredor biológico, y brindar las condiciones óptimas para las actividades acuícolas, el turismo y el ecoturismo (Yáñez-Arancibia et al. 1998, CONABIO 2009, Valdez-Hernández et al. 2009, CONAFOR 2013, MARN 2013, Rodríguez-Zúñiga et al. 2013, Osorio et al. 2017, Sippo et al. 2018, Arifanti et al. 2019, Lagomasino et al. 2020). También son importantes reservorios de carbono (Lovelock 2008, Nellemann et al. 2009, Bouillon 2011, Sasmito et al. 2020), ya que lo almacenan en biomasa viva y, la mayor parte (hasta el 95%), en el suelo al funcionar las raíces como filtro biológico (Boone-Kauffman y Donato 2012, Adame et al. 2018, Sippo et al. 2019). Por tanto, los manglares participan en la mitigación del cambio climático absorbiendo dióxido de carbono (CO2) atmosférico mediante el proceso de fotosíntesis (Zhong y Qiguo 2001, FAO 2010, Adame et al. 2018, Sasmito et al. 2020) y liberando oxígeno. Sin embargo, cuando ocurre un cambio de uso de suelo, como la deforestación, se emite CO2 a la atmosfera por la descomposición de materia orgánica, además de que las altas temperaturas en el ambiente contribuyen a la emisión de este gas; esto acelera la respiración de las plantas (Donato et al. 2011, Troxler et al. 2015, Arellano y Andrade 2016) y contribuye al cambio climático (Lovelock et al. 2017; Adame et al. 2018; Alongi 2018; Sippo et al. 2018, 2019; Adams y Rajkaran 2020; Sasmito et al. 2020).
En lo que concierne a la superficie de manglar, durante los años de 1980 a 2005, se han perdido 3.6 millones de hectáreas a nivel mundial, equivalente al 20% del área global (FAO 2007, Rossi et al. 2020). Por su parte, México es de los países que ha presentado mayor pérdida de esta cobertura, con 80,850 ha perdidas desde 1970 hasta 2015; al mismo tiempo, también presentó un aumento en superficie de manglar perturbado (correspondiente a manglar muerto o en regeneración), con 17,140 ha perturbadas en 2015 respecto a las 1,192 ha en 1970 (FAO 2010, Valderrama-Landeros et al. 2017). Los datos son alarmantes al ser México uno de los 5 países con mayor extensión de manglar a nivel mundial con 775,555 ha (Valderrama-Landeros et al. 2017).
En México, se encuentra Marismas Nacionales, un ecosistema de manglares que constituye un importante sumidero de carbono y funciona como barrera protectora en contra de fenómenos naturales que podrían poner en riesgo a la población humana local. Por otra parte, Marismas Nacionales contribuye a la economía local y regional en el noroeste de México, debido a que el 32% de especies marinas en el golfo de California depende de estos manglares, generando un valor medio anual de $37,500 dólares por cada hectárea de manglar (Aburto-Oropeza et al. 2008). Particularmente, los manglares de Marismas Nacionales permiten el crecimiento y desarrollo de 23 especies de peces, 2 de crustáceos y 2 de moluscos bivalvos de importancia económica que, en conjuto, aportan $80 millones de pesos al año, lo cual representa $6.5 millones de dólares a nivel local y $13.5 millones de dólares a nivel regional (CONANP 2016). No obstante, los recursos naturales de este ecosistema han sido aprovechados a tal grado que Marismas Nacionales ha sido registrada por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO, México) como un sitio con relevancia biológica y con necesidades de rehabilitación ecológica (Valdez-Hernández et al. 2009).
Reconociendo la importancia de los manglares, CONABIO realiza un sistema de monitoreo de manglares con el cual ha generado información sobre la ubicación y la extensión de este ecosistema en el territorio mexicano en los últimos 40 años. No obstante, hace falta conocimiento sobre los factores que influyen en la pérdida, la ganancia o la perturbación de la superficie de manglar y sobre la dinámica de uso de suelo y cobertura vegetal a nivel local y regional para saber si los programas y las acciones de protección realizados en los últimos años han favorecido al ecosistema, además de entender cuáles son las mejores prácticas de rehabilitación en áreas perturbadas (Valderrama-Landeros et al. 2017).
Con lo anterior expuesto, el objetivo principal de este trabajo es analizar la dinámica de cambios de uso de suelo y cobertura vegetal en la zona de Marismas Nacionales en los periodos 1981-2005 y 2005-2015 utilizando la cartografía oficial de CONABIO, mediante una matriz de tabulación cruzada, y conocer las pérdidas, las ganancias, el cambio neto, el cambio total y las transiciones. A partir de estos datos, este estudio también pretende estimar la tasa de deforestación y degradación (manglar perturbado) anual del manglar, así como las emisiones y las absorciones de CO2 provocadas por estos procesos forestales, por la recuperación natural y por la reforestación, mediante técnicas y métodos de información geográfica.
Materiales y métodos
Área de estudio
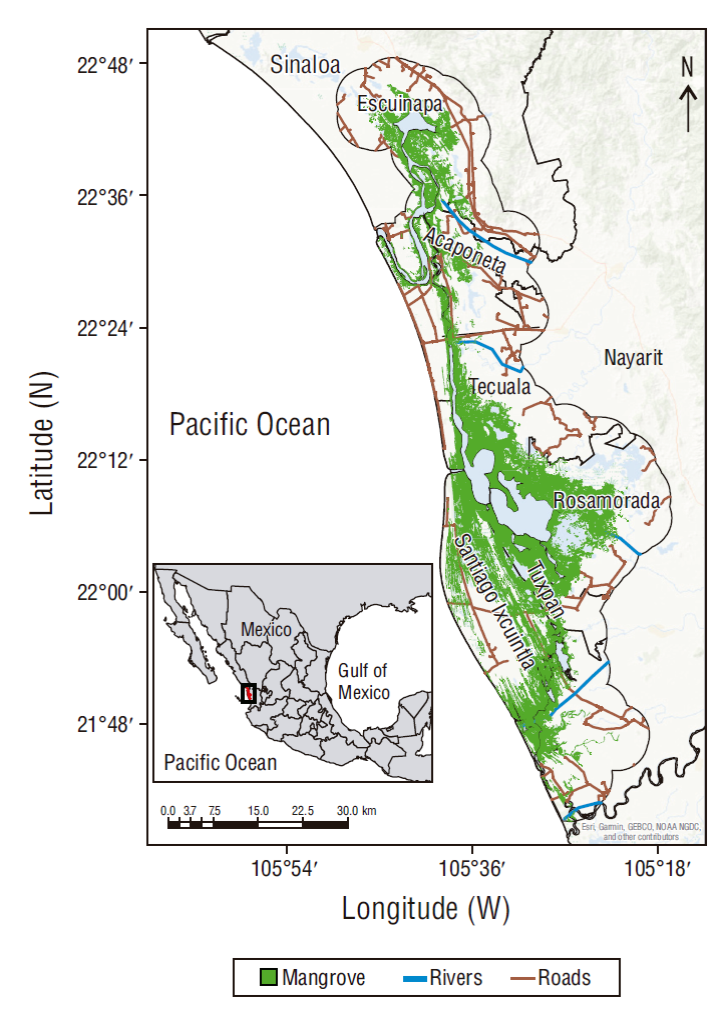
Marismas Nacionales es el ecosistema de manglares más extenso del Pacífico oriental, y en el habitan 99 especies endémicas y 73 amenazadas o en vía de extinción y se albergan aves migratorias (Cárdenas-Guzmán 2011). Se encuentra en la zona costera mexicana del océano Pacífico y cuenta con una población de 56,349 habitantes (INEGI 2015) y una extensión territorial de 220,000 ha distribuida en los municipios de Escuinapa, en el estado de Sinaloa, y Acaponeta, Rosamorada, Santiago Ixcuintla, San Blas, Tecuala y Tuxpan, en el estado de Nayarit (Fig. 1). El clima predominante es cálido subhúmedo, con una temperatura anual superior a 22 ºC; además, los principales aportes de agua al sistema son el río Bejuco, el río Cañas, el río Acaponeta, el río Ruíz, el río San Pedro y el océano Pacífico (Valdez-Hernández et al. 2009).
La vegetación es, principalmente, bosque de manglar, y predominan el mangle rojo (Rhizophora mangle), el mangle negro (Avicennia germinans), el mangle blanco (Laguncularia racemosa) y el mangle botoncillo (Conocarpus erectus) (Rodríguez-Zúñiga et al. 2013). Estas especies de mangle se encuentran en la categoría de especies amenazadas de acuerdo con la NOM-059-SEMARNAT-2010 (DOF 2010). También coexiste vegetación halófila, selva baja caducifolia, selva baja espinosa caducifolia y selva mediana subcaducifolia (Valdez-Hernández et al. 2009).
En 1995 Marismas Nacionales fue identificada y decretada como sitio Ramsar (humedal de importancia internacional, No. 732) (CONANP-SEMARNAT 2013). En 1998 fue designada área importante para la conservación de las aves y, debido a los diversos recursos naturales presentes en este ecosistema, en 2010 fue decretada como Área Natural Protegida Reserva de la Biosfera Marismas Nacionales, Nayarit (CONANP-SEMARNAT 2013). Sin embargo, las especies marinas de este ecosistema han sido aprovechadas por la población humana tanto para consumo como para un sistema mercantil en torno a la acuicultura, mientras que el recurso maderable del manglar se ha utilizado para la construcción de cercas y casas y para leña como combustible (Peña-Messina 2009, Rubio-Cisneros y Aburto-Oropeza 2013). En esta zona también se realizan actividades de turismo y ecoturismo y actividades productivas como la ganadería, la minería y la agricultura (CONANP 2008, CONANP-SEMARNAT 2013). Esta dinámica llevó a Marismas Nacionales a ser decretada como un sitio con relevancia biológica y con necesidades de rehabilitación ecológica por CONABIO (Valdez-Hernández et al. 2009).
Datos
Para conocer la dinámica del manglar, se utilizó la cartografía de uso de suelo y vegetación publicada por CONABIO (2016), a una escala de 1:50,000, para los periodos de 1981-2005 y 2005-2015, la cual estuvo representada en una leyenda de 8 categorías con grado de validez con la realidad del 93% (Valderrama-Landeros et al. 2017). Los mapas fueron obtenidos a partir de un método de clasificación interdependiente basado en las regiones analizadas: manglar (R. mangle, L. racemosa, A. germinans y C. erectus), manglar perturbado (manglar muerto o en regeneración), desarrollo antrópico (poblados, estanques acuícolas, granjas camaroneras, salineras, caminos y carreteras, y obras de infraestructura hidráulica que incluye canales), agrícola-pecuario (agricultura de temporal y riego, pastizales dedicados a la actividad pecuaria, coberturas antrópicas destinadas a la producción de alimentos, y áreas agrícolas en descanso), selvas bajas y mediana (selva baja caducifolia, selva baja espinosa caducifolia y selva mediana subcaducifolia), sin vegetación (áreas sin vegetación aparente y con erosión, dunas costeras de arena y playas), otros humedales (vegetación hidrófila de popal, tular, carrizal y pastizales inundables) y cuerpos de agua (océanos, bahías, esteros, lagunas, ríos, presas y cenotes) (CONABIO 2016).
Análisis de cambio de uso de suelo y cobertura vegetal
Para el análisis de la dinámica de uso de suelo, se utilizó la cartografía original de uso de suelo y cobertura vegetal publicada por CONABIO (escala de 1:50,000) (CONABIO 2016). Con los datos de estas cartografías, se generó una matriz de tabulación cruzada (Pontius et al. 2004), la cual permite calcular las superficies de ganancias, las pérdidas, el cambio neto, el cambio total, los intercambios y las transiciones entre cada una de las categorías en los periodos evaluados (Fig. 2). Las columnas de la matriz representan la superficie de cada categoría del tiempo 1 y las filas representan la superficie de cada categoría del tiempo 2. La fila 6 y la columna 6 representan la suma total de la superficie de cada categoría para los periodos evaluados, y los datos de la diagonal que se forma en la matriz representan la persistencia de cada categoría entre el tiempo 1 y el tiempo 2. Posteriormente, a partir de estos datos, se calcularon los parámetros ganancias (G ij ), pérdidas (L ij ), cambio neto (D j ), intercambio (S j ) y cambio total (DT j ) como sigue:
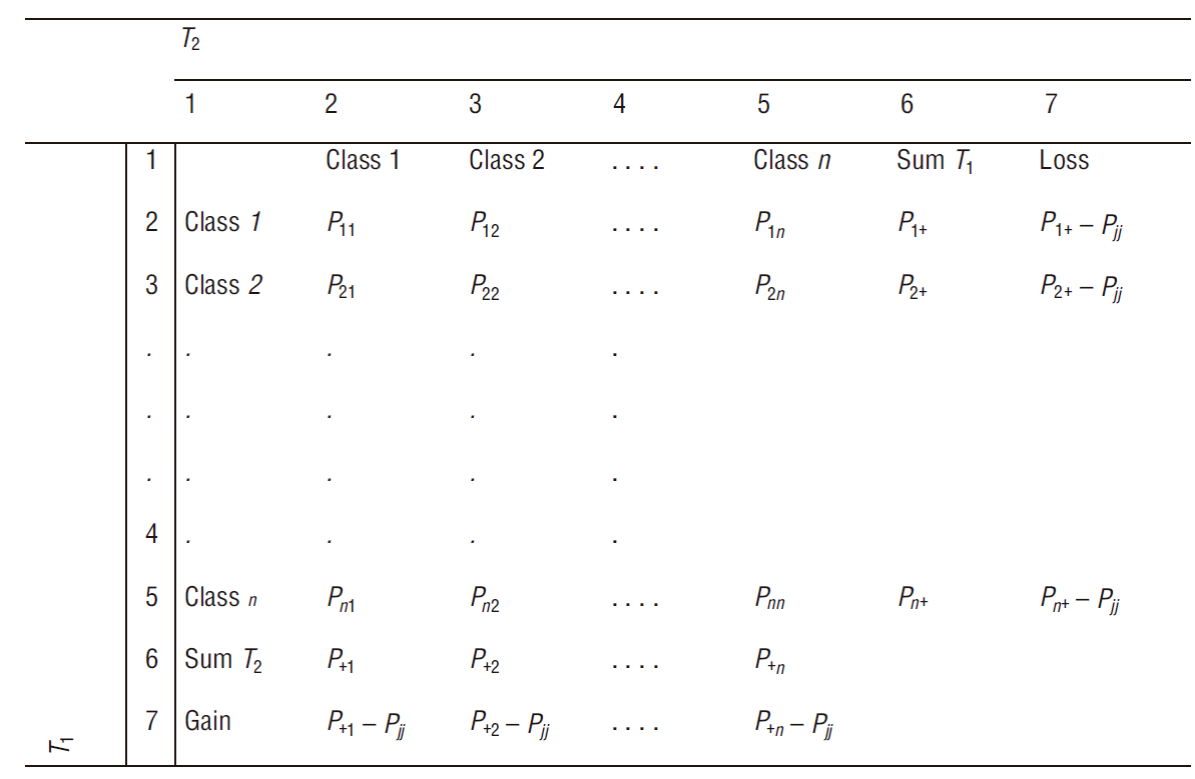
Figura 2 Matriz de cambios. P es el valor de la clase obtenido a través del cruce de mapas de las 2 fechas evaluadas (T1 y T2), y Pjj es la persistencia de cada categoría entre T1 y T2. Fuente: Pontius et al. (2004).
donde P +j es la sumatoria de la columna en cuestión, P jj es el valor de la diagonal principal de la columna en cuestión, P j+ es la sumatoria de la fila en cuestión y 2xMIN es el doble del valor mínimo de las ganacias o pérdidas (Pontius et al. 2004).
Tasas de cambio
Una vez obtenido el total de las superficies y los cambios de cada categoría para las fechas evaluadas, se realizó la estimación de la tasa de cambio anual mediante la ecuación propuesta por FAO (1996), la cual permite conocer cuánto ha sido el cambio anual de la cobertura de manglar al inicio de cada año y se expresa como sigue:
donde r es la tasa de cambio (para expresar en porcentaje, se multiplica por 100), A 1 es la superficie en la fecha 1, D j es el cambio neto y t es el número de años entre las 2 fechas. Esta ecuación es la más implementada para conocer los cambios anuales en el área forestal. Aunque también existen otras ecuaciones para conocer este cambio (e.g., Sader y Joyce 1988, FAO 1995, Puyravaud 2003), estas estiman el valor del cambio neto, es decir, el valor absoluto de la diferencia de las superficies del tiempo 1 y el tiempo 2 del periodo evaluado. Con el fin de valorar las tasas desde diferentes perspectivas, se calcularon la tasa de pérdida y la tasa de cambio neto con los valores obtenidos a través de la matriz de tabulación cruzada. Para ello, se modificó la ecuación de FAO (1996). Cabe destacar que la ecuación modificada es similar a la ecuación de la tasa de cambio neto, por lo que al estimar la pérdida, solo se remplazó este valor en la siguiente ecuación:
donde rp es la tasa de cambio de la pérdida de superficie anual y P corresponde a la pérdida de superficie entre 2 fechas.
Emisión y absorción de CO2
Para analizar la emisión y la absorción de CO2, se clasificaron las transiciones de los usos de suelo y las coberturas vegetales. Posteriormente, se tomaron como referencia los cambios en la vegetación para estimar, mediante la biomasa aérea y biomasa en raíces, las emisiones de CO2 por deforestación y degradación (manglar perturbado en proceso de regeneración o mortalidad), y la absorción de CO2 por recuperación natural, reforestación y permanencia de las coberturas de manglar, selvas bajas y mediana, y otros humedales.
De acuerdo con la metodología pactada en la guía de las buenas prácticas elaborada por el Grupo Intergubernamental de Expertos sobre el Cambio Climático (IPCC, por sus siglas en inglés) para el sector Uso de suelo, Cambio de Uso de Suelo y Silvicultura (USCUSS), para realizar la estimación de CO2, se debe obtener el factor de emisión (FE) y el factor de absorción (FA) de la cobertura vegetal a estimar (IPCC 2003). Por ello, se utilizó el Inventario Nacional de Emisiones de Gases y Compuestos de Efecto Invernadero (INEGEI, México) del sector USCUSS elaborado por el Instituto Nacional de Ecología y Cambio Climático (INECC) y la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT) con datos derivados del Inventario Nacional Forestal y de Suelos (INFyS, México) (INECC-SEMARNAT 2015). El INFyS se apega a los lineamientos del IPCC y proporciona información sobre la superficie que ocupan los usos de suelo y las coberturas vegetales, así como datos dasométricos de cada vegetación. Estos datos fueron adquiridos por el INFyS a partir de muestreos por conglomerados en campo dividiendo el país en cuadrangulares de 5 × 5 km. Respecto a las coberturas vegetales estimadas en el presente trabajo, para manglar y selva mediana, se utilizaron los cuadrantes de 5 × 5 km del INFyS; para selvas bajas y otros humedales, se utilizaron los cuadrantes de 10 × 10 km.
En total, se obtuvieron 341 puntos de muestreo de cobertura de manglar, 2,302 de selva mediana, 1,518 de selva baja y 161 de otros humedales. De estos puntos de muestreo, se obtuvieron subsitios de muestreo y transectos de medición para obtener la información dasométrica, de manera que en los subsitios con superficie de 400 m2, el arbolado medía un diámetro igual o mayor que 7.50 cm respecto a la altura de diámetro de pecho, que es aproximadamente 1.30 m iniciando sobre la superficie del suelo. Por otra parte, en los subsitios que medían 12.56 m2, se registró la frecuencia de plantas o árboles con un mínimo de altura de 25.00 cm y un diámetro de 7.50 cm, y se tomaron de referencia las variables cualitativas de regeneración natural (CONAFOR 2012).
El INECC y la SEMARNAT estimaron el FE de las coberturas vegetales del país con el método de “cambios de existencia” (“stock change”) implementando la ecuación propuesta en las directrices del IPCC, la cual mide el cambio en la existencia de carbono (∆C) en 2 tiempos como sigue:
donde i corresponde al tipo de clima, j corresponde al tipo de bosque, k corresponde al uso de la tierra, Ct 1 es la existencia del sumidero de carbono en el tiempo 1 (en toneladas de carbono) y Ct 2 es la existencia del sumidero de carbono en el tiempo 2 (en toneladas de carbono) (IPCC 2003). Para obtener el FA, el INECC y la SEMARNAT utilizaron el método de “ganancia-pérdida de carbono” (“gain/loss”). También estimaron el ∆C en función de las tasas de pérdida o ganancia de la superficie de uso de suelo referido a los datos de actividad (DA) como sigue:
donde A es el área del uso del suelo, C i es la tasa de ganancia de carbono (en toneladas al año) y CL es la tasa de pérdida de carbono (en toneladas al año) (IPCC 2003). Los DA los obtuvieron el INECC y la SEMARNAT a través de los cambios ocurridos tanto entre coberturas vegetales como en los usos de suelos durante los años de 1993 a 2011 (IPCC 2003, INECC-SEMARNAT 2015). De esta manera, generaron el INEGEI con los datos de FE y FA de las coberturas vegetales del país, lo que permite estimar el CO2 a nivel local o regional. Como los DA son referidos a los cambios de uso de suelo ocurridos en un área específica durante un periodo evaluado, para el presente estudio, los DA se adquirieron a través de los datos generados por la matriz de tabulación cruzada. Para conocer la estimativa de emisión de CO2 (E), se utilizó la siguiente ecuación:
y para conocer la absorción de CO2 (A), se utilizó la siguiente ecuación:
ambas estipuladas por las directrices del IPCC (IPCC 2003).
Resultados
Análisis de cambio de uso de suelo y cobertura vegetal
Del análisis de la dinámica espaciotemporal de las 8 categorías evaluadas en Marismas Nacionales, se observó que la cobertura predominante en 1981 fue manglar (80,071 ha, 26.96%), seguido del uso de suelo agrícola-pecuario (71,235 ha, 23.98%), otros humedales (48,901 ha, 16.46%), cuerpos de agua (46,614 ha, 15.69%), selvas bajas y mediana (45,822 ha, 15.43%), desarrollo antrópico (2,505 ha, 0.84%), sin vegetación (1,030 ha, 0.34%) y manglar perturbado (766 ha, 0.25%) (Tabla 1). Sin embargo, en el transcurso de los años se deforestaron 9,207 ha de manglar, mientras que la categoría agrícola-pecuario incrementó 17,065 ha, transformándose en el suelo predominante para el año 2015 con 88,300 ha (Tabla 1).
Tabla 1 Espacio temporal de las categorías evaluadas en Marismas Nacionales, México. La fuente negrita indica las categorías con más cambios en la superficie.
| Categories | Total in 1981 (ha) | % | Total in 2005 (ha) | % | Total in 2015 (ha) | % |
| Anthropic development | 2,505 | 0.84 | 7,960 | 2.68 | 12,402 | 4.17 |
| Livestock-agricultural | 71,235 | 23.98 | 86,153 | 29.01 | 88,300 | 29.73 |
| Low and medium jungles | 45,822 | 15.43 | 35,392 | 11.91 | 30,947 | 10.42 |
| Without vegetation | 1,030 | 0.34 | 783 | 0.26 | 701 | 0.23 |
| Mangrove | 80,071 | 26.96 | 74,047 | 24.93 | 70,864 | 23.86 |
| Disturbed mangrove | 766 | 0.25 | 4,498 | 1.51 | 7,282 | 2.45 |
| Other wetlands | 48,901 | 16.46 | 44,057 | 14.83 | 38,662 | 13.01 |
| Water | 46,614 | 15.69 | 44,054 | 14.83 | 47,786 | 16.09 |
| TOTAL | 296,944 | 100 | 296,944 | 100 | 296,944 | 100 |
Por su parte, otros humedales y selvas bajas y mediana presentaron una deforestación de 10,239 ha y 14,875 ha, respectivamente. Por lo tanto, durante los periodos evaluados, la deforestación de las coberturas vegetales fue de 34,321 ha, superficie que pasó a ser principalmente un uso de suelo debido al aumento de 27,291 ha. También, observamos que el manglar perturbado (manglar muerto o en regeneración) aumentó 10 veces su tamaño, 6,516 ha de manglar degradado (Tabla 1).
Al analizar la matriz de tabulación cruzada para detectar los cambios ocurridos en el primer periodo evaluado (1981-2005), percibimos la persistencia dominante de usos de suelo y cobertura vegetal en el paisaje, puesto que el 79% (233,522 ha) de la superficie de Marismas Nacionales no experimentó ningún cambio y solo 63,422 ha experimentaron algún tipo de cambio (Tabla 2). La comparación de las pérdidas y las ganancias de las coberturas vegetales indica una mayor deforestación al final del periodo debido a la disminución del 16.86% de manglar, 41.45% de selvas bajas y mediana y 33.82% de otros humedales, en comparación con la ganancia forestal de 9.34%, 18.69% y 23.92%, respectivamente. Aunado a esto, el manglar perturbado se amplió 5 veces más su superficie de origen (Tabla 2). Los indicadores de cambio obtenidos con los datos de pérdidas y ganancias reflejaron un periodo muy dinámico, puesto que el intercambio de las coberturas vegetales superó al cambio neto, lo que manifiesta que estas coberturas participaron casi en el 71% tanto de pérdidas como de ganancias de superficie (Tabla 2). De acuerdo con los indicadores de cambio, las coberturas vegetales presentaron un bajo proceso de recuperación debido a que la pérdida de superficie obtenida fue casi el doble de su tamaño de ganancia. Además, los usos de suelo que aumentaron su superficie fueron agrícola-pecuario, desarrollo antrópico y manglar perturbado, ya que presentaron mayor superficie ganada en comparación con la superficie perdida (Tabla 2).
Tabla 2 Indicadores de cambios en Marismas Nacionales durante los periodos 1981-2005 y 2005-2015.
| Period | Categories | Losses (ha) | Gains (ha) | Net change (ha) | Total change (ha) | Exchange (ha) | Persistence (ha) |
| 1981-2005 | Anthropic development | 135 | 5,590 | 5,455 | 5,725 | 270 | 2,370 |
| Livestock-agricultural | 7,280 | 22,198 | 14,918 | 29,478 | 14,560 | 63,955 | |
| Low and medium jungle | 18,992 | 8,562 | 10,430 | 27,554 | 17,124 | 26,830 | |
| Without vegetation | 534 | 287 | 247 | 821 | 574 | 496 | |
| Mangrove | 13,503 | 7,479 | 6,024 | 20,982 | 14,958 | 66,568 | |
| Disturbed mangrove | 83 | 3,815 | 3,732 | 3,898 | 166 | 683 | |
| Other wetlands | 16,540 | 11,696 | 4,844 | 28,236 | 23,392 | 32,361 | |
| Water | 6,355 | 3,795 | 2,560 | 10,150 | 7,590 | 40,259 | |
| 2005-2015 | Anthropic development | 266 | 4,708 | 4,442 | 4,974 | 532 | 7,694 |
| Livestock-agricultural | 3,844 | 5,991 | 2,147 | 9,835 | 7,688 | 82,309 | |
| Low and medium jungles | 7,142 | 2,697 | 4,445 | 9,839 | 5,394 | 28,250 | |
| Without vegetation | 139 | 57 | 82 | 196 | 114 | 644 | |
| Mangrove | 5,872 | 2,689 | 3,183 | 8,561 | 5,378 | 68,175 | |
| Disturbed mangrove | 700 | 3,484 | 2,784 | 4,184 | 1,400 | 3,798 | |
| Other wetlands | 10,529 | 5,134 | 5,395 | 15,663 | 10,268 | 33,528 | |
| Water | 1,688 | 5,420 | 3,732 | 7,108 | 3,376 | 42,366 |
Respecto al segundo periodo evaluado (2005-2015), observamos que persistió la deforestación con 7.93% en manglar, 8.29% en selvas bajas y mediana y 23.90% en otros humedales, aunque el incremento forestal fue del 3.63%, 3.13% y 11.65%, respectivamente. Por su parte, la degradación de manglar fue del 77.77% al aumentar la superficie de manglar perturbado (Tabla 2). Estos valores nos indicaron que este periodo también fue muy dinámico porque fue mayor el intercambio de superficie de las coberturas vegetales y el uso de suelo agrícola-pecuario que el cambio neto, con la mayor persistencia en el suelo agrícola-pecuario, manglar y otros humedales (Tabla 2). También se determinó que las coberturas vegetales tienen menor posibilidad de recuperarse porque fue mayor la pérdida que la ganancia de superficie. Los usos de suelo con tendencia a aumentar fueron agrícola-pecuario, desarrollo antrópico y manglar perturbado, ya que fue mayor la superficie ganada que la perdida . Por otra parte, tomando de referencia el intercambio de uso de suelo, las coberturas vegetales presentaron un 62% tanto de pérdidas como de ganancias (Tabla 2).
Una vez identificadas las señales de cambios, se obtuvieron las transiciones significativas entre categorías. Durante los 2 periodos, se observó mayor transición de manglar a manglar perturbado, y solo 238 ha se pudieron recuperar (Fig. 3). Esta degradación de manglar ha sido inducida por factores ambientales y antropogénicos. Particularmente, el cambio hidrológico ocasionado con la apertura del canal Cuautla tuvo repercusiones en las localidades de Mexcaltitlán y Ticha del municipio de Santiago Ixcuintla, cerca de la zona núcleo establecida en el Plan de Manejo Reserva de la Biosfera Marismas Nacionales, Nayarit, que tiene como objetivo la preservación del ecosistema a mediano y largo plazo (Fig. 3).
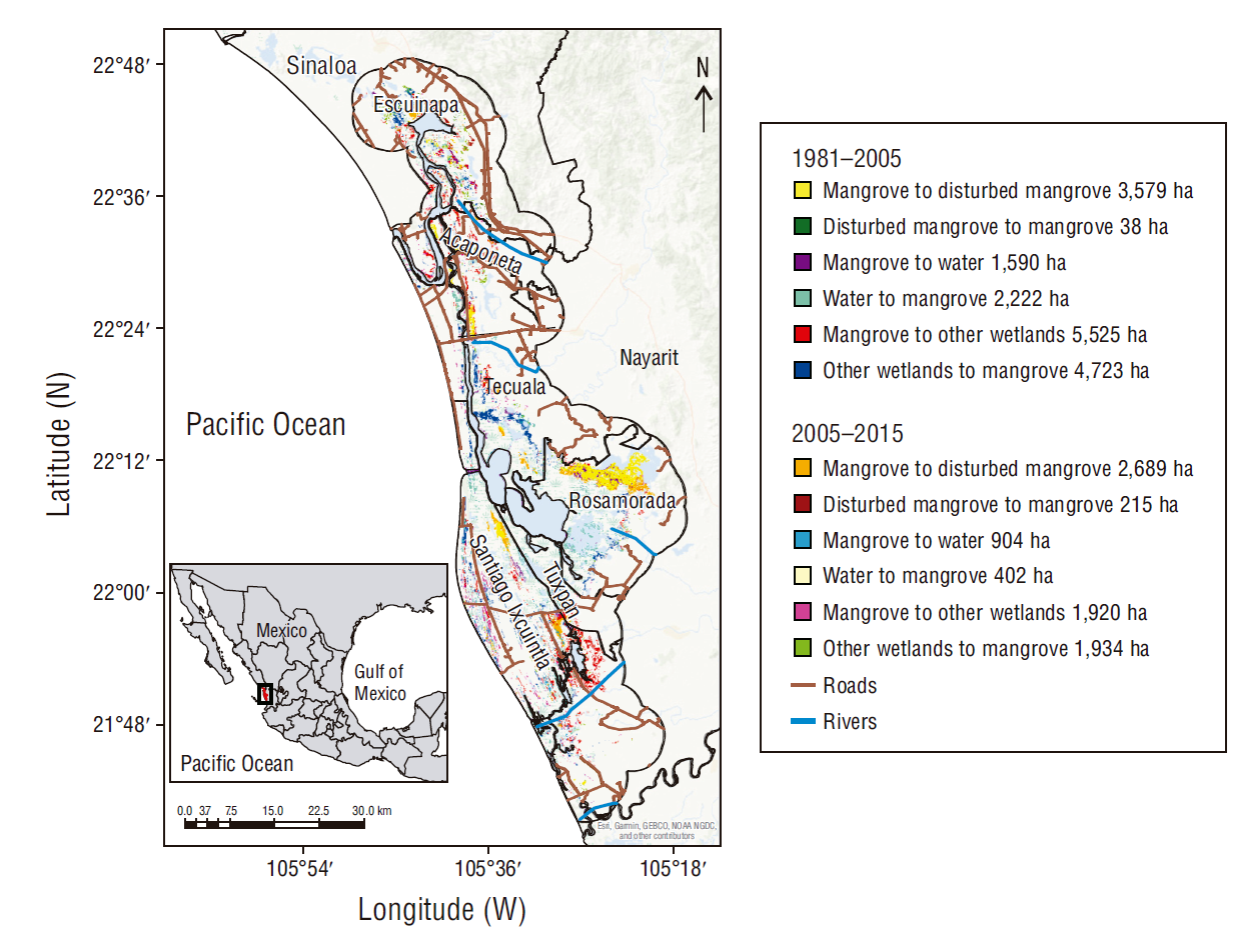
Figura 3 Transiciones entre las categorías manglar, manglar perturbado, cuerpos de agua y otros humedales en Marismas Nacionales.
Los resultados de las transiciones también indicaron que el mayor cambio entre manglar y otros humedales se presentó en manglar, aunque en el segundo periodo este intercambio de superficies fue casi similar. Esta transición también fue muy notoria en la localidad de Mexcaltitán, debido a que es zona turística y recibe impacto del cambio hidrológico. El cambio hidrológico también influyó en el primer periodo, donde hubo mayor transición de cuerpos de agua a manglar, contrario a lo ocurrido en el segundo periodo (Fig. 3).
Tasas de cambio anual
La tasa de cambio neto anual fue de 1.07% para selvas bajas y mediana, 0.32% para manglar y 0.43% para otros humedales. Si no pudiésemos analizar a profundidad estos resultados, concluiríamos que los cambios en las coberturas vegetales presentaron una leve modificación durante el periodo 1981-2005. Sin embargo, la realidad fue diferente al calcular por separado la tasa de pérdida, que para este periodo resultó en 0.77% para manglar, 2.20% para selvas bajas y mediana y 1.70% para otros humedales. Esta deforestación se dio porque cambiaron los usos de suelo, dato que no se puede observar si se presta atención solo a la tasa de cambio neto. No obstante, la tasa de pérdida indicó que los usos de suelo han ganado superficie, y es por ello que las categorías desarrollo antrópico y agrícola-pecuario presentaron la tasa de cambio neto negativa. Por consiguiente, el manglar perturbado también presentó datos negativos (-7.64%) al aumentar su superficie degradada respecto a la existente en 1981, y su tasa de pérdida de 0.48% nos indica que tiene una mínima posibilidad de regeneración o que pasó a ser otro uso de suelo (Fig. 4).
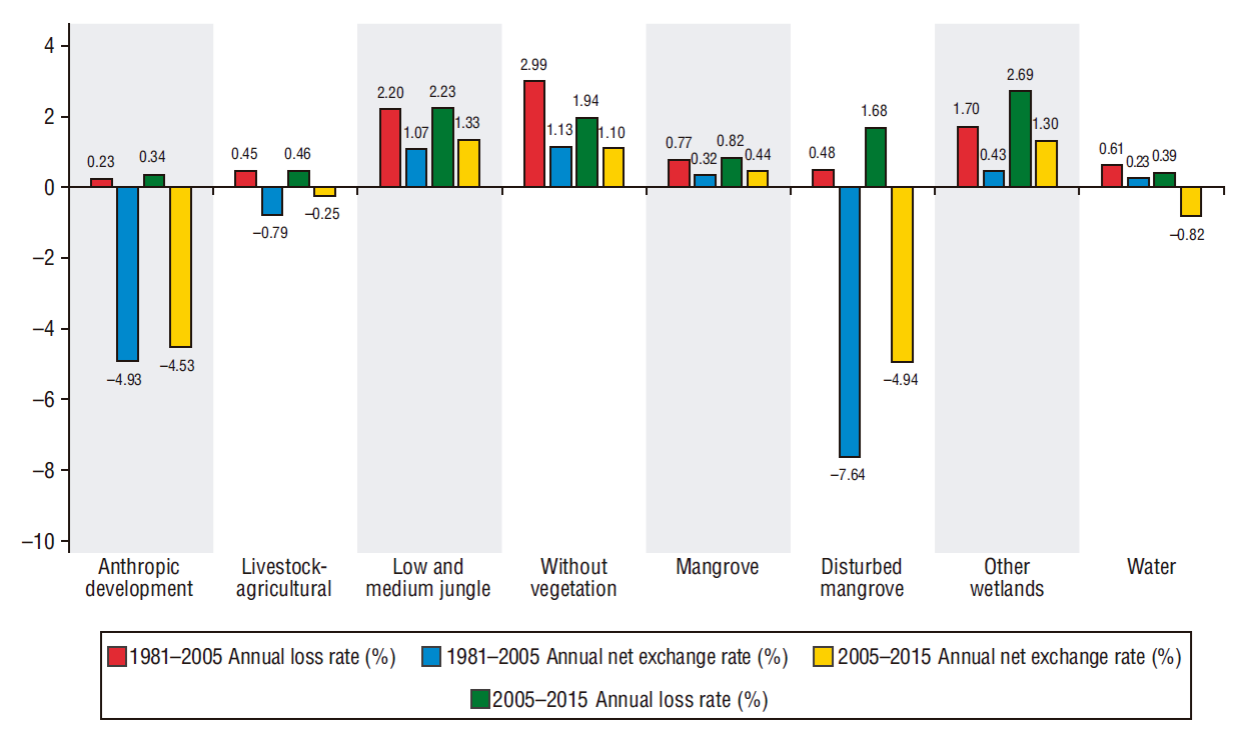
Figura 4 Tasa de cambio neto anual y tasa de pérdida anual o deforestación de uso de suelos y coberturas vegetales en Marismas Nacionales durante los periodos 1981-2005 y 2005-2015.
Las tasas de cambio para el segundo periodo evaluado (Fig. 4) mostraron datos similares a lo observado para el primer periodo porque la tasa de cambio neto subestimó la tasa de pérdida. La tasa de cambio neto fue de 1.33% para selvas bajas y mediana, 0.44% para manglar y 1.30% para otros humedales, que son valores bajos comparados con la deforestación de 2.23%, 0.82% y 2.69%, respectivamente. Los usos de suelo como desarrollo antrópico y agrícola-pecuario ganaron superficie, puesto que presentaron valores negativos en la tasa de cambio neto (-4.53% y -0.25%, correspondientemente). El manglar perturbado también presentó una tasa de cambio neto negativa (-4.94%) al aumentar su superficie degradada (1.68%).
Emisiones y absorciones de CO2 en el bosque de manglar
La estimación de emisiones de CO2 (equivalente, CO2e) debidas al proceso de deforestación de las coberturas vegetales durante los años 1981 a 2005 fue de 1,945.03 Gg de CO2e, de lo cual 432.50 Gg de CO2e correspondió a manglar debido, principalmente, a la transición a otros humedales y al uso de suelo agrícola-pecuario. Selvas bajas y mediana emitieron 1,465.48 Gg de CO2e debido a la transformación al uso de suelo agrícola-pecuario. La categoría otros humedales emitió 47.05 Gg de CO2e porque gran parte de la superficie paso a ser de uso agrícola-pecuario. En suma, se mostró un estimado de 27.16 Gg de CO2e por degradación de manglar por el hecho de pasar a ser manglar perturbado (Tabla 3).
Tabla 3 Emisiones y absorciones de CO2 (equivalente, CO2e) en Marismas Nacionales durante los periodos 1981-2005 y 2005-2015.
| Period | Forest process | Vegetation | Live biomass carbon (t C) | Carbon roots (t C) | Total Carbon (t C) | Emisisions (Gg CO2e) |
| 1981-2005 | Deforestation | Mangrove | -52,182.25 | -12,559.37 | -64,741.62 | 432.500 |
| Low and medium jungles | 233,619.29 | 57,458.61 | 291,077.90 | 1,465.480 | ||
| Other wetlands | 10,216.69 | 2,617.29 | 12,833.98 | 47.058 | ||
| 2005-2015 | Mangrove | -25,964.83 | -6,249.29 | -32,214.11 | 145.210 | |
| Low and medium jungles | 83,892.78 | 20,633.41 | 104,526.19 | 383.263 | ||
| Other wetlands | 3,948.93 | 1,011.63 | 4,960.56 | 18.189 | ||
| 1981-2005 | Degradation | Mangrove | -6017.02 | -1,389.80 | -7,406.82 | 27.158 |
| 2005-2015 | Mangrove | -5,494.96 | -1,269.22 | -6,764.19 | 24.802 | |
| 1981-2005 | Natural recovery | Mangrove | 572.63 | 113.24 | 685.87 | 2.514 |
| Low and medium jungles | 1,273.94 | 291.64 | 1,565.58 | 5.740 | ||
| 2005-2015 | Mangrove | 328.76 | 65.01 | 393.77 | 1.444 | |
| Low and medium jungles | 789.05 | 180.64 | 969.69 | 3.556 | ||
| 1981-2005 | Reforestation | Mangrove | 21.31 | 4.21 | 25.52 | 0.094 |
| Low and medium jungles | 4,450.31 | 1,018.81 | 5,469.11 | 20.053 | ||
| Other wetlands | 103.68 | 24.50 | 128.18 | 0.470 | ||
| 2005-2015 | Mangrove | 13.60 | 2.70 | 16.29 | 0.059 | |
| Low and médium jungles | 1,201.33 | 275.02 | 1,476.34 | 5.413 | ||
| Other wetlands | 183.72 | 43.41 | 227.13 | 0.833 | ||
| 1981-2005 | Forest lands that remain forest | Low and medium jungles to mangrove | 268.46 | 60.99 | 329.45 | 1.208 |
| Low and medium jungles to disturbed mangrove | 1.03 | 0.23 | 1.26 | 0.005 | ||
| Mangrove to low and medium jungles | 513.86 | 119.94 | 633.80 | 2.324 | ||
| 2005-2015 | Low and medium jungles to disturbed mangrove | 7.20 | 1.64 | 8.84 | 0.032 | |
| Low and medium jungle to mangrove | 51.43 | 11.68 | 63.11 | 0.231 | ||
| Mangrove to low and medium jungles | 80.46 | 18.78 | 99.24 | 0.364 | ||
| Disturbed mangrove to low and medium jungles | 0.83 | 0.19 | 1.02 | 0.004 |
t C = tons of carbon, Gg = gigagrams
Durante el periodo 1981-2005 se presentó una absorción estimada de 28.68 Gg de CO2e, de la cual 2.51 Gg de CO2e correspondió a la recuperación natural del manglar y 5.74 Gg de CO2e a selvas bajas y mediana. La mayor estimación del total de absorción (20.43 Gg de CO2e) fue posible por los programas de reforestación que se han llevado a cabo en Marismas Nacionales. Parte de la superficie de otros humedales se reforestó con manglar y presentó un valor de 0.09 Gg de CO2e. La mayor reforestación de selvas bajas y mediana fue en el suelo de uso agrícola-pecuario, con 20.05 Gg de CO2e; además, parte de este mismo uso de suelo se reforestó con otros humedales, con 0.47 Gg de CO2e. Por otra parte, se presentó una absorción de 3.54 Gg de CO2e debido a que las coberturas vegetales permanecieron como áreas forestales; en otras palabras, se mostró una transición entre el manglar y selvas bajas y mediana, pero al permanecer como cubierta forestal, siguieron absorbiendo el CO2 atmosférico por medio del proceso de fotosíntesis.
En el segundo periodo (2005-2015) se exhibió una estimativa de emisión por deforestación de 546.66 Gg de CO2e. La categoría manglar exhibió 145.21 Gg de CO2e a causa de la transición a otros humedales. Selvas bajas y mediana presentó 383.26 Gg de CO2e debido a que pasó a ser uso agrícola-pecuario. Otros humedales emitió 18.19 Gg de CO2e al cambiar a la categoría desarrollo antrópico. La emisión por degradación fue de 24.80 Gg de CO2e dado que el manglar fue perturbado (Tabla 3).
Para el periodo 2005-2015, se estimó una absorción de 11.30 Gg de CO2e al recuperarse el manglar perturbado (1.44 Gg de CO2e) y selvas bajas y mediana (3.55 Gg de CO2e). Además, los programas de reforestación promovieron una absorción de 6.31 Gg de CO2e de la siguiente manera: 0.059 Gg de CO2e por manglar reforestado en áreas de otros humedales, 5.41 Gg de CO2e por selvas bajas y mediana reforestadas en suelos agrícola-pecuarios y 0.83 Gg de CO2e por vegetación de otros humedales reforestados en suelos agrícola-pecuarios. Al mismo tiempo ocurrió una absorción de 0.63 Gg de CO2e por coberturas vegetales que permanecieron como áreas forestales, o sea, que presentaron una transición, pero siguieron siendo vegetación ya sea manglar, selvas bajas y mediana u otros humedales (Tabla 3).
Los resultados de las emisiones y absorciones de CO2 indican que fue mayor la emisión (1,972.19 Gg de CO2e) que la absorción (32.22 Gg de CO2e) de CO2 durante el primer periodo, con un balance neto de 1,939.97 Gg de CO2e. Asimismo, en el segundo periodo fue mayor la emisión (571.46 Gg de CO2e) que la absorción (11.94 Gg de CO2e), con un balance neto de 559.53 Gg de CO2e.
Discusión
La dinámica de los cambios de uso de suelo y cobertura vegetal manifestada en los 2 periodos ha provocado fragmentación en el hábitat y ha puesto en riesgo la supervivencia de las poblaciones de flora y fauna, lo cual incrementa su riesgo de extinción local a largo plazo (Cárdenas-Guzmán 2011). Las causas de esta fragmentación se deben, principalmente, a factores antropogénicos como la acuicultura, la agricultura, la ganadería y la expansión de infraestructura (e.g., la construcción de canales, caminos y carreteras) (Berlanga-Robles y Ruiz-Luna 2007, Hirales-Cota et al. 2010, MARN 2013, Rodríguez-Zúñiga et al. 2013, Vera-Andrade 2018). Una de las causas que provocó la deforestación y la degradación de la cubierta vegetal fue el crecimiento de infraestructura con falta de planificación y escasa o nula capacitación del personal técnico, lo cual se ha manifestado notoriamente en la cobertura de manglar con el diseño inadecuado de las instalaciones acuícolas, principalmente en el estado de Nayarit durante los años de 1985 a 1995 (Peña-Messina 2009).
Adame et al. (2018) señalaron que en las costas del Pacífico del norte y centro de México, la pérdida de manglares se debió a la conversión de estanques camaroneros, lo que representa una pérdida del 80% de la reserva total del carbono. Esto es similar a lo ocurrido en el delta del Mahakam, Indonesia, donde este tipo de conversión provocó una pérdida equivalente a 226 años de carbono almacenado en el suelo (Arifanti et al. 2019). En la provincia de Papúa Occidental, Indonesia, la transformación de cobertura vegetal a acuicultura eliminó el 60% de la reserva de carbono en suelo y el 85% de carbono en biomasa viva (Sasmito et al. 2020). En el golfo de Guayaquil, Ecuador, este cambio emitió 28,059,528 Mg de CO2e (Merecí-Guamán et al. 2017). También hubo pérdidas de manglar en la costa Caribe de Colombia (Torres-Salamanca y Ruíz-Vivas 2017) y en la Reserva Ecológica Manglares Cayapas-Mataje, Ecuador (Bravo-Aguas 2018).
La expansión de infraestructura también se llevó a cabo con la construcción de la carretera de Novillero al campo pesquero de Pericos en Nayarit, lo que interrumpió el paso de la marea a la zona de manglar (Valdez-Hernández et al. 2009). Además, la construcción de canales en 1971 para facilitar la producción pesquera, como el canal en el río San Lorenzo y, en particular, el canal Cuautla al sur de Cuautla, provocó un cambio hidrológico en la laguna de Agua Brava, ya que en un principio tenía un ancho de 30 m y se fue erosionando a más de 1.5 km; actualmente, esta laguna continua deteriorándose poniendo en riesgo a la población aledaña (Valdez-Hernández et al. 2009). La modificación del flujo hidrológico también ha perjudicado a los manglares y otros humedales (De la Lanza-Espino et al. 1996, Ramirez-Zavala et al. 2012, CONANP-SEMARNAT 2013, Rubio-Cisneros y Aburto-Oropeza 2013). Esta afectación se ha observado más en el estado de Nayarit, en el cual, desde 2010, se encuentra el Área Natural Protegida Reserva de la Biosfera Marismas Nacionales, Nayarit (CONANP-SEMARNAT 2013).
Otra causa de la pérdida y la perturbación del manglar, así como de selvas bajas y mediana, es el uso de suelo agrícola-pecuario, dado que en él se realizan actividades como la agricultura de riego y de temporal. Estas actividades conceden una aportación económica baja a la región y se realizan a mediana escala y de manera extensiva (CONANP-SEMRNAT 2013). Además, utilizan gran cantidad de insumos de agroquímicos, y los escurrimientos provenientes de los cultivos se descargan en los esteros, lo que repercute en los manglares y otros humedales (CONANP 2008). También se realiza la ganadería, que produce proteínas para la población y recursos económicos (CONANP-SEMARNAT 2013).
Como se mostró en los resultados, el suelo agrícola-pecuario fue aumentando en el transcurso de los años. El aumento fue más notorio en el municipio de Rosamorada (Nayarit), particularmente en la zona catalogada como subzona de aprovechamiento especial en el mapa de subzonificación de la Reserva de la Biosfera Marismas Nacionales, Nayarit. Este mapa señala que se pueden realizar actividades como acuicultura, agricultura, ganadería, minería, aprovechamiento forestal, recolecta científica, construcción de obra pública y privada, y turismo de bajo impacto sin propiciar la fragmentación del ecosistema ni alterar los flujos hidráulicos, siempre y cuando se cuenten con medidas de mitigación para asegurar la permanencia y la funcionalidad de los ecosistemas y para conservar los recursos naturales (CONANP-SEMARNAT 2013). Sin embargo, las actividades realizadas han reflejado repercusiones en las coberturas vegetales. Por otra parte, y en poca medida, la población de la región degrada a los manglares. Por ejemplo, R. mangle es utilizado para fines medicinales o para la tinción de redes de pesca con los taninos; A. germinans, para la construcción de casas o como pastura para el ganado; y L. racemosa, para la construcción de galerías de tabaco, estacas, postes, trampas para peces, cercas y muros, y también como leña para asar y ahumar pescado (Rodríguez-Zúñiga et al. 2013).
El incremento de manglar perturbado fue ocasionado por actividades antropogénicas, pero también por factores ambientales como huracanes y tormentas tropicales. Esta extinción contraproducente y rápida de manglar (mangrove dieback) ha ido incrementando desde 1994, cuando el impacto del huracán Rosa provocó la pérdida de L. racemosa y A. germinans (Valdez-Hernández et al. 2009). El efecto de las actividades antropogénicas y los factores naturales se ha extendido considerablemente a nivel nacional, puesto que en 1970 la superficie de manglar perturbado era de 1,192 ha y para 2015 aumentó a 18,332 ha, de la cual Marismas Nacionales representa el 39.72% (Valderrama-Landeros et al. 2017). No obstante, los factores ambientaes han causado extinción contraproducente y rápida de manglar en otras regiones. Por ejemplo, en el golfo de Carpentaria, Australia, esta extinción fue ocasionado por aridez, alta variabilidad en la temperatura, salinidad, El Niño y nivel del mar bajo, lo que indujo hipersalinización y tensiones hídricas (Harada et al. 2019). En el norte de Australia, la extinción fue promovida por un bajo nivel del mar (Lovelock et al. 2017, Asbridge et al. 2019, Sippo et al. 2019), y en isla Ábaco, Bahamas, fue inducida por enfermedad foliar (Rossi et al. 2020). Al sureste de Florida, EUA, la causa fue el huracán Irma (Lagomasino et al. 2020), mientras que al noreste de la costa de Florida, fue el aumento del nivel del mar, la temperatura y la precipitación (Rodriguez et al. 2016). En el río Rufiji, Tanzania, se dio por El Niño y fuertes lluvias (Erftemeijer y Hamerlynck 2005); al este de Brasil, por una tormenta de granizo y El Niño (Nogueira-Servino et al. 2018); en Sudáfrica, por agentes patógenos y plagas de insectos (Osorio et al. 2017); y en la costa este de Sudáfrica, por tormentas tropicales y sequías (Adams y Rajkaran 2020).
La pérdida de superficies de manglar por el cambio de uso de suelo influenciado por los factores ambientales y antropogénicos antes mencionados tiene como consecuencia la emisión de CO2 a la atmosfera. Esto también lo demostraron otros estudios. Adame et al. (2018) señalaron que la pérdida de manglares en la costa del Pacífico del norte y centro de México se debe a los estanques camaroneros (80% de pérdida en las reservas de carbono y 66% de pérdida en el cambio de manglar a pastos para ganado [agrícola]), lo que resultó en emisiones de 0.32 ± 0.06 Tg de CO2e en el periodo 1981-2005, 0.68 ± 0.12 Tg de CO2e en 2005-2010 y 0.00 Tg de CO2e en 2010-2015. Asimismo, en las bahías de Jiquilisco y Jaltepeque, El Salvador, la transición de manglares a usos agrícolas redujo el 90% de carbono durante los años de 1993 a 2014 (emisión estimada de 48,495 a 58,004 Gg de CO2e) (Cifuentes et al. 2016). Un estudio llevado a cabo en la región semiárida del noroeste de Brasil determinó que la conversión de manglares a estanques de camarón provocó la pérdida del 58% al 82% del carbono almacenado (emisión media de 1,390 Mg CO2e·ha-1) (Boone-Kauffman et al. 2018). Por su parte, Alongi (2020) mencionó que, a nivel mundial, la disminución de manglar se ha debido a la conversión a zonas de acuicultura y agricultura, con emisiones de 0.088 Pg de CO2. En la costa de Tailandia, el 70% de carbono almacenado se perdió con la transición de manglar a estanques acuícolas abandonados, con una pérdida media de 304 ± 61.3 t C·ha-1 después de 10 años (Elwin et al. 2019). Algo semejante ocurrió en la costa de la bahía Honda, Filipinas, donde las transiciones de zonas de manglar a estanques de acuicultura abandonados, plantaciones cocoteras, áreas de producción de sal abandonadas y superficies deforestadas emitieron 110 kg CO2e·ha−1·d-1 (Castillo et al. 2017). Por otro lado, durante los años de 1975 a 2013, en Sundarban, India, el 60% de manglares se perdió por erosión y se convirtió en superficies antropogénicas (emisión por biomasa aérea de 1,567.98 ± 5,51.69 Gg de CO2) (Akhand et al. 2017).
Respecto al análisis de las tasas de cambio neto y de pérdida, se determinó que, al obtener la deforestación a partir del cambio neto, se subestima la tasa de deforestación, ya que esta se obtiene de las superficies de bosque de manglar en ambas fechas y se omiten los intercambios que tuvieron los usos de suelo en el periodo evaluado. En cambio, la tasa de pérdida da un valor sobre la base explícita de la deforestación del bosque de manglar en ambos periodos. Esto no ocurre de la misma manera a nivel nacional, pues durante los años de 1976 al 2000, la tasa de pérdida anual varió entre 1.0% y 2.5% (INE-SEMARNAT 2005). Para el periodo 1973-2011, Romero-Berny et al. (2013) obtuvieron una tasa anual de 1.1% basándose en el valor de cambio neto. Otra investigación realizada en México mediante la diferencia de un análisis cartográfico reportó que la tasa de deforestación anual estimada fue de 0.22% ± 0.07 para el periodo 1981-2005, 0.49% ± 0.23 para 2005-2010 y −0.57% ± 0.30 para 2010-2015, con una tasa de degradación de 0.11% ± 0.03, 0.29% ± 0.09 y −0.07% ± 0.03, respectivamente, para cada periodo de tiempo evaluado (Adame et al. 2018).
Comparando la superficie deforestada de manglar y la respectiva tasa de pérdida anual, encontramos que tampoco coinciden los resultados obtenidos en este trabajo con otras investigaciones, pues los métodos para adquirir la tasa varían. Tal es el caso que, en el sudeste asiático, durante los años de 2000 a 2012 se deforestaron más de 100,000 ha, con una tasa de deforestación promedio de 0.18%, de lo cual el 30.00% fue ocasionado por la acuicultura (Richards y Friess 2016). En Myanmar, Asia, durante los años de 2000 a 2014 se deforestaron 191,122 ha, con una tasa de deforestación del 2.20% (Estoque et al. 2018). En este mismo lugar, entre 1996 y 2016, la cobertura disminuyó 52.00%, con una tasa de pérdida neta del 3.60% al 3.87% (De Alban et al. 2020). Por otra parte, en la costa del Pacífico de Colombia, Panamá y Costa Rica, entre 2000 y 2005, se perdieron 564 ha por la agricultura, con una tasa de deforestación media de 0.02% (López-Angarita et al. 2018).
Lo anterior nos muestra que Marismas Nacionales, aun siendo un Área Natural Protegida, ha sido afectada en el transcurso de los años por factores antropogénicos y ambientales. Esta afectación ha provocado procesos de deforestación y degradación forestal y, a su vez, emisiones de CO2 a la atmosfera, lo cual contribuye a la emisión de gases de efecto invernadero que incrementan los fenómenos naturales provenientes del cambio climático. Si esta afectación sigue incrementando, la preexistencia de la flora y fauna que coexiste en este hábitat estará en riesgo y los animales de vida silvestre tendrán que buscar un nuevo lugar para subsistir, lo que expondría a la población humana. Por tanto, es de suma importancia que las tomas de decisiones de las nuevas políticas públicas tengan como prioridad proteger y conservar de manera sustentable el bosque de manglar para generar un bienestar social, económico y ambiental.
Agradecimientos
Este trabajo fue apoyado por la Universidad Autónoma de Sinaloa (el Posgrado en Ciencias Biológicas de la Facultad de Biología, la Facultad de Ciencias de la Tierra y el Espacio) y el Consejo Nacional de Ciencia y Tecnología (CVU: 568777, México).
REFERENCIAS
Aburto-Oropeza O, Ezcurra E, Danemann G, Valdez V, Murray J, Sala E. 2008. Mangroves in the Gulf of California increase fishery yields. P Natl Acad Sci USA. 105(30):10456-10459. https://doi.org/10.1073/pnas.0804601105 [ Links ]
Adame MF, Brown CJ, Bejarano M, Herrera-Silveira JA, Ezcurra P, Boone-Kauffman J, Birdsey R. 2018. The undervalued contribution of mangrove protection in Mexico to carbon emission targets. Conserv Lett. 11(4):e12445. https://doi.org/10.1111/conl.12445 [ Links ]
Adams JB, Rajkaran A. 2020 Changes in mangroves at their southernmost African distribution limit. Estuar Coast Shelf S. 247:106862. https://doi.org/10.1016/j.ecss.2020.106862 [ Links ]
Akhand A, Mukhopadhyay A, Chanda A, Mukherjee S, Das A, Das S, Hazra S, Mitra D, Choudhury SB, Rao KH. 2017. Potential CO2 emission due to loss of above ground biomass from the Indian Sundarban mangroves during the last four decades. J Indian Soc Remote. 45(1):147-154. https://doi.org/10.1007/s12524-016-0567-4 [ Links ]
Alongi DM. 2018. Impact of global change on nutrient dynamics in Mangrove Forests. Forests. 9(10):596. https://doi.org/10.3390/f9100596 [ Links ]
Alongi DM. 2020. Global significance of mangrove blue carbon in climate change mitigation (Version 1). Sci. 2:57. https://doi.org/10.3390/sci2030057 [ Links ]
Arellano MF, Andrade JL. 2016. Aspiradoras verdes: captura de carbono en bosques tropicales [Green vacuum cleaners: carbon capture in tropical forests]. Biodiversistas. 125:1-7. [ Links ]
Arifanti VB, Boone-Kauffman J, Hadriyanto D, Murdiyarso D, Rita D. 2019. Carbon dynamics and land use carbon footprints in mangrove-converted aquaculture: The case of the Mahakam Delta, Indonesia. Forest Ecol Manag. 432:17-29. https://doi.org/10.1016/j.foreco.2018.08.047 [ Links ]
Asbridge EF, Bartolo R, Finlayson CM, Lucas RM, Rogers K, Woodroffe CD. 2019. Assessing the distribution and drivers of mangrove dieback in Kakadu National Park, northern Australia. Estuar Coast Shelf S . 228:106353. https://doi.org/10.1016/j.ecss.2019.106353 [ Links ]
Berlanga-Robles CA, Ruiz-Luna A. 2007. Análisis de las tendencias de cambio del bosque de mangle del sistema lagunar Teacapán-Agua Brava, México. Una aproximación con el uso de imágenes de satélite Landsat = Analysis of change trends of the mangrove forest in Teacapan-Agua Brava lagoon system, Mexico. An approximation using Landsat satellite images. Universidad y Ciencia. 23(1):29-46. [ Links ]
Boone-Kauffman J, Bernardino AF, Ferreira TO, Bolton NW, Gomes LEO, Nobrega GN. 2018. Shrimp ponds lead to massive loss of soil carbon and greenhouse gas emissions in northeastern Brazilian mangroves. Ecol Evol. 8(11):5530-5540. https://doi.org/10.1002/ece3.4079 [ Links ]
Boone-Kauffman J, Donato DC. 2012. Protocols for the measurement, monitoring and reporting of structure, biomass and carbon stocks in mangrove forests. Working Paper, no. 86. Bogor (Indonesia): Center for International Forestry Research. 50 p. [ Links ]
Bouillon S. 2011. Storage beneath mangroves. Nat Geosci. 4:282-283. https://doi.org/10.1038/ngeo1130 [ Links ]
Bravo-Aguas YM. 2018. Valoración económica de manglares del sur de la reserva (Renacam) próximos a camaronera mediante el método de reposición de daño [dissertation]. [Esmeraldas (Ecuador)]: Pontificia Universidad Católica del Ecuador sede Esmeraldas. 79 p. [ Links ]
Cárdenas-Guzmán G. 2011. Tesoro ecológico en riesgo. Los manglares de Marismas Nacionales. ¿Cómoves? Revista de Divulgación de la Ciencia de la Universidad Nacional Autónoma de México, No. 156; [accessed 2020 Aug 15].http://www.comoves.unam.mx/numeros/articulo/156/tesoro-ecologico-en-riesgo-los-manglares-de-marismas-nacionales [ Links ]
Castillo JAA, Apan AA, Maraseni TN, Salmo SG III. 2017. Soil greenhouse gas fluxes in tropical mangrove forests and in land uses on deforested mangrove lands. CATENA. 159:60-69. https://doi.org/10.1016/j.catena.2017.08.005 [ Links ]
Cifuentes M, Torres D, Sergio V, Rivera CG, Molina O. 2016. Dynamics of blue carbon stocks and GHG emissions along a land use gradient in El Salvador. American Geophysical Union Fall Meeting Abstracts; [accessed 2020 May 4]. https://ui.adsabs.harvard.edu/abs/2016AGUFM.B11G..02C/abstract [ Links ]
[CONABIO] Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. 2009. Manglares de México: Extensión y Distribución [Mangroves of Mexico: Extension and Distribution]. 2nd ed. Mexico City: CONABIO. 99 p. [ Links ]
[CONABIO] Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. 2016. Geoportal del Sistema Nacional de Información sobre Biodiversidad. Mexico City: Portal de Geoinformación Sistema Nacional de Información sobre Biodiversidad (SNIB); [accessed 2019 Nov 15]. http://www.conabio.gob.mx/informacion/gis/ [ Links ]
[CONAFOR] Comisión Nacional Forestal. 2012. Inventario Nacional Forestal y de Suelos Informe 2004-2009 [National Forest and Land Inventory Report 2004-2009]. 1st ed. Mexico City: CONAFOR. 282 p. [ Links ]
[CONAFOR] Comisión Nacional Forestal. 2013. Bosques, cambio climático y REDD+ en México, guía básica [Forest, climate change and REDD+ in Mexico, a basic guide]. 2nd ed. Mexico City: CONAFOR . 88 p. [ Links ]
[CONANP] Comisión Nacional de Áreas Naturales Protegidas. 2008. Estudio Previo justificativo para el establecimiento del área natural protegida con la categoría de Reserva de la Biósfera “Marismas Nacionales Sinaloa” [Previous justification study for the establishment of the protected natural area with the category of Biosphere Reserve “Marismas Nacionales Sinaloa”]. Mexico City: CONANP. 61 p. [ Links ]
[CONANP] Comisión Nacional de Áreas Naturales Protegidas, The Nature Conservancy, Conselva, Costas y Cominidades. 2016. Programa de adaptación al cambio climático. Complejo Marismas Nacionales, Nayarit y Sinaloa [Climate change adaptation program. Marismas Nacionales, Nayarit and Sinaloa]. Mexico City: Secretaría de Medio Ambiente y Recusros Naturales. 94 p. [ Links ]
[CONANP-SEMARNAT] Comisión Nacional de Áreas Naturales Protegidas-Secretaria de Medio Ambiente y Recursos Naturales. 2013. Programa de Manejo Reserva de la Biosfera Marismas Nacionales Nayarit [Marismas Nacionales, Nayarit biosphere reserve management program]. 1st ed. Mexico City: Secretaría de Medio Ambiente y Recursos Naturales. 195 p. [ Links ]
De Alban JDT, Jamaludin J, Wong-Wen D, Than MM, Webb EL. 2020. Improved estimates of mangrove cover and change reveal catastrophic deforestation in Myanmar. Environ Res Lett. 15:034034. https://doi.org/10.1088/1748-9326/ab666d [ Links ]
De la Lanza-Espino G, Sánchez-Santillán N, Sorani V, Bojórquez-Tapia JL. 1996. Características geológicas, hidrológicas y del manglar en la planicie costera de Nayarit, México [Geological, hydrological and mangrove characteristics in the coastal plain of Nayarit, Mexico]. Investigaciones Geográficas Boletín. 1(32):33-54. https://doi.org/10.14350/rig.59042 [ Links ]
[DOF] Diario Oficial de la Federación. 2010 Nov 26. Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Mexico City: Secretaría de Gobierno. [ Links ]
Donato DC, Kauffman JB, Murdiyarso D, Kurnianto S, Stidham M, Kanninen M. 2011. Mangroves among the most carbon-rich forests in the tropics. Nat Geosci . 4:293-297. https://doi.org/10.1038/ngeo1123 [ Links ]
Elwin A, Bukoski JJ, Jintana V, Robinson EJZ, Clark JM. 2019. Preservation and recovery of mangrove ecosystem carbon stocks in abandoned shrimp ponds. Sci Rep UK. 9:18275. https://doi.org/10.1038/s41598-019-54893-6 [ Links ]
Erftemeijer PLA, Hamerlynck O. 2005. Die-back of the mangrove Heritiera littoralis Dryand, in the Rufiji Delta (Tanzania) following El Niño Floods. J Coastal Res. 42:228-235. [ Links ]
Estoque RC, Myint SW, Wang C, Ishtiaque A, Aung TT, Emerton L, Ooba M, Hijioka Y, Mon MS, Wang Z, et al. 2018. Assessing environmental impacts and change in Myanmar’s mangrove ecosystem service value due to deforestation (2000-2014). Glob Change Biol. 24(11):5391-5410. https://doi.org/10.1111/gcb.14409 [ Links ]
[FAO] Food and Agriculture Organization. 1995. Forest resources assessment 1990 Global Synthesis. Rome: FAO Forestry; [accessed 2019 Dic 20]. http://www.fao.org/3/v5695e/v5695e00.htm [ Links ]
[FAO] Food and Agriculture Organization. 1996. Forest resources assessment 1990 Survey of tropical forest cover study of change processes. Rome: FAO Forestry ; [accessed 2019 Dic 20]. http://www.fao.org/3/w0015e/w0015e00.htm [ Links ]
[FAO] Food and Agriculture Organization. 2007. The world's mangroves 1980-2005. Rome: FAO Forestry ; [accessed 2019 Dic 27]. http://www.fao.org/3/a1427e/a1427e00.pdf [ Links ]
[FAO] Food and Agriculture Organization. 2010. Evaluación de los recursos forestales mundiales 2010: Informe principal. Rome (Italy): FAO Montes; [accessed 2019 Dic 30]. http://www.fao.org/3/i1757s/i1757s.pdf [ Links ]
Harada Y, Fry B, Lee SY, Maher DT, Sippo JZ, Connolly RM. 2019. Stable isotopes indicate ecosystem restructuring following climate-driven mangrove dieback. Limnol Oceanogr. 65(6):1251-1263. https://doi.org/10.1002/lno.11387 [ Links ]
Hirales-Cota M, Espinoza-Avalos J, Schmook B, Ruiz-Luna A, Ramos-Reyes R. 2010. Drivers of mangrove deforestation in Mahahual-Xcalak, Quintana Roo, southeast Mexico = Agentes de deforestación de manglar en Mahahual-Xcalak, Quintana Roo, sureste de México. Cienc Mar. 36(2):147-159. https://doi.org/10.7773/cm.v36i2.1653 [ Links ]
[INE-SEMARNAT] Instituto Nacional de Ecología-Secretaría de Medio Ambiente y Recursos Naturales. 2005. Evaluación preliminar de las tasas de pérdida de superficie de manglar en México [Preliminary assessment of mangrove surface loss rates in Mexico]. México City: INE. 21 p. [ Links ]
[INECC-SEMARNAT] Instituto Nacional de Ecología y Cambio Climático-Secretaría de Medio Ambiente y Recursos Naturales. 2015. First biennial update report to the United Nations framework convention on climate change. 1st ed. Mexico City: INECC-SEMARNAT. 37 p. [ Links ]
[INEGI] Instituto Nacional de Estadística y Geografía. 2015. Encuesta intercensal 2015 [2015 Intercensal Survey]. Mexico City: INEGI [accessed 2019 July 23]. https://www.inegi.org.mx/programas/intercensal/2015/?ps=Microdatos. [ Links ]
[IPCC] Intergovernmental Panel on Climate Change. 2003. Good practice guidance for land use, Land-use change and forestry. Montreal (Canada): Institute for Global Environmental Strategies; IPCC. 590 p. [ Links ]
Lagomasino D, Fatoyinbo L, Castañeda-Moya E, Cook BD, Montesano P, Neigh C, Corp LA, Ott L, Chavez S, Morton DC. 2020. Storm surge, not wind, caused mangrove dieback in southwest Florida following Hurricane Irma. Nat comm. https://doi.org/10.31223/osf.io/q4exh [ Links ]
López-Angarita J, Tilley A, Hawkins JP, Pedraza C, Roberts CM. 2018. Land use patterns and influences of protected areas on mangroves of the eastern tropical Pacific. Biol Conserv. 227:82-91. https://doi.org/10.1016/j.biocon.2018.08.020 [ Links ]
Lovelock CE. 2008. Soil respiration and belowground carbon allocation in mangrove forests. Ecosystems. 11:342-354. https://doi.org/10.1007/s10021-008-9125-4 [ Links ]
Lovelock CE, Feller IC, Reef R, Hickey S, Ball MC. 2017. Mangrove dieback during fluctuating sea levels. Sci Rep UK . 7:1680. https://doi.org/10.1038/s41598-017-01927-6 [ Links ]
[MARN] Ministerio de Ambiente y Recursos Naturales. 2013. Informe técnico: estudio de la cobertura de mangle en la República de Guatemala [Technical report: study of mangrove coverage in the Republic of Guatemala]. Guatemala: MARN. 54 p. [ Links ]
Merecí-Guamán J, Cifuentes M, Casanoves F, Brenes C, Delgado D. 2017. Caracterización de la dinámica de uso de suelo (1985, 2003 y 2016), determinación de flujos de CO2 históricos y simulación de la cobertura de manglar y camaroneras al 2030 [dissertation]. [Turrialba (Costa Rica)]: Centro Agronómico Tropical de Investigación y Enseñanza CATIE. 65 p. [ Links ]
Nellemann C, Corcoran E, Duarte CM, Valdés L, De Young C, Fonseca L, Grimsditch G. 2009. Blue Carbon. A rapid response assessment. Arendal (Noruega): United Nations Environment Programme, GRID-Arendal. [ Links ]
Nogueira-Servino R, De Oliveira-Gomes LE, Fraga-Bernardino A. 2018. Extreme weather impacts on tropical mangrove forests in the Eastern Brazil Marine Ecoregion. Sci Total Environ. 628-629:233-240. https://doi.org/10.1016/j.scitotenv.2018.02.068 [ Links ]
Osorio JA, Crous CJ, Wingfield MJ, Wilhelm De Beer Z, Roux J. 2017. An assessment of mangrove diseases and pests in South Africa. Forestry: An International Journal of Forest Research. 90(3):343-358. https://doi.org/10.1093/forestry/cpw063 [ Links ]
Peña-Messina. 2009. El Cultivo de camarón y la calidad ambiental: ¿Cómo disminuir sus efectos nocivos en las costas de Nayarit?. México: Revista fuente; [accessed 2020 Feb 3]. http://fuente.uan.edu.mx/numero1.php [ Links ]
Pontius RG Jr., Shusas E, McEachern M. 2004. Detecting important categorical land changes while accounting for persistence. Agr Ecosyst Environ. 101(2-3):251-268. https://doi.org/10.1016/j.agee.2003.09.008 [ Links ]
Puyravaud JP. 2003. Standardizing the calculation of the annual rate of deforestation. Forest Ecol Manag . 177(1-3):593-596. https://doi.org/10.1016/S0378-1127(02)00335-3 [ Links ]
Ramirez-Zavala JR, Cervantes-Escobar A, Ramírez-Zavala JR. 2012. El ambiente biofísico de Marismas Nacionales, Sinaloa, y criterios básicos para la gestión de su integridad ecológica. In: Ramíez-Zavala JR, Cervantes-Escobar A, Tapia-Hernández J (eds.), Marismas Nacionales Sinaloa; futuro y conservación. Baja California, Sinaloa (México): Universidad Autónoma de Sinaloa, Pronatura Noroeste AC. p. 53-115. [ Links ]
Richards DR, Friess DA. 2016. Rates and drivers of mangrove deforestation in Southeast Asia, 2000-2012. P Natl Acad Sci USA . 113(2):344-349. https://doi.org/10.1073/pnas.1510272113 [ Links ]
Rodriguez W, Feller IC, Cavanaugh KC. 2016. Spatio-temporal changes of a mangrove-saltmarsh ecotone in the northeastern coast of Florida, USA. Global Ecology and Conservation. 7:245-261. https://doi.org/10.1016/j.gecco.2016.07.005 [ Links ]
Rodríguez-Zúñiga MT, Troche-Souza C, Vázquez-Lule AD, Márquez-Mendoza JD, Vazquez-Balderas B, Valderrama-Landeros L, Velázquez-Salazar S, Cruz-López MI, Ressl RA, Uribe-Martínez A, et al. 2013. Manglares de México: extensión, distribución y monitoreo. Mexico City: CONABIO . 128 p. [ Links ]
Romero-Berny EI, Santamaría-Damián S, Gomez-ortega R, Velázquez-Velázquez E. 2013. Una aproximación a las tasas de deforestación de los manglares en México [An approximation to the deforestation rates of mangroves in Mexico]. Lacandonia. 7(2):51-58. [ Links ]
Rossi RE, Archer SK, Giri C, Layman CA. 2020. The role of multiple stressors in a dwarf red mangrove (Rhizophora mangle) dieback. Estuar Coast Shelf S . 237:106660. https://doi.org/10.1016/j.ecss.2020.106660 [ Links ]
Rubio-Cisneros N, Aburto-Oropeza A. 2013. Marismas Nacionales su subsistencia en el tiempo [Marismas Nacionales their subsistence in time]. Biodiversitas. 108:1-6. [ Links ]
Sader SA, Joyce AT. 1988. Deforestation Rates and Trends in Costa Rica, 1940 to 1983. Biotropica. 20(1):11-19. https://doi.org/10.2307/2388421 [ Links ]
Sasmito SD, Sillanpää M, Hayes MA, Bachri S, Saragi-Sasmito MF, Sidik F, Hanggara BB, Mofu WY, Rumbiak VI, Hendri, et al. 2020. Mangrove blue carbon stocks and dynamics are controlled by hydrogeomorphic settings and land-use change. Glob Change Biol . 26(5):3028-3039. https://doi.org/10.1111/gcb.15056 [ Links ]
Sippo JZ, Lovelock CE, Santos IR, Sanders CJ, Maher DT. 2018. Mangrove mortality in a changing climate: An overview. Estuar Coast Shelf S . 215:241-249. https://doi.org/10.1016/j.ecss.2018.10.011 [ Links ]
Sippo JZ, Maher DT, Schulz KG, Sanders CJ, McMahon A, Tucker J, Santos IR. 2019. Carbon outwelling across the shelf following a massive mangrove dieback in Australia: Insights from radium isotopes. Geochim Cosmochim Ac. 253:142-158. https://doi.org/10.1016/j.gca.2019.03.003 [ Links ]
Torres-Salamanca MG, Ruíz-Vivas AF. 2017. Identificación del cambio de la cobertura de manglar frente al desarrollo de la industria camaronera en la Costa Caribe colombiana, a partir de la interpretación de imágenes de satélite [dissertation]. [Bogota (Colombia)]: Universidad de la Salle Ciencia Unisalle. 97 p. [ Links ]
Troxler TG, Barr JG, Fuentes JD, Engel V, Anderson G, Sanchez C, Lagomasino D, Price R, Davis SE. 2015. Component-specific dynamics of riverine mangrove CO2 efflux in the Florida coastal Everglades. Agr Forest Meteorol. 213:273-282. https://doi.org/10.1016/j.agrformet.2014.12.012 [ Links ]
Valderrama-Landeros LH, Rodríguez-Zúñiga MT, Troche-Souza C, Velázquez-Salazar S, Villeda-Chávez E, Alcántara-Maya JA, Vázquez-Balderas B, Cruz-López MI, Ressl R. 2017. Manglares de México. Actualización y exploración de los datos del sistema de monitoreo 1970/1980-2015. Mexico City: CONABIO . 107 p. [ Links ]
Valdez-Hernández JI, Ruiz-Luna A, Guzmán-Arroyo M, González-Farias F, Acosta-Velázquez J, Vázquez-Lule AD. 2009. Caracterización del sitio de manglar Teacapán-Agua Brava_Marismas Nacionales, Sinaloa-Nayarit. Sitios de manglar con relevancia biologica y con necesidades de rehabilitación ecológica. Report, PN10. Mexico City: CONABIO . 20 p. [ Links ]
Vera-Andrade. 2018. Evaluación y análisis de los cambios de cobertura vegetal del manglar del refugio de vida silvestre manglares estuario Río Esmeraldas [dissertation]. [Ecuador]: Pontificia Universidad Católica del Ecuador sede Esmeraldas. 51 p. [ Links ]
Yáñez-Arancibia A, Twilley RR, Lara-Domínguez AL. 1998. Los ecosistemas de manglar frente al cambio climático global [Mangrove ecosystems in the face of global climate change]. Madera Bosques. 4(2):3-19. https://doi.org/10.21829/myb.1998.421356 [ Links ]
Zhong L, Qiguo Z. 2001. Organic carbon content and distribution in soils under different land uses in tropical and subtropical China. Plant Soil. 231:175-185. [ Links ]
Recibido: 21 de Mayo de 2020; Aprobado: 02 de Octubre de 2020











 texto em
texto em