Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.47 no.1 Ensenada Jan./Mar. 2021 Epub 05-Mar-2021
https://doi.org/10.7773/cm.v47i1.3103
Artículos
Cambios temporales en la abundancia y la alimentación de una comunidad de peces marinos en una laguna costera del sureste mexicano
1Unidad Multidisciplinaria de Docencia e Investigación Sisal, Facultad de Ciencias, Universidad Nacional Autónoma de México, Puerto de abrigo s/n, CP 97355, Sisal, Hunucmá, Yucatán, Mexico.
2Universidad Autónoma de Yucatán, Carretera Mérida-Xmatkuil, km 15.5, Mérida, Yucatán, Mexico.
3Instituto de Ciencias del Mar y Limnología, Unidad Multidisciplinaria de Docencia e Investigación, Universidad Nacional Autónoma de México, Puerto de abrigo s/n, CP 97355, Sisal, Hunucmá, Yucatán, Mexico.
4Escuela Nacional de Estudios Superiores Mérida, Universidad Nacional Autónoma de México, Tablaje catastral, no. 6998, Carretera Mérida-Tetiz, km. 4.5, CP 97357, Ucú, Yucatán, Mexico.
RESUMEN. Las lagunas costeras son sistemas dominados por la variabilidad ambiental ocasionada por ciclos estacionales o nictémeros, lo cual influye directamente en la composición de especies como la de los peces. El objetivo de este estudio fue evaluar la variación en la composición de la comunidad de peces a 2 escalas temporales y analizar la dieta de especies marinas que utilizan la laguna en alguna etapa de su ciclo de vida. El estudio se realizó en la laguna Carbonera en la costa norte de Yucatán, México. Se recolectaron peces cada 2 h con un chinchorro playero durante un ciclo de 24 h, en campañas bimestrales de diciembre de 2010 a octubre de 2011. Las variables hidrológicas registradas y la comunidad de peces se evaluaron a escala nictémera y estacional, y se observaron cambios significativos en la temperatura y la salinidad. La riqueza específica y la diversidad de peces fueron mayores durante la noche, cuando se registraron especies marinas como los armados (Orthopristis chrysoptera), las corvinas (Bairdiella chrysoura), las mojarras (Eugerres plumieri) y los roncos (Haemulon plumierii). La mayor abundancia se obtuvo durante las horas de luz debido a la presencia de cardúmenes de juveniles de sardina (Harengula clupeola) y especies residentes (Floridichthys polyommus y Fundulus persimilis). Se analizó la alimentación de 10 especies de peces marinos en estadio juvenil, y se identificaron 4 principales gremios tróficos (piscívoros, detritívoros, malacófagos y zoobentófagos). Las especies marinas en estadio juvenil de importancia comercial que utilizan la laguna Carbonera para alimentación son las lisas, las sardinas y los roncos. Por lo tanto, este sistema brinda recursos a juveniles de especies de gran importancia para la pesca artesanal, por lo que es de suma importancia elaborar estrategias de manejo para su protección y conservación.
Palabras clave: ciclos nictémeros; zoobentívoros; ictiofauna juvenil; peces marinos
Coastal lagoons are systems that are dominated by the environmental variability caused by seasonal or diel cycles, with a direct effect on fish community composition. The aim of this study was to evaluate the species composition of the fish communities on 2 seasonal scales and analyze the diet composition of marine fish species that use the lagoon at some stage of their life cycles. The study took place in the Carbonera lagoon on the northern coast of Yucatán. Fishes were collected bimonthly (from December 2010 to October 2011) every 2 h using a beach seine net over 24-h cycles. Hydrologic variables and fish community composition were evaluated at nychthemeral and seasonal scales, and significant changes in temperature and salinity were observed. Species richness and diversity of fishes were higher during the night time, with marine species like pigfish (Orthopristis chrysoptera), silver perch (Bairdiella chrysoura), striped mojarra (Eugerres plumieri), and grunts (Haemulon plumieri). Abundance was highest during the daytime because of the presence of schools of juvenile herrings (Harengula clupeola) and residents species (Floridichthys polyommus and Fundulus persimilis). The diet composition of 10 juvenile marine species were analyzed, and four main trophic guilds (piscivores, detritivores, mollusk feeders, and zoobenthivores) were found. The juvenile marine species of commercial value that use the Carbonera lagoon for feeding purposes are mullets, herrings, and grunts. Thus, this system provides resources for juvenile species that are important in artisanal fisheries, and it is therefore very important to make management plans for its protection and conservation.
Key words: nychthymeral cycles; zoobenthivores; juvenile ichthyofauna; marine fishes
INTRODUCCIÓN
La variedad de hábitats que existen en los ecosistemas costeros presenta condiciones de refugio y alimento para muchas especies acuáticas, y estos hábitats funcionan como sitios de intercambio entre la fauna del ambiente marino y la del ambiente continental en distintas etapas de su ciclo de vida (Faunce y Serafy 2008, Kwak et al. 2015). Los peces que viven permanentemente en estos hábitats o que son visitantes ocasionales poseen comportamientos o adaptaciones fisiológicas que les permiten tolerar la dinámica ambiental que se presenta a diferentes escalas temporales. La distribución y la abundancia de estos peces se encuentra determinada por gradientes ambientales, como salinidad, temperatura y oxígeno disuelto (Vega-Cendejas y Hernández-de-Santillana 2004). Las especies marinas que utilizan las lagunas costeras como zonas de forrajeo, protección y desove dependen de condiciones impuestas por los ciclos temporales, como los nictémeros o los estacionales, en donde los patrones de sequía y precipitación juegan un papel importante. Además, la actividad depredadora de individuos solitarios (e.g., pargos o robalos), la presencia de especies que forman agregaciones durante el día (e.g., sardinas o anchoas) y la presencia de estadios juveniles de peces marinos determinan las variaciones a corto plazo en la composición de las asociaciones de peces (Faunce y Serafy 2008, Gross et al. 2019).
Se ha descrito ampliamente la diversidad de peces en aguas costeras del golfo de México (Arceo-Carranza y Vega-Cendejas 2009, Castillo-Rivera et al. 2011, Peralta-Meixueiro y Vega-Cendejas 2011, Bonilla-Gómez et al. 2013), pero las variaciones de las asociaciones de peces marinos juveniles y su alimentación a escala nictémera y estacional son poco conocidas (Arceo-Carranza et al. 2010, Arceo-Carranza et al. 2013, Ayala-Pérez et al. 2014). En la laguna Carbonera, Yucatán (México), no se han realizado estudios sobre el uso de la comunidad íctica a escala temporal nictémera. El objetivo del presente estudio fue analizar la variación en las asociaciones de peces a 2 escalas temporales (nictémera y estacional) en esta laguna costera del sureste de México, así como evaluar la alimentación de 10 especies de peces marinos en estadio juvenil que habitan esta laguna.
MATERIALES Y MÉTODOS
Área de estudio
La costa norte de Yucatán fue decretada como área natural protegida en 2010 con el nombre de “Ciénegas y Manglares de la Costa Norte de Yucatán”. Dentro de esta área, solamente existen 3 bocas de comunicación permanente con el mar. Una de ellas es la laguna Carbonera (Fig. 1), que es un cuerpo de agua semicerrado con profundidad promedio de 30 cm (~180 cm en algunos canales). Está bordeada por manglares, principalmente Rhizophora mangle y Avicennia germinans, mientras que planicies lodosas y pastos sumergidos dominan el fondo. La hidrología está influenciada por corrientes de marea semidiurnas y la descarga de agua dulce a través de ojos de agua y filtraciones (Sánchez-Santillán et al. 2012).
Actividades de muestreo
Las muestras fueron recolectadas bimensualmente de diciembre de 2010 a octubre de 2011, lo que abarcó las 3 épocas climáticas características de la región: secas, lluvias y “nortes” (época caracterizada por vientos fríos). El diseño de muestreo consistió en realizar recolectas cada 2 h comenzando a las 08:00 AM hasta cumplir con un ciclo de 24 h. En cada periodo de recolecta, se registraron las variables hidrológicas de salinidad, temperatura (ºC), oxígeno disuelto (mg/L), sólidos disueltos totales (mg/L) y pH con un medidor multiparamétrico YSI 556, así como la profundidad (cm) con una sondaleza graduada. Estas variables fueron medidas a 50 cm de la superficie. Se realizó un arrastre cada 2 h en la zona de la boca (a 1 m de profundidad máxima dentro de la laguna) con un chinchorro playero de 40 m de longitud y media pulgada de luz de malla, cubriendo un área de 800 m2 (permiso de recolecta No. DOPA/04031/310510.1940). Después de la captura, los peces fueron puestos en hielo triturado y, posteriormente, fijados en formol al 10%.
Procedimiento en laboratorio
En el Laboratorio de Ecología de la Unidad Multidisciplinaria de Docencia e Investigación Sisal de la Universidad Nacional Autónoma de México, los peces fueron identificados hasta nivel de especie por medio de claves especializadas (Hoese y Moore 1998, Castro-Aguirre et al. 1999, Miller 2009). Luego fueron contados, medidos individualmente (longitud estándar, LE; cm ± 0.1) y pesados (g ± 0.01). Después de la identificación, los especímenes fueron depositados en la Colección Ictiológica Regional de Referencia de la Universidad Nacional Autónoma de México, con registro SEMARNAT YUC-PEC-239-01-11.
Para el análisis trófico, se seleccionaron 10 especies de peces marinos que utilizan la laguna en estadio juvenil (Froese y Pauly 2019) con un número de muestra estadísticamente representativo: Archosargus rhomboidalis, Mugil cephalus, Mugil trichodon, Synodus foetens, Elops saurus, Orthopristis chrysoptera, Harengula jaguana, Harengula clupeola, Opisthonema oglinum y Sphoeroides testudineus. El análisis trófico se basó en la identificación de las presas encontradas en los contenidos estomacales. Se registró el área sobre una superficie de papel milimétrico (mm) y el peso (g) para cada una de las presas. Las presas fueron agrupadas en 10 categorías principales: (1) microcrustáceos (anfípodos, isópodos y tanaidáceos), (2) crustáceos (peneidos y braquiuros), (3) moluscos (gasterópodos y bivalvos), (4) peces, (5) poliquetos, (6) insectos, (7) algas (algas bénticas, principalmente), (8) detritus, (9) materia vegetal (semillas y pastos) y (10) “otros”.
Para el análisis cuantitativo, se utilizó el índice de importancia relativa (IRI) descrito por Cortés (1997), el cuál incorpora el método de frecuencia, el método gravimétrico y el método numérico (el área fue utilizada para el numérico).
Análisis estadísticos
Para identificar las diferencias en las asociaciones de peces, se realizó un análisis de similitud (ANOSIM) de 2 vías, con la hora del día (agrupada en 2 categorías: diurno y nocturno) y la época climática como factores. Como los datos no presentaron una distribución normal ni cumplieron con la homogeneidad de varianzas, se utilizó la prueba no paramétrica de Kruskal-Wallis (KW-H) para identificar diferencias temporales entre épocas climáticas y ciclos de luz y oscuridad en los parámetros comunitarios (abundancia, diversidad, equidad, riqueza), y se graficaron la mediana y los cuartiles para cada caso con el software STATISTICA 10.
Para analizar la composición de dietas y la abundancia de presas, se realizó un ANOSIM de 2 vías utilizando como factores las especies de peces y las horas de muestreo (agrupadas en 2 categorías: diurno y nocturno). Los datos del IRI para cada presa se utilizaron para generar una matriz de similitud basada en el índice de Bray-Curtis. Se utilizó la rutina porcentajes de similitud (SIMPER) para identificar las presas que contribuyeron en más del 50% a la disimilitud entre los grupos significativos. Se realizó un análisis de clasificación (cluster) utilizando el índice de similitud de Bray-Curtis, donde el método de agrupación fue el algoritmo de grupo promedio, y se aplicó un análisis de perfiles de similitud (SIMPROF) para determinar estadísticamente los grupos reales generados por los datos analizados. Los análisis no paramétricos se realizaron con el programa PRIMER 6 (Clarke y Gorley 2006). Se utilizó un análisis de correlación de rangos de Spearman para determinar el efecto de las variables hidrológicas sobre las especies de peces analizadas. Se consideró un nivel de significancia del 5% en todos los análisis (Zar 1996).
RESULTADOS
Variación temporal
Se recolectaron un total de 10,779 peces correspondientes a 70 especies. La mayor riqueza de especies y diversidad se registró en la noche, y la mayor abundancia se registró en el día. Estacionalmente, en la época de lluvias se registraron más especies y la mayor abundancia ocurrió durante la época de nortes. El rango en las observaciones se observó de acuerdo con la mediana y los cuartiles mostrados para cada parámetro ecológico (Fig. 2). Sin embargo, estas diferencias no fueron estadísticamente significativas entre número de especies, abundancia, diversidad y equidad en ninguna escala temporal (KW-H: P > 0.05). Los resultados de la composición de especies mostradas por el ANOSIM indicaron diferencias significativas entre todas las épocas climáticas, pero no hubo diferencias en la composición de especies a escala nictémera. Las especies que reflejaron estas diferencias se muestran en la Tabla 1. La especie mejor representada fue H. clupeola con 3,491 organismos en estadio juvenil, y su abundancia fue mayor durante el día y en época de secas. La variación entre épocas climáticas reveló un pico de abundancia de H. clupeola. S. testudineus, Eucinostomus harengulus y Eucinostomus argenteus en época de secas. Durante la época de lluvias, las especies más abundantes fueron M. trichodon, Eucinostomus gula, E. harengulus, S. testudineus, Mugil curema y Sphoeroides spengleri, mientras que en la época de nortes se registraron cardúmenes juveniles (1.0-8.0 cm LE) de sardinas (H. jaguana, H. clupeola y O. oglinum), así como otros peces en estadio juvenil (E. saurus y M. trichodon) (Fig. 3a).
Tabla 1 Resultados del análisis de similitud que muestran el estadístico R, el nivel de significancia (P), la similitud promedio entre muestras y las especies que contribuyeron con el mayor porcentaje a la diferencia.
| R | P | Dissimilarity | Fish species (50%) | Cummulative % | |
| Rainy-northerlies | 0.274 | 0.001 | 79.90 | Fundulus persimilis | 20.22 |
| Floridichthys polyommus | 38.24 | ||||
| Mugil trichodon | 48.65 | ||||
| Eucinostomus gula | 56.83 | ||||
| Rainy-dry season | 0.167 | 0.001 | 80.13 | F. polyommus | 17.36 |
| Harengula clupeola | 28.69 | ||||
| F. persimilis | 38.81 | ||||
| Sphoeroides testudineus | 48.78 | ||||
| Eucinostomus harengulus | 57.19 | ||||
| Northerlies-dry season | 0.241 | 0.001 | 83.77 | F. persimilis | 19.24 |
| F. polyommus | 32.06 | ||||
| H. clupeola | 43.77 | ||||
| S. testudineus | 53.47 | ||||
| Day-night | 0.019 | 0.090 | No significant differences |

Figura 2 Variación nictémera y estacional en los parámetros comunitarios de los peces de la laguna Carbonera. Se muestran los valores del análisis Kurskal-Wallis y el valor de significancia P.

Figura 3 Variación estacional (a) y nictémera (b) de las especies de peces marinos y residentes en la laguna Carbonera. Se presenta la abundancia total por cada categoría y se consideraron solamente aquellas especies con más del 1% de abundancia total. Se muestra la primera letra del género y las 3 primeras letras de la especie: A.lam = Anchoa lamprotaenia, C.ath = Chriodorus atherinoides, C.are = Cynoscion arenarius, C.not = Cynoscion nothus, E.sau = Elops saurus, E.arg = Eucinostomus argenteus, E.gul = Eucinostomus gula, E.har = Eucinostomus harengulus, H.jag = Harengula jaguana, L.rho = Lagodon rhomboides, M.cep = Mugil cephalus, M.cur = Mugil curema, M.tri = Mugil trichodon, O.ogl = Opisthonema oglinum, O.chr = Orthopristis chrysoptera, S.spe = Sphoeroides spengleri, S.tes = Sphoeroides testudineus, S.pla = Symphurus plagiusa, S.foe = Synodus foetens, H.clu = Harengula clupeola, F.pol = Floridichthys polyommus, F.per = Fundulus persimilis.
Las especies de peces marinos con mayor actividad durante la noche fueron H. clupeola, E. saurus, E. gula, E. harengulus, H. jaguana, O. chrysoptera, S. testudineus, S. foetens, M. cephalus y Symphurus plagiusa. La Figura 3b muestra el porcentaje de la captura total por especie. En su mayoría, estos organismos fueron juveniles con tallas máximas que no alcanzaban aún la primera madurez sexual reportada (Froese y Pauly 2019). Las especies residentes Floridichthys polyommus y Fundulus persimilis también tuvieron mayor registro durante la noche (Fig. 3b).
Alimentación
En general, de acuerdo con el IRI (Tabla 2), las presas más consumidas por los peces marinos fueron microcrustaceos (anfípodos), peces y microalgas. Esta tendencia de las presas más importantes coincidió entre los diferentes métodos (área, peso y frecuencia) que componen el IRI (Fig. 4). Las diferencias en la dieta de las especies, en cuanto a composición y abundancia de presas, fueron significativas entre ciclos nictémeros (R global = 0.17; P < 0.01) y entre especies (R global = 0.308; P < 0.01), e incluso entre especies del mismo género (Mugil) y especies del mismo gremio trófico. La actividad de alimentación de las especies piscívoras (E. saurus y S. foetens) y zoobentívoras (O. chrysoptera) ocurrió principalmente durante la noche.
Tabla 2 Porcentaje de peso (%W), área (%A) y frecuencia (%FO) e índice de importancia relativa (%RII) para los grupos presa de las especies de peces de la laguna la Carbonera, Yucatán.
| Archosargus rhomboidalis | Mugil cephalus | Mugil trichodon | ||||||||||
| %W | %A | %FO | %RII | %W | %A | %FO | %RII | %W | %A | %FO | %RII | |
| Microcrustaceans | 41.96 | 41.52 | 33.33 | 58.90 | ||||||||
| Crustaceans | 3.62 | 3.62 | 7.69 | 1.18 | ||||||||
| Mollusk | 3.49 | 3.56 | 12.82 | 1.91 | ||||||||
| Algae | 18.01 | 18.38 | 20.51 | 15.79 | 30.32 | 31.25 | 27.27 | 22.66 | 100 | 100 | 100 | 100 |
| Detritus | 27.92 | 27.92 | 17.95 | 21.21 | 44.68 | 43.75 | 54.55 | 65.08 | ||||
| Plants | 4.23 | 4.23 | 5.13 | 0.92 | 25.00 | 25.00 | 18.18 | 12.27 | ||||
| Fishes | ||||||||||||
| Polychaeta | ||||||||||||
| Insects | ||||||||||||
| Other | 0.77 | 0.77 | 2.56 | 0.08 | ||||||||
| Synodus foetens | Elops saurus | Orthopristis chrysoptera | ||||||||||
| %W | %A | %FO | %RII | %W | %A | %FO | %RII | %W | %A | %FO | %RII | |
| Microcrustaceans | 5.56 | 6.98 | 7.89 | 0.74 | 39.21 | 43.51 | 34.60 | 62.30 | ||||
| Crustaceans | 10.00 | 7.00 | 4.50 | 0.44 | 5.56 | 5.40 | 5.26 | 0.43 | 1.41 | 2.90 | 8.21 | 0.77 |
| Mollusk | 19.49 | 17.53 | 21.41 | 17.25 | ||||||||
| Algae | 0.03 | 0.18 | 3.23 | 0.01 | ||||||||
| Detritus | 8.09 | 8.84 | 2.35 | 0.85 | ||||||||
| Plants | 2.73 | 4.15 | 11.44 | 1.71 | ||||||||
| Fishes | 89.00 | 92.00 | 95.00 | 99.55 | 84.21 | 83.71 | 78.95 | 98.52 | 0.04 | 0.19 | 0.88 | 0.01 |
| Polychaeta | 28.95 | 22.53 | 15.25 | 17.07 | ||||||||
| Insects | 0.48 | 0.66 | 2.63 | 0.02 | 0.02 | 0.07 | 0.88 | 0.01 | ||||
| Other | 1.00 | 1.00 | 0.50 | 0.01 | 4.20 | 3.25 | 5.26 | 0.29 | 0.03 | 0.10 | 1.76 | 0.01 |
| Harengula jaguana | Harengula clupeola | Opisthonema oglinum | ||||||||||
| %W | %A | %FO | %RII | %W | %A | %FO | %RII | %W | %A | %FO | %RII | |
| Microcrustaceans | 85.74 | 87.12 | 74.28 | 98.58 | 92.81 | 91.10 | 68.39 | 99.08 | 90.88 | 88.74 | 83.34 | 98.24 |
| Crustaceans | 6.18 | 4.34 | 11.45 | 0.92 | 0.50 | 0.51 | 3.97 | 0.03 | 0.02 | 2.56 | 1.85 | 0.03 |
| Mollusk | 9.10 | 8.70 | 14.81 | 1.73 | ||||||||
| Algae | ||||||||||||
| Detritus | ||||||||||||
| Plants | ||||||||||||
| Fishes | 6.66 | 7.90 | 2.85 | 0.32 | 4.00 | 4.30 | 9.21 | 0.60 | ||||
| Polychaeta | 2.45 | 3.10 | 5.70 | 0.25 | ||||||||
| Insects | 1.42 | 0.64 | 11.42 | 0.18 | 0.08 | 0.34 | 10.53 | 0.03 | ||||
| Other | 0.09 | 0.12 | 1.32 | 0.01 | ||||||||
| Sphoeroides testudineus | ||||||||||||
| %W | %A | %FO | %RII | |||||||||
| Microcrustaceans | 9.17 | 10.70 | 8.04 | 1.20 | ||||||||
| Crustaceans | 10.59 | 13.25 | 8.62 | 1.54 | ||||||||
| Mollusk | 80.14 | 75.95 | 83.14 | 97.25 | ||||||||
| Algae | ||||||||||||
| Detritus | ||||||||||||
| Plants | ||||||||||||
| Fishes | ||||||||||||
| Polychaeta | ||||||||||||
| Insects | ||||||||||||
| Other | 0.10 | 0.10 | 0.20 | 0.01 | ||||||||

Figura 4 Índice de importancia relativa de las presas que compusieron la dieta de los peces marinos juveniles recolectados en la laguna Carbonera (A.rho = Archosargus rhomboidalis, M.cep = Mugil cephalus, M.tri = Mugil trichodon, S.foe = Synodus foetens, E.sau = Elops saurus, O.chr = Orthopristis chrysoptera, H.jag = Harengula jaguana, H.clu = Harengula clupeola, O.ogl = Opisthonema oglinum, S.tes = Sphoeroides testudineus).
Los resultados del análisis de clasificación confirmaron la formación de 4 gremios tróficos que agruparon especies con similitudes de dieta superiores al 20% (Fig. 5). Synodus foetens y E. saurus consumieron peces. Mugil cephalus, M. trichodon y A. rhomboidalis se alimentaron de detritus y algas bentónicas. Sphoeroides testudineus se alimentó casi exclusivamente de moluscos. Las sardinas (H. jaguana, H. clupeola y O. oglinum) y el armado (O. chrysoptera) se alimentaron principalmente de anfípodos.
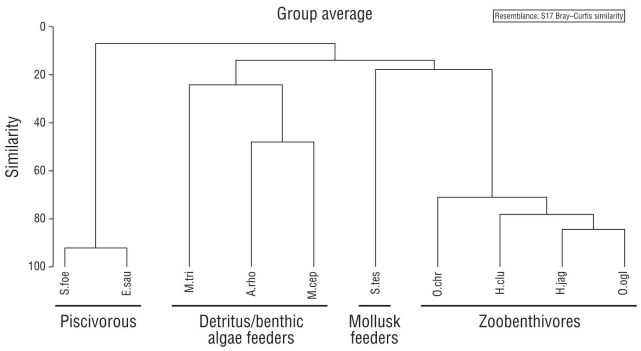
Figura 5 Similitud de la dieta de los peces marinos de la laguna Carbonera, Yucatán, en estadio juvenil (S.foe = Synodus foetens, E.sau = Elops saurus, M.tri = Mugil trichodon, A.rho = Archosargus rhomboidalis, M.cep = Mugil cephalus, S.tes = Sphoeroides testudineus, O.chr = Orthopristis chrysoptera, H.clu = Harengula clupeola, H.jag = Harengula jaguana, O.ogl = Opisthonema oglinum). Los gremios tróficos se agruparon a una similitud (Bray-Curtis) del 20%.
Variables hidrológicas
No se encontraron diferencias significativas (KW-H, P > 0.05) en las variables hidrológicas a lo largo de los ciclos día-noche, excepto en el oxígeno disuelto (KW-H, P < 0.05), que alcanzó su punto máximo durante el día (entre 2:00 PM y 4:00 PM) y el más bajo al amanecer (4:00 AM). Los valores promedio y la desviación estándar para el grupo hora del día (diurno y nocturno) y el grupo épocas climáticas se muestran en la Tabla 3.
Tabla 3 Valores promedio y desviación estándar de las variables hidrológicas para los grupos nictémeros (día y noche) y los de escala estacional (lluvias, nortes y secas).
| Day | Night | Rainy | Nortes | Dry | |
| Temperature (ºC) | 27.88 ± 3.89 | 26.30 ± 3.64 | 31.66 ± 2.45 | 23.25 ± 2.09 | 31.11 ± 2.43 |
| Total dissolved solids (ppm) | 34.48 ± 3.75 | 36.14 ± 3.63 | 36.33 ± 3.25 | 34.04 ± 1.55 | 41.92 ± 3.04 |
| Salinity | 34.97 ± 4.14 | 37.04 ± 4.29 | 37.10 ± 4.15 | 34.51 ± 1.74 | 42.92 ± 3.55 |
| Dissolved oxygen (mg/L) | 6.99 ± 1.47 | 4.97 ± 1.41 | 6.47 ± 1.96 | 5.57 ± 1.86 | 6.61 ± 1.72 |
| Depth (cm) | 78.30 ± 16.45 | 69.38 ± 17.74 | 85.41 ± 20.83 | 65.58 ± 19.97 | 81.95 ± 12.85 |
Con respecto a la variación estacional, se identificaron diferencias significativas entre la temperatura (KW-H = 44.10, P < 0.01), los sólidos disueltos totales (KW-H = 38.90, P < 0.01), la salinidad (KW-H = 34.57, P < 0.01), el pH (KW-H = 15.30, P < 0.01) y la profundidad (KW-H = 6.19, P < 0.05). Las temperaturas medias alcanzaron valores máximos en los meses secos y lluviosos, particularmente en junio (29.9 ºC) y agosto (30.5 ºC), y valores mínimos durante la época de nortes (21.6 ºC). La salinidad media fue de 36.0 (25.0-46.5). Hubo variaciones temporales significativas en los sólidos disueltos totales (25.2 a 44.52 mg/L) y el pH (7.41 a 10.73). Las diferencias estacionales en la profundidad se relacionaron con la precipitación (112 cm en la época lluviosa y 76 cm en la época seca). Los valores promedio y la desviación estándar a escala nictémera y estacional se muestran en la Tabla 3.
En la relación de los peces y la hidrología, se identificaron principalmente relaciones negativas con las especies analizadas (Tabla 4). Se destaca la relación significativa de especies marinas como los sciánidos (Cynoscion nebulosus y Cynoscion arenarius) con la salinidad y los sólidos suspendidos.
Tabla 4 Valores del índice de correlación de Spearman para las relaciones entre las especies de peces y las variables hidrológicas. Solamente se muestran aquellas especies que presentaron al menos una correlación significativa (P < 0.05, valores en negritas).
| Temperature | Total dissolved solids | Salinity | Dissolved oxygen | Depth | |
| Chriodorus atherinoides | -0.13 | 0.01 | -0.007 | -0.06 | -0.25 |
| Cynoscion arenarius | 0.04 | -0.32 | -0.34 | -0.14 | 0.07 |
| Cynoscion nothus | 0.02 | -0.39 | -0.41 | -0.005 | 0.05 |
| Elops saurus | -0.36 | 0.10 | 0.09 | -0.26 | -0.24 |
| Lagodon rhomboides | -0.14 | 0.16 | 0.14 | -0.12 | -0.27 |
| Opisthonema oglinum | -0.27 | -0.14 | -0.14 | -0.09 | -0.006 |
| Orthopristis chrysoptera | -0.16 | 0.26 | 0.23 | -0.36 | 0.02 |
| Sphoeroides spengleri | -0.07 | -0.47 | -0.42 | -0.03 | 0.05 |
| Sphoeroides testudineus | 0.22 | 0.24 | 0.20 | 0.006 | -0.06 |
| Symphurus plagiusa | 0.05 | -0.45 | -0.40 | 0.01 | 0.19 |
| Synodus foetens | 0.007 | -0.35 | -0.29 | -0.03 | 0.14 |
| Fundulus persimilis | -0.36 | -0.30 | -0.32 | -0.18 | -0.02 |
DISCUSIÓN
Variación temporal
Las especies de peces analizadas mostraron un uso diferencial de la laguna, ya que la composición, la abundancia y la alimentación de especies difiere a lo largo de ciclos nictémeros y anuales. Picos de abundancia de especies marinas fueron registrados en horas de oscuridad, donde los estadios juveniles fueron dominantes (Ayala-Pérez et al. 2014, Gross et al. 2019). Este patrón en la composición de tallas es común en lagunas costeras tropicales que funcionan como áreas de crianza (Pattrick y Strydom 2014, Enchelmaier et al. 2020).
La presencia y la abundancia de especies de peces marinos dentro de la laguna cambió a escala nictémera. Las variaciones en las asociaciones de peces a escala nictémera están altamente influenciadas por un subconjunto de especies marinas que forman cardúmenes que ingresan a los sistemas lagunares y estuarinos durante periodos cortos de tiempo para alimentarse y evitar a los depredadores (Castillo-Rivera et al. 2011, Zárate-Hernández et al. 2012, Kruse et al. 2016). Las variaciones nictémeras en la abundancia de lisas (M. trichodon) y sardinas (Clupeidae) son responsables de los cambios en las especies dominantes de la laguna. En este sentido, las variaciones en la abundancia de H. jaguana, O. oglinum y M. trichodon a escala anual podrían estar relacionadas con sus ciclos reproductivos y con el uso de la laguna para el crecimiento de peces juveniles (García-Abad et al. 1999, Ibáñez y Gutiérrez-Benítez 2004).
Alimentación
Los peces presentes en este sitio se alimentaron de diferentes recursos y ocuparon varios niveles tróficos. De acuerdo con la clasificación de Elliott et al. (2007), los peces zoobentívoros forman uno de los grupos más abundantes en los ecosistemas costeros, así como se observó en la laguna Carbonera (Arceo-Carranza et al. 2013, Enchelmaier et al. 2020). La presencia en grandes cantidades de especies marinas juveniles como S. foetens, que se alimenta principalmente de peces, indica que la laguna se está utilizando como área de alimentación (Arceo-Carranza y Chiappa-Carrara 2015). Elops saurus y H. jaguana son especies dependientes de la laguna; desovan en la costa y sus larvas y juveniles buscan las aguas estuarinas para crecer y alimentarse (Santos-Martínez y Arboleda 1993, McBride et al. 2001). Sphoeroides testudineus es una especie con gran plasticidad trófica que tiene una dieta que cambia de acuerdo con la disponibilidad de presas en otras lagunas costeras del golfo de México (Arceo-Carranza et al. 2013, Chi-Espinola y Vega-Cendejas 2013). Este pez se alimenta de anfípodos, macrófitos y detritos, pero en la laguna Carbonera, los moluscos son la presa más importante (Palacios-Sánchez y Vega Cendejas 2010). El armado (O. chrysoptera) es una especie de importancia comercial que tiene presencia durante todo el año; esta especie, que solamente se capturó en estadio juvenil, se alimenta de presas bentónicas, lo que sugiere que la laguna es un hábitat adecuado para su desarrollo, como ha sido reportado por otros autores (Elliott et al. 2007). Otras especies marinas de importancia comercial son las lisas M. cephalus y M. trichodon; estos peces se alimentan, principalmente, de detritos y algas bentónicas y han sido reconocidos como elementos clave en la conducción de energía dentro del sistema (Franco y Bashirullah 1992), al participar como eslabón entre la base de la red trófica y los depredadores de la laguna.
Estas especies apoyan la pesca local (Salas et al. 2006). Por lo tanto, se puede decir que esta laguna constituye un hábitat de crianza que ayuda a mantener las pesquerías artesanales de la región. La selectividad y el uso diferencial de los recursos dan como resultado dietas particulares para cada especie. El tamaño del pez, la hora del día o la época climática pueden contribuir a las diferencias en la dieta. Estos cambios en la dieta pueden interpretarse como una estrategia para reducir la competencia cuando disminuye la abundancia de presas (Dias et al. 2017). En este caso, una diferencia en la intensidad de la depredación es uno de los mecanismos que reducen la superposición de la dieta entre especies (Ramírez-Luna et al. 2008).
Peces y variables hidrológicas
Las variaciones en la salinidad, la temperatura, las concentraciones de oxígeno disuelto y la turbidez regulan la distribución y la abundancia de peces en los sistemas costeros durante los ciclos temporales (Carpentieri et al. 2005). Estos cambios se deben principalmente a la época seca y la de lluvias, las cuales determinan la extensión del hábitat disponible para los peces a lo largo de los humedales kársticos y poco profundos de la costa de Yucatán (Bonilla-Gómez et al. 2013); así mismo, la presencia de los frentes fríos provoca una disminución gradual de la temperatura durante la época de nortes, lo que aumenta la mezcla vertical de la columna de agua a través de la turbulencia. Estos cambios en la hidrología influyen en la distribución de los peces, como sucede en otros sistemas costeros en la costa noreste de la península de Yucatán (Arceo-Carranza y Vega-Cendejas 2009, Peralta-Meixueiro y Vega-Cendejas 2011).
La laguna Carbonera es un sitio ambientalmente dinámico, geográficamente importante para especies marinas por la distancia que hay con otras lagunas costeras en la región. Las primeras etapas de vida en muchas especies se reemplazan a diferentes escalas temporales (nictémeras y estacionales), ya que el hábitat puede usarse como vivero, sitio de alimentación o refugio contra los depredadores. La laguna es importante para la interacción con sistemas vecinos como el mar, los petenes y la ciénega, razón por la cual cuenta con una riqueza importante de peces dulceacuícolas y marinos, los cuales explotan los recursos alimentarios ocupando diversos gremios y niveles en la red trófica del sistema. Este estudio es un primer acercamiento a la utilización de hábitat de juveniles de especies marinas. Se recomienda realizar otros análisis (Beck et al. 2001, Able 2005) para determinar si en realidad esta laguna podría funcionar como un hábitat de crianza.
AGRADECIMIENTOS
Agradecemos especialmente a Maribel Badillo-Alemán y Alfredo Gallardo-Torres su apoyo en la logística de laboratorio y con la curatoria de los ejemplares en la colección. Johnny Valdéz-Iuit brindó apoyo logístico para el trabajo de campo y la realización del mapa del área de estudio. En nombre de todos los autores, el autor de correspondencia declara que no hay conflicto de intereses.
REFERENCIAS
Able, K.W. 2005. A re-examination of fish estuarine dependence: evidence for connectivity between estuarine and ocean habitats. Est Coast Shelf Sci. 64(1):5-17. https://doi.org/10.1016/j.ecss.2005.02.002 [ Links ]
Arceo-Carranza, D., Chiappa-Carrara, X. 2015. Feeding ecology of juvenile marine fish in a shallow coastal lagoon of southeastern Mexico. Lat Am J Aquat Res. 43(4):621-631. [ Links ]
Arceo-Carranza, D., Vega-Cendejas, M.E. 2009. Spatial and temporal characterization of fish assemblages in a tropical coastal system influenced by freshwater inputs: northwestern Yucatan peninsula. Rev Biol Trop. 57(1-2):89-103. https://doi.org/10.15517/rbt.v57i1-2.11293 [ Links ]
Arceo-Carranza, D., Vega-Cendejas, M.E., Hernández-de-Santillana, M. 2013. Day and night trophic variations of dominant fish species in a lagoon influenced by freshwater seeps. J Fish Biol. 82(1):54-68. https://doi.org/10.1111/j.1095-8649.2012.03463.x [ Links ]
Arceo-Carranza, D., Vega-Cendejas, M.E., Montero-Muñoz, J.L., Hernández-de-Santillana, M.J. 2010. Influencia del hábitat en las asociaciones nictimerales de peces en una laguna costera tropical = Influence of habitat type on diel fish associations in a tropical costal lagoon. Rev Mex Biod. 81(003):823-837. https://doi.org/10.22201/ib.20078706e.2010.003.652 [ Links ]
Ayala-Pérez, L.A., Vasco-Villa, O., Sosa-López, A. 2014. Evaluación de las asociaciones de peces dominantes influenciadas por el ciclo nictemeral y la variación temporal en la reserva de la biósfera Los Petenes, Campeche México = Evaluation of the associations of dominant fish influenced by the nycthemeral cycle and temporal variations in Los Petenes Biosphere Reserve, Campeche, Mexico. Cienc UAT. 9(1):33-43. https://doi.org/10.29059/cienciauat.v9i1.618 [ Links ]
Beck, M.W., Heck, K.L., Able, K.W., Childers, D.L., Eggleston, D.B., Gillanders, B.M., Halpern, B., Hays, C.G., Hoshino, K., Minello, T.J. et al. 2001. The identification, conservation, and management of estuarine and marine nurseries for fish and invertebrates. Bioscience. 51(8):633-641. https://doi.org/10.1641/0006-3568(2001)051[0633:ticamo] 2.0.co;2 [ Links ]
Bonilla-Gómez, J.L., Badillo, M., López, K., Gallardo, A., Galindo, C., Arceo, D., Chiappa-Carrara, X. 2013. Environmental influences on the abundance of dominant fishes in a very shallow tropical coastal lagoon in northwestern Yucatan peninsula, Mexico. J Mar Sci Res Dev. 3:118. https//:doi.org/10.4172/2155-9910.1000118 [ Links ]
Carpentieri, P., Colloca, F., Ardizzone, G.D. 2005. Day-night variations in the demersal nekton assemblage on the Mediterranean shelf-break. Estuar Coast Shelf Sci. 63(4):577-588. https://doi.org/10.1016/j.ecss.2005.01.005 [ Links ]
Castillo-Rivera, M., Ortiz-Burgos, S., Zárate-Hernández, R. 2011. Estructura de la comunidad de peces estuarinos en un hábitat con vegetación sumergida: variación estacional y nictémera = Estuarine fish community structure in a submerged aquatic vegetation habitat: seasonal and diel variations. Hidrobiológica. 21(3):311-321. [ Links ]
Castro-Aguirre, J.L., Espinoza-Pérez, H.S., Schmitter-Soto, J.J. 1999. Ictiofauna estuarino-lagunar y vicaria de México [Estuarine-lagoon and vicar ichthyofauna of Mexico]. Colección Textos Politécnicos, Serie Biotecnologías. Mexico: Editorial Limusa. 711 p. [ Links ]
Chi-Espinola, A.A., Vega-Cendejas, M.E. 2013. Hábitos alimenticios de Sphoeroides testudineus (Perciformes: Tetraodontidae) en el sistema lagunar de Ría Lagartos, Yucatán, México = Feeding habits of Sphoeroides testudineus (Perciformes: Tetraodontidae) in the lagoon system of Ria Lagartos, Yucatán Mexico. Rev Biol Trop. 61(2):849-858. https://doi.org/10.15517/RBT.V61I2.11229 [ Links ]
Clarke, K.R., Gorley, R.N. 2006. PRIMER V6 User Manual/Tutorial. Plymouth (UK): PRIMER-E. 192 p. [ Links ]
Cortés, E. 1997. A critical review of methods of studying fish feeding based on analysis of stomach contents: application to elasmobranch fishes. Can J Fish Aquat Sci. 54(3):726-738. https://doi.org/10.1139/f96-316 [ Links ]
Dias, T.S., Stein, R.J., Fialho, C.B. 2017. Ontogenetic variations and feeding habits of a Neotropical annual fish form Southern Brazil. Iheringia Sér Zool. 107:e2017020. https://doi.org/10.1590/1678-4766e2017020 [ Links ]
Elliott, M., Whitfield, A.K., Potter, I.C., Blaber, S.J.M., Cyrus, D.P., Nordlie, F.G., Harrison, T.D. 2007. The guild approach to categorizing estuarine fish assemblages: a global review. Fish and Fisheries. 8(3):241-268. https://doi.org/10.1111/j.1467-2679.2007.00253.x [ Links ]
Enchelmaier, A.C., Babcock, E.A., Hammerschlag, N. 2020. Survey of fishes within a restored mangrove habitat of a subtropical bay. Estuar Coast Shelf Sci. 244:106021. https://doi.org/10.1016/j.ecss.2018.11.009 [ Links ]
Faunce, C.H., Serafy, J.E. 2008. Growth and secondary production of an eventual reef fish during mangrove residency. Estuar Coast Shelf Sci. 79(1):93-100. https://doi.org/10.1016/j.ecss.2008.03.006 [ Links ]
Franco, L., Bashirullah, K.M.B. 1992. Alimentación de la lisa (Mugil curema) del Golfo de Cariaco estado de Suche, Venezuela [The feeding of Mugil curema in the Cariaco Gulf, Sucre state, Venezuela]. Zoo Trop. 10(2):219-238. [ Links ]
Froese, R., Pauly, D. (eds.). 2019. FishBase. World Wide Web electronic publication. [Place unknown]: FishBase; accessed 2019 Dec 6. https://www.fishbase.org , version (08/2019). [ Links ]
García-Abad, M.C., Tapia-García, M., Yáñez-Arancibia, A., Sánchez-Gil, P. 1999. Distribución, abundancia y reproducción de Harengula jaguana Goode y Bean, 1879, en la plataforma continental del sur del Golfo de México (Pisces: Clupeidae) [Distribution, abundance, and reproduction of Harengula jaguana Goode and Bean, 1879, on the continental shelf of the southern Gulf of Mexico (Pisces: Clupeidae)]. Biotropica. 31(3):494-501. https://doi.org/10.1111/j.1744-7429.1999.tb00392.x [ Links ]
Gross, C., Ruesink, J.L., Pruitt, C., Trimble, A.C., Donoghue, C. 2019. Temporal variation in intertidal habitat use by nekton at seasonal and diel scales. J Exp Mar Biol Ecol. 516:25-34. https://doi.org/10.1016/j.jembe.2019.04.009 [ Links ]
Hoese, H.D., Moore, R.H. 1998. Fishes of the Gulf of México: Texas, Louisiana and Adjacent Waters (Keys). 2nd ed. Texas: Texas University Press. 416 p. [ Links ]
Ibáñez, A.L., Gutiérrez-Benítez, O. 2004. Climate variables and spawning migrations of the striped mullet and white mullet in the north-western area of the Gulf of Mexico. J Fish Biol. 65(3):822-831. https://doi.org/10.1111/j.0022-1112.2004.00488.x [ Links ]
Kruse, M., Taylor, M., Muhando, C.A., Reuter, H. 2016. Lunar, diel, and tidal changes in fish assemblages in an East African marine reserve. Reg Stud Mar Sci. 3:49-57. https://doi.org/10.1016/j.rsma.2015.05.001 [ Links ]
Kwak, S.N., Klumpp, D.W., Park, J.M. 2015. Feeding relationships among juveniles of abundant fish species inhabiting tropical seagrass beds in Cockle Bay, North Queensland, Australia. NZJ Mar Freshw Res. 49(2):205-223. https://doi.org/10.1080/00288330.2014.990467 [ Links ]
McBride, R.S., MacDonald, T.C., Matheson, Jr. R.E., Rydene, D.A., Hood, P.B. 2001. Nursery habitats for ladyfish, Elops saurus, along salinity gradients in two Florida estuaries. Fish Bull. 99(3):443-458. [ Links ]
Miller, R.R. 2009. Peces Dulceacuícolas de México = Freshwater Fishes of México. Mexico City (Mexico): Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Sociedad Ictiológica Mexicana A C, El colegio de la Frontera Sur, Consejo de los Peces del Desierto México-Estados Unidos. [ Links ]
Palacios-Sánchez, S.E., Vega-Cendejas, M.E. 2010. Cambios alimenticios en tres especies de Sphoeroides (Tetraodontiformes: Tetraodontidae) posterior al huracán Isidoro en Bocana de la Carbonera, Sureste del Golfo de México = Feeding changes for three Sphoeroides species (Tetraodontiformes: Tetraodontidae) after Isidore hurricane impact in Carbonera Inlet, Southeastern Gulf of Mexico. Rev Biol Trop. 58(4):1223-1235. https://doi.org/10.15517/rbt.v58i4.5407 [ Links ]
Pattrick, P., Strydom, N. 2014. Recruitment of fish larvae and juveniles into two estuarine nursery areas with evidence of ebb tide use. Estuar Coast Shelf Sci. 149:120-132. https://doi.org/10.1016/j.ecss.2014.08.003 [ Links ]
Peralta-Meixueiro, M.A., Vega-Cendejas, M.E. 2011. Spatial and temporal structure of fish assemblages in a hyperhaline coastal system: Ría Lagartos, Mexico. Neotrop Ichthyol. 9(3):673-682. https://doi.org/10.1590/s1679-62252011005000033 [ Links ]
Ramírez-Luna, V., Navia, A.F., Rubio, E.A. 2008. Food habits and feeding ecology of an estuarine fish assemblage of northern Pacific Coast of Ecuador. Pan-American Journal of Aquatic Sciences. 3(3):361-372. [ Links ]
Salas, S., Mexicano-Cintora, G., Cabrera, M.A. 2006. ¿Hacia dónde van las pesquerías en Yucatán? Tendencias, retos y perspectivas [Where are fisheries heading in Yucatán? Trends, challenges, and perspectives]. Mexico: Centro de Investigación y de Estudios Avanzados-Mérida. [ Links ]
Sánchez-Santillán, N., de la Lanza-Espino, G., Sánchez-Trejo, R. 2012. Análisis de la climatología dinámica en el NE de la península de Yucatán, México [Analysis of the dynamic climatology in the NE of the Yucatan Peninsula, Mexico]. In: Sánchez, A.J., Chiappa-Carrara, X., Brito-Pérez, R. (eds.), Recursos Acuáticos Costeros del Sureste [Southeast aquatic coastal resources]. Mérida (Mexico): Consejo de Ciencia, Innovación y Tecnología del Estado de Yucatán. p. 29-55. [ Links ]
Santos-Martínez, A., Arboleda, S. 1993. Aspectos biológicos y ecológicos del macabí Elops saurus Linnaeus (Pisces: Elopidae) en la ciénaga grande de Santa Marta y costa adyacente, Caribe colombiano [Biological and ecological aspects of the macabi Elops saurus Linnaeus (Pisces: Elopidae) in the large swamp of Santa Marta and adjacent coast, Colombian Caribbean]. Bol Invest Mar Cost. 22(1):77-96. [ Links ]
Vega-Cendejas, M.E., Hernández-de-Santillana, M. 2004. Fish community structure and dynamics in a coastal hypersaline lagoon: Rio Lagartos, Yucatan, Mexico. Estuar Coast Shelf Sci. 60(2):285-299. https://doi.org/10.1016/j.ecss.2004.01.005 [ Links ]
Zar, J.H. 1996. Biostatistical Analysis. Upper Saddle River (NJ): Prentice Hall. 662 p. [ Links ]
Zárate-Hernández, R., Castillo-Rivera, M., Sanvicente-Añorve, L., Ortiz-Burgos, S. 2012. Spatial, diel, and seasonal changes in the fish community structure of a Mexican tropical estuary = Cambios espaciales, nictímeros y estacionales en la estructura de la comunidad de peces en un estuario tropical mexicano. Cienc Mar. 38(4):665-676. https://doi.org/10.7773/cm.v38i4.2018 [ Links ]
Recibido: 13 de Febrero de 2020; Aprobado: 13 de Agosto de 2020











 texto em
texto em 



