Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.42 no.4 Ensenada Dez. 2016
https://doi.org/10.7773/cm.v42i4.2677
Artículos
Análisis de la capacidad antioxidante y compuestos bioactivos en extractos macroalgales y liquénicos mediante la aplicación de diferentes solventes y métodos de evaluación
1 Department of Ecology and Geology, Faculty of Sciences, International Campus of Excellence Andalucia Tech, University of Málaga, 29071 Málaga, Spain.
Los extractos naturales de las macroalgas son ampliamente reconocidos por sus propiedades antioxidantes. En este trabajo la capacidad antioxidante de diversos extractos acuosos e hidroalcohólicos obtenidos de algas marinas (rojas y verdes) y de un liquen marino, recolectados en diferentes puntos del sur de España (aguas intermareales y estuarinas), fue evaluada mediante diferentes métodos: método ABTS, ensayo DPPH y método de decoloración del β-caroteno (BBM). Se determinó el contenido de lípidos totales, carbohidratos totales y fotoprotectores de radiación UV con capacidad antioxidante como los aminoácidos de tipo micosporina y compuestos fenólicos. Entre los solventes de extracción, el mayor rendimiento de extracción se observó en los solventes H2O y MeOH 20% (v/v). La mayor actividad antioxidante se encontró en los extractos de las macroalgas rojas Hydropuntia cornea, Gracilariopsis longissima, Halopithys incurva y Porphyra umbilicalis, mientras que la actividad más baja se detectó en los de la macroalga verde Ulva rotundata. En general, la actividad antioxidante fue mayor usando el ensayo DPPH que el método ABTS y el BBM. Aun así, se propone el método ABTS como una prueba sencilla y rápida que proporciona una visión completa del extracto en su conjunto, ya que mediante esta metodología se evalúan los componentes que se encuentran tanto en el medio lipofílico como el medio hidrofílico. La actividad antioxidante se relacionó con la composición de compuestos bioactivos sin descartar la acción sinérgica entre sus compuestos. Se discute el uso biotecnológico de los extractos de macroalgas con alta capacidad antioxidante.
Palabras clave: antioxidantes; compuestos bioactivos; extractos; líquenes; macroalgas
Natural extracts of macroalgae are widely recognized for their antioxidant properties. In this work, the antioxidant capacity of various aqueous and hydroalcoholic extracts obtained from red and green marine algae and from one marine lichen collected from different sites in southern Spain (intertidal and estuarine waters) was evaluated by different methods: ABTS free radical scavenging assay, DPPH assay, and P-carotene bleaching method (BBM). Contents of total lipids, total carbohydrates, and UV photoprotectors with antioxidant capacity, such as mycosporine-like amino acids and phenolic compounds, were determined. Among the extraction solvents, the highest extraction yield was observed in H2O and 20% MeOH (v/v). The highest antioxidant activity was found in the extracts of the red macroalgae Hydropuntia cornea, Gracilariopsis longissima, Halopithys incurva, and Porphyra umbilicalis, whereas the lowest activity was detected in the green macroalga Ulva rotundata. In general, the antioxidant activity was higher using DPPH than BBM and ABTS. Even so, the ABTS assay is an easy and quick test that provides a comprehensive view of the entire extract in both the lipophilic medium and hydrophilic medium. The antioxidant activity was related to the composition of bioactive compounds and synergistic action is not discarded. The biotechnological use of macroalgal extracts with high antioxidant capacity is discussed.
Key words: antioxidants; bioactive compounds; extracts; lichen; macroalgae
Introducción
Los organismos marinos, incluyendo las algas y los líquenes, han atraído la atención de muchos investigadores como fuente de compuestos bioactivos debido a sus propiedades, la diversidad de sus moléculas y sus nuevas estructuras químicas que son complejas y difíciles de sintetizar químicamente. Las algas proporcionan una excelente fuente de compuestos bioactivos como carotenoides, polisacáridos, proteínas, lípidos, ácidos grasos, pigmentos, vitaminas, poli-fenoles y microelementos, entre otras sustancias (Borowitzka 2013). Los compuestos bioquímicos de algas se usan actualmente como ingredientes con propiedades bioactivas en productos cosmecéuticos. Estos productos cosméticos se diferencian de los productos cosméticos clásicos porque presentan propiedades terapeúticas o farmacológicas. Los líquenes también son bien conocidos debido a la diversidad de sus metabolitos secundarios denominados sustancias liquénicas. Recientemente, existe un gran interés en los compuestos activos naturales como alternativa a las sustancias sintéticas. Aunque estos compuestos, a menudo, muestran una menor actividad, no son tóxicos ni generan residuos.
Los antioxidantes presentes en extractos de algas y líquenes son de interés especial para su uso en cosméticos y productos nutracéuticos (mediante vía oral o tópica) ya que sus posibles riesgos de toxicidad y salud no son tan grandes como la de antioxidantes sintéticos (Thomas y Kim 2013). Las actividades farmacológicas (antitumorales y antiinflamatorias) han estado estrechamente relacionadas con el desequilibrio oxidativo. Las propiedades antioxidantes de los compuestos naturales de algas pueden aumentar la vida útil de los alimentos y cosméticos a través de la oxidación (Chintali Ashwini et al. 2013). Además de los antioxidantes, las algas también proporcionan otros ingredientes utilizados en la formulación de productos cosméticos, tales como otros ingredientes bioactivos, minerales, polisacáridos, etc. Esto apoya la utilización de algas y líquenes como suplementos farmacéuticos funcionales y/o dietéticos para mejorar la salud humana debido al impacto positivo que su uso tendría en la prevención y/o el tratamiento de patologías relacionadas con el estrés oxidativo (Yuan y Walsh 2006).
El objetivo de este estudio es evaluar la actividad antioxidante de los extractos de algas marinas y de un liquen marino mediante la utilización de distintos solventes, relacionados con los diferentes mecanismos de acción, la cual se explicaría por la presencia de diversos metabolitos extraídos con dichos solventes (Batista-González et al. 2009). Se cuantificó el contenido de compuestos algales y liquénicos con propiedades bioactivas potenciales, tales como carbohidratos, lípidos y sustancias fotoprotectoras UV con capacidad antioxidante como polifenoles y aminoácidos de tipo micos-porina (AAM) (Stengel et al. 2011). Estos compuestos muestran aplicaciones importantes en una gama de productos en la industria alimentaria, farmacéutica y cosmética.
Las siguientes especies fueron seleccionadas para este estudio con base en su capacidad de ser cultivadas, de manera intensiva, en sistemas de acuicultura multitrófica integrada (Gómez-Pinchetti et al. 2011) y el uso biotecnológico potencial de su biomasa: Gelidium corneum (Hudson) JV Lamouroux y Gelidium pusillum (Stackhouse) Le Jolis (Rabiei et al. 2016); Porphyra umbilicalis Kützing (Pereira y Yarish 2010); Halopithys incurva (Hudson) Batters (Güenaga 2011); Gracilariopsis longissima (SG Gmelin) M Steentoft, LM Irvine y WF Farnham (Hernández et al. 2006); Hydropuntia cornea (J Agardh) MJ Wynne (Figueroa et al. 2012); y Ulva rotundata Bliding (Martínez-Aragón et al. 2002). Cabe destacar que el cultivo de Lichina pygmaea (OF Müller) C Agardh es actualmente inviable, por lo que sólo es posible cultivar los fotobiontes del género Calothrix (cianobacterias) para la producción de metabolitos de interés. Es probable que la simbiosis entre el fotobionte y el mico-bionte sea más favorable para la producción de compuestos bioactivos debido a las sinergias que pueden surgir entre ambos organismos.
Materiales y métodos
Siete macroalgas limpias y frescas y un liquen marino fueron recolectados en áreas costeras de diferentes lugares geográficos al mismo tiempo y en los mismos periodos temporales. La biomasa se colocó en un refrigerador de hielo portátil (aproximadamente -4 °C) durante 3-4 h. Todas las especies fueron recolectadas en Tarifa, Cádiz, España (36°00'10"N, 5°36'33"W), excepto Gracilariopsis longissima (río San Pedro, Cádiz, España; 36°32'52"N, 6°12'33"W), Hydropuntia cornea (Gran Canaria, islas Canarias; 27°59'28"N, 15°22'8"W) y U. rotundata (Málaga, Málaga, España; 36°42'41"N, 4°19'33"W). Sólo H. cornea fue obtenida a partir de cultivos (densidades de alga de 6-8 g de peso fresco por litro) en tanques situados en un invernadero.
Las algas se secaron entre hojas de papel para eliminar el exceso de humedad y se congelaron a -20 °C hasta el momento de su análisis. La extracción se realizó con diversos solventes alcohólicos e hidroalcohólicos: H2O destilada (100%), EtOH (100%), EtOH (50%) y MeOH (20%). Para cada extracto, se utilizaron 10 g de peso fresco de los talos de algas. Los talos se colocaron en un mortero con 150 mL de los solventes citados anteriormente, y se utilizó arena estéril para facilitar la extracción por abrasión. El mortero se colocó sobre un soporte de hielo. Posteriormente, los extractos se incubaron en un baño térmostatizado (modelo SS40-2, Grants Instruments, Cambridge, RU) a 45 ± 2 °C con agitación constante durante 6 h. Después de este tiempo, los primeros extractos se filtraron a través de una malla de 100 y luego se centrifugaron (centrífuga Beckman GS-15R) durante 10 min a 4 °C. Finalmente, el sobrenadante se concentró en un rotavapor Buchi R-210.
Los rendimientos de extracción (η) para cada solvente se calcularon después de realizar la extracción. Se calcularon los rendimientos de extracción relacionados con la biomasa extraída (en peso seco) de acuerdo con la siguiente fórmula: (η%) = (solubilizado(obtenido))/biomasa(proporcionada)) x 100. El solubilizado(obtenido) (en gramos de peso seco) es la cantidad de material extraído de la biomasa con los diferentes solventes y la biomasa(proporcionada) es la cantidad de biomasa (en gramos) utilizada para realizar la extracción. La relación peso fresco/ peso seco (PF/PS) se calculó para cada especie tras mantener las muestras durante 24 h a 60 °C.
El contenido de materia orgánica (%) se estimó midiendo la pérdida de material por ignición a 550 °C durante 3.5 h. Todos los ensayos bioquímicos fueron realizados por triplicado.
Métodos para evaluar la actividad antioxidante
El ensayo DPPH se realizó de acuerdo con el método desarrollado por Kim et al. (2002). La reacción se completó después de 30 min en oscuridad a temperatura ambiente (~20 °C) debido a que la luz puede degradar el radical generado. La absorbancia se leyó a 517 nm en un espectro-fotómetro (modelo UVMini-1240, Shimadzu, Columbia, EUA).
El método ABTS se realizó de acuerdo con Re et al. (1999). La reacción finalizó tras 8 min a temperatura ambiente y se registró inmediatamente la absorbancia a 413 nm. La actividad antioxidante de los extractos evaluados mediante DPPH y ABTS se calculó siguiendo el mismo procedimiento matemático.
El método de decoloración del β-caroteno (BBM) se realizó de acuerdo con Hidalgo et al. (1994). Se monitorizó la disminución de la absorbancia a 470 nm durante 90 min tras la adición del extracto a la solución. La actividad antioxidante (AA%) se calculó de acuerdo con la siguiente ecuación usando las pendientes: [AA% = (pendiente(muestra) -pendiente(control)/pendiente(control)) x 100]. Las pendientes se calcularon a partir de la curva de decoloración obtenida (absorbancia/tiempo). Para ello, se utilizó la parte de la curva que describe un comportamiento lineal mediante ajustes de regresión lineal. Se usó el antioxidante de referencia Trolox (0-15 μM) como solución estándar para los 3 métodos. Los resultados se expresaron como micromoles de equivalentes Trolox por gramo de peso seco (nmol TE g-1 PS). Los valores mostrados en este estudio son para cada especie y para cada método utilizado.
El contenido total de carbono y nitrógeno interno se determinó en un analizador elemental LECO-932 CNHS (Michigan, EUA) y se calcularon las relaciones C:N.
La cuantificación de los carbohidratos totales se llevó a cabo mediante el método de la antrona (Brooks et al. 1986). Los resultados se expresaron como almidón equivalente (% almidón) multiplicando por el factor 0.9.
Los contenidos totales de lípidos en los extractos se cuantificaron mediante el método de la sulfo-fosfo-vainillina (SPV) según Mishra et al. (2014). Para obtener la curva estándar, se usó trioleína a concentraciones finales de 0.1-0.6 mg L-1.
Los compuestos fenólicos se determinaron después del periodo de incubación siguiendo el procedimiento descrito por Folin y Ciocalteau (1927). Se usó floroglucinol para la preparación de la curva patrón.
Los AAM se analizaron mediante HPLC (Waters 600), tal como se describió en Korbee-Peinado et al. (2004), utilizando los coeficientes de extinción ya publicados.
Análisis estadístico
Se utilizaron análisis de varianza (ANDEVA) para determinar las diferencias en las variables estudiadas. Se realizaron ANDEVA de 2 vías para detectar diferencias significativas entre los diferentes ensayos antioxidantes y los solventes empleados para cada especie, y ANDEVA de una vía para las demás variables estudiadas. La homogeneidad de la varianza se calculó usando la prueba de Cochran mediante inspección visual de los residuos para ambos análisis. Las pruebas de Student-Newman-Keuls (SNK) se realizaron después de encontrar diferencias significativas en los ANDEVA (análisis post hoc). Las correlaciones entre los datos obtenidos se calcularon utilizando el coeficiente de correlación de Pearson (r). Todos los análisis se realizaron con el software SPSS v10.0 para Windows (SPSS, Chicago, IL, EUA).
Resultados
La relación PF/PS fue de 4.75 para Gelidium pusillum, 3.05 para Gelidium corneum, 5.60 para Porphyra umbilicalis, 3.68 para Halopithys incurva, 7.57 para Gracilariopsis longissima, 9.17 para Hydropuntia cornea, 2.54 para Ulva rotundata y 3.67 para Lichina pygmaea. El contenido de agua de las especies estudiadas varió entre 60% y 90% (Tabla 1) y el porcentaje de materia orgánica varió de 9.4% en Halopithys incurva a 6% en Gracilariopsis longissima y Hydropuntia cornea. El porcentaje de cenizas fue muy alto en U. rotundata y L. pygmaea (aproximadamente 32%), mientras que el valor mínimo fue de 5.3% en H. cornea (Tabla 1).
Tabla 1 Contenido de carbono y nitrógeno, humedad, materia orgánica y cenizas para las diferentes especies. Cada valor se representa como media ± error estándar (n = 3): C, N y C:N expresados en porcentaje del peso seco (v/v); humedad, materia orgánica y cenizas expresadas en porcentaje del peso fresco. Las letras diferentes en una misma columna indican diferencias significativas entre las especies (P < 0.05).
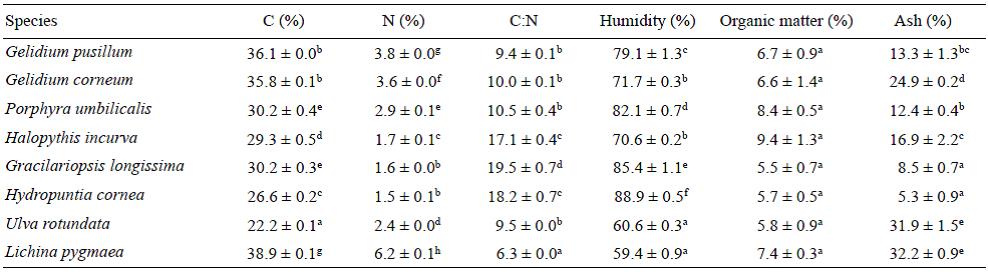
El rendimiento de extracción fue significativamente diferente (P < 0.01) dependiendo del solvente utilizado (Fig. 1). El orden de los rendimientos de extracción fue, de mayor a menor, el siguiente: MeOH 20% = H2O; H2O = EtOH 50%; EtOH 50% = EtOH 100% (Fig. 1).

Figura 1 Rendimiento de extracción (% rendimiento [v/v]) para los solventes. Los datos se expresan como la media de todas las especies analizadas (media ± error estándar; n = 27). Las letras diferentes indican diferencias significativas entre los solventes (P < 0.05).
Las capacidades antioxidantes de las 8 especies se probaron con 3 métodos antioxidantes. En el caso de los métodos DPPH y ABTS, el solvente que mostró el valor más alto en los ensayos fue el EtOH 50% (para el 66.7% y 44.4%, respectivamente, de las especies estudiadas). Sin embargo, con el BBM, el solvente con el mejor resultado fue EtOH 100% (para el 44.7% de las especies). Para todas las especies de macroalgas, se encontraron interacciones significativas entre los factores "solvente" y "método" (P < 0.01). En el caso de Gelidium pusillum, la mayor actividad para el ensayo DPPH (9.65 (mol TE g-1 PS) (P < 0.01) se encontró en EtOH 50% (Fig. 2a). Se observó la mayor capacidad antioxidante en ambos solventes etanólicos (EtOH 50% y EtOH 100%). Se encontró este mismo patrón para Gelidium corneum, aunque no hubo diferencias significativas entre los solventes EtOH 50% y EtOH 100% para el ensayo DPPH, el cual mostró mayor actividad (Fig. 2b). En el caso de P umbilicalis (Fig. 2c), el solvente acuoso mostró resultados similares para DPPH y ABTS. La actividad antioxidante para DPPH y BBM fue también la misma para los extractos de H2O, EtOH 100% y MeOH 20°% (P > 0.05). El solvente que mostró la mayor capacidad de extracción de compuestos antioxidantes para esta especie fue EtOH 50% (10.7 (mol TE g-1 PS) para el ensayo DPPH. En el caso de Halopithys incurva (Fig. 2d), se alcanzó la mayor capacidad antioxidante (10.7 (mol TE g-1 PS) en MeOH 20% con el ensayo DPPH. No hubo diferencias significativas entre los solventes EtOH 50% y MeOH 20%, así como entre H2O y EtOH 100% con el BBM. En el caso de Gracilariopsis longissima, DPPH y ABTS no mostraron diferencias significativas en términos de capacidad antioxidante para los solventes MeOH 20% y H2O (Fig. 2e).
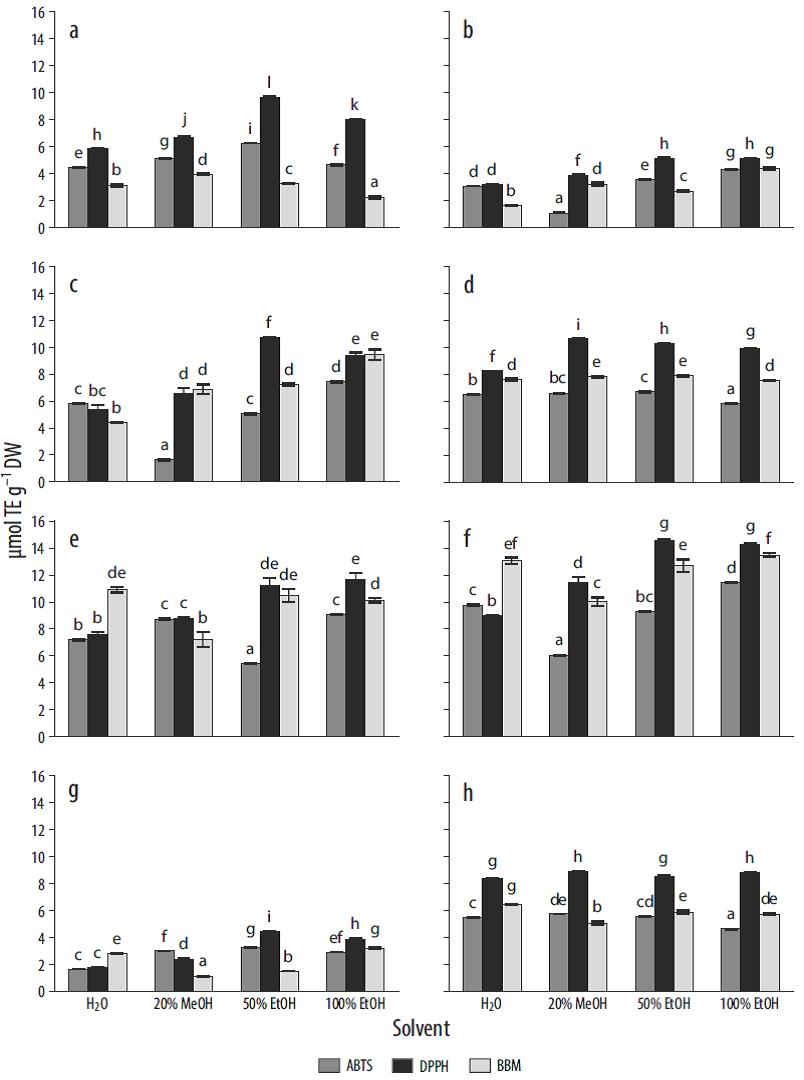
Figura 2 Capacidad antioxidante, expresada como micromoles de equivalentes Trolox por gramo de peso seco (umol TE g-1 DW), en las especies estimada mediante los ensayos ABTS, DPPH y BBM usando diferentes solventes. (a) Gelidium pusillum, (b) Gelidium corneum, (c) Porphyra umbilicalis, (d) Halopythis incurva, (e) Gracilariopsis longissima, (f) Hydropuntia cornea, (g) Ulva rotundata, y (h) Lichina pygmaea. Las letras diferentes indican diferencias significativas para los solventes y los métodos (P < 0.05).
No hubo diferencias significativas entre BBM y DPPH para EtOH 50%. En general, se encontró la mayor actividad antioxidante en el solvente etanólico. Hydropuntia cornea mostró la mayor capacidad antioxidante entre las especies estudiadas, con valores máximos de aproximadamente 14.5 (mol TE g-1 PS en extractos etanólicos (Fig. 2f). Ulva rotundata presentó una menor capacidad antioxidante que las algas rojas analizadas; el valor más alto se obtuvo con EtOH 50% en el ensayo DPPH (4.46 (mol TE g-1 PS) (Fig. 2g).
En el caso de L. pygmaea (Fig. 2h), en el ensayo DPPH la actividad antioxidante fue ligeramente superior para MeOH 20% y EtOH 100% que para los otros 2 solventes. Para el método ABTS, la actividad antioxidante en H2O y EtOH 100% fue menor que en los otros extractos (Fig. 2). Sin embargo, el valor más alto según el BBM se encontró en H2O.
El contenido de carbono fue significativamente diferente en las especies analizadas (P < 0.01), excepto para las especies del género Gelidium (P > 0.05). El contenido de carbono varió entre 22.2% en U. rotundata y 39% en el liquen marino L. pygmaea. También se encontraron valores de hasta el 30% en Gelidium pusillum, Gelidium corneum, P. umbilicalis y Gracilariopsis longissima. El contenido de nitrógeno resultó ser aún más heterogéneo (P < 0.01) que el de carbono.
El nivel más alto se alcanzó en L. pygmaea (6.2%), seguido por las especies del género Gelidium (superior al 3.5%) (Tabla 1). Gracilariopsis longissima y Hydropuntia cornea presentaron valores similares. Sin embargo, las especies con diferente contenido de carbono y nitrógeno mostraron la misma relación C:N (Tabla 1).
Los carbohidratos totales, expresados como porcentaje, mostraron el valor más alto en EtOH 50% y MeOH 20% (Tabla 2). En el último solvente, los extractos de Halopithys incurva mostraron el mayor porcentaje de carbohidratos totales entre las algas estudiadas (16.1%), seguido de Gracilariopsis longissima (14.8%). Se observaron niveles de 4-6% en Gelidium corneum, P. umbilicalis y U. rotundata, mientras que se detectaron niveles superiores al 6% en Gelidium pusillum y Hydropuntia cornea. En MeOH 20%, el nivel más bajo de carbohidratos totales se observó en L. pygmaea (3.28%).
Tabla 2 Carbohidratos totales y lípidos totales (% del peso seco) para los diversos solventes y especies. Cada valor se representa como la media ± error estándar (n = 3). Las letras diferentes en la misma fila indican diferencias significativas entre los solventes para cada especie (P < 0.05); n.p.q. = no fue posible cuantificar.
El mayor contenido de lípidos se obtuvo con EtOH 50% para 6 especies. El contenido de lípidos en Halopithys incurva y Gelidium pusillum no se pudo cuantificar como consecuencia de una alta interferencia entre el contenido fenólico y el método SPV (Sun et al. 1998). Los valores más altos (superiores al 5%) fueron encontrados para P. umbilicalis y L. pygmaeae. Las otras algas presentaron valores entre 4.4%% y 1.7% (Tabla 2). Por el contrario, el contenido más bajo se obtuvo en P. umbilicalis con EtOH 100%.
Para 3 de las 8 especies, los compuestos fenólicos (expresados como floroglucinol) mostraron valores más altos para el solvente MeOH 20% (Fig. 3). Se encontraron diferencias significativas (P < 0.01) entre los solventes para todas las especies, excepto para L. pygmaea. Los valores más altos de compuestos fenólicos se obtuvieron para Gelidium pusillum (4.5-6 mg g-1 PS), seguido de L. pygmaea (7 mg g-1 PS), H. incurva (4.5 mg g-1 PS) y H. cornea (3 mg g-1 PS) en extractos de MeOH 20% (Fig. 2). En las otras especies se obtuvieron valores cercanos o inferiores a 3 mg g-1 PS.
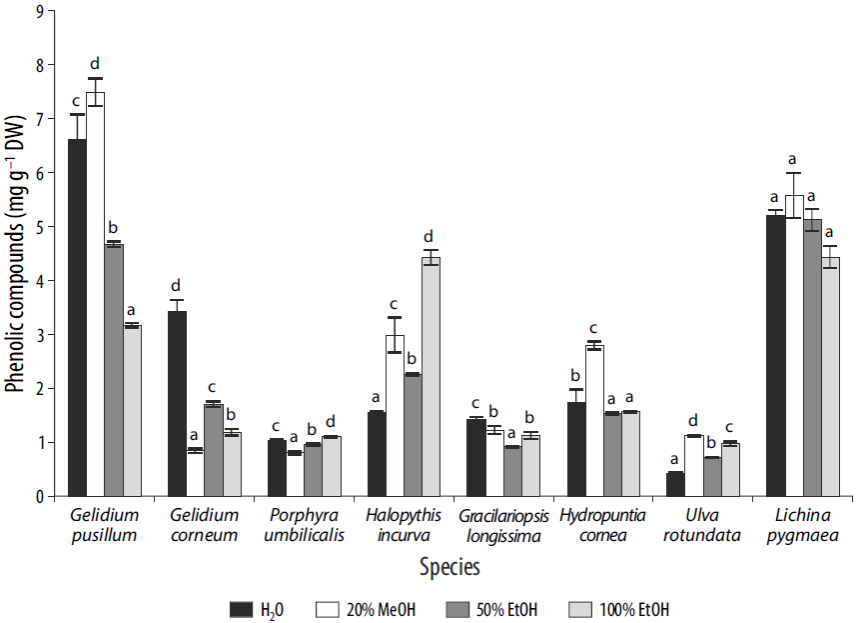
Figura 3 Compuestos fenólicos (mg g-1 de peso seco) en diferentes solventes para cada especie. Las diferencias entre los solventes para cada especie se indican con letras diferentes (P < 0.05). Los datos se expresan como media ± error estándar (n = 3).
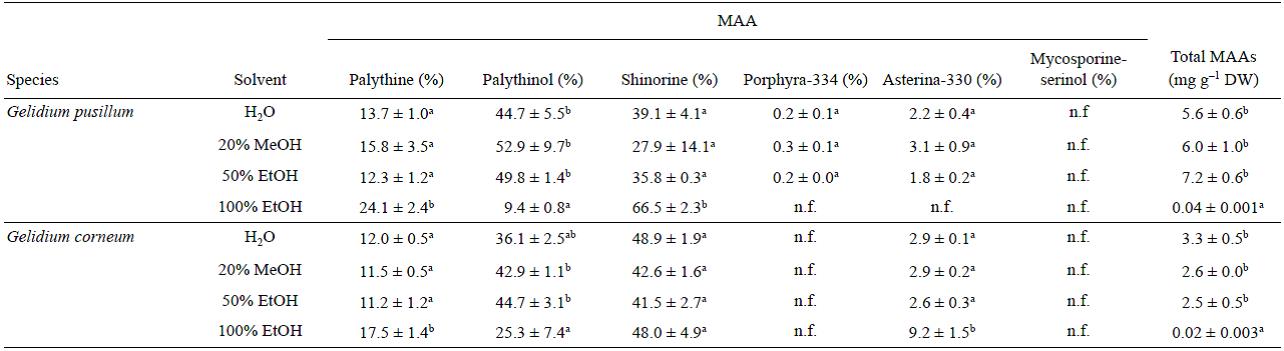
La cantidad y composición de AAM fue significativamente diferente entre las especies estudiadas. Se detectaron 6 AAM diferentes en proporciones distintas: micosporina-serinol, palitina, palitinol, shinorina, porphyra-334 y asterina-330. Los últimos 5 AAM sólo se encontraron en Gelidium pusillum y P. umbilicalis, mientras que micosporina-serinol se cuantificó excluvisamente en L. pygmaea (Tabla 3). El contenido de AAM totales en Gelidium pusillum fue aproximadamente 1.7 veces mayor que en Gelidium corneum. Para estos compuestos, no se encontraron diferencias significativas en términos de solvente empleado durante la extracción excepto para EtOH 100%, donde el contenido de AAM fue mucho menor que para los demás solventes utilizados. El segundo AAM dominante fue el palitinol, que se detectó en todas las especies excepto en L. pygmaeae. El aminoácido palitina se observó en todas las especies excepto en el liquen marino y en Gracilariopsis longissima. Como aminoácido exclusivo, micosporina-serinol sólo se encontró en L. pygmaeae. Porphyra-334 se encontró en sólo 3 de las especies (Gelidium pusillum, P. umbilicalis y Hydropuntia cornea). Finalmente, se detectó asterina-330 en ambas especies del género Gelidium y en P. umbilicalis.
Tabla 3 Composición de aminoácidos tipo micosporina (AAM) y concentración total de AAM en diferentes especies y solventes. Los datos se expresan como la media ± error estándar (n = 3) (% w/w peso seco). Las diferentes letras indican diferencias significativas entre los solventes para cada especie (P < 0.05); n.f. = no encontrado.
La capacidad antioxidante en Gelidium pusillum se correlacionó con el contenido de lípidos en el ensayo ABTS (P < 0.05; r = 0.98; n = 12), y con el contenido de carbohidratos (P < 0.05; r = 0.98; n = 12) y el aminoácido asterina-330 (P < 0.05; r = 0.67; n = 9) para el BBM. Sin embargo, en el caso de Gelidium corneum, la capacidad antioxidante estuvo relacionada, en el ensayo ABTS, con los AAM totales (P < 0.01; r = 0.78; n = 12). Para P. umbilicalis, en el ensayo ABTS, la capacidad antioxidante se correlacionó con el contenido fenólico (P < 0.01; r = 0.99), el aminoácido shinorina (P < 0.01; r = 0.83; n = 12), el aminoácido porphyra-334 (P <0.01; r = 0.92; n = 12) y los AAM totales (P <0.01; r = 0.91; n = 12). En Halopithys incurva (P < 0.01; r = 0.80; n = 12) y U. rotundata (P < 0.01; r = 0.72; n = 12), el contenido fenólico se correlacionó positivamente con la capacidad antioxidante. En Gracilariopsis longissima, la capacidad antioxidante cuantificada con el BBM se correlacionó con los lípidos totales (P < 0.01; r = 0.80; n = 12). La capacidad antioxidante en Hydropuntia cornea se correlacionó con el aminoácido palitinol (P < 0.05; r = 0.82) en el ensayo DPPH. Por último, la capacidad antioxidante en L. pygmaea se correlacionó con el contenido de compuestos fenólicos (P <0.05; r = 0.969; n = 12) y carbohidratos totales (P < 0.01; r = 0.89; n = 12) en el ensayo ABTS. El aminoácido shinorina se correlacionó con la actividad antioxidante (P < 0.01; r = 0.80; n = 12) en el ensayo DDPH.
Se encontró correlación entre la actividad antioxidante entre los 3 métodos empleados: ABTS-DPPH (P < 0.01; r = 0.859; n = 36), ABTS-BBM (P < 0.01; r = 0.825; n = 36) y DPPH-BBM (P < 0.01; r = 0.841; n = 36).
La cantidad de carbohidratos solubles se correlacionó con las actividades antioxidantes medidas con los ensayos ABTS (P < 0.01; r = 0.28; n = 96) y DPPH (P < 0.01; r = 0.30; n = 96). El contenido de lípidos se relacionó con la actividad antioxidante en Gracilariopsis longissima con el método ABTS (P < 0.01; r = 0.25; n = 96) y el BBM (P < 0.01; r = 0.99; n = 96).
El contenido de compuestos fenólicos se correlacionó con los métodos ABTS (P < 0.05; r = 0.21; n = 96) y DPPH (P < 0.01; r = 0.28; n = 96). Finalmente, los niveles de AAM totales también se correlacionaron con los métodos ABTS (P <0.05; r = 0.408; n = 36) y DPPH (P < 0.05; r = 0.431; n = 36).
Discusión
En general, cabe destacar que para el solvente acuoso (H2O), la capacidad antioxidante de los métodos DPPH y ABTS fue similar en el 55% de las especies estudiadas. Este resultado podría explicarse debido a que ambos métodos se rigen por el mismo mecanismo de acción. Entre estos 2 ensayos antioxidantes, el solvente con mayor capacidad de extracción de antioxidantes fue el EtOH 50% para el 44% y 56% de las especies estudiadas con los métodos ABTS y DPPH, respectivamente. Estos resultados concuerdan con los obtenidos por Plaza et al. (2010). Sin embargo, para el BBM, el mejor solvente fue EtOH 100%, probablemente relacionado con el hecho de que este método es adecuado para la determinación de compuestos antioxidantes en un medio estrictamente lipofílico.
Otra diferencia importante entre los ensayos empleados es que el radical ABTS puede solubilizarse tanto en solventes orgánicos como en solventes acuosos, por lo que se puede medir la actividad antioxidante considerando la naturaleza hidrófila o lipofílica de los compuestos de la muestra (Wojdylo et al. 2007). Por el contrario, el radical DPPH sólo puede medirse en un medio orgánico, limitando la interpretación de la capacidad antioxidante de los compuestos hidro-fílicos presentes en los extractos (Surveswaran et al. 2007). Por otra parte, no se descarta el sinergismo que pueda acontecer entre los diferentes compuestos en los extractos.
Para seleccionar una especie es necesario desarrollar métodos de extracción apropiados, rápidos, rentables y respetuosos con el medio ambiente, y que permitan aislar compuestos biológicamente activos sin que se origine una pérdida de la bioactividad. En numerosos estudios, los solventes más comunes para la extracción de antioxidantes incluyen agua, etanol, metanol y mezclas acuosas de los mismos (Alam et al. 2013). Éstos tienen buena polaridad y por lo tanto son favorables para ser utilizados para la extracción de compuestos polares tales como compuestos fenólicos o AAM, entre otros. En última instancia, la polaridad del solvente así como la técnica de extracción tienen un efecto crítico sobre el rendimiento de extracción (López et al. 2011). El metanol, sin embargo, debería de ser descartado para aplicaciones cosméticas debido a su toxicidad.
Entre los ensayos utilizados en este estudio para el barrido de radicales, los métodos ABTS y DPPH son los más rápidos, simples (no incluyen muchos pasos) y tienen un menor coste en comparación con el BBM. Además, el BBM requiere muchos más reactivos, mucho más tiempo y más recursos técnicos para la realización del ensayo, y el resultado sólo proporciona una visión de los antioxidantes que se encuentren en la matriz lipofílica. El ensayo ABTS es el único método evaluado en este estudio que es aplicable tanto a antioxidantes hidrofílicos como lipofílicos (Alam et al. 2013), por lo que su uso es justificado en otros estudios en los que se pretende obtener una visión integrada del extracto. Se encontró una correlación positiva entre los métodos DPPH y ABTS, entre ABTS y BBM, y entre BBM y DPPH. Floegel et al. (2011) también encontraron una correlación positiva entre los métodos DPPH y ABTS. Esto se explica por el hecho de que estos ensayos se fundamentan en el mismo mecanismo de reacción (en la transferencia de electrones), mientras que el BBM se fundamenta en un mecanismo de transferencia de átomos de hidrógeno (Huang et al. 2005).
En nuestro estudio, en general, la actividad antioxidante en el liquen marino y las macroalgas analizadas (5-15 μmol TE g-1 PS) es alta en comparación con otros resultados publicados para varias microalgas (7-11 μmol TE g-1 PS) y otras macroalgas (1.6-2.2 μmol TE g-1 PS) (Matanjun et al. 2008). Esto podría ser explicado debido a que la mayoría de las especies analizadas en otros estudios se someten a diferentes estresores en el sistema de cultivo. El aumento del estrés provoca una activación de las sustancias antioxidantes enzimáticas y no enzimáticas (Stengel et al. 2011). Acerca del efecto del tipo de solvente en la actividad antioxidante, Yuan et al. (2005) estimaron la actividad antioxidante relacionada con los polifenoles de Palmaria palmata, obteniendo niveles más altos de estas sustancias usando metanol como extractor. Los componentes hidrófilos se extraen con solventes polares tales como agua, metanol o etanol. O'Sullivan et al. (2011) utilizaron metanol y agua para extraer compuestos bioactivos (antioxidantes) de diferentes algas pardas, siendo el género Fucus el que presentó mayor actividad antioxidante. Los resultados de este estudio concuerdan con los resultados encontrados por Sarikurkcu et al. (2009) en extractos de plantas terrestres, en los que se observó una fuerte correlación entre la polaridad de los extractos y su potencial antioxidante. Los extractos más polares mostraron el mayor potencial para la neutralización de radicales libres. Desde un punto de vista biotecnológico, para tener una alta producción, lo idóneo es que las especies potencialmente cultivables presenten bajos niveles de agua y altos niveles de materia orgánica. Las algas rojas analizadas en este trabajo presentaron niveles mucho más altos de agua interna y menor materia orgánica que L. pygmaea y U. rotundata (Chlorophyta). Estas 2 especies presentaron bajos niveles de agua interna en cuanto a la relación PF/PS. Holdt y Kraan (2011) encontraron un porcentaje similar de agua en las especies de Ulva (78-80%) en comparación con las macroalgas rojas (72-85%). Esto depende de las características propias de la especie, así como de la zona que ocupen en el ecosistema. El contenido de cenizas y de materia orgánica en las diferentes especies obtenidas del entorno natural es dependiente también del filo, del origen geográfico y de las variables estacionales, ambientales y fisiológicas en el que se encuentren. En cualquier caso, los minerales contenidos en la ceniza de algas también presentan interés desde el punto de vista nutricional.
La extracción de compuestos biológicamente activos de la biomasa de algas no es selectiva. El extracto en su conjunto es una mezcla de diferentes compuestos. Los factores que influyen en la composición y la actividad de los extractos de algas dependen de las especies empleadas, las condiciones ambientales donde se recolectaron, la estación del año, la edad, la ubicación geográfica y las tecnologías de extracción empleadas (Kadam et al. 2013). El estrés ambiental al que están sometidas las algas (e.g., irradiancia, temperatura, desecación, estrés osmótico, etc.) conduce a la formación de radicales libres y agentes oxidantes que pueden provocar daño fotodinámico (Gupta y Abu-Ghannam 2011).
Las macroalgas marinas son una fuente de compuestos bioactivos con diferentes actividades biológicas que habitualmente no se encuentran en plantas terrestres. Las algas contienen polisacáridos (polímeros de monosacáridos unidos entre sí por enlaces glicosídicos) con numerosas aplicaciones biotecnológicas en productos tales como estabilizantes, espesantes, emulsionantes, alimentos, bebidas, etc. Las concentraciones totales de carbohidratos en las especies de algas marinas de interés oscilan entre el 4% y el 76% PS. Los carbohidratos pueden separarse químicamente en fracciones solubles e insolubles. La cantidad de carbohidratos solubles varía entre los taxones, siendo más alta en las algas rojas de acuerdo a los resultados obtenidos en este estudio. Las 2 especies que mostraron los mayores valores de carbohidratos son Gracilariopsis longissima y Halopithys incurva (16.1% y 14.8%, respectivamente) en MeOH 20%. Estas especies han demostrado una alta tasa de crecimiento en sistemas de acuicultura multitrófica integrada. En cultivos a una densidad de 6 g PF L-1, se encontró una alta producción de biomasa (22-29 g PS m-2 d-1) (Viera et al. 2011). También se observó una tasa de crecimiento de 10-16% d-1 para G. longissima y H. incurva (Robledo et al. 2014). En sistemas de acuicultura extensiva, G. longissima mostró un crecimiento del 9% d-1 (Hernández et al. 2006). Por último, H. incurva también se ha cultivado en efluentes de piscicultura a una densidad de 8 g PF L-1 con una producción de aproximadamente 5 g PS m-2 d-1 y una eficiencia de asimilación de nitrógeno de 90-99%; sin embargo, a una densidad de cultivo de 6gPFL-1, la productividad promedio de la biomasa en los distintos tratamientos fue de 16-19 g PS m-2 d-1 (Viera et al. 2011).
Se detectaron polifenoles en todas las especies analizadas, siendo mayor en las algas rojas Gelidium pusillum y Halopithys incurva y en el liquen marino L. pygmaeae con respecto a las otras especies. El nivel más bajo de polifenoles se encontró en la alga verde U. rotundata. En el 44% de las especies estudiadas, el solvente MeOH 20% fue el más eficiente para la extracción de estas sustancias. Esto coincide con los resultados obtenidos por López et al. (2011), quienes describieron una extracción más eficiente en metanol o etanol que en agua; sin embargo, el extracto obtenido con el solvente H2O para el alga parda Stypocaulon scoparium mostró el mayor contenido fenólico en comparación con los solventes MeOH 50%, MeOH 100% y EtOH 100% empleados en ese estudio. López et al. (2011) afirmaron que los niveles de compuestos fenólicos pueden variar hasta 3 veces dependiendo del método de extracción utilizado. En este estudio, el contenido de compuestos fenólicos en algunas de las algas rojas y en el liquen es tan alto como en macroalgas pardas, el grupo de macroalgas con el mayor nivel reportado de polife-noles (Connan et al. 2006, Stengel et al. 2011). Por ejemplo, el contenido de fenoles en los diferentes solventes fue de 3.2-6.1 mg g-1 PS para Gelidium pusillum, 1.5-4.4 mg g-1 PS para Halopithys incurva, 1.5-2.8 mg g-1 PS para Hydropuntia cornea y 4.4-5.2 mg g-1 PS para L. pygmaea. El alto nivel de fenoles en Halopithys incurva ya ha sido reportado previamente por Güenaga (2011). Además, se han detectado fenoles sulfatados y bromados en varias especies de macroalgas rojas (Zhao et al. 2004). Entre las macroalgas, la división Rhodophyta es la que posee la mayor abundancia de fenoles halogenados (bromados y clorados fundamentalmente) con probados efectos antioxidantes, antimicrobianos, anticancerígenos, antidiabéticos y antitrombóticos. Los resultados obtenidos en este estudio para los compuestos fenólicos concuerdan con los valores encontrados por otros autores. Souza et al. (2011) obtuvieron valores de 1.1 y 0.89 mg EAG (equivalentes de ácido gálico) g-1 PS para Gracilaria birdiae e Hydropuntia cornea, respectivamente. Para Porphyra sp., Kuda et al. (2005) obtuvieron 0.88 mg EC (equivalentes de catequinas) g-1 PS en solvente etanólico. Para Gracilariopsis tenuifrons, Zubia et al. (2014) encontraron valores de 1-1.4 mg EF (equivalentes de floroglucinol) g-1 PS para los fenoles extraídos con solventes metanólicos.
Los espectros de absorción de los extractos presentaron picos característicos en la región UVB (310 nm) y UVA (330-334 nm) (datos no mostrados). Este intervalo espectral corresponde a la absorción por moléculas fotoprotectoras (AAM) presentes en algunos organismos marinos, como las algas rojas y los líquenes. En U. rotundata no se encontró ninguna absorción en este intervalo espectral y no se detectaron AAM por HPLC. La absorción máxima a 310 nm en los extractos de L. pygmaeae corresponde al oxo-AAM micosporina-serinol, mientras que los picos de absorción con un máximo de alrededor de 320-334 nm están relacionados con los imino-AAM de algas rojas (palitina, palitinol, shino-rina, porphyra -334 y asterina-330).
En nuestro estudio, Gelidium pusillum y G. corneum presentaron palitinol y shinorina como los AAM principales. En general, para todas las especies estudiadas, el contenido de AAM usando EtOH 100% como solvente fue mucho menor que para otros solventes. Esto puede explicarse debido a la menor polaridad del etanol para interactuar con la parte hidrofóbica de aminoácidos y péptidos. Los AAM pueden diferir entre las especies debido a las condiciones ambientales en las que se encuentren (radiación UV, disponibilidad de nitrógeno, etc.). El contenido de AAM totales en G. pusillum fue aproximadamente 1.7 veces mayor que el de G. corneum debido a que G. pusillum se ubica en la parte superior de la zona intermareal en comparación con G. corneum que se ubica en la parte inferior y en zonas submareales y, por lo tanto, la irradiancia diaria integrada en el sitio de crecimiento de G. pusillum es superior a la de G. corneum (Figueroa y Gómez 2001). Los AAM están regulados tanto por la irra-diancia como por la calidad lumínica, pero también por la disponibilidad de nitrógeno (Barufi et al. 2011). Torres et al. (2015) encontraron 4 AAM (asterina-330, palitinol, palitene y usijerene) en Gracilariopsis tenuifrons después de realizar una extracción etanólica, mientras que en este estudio se encontró sólo palitinol en G. longissima, pero además shino-rina usando MeOH 20% o EtOH 50%. El bajo rendimiento de extracción encontrado usando etanol como solvente podría explicar este resultado. Probablemente shinorina se encontró en trazas fuera del intervalo de detección del HPLC.
La relación C:N se utiliza como indicador del estado nutricional. Bajo recursos limitados de nutrientes, especialmente nitrógeno, el crecimiento se ve restringido en los organismos fotosintéticos, lo que genera un aumento en la relación C:N, el cual significa un aumento en la producción de metabolitos secundarios (Bryant et al. 2012). Por lo tanto, la relación C:N es un buen indicador para estimar el aumento en la producción de metabolitos secundarios. En relación con el contenido de compuestos antioxidantes, Ibrahim y Jaafar (2011) encontraron, en plantas terrestres, que el bajo contenido de nitrógeno y, por lo tanto, los altos niveles de C:N están relacionados con la acumulación de metabolitos secundarios involucrados en la capacidad antioxidante. Estos resultados concuerdan con los observados en este estudio, donde especies con una alta relación C:N presentaron mayores valores de actividad antioxidante en los ensayos ABTS y BBM.
En conclusión, las 2 especies de este estudio con mayor capacidad antioxidante y moléculas con potencial interés biotecnológico fueron las algas rojas Gracilariopsis longissima y Hydropuntia cornea. Halopithys incurva es otra especie interesante debido al alto nivel de compuestos fenólicos que presenta y debido a que anteriormente ya se ha logrado cultivar con éxito (Güenaga 2011). Por otro lado, Gelidium pusillum es también una especie de alga roja con altos niveles de AAM y polifenoles pero actualmente no existen técnicas que permitan su cultivo. Numerosos estudios han demostrado que las 2 primeras especies poseen una alta capacidad de crecimiento en sistemas de biofiltración de efluentes (Figueroa et al. 2012), por lo que su cultivo sería económicamente viable y ambientalmente sostenible.
Se propone como solvente más adecuado para estos fines biotecnológicos el etanol (EtOH 50%), siendo éste un solvente orgánico con baja toxicidad y con un bajo precio en el mercado actual. Podría ser empleado para la extracción de compuestos antioxidantes al no presentar problemas toxicológicos en las futuras aplicaciones que se deriven de los extractos. El método ABTS se propone para la determinación de la capacidad antioxidante de los extractos algales, ya que es una ensayo fácil, rápido y barato, y además proporciona una visión integradora del extracto tanto en el medio lipofílico como en el medio hidrofílico.
Con el fin de comprender mejor los mecanismos subyacentes a los efectos antioxidantes en las algas, es necesario estudiar la relación estructura-actividad y las sinergias que puedan acontecer entre los componentes, realizar un análisis de purificación y estructural de moléculas potencialmente antioxidantes, así como desarrollar nuevas técnicas de extracción y purificación.
Agradecimientos
Se agradece el apoyo financiero de la Junta de Andalucía (España) al proyecto de investigación "Fotobiología y biotecnología de organismos acuáticos" (RNM295).
REFERENCIAS
Alam MN, Bristi NJ, Rafiquzzaman M. 2013. Review on in vivo and in vitro methods evaluation of antioxidant activity. Saudi Pharm. J. 21: 143-152. [ Links ]
Barufi JB, Korbee N, Oliveira MC, Figueroa FL. 2011. Effects of N supply on the accumulation of photosynthetic pigments and photoprotectors in Gracilaria tenuistipitata (Rhodophyta) cultured under UV radiation. J. Appl. Phycol. 23: 457-166. [ Links ]
Batista-González AE, Charles MB, Mancini-Filho J, Vidal Novoa A. 2009. Las algas marinas como fuentes de fitofármacos antioxidants. Rev. Cuba. Plantas Med. 14: 1-18. [ Links ]
Borowitzka MA. 2013. High-value products from microalgae-their development and commercialisation. J. Appl. Phycol. 25: 743-756. [ Links ]
Brooks JR, Griffin VK, Kattan MW. 1986. A modified method for total carbohydrate analysis of glucose syrups, maltodextrins, and other starch hydrolysis products. Cereal Chem. 63: 465-466. [ Links ]
Bryant JP, Chapin FS, Klein DR, Carbon DR. 2012. Carbon/nutrient balance of boreal plants in relation to vertebrate herbivory. Oikos 40: 357-368. [ Links ]
Chintale Ashwini G, Kadam Vaishali S, Sakhare Ram S, Birajdar Ganesh O, Nalwad Digambar N. 2013. Role of nutraceuticals in various diseases: A comprehensive review. Int. J. Res. Pharm. Chem. 3: 290-299. [ Links ]
Connan S, Delisle F, Deslandes E, Ar Gall E. 2006. Intra-thallus phlorotannin content and antioxidant activity in Phaeophyceae of temperate waters. Bot. Mar. 49: 39-46. [ Links ]
Figueroa FL, Gomez I. 2001. Photosynthetic acclimation to solar UV radiation of marine red algae from the warm-temperate coast of southern Spain: A review. J. Appl. Phycol. 13: 235-248. [ Links ]
Figueroa FL , Korbee N , Abdala R, Jerez CG, López-de la Torre M, Güenaga L, Larrubia MA, Gómez-Pinchetti JL. 2012. Biofiltration of fishpond effluents and accumulation of N-compounds (phycobiliproteins and mycosporine-like amino acids) versus C-compounds (polysaccharides) in Hydropuntia cornea (Rhodophyta). Mar. Pollut. Bull. 64: 310-318. [ Links ]
Floegel A, Kim DO, Chung SJ, Koo SI, Chun OK. 2011. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods. J. Food Compos. Anal. 24: 1043-1048. [ Links ]
Folin O, Ciocalteau V. 1927. Tyrosine and tryptophane in proteins. J. Biol. Chem. 73: 627-648. [ Links ]
Gómez-Pinchetti JL , Suárez Álvarez S, Güenaga Unzetabarrenechea L, Figueroa FL , García-Reina G. 2011. Posibilidades para el Desarrollo de Sistemas Integrados con Macroalgas en las Islas Canarias y su Entorno, pp. 74-93. ISBN: 978-84-615-4974-0. [ Links ]
Güenaga L . 2011. Influence of solar radiation and ammonium on the accumulation of antioxidant substances in seaweeds grown in a biofiltration system. PhD thesis, Las Palmas G.C. University, Spain, 283 pp. [ Links ]
Gupta S, Abu-Ghannam N. 2011. Recent developments in the application of seaweeds or seaweed extracts as a means for enhancing the safety and quality attributes of foods. Innov. Food Sci. Emerg. Technol. 12: 600-609. [ Links ]
Hernández I, Pérez-Pastor A, Vergara JJ, Martínez-Aragón JF, Fernández-Engo MÁ, Pérez-Lloréns JL. 2006. Studies on the biofiltration capacity of Gracilariopsis longissima: From microscale to macroscale. Aquaculture 252: 43-53. [ Links ]
Hidalgo ME, Fernández E, Quilhot W, Lissi E. 1994. Antioxidant activity of depsides and depsidones. Phytochemistry 37: 1585-1587. [ Links ]
Holdt SL, Kraan S. 2011. Bioactive compounds in seaweed: Functional food applications and legislation. J. Appl. Phycol. 23(3): 543-597. [ Links ]
Huang D, Boxin OU, Prior RL. 2005. The chemistry behind antioxidant capacity assays. J. Agric. Food Chem. 53: 1841-1856. [ Links ]
Ibrahim MH, Jaafar HZE. 2011. The relationship of nitrogen and C/ N ratio with secondary metabolites levels and antioxidant activities in three varieties of Malaysian kacip fatimah (Labisia pumila Blume)Molecules 16: 5514-5526. [ Links ]
Kadam SU, Tiwari BK, O'Donnell CP. 2013. Application of novel extraction technologies for bioactives from marine algae. J. Agric. Food Chem. 61: 4667-4675. [ Links ]
Kim DO , Lee KW, Lee HJ, Lee CY. 2002. Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic phytochemicals. J. Agric. Food Chem. 50: 3713-3717. [ Links ]
Korbee-Peinado N, Abdala Díaz RT, Figueroa FL , Helbling EW. 2004. Ammonium and UV radiation stimulate the accumulation of mycosporine-like amino acids in Porphyra columbina (Rhodophyta) from Patagonia, Argentina. J. Phycol. 40: 248-259. [ Links ]
Kuda T, Tsunekawa M, Goto H, Araki Y. 2005. Antioxidant properties of four edible algae harvested in the Noto Peninsula, Japan. J. Food Compos. Anal. 18: 625-633. [ Links ]
López A, Rico M, Rivero A, Suárez de Tangil M. 2011. The effects of solvents on the phenolic contents and antioxidant activity of Stypocaulon scoparium algae extracts. Food Chem. 125: 1104-1109. [ Links ]
Martínez-Aragón JF , Hernández I , Pérez-Lloréns JL , Vázquez R, Vergara JJ . 2002. Biofiltering efficiency in removal of dissolved nutrients by three species of estuarine macroalgae cultivated with sea bass (Dicentrarchus labrax) waste waters. 1. Phosphate. J. Appl. Phycol. 14: 365-374. http://dx.doi.org/10.1023/A:1022134701273 [ Links ]
Matanjun P, Mohamed S, Mustapha NM, Muhammad K, Ming CH. 2008. Antioxidant activities and phenolics content of eight species of seaweeds from north Borneo. J. Appl. Phycol. 20: 367-373. [ Links ]
Mishra SK, Suh WI, Farooq W, Moon M, Shrivastav A, Park MS, Yang JW. 2014. Rapid quantification of microalgal lipids in aqueous medium by a simple colorimetric method. Bioresour. Technol. 155: 330-333. [ Links ]
O'Sullivan AM, O'Callaghan YC, O'Grady MN, Queguineur B, Hanniffy D, Troy DJ, Kerry JP, O'Brien NM. 2011. In vitro and cellular antioxidant activities of seaweed extracts prepared from five brown seaweeds harvested in spring from the west coast of Ireland. Food Chem. 126: 1064-1070. [ Links ]
Pereira R, Yarish C. 2010. The role of Porphyra in sustainable culture systems: Physiology and applications. In: Seaweeds and their Role in Globally Changing Environments. Springer, The Netherlands, pp. 339-354. [ Links ]
Plaza M, Santoyo S, Jaime L, García-Blairsy Reina G, Herrero M, Señoráns FJ, Ibáñez E. 2010. Screening for bioactive compounds from algae. J. Pharm. Biomed. Anal. 51: 450-155. [ Links ]
Rabiei R, Phang SM, Lim PE, Salleh A, Sohrabipour J, Ajdari D, Zarshenas GA. 2016. Productivity, biochemical composition and biofiltering performance of agarophytic seaweed, Gelidium elegans (red algae) grown in shrimp hatchery effluents in Malaysia. Iran. J. Fish. Sci. 15:53-74. [ Links ]
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med. 26: 1231-1237. [ Links ]
Robledo D, Navarro-Angulo L, Valdes Lozano D, Freile-Pelegrin Y. 2014. Nutrient removal efficiency of Hydropuntia cornea in an integrated closed recirculation system with pink shrimp Farfantepenaeus brasiliensisAquacult. Res. 45: 1648-1658. [ Links ]
Sarikurkcu C, Arisoy K, Tepe B, Cakir A, Abali G, Mete E. 2009. Studies on the antioxidant activity of essential oil and different solvent extracts of Vitex agnus castus L. fruits from Turkey. Food Chem. Toxicol. 47: 2479-2483. [ Links ]
Souza BWS, Cerqueira MA, Martins JT, Quintas MAC, Ferreira ACS, Teixeira JA, Vicente AA. 2011. Antioxidant potential of two red seaweeds from the Brazilian coasts. J. Agric. Food Chem. 59: 5589-5594. [ Links ]
Stengel DB, Connan S , Popper ZA. 2011. Algal chemodiversity and bioactivity: Sources of natural variability and implications for commercial application. Biotechnol. Adv. 29: 483-501. http://dx.doi.org/10.1016/j.biotechadv.2011.05.016 [ Links ]
Sun B, Ricardo-da-Silva JM, Spranger I. 1998. Critical factors of vanillin assay for catechins and proanthocyanidins. J. Agric. Food Chem. 46: 4267-4274. [ Links ]
Surveswaran S, Cai YZ, Corke H, Sun M. 2007. Systematic evaluation of natural phenolic antioxidants from 133 Indian medicinal plants. Food Chem. 102: 938-953. [ Links ]
Thomas N, Kim S-K. 2013. Beneficial effects of marine algal compounds in cosmeceuticals. Mar. Drugs 11: 146-164. [ Links ]
Torres PB, Chow F, Santos DYAC. 2015. Growth and photosynthetic pigments of Gracilariopsis tenuifrons (Rhodophyta, Gracilariaceae) under high light in vitro culture. J. Appl. Phycol. 27: 1243-1251. [ Links ]
Viera MP, de Vicose GC, Gómez-Pinchetti JL , Bilbao A, Fernandez-Palacios H, Izquierdo MS. 2011. Comparative performances of juvenile abalone (Haliotis tuberculata coccinea Reeve) fed enriched vs non-enriched macroalgae: Effect on growth and body composition. Aquaculture 319: 423-429. [ Links ]
Wojdylo A, Oszmiański J, Czemerys R. 2007. Antioxidant activity and phenolic compounds in 32 selected herbs. Food Chem. 105: 940-949. [ Links ]
Yuan YV, Bone DE, Carrington MF. 2005. Antioxidant activity of dulse (Palmaria palmata) extract evaluated in vitroFood Chem. 91: 485-494. [ Links ]
Yuan YV, Walsh NA. 2006. Antioxidant and antiproliferative activities of extracts from a variety of edible seaweeds. Food Chem. Toxicol. 44: 1144-1150. [ Links ]
Zhao J, Fan X, Wang S, Li S, Shang S, Yang Y, Xu N, Lü Y, Shi J. 2004. Bromophenol derivatives from the red alga Rhodomela confervoidesJ. Nat. Prod. 67: 1032-1035. [ Links ]
Zubia M, Freile-Pelegrín Y, Robledo D . 2014 Photosynthesis, pigment composition and antioxidant defences in the red alga Gracilariopsis tenuifrons (Gracilariales, Rhodophyta) under environmental stress. J. Appl. Phycol. 26: 2001-2010. [ Links ]
Recibido: Agosto de 2016; Aprobado: Noviembre de 2016











 texto em
texto em