Introducción
Desde la década de 1960, se han realizado estudios para comprender el proceso de calcificación que llevan a cabo los corales hermatípicos y conocer los factores que limitan su crecimiento. Wells (1963) determinó que los parámetros de crecimiento coralino guardan una relación directa con las variaciones estacionales en las condiciones ambientales.
Knutson et al. (1972) confirmaron esta teoría y reconocieron pares de bandas de crecimiento anual, de alta y baja densidad, en el esqueleto de los corales, las cuales representan las épocas de mayor y menor calcificación. Este patrón de bandas permite analizar, retrospectivamente, los parámetros de crecimiento del esqueleto coralino mediante 3 variables que contienen información complementaria: (1) la tasa de extensión del esqueleto, (2) la densidad del esqueleto (la cual depende directamente de la densidad de la aragonita [2.94 g cm-3], y los poros en el esqueleto son los responsables de afectar este valor [Hughes 1987]) y (3) la tasa de calcificación (Dodge y Brass 1984, Carricart-Ganivet et al. 2000). Además, las bandas en el esqueleto coralino están asociadas a las condiciones ambientales predominantes donde se desarrolla el coral y, por tanto, son una herramienta importante para reconstruir las condiciones ambientales en donde habitan los corales (Knutson et al. 1972, Buddemeier 1974, Chalker et al. 1985).
Las variables ambientales que más influyen en el crecimiento coralino son la luz (Buddemeier 1974, Wellington y Glynn 1983, Falkowski 2000, Yentsch et al. 2002), la sedimentación (Dodge et al. 1974, Loya 1976, Barnes y Lough 1999, Fabricius 2005), la concentración de nutrientes (Atkinson y Bilger 1992, Lough et al. 1999, Fabricius 2005), el estado de saturación de la aragonita (Ωaragonita) (Gattuso et al. 1998, Kleypas et al. 1999, Langdon et al. 2000, Marubini et al. 2001), el pH (Atkinson et al. 1994, Marubini y Atkinson 1999, Kleypas y Langdon 2006) y la temperatura superficial del mar (TSM) (Dodge et al. 1974, Veron 1995, Lough y Barnes 2000, Cruz-Piñón et al. 2003, Carricart-Ganivet 2004, Carricart-Ganivet et al. 2012, Cabral-Tena et al. 2013, Norzagaray-López et al. 2013).
El crecimiento de los corales y su variación están controlados por 2 factores: (1) la cantidad de energía disponible para la precipitación de material calcáreo (conocido como tasa de calcificación) y (2) la manera en la que este material es utilizado por el coral para construir su esqueleto. Las diferencias en este último resultan en 2 estrategias de crecimiento de los corales: invertir los recursos para calcificar y formar esqueletos más densos, o bien, para formar esqueletos con mayor extensión (Carricart-Ganivet 2007).
En el Pacífico oriental y el Caribe mexicano, se ha observado que los corales masivos pertenecientes a los géneros Porites y Orbicella siguen un patrón anual de crecimiento: a finales del verano, cuando la TSM es alta, depositan un esqueleto más denso y se forma una banda de alta densidad; contrariamente, cuando la TSM disminuye, reduce también la densidad de su esqueleto y se forma una banda de baja densidad (Highsmith 1979, Barnes y Lough 1993, Lough y Barnes 2000, Carricart-Ganivet 2004). Así, un par de bandas de crecimiento de distinta densidad (alta, baja) representa un año de crecimiento (Barnes y Lough 1993). Con esto en consideración, el análisis del patrón de bandas alterno en el esqueleto de los corales permite conocer la tasa de calcificación anual (g CaCO3 cm-2 año-1), que de acuerdo con Dodge y Brass (1984) es el producto de la tasa de extensión del esqueleto (cm año-1) y la densidad del mismo (g CaCO3 cm-3).
Considerando que el crecimiento coralino está relacionado con las condiciones ambientales en donde se desarrollan los corales (Knutson et al. 1972), la determinación de los parámetros básicos de calcificación (i.e., extensión, densidad) y los factores ambientales que los regulan a escala regional, especialmente para aquellas especies de coral que contribuyen en mayor medida al desarrollo estructural del sistema arrecifal, se vuelve indispensable. El crecimiento de los corales escleractinios es responsable de la persistencia de los arrecifes coralinos a través del tiempo (Manzello 2010). Así, cuantificar la tasa de calcificación de las principales especies de corales formadores de arrecife y conocer las variables ambientales que regulan este proceso permite evaluar el estado en el que se encuentran estas especies y el estado de salud del arrecife en general. Adicionalmente, la información contenida en las bandas de densidad de los esqueletos permite hacer reconstrucciones ambientales de los periodos en los que se desarrolló el coral y, con esto, inferir la respuesta del crecimiento coralino ante escenarios climáticos futuros (i.e., Buddemeier et al. 2004, IPCC 2007). Lo anterior se vuelve particularmente relevante para aquellas especies o regiones donde los arrecifes se desarrollan en condiciones ambientalmente marginales. Desde finales del siglo XIX, se ha reconocido que el Pacífico oriental tropical representa una zona subóptima para el desarrollo arrecifal porque presenta una plataforma continental estrecha, alta productividad, aguas relativamente frías y surgencias estacionales (Glynn y Ault 2000), además de agua con bajo pH y baja Ωaragonita (Manzello et al. 2008, Manzello 2010). De manera particular, estos 2 últimos elementos convierten al Pacífico oriental en un laboratorio natural para estudiar los efectos de un océano con altos niveles de CO2 en los procesos que regulan la calcificación de las especies de coral y el desarrollo arrecifal. A pesar de la relevancia del tema, existe un número limitado de estudios respecto a la calcificación de corales en el Pacífico oriental (Glynn y Wellington 1983; Wellington y Glynn 1983; Halfar et al. 2005; Calderón et al. 2007; Reyes-Bonilla y López-Pérez 2009; Cabral-Tena et al. 2013; Norzagaray-López et al. 2013, 2014), de los cuales un número aún más escaso ha reportado valores de crecimiento obtenidos in situ (Glynn y Wellington 1983; Wellington y Glynn 1983; Cabral-Tena et al. 2013; Norzagaray-López et al. 2013, 2014). A la fecha, las estimaciones in situ han sido llevadas a cabo en las islas Galápagos (Glynn y Wellington 1983, Wellington y Glynn 1983) y el golfo de California (Cabral-Tena et al. 2013; Norzagaray-López et al. 2013, 2014; Tortolero-Langarica 2016), pero se carece de estimaciones para corales que se desarrollan en la costa del Pacífico del sur de México.
Las aguas tropicales mexicanas del Pacífico se caracterizan por presentar arrecifes relativamente pequeños, discontinuos y con baja diversidad de especies de coral (Reyes-Bonilla 2003). Generalmente, hay un dominio de Pocillopora spp. y contribuciones menos importantes de Pavona spp. y Porites spp. (Glynn y Leyte-Morales 1997, López-Pérez et al. 2012). De las 5 regiones en que se dividen los arrecifes del Pacífico en México, la región del sur está conformada por las formaciones arrecifales frente a Ixtapa-Zihuatanejo en el estado de Guerrero (López-Pérez et al. 2012) y frente a Puerto Ángel (Reyes-Bonilla y Leyte-Morales 1998) y Bahías de Huatulco en el estado de Oaxaca (Glynn y Leyte-Morales 1997, López-Pérez y Hernández-Ballesteros 2004). Estas 2 zonas presentan condiciones climáticas y oceanográficas diferentes. En específico, la zona de Huatulco está influenciada por surgencias estacionales que ocurren en el golfo de Tehuantepec, las cuales transportan agua subsuperficial con bajo pH, baja Ωaragonita y variaciones en la TSM (Chapa-Balcorta et al. 2015). En contraste, la zona arrecifal de Ixtapa-Zihuatanejo tiene condiciones más estables en la TSM (Morales et al. 2008) y mayor Ωaragonita (Reyes-Bonilla et al. 2014). Estas diferencias en las condiciones podrían verse reflejadas en los parámetros de crecimiento de los corales constructores de arrecifes de cada zona. Sin embargo, para ninguna de estas zonas se han determinado los parámetros de crecimiento de ninguna de las especies de coral. Conocer los parámetros de crecimiento coralino y los factores que lo regulan se vuelve particularmente necesario si consideramos que la reciente evaluación del sistema de carbonatos de la región (Chapa-Balcorta et al. 2015) reveló que los arrecifes podrían experimentar condiciones de estrés por acidificación más extremas que lo previamente sugerido (Manzello et al. 2008, Manzello 2010).
En este sentido, la presente investigación tuvo por objetivo determinar la tasa de extensión, la densidad y la tasa de calcificación de las principales especies constructoras de arrecifes (Pocillopora meandrina, Pocillopora damicornis, Pocillopora verrucosa, Pocillopora capitata, Porites panamensis, Porites lobata, Pavona gigantea y Pavona varians) en aguas del Pacífico frente al sur de México, evaluar el efecto que tiene la TSM en el crecimiento de estas especies y comparar los parámetros de calcificación obtenidos en este estudio con los reportados por otros autores para diferentes latitudes. Esto es relevante en un momento en el que se debaten los probables escenarios del calentamiento global (cambio climático) y su influencia en los ecosistemas costeros y arrecifales.
Materiales y métodos
Área de estudio
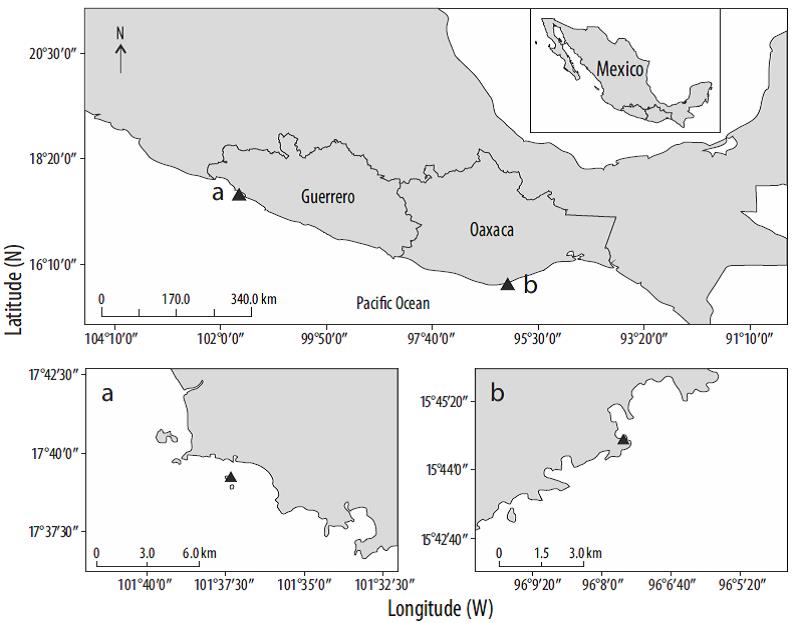
Se recolectaron colonias de coral en 2 sitios con condiciones oceanográficas diferentes (Fig. 1). La Entrega (Oaxaca; 15°44'34"N, 96°07'35"W) está situado en el margen occidental del golfo de Tehuantepec. En esta zona, producto de fuertes vientos provenientes del norte, se presentan intensos periodos de surgencias (octubre-abril) (Chapa-Balcorta et al. 2015). En estos periodos, se ha observado que la TSM puede descender hasta 8 °C (promedio anual 28.7 °C), y se ha registrado una disminución en el pH y una menor Ωaragonita (Chapa-Balcorta et al. 2015). Por su parte, Zacatoso (Guerrero; 17°39'14"N, 101°37'19"W) presenta parámetros ambientales típicos de las aguas del Pacífico del sur de México: una TSM media anual de 29.2 °C (Morales et al. 2008), oscilaciones térmicas anuales menores que 2 °C, una salinidad superficial media de 34, una termoclina estable y poco profunda (20-40 m) (Fiedler y Talley 2006) y una mayor Ωaragonita (Reyes-Bonilla et al. 2014). A diferencia de La Entrega, Zacatoso no está influenciado por eventos de surgencia que afecten la TSM, el pH y la concentración de Ωaragonita.
Actividades de campo
Durante septiembre y noviembre de 2010, 40 fragmentos de corales hermatípicos obtenidos previamente de colonias saludables fueron fijadas con plastilina epóxica en una estructura de PVC anclada a 5 m de profundidad en Zacatoso y La Entrega. Para tener un registro puntal del crecimiento, las colonias fueron marcadas con rojo de alizarina (Barnes 1972). Los corales fijados y marcados fueron extraídos en octubre y noviembre de 2013. Al final del periodo, se recolectaron en La Entrega, 4 colonias de Pocillopora meandrina, 9 de Pocillopora damicornis, 2 de Pocillopora capitata, 8 de Porites panamensis y 4 de Pavona varians. En Zacatoso, se recolectaron 3 colonias de Pocillopora verrucosa, 5 de Porites lobata y 5 de Pavona gigantea. Las colonias de corales ramificados presentaron una altura de 9 a 15 cm, y un espesor de 8 a 10 cm. Los corales masivos midieron de 4 a 9 cm de altura y de 8 a 12 cm de espesor.
Parámetros de crecimiento
Se determinó la tasa de extensión (cm año-1) y la densidad del esqueleto (g CaCO3 cm-3) de cada colonia. En el caso de las colonias de Pocillopora (crecimiento ramificado), la extensión del esqueleto se obtuvo midiendo, con un vernier digital (±0.1 mm de precisión), la distancia desde la línea teñida de rojo de alizarina hasta el ápice de la ramificación. La densidad del esqueleto se estimó por el método de volumen desplazado (Brown y Scoffin 1986). La tasa de calcificación (g CaCO3 cm-2 año-1) se calculó como el producto de la densidad y la extensión del esqueleto (Lough y Barnes 2000).
En el caso de las colonias de Porites y Pavona (crecimiento masivo), cada colonia se cortó en lajas de 7 mm de espesor a lo largo del eje de crecimiento con una sierra de alta velocidad. Cada laja fue lavada y puesta a secar al sol por 24 h. Las lajas de coral fueron radiografiadas con un equipo de rayos X para mamografía digital (Senographe 600T Senix HF, Waukesha, WI) a 34-40 kVp durante 60 s de exposición y con 45 cm de distancia focal. En cada exposición se empleó un estándar de aragonita constituido por 8 bloques de grosor y densidad conocida (2.83 g CaCO3 cm-3) fabricados a partir de la concha de Tridacna maxima (Carricart-Ganivet y Barnes 2007). Las imágenes digitalizadas de los rayos X se utilizaron para medir los parámetros de crecimiento usando el método de densitometría óptica (Carricart-Ganivet y Barnes 2007). Las bandas de crecimiento coralino de cada imagen se analizaron mediante el software Image J v.1.44 (https://imagej.nih.gov/ij/). La extensión anual (cm año-1) se estimó como la distancia lineal entre 2 bandas consecutivas de baja densidad. La densidad media anual (g CaCO3 cm-3) se definió como el promedio entre el mínimo y máximo de densidad adyacente para cada par de bandas. Finalmente, la tasa anual de calcificación (g CaCO3 cm-2 año-1) se obtuvo mediante el producto de la densidad promedio anual y el crecimiento anual de cada par de bandas (Lough y Barnes 2000).
Con el objetivo de evaluar el efecto estacional que tiene la TSM sobre los parámetros de crecimiento de los corales masivos (Porites y Pavona), se obtuvieron tasas de crecimiento semestrales. Se usó el perfil de densidad generado mediante el método de densitometría óptica (Carricart-Ganivet y Barnes 2007) utilizado para calcular la tasa de calcificación anual, así como las fechas de recolecta (octubre y noviembre de 2013) y marcaje (alizarina, septiembre y noviembre de 2010), para hacer un análisis esclerocronoló-gico. Las bandas que se situaban por detrás de la marca de alizarina se consideraron como bandas anteriores a 2010. Considerando que un par de bandas de crecimiento de distinta densidad (alta, baja) representa un año de crecimiento (Barnes y Lough 1993), se hicieron lecturas de cada banda por separado (en lugar de 2, como en el cálculo anual) para, así, obtener los valores semestrales de crecimiento (Fig. 2). La extensión semestral se calculó como la distancia lineal que ocupa cada banda (alta o baja densidad). La densidad semestral promedio se estimó como el promedio entre la densidad mínima y máxima que presentaba cada banda por separado. La tasa de calcificación semestral se calculó como el producto entre la extensión lineal y la densidad promedio semestrales.
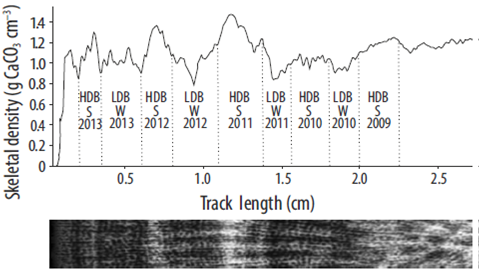
Figura 2 Valores de densidad a lo largo de un transecto de una imagen digital de rayos X. Para estimar los valores semestrales (verano/invierno), se ancló la distancia que ocupaba cada banda a lo largo del transecto (línea punteada): HDB, banda de alta densidad; LDB, banda de baja densidad; S, verano; W, invierno.
Temperatura superficial del mar
Para cada localidad, se obtuvieron los valores de TSM (máximo, mínimo y promedio mensual ± desviación estándar) a partir de imágenes del sensor satelital Aqua MODIS, con 4 km de resolución espacial (http://oceanco-lor.gsfc.nasa.gov/cgi/l3), los cuales comprendieron el periodo de enero de 2007 a diciembre de 2013. Con el fin de comparar la TSM con las bandas de crecimiento de los corales, estos valores se agruparon por semestre considerando el de diciembre a mayo como temporada de invierno y el de junio a noviembre como temporada de verano. Considerando que, debido a la resolución (4 x 4 km), los datos de TSM obtenidos por el sensor Aqua MODIS pudieran no representar la temperatura experimentada por los corales en las áreas de crecimiento, se compararon datos de TSM obtenidos in situ para el periodo 2010-2011 en La Entrega con los datos de TSM obtenidos por el sensor para el mismo periodo. El ter-mógrafo se instaló a 5 m de profundidad y registró la temperatura a intervalos de 1 h. De acuerdo con un análisis de regresión lineal simple, los datos in situ y los datos satelitales tuvieron el mismo patrón estacional y una relación positiva altamente significativa (r 2 = 0.96, P = 0.0001). Lo anterior sugiere que el uso de los valores de TSM obtenidos mediante imágenes de satélite es adecuado para los análisis que involucran a los parámetros de crecimiento de los corales.
Análisis de datos
Se evaluó la relación entre los valores anuales de crecimiento coralino (tasa de extensión, densidad del esqueleto y tasa de calcificación) de las especies con crecimiento masivo mediante un análisis de correlación de Pearson. Adicionalmente, se utilizaron modelos de regresión lineal para evaluar la relación entre los valores de TSM y los valores semestrales de crecimiento coralino. Previo a estos análisis, se evaluaron los supuestos de normalidad y homocedasticidad de los datos. Para todos los análisis estadísticos, se consideró un α =0.05 (Zar 2010).
Resultados
Los valores de crecimiento anual promedio (± desviación estándar) (periodo 2010-2013) se muestran en la Figura 3. Respecto a los corales ramificados, Pocillopora damicornis (La Entrega, Oaxaca) presentó el valor promedio más alto de densidad (1.78 ± 0.31 g CaCO3 cm-3) y un crecimiento en extensión de 2.94 ± 0.32 cm año-1, lo que resulta en una tasa de calcificación de 5.23 ± 1.03 g CaCO3 cm-2 año-1, la más alta registrada para el género. Pocillopora verrucosa (Zacatoso, Guerrero) tuvo el valor de densidad más bajo (1.47 ± 0.01 g CaCO3 cm-3) y la tasa de extensión más alta (3.42 ± 0.32 cm año-1) del género, lo que se traduce en una tasa de calcificación de 5.04 ± 0.44 g CaCO3 cm-2 año-1. Pocillopora meandrina (La Entrega, Oaxaca) presentó una densidad de 1.47 ± 0.09 g CaCO3 cm-3, un crecimiento de 2.02 ± 0.39 cm año-1 y una tasa de calcificación de 2.99 ± 0.74 g CaCO3 cm-2 año-1. Pocillopora capitata (La Entrega, Oaxaca) mostró una densidad de 1.67 ± 0.07 g CaCO3 cm-3, una extensión de 2.92 ± 0.23 cm año-1 y una calcificación de 4.87 ± 0.14 g CaCO3 cm-2 año-1.
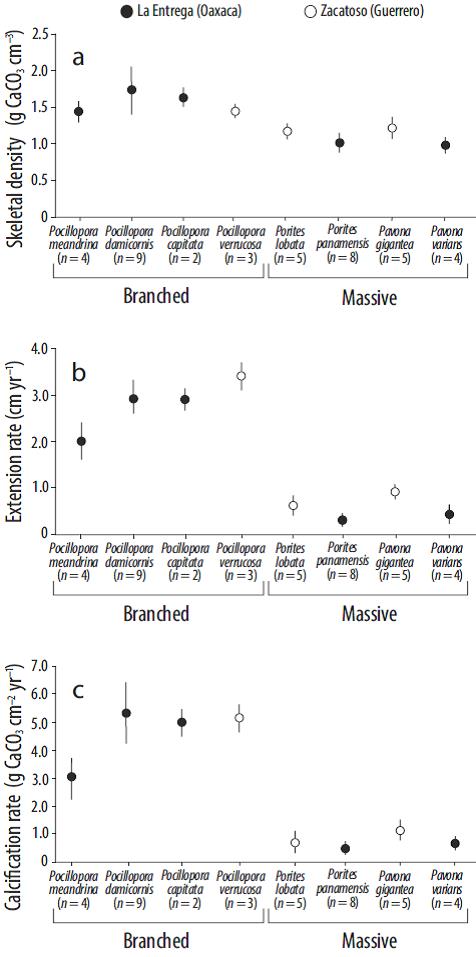
Figura 3 Parámetros de crecimiento de corales escleractinios en la costa del Pacífico del sur de México durante el periodo 2010-2013: (a) densidad del esqueleto (g CaCO3 cm-3), (b) tasa de extensión (cm año-1) y (c) tasa de calcificación (g CaCO3 cm-2 año-1). Los círculos representan la media; las líneas verticales, la desviación estándar; y n, el tamaño de muestra.
Respecto a las especies de coral masivo, en Zacatoso (Guerrero), Pavona gigantea mostró los valores más altos de densidad (1.24 ± 0.09 g CaCO3 cm-3), extensión (0.91 ± 0.07 cm año-1) y calcificación (1.13 ± 0.09 g CaCO3 cm-2 año-1), mientras que Porites lobata tuvo una densidad de 1.20 ± 0.07 g CaCO3 cm-3, un crecimiento de 0.60 ± 0.16 cm año-1 y una tasa de calcificación de 0.72 ± 0.22 g CaCO3 cm-2 año-1. Considerando a las especies que se desarrollan en el arrecife La Entrega (Oaxaca), Porites panamensis tuvo los valores más bajos en densidad (1.12 ± 0.08 g CaCO3 cm-3), extensión (0.31 ± 0.07 cm año-1) y calcificación (0.34 ± 0.07 g CaCO3 cm-2 año-1), mientras que Pavona varians tuvo una densidad de 1.04 ± 0.07 g CaCO3 cm-3, una extensión de 0.43 ± 0.07 cm año-1 y una calcificación de 0.45 ± 0.09 g CaCO3 cm-2 año-1.
Las colonias de los géneros con crecimiento masivo tuvieron en promedio 4 pares de bandas de crecimiento, lo que representa el registro de 4 años (2009-2013) de crecimiento por colonia. Esto sugiere que las colonias estudiadas tenían en promedio un año de crecimiento previo a la siembra. De acuerdo con el análisis de correlación entre los 3 parámetros de crecimiento anuales (extensión, densidad y calcificación), la relación fue positiva y significativa entre la tasa de extensión y la tasa de calcificación para todas las especies estudiadas (Porites lobata: r = 0.97, P = 0.0001; Pavona gigantea: r = 0.98, P = 0.0001; Porites panamensis: r = 0.98, P = 0.0001; y Pavona varians: r = 0.99, P = 0.0001). La correlación entre la densidad del esqueleto y la tasa de calcificación fue baja (P > 0.05) para todas las especies.
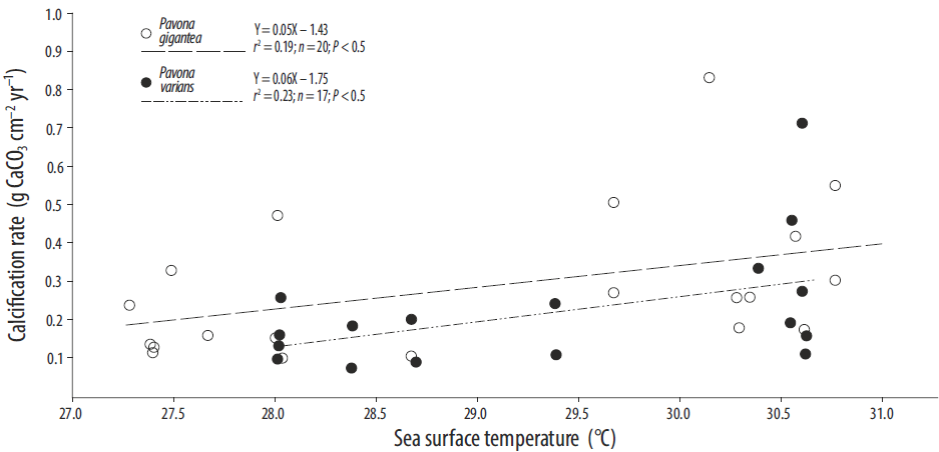
Cuando se compararon los registros de la TSM con los de los parámetros de crecimiento (Tabla 1), los valores de densidad del esqueleto de las colonias de los géneros Porites y Pavona se relacionaron positivamente con la TSM (Fig. 4). En Zacatoso, la relación entre la TSM y la densidad del esqueleto fue significativa para Porites lobata (r2 = 0.55, P = 0.0001) y Pavona gigantea (r 2 = 0.62, P = 0.0001). En La Entrega, Porites panamensis (r 2 = 0.36, P = 0.01) y Pavona varians (r 2 = 0.55, P = 0.001) mostraron una tendencia positiva significativa. La tasa de calcificación semestral mostró una correlación baja, aunque significativa, con la TSM para Pavona gigantea (r 2 = 0.19, P < 0.5) y Pavona varians (r 2 = 0.23, P < 0.5; Fig. 5). Las tasas de extensión para Porites lobata, Porites panamensis, Pavona gigantea y Pavona varians no se relacionaron significativamente con la TSM.
Tabla 1 Promedio (± desviación estándar) semestral (verano/invierno) de la densidad del esqueleto, la extensión y la calcificación de las especies de coral masivo estudiadas.
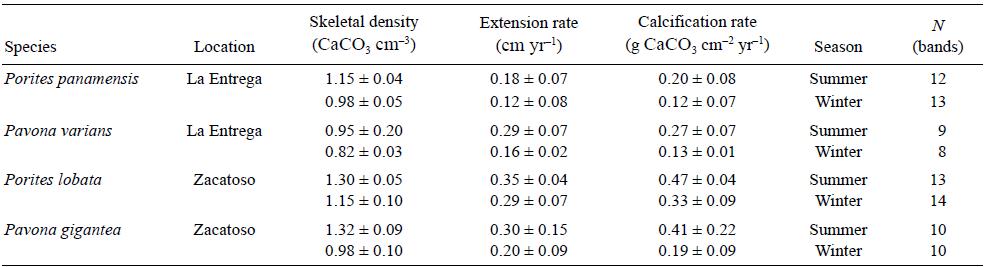
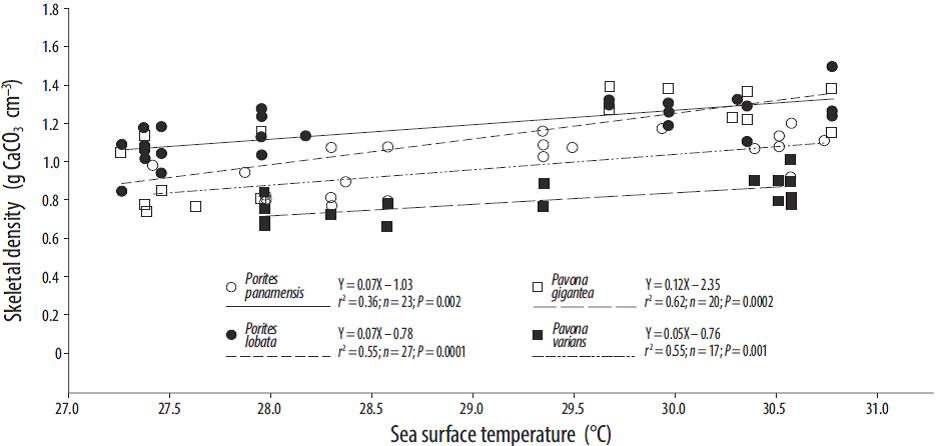
Figura 4 Relación entre la densidad del esqueleto y la temperatura superficial del mar en los corales masivos recolectados en la costa del Pacífico del sur de México.
Discusión
Parámetros de crecimiento: especies ramificadas
Las tasas de extensión de las especies de Pocillopora (P. capitata, P. damicornis, P. meandrina y P. verrucosa) registradas en este trabajo están dentro del intervalo reportado por otros estudios realizados en la costa del Pacífico de Centroamérica (Glynn 1977, Guzmán y Cortés 1989, Jiménez y Cortés 2003, Manzello 2010). Considerando que las condiciones ambientales en las 2 regiones donde se desarrolló este estudio han sido descritas como desfavorables para el crecimiento coralino (e.g., surgencias, oscilaciones en la TSM, baja Ωaragonita; Reyes-Bonilla et al. 2002, Cupul-Magaña y Calderón-Aguilera 2008, Chapa-Balcorta et al. 2015), éstas no deben ser lo suficientemente agudas o extremas como para influenciar negativamente el proceso de calcificación de Pocillopora y, en última instancia, la contribución de carbonato de calcio del género al desarrollo arrecifal. Excepto un arrecife en la zona de Ixtapa (Morros del Cerro Colorado, Guerrero; López-Pérez et al. 2012), donde Porites lobata contribuye mayormente a la estructura y crecimiento arreci-fal, los arrecifes del área de estudio se caracterizan por ser relativamente pequeños, tener baja diversidad de especies y estar construidos mayoritariamente por especies del genero Pocillopora (Cortés 2003, Reyes-Bonilla 2003).
Uno de los factores que podrían explicar la dominancia de las especies de Pocillopora en la región es la relación simbiótica de este género con clados tipo D de Symbiodinium tolerantes al estrés térmico (LaJeunesse et al. 2010, Walther-Mendoza et al. 2016), que podría resultar ventajosa durante eventos El Niño (Carriquiry et al. 2001, Reyes-Bonilla et al. 2002, Baker et al. 2004, López-Pérez et al. 2016). Además, la capacidad de Pocillopora spp. para tolerar el aumento en las concentraciones de nutrientes, principalmente fósforo y amonio (Stambler et al. 1991, Muller-Parker 1994), que emergen durante las surgencias estacionales que ocurren en la región pudiera también ser ventajoso. Hay otros 2 elementos que podrían contribuir a la dominancia del género en la región: (1) su capacidad para reproducirse asexualmente mediante fragmentación y (2) sus altas tasas de extensión y calcificación. Tanto en el Indo-Pacífico como en el Pacífico oriental (Carriquiry y Reyes-Bonilla 1997, Ayre et al. 1997), se ha observado que las especies del género Pocillopora colonizan fácilmente otras áreas arrecifales después de que sus ramas se desprenden por efecto del oleaje o ciclones; en caso de no ser enterrados (López-Pérez et al. 2007), los fragmentos así generados se unen al sustrato y continúan desarrollándose, lo que incrementa el éxito competitivo por espacio de las especies ramificadas con respecto a las especies con poca probabilidad de fragmentarse (Glynn y Ault 2000, Reyes-Bonilla 2003, Reyes-Bonilla et al. 2013). Pocillopora spp. tiene tasas de extensión y calcificación relativamente altas comparadas con las observadas en Porites spp. y Pavona spp. en el área de estudio (Fig. 3) y en Pocillopora spp. que se desarrollan en otros sitios (Tabla 2).
Parámetros de crecimiento: especies masivas
Los valores de la tasa de calificación obtenidos para las especies de coral masivo, en su mayoría, son menores que aquellos reportados previamente por otros autores y para otras latitudes (Tabla 2). En el caso de Porites panamensis, el valor fue 32% menor para el área de estudio que el valor reportado para bahía Concepción (0.5 g CaCO3 cm-2 año-1) en el golfo de California (Cabral-Tena et al. 2013) y para las islas Marietas (0.49 ± 0.16 g CaCO3 cm-2 año-1) en la costa del Pacífico de la parte central de México (Norzagaray-López et al. 2013), y hasta 74.8% menor que el valor registrado para bahía de La Paz (Cabral-Tena et al. 2013) y cabo Pulmo (Reyes-Bonilla y Calderón-Aguilera 1994). Respecto a Porites lobata, los valores de los 3 parámetros de crecimiento registrados en el presente estudio fueron ligeramente mayores respecto a lo observado por Tortolero-Langarica et al. (2016) para corales de vida libre (i.e., rodolitos) en isla Isabel frente a Nayarit; por tanto, los corales que se desarrollan en Ixtapa (este estudio) son 21.6% más extensos (0.60 ± 0.16 cm año-1) y 10% más densos (1.20 ± 0.07 g CaCO3 cm-3), y calcifican, en promedio, 29.1% más (0.72 ± 0.22 g CaCO3 cm-2 año-1). No obstante, Porites lobata posee una tasa de calcificación 57.8% menor que aquella reportada por Barnes y Lough (1992) para la gran barrera arrecifal de Australia (1.71 ± 0.25 g CaCO3 cm-2 año-1). Igualmente, Pavona gigantea tiene una tasa de calcificación 17% menor que aquella reportada para el arrecife La Uva (1.35 g CaCO3 cm-2 año-1) en Panamá (Manzello 2010). Pavona varians mostró una calcificación menor (28.57%) que lo previamente reportado por Manzello (2010) para Panamá (0.63 g CaCO3 cm-2 año-1).
Los relativamente bajos valores de calcificación de las especies con crecimiento masivo registrados durante el presente estudio resultaron de una reducida tasa de extensión promedio. En los años de mayor extensión de cada colonia, se registró el valor más alto de calcificación, lo que sugiere que las colonias de Porites panamensis, Porites lobata, Pavona gigantea y Pavona varians que se desarrollan en la costa del Pacífico del sur de México invierten más recursos en extensión que en densidad, resultado de una relación positiva entre la tasa de extensión y la tasa de calcificación (Lough y Barnes 2000, Carricart-Ganivet et al. 2007, Cabral-Tena et al. 2013). Lo observado sugiere que estas especies adoptan una estrategia de crecimiento de extensión, lo que les permite competir por espacio y, así, ocupar una mayor área en el menor tiempo posible (Lough y Barnes 2000). Ésta es la misma estrategia que adoptan las especies ramificadas en la región (ver sección previa). No obstante, los valores de extensión esqueletal de cualquier especie de Pocillopora son sensiblemente mayores que los observados para cualquier especie con crecimiento masivo; por tanto, los pocilopóridos en la región contribuyen mayoritariamente (>90%) a la construcción de la estructura arrecifal, mientras que Pavona spp. (>5%) y Porites spp. (>1%) lo hacen de manera marginal (Glynn y Leyte-Morales 1997, Carriquiry et al. 2001, López-Pérez et al. 2012).
Relación entre el crecimiento y la TSM
Aunque se siguen discutiendo los mecanismos y el tiempo en que se forman las bandas de alta y baja densidad en los esqueletos de los corales y los factores que regulan la calcificación coralina, se reconoce que variables tales como la luz (Buddemeier 1974, Wellington y Glynn 1983, Falkowski 2000, Yentsch et al. 2002), la sedimentación (Carricart-Ganivet y Merino 2001), la concentración de nutrientes (Lough et al. 1999), Ωaragonita (Gattuso et al. 1998, Kleypas et al. 1999, Langdon et al. 2000, Marubini et al. 2001) y la TSM (Dodge et al. 1974; Carricart-Ganivet 2004, 2007; Cabral-Tena et al. 2013; Norzagaray-López et al. 2013) influyen estos procesos. En particular, se ha observado que la TSM afecta sustancialmente la tasa de calcificación de los corales (Dodge et al. 1974, Veron 1995, Lough y Barnes 2000, Cruz-Piñón et al. 2003, Carricart-Ganivet 2004, Carricart-Ganivet et al. 2012). Cabral-Tena et al. (2013) y Norzagaray-López et al. (2013) reportaron que la TSM tiene influencia sobre la extensión y densidad del esqueleto de los corales masivos de la costa del Pacífico de México. Considerando que la principal estrategia de crecimiento en todas las especies masivas estudiadas es la extensión (ver sección anterior), se esperaría encontrar una relación entre la extensión y la TSM. Sin embargo, los resultados no indican que exista relación significativa (P > 0.05) entre estas 2 variables, lo que sugiere que la extensión pudiese estar regulada por alguna otra variable ambiental no considerada en esta zona del sur de México (Guerreo y Oaxaca).
En el caso de la densidad del esqueleto, se observó una relación significativa con la TSM en todas las especies con crecimiento masivo, lo que indica que la máxima densidad anual del esqueleto se alcanza cuando la temperatura es alta. Lo anterior concuerda con lo observado para el género Porites en Australia por Barnes y Lough (1992), quienes reportaron bandas de alta densidad formadas durante el verano. En cuanto a la relación entre la tasa de calcificación y la TSM, Pavona gigantea y Pavona varians (Fig. 5) mostraron puntos máximos de calcificación a temperaturas por arriba de los 29 °C, lo que difiere con lo encontrado en otros estudios donde se registra una temperatura de máxima calcificación en el intervalo de 26 a 28 °C (Edmunds 2005, Cooper et al. 2008). Esta diferencia puede resultar de la adaptación local de los corales constructores de arrecifes a las condiciones ambientales que experimentan los organismos en la costa del Pacífico del sur de México. No es raro encontrar evidencias de poblaciones de corales aclimatadas a temperaturas locales o regionales más bajas o más elevadas (Kleypas et al. 1999) que las reportadas aquí, y que podrían alcanzar niveles de calcificación máximos a distintos intervalos de temperatura, probablemente en concordancia con distintos tipos de simbiontes (Baker 2004, Jones et al. 2008, LaJeunesse et al. 2010, Walther-Mendoza et al. 2016).
Finalmente, el tamaño de muestra fue pequeño para algunas especies (e.g., Pavona varians), por lo que los resultados deben tomarse con cautela; no obstante, este estudio reporta, por primera vez, las tasas de extensión, densidad y calcificación de las principales especies de corales constructoras de arrecife de la costa del Pacífico del sur de México. Los resultados son, en virtud de sí mismos, relevantes pero cuando son analizados en un contexto regional (i.e., Pacífico oriental), ofrecen indicios respecto a los procesos que a gran escala regulan los parámetros de calcificación de los corales, en particular aquellos relacionados con Ωaragonita y el pH. Así, los resultados de la presente contribución, en conjunto con estudios del sistema de carbonatos en esta región (Chapa-Balcorta et al. 2015), son fundamentales para en un futuro cercano estudiar en tiempo real los efectos causados por el pH y Ωaragonita en el desarrollo de los corales formadores de arrecifes.











 texto en
texto en