Introducción
La foca de puerto del Pacífico, Phoca vitulina richardii, se distribuye desde Japón hasta México (Committee on Taxonomy 2016). En México, se encuentra en 9 islas sobre la costa occidental de Baja California, desde las islas Coronado hasta isla Asunción (Maravilla-Chávez y Lowry 1996, Lubinsky-Jinich en prensa). Es una especie filopátrica (Härkönen y Harding 2001), que no realiza migraciones estacionales (Stewart y Yochem 1994), y se alimenta en un radio de 2 a 30 km alrededor de las zonas terrestres de descanso (Suryan y Harvey 1998, Tollit et al. 1998). Los nacimientos y la muda de la foca de puerto son procesos anuales que se repiten con alta precisión temporal (Temte 1991), ya que se encuentran controlados por factores bióticos y abióticos (Bigg 1981).
La temporalidad de los nacimientos y de la muda de la foca de puerto varía en función de la localización geográfica de las colonias. Los nacimientos están controlados principalmente por el fotoperiodo (Temte 1994). Temte et al. (1991) describieron 3 patrones para la temporalidad de los nacimientos de P. v. richardii: (1) una clina latitudinal, de sur a norte, en la cual los nacimientos suceden primero en bahía San Quintín, Baja California, México, y por último en Grays Harbor, Washington, EUA; (2) en Puget Sound, Washington, los nacimientos suceden aproximadamente 2 meses después que en lugares de la misma latitud; y (3) del norte de Columbia Británica a Alaska los nacimientos no presentan ninguna variación latitudinal. Por ejemplo, en la isla Tugidak, Alaska, los nacimientos comienzan en mayo (Jemison y Kelly 2001); en el sur de Puget Sound, Washington, en agosto (Newby 1973); en la isla San José, Washington, en junio (Suryan 1995); en la bahía de San Francisco, California, en marzo (Bohorquez 2001); y en las islas del Canal, California, en febrero (Stewart y Yochem 1994). Para México, sólo hay registros de crías en momentos puntuales entre enero y abril (Padilla-Villavicencio 1990, Loya-Salinas et al. 1992, Lubinsky-Jinich en prensa).
La temporada de muda sucede entre la temporada de cría y de 2 a 3 meses después de ésta (Bigg 1981). Los factores que pueden influir en este proceso son el fotoperiodo, la temperatura y las hormonas (Ling 1972, Ashwell-Erickson et al. 1986, Mo et al. 2000); por lo tanto, el momento en el que muda cada individuo depende de su sexo, edad y estado de madurez sexual (Thompson y Rothery 1987, Daniel et al. 2003). La fenología de la muda de P. v. richardii sólo ha sido estudiada en la isla Tugidak, donde la muda ocurre de julio a septiembre (Daniel et al. 2003). En México, se han observado individuos mudando entre marzo y junio a lo largo de su distribución (Lubinsky-Jinich en prensa).
Las zonas de descanso son utilizadas con mayor frecuencia durante la temporada de cría, ya que en estos lugares las hembras paren y alimentan a sus crías, y los machos permanecen más tiempo en tierra para aparearse después del destete (Bonnes et al. 2006). También son utilizadas durante la temporada de muda, cuando las focas pasan más tiempo descansando (Daniel et al. 2003). Debido a este comportamiento, existe una variación temporal en la abundancia de focas en tierra (Brown y Mate 1983, Jemison y Kelly 2001, Daniel et al. 2003). Por lo tanto, para evaluar el tamaño de las colonias es necesario conocer la temporalidad de los nacimientos y la muda, y determinar en cuál de estos eventos se congrega el mayor número de individuos en tierra, ya que esto también varía entre localidades (Huber et al. 2001, Jemison et al. 2006).
El conocimiento sobre la biología y ecología de la foca de puerto en México es escaso. Se desconoce la temporalidad de los nacimientos y de la muda, por lo que es posible que para las estimaciones de abundancia realizadas hasta ahora (e.g., Padilla-Villavicencio 1990, Loya-Salinas et al. 1992, Lubinsky-Jinich en prensa), los conteos no se hayan efectuado en las fechas adecuadas y el tamaño de la población podría estar subestimado. El objetivo de este estudio fue caracterizar y determinar la temporalidad de los nacimientos y la muda de P. v. richardii en el estero de Punta Banda (EPB), Baja California, localizado cerca del extremo norte de la distribución de la especie en México.
Materiales y métodos
Trabajo de campo
El EPB (31°42'-31°47'N, 116°37'-116°40'W) se localiza en el noroeste de la península de Baja California, en la zona suroeste de la bahía de Todos Santos (Fig.1). Es un ambiente costero lagunar representativo de la ecorregión californiana, y se ha declarado como un Humedal de Importancia Internacional (sitio RAMSAR no. 1604).

Figura 1 Boca del estero de Punta Banda, Baja California, México. Sitios donde suele localizarse la colonia de focas de puerto (Phoca vitulina richardii) (●).
El trabajo de campo se realizó de febrero a abril de 2011 y de enero a julio de 2012. Se hicieron observaciones desde tierra una vez por semana en 2011 y 3 veces por semana en 2012, en marea baja preferentemente, ya que es cuando más individuos se observan en tierra (Jemison y Kelly 2001). Se realizaron un total de 11 conteos en 2011 y 77 en 2012. Para las observaciones se utilizaron binoculares (7 x 50), un telescopio (25x) y una cámara fotográfica digital con lente zoom telefoto (200-400 mm).
Para determinar la temporalidad de los nacimientos, en cada conteo se registró el número total de individuos en tierra y en agua, dentro de la boca del EPB (Fig. 1), así como el número de crías, que se distinguen fácilmente por el pelaje nuevo y el pequeño tamaño de su cabeza. Se consideraron crías a los individuos nacidos el año del muestreo y que aún no eran destetados. Cuando una cría se encontraba sola durante las horas de observación, sin ninguna relación con un animal adulto, se le clasificó como cría destetada.
Para caracterizar el proceso de muda se registró el número de individuos que se encontraban en las etapas descritas por Daniel et al. (2003), específicamente la etapa tardía de premuda (premuda C), porque fue la etapa que se podía identificar inequívocamente, y las etapas de la muda, que en este estudio se agruparon en una sola etapa. Los animales en premuda C se caracterizan por haber perdido las manchas y los anillos, y por presentar un pelaje café oscuro o claro uniforme (Daniel et al. 2003). En cambio, durante la muda el pelo nuevo, más brilloso y definido, va reemplazando poco a poco al pelo viejo hasta cubrir el cuerpo del animal. Los individuos que no se pudieron clasificar en alguna de estas etapas se registraron como "no determinable". Además, se registró el número de individuos que presentaban cada patrón de progresión de la muda, que depende de la región del cuerpo donde inicia el proceso y cómo éste se va extendiendo a lo largo del cuerpo (Daniel et al. 2003). El patrón de muda más descrito (Stutz 1967, Ashwell-Erickson et al. 1986, Daniel et al. 2003) se caracteriza por la presencia inicial de pelo nuevo en la cabeza y las aletas. El patrón de muda inverso se caracteriza por la presencia de pelo nuevo inicialmente en el tronco y por último en la cabeza y las aletas (Daniel et al. 2003).
Análisis de los datos
Se utilizó el modelo de Rothery y McCann (1987) para determinar la temporalidad de los nacimientos. El modelo ha sido empleado exitosamente para describir la distribución temporal de hembras y crías del elefante marino (Mirounga sp.) en tierra (Rothery y McCann 1987, García-Aguilar 2004). El modelo supone que la distribución temporal de las crías sigue una distribución normal con una fecha media de nacimientos μ (en días) y desviación estándar σ, y que la duración de la lactancia, L, es igual para todas las crías. El número de crías en el tiempo t, n(t) (días), está dado por:
donde N T es el número total de crías producidas en una sola temporada y p(t, μi, a i , L) es la proporción esperada de crías al tiempo t. Para ambos años estudiados t = 1 y corresponde al 1 de enero. Esta proporción considera a todas las crías que nacieron antes del tiempo t menos las que fueron destetadas antes de t - L, por lo que la distribución normal de p es:
donde ϕ es la distribución acumulada de la distribución normal estandarizada. Esta ecuación describe una curva simétrica alrededor de t = μ + L/2, el momento en el que ocurre el máximo número de crías. N T es el valor de la pendiente que se obtiene al hacer la regresión lineal entre p(t, μi , σi , L) y el número de crías observadas (Rothery y McCann 1987). Los valores de μi , σi y L se obtuvieron al minimizar la suma de cuadrados de la variación residual entre el modelo y los datos observados en 2012; para el análisis de 2011, al haber menos datos, se empleó la duración de la lactancia estimada en 2012 para estimar μ y σ.
Para determinar la temporalidad de la muda, se utilizaron los datos de las etapas premuda C y muda recolectados en 2012. Se calculó la frecuencia acumulada relativa del número de individuos en cada una de estas etapas y se realizó un ajuste no lineal del modelo logístico. Para cada etapa, se consideró como la fecha de inicio cuando la proporción de individuos fue >0.01 y el final cuando la proporción fue >0.99. Para identificar el periodo con mayor proporción de individuos en la etapa de premuda C y en la etapa de muda, se realizó una regresión polinomial utilizando los programas Origin 8.5.1. y Curve Expert Professional 1.6.3. Para determinar si existían diferencias significativas entre el porcentaje de individuos que presentaba cada patrón de progresión de la muda, y cuál fue el patrón predominante, se empleó una prueba U de Mann-Whitney (Zar 2010). Ésta se realizó con un nivel de significancia (α) de 0.05 utilizando el programa STATISTICA 7.1.
Para determinar en qué temporada se pueden encontrar más individuos en tierra, se calculó para cada conteo el porcentaje de la colonia que se encontraba en tierra. Para ello, se empleó como tamaño mínimo de la colonia 99 individuos, ya que fue el máximo conteo registrado. De esta forma se generó una serie de tiempo del número total de individuos y de los individuos adultos e inmaduros. Debido a la gran fluctuación de los datos, se obtuvo la media móvil de 14 términos para ver la tendencia de éstos y poder determinar cuál es la temporada en la que se puede ver más del 50% de la colonia en tierra. El análisis se realizó con el programa STATISTICA 7.1.
Resultados
Temporalidad de los nacimientos de focas de puerto
La distribución temporal de las crías de foca de puerto presentó un patrón regular (Fig. 2), que fue satisfactoriamente descrito por el modelo (R 2 = 0.991 en 2011 y R 2 = 0.887 en 2012). La duración de la lactancia, a partir de las observaciones de 2012, se estimó que fue de 22.65 días. En ambos años (2011 y 2012), la duración de la temporada de cría fue de 9 semanas aproximadamente, de mediados de febrero a mediados de abril (Tabla 1, Fig. 2). La fecha media de nacimientos se produjo a principios de marzo y el máximo número de crías ocurrió a mediados de marzo (Tabla 1, Fig. 2). Se estimó que el número total de crías fue 34 en 2011 y 35 en 2012 (ver regresiones lineales en Fig. 2).

Figura 2 Distribución temporal ajustada con el modelo de Rothery y McCann (1987) (-) para los conteos (●) de las crías de foca de puerto, Phoca vitulina richardii, observadas durante la temporada de cría de 2011 (a) y de 2012 (b) en el estero de Punta Banda. Los residuales se muestran en la parte inferior y el modelo de regresión se muestra en la parte superior derecha. El día 1 representa el día 1 de enero.
Tabla 1 Temporalidad de los nacimientos de la foca de puerto, Phoca vitulina richardii, en el estero de Punta Banda en 2011 y 2012, estimada a partir del modelo de Rothery y McCann (1987). El día 1 representa el día 1 de enero. La temporada de cría empieza cuando se observa la primera cría recién nacida. El fin de la temporada de cría se estima cuando todas las crías han sido destetadas.

Temporalidad y progresión de la muda de focas de puerto
La distribución temporal de la frecuencia relativa acumulada del número de individuos en las etapas de premuda C y muda se ajustó satisfactoriamente al modelo logístico (R 2 = 0.995 para premuda C y R 2 = 0.998 para la etapa de muda) (Fig. 3). Se estimó que la etapa de premuda C tuvo una duración de 15 semanas; comenzó a finales de marzo y concluyó a principios de julio (Tabla 2). La etapa de muda tuvo una duración de 11 semanas, aproximadamente, e inició a finales de abril y terminó a mediados de julio. La distribución temporal de la proporción de individuos en premuda C y en muda se ajustó a un polinomio de grado 5 y a uno de grado 3, respectivamente (R 2 = 0.803 para premuda C y R 2 = 0.737 para la etapa de muda). La proporción máxima de individuos en premuda C se estimó que fue el 5 de mayo (63%) y en la etapa de muda, el 10 de junio (48%).
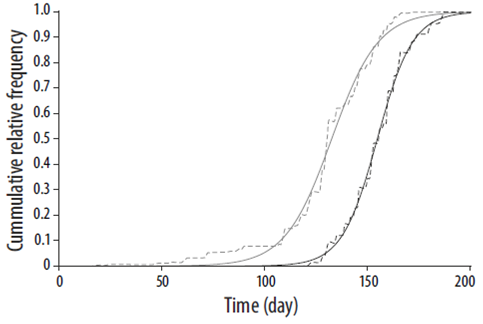
Figura 3 Modelo logístico de la frecuencia acumulada del número de individuos en la etapa tardía de premuda (premuda C, línea continua gris) y la etapa de muda (línea continua negra) de la foca de puerto, Phoca vitulina richardii, en 2012 en el estero de Punta Banda. También se muestra la frecuencia relativa acumulada de la premuda C (línea discontinua gris) y la muda (línea discontinua negra). El día 1 representa el día 1 de enero.
Tabla 2 Temporalidad de la muda de la foca de puerto, Phoca vitulina richardii, en el estero de Punta Banda, estimada con datos obtenidos en 2012. El día 1 representa el día 1 de enero. El final de la temporada se estima que es cuando la proporción de individuos es >0.99.

Se encontraron diferencias significativas entre los 2 patrones de progresión de la muda (U = 37, P < 0.001). De los individuos que se pudieron clasificar por día en alguno de los patrones, en promedio el 19% siguieron el patrón de muda de las aletas y la cabeza al tronco y el 81% siguieron el patrón de muda inverso.
Variación temporal de abundancia de focas de puerto en tierra
En cuanto al número total de individuos, se encontró que durante la temporada de cría y de muda se observó a más del 50% de los individuos en tierra. En el caso de los individuos adultos e inmaduros, sólo durante la temporada de muda se observó a más del 50% en tierra (Fig. 4).

Figura 4 Porcentaje del total de individuos (a) y de individuos inmaduros y adultos (b) de la foca de puerto, Phoca vitulina richardii, en tierra a lo largo del periodo de observación de 2012 en el estero de Punta Banda. Media móvil (-); porcentaje de individuos de la colonia en tierra por conteo (●). El día 1 representa el día 1 de enero.
Discusión
Temporalidad de los nacimientos de focas de puerto
La temporada de cría de P. v. richardii en el EPB tuvo lugar de mediados de febrero a mediados de abril, y coincide con el periodo de tiempo en que se realizaron las observaciones puntuales de crías en 1983, 1984 y 1990 (Padilla-Villavicencio 1990, Loya-Salinas et al. 1992). Además, la fecha media de nacimientos estimada para la temporada de 2011 y la de 2012 sólo varió por un día, de forma que se reflejó la alta sincronización que presentan los nacimientos de la foca de puerto año tras año en una zona determinada (Temte 1991). Sin embargo, existe un registro de 13 crías a principios de mayo de 1982 en el EPB (Padilla-Villavicencio 1990). Es posible que éstas pudieron haber sido crías destetadas o la temporada de cría se pudo haber atrasado debido a las condiciones ambientales, como por ejemplo, una disminución de la disponibilidad de alimento el año anterior al conteo (Bohorquez 2001, Jemison y Kelly 2001). Esta última hipótesis es menos probable debido a que en 1981 los valores del Índice Oceánico de El Niño no presentaron anomalías (CPC 2015). También existe un registro de 2 crías a finales de enero de 1984 (Padilla-Villavicencio 1990), pero estas crías pudieron haber sido prematuras.
Los nacimientos en el EPB comenzaron en fechas más tempranas, si se compara con las localidades más norteñas, por lo que parece cumplirse la clina latitudinal descrita por Temte et al. (1991). Con base en la regresión lineal propuesta por Temte et al. (1991), en función de la latitud para las colonias de México a Washington, la fecha media de nacimientos debería ser el 29 de marzo en el EPB; sin embargo, ocurrió el 5 de marzo, es decir, 24 días antes. Aunque este día se encuentra en el límite inferior del intervalo de confianza del 95% (27 de febrero a 28 de abril), este intervalo es demasiado amplio. En cambio, si se compara la fecha media de nacimientos para el EPB (31.77°N) con aquella para La Jolla, California (32.85°N), que se calculó a partir de datos publicados por La Jolla Friends of the Seals (2012), se obtiene que los nacimientos en ese sitio ocurrieron 12 días antes en 2012 (22 de febrero) que en el EPB. No parece cumplirse en este caso el gradiente latitudinal, que describe que la fecha media de nacimientos se produciría 4.1 días más tarde por grado de latitud hacia el norte (Temte et al. 1991). Además, parece haber un desfase entre la temporada de cría en el EPB y la temporada en la isla Todos Santos Sur, Baja California (31.8°N), ya que en 2013 la temporada de cría en el EPB continuó al menos 11 días más después de que la temporada hubiera finalizado en la isla Todos Santos (datos no publicados). En este caso se esperaría que en ambas zonas la temporada de nacimientos se produjera al mismo tiempo, debido a que se encuentran prácticamente a la misma latitud y, por tanto, están expuestas a las mismas horas de luz al día (fotoperiodo). Todo lo anterior podría indicar que la colonia de focas del EPB está reproductivamente aislada de la colonia de la isla. Este es el caso de las focas de Puget Sound, Washington, donde las diferencias en la temporalidad de los nacimientos entre colonias cercanas fueron atribuidas a diferencias genéticas importantes entre poblaciones (Huber et al. 2010). Se ha determinado que cada población de foca de puerto responde a un fotoperiodo específico que señala la reactivación del blastocisto y controla el momento de la implantación (Temte 1994). En la foca de puerto del Pacífico, la implantación del blastocisto se produce 283 días (rango: 274-291) antes del nacimiento (Temte 1994). Otro factor que podría apoyar que la colonia del EPB está aislada reproductivamente es que el fotoperiodo crítico al que responde esta colonia (entre 13.88 y 14.14 h de luz al día) no coincide con el fotoperiodo reportado para la foca de puerto de Washington a México (14.3 h de luz al día; Temte 1994).
Se estimó una duración de la temporada de cría de aproximadamente 9 semanas, 1 semana más que las 6 a 8 semanas reportadas para la especie (Bigg 1981). El número total de crías estimadas en 2012 fue de 35 crías, que coincide con los datos observados, ya que el máximo conteo de crías fue de 33 crías, y 2 crías habían muerto antes de este conteo. Debido a que el número de crías estimado fue semejante en ambos años (34 en 2011 y 35 en 2012), podría suponerse que la producción de crías se mantuvo constante en el EPB. Se estimó una duración de la lactancia de 3 semanas, que es menor que las 4 a 6 semanas reportadas para las colonias de P. v. richardii en Washington (Newby 1973) y en el sur de Columbia Británica (Cottrell et al. 2002). Esto puede deberse al disturbio por presencia humana al que están sometidas las focas en el EPB, como se pudo observar en el trabajo de campo. El disturbio puede provocar un aumento en la tasa de abandono de las crías (Jemison y Kelly 2001), lo que se refleja en una disminución del tiempo de lactancia. La disponibilidad de alimento antes y durante la temporada de cría también puede influir en la duración de la lactancia (Jemison y Kelly 2001).
Temporalidad y progresión de la muda de focas de puerto
La temporada de muda de P. v. richardii en el EPB se presenta de finales de abril a mediados de julio, antes que lo reportado para otros lugares localizados más al norte, como California (de mayo a junio; Stewart y Yochem 1994), Oregón (de julio a septiembre; Brown y Mate 1983), Washington y Canadá (de agosto a octubre; Stutz 1967), y Alaska (de julio a septiembre; Daniel et al. 2003). La temporada de muda parece seguir una clina latitudinal de sur a norte, lo que podría deberse a una respuesta al fotoperiodo (Mo et al. 2000) y a la conexión con la temporada reproductiva, la cual también presenta una clina latitudinal (Temte et al. 1991), ya que la muda en las hembras y los machos adultos se encuentra inhibida por hormonas sexuales (Thompson y Rothery 1987, Daniel et al. 2003). La etapa de premuda C en el EPB comienza a finales de marzo y concluye a principios de julio, pero en la isla Tugidak (Alaska) termina entre finales de agosto y principios de septiembre (Daniel et al. 2003), por lo que en esta etapa también se aprecia el gradiente latitudinal.
En el EPB, el patrón de muda inverso es el predominante. Sin embargo, en otros lugares de la distribución de P. v. richardii situados a latitudes más altas, como Canadá (Stutz 1967) y Alaska (Ashwell-Erickson et al. 1986, Daniel et al. 2003), el patrón de muda de las aletas y la cabeza al tronco es el predominante. Este último patrón también se ha observado en la subespecie P. v. vitulina del suroeste de Irlanda, aunque en esta zona se ha observado una mayor proporción de individuos que presentan el patrón de muda inverso (48%, Cronin et al. 2014). En otras especies de fócidos se piensa que esta diferencia en la progresión de la muda podría deberse al estado nutricional de los individuos (Lydersen et al. 2000). En este estudio no se vio que las focas que presentaban el patrón de muda inverso tuvieran una mala condición corporal en comparación con las que presentaban el otro patrón. Una posible explicación sobre la predominancia del patrón de muda inverso en el EPB puede estar relacionada con diferencias en la temperatura ambiental. Se ha observado, por medio de termografía infrarroja, que al encontrarse en tierra, las focas comienzan a elevar su temperatura en la región de la cabeza, cuello y aletas posteriores cuando la temperatura ambiental es baja (5-12 °C; Mauck et al. 2003). A pesar de que ocurre lo mismo a altas temperaturas ambientales, las zonas de liberación de calor se extienden hacia el cuerpo y, si las focas permanecen suficiente tiempo fuera del agua, las zonas de alta temperatura en el tronco del cuerpo superan a las de la cabeza, el cuello y las aletas (32-36 °C; Mauck et al. 2003). Debido a que la epidermis necesita de una alta temperatura para la regeneración folicular (Boily 1995), las diferencias en la temperatura ambiental entre las colonias podrían determinar la progresión de la muda. Es decir, las latitudes bajas, donde las temperaturas ambientales son altas, favorecerían un patrón de muda del tronco hacia la periferia (cabeza y aletas; patrón de muda inverso), y las latitudes altas, donde las temperaturas ambientales son bajas, favorecerían un patrón de muda de la cabeza y las aletas hacia el tronco.
Variación temporal de abundancia de focas de puerto en tierra
Las máximas abundancias de P. v. richardii en tierra se han encontrado durante las temporadas de cría y de muda (Brown y Mate 1983, Jemison y Kelly 2001), lo cual parece coincidir con este estudio en cuanto al número total de individuos en tierra en estas temporadas. Sin embargo, al examinar el número de individuos adultos e inmaduros (destetados, añeros y subadultos) en tierra, es sólo durante la temporada de muda cuando se puede encontrar a más del 50% de la colonia en tierra. Esto indica que la alta abundancia de individuos en tierra durante la temporada de cría en el EPB se debe precisamente a las crías.
En el EPB, el periodo de mayor abundancia de individuos adultos e inmaduros de P. v. richardii fue la temporada de muda, al igual que lo reportado para el sur de California (Stewart y Yochem 1994) y Alaska (Daniel et al. 2003). Esto se debe a que los individuos que van a mudar pasan más tiempo en tierra (Daniel et al. 2003). Los individuos posiblemente utilizan su estancia en tierra como una estrategia para conservar energía, debido a los gastos energéticos requeridos durante la muda para mantener la alta temperatura que necesita la epidermis al realizar este proceso (Boily 1995), la cual se puede alcanzar mejor estando en tierra (Feltz y Fay 1966). Después de completar la muda, los individuos vuelven a pasar más tiempo en el agua alimentándose (Stewart y Yochem 1994), lo que puede explicar la tendencia de la abundancia a disminuir al final de la temporada de muda. Además, el mayor porcentaje de individuos en tierra se encuentra entre la máxima proporción de individuos en premuda C y la máxima proporción de individuos en muda. Por lo tanto, si se quiere estimar la abundancia de esta población, sería recomendable realizar los conteos en este periodo de tiempo (del 5 de mayo al 10 de junio). También se debe considerar hacer los conteos durante la marea baja, que es cuando más focas tienden a estar fuera del agua, y, en el EPB, en los días en los que la marea baja coincida con las primeras horas de luz, cuando hay menos presencia humana en las playas.
En resumen, en este trabajo se determinó que la temporada de cría de P. v. richardii en el EPB comienza a mediados de febrero y finaliza a mediados de abril, mientras que la temporada de muda inicia a finales de abril y termina a mediados de julio. El patrón de muda predominante fue el inverso, de tronco a cabeza y aletas. La mayor abundancia de individuos adultos e inmaduros en tierra se encontró durante la temporada de muda, de forma que el momento óptimo para realizar conteos y estimar la abundancia de P. v. richardii en el EPB es de principios de mayo a principios de junio.











 text in
text in 


