Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.42 no.3 Ensenada sep. 2016
https://doi.org/10.7773/cm.v42i3.2594
Artículos
Modelización del impacto bentónico de los residuos particulados provenientes de una granja de doradas (Sparus aurata) durante un ciclo completo de cultivo
1 Centre Internacional d'Investigació dels Recursos Costaners (CIIRC), c/ Jordi Girona 1-3, Mòdul D1, 08034 Barcelona, Spain.
2 Laboratori d'Enginyeria Marítima (LIM-UPC), Universitat Politécnica de Catalunya-BarcelonaTech, c/ Jordi Girona 1-3, Mòdul D1, 08034 Barcelona, Spain.
3 Universidad de Los Lagos (ULAGOS), Camino Chinquihue Km. 6, Puerto Montt, Chile.
La relación entre la acuicultura y calidad del agua juega un rol determinante tanto en el volumen y calidad de la producción acuícola como en los impactos de la acuicultura en el medio marino. La capacidad natural de asimilación del cuerpo de agua puede ser insuficiente para adaptarse a la entrada continua de residuos procedentes de granjas piscícolas. Su impacto no depende sólo de los residuos vertidos, sino también de otros factores tales como la hidrodinámica local o los patrones de alimentación de la especie cultivada. En este estudio se combina un modelo hidrodinámico con uno de transporte para simular la deposición de residuos particulados (heces y alimento no comido) procedentes de una granja de doradas en el Mediterráneo occidental durante los 17 meses de cultivo, teniendo en cuenta las variaciones naturales de la alimentación de los peces durante este periodo. Los resultados confirman que las mayores concentraciones bénticas de materia orgánica y nutrientes se producen en un radio de 100-500 m desde las jaulas, dependiendo del tipo de partícula y de las corrientes. La combinación de un periodo de simulación largo y patrones de circulación realistas subraya la importancia de considerar la variabilidad de las corrientes a largo plazo para evaluar el impacto ambiental de granjas de peces, y destaca las limitaciones de las actuales prácticas simplistas de evaluación del impacto.
Palabras clave: residuos particulados; modelado 3D; Sparus aurata; ciclo completo de cultivo; evaluación de impacto
The relationship between aquaculture activities and water quality plays an important role in determining the volume and quality of production as well as the impact of aquaculture on the aquatic environment. The natural assimilation capacity of a waterbody is often insufficient to cope with the continuous input of wastes from fish farms. Their impact depends not only on the waste itself, but also on other factors such as the local hydrodynamics at the farm site or the cultured species' feeding pattern. We combine a hydrodynamic model with a transport code to simulate the deposition of fecal pellets and uneaten feed from a gilthead seabream farm in the western Mediterranean Sea. The simulation spans a full 17-month rearing cycle and considers the natural variations in the feed demand of the fish during this period. The results indicated that the maximum benthic concentrations of organic matter and nutrients were found within a 100-500 m distance from the cages, depending on the type of particulate waste and on the local current characteristics. The combination of a long simulation period and realistic hydrodynamic patterns highlights the importance of considering long-term current variability when assessing the environmental impact of fish farms, and stresses the limitations of current simplistic assessment practices.
Key words: particulate wastes; 3D modeling; Sparus aurata; full rearing cycle; loading assessment
Introducción
La interacción entre la acuicultura y calidad de agua es un tema ampliamente conocido. Mientras que el volumen y la calidad de la cosecha, e incluso la viabilidad de la granja, dependen de la calidad del agua en la que se encuentra ubicada, las actividades de cultivo de peces son también una fuente potencial de deterioro de la calidad del agua, debido al aporte de diferentes tipos de materias y sustancias al medio acuático. Éstas pueden incluir estructuras plásticas y metálicas, alimento no consumido, productos metabólicos, productos químicos, microorganismos, parásitos, o animales asilvestrados (Soto et al. 2001, Hindar et al. 2006, León 2006, Mente et al. 2006). Varios estudios han identificado la introducción en el medio acuático de residuos que contienen materia orgánica y nutrientes (principalmente nitrógeno y fósforo), provenientes del alimento no comido, las partículas fecales y las excreciones líquidas de los peces, como la causa más evidente del impacto ambiental producido por las granjas de cultivo de peces en jaulas (ver referencias en Maldonado et al. 2005, Ruiz et al. 2010).
Con la perspectiva de una industria en continuo crecimiento (FAO 2014), es fundamental avanzar en el conocimiento de cómo esta actividad puede afectar a un determinado cuerpo de agua, de tal forma que los beneficios económicos y sociales vinculados al desarrollo de la acuicul-tura se logren de manera sostenible, sin poner en peligro los recursos acuáticos naturales.
La evaluación del impacto ambiental de las piscifactorías es una tarea compleja debido al gran número de variables (climáticas, hidrográficas, biológicas, tecnológicas y sociales) que intervienen, y a menudo para ello se utilizan simulaciones numéricas. Por esta razón, recientemente se han desarrollado muchos modelos numéricos centrados principalmente en el impacto bentónico sobre las áreas cercanas a las granjas. Gowen y Bradbury (1987) desarrollaron un modelo simplificado para estimar el área afectada por el alimento no comido y las partículas fecales en un cuerpo de agua con circulación barotrópica; este modelo fue posteriormente mejorado y actualizado por Gowen et al. (1989, 1994), al incluir una batimetría más realista y un campo de corrientes tridimensional (3D). Ervik et al. (1997) presentaron el sistema MOM (Modelling-Ongrowing fish farms-Monitoring) que puede utilizarse para ajustar el impacto local de las piscifactorías marinas a la capacidad de carga de los cuerpos de agua. Panchang et al. (1997) utilizaron un modelo hidrodinámico y uno de transporte para simular la dispersion de residuos particulados en la costa de Maine (EUA). Cromey et al. (2002a) desarrollaron DEPOMOD, el cual predice el patrón de deposición de los residuos sólidos sobre el fondo marino y permite estimar los cambios resultantes sobre las comunidades bentónicas. Doglioli et al. (2004) acoplaron el modelo hidrodinámico POM y el modelo lagrangiano LAMP3D para simular el transporte 3D de nutrientes disueltos, las partículas fecales y el alimento no comido en el mar de Liguria (Italia). Skogen et al. (2009) utilizaron el sistema NORWECOM para reproducir los efectos de la salmonicultura en un fiordo de Noruega. Finalmente, Symonds (2011) y Moreno et al. (2011) combinaron códigos hidrodinámicos con módulos de transporte lagrangianos para simular la dispersión de residuos de piscifactorías en zonas dominadas por la marea durante cortos periodos de tiempo (15 días). Una descripción de éstos y otros modelos desarrollados en este campo se puede encontrar en Chaperón (2015).
Muchos de estos modelos han sido implementados en condiciones muy simplificadas (e.g., batimetría y/o hidrodinámica sencilla, generación constante de residuos, etc.), dando como resultado una descripción muy simple y poco realista del sistema. Como ejemplo, sólo Skogen et al. (2009) utilizaron un campo de corriente totalmente 3D para simular el transporte de los residuos de piscifactorías, mientras que los otros utilizaron un esquema hidrodinámico 2DH o cuasi 3D, o corrientes constantes o uniformes obtenidas de mediciones puntuales.
En este estudio se intenta ir un paso más allá utilizando un modelo hidrodinámico completamente 3D junto con un código de transporte lagrangiano para simular el impacto de los residuos sólidos generados en una piscifactoría de doradas en el Mediterráneo occidental, considerando los cambios en el ritmo de alimentación de los peces (y, por lo tanto, en la producción de residuos) durante todo el ciclo de cultivo, que es, aproximadamente, de 17 meses. Este estudio se centra únicamente en los procesos físicos de transporte, y no considera otros procesos tales como fraccionamiento y reminerali-zación de materia orgánica (e.g., Cromey et al. 2002b), o el uso de materia orgánica por parte de varios organismos para generar biomasa viva (e.g., Karakassis et al. 2000).
Materiales y métodos
Área de estudio
El estudio está centrado en una subregión del golfo de Valencia de 113 x 280 km2, en la costa del Mediterráneo español (Fig. 1), entre 37.8°N-40.4°N y 0.6°W-0.7°E. La profundidad máxima dentro de este dominio es de unos 1,400 m. El análisis de los datos de un correntómetro pertenecientes a la red de observaciones de aguas profundas de Puertos del Estado (Administración Portuaria Nacional), ubicada dentro del área de estudio (39.46°N, 0.26°W), permite identificar las características hidrodinámicas y meteorológicas de la región. Las corrientes dominantes del SSW, con velocidades máximas de 30-35 cm s-1, son impulsadas por la circulación de mesoescala (Castellón et al. 1990), aunque también es importante el flujo de agua en la dirección opuesta. La salinidad es relativamente estable alrededor de 38, mientras que la temperatura del agua fluctúa entre un mínimo de 13 °C en febrero y un máximo de 28 °C en julio.

Figura 1 Mapa del área de estudio que incluye la posición de la piscifactoría considerada y la ubicación de la boya de aguas profundas de Puertos del Estado. Las líneas punteadas muestran los 3 dominios computacionales utilizados para las simulaciones.
Dentro de esta área, se ha estudiado la acumulación sobre el fondo marino de los residuos particulados provenientes de una piscifactoría ubicada en el golfo de Valencia. Esta piscifactoría (piscifactoría S en Fig. 1; 39.0284°N, 0.1272°W) selocaliza a 6.4 km de la costa, donde la profundidad del agua es de aproximadamente 40 m. Está compuesta por 42 jaulas circulares de 16 m de diámetro y 10 m de profundidad, distribuidas en una superficie de 0.5 km2. La especie cultivada es la dorada (Sparus aurata) y se supone una producción anual de 500 t. Éstas son las características de una granja de doradas que existió en el lugar, pero que actualmente está fuera de operación.
Modelos numéricos
Se utilizaron 2 modelos para realizar las simulaciones. El primero, usado para la modelización hidrodinámica, es la version AGRIF (Blayo y Debreu 1999) del modelo de superficie libre en diferencias finitas ROMS (Shchepetkin y McWilliams 2005), el cual resuelve las ecuaciones primitivas usando una simplificación de Boussinesq y una hipótesis hidrostática. Para evaluar la validez del modelo numérico, las corrientes proporcionadas por ROMSAGRIF en el periodo de diciembre de 2004 a noviembre de 2005 fueron comparadas cualitativamente con los datos medidos por la boya de Puertos del Estado. Desafortunadamente, y puesto que sólo se dispone de información estadística sobre estas medidas (rosas de corrientes e histogramas de frecuencia), no fue posible realizar una comparación cuantitativa.
La dispersión de los residuos particulados provenientes de la piscifactoría (partículas fecales y exceso de alimento) fue simulada utilizando el modelo lagrangiano LIMMIX (Mestres 2002), el cual dispersa las partículas de acuerdo con diferentes mecanismos de transporte mediante la resolución de una versión discretizada de la ecuación 3D de Fokker-Planck. Este modelo ha sido aplicado con éxito a varios escenarios (Mestres et al. 2003, 2010).
Caracterización de los residuos de la piscifactoría
El volumen diario de residuos particulados generados en la granja durante los 17 meses de cultivo fue estimado utilizando los coeficientes de alimentación (peso de alimento por cada 100 kg de biomasa) obtenidos experimentalmente por Mingarro (2004) para un cultivo intensivo de doradas en aguas del Mediterráneo (Fig. 2). Estos coeficientes fueron corregidos bajo el supuesto de que aproximadamente un 5% del alimento introducido a las jaulas no es consumido por los peces. Este porcentaje es considerado como un valor típico para el alimento no consumido (Vassallo et al. 2006), aunque en la actualidad este porcentaje puede variar de valores más pequeños para piscifactorías de salmón Atlántico altamente tecnificadas hasta 20% para piscifactorías más pequeñas y con menos tecnología.

Figura 2 (Panel superior) Variación estacional del fotoperiodo (línea discontinua) y de la temperatura (línea continua). (Panel inferior) Peso corporal (barras), alimento consumido (○) y tasa de conversión (FCR, ●) para los peces cultivados durante un periodo experimental completo (adaptado de Mingarro 2004).
La masa y composición de los residuos orgánicos se calcula a partir de la masa total de alimento suministrado (M) y del aumento de peso de la biomasa (ΔB), en términos de porcentaje. Basándose en varios autores (Wallin y Hakanson 1991, Findlay y Watling 1994, Lupatsch y Kissil 1998, Doglioli et al. 2004), se puede considerar que el contenido de N, P y C orgánico en el alimento es de 6.5%, 1.3% y 45%, respectivamente. Según Meske y Manthey (1983) y Doglioli et al. (2004), la cantidad de N y P que queda retenida en el pez es, respectivamente, el 3% y 0.4% del aumento de peso del pez. Con estos valores y recordando que el 5% del alimento suministrado no es comido por los peces, se puede estimar la cantidad de N y P introducido al medio acuático en forma de alimento no consumido y productos excretados.
Además, el 78% del N y el 27% del P de los productos excretados se encuentra en forma de materia disuelta, mientras que las cantidades restantes se encuentran en forma de materia particulada (Lupatsch y Kissil 1998). Introduciendo subíndices para identificar la masa de un determinado nutriente que es consumido (c), no consumido (u), retenido en la biomasa (B), o excretado (exc) en forma de materia disuelta (d) o particulada (p), las relaciones anteriores pueden expresarse como las siguientes ecuaciones:
donde
Por otra parte, suponiendo que las partículas fecales contienen un 28% de carbono (Findlay y Watling 1994) y que la producción diaria de estos residuos es de 1.9 g por kilógramo de biomasa (Dudley et al. 2000), la cantidad diaria de C introducido al medio puede ser estimada como
Esta cuantificación está basada en la composición y digestibilidad de un alimento típico, pero los porcentajes exactos y las tasas de asimilación dependen del alimento y podrían dar lugar a fracciones metabolizados y excretadas levemente diferentes.
Otro factor que se debe considerar es la velocidad de sedimentación de las partículas fecales y de alimento no consumido. Las partículas de alimento no consumido caen aproximadamente 3 veces más rápido que las partículas fecales (Gowen et al. 1989), pues las velocidades de sedimentación son entre 6 y 14 cm s-1 para partículas de alimento (Panchang et al. 1997, Doglioli et al. 2004, Vassallo et al. 2006, Piedecausa et al. 2009), y entre 0.05 y 7.5 cm s-1 para partículas fecales (Panchang et al. 1997, Doglioli et al. 2004, Piedecausa et al. 2009). Con base en estos estudios, las velocidades de sedimentación consideradas en este documento fueron 10 cm s-1 para las partículas de alimento no consumido y 2 cm s-1 para las partículas fecales, a lo largo de toda la simulación. Estas velocidades, sin embargo, deberían cambiar en el tiempo ya que el aumento del tamaño de los peces produce cambios en su dieta (requiriendo diferentes partículas de alimento) y también genera partículas fecales más grandes.
Configuración de las simulaciones
Se definieron 3 dominios computacionales anidados (Fig. 1) que permitieron aumentar la resolución horizontal desde 1,730 m (1/50°, compatible con los datos de forzamiento climatológico) hasta una resolución de aproximadamente 187 m, lo cual permitió una descripción detallada de la zona de estudio. En la dirección vertical, todos los dominios fueron discretizados en 20 capas σ. Para la mezcla horizontal se escogió un esquema laplaciano, mientras que la mezcla vertical se describió utilizando una aproximación paramétrica LMD. Para las variables 2DH y 3D se utilizaron las condiciones de contorno abiertas de Flather y Orlanski, respectivamente. Para estas simulaciones, la batimetría se obtuvo de la base de datos ETOPO2v2 (National Geophysical Data Center 2006), la temperatura y salinidad del agua se obtuvieron de la base de datos WOA05 (Antonov et al. 2006, Locarnini et al. 2006), y la marea y los forzamientos climatológicos superficiales se obtuvieron de las bases de datos TPX06 (Egbert y Erofeeva 2002) e ICOADS (Woodruff et al. 2011), respectivamente. El periodo simulado se extendió por 17 meses (desde marzo de 2004 hasta julio de 2005) entregando un promedio diario de corrientes 3D, así como distribuciones de temperatura y salinidad.
Para modelar la dispersión de residuos, se realizaron simulaciones independientes para el alimento no comido y para las partículas fecales. Para el alimento no comido, las partículas fueron liberadas en las jaulas cada 60 s, en tanto que para las partículas fecales, las partículas se liberaron cada 300 s. El número de partículas liberadas en cada paso depende de un patrón de alimentación predefinido que supone que el alimento fue proporcionado 2 veces al día durante los meses cálidos (mayo a octubre) y 1 vez al día durante los meses fríos (Mingarro, 2004). Se supuso también que la producción de las partículas fecales empezó inmediatamente después del periodo de alimentación y duró 1 h. La cantidad de alimento suministrado fue constante para cada mes, y se definió teniendo en cuenta la Figura 2 y la producción final prevista de 500 t (Fig. 3). Todos los detalles de las modelaciones pueden encontrarse en Chaperón (2015).
Resultados
En la Figura 4 se comparan las corrientes modeladas con las corrientes medidas en la boya de Puertos del Estado entre diciembre de 2004 y noviembre de 2005. Aunque en general se observa similitud entre ambos tipos de datos para la magnitud y direcciones predominantes de la corriente, se puede ver que los resultados del modelo tienden a sobrestimar la velocidad y frecuencia de los flujos en dirección WSW; sin embargo, las direcciones del flujo principal (i.e., SSW-S y N-NE) están bastante bien reproducidas. Estas discrepancias se pueden atribuir a varios factores, tales como la baja resolución vertical de la grilla, y al hecho de que el modelo fue inicializado y forzado con datos climatológicos en lugar de datos medidos. Teniendo en cuenta esto, se considera que los resultados del modelo hidrodinámico son aceptables para los propósitos de este estudio.

Figura 4 Rosas de corrientes (arriba) e histogramas de frecuencia (abajo) en la posición de la boya de Puertos del Estado para el periodo de diciembre de 2004 a noviembre de 2005. Datos medidos por la boya (izquierda) y datos modelados por ROMS_AGRIF (derecha). Ws denota la velocidad de la corriente.
La Figura 5, basada en la Figura 3, muestra la evolución temporal del C y los nutrientes que ingresaron al medio acuático a través de la materia fecal y el alimento no comido durante el periodo de simulación. El aporte de masa a través del alimento no comido siempre es menor que el aporte debido a las partículas fecales. Esto fue particularmente cierto para C durante la segunda mitad del ciclo de cultivo, en la cual la fracción de C fecal puede ser hasta un 91% del total (con un promedio global del 74.5%). Ambos nutrientes muestran un comportamiento muy similar, con un aporte a través de las partículas fecales que se encuentra entre 37.5% y 78.5% del N total (con un promedio de 71.89%), y entre 50% y 100% del P total (con un promedio de 85.7%).
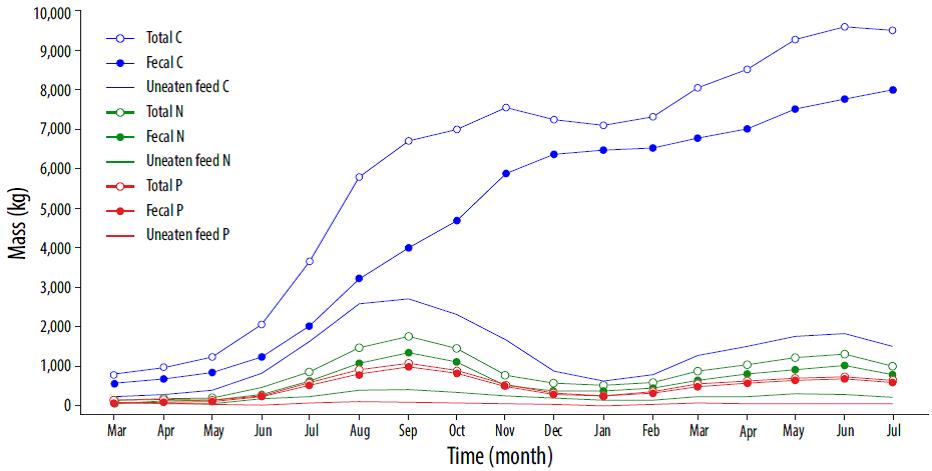
Figura 5 Materia orgánica (C) y nutrientes (N y P) vertidos mensualmente desde la piscifactoría durante los 17 meses del ciclo de cultivo.
La Figura 6 (arriba) muestra el crecimiento, a lo largo del tiempo, del área del fondo marino que es afectada por la deposición de partículas fecales y partículas de alimento no comido. En la Figura 6 (abajo) se muestra la forma y extensión del área afectada en diferentes instantes de la simulación. Al final de la simulación (día 510), los resultados muestran que la acumulación de partículas de alimento no comido debajo y alrededor de la piscifactoría cubre un área de aproximadamente 0.6 km2. En tanto, el área cubierta por las partículas fecales en el mismo instante es de aproximadamente 1.7 km2 (más de 2.5 veces la superficie afectada por el alimento no comido). Aunque da la impresión que después de los 3 meses (día 90) el área total afectada por las partículas fecales no experimenta cambios, en realidad existe un aumento gradual después del día 180, que llega hasta un 30% (Fig. 6, arriba). Este aumento puede estar asociado a la aparición de condiciones oceanográficas típicas de otoño e invierno alrededor del día 210, lo cual provoca cambios en la dirección predominante de las corrientes. Esto produjo un desplazamiento hacia el este del área de deposición tanto de partículas fecales como de partículas de alimento no comido (Fig. 6, abajo). Centrándose en las jaulas individualmente, la deposición de las partículas está principalmente orientada en dirección NNW-S, y coincide con las direcciones dominantes del flujo (Fig. 4). Además, las partículas de alimento no comido se depositan dentro de los 100 m de distancia desde las jaulas, mientras que las partículas fecales pueden alejarse hasta 500 m de las jaulas antes de depositarse en el fondo marino.

Figura 6 (Arriba) Área del fondo marino afectada por la deposición de residuos particulados provenientes de la piscifactoría durante todo el periodo de simulación. (Abajo) Forma y extensión del área afectada por el alimento no comido (izquierda) y por la materia fecal (derecha) en diferentes instantes de la simulación. Los puntos rojos muestran la posición de las jaulas de peces. Las letras A y B (abajo, derecha) indican las posiciones en las que se extrajeron valores para la Figura 7 (panel inferior).
Las Figuras 7 y 8 muestran la concentración total de C y P en el fondo marino, en la zona en que se encuentra la piscifactoría, bajo el supuesto de un comportamiento conservativo en el cual los cambios en la concentración se deben únicamente a los procesos físicos de transporte. Durante los primeros meses, para ambos elementos, los valores altos de concentración se encuentran en zonas debajo o muy cerca de los grupos de jaulas (entre 50 y 100 m), debido a que las condiciones de verano con corrientes más débiles depositan las partículas a distancias relativamente cortas de la fuente de vertido. Como el campo de corrientes se torna más energético al final del verano, las zonas de máxima concentración se alejan de las jaulas y aumenta la extensión del fondo marino afectado por la deposición de los residuos. El hecho que la mayor parte de los nutrientes y, particularmente, la materia orgánica que llega al fondo marino proviene de las partículas fecales, las cuales son mucho más dispersivas que las partículas de alimento no comido, contribuye a intensificar los cambios en la distribución espacial de las partículas. Al final del periodo de 17 meses, las máximas concentraciones de C son aproximadamente de 1.2 kgm-2, mientras que la mayor parte de la superficie afectada presenta concentraciones menores que 0.4 kg m-2. La acumulación de N muestra una distribución espacial similar a la de C, aunque sus valores son un orden de magnitud más pequeños, entre un máximo de aproximadamente 0.14 kgm-2 y un valor de fondo de aproximadamente 0.01 kg m-2. Por último, la concentración de P varía de 0.10 kg m-2 cerca de las jaulas hasta valores mínimos por debajo 0.01 kg m-2 en la periferia de la superficie afectada.

Figura 7 (Arriba y centro) Distribución espacial de C en el fondo marino en 4 instantes diferentes durante el periodo de simulación (días 30, 150, 300 y 510). Note que la escala de color es diferente para cada figura. (Abajo) Concentración (línea continua) y flujo promedio diario (línea discontinua) de C en las 2 posiciones indicadas en el panel inferior de la parte derecha de la Figura 6.

Figura 8 Distribución espacial de P en el fondo marino en 4 instantes diferentes durante el periodo de simulación (días 30, 150, 300 y 510). Note que la escala de color es diferente para cada figura.
La Figura 7 (abajo) muestra la variabilidad temporal de la tasa promedio diaria de deposición de C en los puntos A y B de la Figura 6. En el punto A, muy cerca de las jaulas, la tasa es menor que 0.2 kg m-2 por día durante casi toda la simulación, excepto durante los últimos 2 meses, en los cuales es significativamente mayor hasta alcanzar un valor pico de 0.7 kg m-2 por día el mes 16 (día 480). Por otra parte, las tasas de deposición de C son mucho menores durante los primeros 10 meses, pero aumentan drásticamente entre los meses 11 y 17 hasta alcanzar un pico de aproximadamente 1.5kgm-2 por día el mes 14.
Estas diferentes tasas de deposición se reflejan en los valores de la concentración. La concentración de C en el punto A aumenta de manera constante durante los primeros 8 meses, permanece casi sin cambio entre los meses 8 y 15, y luego aumenta nuevamente en los últimos 60 días de la simulación. En el punto B (60 m más lejos de las jaulas que A), la concentración es significativamente menor en los primeros 10 meses (menos del 20% de la concentración en A entre los meses 5 y 10), pero aumenta drásticamente durante la segunda mitad del periodo de simulación (meses 10 a 17). Al final del ciclo de cultivo, la cantidad de C acumulado en el punto B es el doble que en el punto A, y hasta se triplica durante los meses 14 y 15.
Discusión
Los resultados muestran que la superficie del fondo marino afectada por la deposición de partículas de alimento no comido y partículas fecales puede ser hasta 3 veces más grande que el área ocupada por la piscifactoría, aunque la concentración de C y nutrientes (N y P) en esta región es generalmente pequeña. Las concentraciones más altas se encuentran relativamente cerca de las jaulas, dentro de un radio de aproximadamente 100 m, aunque esta distancia depende fuertemente de las características físicas de las partículas de residuos y, sobre todo, de la variabilidad de las corrientes marinas dominantes. La abundancia de C orgánico en el fondo marino modifica el potencial redox (haciéndolo más negativo, Morata et al. 2015) y, por tanto, aumenta el metabolismo de los sedimentos e incrementa el consumo de oxígeno, lo cual puede provocar una alteración en el tipo, la distribución y la actividad fisiológica de las comunidades bentónicas. Morata et al. (2015), por ejemplo, encontraron una notable disminución en la riqueza específica y un aumento de 9 veces en la abundancia debajo de una piscifactoría de doradas ubicada en el Mediterráneo noroccidental, similar a la considerada aquí, en comparación con una estación de control.
El modelo muestra también que las partículas fecales cubren un área más grande que las partículas de alimento no comido, que caen más cerca de los puntos de vertido, debido principalmente a su mayor velocidad de caída, pero también debido a otros factores como la profundidad local, la pendiente del fondo o la ausencia de corrientes de marea significativas. Combinando la evolución temporal de los distintos tipos de partículas con su composición química puede verse cómo, después de los primeros meses del ciclo de cultivo, el aumento en la concentración de nutrientes y, especialmente de material orgánico, se debe principalmente a las partículas fecales y no al alimento no comido, el cual contribuye de manera relativamente pequeña. Aunque se ha considerado que los nutrientes depositados en el fondo tienen un comportamiento conservativo, no se espera que la conclusión general cambie significativamente si se considerara un comportamiento no conservativo. Esto sugiere que el impacto en el fondo marino debido al alimento no comido es relativamente pequeño en comparación con el impacto debido a las partículas fecales, con lo cual, desde un punto de vista ambiental, resulta más útil aumentar la digestibilidad de los alimentos que mejorar los sistemas de alimentación para minimizar las pérdidas.
Estos resultados ponen de relieve algunas limitaciones de los protocolos usados normalmente para el control de la contaminación debido a la acuicultura. Éstos se basan en el análisis de muestras de sedimento tomadas en puntos predefinidos y en momentos específicos. Sin embargo, si no hay información a priori de dónde pueden acumularse los residuos, la selección de puntos de muestreo de fácil acceso pero representativos de la contaminación podría ser una tarea difícil de cumplir. A menudo, el muestreo es reemplazado por estimaciones basadas en modelos simplificados (e.g., datos de corrientes con mediciones de un solo día, producción de residuos con tasa constante o batimetría uniforme), lo cual entrega una descripción demasiado simple del problema real. Sin embargo, y en contraposición a este tipo de enfoque, las Figuras 6 y 7 (abajo) ilustran la importancia de considerar una hidrodinámica realista de largo plazo al estimar los efectos ambientales de las piscifactorías, ya que pueden encontrarse grandes diferencias en los impactos medidos en un conjunto fijo de puntos en diferentes instantes de tiempo.
El enfoque desarrollado en este documento muestra algunas novedades en lo referente a estudios de modelización anteriores. Detalles como la duración de la simulación, que abarca los 17 meses de un ciclo completo de cultivo, y la incorporación de la tasa de alimentación de los peces, que toma en cuenta tanto las variaciones diarias como estacionales, no han sido encontrados en los trabajos científicos revisados. Por otro lado, resultan evidentes algunas limitaciones de la metodología presentada. El uso de datos climatológicos globales para forzar el modelo hidrodinámico permite que el procedimiento sea aplicado en cualquier lugar, pero introduce una fuente de error que puede ser significativa. En el golfo de Valencia, las corrientes son gobernadas fuertemente por la topografía local, con lo cual los resultados del modelo y las observaciones son estadísticamente similares, pero esto podría no ser el caso en dominios más complejos. Las limitaciones en el código de dispersión (e.g., velocidad de sedimentación constante de las partículas, ausencia de resuspensión, comportamiento conservativo de materia orgánica y nutrientes ignorando el fraccionamiento, la remineralización y el efecto de otros organismos), junto con la validación del modelo, son temas que se abordarán en el futuro cercano.
A pesar de ello, la metodología presentada ha demostrado ser una herramienta potencialmente útil para ayudar en la planificación y el manejo de procesos relacionados con el monitoreo y control de la calidad del agua y el sedimento, asociados a las actividades de la acuicultura, lo cual optimizará las campañas de campo y los costos económicos.
Agradecimientos
El segundo autor está agradecido con la Comisión Nacional de Investigación Científica y Tecnológica (CONICYT, Chile) por la ayuda económica prestada, y con la Universidad de Los Lagos por el periodo sabático otorgado para completar esta investigación. Se reconoce el permanente apoyo brindado por la Secretaria d'Universitats i Recerca del Dpt. d'Economia i Coneixement de la Generalitat de Catalunya (ref 2014SGR1253).
REFERENCIAS
Antonov JI, Locarnini RA, Boyer TP, Mishonov AV, Garcia HE. 2006. World Ocean Atlas 2005. Vol. 2: Salinity. Levitus S (ed.), NOAA Atlas NESDIS 62. US Government Printing Office, Washington, DC. [ Links ]
Blayo E, Debreu L. 1999. Adaptive mesh refinement for finite-difference ocean models: First experiments. J. Phys. Oceanogr. 29: 1239-1250. [ Links ]
Castellón A, Font J, García E. 1990. The Liguro-Provençal-Catalan current (NW Mediterranean) observed by Doppler profiling in the Balearic Sea. Sci. Mar. 54(3): 269-276. [ Links ]
Chaperón WB. 2015. Modelización 3D de la dispersión de residuos generados en piscifactorías marinas. PhD thesis, Universitat Politécnica de Catalunya-Barcelona Tech, Barcelona, Spain. [ Links ]
Cromey CJ, Nickell TD, Black KD. 2002a. DEPOMOD. Modelling the deposition and biological effects of waste solids from marine cage farms. Aquaculture 214: 211-239. [ Links ]
Cromey CJ, Nickell TD, Black KD, Provost PG, Griffiths CR. 2002b. Validation of a fish farm waste resuspension model by use of a particulate tracer discharged from a point source in a coastal environment. Estuaries 25(5): 916-929. [ Links ]
Doglioli A, Magaldi M, Vezzulli L, Tucci S. 2004. Development of a numerical model to study the dispersion of wastes coming from a marine fish farm in the Ligurian Sea (Western Mediterranean). Aquaculture 231: 215-235. [ Links ]
Dudley R, Panchang V, Newell C. 2000. Application of a comprehensive modeling strategy for the management of net-pen aquaculture waste transport. Aquaculture 187: 319-349. [ Links ]
Egbert GD, Erofeeva SY. 2002. Efficient inverse modelling of barotropic ocean tides. J. Atmos. Oceanic Technol. 19: 183-204. [ Links ]
Ervik A, Hansen PK, Aure J, Stigebrandt A, Johannessen P, Jahnsen T. 1997. Regulating the local environmental impact of intensive marine fish farming I. The concept of the MOM system (Modelling-Ongrowing fish farms-Monitoring). Aquaculture 158: 85-94. http://dx.doi.org/10.1016/S0044-8486(97)00186-5 [ Links ]
[FAO] Food and Agriculture Organization. 2014. The State of World Fisheries and Aquaculture 2014. Opportunities and Challenges. Food and Agriculture Organization of the United Nations, Rome, Italy, 223 pp. [ Links ]
Findlay R, Watling L. 1994. Towards a process level model to predict the effects of salmon net-pen aquaculture on the benthos. In: Hargrave BT (ed.), Modelling Benthic Impacts of Organic Enrichment from Marine Aquaculture. Canadian Tech. Rep. on Fisheries and Aquatic Sciences, Department of Fisheries and Oceans, Ottawa, Canada, pp. 47-77. [ Links ]
Gowen RJ, Bradbury NB. 1987. The ecological impact of salmon farming in coastal waters: A review. Oceanogr. Mar. Biol. 25: 563-575. [ Links ]
Gowen RJ, Bradbury NB, Brown JR. 1989. The use of simple models in assessing two interactions between fish farming and the marine environment. In: de Pau EJ, de Pau NWN (eds.), Aquaculture : A Biotechnology in Progress. European Aquaculture Society, Bredene, Belgium, pp. 1071-1080. [ Links ]
Gowen RJ, Smyth D, Silvert W. 1994. Modelling the spatial distribution and loading of organic fish farm waste to the seabed. In: Hargrave BT (ed.), Modelling Benthic Impacts of Organic Enrichment from Marine Aquaculture . Canadian Technical Report on Fisheries and Aquatic Sciences, Department of Fisheries and Oceans, Ottawa, Canada, pp. 19-30. [ Links ]
Hindar K, Fleming IA, McGinnity P, Diserud A. 2006. Genetic and ecological effects of salmon farming on wild salmon: Modelling from experimental results. ICES J. Mar. Sci. 63(7): 1234-1247. [ Links ]
Karakassis I, Tsapakis M, Hatziyanni E, Papadopoulou KN, Plaiti W. 2000. Impact of cage farming of fish on the seabed in three Mediterranean coastal areas. ICES J. Mar. Sci. 57(5): 1462-1471. [ Links ]
León JN. 2006. Synopsis of salmon farming impacts and environmental management in Chile. Consultancy Technical Report. World Wildlife Fund Chile, Valdivia, Chile. [ Links ]
Locarnini RA, Mishonov AV, Antonov JI, Boyer TP, Garcia HE. 2006. World Ocean Atlas 2005, Volume 1: Temperature. Levitus S (ed.), NOAA Atlas NESDIS 61. US Government Printing Office, Washington, DC. [ Links ]
Lupatsch I, Kissil G. 1998. Predicting aquaculture waste from gilthead seabream Sparus aurata culture using a nutritional approach. Aquat. Living Resour. 11(4): 265-268. [ Links ]
Maldonado M, Carmona MC, Echeverría Y, Riesgo A. 2005. The environmental impact of Mediterranean cage fish farms at semi-exposed locations: Does it need a reassessment? Helgol. Mar. Res. 59: 121-135. [ Links ]
Mente E, Pierce GJ, Santos MB, Neofitou C. 2006. Effect of feed and feeding in culture of salmonids on the marine aquatic environment: A synthesis for European aquaculture. Aquacult. Int. 14: 499-522. [ Links ]
Meske C, Manthey M. 1983. Sarotherodon niloticum-tropical cichlids as food fish. Int. Fischwirt 30: 30-34. [ Links ]
Mestres M. 2002. Three-dimensional simulation of pollutant dispersion in coastalwaters. PhD thesis, Universitat Politécnica de Catalunya, Barcelona, Spain. [ Links ]
Mestres M, Sierra JP, Sánchez-Arcilla A, González del Río J, Wolf T, Rodríguez A, Ouillon S. 2003. Modelling of the Ebro River plume. Validation with field observations. Sci. Mar. 64: 379-391. [ Links ]
Mestres M, Sierra JP, Mosso C, Sánchez-Arcilla A . 2010. Modelling the sensitivity to various factors of shipborne pollutant discharges. Env. Model. Software 25(3): 333-343. [ Links ]
Mingarro M. 2004. Estrategias de alimentación y cultivo de la dorada (Sparus aurata). Regulación endocrina y estado inmunopatológico. PhD thesis, Universidad de Valencia, Spain. [ Links ]
Morata T, Falco S, Gadea I, Sospedra J, Rodilla M. 2015. Environmental effects of a marine fish farm of gilthead seabream (Sparus aurata) in the NW Mediterranean Sea on water column and sediment. Aquacult. Res. 46: 59-74. [ Links ]
National Geophysical Data Center. 2006. 2-minute Gridded Global Relief Data (ETOPO2) v2. National Geophysical Data Center, NOAA [accessed May 2013]. http://dx.doi.org/10.7289/V5J1012Q [ Links ]
Moreno J, Telfer T, Ross L. 2011. Application of 3D hydrodynamic and particle tracking models for better environmental management of finfish culture. Cont. Shelf Res. 31: 675-684. [ Links ]
Panchang V, Cheng G, Newell C. 1997. Modeling hydrodynamic sand aquaculture waste transport in coastal Maine. Estuaries 20(1): 14-41. [ Links ]
Piedecausa M, Aguado-Giménez F, García-García B, Ballester G, Telfer T. 2009. Settling velocity and total ammonia nitrogen leaching from commercial feed and faecal pellets of gilthead seabream (Sparus aurata L. 1758) and seabass (Dicentrarchus labrax L. 1758). Aquacult. Res. 40: 1703-1714. [ Links ]
Ruiz JM, Marco-Méndez C, Sánchez-Lizaso JL. 2010. Remote influence of offshore fish farm waste on Mediterranean seagrass (Posidonia oceanica) meadows. Mar. Environ. Res. 69(3): 118-126. [ Links ]
Shchepetkin AF, McWilliams JC. 2005. The regional oceanic modeling system (ROMS): A split-explicit, free-surface, topography-following-coordinate oceanic model. Ocean Model. 9: 347-404. [ Links ]
Skogen M, Eknes M, Asplin L, Sandvik A. 2009. Modelling the environmental effects of fish farming in a Norwegian fjord. Aquaculture 298: 70-75. [ Links ]
Soto D, Jara F, Moreno C. 2001. Escaped salmon in the Chiloe and Aysen inner seas, southern Chile: Facing ecological and social conflicts. Ecol. Appl. 11(6): 1750-1762. [ Links ]
Symonds A. 2011. A comparison between far-field and near-field dispersion modeling of fish farm particulate wastes. Aquacult. Res. 42: 73-85. [ Links ]
Vassallo P, Doglioli A, Rinaldi F, Beiso I. 2006. Determination of physical behaviour of feed pellets in Mediterranean water. Aquacult. Res. 37(2): 119-126. [ Links ]
Wallin M, Hakanson L. 1991. Nutrient loading models for the assessment of environmental effects of marine fish farms. In: Mackinen T (ed.), Marine Aquaculture and the Environment, Nord 22. Nordic Council of Ministers, Copenhagen, pp. 39-55. [ Links ]
Woodruff SD, Worley SJ, Lubker SJ, Ji Z, Freeman JE, Berry DI, Brohan P, Kent EC, Reynolds RW, Smith SR, Wilkinson C. 2011. ICOADS Release 2.5: Extensions and enhancements to the surface marine meteorological archive. Int. J. Climatol. 31(7): 951-967. http://dx.doi.org/10.1002/joc.2103 [ Links ]
Recibido: Octubre de 2015; Aprobado: Julio de 2016











 texto en
texto en 



