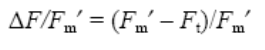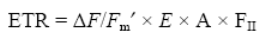Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.42 no.2 Ensenada jun. 2016
https://doi.org/10.7773/cm.v42i2.2587
Artículos
Actividad fotosintética estimada mediante fluorescencia in vivo de la clorofila a en macroalgas calcáreas rojas
1Departmento de Ecología y Geología, Facultad de Ciencias, Campus de Excelencia Internacional Andalucía Tech, Universidad de Málaga, 29071 Málaga, España.
2Centro de Estudios Avanzados, Universidad de Playa Ancha, Calle Traslaviña 450, Viña del Mar, Provincia de Valparaíso, Chile.
3Departamento de Botânica, Universidade Federal de Santa Catarina, 88040-970 Trindade, Florianópolis, Santa Catarina, Brazil.
4Programa de Investigación en Botánica Marina, Departamento de Biología Marina, Universidad Autónoma de Baja California Sur, Km 5.5 carretera al sur, Col. El Mezquitito, 23080 La Paz, Baja California Sur, México.
Resumen: La actividad fotosintética fue estimada, en 2 series experimentales, mediante la fluorescencia in vivo de la clorofila a en 2 algas rojas calcáreas: Neogoniolithon brassica-florida, que forma arrecifes de vermétidos con Dendropoma petraeum, y Lithophyllum margaritae (rodolitos). En la primera serie, vermétidos recolectados en el Parque Natural Cabo de Gata-Níjar (Almería, España) fueron incubados en mesocosmos a diferentes temperaturas: temperatura ambiental (T) y temperatura ambiental más 2 oC (T+). Las variaciones diurnas en el rendimiento cuántico efectivo estuvieron relacionadas con el incremento de irradiancia solar. La tasa de transporte de electrones (ETR) fue más alta en el tratamiento T+ que en T. La producción de oxígeno, estimada a partir de la ETR, fue mayor en N. brassica-florida del medio natural que en vermétidos incubados en mesocosmos o en el laboratorio. En la segunda serie experimental, L. margaritae con o sin epifauna (dominada por esponjas) fue recolectada en 2 sitios (Pedregoso y CFE) de la península de Baja California, México, a 2 profundidades (1 y 2 m). La ETR de rodolitos recolectados a 1 m de profundidad con epifauna asociada fue más alta que la de aquellos recolectados a 2 m de profundidad, indicando la importancia del incremento de la irradiancia sobre la producción fotosintética. La actividad fotosintética fue mayor en L. margaritae de Pedregoso, el lugar con mejor calidad de agua (alta trasparencia y baja contaminación) y con disponibilidad de sustrato rocoso. En CFE, la eficiencia fotosintética (α ETR) fue más alta en los rodolitos con epifauna. Los valores más altos de ETR para N. brassica-florida a T+ y de α ETR o ETR para L. margaritae con esponjas fijadas podrían ser explicados por el incremento de CO2 disponible para la fotosíntesis procedente de la respiración de la fauna asociada. En este trabajo se discute la utilidad de la fluorescencia in vivo de la clorofila a para estimar la fotosíntesis en macroalgas calcáreas en experimentos multifactoriales.
Palabras clave: fluorescencia in vivo de la clorofila a; algas rojas calcáreas; rodolitos; temperatura; vermétidos
Photosynthetic activity was estimated, in 2 different sets of experiments, as in vivo chlorophyll a fluorescence in 2 calcareous red macroalgae: Neogoniolithon brassica-florida, which forms vermetid reefs with Dendropoma petraeum, and the rhodolith-forming Lithophyllum margaritae. In the first set of experiments, vermetid reefs collected from the Cabo de Gata-Níjar Natural Park (Almería, Spain) were incubated for 6 months in outdoor mesocosms at 2 different temperatures: ambient temperature (T) and ambient temperature plus 2 oC (T+). Daily variations in effective quantum yields were related to the increase in solar radiation. Electron transport rate (ETR) was higher at T+ than at T. Oxygen production, estimated from ETR, was higher in N. brassica-florida growing in vermetid reefs in the coastal area than in those incubated in mesocosms or under laboratory conditions. In the second set of experiments, L. margaritae specimens with or without attached epifauna (mainly sponges) were collected at 2 sites (Pedregoso and CFE) on the Baja California Peninsula, Mexico, and at 2 depths (1 and 2 m). ETR values for rhodoliths collected at 1 m depth and with attached epifauna were higher than those for rhodoliths collected at 2 m depth, indicating the importance of greater incident radiation on photosynthetic activity. Photosynthetic activity was higher in L. margaritae collected from Pedregoso, the site with better water quality (high transparency and low pollution) and rocky substrate availability. In the CFE samples, the photosynthetic efficiency (αETR) was highest in rhodoliths with attached epifauna. The highest ETR values for N. brassica-florida at T+ and the highest αETR or ETR values for L. margaritae with attached sponges may be explained by the increase in CO2 available for photosynthesis due to the respiration of the associated fauna. The usefulness of in vivo chlorophyll a fluorescence for estimating photosynthetic production in calcareous macroalgae under multifactorial experiments is discussed.
Key words: in vivo chlorophyll a fluorescence; red calcareous macroalgae; rhodoliths; temperature; vermetids
Introducción
Entre las macroalgas, las rodófitas constituyen el grupo con la mayor diversidad en el mar. Las algas rojas calcáreas representan una alta proporción de especies dentro de este filo (Lüning 1990). De acuerdo con Kelaher (2002), las algas calcáreas contribuyen al mantenimiento de la estructura de las comunidades intermareales, ya que proporcionan refugio para muchos organismos, protegiéndolos contra la acción de las olas. Las algas coralinas son un grupo de algas ubicuas y son dominantes en las comunidades de arrecifes de coral (Littler 1973, Glynn 1996). Sin embargo, la abundancia de las algas coralinas en ambientes crípticos y sombreados ha sido ampliamente subestimada (Littler 1973). Las algas calcáreas pueden crecer tanto en aguas profundas (200 m de profundidad) en el límite de la zona fótica (0.0015 mol m-2 s-1) como en aguas superficiales expuestas a altos niveles de radiación fotosintéticamente activa (PAR, por sus siglas en inglés) y radiación ultravioleta (UV) (Littler et al. 1991, Payri et al. 2001). La producción primaria de las macroalgas coralinas incrustantes se considera alta debido a su gran abundancia, aunque la contribución a las tasas de producción de carbono orgánico es baja (Larkum y Wood 1993). Según Chisholm et al. (1990), la productividad orgánica posiblemente ha sido subestimada, ya que la mayoría de los estudios sobre la actividad fotosintética se han llevado a cabo con fuentes de luz artificial.
Con el objetivo de aumentar el conocimiento sobre el estado funcional de las macroalgas rojas calcáreas, se estimó la actividad fotosintética a través del uso de la fluorescencia in vivo de la clorofila a asociada al fotosistema II en muestras de macroalgas rojas calcáreas obtenidas de 2 comunidades en diferentes localidades geográficas: (1) Neogoniolithon brassica-florida (Harvey) Setchell y LR 1943 Mason, obtenida de arrecifes de vermétidos formados por Dendropoma petraeum (Prosobranchia, Mollusca) en Almería, en la costa mediterránea española, y (2) Lithophyllum margaritae (Hariot) Heydrich 1901, obtenida de rodolitos recolectados en 2 sitios de bahía Magdalena, Baja California Sur, México. Es de gran interés conocer las respuestas de las macroalgas rojas calcáreas a los cambios de las variables ambientales mediante experimentos sobre los efectos de la radiación solar y/o las variaciones de la temperatura sobre la productividad fotosintética, además de evaluar el efecto de animales asociados o fijados a las algas.
Los arrecifes de vermétidos están formados por gasterópodos marinos sésiles y macroalgas rojas calcáreas. El gasterópodo vermétido D. petraeum forma densas agregaciones cementadas por el alga roja N. brassica-florida a lo largo de la zona intermareal media en las zonas más cálidas del mar Mediterráneo, al sudeste de España. Ambas especies forman costras compactas y resistentes en zonas de aguas oligotróficas moderadamente expuestas y con bajas tasas de sedimentación (Calvo et al. 1998). A pesar de su importancia como constructores biogénicos, moduladores de los procesos costeros morfológicos, indicadores de los cambios del nivel del mar y promotores de hábitats ecológicos de la biodiversidad (Calvo et al. 1998), se han realizado muy pocos estudios sobre los arrecifes de vermétidos (Keen y Morton 1960). La mayoría de los estudios se han centrado en los gasterópodos (Milazzo et al. 2014) o en toda la comunidad, pero no se han encontrado estudios sobre las algas ni sobre las relaciones entre ambos organismos. En este contexto, es importante conocer los factores que afectan a las algas asociadas para entender cómo los cambios en el medio ambiente podrían afectar al esperado equilibrio en el arrecife. En este estudio, presentamos el efecto del aumento de la temperatura sobre la actividad fotosintética de N. brassica-florida asociada con D. petraeum recolectada en el Parque Natural Cabo de Gata-Níjar (Almería, España) (Fig. 1a).
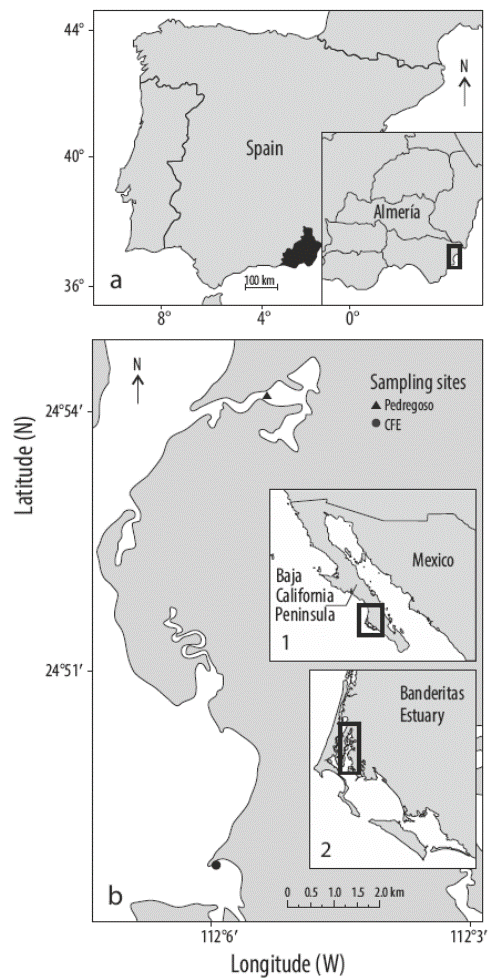
Figura 1 (a) Sitio de recolección de vermétidos (Dendropoma petraeum) con macroalgas rojas Neogoniolithon brassica-florida en el Parque Natural Cabo de Gata-Níjar (sur de España; 36º48´N, 2º03´W). (b) Sitios de recolección de rodolitos (Lithophyllum margaritae) en el estuario Banderitas dentro de bahía Magdalena (Baja California Sur, México). Recuadro 1: ubicación de bahía Magdalena (cuadro negro) en el noroeste de México. Recuadro 2: ubicación del estuario Banderitas (cuadro negro) dentro de bahía Magdalena.
Por otro lado, los rodolitos son algas coralinas no geniculadas de vida libre que forman extensas praderas en algunos fondos marinos. Constituyen importantes ecosistemas biogénicos carbonatados (Foster 2001) y son refugio para muchos organismos (Amado-Filho et al. 2007, Foster et al. 2007). Además sirven de alimento para especies de invertebrados y sostienen especies de importancia comercial en muchas áreas costeras (Kamenos et al. 2003, Steller et al. 2003). Sin embargo, el conocimiento fisiológico de esta comunidad de algas es escaso. A nivel geológico, las algas coralinas son muy importantes para mantener la estabilidad de las playas, ya que constituyen una de las principales fuentes de sedimentos de carbonato (Russell y Johnson 2000). En el golfo de California, los rodolitos forman extensas praderas y resisten condiciones físicas extremadamente variables como, por ejemplo, los altos cambios de temperatura de 8 a 32 ºC (Foster et al. 1997, Riosmena-Rodríguez et al. 1999). Lithophyllum margaritae es la especie formadora de rodolitos más abundante entre las especies coralinas no geniculadas de la región.
En este estudio, la hipótesis es que la actividad fotosintética de las algas calcáreas aumentará en las condiciones que favorezcan la tasa de respiración de los animales asociados a las macroalgas, lo que hará que el CO2 disponible para la fotosíntesis se incremente (i.e., el aumento de temperatura en el caso de D. petraeum [vermétidos] en la primera serie experimental o la presencia de epifauna [dominada por esponjas] en los rodolitos en el caso de la segunda serie experimental). Otras variables como la irradiancia y la disponibilidad de nutrientes también fueron consideradas.
Materiales y métodos
Muestreo
Especímenes de N. brassica-florida asociados a los arrecifes de vermétidos (D. petraeum) fueron recolectados en el Parque Natural Cabo de Gata-Níjar (Almería, España: 36º48´N, 2º03´W) (Fig. 1a) y fueron transportados, en tanques con temperatura controlada, a los mesocosmos de la Unidad de Microbiología, Ecofisiología y Genética de Organismos Acuáticos (UMEGOA) de la Universidad de Málaga. Se recolectaron 12 unidades de arrecifes de vermétidos de 10 × 10 cm2 de tamaño.
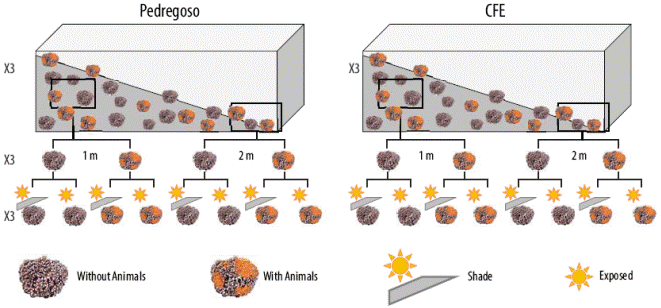
Por otro lado, se recolectaron muestras de L. margaritae en 2 sitios del estuario Banderitas, una laguna costera en bahía Magdalena situada en la vertiente del Pacífico de la península de Baja California, México: (1) Pedregoso (24º54´12´´N, 112º05´24´´W) y (2) CFE (24º48´45´´N, 112º05´59´´W) (Fig. 1b). En cada sitio, se muestrearon rodolitos a 2 profundidades (1 y 2 m) y se recolectó un total de 72 rodolitos, 36 cubiertos con epifauna (principalmente esponjas) y 36 sin epifauna epífita. Los experimentos de campo se llevaron a cabo en esta laguna costera.
Diseños experimentales y variables fisiológicas
Para las mediciones de fluorescencia, se utilizaron 2 fluorímetros diferentes: un equipo Water-PAM para las mediciones en mesocosmos al aire libre y para las mediciones in situ en la zona costera, y un equipo PAM-2000 para las mediciones de laboratorio. Ambos fluorímetros cuentan con luz roja como luz medida, pero la luz actínica es de color rojo en Water-PAM y suministrada por luz halógena en el caso del PAM-2000. Las características técnicas de estos fluorímetros pueden encontrarse en Figueroa et al. (2013).
Experimento 1
En el primer conjunto de experimentos realizados en España, el sistema de mesocosmos se compuso de 3 recipientes abiertos (0.094 m2 de área de superficie, 14 L de volumen) por tratamiento, conectados en paralelo a un tanque diferente de 102 L de capacidad. El flujo de agua entre cada cuadro y su depósito de cabecera fue de 0.84 ± 0.05 L min-1, lo que representa una tasa de renovación de 26 ± 1% h-1 (según Stengel et al. 2014) con un sistema de regulación de la temperatura del agua (Titán, Aqua Medic, Bissendorf, Alemania). Las muestras fueron incubadas en depósitos individuales al aire libre durante un período de 6 meses (de febrero a agosto de 2013) bajo condiciones solares seminaturales (EPAR [400-700 nm] reducida en un 37%; radiación UVA [320-400 nm] y UVB [280-320 nm] reducidas en un 41%) y a 2 temperaturas diferentes: temperatura ambiente (T) y temperatura ambiente incrementada 2 ºC (T+) (Fig. 2a, b). Las variables fisicoquímicas (pH y temperatura) fueron controladas diariamente en cada tanque con un sistema de control de AT T 2001 HC (Aqua Medic). La radiación solar incidente se midió constantemente con un radiómetro multifiltro NILU-UV6 (Geminali AS, Noruega). En general, la irradiancia incidente in situ se midió con un radiómetro U12- UV Zippo Hobo y la irradiancia incidente puntual se midió utilizando un sensor PAR esférico LI-COR en un radiómetro (Walz GmbH, Effeltrich, Alemania) (Quintano et al. 2013).

Figura 2 Fotografías de vermétidos en el sitio de recolección (Parque Natural Cabo de Gata-Níjar, sur de la Península Ibérica, España) (a) y en las cubetas eperimentales (b), y de rodolitos en contenedores experimentales sin epifauna (c) y con los animales fijados, predominantemente esponjas (d).
La actividad fotosintética estimada mediante el uso in vivo de fluorescencia de clorofila a se determinó para diferentes condiciones: en mesocosmos al aire libre, in situ y en el laboratorio.
En el caso de las condiciones en los mesocosmos al aire libre, los ciclos diarios de respuestas fotosintéticas fueron evaluados bajo radiación solar natural. El rendimiento cuántico efectivo (ΔF/Fm´) se midió con un fluorímetro Water-PAM aproximadamente cada 2 h durante 6 días con diferente intensidad de radiación (19 y 25 de abril, 3 y 29 de mayo, 18 de julio y 3 de agosto de 2013). Este parámetro se calcula como
donde Ft es la fluorescencia intrínseca de alga incubada en luz y Fm´ es la fluorescencia máxima alcanzada después de un pulso de saturación cuando la algas se incuban en luz. La tasa de transporte electrónico (ETR, por sus siglas en inglés; μmol electrones m-2 s-1) se calculó de acuerdo con Schreiber et al. (1995):
donde E es la irradiancia incidente PAR (μmol m-2 s-1 de fotones), A es la absorptancia del talo calculada como la fracción de la radiación incidente absorbida por las algas (ver Figueroa et al. 2003) y FII es la fracción de clorofila a relacionada con el fotosistema II (400-700 nm), que es de 0.15 en macroalgas rojas (Figueroa et al. 2014a). Los valores calculados a partir de los datos de los ciclos diarios de ETR fueron designados ETRcd y el valor máximo de ETR obtenido a partir de todos los datos de los ciclos diarios fue designado ETRmáx(cd).
En la zona costera donde estaban creciendo los organismos (Cabo de Gata-Níjar), se realizaron mediciones in situ de ΔF/Fm´ y ETR (ETRin situ) con el fluorímetro Water-PAM.
En el laboratorio, mediante el uso de un fluorímetro PAM-2000, se realizaron curvas rápidas de luz (RLC, por sus siglas en inglés), es decir, el ΔF/Fm´ frente a la irradiancia con una preincubación de la muestra durante 15 min en oscuridad. Cada réplica se sometió a un pulso de saturación con varios niveles progresivos de intensidades de luz durante 20 s en intervalos de 10 (55, 199, 258, 330, 488, 666, 891, 1260, 1830 y 2700 fotones μmol m-2 s-1). De las RLC, se obtuvo la máxima tasa de transporte electrónico (ETRmáx) a partir del ajuste de la función tangencial de acuerdo con Jassby y Platt (1976).
Los datos de ETRcd, ETRin situ y ETRmáx fueron convertidos en valores de producción de oxígeno con un factor de conversión de 0.1 (10 fotones necesarios para producir 1 mol de O2), de acuerdo con Williams y Robertson (1991) y como se describe por Kromkamp et al. (2008) para microalgas.
Experimento 2
En el experimento realizado en México, los rodolitos recolectados en Pedregoso y CFE (estuario Banderitas) se transportaron a una zona de sombra cerrada cerca de la orilla, y todos los talos fueron colocados en vasos de 4 L llenos de agua de mar (Fig. 3). Después de la aclimatación durante 6 h, los rodolitos fueron expuestos a 2 tratamientos: pleno sol y sombra (Figs. 2c, d; 3). Las RLC fueron evaluadas de acuerdo con Schreiber et al. (1995) utilizando un fluorímetro Water-PAM. La irradiancia solar se controló con 2 radiómetros U12-UV Zippo Hobo. Las muestras se colocaron en cámaras de 0.5 L y se incubaron durante 15 min en oscuridad para determinar el rendimiento cuántico máximo (Fv/Fm). Después de esto, las RLC se llevaron a cabo con 10 irradiaciones incrementales (7, 16, 23, 34, 51, 116, 166, 231, 315 y 564 μmol fotones m-2 s-1) a intervalos de 20 s en cada irradiancia. Los valores de ΔF/Fm´ y ETR se determinaron mediante el uso del fluorímetro Water-PAM de acuerdo con Figueroa et al. (2003), y se calcularon como se explica en el experimento 1. A partir de las RLC, los diferentes parámetros de ETR, tales como ETRmáx, la irradiancia de saturación (EkETR) y la pendiente inicial de ETR frente a la función de irradiancia (α ETR) como estimador de eficiencia fotosintética, se obtuvieron a partir de ajustes de la función tangencial de acuerdo con Eilers y Peeters (1988).
Análisis estadístico
Los efectos interactivos entre las variables fisiológicas se evaluaron mediante el análisis de varianza (ANOVA). En el caso de L. margaritae, el sitio, la profundidad y la presencia de animales se incluyeron como factores fijos para las variables fotosintéticas, y en el caso de N. brassica-florida asociada a los arrecifes de vermétidos, la temperatura y la ubicación se incluyeron como factores fijos para la tasa de producción de oxígeno. La homogeneidad de la varianza se probó mediante pruebas de Cochran y por inspección visual de los residuos. Se realizaron pruebas de Student-Newman-Keuls (SNK) después de encontrar interacciones significativas (ANOVA, Underwood 1997). Todos los datos se ajustaron a la homogeneidad de la varianza. Los análisis se llevaron a cabo con el programa SPSS v21 (IBM, EUA).
Resultados
Experimento 1
La temperatura del agua durante el periodo experimental fue de aproximadamente 19.0 ± 2.3 ºC en el tratamiento con T y 21.5 ± 2.3 ºC en el tratamiento con T+.
Los valores del ΔF/Fm´ obtenidos para N. brassicaflorida como parte de los vermétidos y N. brassica-florida incubada en mesocosmos al aire libre disminuyeron desde la mañana hasta el mediodía y aumentaron del mediodía a la tarde (Fig. 4a). La disminución fue mayor en los días con altas irradiancias diarias (Fig. 4b). La ETRmáx(cd) fue similar en el experimento con T+ (32.5 ± 0.65 μmol fotones m-2 s-1) y el experimento con T (29.4 ± 0.62 μmol fotones m-2 s-1). La producción de oxígeno estimada a partir de la ETRmáx en condiciones de laboratorio fue de 29 a 53 mmol O2 m-2 h-1 en el experimento con T y de 24 a 55 mmol O2 m-2 h-1 en el experimento con T+ (Tabla 1). Sin embargo, la producción de oxígeno estimada a partir de los valores de ETRmax (cd) en condiciones al aire libre fue mayor en el experimento con T+ que en el experimento con T (Tabla 1); la producción de oxígeno estimada para los mesocosmos bajo radiación solar (48-196 mmol O2 m-2 h-1) fue aproximadamente 2 veces mayor que la producción estimada a partir de las mediciones en el laboratorio bajo iluminación artificial (31-108 mmol O2 m-2 h-1; lámpara halógena, fluorímetro PAM-2000) (Tabla 1). La producción de oxígeno estimada a partir de la ETRin situ (utilizando el fluorímetro Water-PAM) a temperatura ambiente fue 4 veces mayor (216 a 230 mmol O2 m-2 h-1) que la producción en condiciones de laboratorio y aproximadamente 2 veces mayor que la producción en condiciones al aire libre (mesocosmos) (Tabla 1).
Tabla 1 Tasa de producción de oxígeno (mmol O2 m-2 h-1) estimada a partir de la tasa de transporte de electrones para Neogoniolithon brassica-florida in situ en la zona costera (campo, 0 m de profundidad) e incubada en mesocosmos al aire libre y en condiciones de laboratorio a 2 temperaturas diferentes: temperatura ambiente (T) y temperatura ambiente incrementada 2 ºC (T+). Los datos se comparan con los datos de otro estudio (Chisolm 2003) para N. brassica-florida a 3 y 6 m de profundidad.

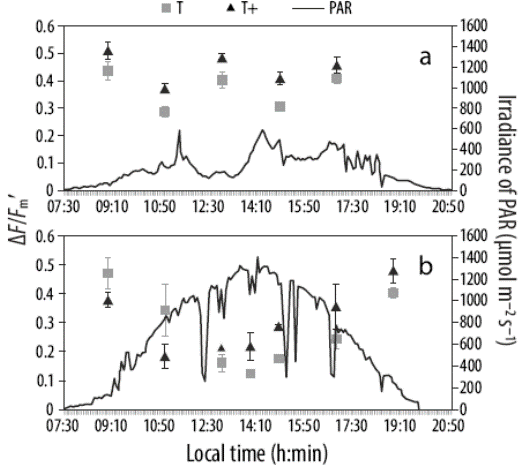
Figura 4 Rendimiento cuántico efectivo (ΔF/Fm´, símbolos) de Neogoniolithon brassica-florida en los tanques experimentales a lo largo del día (h:min) durante el 3 de mayo (a) y 29 de mayo (b) de 2013. Los datos se presentan según la temperatura ambiente (cuadros grises, T) y la temperatura ambiente más 2 ºC (triángulos negros, T+). Las líneas discontinuas representan la irradiancia de la radiación fotosintéticamente activa (400-700 nm; μmol photons m-2 s-1).
Experimento 2
La actividad fotosintética estimada a partir de la fluorescencia in vivo de la clorofila a para los rodolitos (L. margaritae) recolectados en bahía Magdalena (México) se muestra en las Figuras 5 y 6. La ETRmax para los rodolitos con epifauna adjunta recolectados a 1 m de profundidad fue mayor que la de los rodolitos recolectados a 2 m de profundidad, pero no se observaron diferencias significativas entre los 2 sitios de recolección (Fig. 5a, Tabla 2). La agrupación de datos muestra que la ETRmáx fue mayor en los rodolitos recolectados a 1 m de profundidad en Pedregoso que a 1 m de profundidad en CFE, independientemente de la presencia o ausencia de animales fijados a los rodolitos (Fig. 5b, Tabla 2). No se observaron diferencias significativas entre los 2 sitios para los rodolitos recolectados a 2 m de profundidad. Esto indica la heterogeneidad espacial de la productividad expresada como ETR en rodolitos. Como era de esperar, la productividad fue significativamente (P < 0.05) mayor para Pedregoso, el sitio con mejor calidad del agua y con sustrato rocoso, que para CFE, una ensenada que está más próxima a vertidos urbanos e industriales y presenta un mayor porcentaje de sedimentos fangosos en comparación con Pedregoso (Fig. 1b). La ETRmáx fue 2 veces mayor en Pedregoso que en CFE (Fig. 5b, Tabla 2), lo que significa que los rodolitos en Pedregoso tienen una capacidad fotosintética superior. En los rodolitos de Pedregoso (que representa un área pristina), la saturación de la irradiancia (Ek) fue mucho mayor en las algas recolectadas a 1 m en comparación con aquellas recolectadas a 2 m de profundidad (Fig. 5c, Tabla 2). Esto confirma que los rodolitos que crecen a 1 m presentan un patrón de luz solar fotosintético completo en comparación con la de los rodolitos recolectados a 2 m de profundidad (luz solar atenuada). Sin embargo, no se observaron diferencias significativas en la Ek en rodolitos recolectados a ambas profundidades en CFE (Fig. 5c, Tabla 2). La presencia de animales fijados a los rodolitos no mostró diferencias significativas por sitio y profundidad. No se observaron diferencias significativas en la eficiencia fotosintética (α ETR) entre profundidades (Fig. 6a, Tabla 2), pero α ETR fue mayor en los rodolitos de CFE con epifauna fijada que en los rodolitos sin epifauna (Fig. 6b, Tabla 2 ).
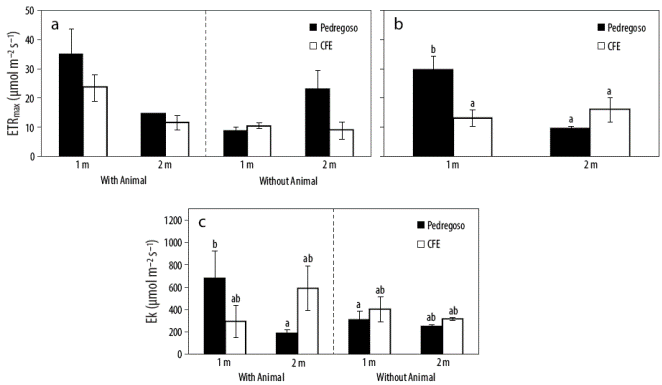
Figura 5 Tasa máxima de transporte de electrones (ETRmax, μ mol electrons m-2 s-1) (a), datos de ETRmax agrupados (b) e irradiancia de saturación (Ek, μ mol fotones m-2 s-1) (c) para los rodolitos (Lithophyllum margaritae) recolectados en las estaciones de muestreo Pedregoso (barras blancas) y CFE (barras negras) en bahía Magdalena a diferentes profundidades (1 y 2 m), con o sin epifauna fijada. Los tratamientos que presentan diferencias significativas se muestran con letras diferentes (P < 0.05).
Tabla 2 Resultados del análisis de varianza para los experimentos con Lithophyllum margaritae en bahía Magdalena recolectados en 2 sitios (S, Pedregoso y CFE), a 2 profundidades (D, 1 y 2 m) y con o sin epifauna (E), respecto a los parámetros de la fotosíntesis: tasa máxima de transporte de electrones (ETRmax), irradiancia de saturación del ETR (EkETR) y eficiencia fotosintética (α ETR). Las diferencias significativas con valores P < 0.01 y P < 0.05 se muestran en negrita.
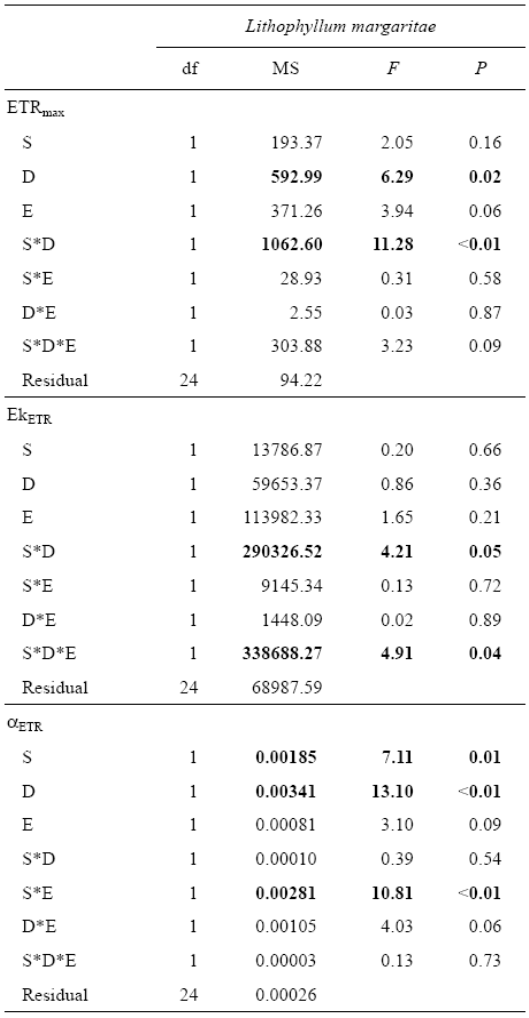
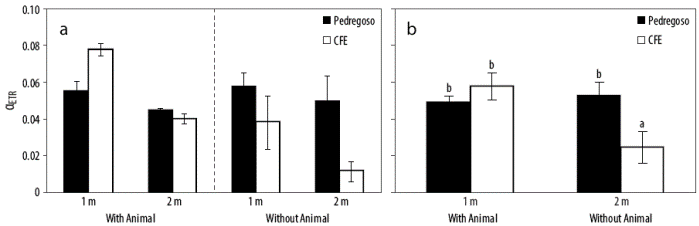
Figura 6 Eficiencia fotosintética (α ETR, unidades relativas) para Lithophyllum margaritae con o sin epifauna adjunta recolectada a diferentes profundidades (1 y 2 m) en las estaciones de muestreo Pedregoso (barras blancas) y CFE (barras negras) en bahía Magdalena (a), y los datos agrupados de las 2 estaciones y diferentes profundidades (b). Los tratamientos que presentan diferencias significativas se muestran con letras diferentes (P < 0.05).
Discusión
En el presente estudio, los valores de ETR, considerada como indicador de la productividad algal, para N. brassicaflorida durante ciclos diarios fueron más altos en el tratamiento con temperatura incrementada en 2 ºC (T+) en comparación con aquellos obtenidos en el tratamiento con temperatura ambiente (T). El incremento en la actividad fotosintética podría ser explicado por el incremento en la disponibilidad de CO2 debido al aumento esperado en la respiración del molusco D. petraeum en los arrecifes de vermétidos sometidos al experimento con T+.
Por otro lado, la α ETR en L. margaritae del sitio CFE fue mayor en rodolitos con animales adheridos a ellos que en los rodolitos sin epifauna. En el caso de CFE, los animales adheridos a los rodolitos pueden probablemente proveer de CO2, a través de la respiración, a las algas para la actividad fotosintética, como ha sido reportado por Mercado et al. (1998) para otra alga roja, Gelidium sesquipedale, con epifauna (briozoarios) adherida a su talo. Mercado et al. (1998) mostrararon que la presencia de animales adheridos (Electra pilosa) a G. sesquipedale incrementó la actividad fotosintética del alga en alrededor del 40% en comparación con las algas de las cuales los briozoarios habían sido removidos, y atribuyeron este incremento al incremento de CO2 disponible para las algas rojas. En el caso las poblaciones de rodolitos en bahía Magdalena, la epifauna dominante adherida estuvo formada por esponjas (Ávila y Riosmena-Rodríguez 2011). Ávila et al. (2012) encontraron 13 especies de esponjas viviendo asociadas a estos mantos de macroalgas no geniculadas, formando un hábitat complejo y diverso; estos autores encontraron que la función de las esponjas es formar un tejido conectivo que contribuye a la estabilidad del manto.
El ETR, y consecuentemente la producción de oxígeno, fue mayor en N. brassica-florida bajo condiciones in situ en las aguas costeras en comparación con los vermétidos incubados bajo condiciones al aire libre (mesocosmos) y bajo condiciones de laboratorio. Probablemente, las condiciones de luz natural y nutrientes naturales favorecieron la producción fotosintética del alga, en comparación con la actividad fotosintética de las muestras mantenidas en los mesocosmos o en condiciones de laboratorio. La producción de oxígeno en N. brassica-florida que formaba parte de los arrecifes de vermétidos fue mayor que aquella reportada por Chisholm (2003) para N. brassica-florida de vida libre (Tabla 1). La mayoría de los estudios acerca de algas calcáreas han utilizado radiación artificial (Burdet et al. 2012); sin embargo, en años recientes, un número creciente de estudios de algas calcáreas ha utilizado una combinación de mediciones en laboratorio e in situ (Irving et al. 2004, Burdet et al. 2012). En el estudio de Chisholm (2003), la fotosíntesis neta fue variable entre distintas algas coralinas tropicales: los valores in situ más altos correspondieron a especies de Hydrolithon (24-28 mmol O2 m-2 h-1) y N. brassica-florida (28-14 mmol O2 m-2 h-1) en vida libre, mientras que los valores más bajos correspondieron a N. brassica-florida (13.6-12.8 mmol O2 m-2 h-1), Neogoniolithum conicum (10.5 mmol O2 m-2 h-1) y diversas especies del género Hydrolithon (16.9-14.4 mmol O2 m-2 h-1) en condiciones de laboratorio. Los valores de producción de oxígeno de algas cálcareas obtenidos por Chisholm (2003) y los del presente estudio fueron mayores que aquellos reportados en estudios previos (Littler y Littler 1980, Littler et al. 1983).
La ETR en rodolitos fue afectada por el sitio de recolección debido a las características ambientales y la profundidad, y por la presencia de animales adheridos a los rodolitos. Los valores de ETRmáx (capacidad fotosintética) fueron 2 veces mayores para Pedregoso que para CFE, lo cual puede estar asociado a una mayor transparencia de la columna de agua y, consecuentemente, mayor disponibilidad de luz para la fotosíntesis. El mismo resultado fue encontrado en aguas ultraoligotróficas (Parque Natural Cabo de Gata-Níjar, España) por Celis-Plá et al. (2014). Ellos registraron altos valores de ETRmáx para Ellisolandia elongata recolectada a 2 m de profundidad en condiciones de luz. La α ETR en rodolitos de Pedregoso fue mayor que la de aquellos recolectados en CFE, pero sólo en rodolitos sin epifauna. El análisis de varianza multivariado confirma que la variabilidad espacial fue el principal factor que influyó en el rendimiento fotosintético, ya que los valores más altos fueron para Pedregoso. La exposición a la luz solar (luz directa vs sombra) y la presencia de epifauna adherida (epibionte vs sin epibionte) tuvieron un efecto igualmente significativo en la eficiencia fotosintética; el factor menos significativo en este análisis fue la profundidad. Ávila y Riosmena-Rodríguez (2011) y Ávila et al. (2012) también reportaron que los mantos de rodolitos en CFE, en comparación con los de Pedregoso, tienen mayores densidades por metro cuadrado, mayor diversidad de especies, mayor ramificación del talo, y mayor esfericidad, que son indicadores de una zona dinámica, con corrientes de marea intensas, como la entrada del estero Banderitas (donde los sitios Pedregoso y CFE están localizados, Fig. 1b).
Adicionalmente, Steller et al. (2007) registraron que los estresantes biológicos y las variables físicas, como la temperatura, tuvieron un efecto en las tasas fotosintéticas y de calcificación en L. margaritae; las tasas fotosintéticas, tasas de calcificación y tasas de crecimiento en los rodolitos mostraron amplias variaciones como resultado de cambios de temperatura en laboratorio o en campo. Las tasas máximas de fotosíntesis y respiración incrementaron 5 veces al incrementar la temperatura de 25 a 30 ºC (Steller et al. 2007). Los datos de laboratorio sugieren que el crecimiento de los rodolitos está regulado estacionalmente por la temperatura del agua de mar. Las tasas de crecimiento en campo fueron significativamente mayores en verano (5.02 ± 1.16 mm año-1) que en invierno (0.83 ± 0.16 mm año-1), apoyando los resultados de laboratorio (Steller et al. 2007). De acuerdo con Steller et al. (2007), los fuertes efectos en las tasas fotosintéticas, la calcificación y el crecimiento de L. margaritae en el golfo de California sugieren que los cambios en la temperatura regulan directamente la producción de estos mantos.
Los estudios del efecto del cambio climático en organismos acuáticos han sido realizados principalmente con 1 o 2 variables, y aquellos que consideran las interacciones de 3 o más factores son más escasos (Bischof et al. 2006, Häder et al. 2007). Las respuestas de los fotoautótrofos a un solo factor dependen de otros factores (Breitburg et al. 1998, Stengel et al. 2014). Esto es probablemente la razón de la alta variabilidad en las respuestas al incremento de CO2 entre las algas (Koch et al. 2013). La combinación de un incremento en la concentración de CO2 y la exposición a la luz impacta de manera negativa la fotosíntesis y el crecimiento de los productores primarios marinos (Gao et al. 2012). La actividad fotosintética incrementa debido al aumento de CO2 tanto en macroalgas calcáreas (Reiskind et al. 1988, Semesi et al. 2009) como no calcáreas (Connell y Russell 2010, Russell et al. 2011). Se ha encontrado que las concentraciones elevadas de CO2 disminuyen la tasa de calcificación y, por tanto, afectan el crecimiento de Corallina pilulifera (Gao et al. 1993). En contraste, también se ha encontrado que los incrementos de CO2 pueden incrementar la fotosíntesis en algas calcáreas como Halimeda (De Beer y Larkum, 2001) y C. pilulifera (Gao et al. 1993), pero estos efectos son enmascarados al compararlos con la disminución en la calcificación como resultado de la disminución en la tasa de saturación de carbonatos; sin embargo, este efecto es difícil de predecir.
Si la disponibilidad de nutrientes incrementa debido a mayores aportes terrestres, existe una posibilidad de incrementos sinérgicos en el crecimiento de algas cespitosas (debido a un incremento de CO2 y nutrientes), lo que promueve un incremento en algas cespitosas en relación con macroalgas calcáreas. Por ejemplo, se conoce poco acerca de cómo las algas calcáreas responden a la radiación UV en combinación con la acidificación. La radiación UV puede actuar sinérgicamente, antagónicamente o independientemente con la acidificación del océano (alto CO2/bajo pH del agua de mar) y afectar el proceso de calcificación (Gao y Zheng 2010). En Corallina sessilis, la presencia de radiación UV inhibió el crecimiento, la evolución de O2 fotosintético y las tasas de calificación, lo que refleja un efecto sinérgico del enriquecimiento de CO2 con la radiación UV (Gao y Zheng 2010). Sin embargo, la inhibición de la fotosíntesis inducida por radiación UV incrementa cuando la proporción de carbono inorgánico particulado/carbono orgánico particulado disminuye por la influencia de agua acidificada por CO2. Así, las algas coralinas pueden sufrir más daño por radiación UVB al disminuir la calcificación con el aumento de la acidificación del océano. En combinación con otros factores de estrés, tales como calentamiento global, incremento en la frecuencia de tormentas y la contaminación, un aumento de radiación UV en aguas superficiales incrementará el impacto en las macroalgas litorales incluso a una tasa exponencial, de tal forma que diversas especies puedan estar en riesgo o forzadas a buscar refugio en aguas más profundas (Wahl et al. 2004, Connell y Russell 2010, Figueroa et al. 2014b). La mayoría de las investigaciones han sido realizadas a nivel de especie y aún hay información escasa del efecto interactivo del cambio climático en la estructura, diversidad y producción primaria de comunidades algales y macrófitas (Wahl et al. 2004, Bischof et al. 2006). Consecuentemente, la identificación de cómo las condiciones alternantes modifican la disponibilidad de recursos y las limitaciones puede facilitar la anticipación de la sostenibilidad futura de componentes principales del ecosistema y las comunidades que soporta (Falkenberg et al. 2013). De acuerdo con Harley et al. (2012), el calentamiento futuro favorecerá a los herbívoros y tendrá impactos negativos indirectos en los mantos de macroalgas formadores de dosel. Incrementos futuros en CO2 tendrán efectos negativos fuertes en algas costrosas coralinas y efectos positivos en macroalgas no calcificantes tanto de manera directa vía crecimiento mejorado como de manera indirecta vía el consumo por herbívoros calcáreos.
Para poder evaluar la vulnerabilidad y aclimatación de las macroalgas rojas calcáreas a factores del cambio climático (IPCC 2014), es necesario realizar experimentos multifactoriales bajo condiciones controladas simulando escenarios de cambio climático (Martin y Gattuso 2009, McElhany y Busch 2013, Stengel et al. 2014) y usando indicadores funcionales de la fotosíntesis no intrusivos, como lo son las técnicas de fluorescencia in vivo de la clorofila a (Figueroa y Korbee 2010).
Agradecimientos
Se agradece la financiación del Proyecto Interacid (RNM5750) de la Junta de Andalucía para las investigaciones realizadas con vermétidos en el Parque Natural Cabo de Gata-Níjar (España) y en los mesocosmos de la Universidad de Málaga. PSMCP agradece la beca otorgada por la Comisión Nacional de Investigación Científica y Tecnológica (CONICYT, Chile). RRR agradece a la Fundación Marisla el apoyo para los estudios en bahía Magdalena (Baja California, México).
REFERENCIAS
Amado-Filho GM, Maneveldt G, Manso RCC, Marins-Rosa BV, Pacheco MR, Guimarães SMPB. 2007. Structure of rhodolith beds from 4 to 55 meters deep along the southern coast of Espírito Santo State, Brazil = Estructura de los mantos de rodolitos de 4 a 55 metros de profundidad en la costa sur del estado de Espírito Santo, Brasil. Cienc. Mar. 33(4): 399-410. [ Links ]
Ávila E, Riosmena-Rodríguez R. 2011. A preliminary evaluation of shallow-water rhodolith beds in Bahia Magdalena, Mexico. Braz. J. Oceanogr. 59(4): 365-375. http://dx.doi.org/10.1590/S1679-87592011000400007 [ Links ]
Ávila E, Riosmena-Rodríguez R, Hinojosa-Arango G. 2012. Sponge-rhodolith interactions in a subtropical estuarine system. Helgoland Mar. Res. 67(2): 349-357. http://dx.doi.org/10.1007/s10152-012-0327-y [ Links ]
Bischof K, Gómez I, Molis M, Hanelt D, Karsten U, Lüder U, Roleda MY, Zacher K, Wiencke C. 2006. Ultraviolet radiation shapes seaweed communities. Rev. Eviron. Sci. Biotechnol. 51: 141-166. [ Links ]
Breitburg DL, Baxter JW, Hatfield CA, Howarth RW, Jones CG, Lovett GM, Wigand C. 1998. Understanding effects of multiple stressors: Ideas and challenges. In: Pace ML, Groffman PM (eds.), Successes, Limitations, and Frontiers in Ecosystem Science. Springer, New York, USA, pp. 416-431. [ Links ]
Burdet HL, Hennige SJ, Francis FTY, Kamenos NA. 2012. The photosynthetic characteristics of coralline alga determined by using pulse amplitude modulation PAM fluorometry. Bot. Mar. 55: 499-509. [ Links ]
Calvo M, Templado J, Penchaszadeh PE. 1998. Reproductive biology of the gregarious Mediterranean vermetid gastropod Dendropoma petraeum. J. Mar. Biol. Assoc. UK 78: 525-549. [ Links ]
Celis-Plá PSM, Martínez B, Quintano E, García-Sánchez M, Pedersen A, Navarro NP, Copertino M, Mangaiyarkarasi N, Mariath R, Figueroa FL, Korbee N. 2014. Short-term ecophysiological and biochemical responses of Cystoseira tamariscifolia and Ellisolandia elongata to changes in solar irradiance and nutrient levels. Aquat. Biol. 22: 227-243. [ Links ]
Chisholm JRM. 2003. Primary productivity of reef-building crustose coralline algae. Limnol. Oceanogr. 48: 1376-1387. [ Links ]
Chisholm JRM, Collingwood JC, Gill EF. 1990. A novel in situ respirometer for investigating photosynthesis and calcification in crustose coralline algae. J. Exp. Mar. Biol. Ecol. 141: 15-29. [ Links ]
Connell SD, Russell BD. 2010. The direct effects of increasing CO2 and temperature on non-calcifying organisms: Increasing the potential for phase shifts in kelp forests. Proc. R. Soc. Lond. B: Biol. Sci. 277: 1409-1415http://dx.doi.org/10.1098/rspb.2009.2069 [ Links ]
De Beer D, Larkum AWD. 2001. Photosynthesis and calcification in the calcifying algae Halimeda discoidea studied with microsensors. Plant Cell Environ. 24(11): 1209-1217. [ Links ]
Eilers PHC, Peeters JCH. 1988. A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton. Ecol. Model. 42: 199-215. [ Links ]
Falkenberg LJ, Rusell BD, Connell SD. 2013. Contrasting resource limitations of marine primary producers: Implications for competitive interactions under enriched CO2 and nutrient regimes. Oecologia 172(2): 575-583. http://dx.doi.org/10.1007/s00442-012-2507-5 [ Links ]
Figueroa FL, Conde-Álvarez R, Gómez I. 2003. Relations between electron transport rates determined by pulse amplitude modulated fluorescence and oxygen elution in macroalgae under different light conditions. Photosynthesis Res. 75: 259-275. [ Links ]
Figueroa FL, Bonomi-Barufi J, Malta EJ, Conde-Álvarez R, Nitschke U, Arenas F, Mata M, Connan S, Abreu MH, Marquardt R, Vaz-Pinto F, Konotchick T, Celis-Plá PSM, Hermoso M, Ordoñez G, Ruiz E, Flores P, de los Ríos J, Kirke D, Chow F, Nassar CAG, Robledo D, Pérez-Ruzafa A, BañaresEspaña E, Altamirano M, Jiménez C, Korbee N, Bischof K, Stengel DB. 2014a. Short-term effects of increasing CO2, nitrate and temperature on three Mediterranean macroalgae: Biochemical composition. Aquat. Biol. 22: 177-193. [ Links ]
Figueroa FL, Domínguez-González B, Korbee N. 2014b. Vulnerability and acclimation to increased UVB in the three intertidal macroalgae of different morpho-functional groups. Mar. Environ. Res. 101: 8-21. [ Links ]
Figueroa FL, Jerez CG, Korbee N. 2013. Use of in vivo chlorophyll fluorescence to estimate photosynthetic activity and biomass productivity in microalgae grown in different culture systems. Lat. Am. J. Aquat. Res. 41: 801-819. [ Links ]
Figueroa FL, Korbee N. 2010. Interactive effects of UV radiation and nutrients on ecophysiology: Vulnerability and adaptation to climate change. In: Seckbach J, Einav R, Israel A (eds.), Seaweeds and their Role in Globally Changing Environments. Springer, Heidelberg, Germany, pp. 157-182 http://dx.doi.org/10.1007/978-90-481-8569-6_10 [ Links ]
FosterMS. 2001. Rhodoliths: Between rocks and soft places. J. Phycol. 375: 659-667. [ Links ]
Foster MS, McConnico LM, Lundsten L, Wadsworth T, Kimball T, Brooks LB, Steller DL. 2007. Diversity and natural history of a Lithothamnion muelleri-Sargassum horridum community in the Gulf of California = Diversidad e historia natural de una comunidad de Lithothamnion muelleri y Sargassum horridum en el golfo de California. Cienc. Mar. 33(4): 367-384. [ Links ]
Foster MSR, Riosmena-Rodríguez R, Steller DL, Woelkerling WJ. 1997. Living rhodolith beds in the Gulf of California and their implications. In: Johnson ME, Ledesma-Vázquez J (eds.), Pliocene Carbonates and Related Facies Flanking the Gulf of California, Baja California, Mexico. Geological Society of America Special paper no. 318, Boulder, Colorado, pp. 127-139. [ Links ]
Gao K, Aruga Y, Asada K, Ishihara T, Akano T, Kiyohara M. 1993. Calcification in the articulated coralline alga Corallina pilulifera, with special reference to the effect of elevated CO2 concentration. Mar. Biol. 117: 129-132. [ Links ]
Gao K, Xu J, Gao G, Li Y, Hutchin SDA, Huang B, Wang L, Zheng Y, Peng Jin P, Cai X, Häder D-P, Li W, Xu K, Liu N, Riebesell U. 2012. Rising CO2 and increased light exposure synergistically reduce marine primary productivity. Nature Climate Change 2: 519-523. [ Links ]
Gao K, Zheng Y. 2010. Combined effects of ocean acidification and solar UV radiation on photosynthesis, growth, pigmentation and calcification in the coralline alga Corallina sessilis Rhodophyta. Global Change Biol. 16: 2388-2398. [ Links ]
Glynn PW. 1996. Coral reef bleaching: Facts, hypotheses and implications. Global Change Biol. 26: 495-509. [ Links ]
Häder DP, Kumar HD, Smith RC, Worrest RC. 2007. Effects of solar UV radiation on aquatic ecosystems and interactions with climate change. Photochem. Photobiol. Sci. 6: 267-285. [ Links ]
Harley CDG, Anderson KM, Demes KW, Jorve JP, Kordas JR, Coyle TA. 2012. Effects of climate change on global seaweed communities. J. Phycol. 48: 1064-1078. [ Links ]
[IPCC ] Intergovernmental Panel on Climate Change. 2014. The Physical Science Basis. Working Group I Contribution to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge, UK. [ Links ]
Irving AD, Connell SD, Elsdon TS. 2004. Effects of kelp canopies on bleaching and photosynthetic activity of encrusting coralline algae. J. Exp. Mar. Biol. Ecol. 310(1): 1-12. [ Links ]
Jassby AD, Platt T. 1976. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton. Limnol. Oceanogr. 21: 540-547 [ Links ]
Kamenos NA, Moore PG, Hall-Spencer JM. 2003. Substratum heterogeneity of dredged vs un-dredged maerl grounds. J. Mar. Biol. Assoc. UK 83: 411-413. [ Links ]
Keen AM, Morton JE. 1960. Some new African species of Dendropoma (Vermetidae: Mesogastropoda). J. Molluscan Stud. 34(1): 36-51. [ Links ]
Kelaher B. 2002. Influence of physical characteristics of coralline turf on associated macrofaunal assemblages. Mar. Ecol. Prog. Ser. 232: 141-148. [ Links ]
Koch M, Bowes G, Ross C, Zhang XH. 2013. Climate change and ocean acidification effects on seagrasses and marine macroalgae. Global Change Biol. 19: 103-132. [ Links ]
Kromkamp JC, Dijkman NA, Peene J, Simis SGH, Gons HJ. 2008. Estimating phytoplankton primary production in Lake Ijsselmeer (the Netherlands) using variable fluorescence (PAMFRRF) and C-uptake techniques. Eur. J. Phycol. 43: 327-344. [ Links ]
Larkum AWD, Wood WF. 1993. The effect of UV-B radiation on photosynhesis and respiration of phytoplankton, benthic macroalgae and seagrasses. Photosynthesis Res. 36(1): 17-23. http://dx.doi.org/10.1007/BF00018071 [ Links ]
Littler MM. 1973. The productivity of Hawaiian fringing-reef crustose Corallinaceae and an experimental evaluation of production. Limnol. Oceanogr. 18: 949-952. [ Links ]
Littler MM, Littler DS. 1980. The evolution of thallus form and survival strategies in benthic marine macroalgae: Field and laboratory tests of a functional form model. Am. Nat. 116: 25-44. [ Links ]
Littler MM, Littler DS, Hanisak MD. 1991. Deep-water rhodolith distribution, productivity, and growth history at sites of formation and subsequent degradation. J. Exp. Mar. Biol. Ecol. 150 (2): 163-182. [ Links ]
Littler MM, Littler DS, Taylor PR. 1983. Evolutionary strategies in a tropical barrier reef system: Functional form groups of marine macroalgae. J. Phycol. 19: 229-237. [ Links ]
LüningK. 1990. Seaweeds: Their Environment, Biogeography and Ecophysiology. John Wiley, New York, USA, 525pp. [ Links ]
Martin S, Gattuso JP. 2009. Response of Mediterranean coralline algae to ocean acidification and elevated temperature. Global Change Biol. 15: 2089-2100. [ Links ]
McElhany P, BuschDS. 2013. Appropriate pCO2 treatments in ocean acidification experiments. Mar. Biol. 160: 1807-1812. [ Links ]
Mercado JM, Carmona R, Niell FX. 1998. Epiphytic bryozoans enhance the inorganic carbon acquisition in Gelidium sesquipedale. J. Phycol. 34: 925-927. [ Links ]
Milazzo M, Rodolfo-Metalpa R, Chan VBS, Fine M, Alessi C, Thiyagarajan V, Hall-Spencer JM, Chemello R. 2014. Ocean acidification impairs vermetid reef recruitment. Sci. Rep. 4: 4189. [ Links ]
Payri CE, Maritorena S, Bizeau C, Rodiere M. 2001. Photoacclimation in the tropical coralline alga Hydrolithon onkodes (Rhodophyta, Corallinaceae) from a French Polynesian reef. J. Phycol. 37: 223-234. http://dx.doi.org/10.1046/j.1529-8817.2001.037002223.x [ Links ]
Quintano E, Ganzedo U, Díez I, Figueroa FL, Gorostiaga JM. 2013. Solar radiation (PAR and UVA) and water temperature in relation to biochemical performance of Gelidium corneum (Gelidiales, Rhodophyta) in subtidal bottoms off the Basque coast. J. Sea Res. 83: 47-55. http://dx.doi.org/doi:10.1016/j.seares.2013.05.008 [ Links ]
Reiskind, JB, Seamon, PT, Bowes, G. 1988. Alternative methods of photosynthetic carbon assimilation in marine macroalgae. Plant Physiol. 87(3): 686-692. [ Links ]
Riosmena-Rodríguez R, Woelkerling WmJ , Foster, MS. 1999. Taxonomic reassessment of rhodolith-forming species of Lithophyllum (Corallinales, Rhodophyta) in the Gulf of California, Mexico. Phycologia 38: 401-417. http://dx.doi.org/10.2216/i0031-8884-38-5-401.1 [ Links ]
Russell P, Johnson ME. 2000. Influence of seasonal winds on coastal carbonate dunes from the Recent and Plio-Pleistocene at Punta Chivato, Baja California Sur, Mexico. J. Coast. Res. 16 (3): 709-723. [ Links ]
Russell BD, Passarelli CA, Connell SD. 2011. Forecasted CO2 modifies the influence of light in shaping subtidal habitat. J. Phycol. 47: 744-752. [ Links ]
Semesi IS, Kangwe J, Björk M. 2009. Alterations in seawater pH and CO2 affect calcification and photosynthesis in the tropical coralline alga, Hydrolithon sp. (Rhodophyta). Estuar. Coast. Shelf Sci. 84: 337-341. http://dx.doi.org/doi:10.1016/j.ecss.2009.03.038 [ Links ]
Schreiber U, Endo T, Mi H, Asada K. 1995. Quenching analysis of chlorophyll fluorescence by saturation pulse method: Particular aspects relating to the study of eukaryotic algae and cyanobacteria. Plant Cell Physiol. 36: 873-882. [ Links ]
Steller DL, Hernández-Ayón JM, Riosmena-Rodríguez R, Cabello Pasini A. 2007. Effect of temperature on photosynthesis, growth and calcification rates of the free-living coralline alga Lithophyllum margaritae = Efecto de la temperatura sobre las tasas de fotosíntesis, crecimiento y calcificación del alga coralina de vida libre Lithophyllum margaritae. Cienc. Mar. 33(4): 441-456. [ Links ]
Steller DL, Riosmena-Rodríguez R, Foster MS, Roberts CA. 2003. Rhodolith bed diversity in the Gulf of California: The importance of rhodolith structure and consequences of disturbance. Aquat. Conserv. 13(S1): S5-S20. [ Links ]
Stengel DB, Conde-Álvarez R, Connan S, Nitschke U, Arenas F, Abreu H, Bonomi J, Chow F, Robledo D, Malta EJ, Mata M, Konotchick T, Nassar C, Pérez-Ruzafa Á, López D, Marquardt D, Vaz-Pinto F, Celis-Plá PSM, Hermoso M, Ruiz E, Ordoñez G, Flores P, Zanolla M, Bañares-España E, Altamirano M, Korbee N, Bischof K, Figueroa FL. 2014. Short-term effects of CO2, nutrients and temperature on three marine macroalgae under solar radiation. Aquat. Biol. 22: 159-176. [ Links ]
Underwood T. 1997. Experiments in Ecology. Their logical design and interpretation using analysis of variance. Cambridge University Press, Cambridge, UK. [ Links ]
Wahl M, Molis M, Davis A, Drobestov S, Durr ST, Johansson J, Kinley J, Kirugara D, Langer M, Lotze HK, Thiel M, Thomanson JC, Word B, Ben-Yosef DZ. 2004. UV effects that come and go: A global comparison of marine benthic community level impacts. Global Change Biol. 10: 1962-1972. [ Links ]
Williams PI, Robertson JE. 1991. Overall planktonic oxygen and carbon dioxide metabolisms: The problem of reconciling observations and calculations of photosynthetic quotients. J. Plankton Res. 13(S1): 153-169. [ Links ]
Recibido: Octubre de 2015; Aprobado: Mayo de 2016











 texto en
texto en