Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.42 no.2 Ensenada Jun. 2016
https://doi.org/10.7773/cm.v42i2.2581
Artículos
Efectos de la triploidía inducida por choque frío sobre la división celular, la tasa de eclosión y la supervivencia larvaria de la cabrilla arenera (Paralabrax maculatofasciatus)
1Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional (CICIMAR-IPN), Av. IPN s/n, Col. Playa Palo de Santa Rita, La Paz 23096, Baja California Sur, México.
2Centro de Investigaciones Biológicas del Noroeste (CIBNOR), Mar Bermejo 195, Col. Playa Palo de Santa Rita, La Paz 23096, Baja California Sur, México.
Se realizaron 3 experimentos para evaluar los efectos de la triploidía inducida por choque frío sobre (1) la incidencia de división celular anormal durante la embriogénesis, (2) la tasa de eclosión y la proporción de larvas vitelinas vivas en los embriones con división celular normal contra los embriones con división anormal y (3) la supervivencia de larvas triploides de la cabrilla arenera (Paralabrax maculatofasciatus). Los desoves se obtuvieron por inducción hormonal (LHRHa). La triploidía se indujo por choque frío poco después de la fecundación. En el experimento 1, el porcentaje de embriones con división anormal fue significativamente más alto (P < 0.05) en las larvas tratadas con choque frío que en el grupo control, mientras que la tasa de eclosión y la proporción de larvas vitelinas vivas fueron significativamente más bajas (P < 0.05). En el experimento 2, cuando los embriones con divisiones normales y anormales de ambos grupos fueron incubados por separado, los embriones con divisiones celulares normales en el grupo de choque frío presentaron una tasa de eclosión y una proporción de larvas vitelinas vivas significativamente más altas que los embriones con división celular anormal del mismo grupo. No se observaron diferencias en el grupo control. En el experimento 3, se observó una disminución significativa (P < 0.05) en la cantidad de triploides a lo largo del periodo larvario. La supervivencia final fue drásticamente menor para las larvas triploides en comparación con las larvas que resultaron diploides después del choque frío o que no recibieron tratamiento. Los bajos porcentajes de triploides al final del periodo larvario limitan el desarrollo del cultivo de la cabrilla arenera triploide.
Palabras clave: división celular; anormalidades embrionarias; mortalidad larvaria; triploidía; Paralabrax maculatofasciatus
Three experiments assessed the effects of cold-shock induced triploidy on (1) the incidence of abnormal cell cleavage during embryogenesis, (2) hatching success and the proportion of live yolk-sac larvae in normally cleaved versus abnormally cleaved embryos, and (3) survival of triploid larvae of spotted sand bass (Paralabrax maculatofasciatus). All spawns were obtained by hormonal induction (LHRHa). Triploidy was induced by cold shock shortly after fertilization. In experiment 1, the percentage of abnormal cell cleavage was significantly higher (P < 0.05) in the cold-shocked group than in the control group, while the hatching rate and the proportion of live yolk-sac larvae were significantly lower (P < 0.05). In experiment 2, when normally and abnormally cleaved embryos from the control and cold-shocked groups were incubated separately, normal cleaved embryos in the cold-shocked group showed a significantly higher hatching rate and proportion of live yolk-sac larvae than abnormally cleaved embryos in the same group. No difference was observed in the control group. In experiment 3, a significant decrease (P < 0.05) in the triploidy count was observed throughout the larval period. Final survival was drastically lower for triploid larvae compared to cold-shocked diploids and untreated eggs. Low triploidy percentages at the end of the larval period would seriously hinder the development of triploid sand bass culture.
Key words: cell cleavage; embryonic abnormalities; larval mortality; triploidy; Paralabrax maculatofasciatus
Introducción
La cabrilla arenera, Paralabrax maculatofasciatus, es una especie potencial para la acuicultura a lo largo de la costa noroccidental de México. Es una hermafrodita ginogenética. En nuestro laboratorio se han abordado varios aspectos relacionados con el cultivo de esta especie, incluyendo el cultivo de larvas (Álvarez-González et al. 2000), la nutrición de juveniles (Álvarez-González et al. 2001) y su engorde en jaulas marinas (Grayeb-del Alamo 2001). No obstante, esta especie llega a la maduración sexual antes de alcanzar la talla comercial (datos no publicados). Esto se considera un grave problema ya que la madurez sexual se relaciona, en muchas especies, con una disminución de la tasa de crecimiento y supervivencia (Felip et al. 2001, Piferrer et al. 2009).
La inducción de la triploidía es la técnica de manipulación cromosómica más usada cuando el objetivo es producir peces estériles para la acuicultura (Piferrer et al. 2009). La triploidía se logra forzando la retención del segundo cuerpo polar poco después de la fecundación, mediante uno de varios métodos, como choque térmico (frío o caliente) y presión hidrostática (Dunham 2004). La mayoría de los estudios de manipulación cromosómica se han enfocado en encontrar la combinación correcta de las variables para inducir la triploidía y en examinar el crecimiento de individuos triploides durante las etapas juvenil y adulta, la dinámica hematológica, el rendimiento en condiciones de estrés y el desarrollo gonádico (Piferrer et al. 2000, Felip et al. 2001, Alcántar-Vázquez et al. 2008). Por otro lado, la embriogénesis y la supervivencia durante el periodo larval de peces marinos triploides han recibido poca atención hasta la fecha.
Algunos estudios han registrado un aumento en el número de embriones muertos y bajos porcentajes de eclosión de larvas triploides (Piferrer et al. 2003, Peruzzi et al. 2007); sin embargo, ninguno ha documentado cuáles son las alteraciones en el desarrollo embrionario que causan la mortalidad. La embriogénesis temprana consiste en una serie de divisiones mitóticas conocida como división celular. Cada división produce nuevas células llamadas blastómeros. Cuando los embriones contienen arreglos inusuales de blastómeros se considera que presentan 'división anormal'. Si la división celular anormal ocurre temprano en la embriogénesis puede ser detrimental (Avery y Brown 2005). Una anomalía en uno o más blastómeros puede tener un mayor impacto en el desarrollo que una deformidad en 1 o 2 células más adelante (Kjørsvik et al. 1990). Se han documentado correlaciones positivas entre las tasas de división normal temprana y el éxito de eclosión para diferentes especies (Kjørsvik et al. 2003, Rideout et al. 2004, Penney et al. 2006). En general, poco se sabe de los efectos de la inducción de la triploidía sobre la división celular y cómo afecta el éxito de eclosión (Sultana 2005).
Durante el cultivo de larvas, también se ha observado una mayor mortalidad de triploides que de diploides (Piferrer et al. 2003, Opstad et al. 2013). Se han propuesto diversas explicaciones para explicar esta mortalidad temprana de larvas triploides, incluyendo el momento o la magnitud del tratamiento, la duración del tratamiento (Johnstone 1985, Piferrer et al. 2003) y la recién adquirida condición triploide, que involucra la presencia de un tercer juego de cromosomas (Felip et al. 1997, Piferrer et al. 2000).
En nuestro laboratorio se ha desarrollado un método de choque frío para inducir la triploidía en la cabrilla arenera (Alcántar-Vázquez et al. 2008); sin embargo, el tratamiento de choque frío no siempre induce una triploidización del 100%. A los individuos que resultaron diploides a pesar de haber sido tratados con choque frío se les conoce como larvas diploides sometidas a choque frío. En un experimento previo con la cabrilla arenera, la proporción de triploides con respecto a diploides sometidos a choque frío fue 9:1 a la eclosión, pero después de 10 meses de cultivo, la proporción había cambiado a 1:3, lo que muestra que la tasa de mortalidad de las larvas triploides fue 27 veces mayor que la de las larvas diploides sometidas a choque frío (resultados no publicados). No se han documentado resultados similares para otras especies.
Los objetivos de este estudio fueron tratar de determinar algunas alteraciones en la embriogénesis de la cabrilla arenera que podrían explicar la alta mortalidad de triploides durante este periodo, así como determinar si se repetía el bajo porcentaje de triploidía en los juveniles de 10 meses y cuándo sucedía. Para esto, se realizaron 3 experimentos: en el experimento 1 se registró la ocurrencia de división celular anormal en embriones de la cabrilla arenera sometidos y no sometidos a choque frío, en el experimento 2 se examinaron las diferencias en el éxito de eclosión y la supervivencia temprana entre los embriones con divisiones celulares normales y anormales, y en el experimento 3 se evaluaron los porcentajes de triploidía durante el periodo larvario en desoves individuales (grupo control y grupo sometido a choque frío).
Materiales y métodos
Manejo de reproductores, eclosión e inducción de la triploidía
Se capturaron reproductores silvestres (hembras: 150-300 g; machos: 300-500 g) de la cabrilla arenera en la parte sur del golfo de California (bahía de La Paz, México, 24º9'N, 110º19'W) durante la temporada reproductiva. Al llegar al laboratorio, los peces fueron anestesiados con 2-fenoxietanol (400 mg L-1) y se determinó su madurez gonádica. Se indujo el desove con LHRHa siguiendo el método descrito por Alcántar-Vázquez et al. (2008). Se recolectaron ovocitos hidratados mediante extracción manual. Aproximadamente 1 h antes de la canulación de hembras, se recolectó semen con una jeringa de 1 mL y se mantuvo en hielo a 4 ºC. Se indujo la triploidía siguiendo a Alcántar-Vázquez et al. (2008). Cinco minutos después de la fecundación, los embriones fueron sometidos a choque frío (8 ± 0.3 ºC) durante 20 min.
Experimento 1: Efecto del tratamiento de choque frío sobre la división celular temprana
Se usaron desoves de 13 hembras: 7 en 2008 y 6 en 2009. Cada desove fue fertilizado con semen de 3 a 4 machos. Se dividieron los huevos fertilizados de cada hembra en 2 grupos: grupo control (2 réplicas) y grupo sometido a choque frío (3 réplicas). Después del tratamiento de choque frío, aproximadamente 50 huevos de este grupo y 50 huevos del grupo control fueron depositados en microplacas de 12 pozos (4 huevos por pozo) con agua de mar estéril. Se determinó la división celular normal o anormal bajo un microscopio óptico de disección. Como la cabrilla arenera es una especie de desarrollo rápido, se observaron algunos desoves tan pronto como la fase de 4 células, mientras que otros no se observaron hasta la fase de 32 células, pero nunca después. Todos los embriones que no mostraron una división normal (ver Fig. 1 a) fueron considerados anormales (Fig. 1b). Los embriones en la fase de 32 células fueron considerados normales o abnormales con base en la organización estructural de los blastómeros (Fig. 1c, d). Después de esta evaluación, se colocaron las microplacas de 12 pozos en una incubadora de temperatura controlada (25 ºC). Después de la eclosión, se registró el número de embriones muertos y de larvas vitelinas vivas y muertas. Las larvas vitelinas que estaban dobladas o ligeramente opacas se registraron como muertas (Fig. 1e, f).

Figura 1 Fotografías digitales representativas de la cabrilla arenera (Paralabrax maculatofasciatus): (a) división celular normal y (b) division celular anormal en embriones en la fase de 8 células, (c) división celular normal y (d) división celular anormal en embriones en la fase de 32 células, (e) larvas eclosionadas normales y (f) larvas muertas. Barra de escala = 90 µm.
Experimento 2: Relación entre la división celular anormal y el éxito de eclosión
El procedimiento descrito arriba se repitió en 2009. En esta ocasión, para determinar si había una relación entre las tasas de eclosión y la división celular anormal, se separaron los embriones en 4 grupos: embriones del grupo control con división normal (1) y anormal (2), y embriones del grupo sometido a choque frío con división normal (3) y anormal (4). Se colocaron por separado en microplacas de 12 pozos y se incubaron como se describe arriba.
Experimento 3: Efecto de la triploidía sobre la supervivencia durante el periodo larvario
El porcentaje de triploidía se examinó en diferentes momentos durante el periodo larvario. Ya que los desoves por inducción hormonal de la cabrilla arenera producen pocos huevos, fue imposible usar réplicas. Por esta razón, el experimento se realizó con 3 desoves individuales. Se usaron de 4 a 5 machos para fertilizar los huevos de cada hembra. Se aplicó choque frío como se describió anteriormente. Se seleccionaron los desoves con porcentajes de triploidía de ~80% con el fin de obtener larvas de ambas ploidías (triploides y diploides sometidas a choque frío) para seguir los porcentajes de ploidías durante el cultivo larvario. Los huevos fueron transferidos inmediatamente para su incubación (a 25 ºC y salinidad de 35) a 2 tanques cónicos de 120 L de capacidad con circulación de agua. Veinticuatro horas después de la eclosión, se estimó el número de larvas vitelinas mediante métodos volumétricos. La densidad larvaria se estableció usando el número de larvas que sobrevivieron el tratamiento de choque frío. Las larvas del grupo control y del grupo sometido a choque frío fueron transferidas a 2 tanques separados de 100 L de capacidad. Se usó un fotoperiodo de 13:11 (luz:oscuridad). La temperatura y el oxígeno fueron medidos diariamente con un oxímetro (±0.1) (YSI modelo 58, Yellow Springs Instrument Co., Inc., Ohio). La salinidad se midió con un refractómetro (Aquafauna, Tokio).
El plan de alimentación fue el siguiente: de 1 a 18 días después de la eclosión (DDE) las larvas se alimentaron con rotíferos (Brachionus plicatilis) tipo S enriquecidos con Selco (Artemia System, Gante, Bélgica) a una densidad de 4-15 rotíferos por mililitro. De 15 a 30 DDE, se ofrecieron nauplios de Artemia franciscana enriquecidos con Selco a una densidad de 4-12 nauplios por mililitro. De 25 a 30 DDE, también se ofrecieron ejemplares de Artemia cultivados en el laboratorio. Se tomaron muestras de 30 larvas al momento de la eclosión y 5, 15 y 30 DDE, y se mantuvieron a -80 ºC hasta realizar el análisis de ploidía. Se contó el número de larvas vivas al día 30 (NL30) del grupo sometido a choque frío y del grupo control.
El número de larvas triploides al día 30 (T30) y el número de larvas diploides sometidas a choque frío al día 30 (CSD30) fueron evaluados con las siguientes fórmulas:
T30 = NL30 × (% triploides al día 30) (1)
CSD30 = NL30 - T30 (2)
El porcentaje de triploides que sobrevivieron (ST) y el porcentaje de diploides sometidos a choque frío que sobrevivieron (SCSD) hasta el día 30 fueron calculados como sigue:
ST = [(NL30 × % triploides al día 30)/IT] × 100 (3)
SCSD = [(NL30 - no. triploides al día 30)/ICSD] × 100 (4)
donde IT es el número inicial de larvas triploides e ICSD es el número inicial de larvas diploides sometidas a choque frío.
La supervivencia (expresada en porcentaje) al momento de la eclosión fue calculada como el número de larvas eclosionadas en relación al número inicial de huevos. El número de larvas usadas para determinar la ploidía se adicionó al número total de larvas eclosionadas. Se calculó la proporción de larvas vitelinas como el número de larvas vitelinas por larvas eclosionadas. La ploidía se determinó mediante citometría de flujo (Partec Ploidy Analyser, Münster, Alemania) según lo descrito por Alcántar-Vázquez et al. (2008). La triploidía se analizó a partir de un conjunto de 30 larvas, excepto los días 15 y 30 después de la eclosión, cuando se tomó una muestra de músculo de cada larva y se analizó por separado.
Análisis estadístico
Todos los porcentajes fueron sometidos a una transformación arcoseno antes del análisis estadístico (Sokal y Rohlf 1998). Se verificó la normalidad de los datos con la prueba de Kolmogorov-Smirnov y se evaluó la homogeneidad de la varianza con la prueba de Levine. Para el experimento 2, se usó un modelo lineal que incluyó el año y tratamiento como factores fijos y el porcentaje de triplodía por desove como una covariable (Y = arcoseno de %triploides + año + tratamiento + año*tratamiento + e). Cuando se separaron los embriones normales y anormales del grupo control y el grupo sometido a choque frío, se usó el mismo modelo, con tratamiento (control y huevos sometidos a choque frío) y división celular (normal o anormal) como factores fijos. Para los huevos sometidos a choque frío, se usó el porcentaje de triploidía como un predictor continuo para evaluar su efecto sobre la división celular, el éxito de eclosión y las larvas vitelinas vivas. Se usó el coeficiente de correlación de Pearson para determinar si existía una relación significativa entre la división anormal y la supervivencia a la eclosión o entre la proporción de larvas vitelinas vivas en el grupo control y el grupo sometido a choque frío. En el experimento 3, se usó un análisis de varianza de una vía para identificar las diferencias en el porcentaje de triploidía durante el periodo larvario y, cuando se detectó una diferencia significativa, se usó la prueba de Tukey. El nivel de significancia establecido para todos los análisis fue P < 0.05.
Resultados
Efecto de la triploidía sobre la división celular
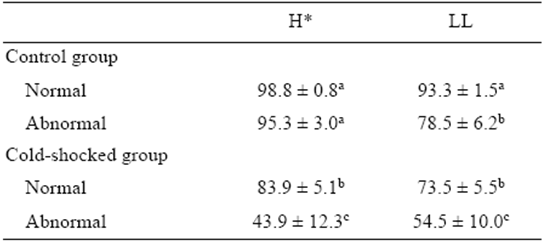
Se observó un coeficiente de correlación de Pearson significativamente negativo entre los porcentajes transformados de la división celular anormal y eclosión (r = -0.63; P < 0.05) y la proporción de larvas vitelinas vivas (r = -0.58; P < 0.05). La proporción de embriones con división anormal fue significativamente mayor (P < 0.05) en el grupo sometido a choque frío en ambos años experimentales, mientras que el porcentaje de eclosión y la proporción de larvas vitelinas vivas fue significativamente menor (P < 0.05). El porcentaje de triploidía fue significativamente mayor durante el primer año (experimento 1) que durante el segundo (experimento 2) (Tabla 1). El porcentaje transformado de triploidía no fue una covariable significativa (P = 0.83) para la supervivencia a la eclosión, la proporción de división anormal o la proporción de larvas vitelinas vivas. Ninguna de estas variables mostró alguna interacción entre tratamiento y año.
Tabla 1 Porcentajes de división celular anormal (AC), eclosión (H), larvas vivas (LL) y triploidía (T) (promedio ± error estándar) para los huevos de la cabrilla arenera (Paralabrax maculatofasciatus) del grupo control (C) y del grupo sometido a choque frío (CS) en los experimentos 1 (n = 7) y 2 (n = 6).

*Means for untransformed data. Superscript letters indicate significant differences in each row (P < 0.05).
Relación entre la división celular anormal y el éxito de eclosión
Cuando los embriones con divisiones normales y anormales del grupo control y el grupo sometido a choque frío fueron incubados por separado, se observaron diferencias significativas (P < 0.05) en el porcentaje de eclosión y el porcentaje de larvas vitelinas vivas (Tabla 2). Los porcentajes de eclosión fueron significativamente diferentes (P = 0.017) debido a que el porcentaje de eclosión fue significativamente menor (P < 0.05) para los embriones anormales del grupo sometido a choque frío en comparación con los embriones normales. No se observó una diferencia significativa entre los embriones normales y anormales del grupo control. El número de larvas vitelinas vivas fue significativamente más alto (P < 0.05) en los embriones normales del grupo control y significativamente más bajo en los embriones anormales del grupo sometido a choque frío (Tabla 2).
Porcentajes de triploidía durante el periodo larvario
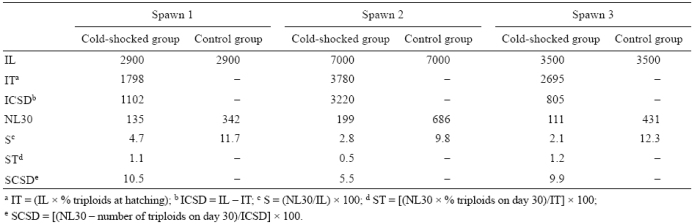
Se observó una disminución significativa (P < 0.05) de los porcentajes de triploidía durante el periodo larvario en los 3 desoves individuales (Tabla 3). El número de prejuveniles al día 30 (NL30) fue mayor en el grupo control que en el grupo sometido a choque frío (Tabla 4). En el grupo sometido a choque frío, el porcentaje de diploides que sobrevivieron al día 30 (SCSD) fue mayor que el de triploides, pero cerca a lo observado para el grupo control en los 3 desoves. Al día 30, en los 3 desoves, el número de prejuveniles diploides sometidos a choque frío siempre fue mayor que el número de triploides (Tabla 4).
Tabla 3 Porcentaje* de triploidía a la eclosión (TH) y a 5 (T5), 15 (T15) y 30 (T30) días después de la eclosión. Datos de desoves individuales (S1, S2, S3) de la cabrilla arenera.

*Means of untransformed data. Superscript letters indicate significant differences in each column (P < 0.05).
Tabla 4 Número inicial de larvas (IL), número inicial de larvas triploides (IT), número inicial de larvas diploides sometidas a choque frío (ICSD), número de prejuveniles al día 30 (NL30), porcentaje de supervivencia al día 30 (S), porcentaje de supervivencia de larvas triploides al día 30 (ST) y porcentaje de supervivencia de larvas diploides sometidas a choque frío al día 30 (SCSD). Datos de desoves individuales de la cabrilla arenera (Paralabrax maculatofasciatus).
Discusión
En el presente estudio se observó una mayor mortalidad relacionada con la división celular anormal en los embriones de la cabrilla arenera sometidos a choque frío. Además, se registró una disminución de la cantidad de triploides durante el periodo larvario.
Se observó división celular anormal tanto en el grupo control como en el grupo sometido a choque frío; sin embargo, mientras que la tasa de división anormal fue de 25% en el grupo control, el éxito de eclosión fue >90%. Estos resultados coinciden con los de Vallin y Nissling (1998), quienes argumentan que divergencias en las células tempranas no diferenciadas de bacalao (4 a 32 células) permiten que el desarrollo proceda normalmente hasta la eclosión. Rideout et al. (2004) indicaron que la viabilidad varía en embriones con división anormal y depende del tipo de anormalidad blastomérica. Además, las proteínas y los mecanismos de reparación están constantemente trabajando para reducir los blastómeros anormales y la mortalidad embrionaria, actuando como puntos de control durante la división celular (Gerald 2005). Sin embargo, cuando se separaron los embriones con divisiones normales y anormales en nuestros 2 grupos experimentales, sólo se observó una correlación negativa significativa entre los embriones anormales y la eclosión en los huevos sometidos a choque frío; por ende, una proporción alta de huevos anormales no eclosionaron. Es probable que se interrumpan los mecanismos de autoreparación durante el tratamiento de choque frío debido a cambios en las proteínas intracelulares. Felip et al. (1997) y Piferrer et al. (2003) sugieren que el incremento de división celular anormal que se observa después de un tratamiento de choque frío puede ser resultado de aneuploidía. La adición de un tercer juego de cromosomas podría interferir durante la anafase. Estos cromosomas adicionales podrían afectar la alineación del huso mitótico en las etapas tempranas de la mitosis, y cambiar la dinámica de los microtúbulos durante la división celular y, consecuentemente, modificar la distribución del material genético y el volumen citoplasmático entre las células hijas (Gerald 2005, Voronina y Wessel 2006). Por otro lado, la división anormal puede ser resultado de la intensidad del choque frío. Las proteínas intracelularles involucradas en la formación de microtúbulos pueden ser afectados negativamente, lo que provocaría aneuploidía o una interrupción de la acción y distribución de proteínas específicas en cada mitad de las células en división (Downing y Allen 1987, Voronina y Wessel 2006).
En el bacalao del Atlántico, que vive en aguas frías, Sultana (2005) no observó diferencias en el porcentaje de embriones con división anormal entre el grupo sometido a choque frío y el grupo control. De hecho, el porcentaje de embriones con división anormal así como el porcentaje de eclosión fueron muy bajos para ambos grupos. La diferencia entre la temperatura del choque frío y la temperatura de mantenimiento parece ser más importante que la propia temperatura del choque (Diaz et al. 1993). La diferencia fue de sólo 5 ºC en el experimento con el bacalao del Atlántico y de 14 ºC en nuestro experimento. Esta diferencia podría explicar la alta proporción de división anormal en nuestro estudio.
En el presente estudio, durante el cultivo de larvas de la cabrilla arenera, el porcentaje de supervivencia de las larvas triploides fue menor que el de las diploides sometidas a choque frío y del grupo control. La supervivencia de las larvas diploides del grupo control fue similar a la obtenida por Álvarez-González et al. (2000) en un estudio previo con la misma especie en nuestro laboratorio. Una mayor mortalidad de larvas triploides que de diploides control ha sido documentada por Solar et al. (1984), quienes sugieren que esta disminución gradual en la supervivencia puede ser resultado de un grado de endogamia causada por la retención del segundo cuerpo polar.
No obstante, no se puede ignorar la intensidad del choque frío. Los individuos que no responden a choques térmicos cuando la inducción a la triploidía no es del 100% pueden servir como controles para determinar el efecto de la intensidad del choque sobre la supervivencia y las tasas de crecimiento durante el periodo larvario (Piferrer et al. 2009). Maxime (2008) sugiere que es poco probable que las temperaturas usadas durante el tratamiento de inducción a la triploidía sean lo suficientemente intensas para interrumpir el desarrollo después de la embriogénesis temprana. Los porcentajes de diploides sometidos a choque frío en los 3 desoves fueron similares a los obtenidos para el grupo control, lo que sugiere que la intensidad del choque frío no fue responsable de la baja supervivencia de las larvas triploides.
No tenemos evidencia concluyente de la mortalidad diferencial entre las larvas triploides y las larvas diploides sometidas a choque frío. Se han documentado varias diferencias entre peces triploides y diploides que pueden afectar el desarrollo y la supervivencia de larvas. Se han registrado comportamientos anormales, incluyendo comportamiento natatorio y alimentario inusual (Solar et al. 1984), para larvas triploides de algunas especies (Piferrer et al. 2009). Se ha registrado un comportamiento menos agresivo para juveniles triploides (Galbreath et al. 1994), y en peces triploides se han observado deformidades de la mandíbula inferior (Lijalad y Powell 2009), de la vejiga natatoria y esqueléticas (Tiwary y Ray 2004). También se ha propuesto la disminución del área superficial de una célula asociada a la elevación del estatus de ploidía y su potencial relación con varias características biológicas y fisiológicas negativas, entre ellas la disminución del número de células en algunos órganos (Swarup 1959), el número de células en la sangre circulante, la capacidad de transportar oxígeno (Saddler et al. 2000), rutas metabólicas (Hyndman et al. 2003, Atkins y Benfey 2008) y la respuesta al estrés (Beyea et al. 2005).
En conclusión, la mortalidad de embriones de la cabrilla arenera sometidos a choque frío puede atribuirse a la división celular anormal provocada por el choque frío (8 ºC), lo que resultó en una menor eclosión que la observada en embriones con división anormal del grupo control. Asimismo, se registró una tasa de supervivencia diferencial entre las larvas triploides y las diploides sometidas a choque frío, lo que se tradujo en porcentajes bajos de triploides al final del periodo larvario. Esto representa un serio impedimento para la producción de larvas triploides de la cabrilla arenera. Una posible solución sería realizar el cultivo larvario exclusivamente con desoves sometidos a choque frío que han resultado en 100% de triploidía. Se necesita realizar más investigación para determinar la viabilidad de cultivar larvas triploides de la cabrilla arenera, y un próximo paso lógico sería estudiar su maduración sexual.
Agradecimientos
Este trabajo fue financiado por la Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional (SIP-IPN proyectos 20070038, 20082246 y 20090537). SD y RP son becarios de COFAA-IPN y EDI-IPN. Traducido al español por Christine Harris.
REFERENCIAS
Alcántar-Vázquez JP, Dumas S, Puente-Carreón E, Pliego-Cortés HS, Peña R. 2008. Induction of triploidy in spotted sand bass (Paralabrax maculatofasciatus Steindachner 1868) by cold shock. Aquacult. Res. 39: 59-63. [ Links ]
Álvarez-González CA, Civera-Cerecedo R, Ortiz-Galindo JL, Dumas S, Moreno-Legorreta M, Grayeb-del Alamo T. 2001. Effect of dietary protein level on growth and body composition of juvenile spotted sand bass, Paralabrax maculatofasciatus, fed practical diets. Aquaculture 194: 151-159. [ Links ]
Álvarez-González CA, Ortiz-Galindo JL, Dumas S, Martínez-Díaz S, Hernández Ceballos DE, Grayeb-del Alamo T, MorenoLegorreta M, Peña-Martínez R, Civera-Cerecedo R. 2000. Effect of stocking density on the growth and survival of spotted sand bass Paralabrax maculatofasciatus larvae in a closed recirculating system. J. World Aquacult. Soc. 32: 130-137. [ Links ]
Atkins ME, Benfey TJ. 2008. Effect of acclimation temperature on routine metabolic rate in triploid salmonids. Comp. Biochem. Physiol. A 149: 157-161. [ Links ]
Avery TS, Brown AJ. 2005. Investigating the relationship among abnormal patterns of cell cleavage, egg mortality and early larval condition in Limanda ferruginea. J. Fish Biol. 67: 890-892. [ Links ]
Beyea MM, Benfey TJ, Kieffe JD. 2005. Hematology and stress physiology of juvenile diploid and triploid shortnose sturgeon (Acipenser brevirostrum). Fish Physiol. Biochem. 31: 303-313 [ Links ]
Diaz NF, Iturra P, Veloso A, Estay F, Colihueque N. 1993. Physiological factors affecting triploid production in rainbow trout, Oncorhynchus mykiss. Aquaculture 114: 33-40. [ Links ]
Downing SL, Allen Jr SK. 1987. Induced triploidy in the Pacific oyster Crassostrea gigas. Optimal treatments with cytochalasin B depend on temperature. Aquaculture 61: 1-15. [ Links ]
Dunham RA. 2004. Aquaculture and Fisheries Biotechnology: Genetic Approaches. CABI Publishing, Wallingford, UK. [ Links ]
Felip A, Piferrer F, Zanuy S, Carrillo M. 2001. Comparative growth performance of diploid and triploid European sea bass over the first four spawning seasons. J. Fish Biol. 58: 76-88. [ Links ]
Felip A, Zanuy S, Carrillo M, Martínez G, Ramos J, Piferrer F. 1997. Optimal conditions for the induction of triploidy in the sea bass (Dicentrarchus labrax L.). Aquaculture 152: 287-298. [ Links ]
Galbreath FP, St Jean W, Anderson V, Thorgaard GH. 1994. Freshwater performance of all-female diploid and triploid Atlantic salmon. Aquaculture 128: 41-49. [ Links ]
Gerald K. 2005. Cell and Molecular Biology: Concepts and Experiments. 4thed. John Wiley and Sons, Hoboken, NJ, USA. [ Links ]
Grayeb del Alamo T. 2001. Efecto de la densidad en el crecimiento de la cabrilla arenera Paralabrax maculatofasciatus (Percoidei: Serranidae) cultivada en jaulas flotantes. MSc thesis, Centro Interdisciplinario de Ciencias Marinas, La Paz, Baja California Sur, México. [ Links ]
Hyndman CA, Kieffer JD, Benfey TJ. 2003. Physiology and survival of triploid brook trout following exhaustive exercise in warm water. Aquaculture 221:629-643. [ Links ]
Johnstone R. 1985. Induction of triploidy in Atlantic salmon by heat shock. Aquaculture 49: 133-139. [ Links ]
Kjørsvik E, Hoelhne-Reitan K, Reitan KI. 2003. Egg and larval quality criteria as predictive measures for juvenile production in turbot (Scophthalmus maximus L.). Aquaculture 227: 9-20. [ Links ]
Kjørsvik E, Mangor-Jensen A, Holmefjord I. 1990. Egg quality in fishes. Adv. Mar. Biol. 26: 71-113. [ Links ]
Lijalad M, Powell MD 2009. Effects of lower jaw deformity on swimming performance and recovery from exhaustive exercise in triploid and diploid Atlantic salmon Salmo salar L. Aquaculture 290: 145-154. [ Links ]
Maxime V. 2008. The physiology of triploid fish: Current knowledge and comparisons with diploid fish. Fish Fish. 9: 67-78. [ Links ]
Opstad I, Fjelldal PG, Karlsen Ø, Thorsen A, Hansen TJ, Taranger GL. 2013. The effect of triploidization of Atlantic cod (Gadus morhua L.) on survival, growth and deformities during early life stages. Aquaculture 388-391: 54-59. [ Links ]
Penney RW, Lush LP, Wade J, Brown AJ, Parrish CC, Burton MP. 2006. Comparative utility of egg blastomere morphology and lipid biochemistry for prediction of hatching success in Atlantic cod, Gadus morhua L. Aquacult. Res. 37: 272-283. [ Links ]
Peruzzi S, Kettunen A, Primicerio R, Kauric G. 2007. Thermal shock induction of triploidy in Atlantic cod (Gadus morhua L.). Aquacult. Res. 38: 926-932. [ Links ]
Piferrer F, Beaumont A, Falguiere JC, Flajshans M, Haffray P, Colombo L. 2009. Polyploid fish and shellfish: Production, biology and applications to aquaculture for performance improvement and genetic containment. Aquaculture 293: 125-156. [ Links ]
Piferrer F, Cal RM, Álvarez-Blázquez B, Sánchez B, Martínez P. 2000. Induction of triploidy in the turbot (Scophthalmus maximus) I. Ploidy determination and the effects of cold shocks. Aquaculture 188: 79-90. [ Links ]
Piferrer F, Cal RM, Gómez C, Bouza C, Martínez P. 2003. Induction of triploidy in the turbot (Scophthalmus maximus). II. Effects of cold shock timing and induction of triploidy in a large volume of eggs. Aquaculture 200: 821-831. [ Links ]
Rideout RM, Trippel EA, Litvak MK. 2004. Predicting haddock embryo viability based on early cleavage patterns. Aquaculture 230: 215-228. [ Links ]
Saddler J, Wells RM, Pankhurst MP, Pankhurst NW. 2000. Blood oxygen transport, rheology and haematological responses to confinement stress in diploid and triploid Atlantic salmon, Salmo salar. Aquaculture 184: 349-361. [ Links ]
Sokal RR, Rohlf FJ. 1998. Biometry: The principles and practices of statistics in biological research. 3rd ed. WH Freeman and Company, New York. [ Links ]
Solar I, Donaldson EM, Hunter GA. 1984. Induction of triploidy in rainbow trout (Salmo gairdneri) by heat shock and investigation of early growth. Aquaculture 42: 57-67. [ Links ]
Sultana RM. 2005. Prediction of larval viability based on egg quality parameters and early cleavage patterns in the experiments of triploidy induction in Atlantic cod, Gadus morhua L. MScthesis. University of Tromsø, Norway. [ Links ]
Swarup H. 1959. The oxygen consumption of diploid and triploid Gasterosteus aculeatus (L). J. Genet. 56: 156-160. [ Links ]
Tiwary BK, Ray AK. 2004. Alterations in air-sac and skeleton of triploid Heteropneustes fossilis J.Fish Biol. 64:268-272. [ Links ]
Vallin L, Nissling A. 1998. Cell morphology as an indicator of viability of cod egg-results from an experimental study. Fish. Res. 38: 247-255. [ Links ]
Voronina E, Wessel GM. 2006. Activator of G-protein signaling in asymmetric cell divisions of the sea urchin embryo. Dev. Growth Differ. 48: 549-557. [ Links ]
Recibido: Septiembre de 2015; Aprobado: Abril de 2016











 texto em
texto em