Introducción
El crecimiento y mantenimiento de las comunidades y arrecifes de coral dependen de un proceso dinámico que involucra la acumulación y la remoción de carbonatos a través del tiempo (Goldber 2013). Una parte importante de la remoción de carbonatos es causada por la bioerosión, que involucra la disolución y/o la excavación de carbonato por organismos, entre los cuales se encuentran los principales macro bioerosionadores de los sistemas arrecifales, como las esponjas (Nava y Carballo 2008), poliquetos (Hutchings 2008), moluscos (Kiene y Hutchings 1994), peces (Bruggemann et al. 1996) y erizos de mar (Glynn 1988, Perry et al. 2012).
La actividad alimenticia de los erizos de mar ha sido recurrentemente señalada como relevante dentro de los sistemas arrecifales debido a la capacidad de los erizos para controlar las comunidades algales (Carpenter 1986, Hughes et al. 1987) y facilitar el reclutamiento coralino (Sammarco 1980). Adicionalmente, los erizos han sido reconocidos por su rol en la remoción de carbonatos (Glynn 1988, Reaka-Kudla et al. 1996) y, en última instancia, en el crecimiento y mantenimiento de los ecosistemas arrecifales (Bellwood et al. 2004).
En el Pacífico Oriental Tropical, se ha estudiado la tasa de bioerosión de los erizos de mar Toxopneustes roseus, Eucidaris thouarsii y Diadema mexicanum (Glynn 1988, Reaka-Kudla et al. 1996, Reyes-Bonilla y Calderón-Aguilera 1999, Herrera-Escalante et al. 2005) y su relevancia en las comunidades y arrecifes coralinos de México (golfo de California, Oaxaca), Costa Rica, Panamá y las islas Galápagos. Debido a su capacidad para remover carbonatos (Glynn 1988, Reaka-Kudla et al. 1996), su alta abundancia (Glynn y Leyte-Morales 1997, Herrera-Escalante et al. 2005, Alvarado et al. 2012) y su comportamiento gregario (Levitan 1988), D. mexicanum es considerado como el equinodermo más relevante en los ecosistemas arrecifales del Pacífico oriental (Alvarado et al. 2015).
En las costas del Pacífico del sur de México, se ha estimado que la remoción de carbonatos por la actividad alimenticia de D. mexicanum alcanza hasta 4 kg/m2/año en Bahías de Huatulco (Herrera-Escalante et al. 2005). Dicha estimación, sin embargo, puede cambiar de manera importante en función de las modificaciones temporales de la abundancia del erizo (Benítez-Villalobos et al. 2008). A pesar de los estudios anteriores, en Ixtapa-Zihuatanejo, Guerrero (López-Pérez et al. 2012), y en Puerto Ángel, Oaxaca (Leyte-Morales 1997, Reyes-Bonilla y Leyte-Morales 1998), existen extensas e importantes porciones coralinas para las cuales se carece de datos respecto al papel que desempeñan los erizos en la remoción de carbonatos. Por otro lado, cabe resaltar que en la estimación de remoción de carbonatos para D. mexicanum en Bahías de Huatulco se consideraron los carbonatos totales pero no se analizó la composición del material erosionado (Glynn 1988). Lo anterior es de vital importancia, pues dependiendo del tipo de material removido, será el efecto del erizo sobre el sistema analizado. Por ejemplo, si D. mexicanum remueve predominantemente material calcáreo depositado por algas (calcita de magnesio), el cual es reemplazado rápidamente durante el crecimiento algal, entonces el efecto de los erizos sobre el esqueleto de los corales será mínimo. Por el contrario, si el contenido de aragonita en el material erosionado es importante, la actividad alimenticia de los erizos podría causar un daño importante en la estructura coralina. Considerando lo anterior, el presente estudio tiene como objetivo determinar el efecto de la actividad alimenticia del erizo de mar D. mexicanum en comunidades y arrecifes coralinos localizados en tres zonas de la costa sudoccidental (océano Pacífico) de México: Ixtapa-Zihuatanejo, Puerto Ángel y Bahías de Huatulco. Para tal fin, además de estimar la remoción de carbonatos, se analizó la composición (calcita de magnesio vs aragonita) del material erosionado con el fin de obtener una estimación más precisa del efecto del erizo sobre los sistemas coralinos de la región.
Materiales y métodos
Área de estudio
El estudio se realizó de septiembre de 2008 a agosto de 2009 en 15 sitios ubicados en los estados de Guerrero y Oaxaca, México (Fig. 1). Los sitios se agruparon en tres zonas (coordenadas extremas de 15°39'42.76"N y 17°40'49.21"N y 96°07'41.50"W y 101°39'32.43"W): la zona de Ixtapa-Zihuatanejo (Guerrero) estuvo conformada por los sitios Morros del Cerro Colorado, Zacatoso, El Chato, Caleta de Chon y Manzanillo; la zona de Puerto Ángel (Oaxaca) estuvo conformada por Mazunte, Estacahuite, La Mina, Playa del Muerto y La Tijera; y la zona de Bahías de Huatulco (Oaxaca) estuvo conformada por San Agustín, Riscalillo, isla Cacaluta, Violín y La Entrega. En todos los casos, se trata de comunidades y/o arrecifes coralinos de tipo franja (extensión variable), localizados en bahías o detrás de rocas que los protegen del oleaje, que no exceden los 12 m de profundidad. Su tipo de fondo se muestran en la Tabla 1. Las comunidades coralinas del área de estudio están dominadas por Pocillopora spp. (>90%) y en menor medida por Pavona spp. (<5%) y Porites spp. (<1%) (Glynn y Leyte-Morales 1997; Reyes-Bonilla y Leyte-Morales 1998; López-Pérez et al. 2012, 2014). Para una descripción más detallada de la composición de especies, cobertura, extensión, profundidad y otros datos particulares, se puede consultar a López-Pérez et al. (2012) para los sistemas que se desarrollan en Ixtapa-Zihuatanejo; Reyes-Bonilla y Leyte-Morales (1998) para aquellos ubicados en la zona de Puerto Ángel; y Glynn y Leyte-Morales (1997), López-Pérez et al. (2014) y Santiago-Valentín et al. (2015) para los sistemas que se localizan en Bahías de Huatulco.
Obtención de datos
Para determinar el impacto bioerosivo de D. mexicanum en arrecifes y comunidades arrecifales de las costas sudoccidentales de México, se consideró la estructura poblacional del erizo, su relación con las características del sustrato y la proporción de aragonita coralina removida por clase de talla.
La densidad poblacional (ind/m2) de D. mexicanum y la cobertura (%) de las características del sustrato (corales por género, algas, coral muerto, rocas y arena) se obtuvieron mediante cuatro transectos de banda (20 × 1 m) en cada sitio; excepto en Playa del Muerto, donde el tamaño reducido del sitio impidió realizar más de dos transectos. En los transectos, el porcentaje de cobertura de cada característica del sustrato se determinó de manera visual cada metro cuadrado utilizando un cuadrante de 1 m2 con cuadrículas de 10 x 10 cm. La dimensión de los transectos fue elegida para garantizar la comparación respecto a estudios previos (e.g., Reyes-Bonilla y Calderón-Aguilera 1999, Herrera-Escalante et al. 2005, Benítez-Villalobos et al. 2008, Alvarado et al. 2012) y estudios en curso en el Pacífico Oriental Tropical. El número de transectos por sitio se mantuvo constante entre sitios y puede considerarse adecuado debido a que el área de los sistemas, excepto La Entrega que tiene ~3.2 ha, no rebasa las 2 ha. Los transectos se colocaron aleatoriamente sobre la estructura arrecifal, paralelos a la línea de costa y dentro del intervalo de distribución bati-métrica de las comunidades coralinas (0-12 m) en cada sitio. Concurrentemente, se registró in situ el diámetro testal (±0.01cm) de hasta 50 individuos de D. mexicanum elegidos al azar en los transectos con el fin de determinar la estructura de talla para cada sitio.
La cantidad de aragonita coralina (g CaCO3/ind/d) y calcita de magnesio (g MgCO3/ind/d) removida por clase de talla (clase 1, <3.4 cm; clase 2, 3.4-6.1 cm; clase 3, >6.1 cm) se determinó a partir del análisis de las heces de 33 individuos de D. mexicanum elegidos al azar en un sitio (Estacahuite) elegido aleatoriamente. Este esquema de mues-treo supone que la actividad alimenticia y, por consiguiente, la remoción de carbonatos por parte de D. mexicanum es relativamente homogénea entre individuos de la misma talla que habitan sitios distintos, pero presenta diferencias en función de la talla de los individuos.
Para la obtención de las heces y el análisis de las mismas, se siguió el método de Glynn (1988). Mediante este método, la aragonita coralina se tiñe ligeramente de rosa y la calcita de magnesio (i.e., algas coralinas) de color naranja. Lo anterior facilita la diferenciación entre estas formas de carbonatos y permite una estimación más precisa del carbonato que D. mexicanum remueve de las comunidades y arrecifes coralinos en el área de estudio.
Se estimó el balance entre el depósito y la remoción de carbonatos en las comunidades y arrecifes coralinos de las costas sudoccidentales de México. Para estimar el depósito, se consideraron datos de cobertura (ver arriba, Tabla 1), tasa de extensión lineal (Guzmán y Cortés 1989a, Jiménez y Cortés 2003) y densidad (Glynn y Macintyre 1977, Hughes 1987) por cada género de coral registrado en cada sitio siguiendo el método utilizado por Perry et al. (2012). Por su parte, la remoción se estimó a partir de los datos de densidad, estructura de talla y contenido de aragonita coralina y calcita de magnesio en las heces de los erizos siguiendo la metodología propuesta por Herrera-Escalante et al. (2005).
Análisis de datos
Se evaluó si los datos de densidad y talla de D. mexicanum cumplían con los supuestos de normalidad y homogeneidad de varianza. Como los datos no cumplieron con los supuestos, las diferencias entre zonas (Ixtapa-Zihuatanejo, Puerto Ángel, Bahías de Huatulco) y entre sitios dentro de las zonas se evaluaron mediante un análisis de varianza no paramétrico de Kruskal-Wallis, seguido de una prueba a posteriori de Nemenyi (Zar 2009).
El grado de asociación entre las características del sustrato y la densidad y talla de D. mexicanum se evaluó mediante dos métodos. El primer método consistió en analizar la correlación entre las variables individuales mediante una prueba por rangos de Spearman. Para el segundo método, se utilizó un análisis de regresión lineal simple para evaluar la relación entre la puntuación de los sitios obtenida mediante el análisis de coordenadas principales de las características del sustrato y los datos de abundancia y talla de los erizos.
Para evaluar si alguno de los tipos de carbonatos removidos por los erizos era predominante, los datos de aragonita coralina y calcita de magnesio contenidos en las heces se compararon mediante una prueba U de Mann-Whitney.
Finalmente, se empleó un análisis de varianza no paramétrico de Kruskal-Wallis, seguido de una prueba a posteriori de Nemenyi (Zar 2009), para (a) evaluar si la cantidad removida de cada especie de carbonato (aragonita coralina, calcita de magnesio) variaba entre tallas del erizo y (b) evaluar las diferencias espaciales en el depósito y remoción de carbonatos entre zonas y entre sitios dentro de las zonas.
Resultados
El análisis espacial de los datos de densidad de D. mexicanum evidenció que existen diferencias significativas entre zonas (H = 13.4, P = 0.001). Puerto Ángel presentó una densidad de erizos significativamente mayor (Q = 2.394) que Bahías de Huatulco e Ixtapa-Zihuatanejo (Tabla 1). A escala local, en las zonas de Ixtapa-Zihuatanejo (H = 7.1, P = 0.13) y Puerto Ángel (H = 8.5, P = 0.07) no ocurrieron diferencias significativas entre sitios. Aunque en Bahías de Huatulco (H = 17.4, P = 0.003) ocurrieron diferencias significativas entre sitios, la prueba a posteriori fue incapaz de discernir entre qué sitios ocurrieron las diferencias.
Respecto a la talla de los organismos, el análisis reveló que existen diferencias significativas (H = 139.5, P = 0.00) en el diámetro de la testa de los erizos entre todas las zonas (Q = 2.394). El diámetro de la testa de los erizos fue significativamente mayor en Puerto Ángel, seguido de Ixtapa-Zihuatanejo y finalmente de Bahías de Huatulco (Tabla 1). A una escala espacial menor, se detectó que el diámetro de los erizos difirió entre los sitios ubicados en Ixtapa-Zihuatanejo (H = 25.21, P = 0.00) y Bahías de Huatulco (H = 11.68, P = 0.01). En Iztapa-Zihuatanejo, el diámetro de los erizos que habitan en Manzanillo difirió significativamente (Q = 2.807) de los que habitan en Zacatoso, El Chato y Morros del Cerro Colorado (Tabla 1). Para Bahías de Huatulco, la prueba a posteriori fue incapaz de identificar diferencias significativas entre los diámetros de los erizos que habitan distintos sitios.
Mediante el análisis de coordenadas principales, la ordenación de los sitios y las zonas en función de las características del sustrato puede ser descrita a partir de los primeros dos componentes (PCO1 y PCO2), los cuales contribuyeron con el 96.6% de la variación total (PCO1, 74.3%; PCO2, 22.3%) (Fig. 2a). La ordenación indicó que existe un gradiente de sitios que va desde la zona de Bahías de Huatulco (parte izquierda del diagrama) hasta la zona de Puerto Ángel (parte derecha del diagrama), pasando por los sitios que comprenden la zona de Ixtapa-Zihuatanejo. El gradiente está relacionado principalmente con la variación espacial en el porcentaje de cobertura de corales (porción izquierda de la ordenación) y en la cobertura de roca (porción derecha de la ordenación). Es decir, la cobertura de corales es relevante en la zona de Bahías de Huatulco, pero pierde relevancia hacia la zona de Puerto Ángel donde se incrementa la cobertura de roca. Las otras características del sustrato no fueron relevantes en la ordenación.
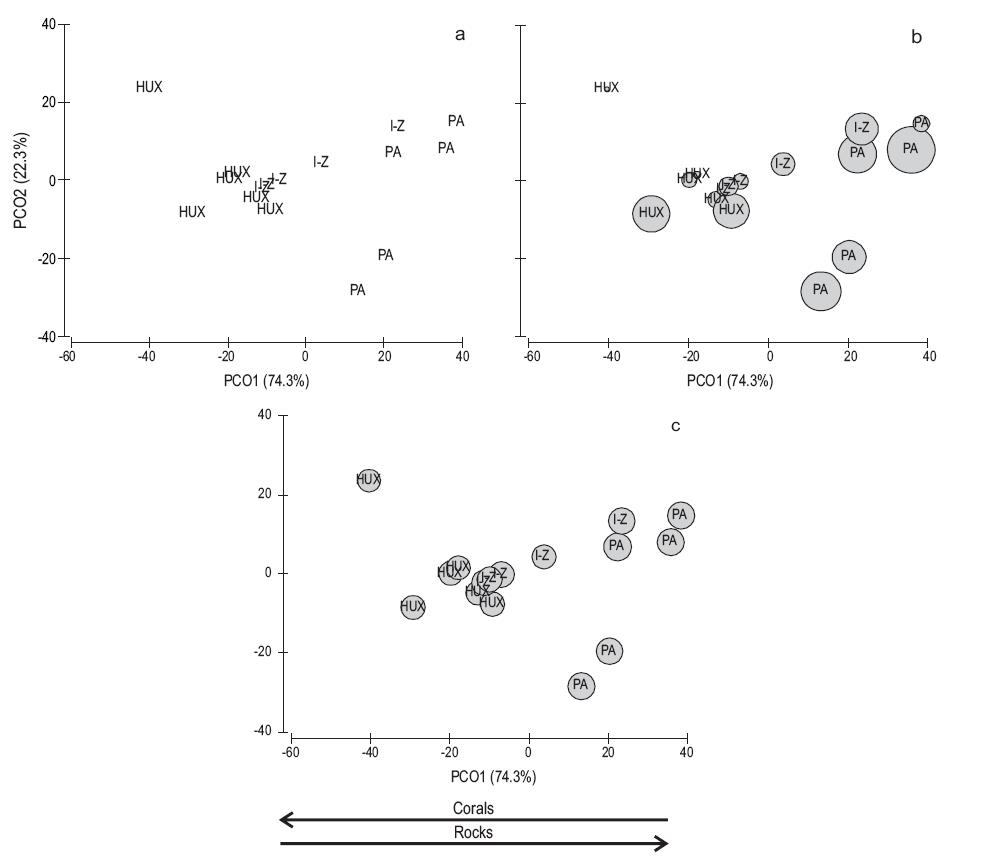
Figura 2: Ordenación de los sitios y las zonas de muestreo mediante un análisis de coordenadas principales: (a) ordenación de los sitios y las zonas con base en las características del sustrato, (b) ordenación de los sitios y las zonas con base en las características del sustrato y su relación con la talla de los erizos de mar, (c) ordenación de los sitios y las zonas con base en las características del sustrato y su relación con la densidad de erizos de mar. I-Z = Ixtapa-Zihuatanejo, Guerrero; PA = Puerto Ángel, Oaxaca; HUX = Bahías de Huatulco, Oaxaca. Los círculos indican la talla y densidad relativas de los erizos de mar. La dirección de las flechas indica la importancia de corales y rocas en la ordenación.
Por otro lado, el análisis de datos reveló que existe una relación significativa entre la puntuación del primer componente (PCO1) de la ordenación y la talla de D. mexicanum (r 2 = 0.79, P = 0.00) (Fig. 2b), así como entre la puntuación y la densidad de erizos (r 2 = 0.28, P = 0.03) (Fig. 2c). Lo anterior indica que las variaciones espaciales de la talla (79%) y la densidad (28%) de los erizos pudieran estar explicadas por las características del sustrato de cada sitio. Es decir, los organismos alcanzaron mayor talla y densidad en sitios con mayor cobertura de roca (e.g., Puerto Ángel) y baja cobertura de coral vivo. De manera individual, la densidad de erizos se correlacionó inversa y significativamente con la cobertura coralina (r de Spearman = -0.59, n = 15, P < 0.05) y la abundancia de algas (r de Spearman = -0.53, n = 15, P < 0.05), pero directamente con la presencia de rocas (r de Spearman = 0.53, n = 15, P < 0.05). El diámetro de los individuos de D. mexicanum se correlacionó inversa y significativamente con la cobertura de coral (r de Spearman = -0.82, n = 15, P < 0.05) y algas (r de Spearman = -0.81, n = 15, P < 0.05) y directamente con la presencia de rocas (r de Spearman = 0.78, n = 15, P < 0.05).
La remoción de carbonatos totales fue directamente proporcional a la talla del organismo (clase 1 = 0.052 g/ind/d, clase 2 = 0.202 g/ind/d, clase 3 = 0.325 g/ind/d), de tal forma que los individuos pequeños removieron menor cantidad de carbonatos que los individuos grandes. Del total de carbonatos removidos por los erizos, el 22% correspondió a aragonita coralina y el 78% a calcita de magnesio; esta última fue significativamente mayor que la primera (t = -6.21, P = 0.000). Respecto a la remoción por tipo de carbonato y talla, se observó la misma relación que para los carbonatos totales, es decir, tanto la remoción de aragonita coralina como la de calcita de magnesio fueron directamente proporcionales a la talla de los individuos.
La tasa de acumulación de carbonatos en comunidades y arrecifes coralinos presentó diferencias significativas (H = 47.17, P = 0.00) entre todas las zonas (Q = 2.39). Bahías de Huatulco presentó la mayor tasa de acumulación, seguida de Ixtapa-Zihuatanejo y Puerto Ángel (Tabla 1). Se detectaron diferencias significativas entre los sitios de Ixtapa-Zihuatanejo (H = 14.81, P = 0.005) y Puerto Ángel (H = 10.42, P = 0.03), pero no entre los sitios de Bahías de Huatulco (H = 8.50, P = 0.13). En Puerto Ángel (Q = 2.80) las diferencias ocurrieron entre todos los sitios. En Ixtapa-Zihuatanejo (Q = 2.80), las tasas de acumulación en Zacatoso y Manzanillo fueron significativamente mayores que en El Chato, Morros del Cerro Colorado y Caleta de Chon (Tabla 1); Zacatoso por su parte, presentó una tasa de acumulación mayor que Manzanillo.
Respecto a la tasa de remoción de carbonatos por la actividad alimenticia de D. mexicanum en comunidades y arrecifes coralinos, se observaron diferencias significativas entre zonas (H = 24.78, P = 0.00). La tasa de remoción fue mayor en Puerto Ángel (Q = 2.39), seguido de Bahías de Huatulco e Ixtapa-Zihuatanejo (Tabla 1). La tasa de remoción varió significativamente entre los sitios de Ixtapa-Zihuatanejo (H = 11.96, P = 0.01) y los sitios de Bahías de Huatulco (H = 12.17, P = 0.03), pero no entre los sitios de Puerto Ángel (H= 8.37, P = 0.07). En Ixtapa-Zihuatanejo (Q = 2.39), las diferencias ocurrieron entre todos los sitios, excepto entre Morros del Cerro Colorado y El Chato. En Bahías de Huatulco (Q = 2.93), La Entrega difirió significativamente del resto de los sitos, Cacaluta de Violín y San Agustín, y Riscalillo de San Agustín (Tabla 1).
Por último, el balance entre acumulación y remoción de aragonita coralina indicó que esta última fue de sólo 3.1% del total depositado en Puerto Ángel, donde la remoción fue más intensa. No obstante, valores más modestos se observaron en Bahías de Huatulco, seguido de Ixtapa-Zihuatanejo. Así, en los arrecifes que se desarrollan frente a las costas sudoccidentales de México, la acumulación neta de aragonita coralina (~96.9%) fue mucho mayor que la remoción (~3.1%) por la actividad alimenticia de D. mexicanum en todas las zonas (Tabla 1).
Discusión
Los resultados mostraron que la remoción de carbonatos por la actividad alimenticia de D. mexicanum representa una pequeña fracción (~3.2%) del total de carbonatos depositados por los corales constructores de arrecife frente a las costas del Pacífico del sur de México. Lo anterior sugiere que la actividad alimenticia de esta especie no compromete el crecimiento y permanencia de las comunidades y arrecifes coralinos en Ixtapa-Zihuatanejo en Guerrero y en Puerto Ángel y Bahías de Huatulco en Oaxaca. Así, lo aquí reportado es opuesto a lo observado en los años de la década de 1980 en Panamá por Glynn (1988) y en Costa Rica por Guzmán y Cortés (1989 b), en donde se registró que D. mexicanum erosionó activamente los sistemas coralinos de la región. Sin embargo, nuestros resultados concuerdan con lo reportado por Reyes-Bonilla y Calderón-Aguilera (1999) para cabo Pulmo, por Herrera-Escalante et al. (2005) y Benítez-Villalobos et al. (2008) para Huatulco y por Alvarado et al. (2012) para isla Cocos, isla Caño y bahía Culebra en Costa Rica, en donde se observó que los carbonatos removidos por los erizos representan una pequeña fracción de lo depositado por los corales constructores de arrecifes.
Contrario a los valores de remoción diaria previamente registrados para D. mexicanum en el Pacífico oriental, los observados durante el presente estudio (0.52-0.324 g/ind/d) fueron menores que los encontrados en Panamá (1.98 g/ind/d, Glynn 1988), Huatulco (2.08 g/ind/d, Herrera-Escalante et al. 2005) y Costa Rica (0.56-2.25 g/ind/d, Alvarado et al. 2012). Los valores de la remoción diaria estimados en el presente estudio se traducen en un impacto anual de 0.03 kg/m2/año en las comunidades y arrecifes coralinos del sudoeste de México, lo que representa, cuando se contrasta con los valores de remoción anual más bajos, sólo el 17% de lo registrado para otros arrecifes de la región (Panamá, 3.47-10.4 kg/m2/ año, Glynn 1988; Huatulco, 0.17-4 kg/m2/año, Herrera-Escalante et al. 2005, Benítez-Villalobos et al. 2008; Costa Rica, 0.31-0.75 kg/m2/año, Alvarado et al. 2012).
La remoción anual de D. mexicanum en las comunidades y arrecifes coralinos de las costas del Pacífico del sur de México está íntimamente ligada a la actividad alimenticia de la especie (Glynn 1988) y a su variación en función de la talla (Herrera-Escalante et al. 2005). La remoción, además, está asociada a los niveles de densidad, los patrones de distribución espacial (i.e., agregación) y la distribución espacial de los erizos en las distintas zonas del arrecife (Hawkins 1981, Bak 1994, Woodley 1999). El valor del contenido de carbonatos totales en las heces de D. mexicanum en función de la talla se encuentra dentro de los valores observados para otras especies de Diadema que ocurren en el Caribe y en el océano Pacífico (Perry et al. 2012). Sin embargo, cuando se considera el tipo de carbonato removido, la dieta de D. mexicanum incluye sólo ~6-22% de aragonita coralina, mientras que el porcentaje restante corresponde a calcita de magnesio. Los resultados del presente estudio contrastan marcadamente con lo observado por Glynn (1988) en Panamá, donde D. mexicanum removió una mayor proporción (~75%) de aragonita coralina. La asimetría entre los valores obedece a diferencias metodológicas, aunque una parte de la variación pudiera resultar de las diferencias en el tipo de sustrato en donde la especie lleva a cabo su actividad alimenticia o las diferencias espaciales en los hábitos alimenticios de la especie. Glynn (1988) observó que la bioerosión de D. mexicanum es dos veces mayor en sustrato de coral muerto que en coral vivo. En perspectiva, el efecto de la actividad alimenticia de D. mexicanum en las costas del Pacífico del sur de México pudiera estar íntimamente ligado con el estado de conservación de los sistemas estudiados. Así, comunidades y arrecifes con grandes extensiones de coral muerto experimentarán niveles de remoción de aragonita coralina elevados y viceversa. Además, el efecto combinado entre los mayores niveles de remoción de aragonita coralina relacionados al estado de conservación, el aumento de la densidad y el comportamiento gregario de D. mexicanum (Levitan 1988) podrían exacerbar la bioerosión de la estructura arrecifal. Lo reportado para Costa Rica, Panamá y las islas Galápagos posterior al evento de El Niño 1982-1983 (Glynn 1988, Guzmán y Cortés 1992, Eakin 1996, Reaka-Kudla et al. 1996, Alvarado et al. 2012) representan ejemplos donde un empobrecimiento en el estado de conservación de la comunidad coralina promueve procesos erosivos relevantes. En el caso de las costas del Pacífico del sur de México, comunidades y arrecifes coralinos en el área de Acapulco en Guerrero (López-Pérez et al. 2012) y Puerto Escondido (López-Pérez, datos sin publicar), Puerto Ángel (Reyes-Bonilla y Leyte-Morales 1998) y Bahías de Huatulco en Oaxaca (Glynn y Leyte-Morales 1997, López-Pérez y Hernández-Ballesteros 2004) pudieran haber experimentado una rápida bioerosión luego del deterioro del estado de conservación producto, principalmente, de la actividad humana en la región, aunque carecemos de datos para confirmarlo.
En términos generales, la densidad de D. mexicanum en las comunidades y arrecifes coralinos de las costas del Pacífico del sur de México no difiere, o se encuentran ligeramente por debajo, de los valores registrados para otros sistemas arrecifales del Pacífico Oriental Tropical (Alvarado y Fernández 2005, Herrera-Escalante et al. 2005, Benítez-Villalobos et al. 2008, Alvarado et al. 2012). En el área de estudio, se observaron diferencias significativas en la densidad de D. mexicanum a distintas escalas espaciales. De acuerdo con nuestros resultados, la distribución espacial de la densidad y talla de D. mexicanum en la zona de estudio pudiera estar explicada por la variación en el tipo de sustrato. En particular, la mayor densidad y talla de D. mexinanum se encontró en aquellos sitios donde la cobertura de corales y algas fue más baja y donde la cobertura de roca fue mayor. Estos resultados pueden dar indicios acerca de los potenciales efectos, presentes y futuros, de la bioero-sión de D. mexicanum en las comunidades y arrecifes coralinos de las costas del Pacífico del sur de México. En general, los mayores niveles de bioerosión por la actividad alimenticia de D. mexicanum se observaron en Puerto Ángel (Oaxaca) y los menores en Ixtapa-Zihuatanejo (Guerrero). De continuar los presentes niveles de uso y estado de conservación de los sistemas coralinos frente a las costas suoccidentales de México, podríamos esperar una bioerosión cada vez más importante en las comunidades y arrecifes en el área de Puerto Ángel (Oaxaca), en particular en sitios como La Tijera y Playa del Muerto en donde se observan importantes secciones (>30%) de coral muerto.
Finalmente, el presente recuento de bioerosión sólo incluye el efecto potencial de la actividad alimenticia de D. mexicanum sobre comunidades y arrecifes coralinos frente a las costas sudoccidentales de México, pero deja de lado la bioerosión asociada a la abrasión mecánica de las espinas de los erizos (Herrera-Escalante et al. 2005). De manera adicional, los datos de bioerosión de las comunidades y arrecifes coralinos del Pacífico sur mexicano aquí presentados deben ser considerados parciales, pues no consideran la bioerosión por esponjas (Nava y Carballo 2008; Carballo et al. 2008, 2013), peces (Ong y Holland 2010), moluscos y otros macro y micro bioerosionadores (Perry et al. 2012) que contribuyen de manera importante a la remoción de carbonatos de los ecosistemas arrecifales.











 texto en
texto en