Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.41 no.4 Ensenada dic. 2015
https://doi.org/10.7773/cm.v41i4.2571
Artículo de revisión
Efectos del clima oceánico sobre el ciclo de vida y la distribución de peces pelágicos menores en el Sistema de la Corriente de California, frente a Baja California
1 Facultad de Ciencias Marinas, Universidad Autónoma de Baja California, Carretera Tijuana-Ensenada #3917, Zona Playitas, CP 22860 Ensenada, Baja California, México
2 Departamento de Oceanografía Biológica, División de Oceanología, Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE), Carretera Ensenada-Tijuana #3918, Zona Playitas, CP 22860 Ensenada, Baja California, México
Los peces pelágicos menores son importantes indicadores ecológicos del estado del Sistema de la Corriente de California, ya que su abundancia y distribución se ven alteradas directamente en respuesta a los forzamientos climáticos. Estas especies forman cardúmenes, consumen plancton y son forraje para niveles tróficos superiores. En este trabajo se describen las historias de vida y los patrones de distribución de la sardina, anchoveta y dos especies de macarela que ocupan aguas del océano Pacífico frente a la península de Baja California (México). Desde el punto de vista de las pesquerías (cuando la información está disponible), se abordan temas relacionados con los forzamientos biofísicos que mantienen y estructuran la condición del hábitat de las especies, sus patrones de movimiento, su productividad y la estructura poblacional relativo a las subpoblaciones. A pesar de que la información basada en las pesquerías puede estar sesgada por la escala de operación y las áreas de disponibilidad de los peces, en este trabajo las capturas se utilizan como indicadores de la historia de vida de las diferentes subpoblaciones. Para evaluar la validez de varios paradigmas existentes en oceanografía pesquera, se utilizaron principalmente estudios basados en sardina. Por último, con el objetivo de describir cómo el ambiente puede establecer la estructura poblacional de los peces pelágicos, se discute la variabilidad espaciotemporal de las dos subpoblaciones, norteña y sureña, de sardina (Sardinops sagax) y macarela (Scomber japonicus) de 2000 a 2014. En respuesta al enfriamiento regional mantenido desde el inicio de este periodo, las subpoblaciones norteñas muestran una tendencia a contraerse hacia el sur del sistema, hasta aguas frente a bahía Magdalena. Estos cambios en distribución y productividad de una población parecen ser resultado de los efectos combinados de la pesca y el cambio en el clima del océano que podrían alterar las características del hábitat.
Palabras clave: peces pelágicos menores; subpoblaciones; forzamientos; Baja California; hábitat
Due to their sensitivity to climate forcing that may alter their abundance and distribution, small pelagic fish are important ecological indicators of the state of the California Current System. They are schooling, planktivorous fish that provide forage for higher trophic levels. We describe the life cycle histories and patterns of distribution of sardine, anchovy, and mackerel species occupying the waters along the west coast of the Baja California Peninsula (Mexico). The links between the physical and biological forcing and the structure and condition of their habitats, their patterns of movement, productivity, and stock structure (where information is available) are described in relation to the fisheries. We have used the catches as a proxy for the history of the different stocks, while recognizing that fisheries-derived information is biased by the operational scale and only covers areas where fish are available. We have relied mainly on studies of sardines to evaluate the validity of the principal paradigms in fisheries oceanography. We describe how the environment can structure a population by relating an example given by the spatiotemporal variability of the northern and southern stocks of Pacific sardine (Sardinops sagax) and Pacific mackerel (Scomber japonicus) from 2000 to 2014. During this period, the northern stocks showed a marked tendency to contract southwards, as far south as Magdalena Bay, in response to the regional cooling that began in the previous decade. It appears that the combined effects of fishing and climate change may sufficiently alter habitat characteristics so that both the distribution and productivity of a population are shifted.
Key words: small pelagic fishes; stocks; physical forcing; Baja California; habitat
Introducción
El objetivo de este artículo es examinar los patrones de distribución y las historias de vida de los peces pelágicos menores a lo largo de la costa occidental de la península de Baja California (México) en el contexto de la circulación regional del Sistema de la Corriente de California (SCC). Nos enfocaremos en las especies más importantes de la región: la sardina del Pacífico (Sardinops sagax), la anchoveta (Engraulis mordax), la macarela del Pacífico (Scomber japonicus) y el charrito (Trachurus symmetricus). La variabilidad climática en diferentes escalas (estacionales a interde-cadales) contribuye a modificar las características físicas, químicas y biológicas del hábitat de estas especies. Su movilidad les permite cambiar sus zonas de desove tanto en el tiempo como en el espacio, y así garantizar el éxito reproductivo para sostener sus poblaciones. Se examinan las tendencias históricas de las capturas comerciales, la variabilidad de la distribución del desove y la abundancia de huevos como indicadores del movimiento y la productividad de las diferentes subpoblaciones. Se hace énfasis en la sardina del Pacífico y la macarela del Pacífico ya que son objeto de un manejo activo en las pesquerías de Baja California y muestran una importante variación de sus capturas en escalas de meses a décadas, además de que han sufrido colapsos históricos de sus poblaciones en el siglo XX.
Los peces pelágicos menores son componentes clave en el SCC. Estas especies generalmente presentan elevadas bio-masas y una amplia distribución. Además, comparten algunas características de sus ciclos de vida, entre ellas el ser planc-tívoras, formar cardúmenes y desovar en múltiples ocasiones duante un ciclo anual. Junto con eufáusidos, estas especies representan más del 10% de la biomasa del SCC y afectan la abundancia, la condición y el comportamiento de los niveles tróficos superiores en la cadena alimenticia (Kaplan et al. 2013). Una característica importante es su sensibilidad a cambios ambientales, lo que las hace vulnerables a las variaciones en los forzamientos físicos (Parrish et al. 1981) que conllevan a drásticas fluctuaciones en sus abundancias (Lluch-Belda et al. 1989, Schwartzlose et al. 1999, Alheit et al. 2009). Por otro lado, su explotación comercial, que representa alrededor del 25% de la captura de peces a nivel mundial (Checkley et al. 2009), también ha sido responsable de los cambios históricos en su productividad (Hsieh et al. 2006, Rykaczewski y Checkley 2008). Puesto que los peces pelágicos menores integran la productividad de niveles tróficos inferiores, los cambios en el tamaño de la población, a menudo drásticos, los convierte en indicadores importantes de la respuesta del ecosistema pelágico a los cambios del clima oceánico.
Una población es vulnerable a la combinación de la pesca y condiciones ambientales desfavorables que pueden reducir su capacidad reproductiva (Hsieh et al. 2006, Anderson et al. 2008). Las especies pelágicas planctívoras son más susceptibles a las pesquerías debido a la remoción de individuos adultos que resulta en distribuciones de edad, talla y fecundidad truncadas (Anderson et al. 2008). Según Peck et al. (2013), el colapso y reemplazo de una población comienza con un cambio en la abundancia vinculado a clases anuales menores debido a un menor éxito reproductivo. Puesto que la evaluación correcta de las escalas temporales y espaciales de distribución y abundancia puede estar sesgada por la escala operacional de la pesca, se requieren métodos independientes para estudiar el estado natural de las poblaciones. La información depende de factores tales como la longevidad de las especies y sus patrones de movimiento durante un ciclo anual, así como cambios de escala interanual y decadal.
Este artículo aborda aspectos relevantes de la historia de vida y distribución de las especies pelágicas menores que habitan aguas frente a la península de Baja California. Se presenta una descripción del entorno físico del SCC, se analizan aspectos más generales en cuanto a cómo el ciclo de vida de las especies está ligado al clima oceánico para determinar sus patrones de abundancia y distribución, y se describe el concepto de subpoblaciones y sus características demográficas que las distinguen. Nótese que designamos las diferentes subpoblaciones de sardina con nombres que reflejan su asociación con las masas de agua en las cuales habitan, esto es, subpoblación "subártica" y subpoblación "subtropical", a diferencia de Félix-Uraga et al. (2004) quienes usaron "fría" y "templada", respectivamente. A veces usamos "templado subtropical" y "frío subártico".
Además, se analiza la dinámica poblacional de pelágicos menores en las aguas frente a la parte norte de la península de Baja California en relación a su abundancia con base en las estadísticas de captura proporcionadas por el Instituto Nacional de Pesca (INAPESCA) para sardina, macarela y anchoveta (Cota-Villavicencio et al. 2010). Para evaluar la validez y utilidad de paradigmas existentes en la oceanografía pesquera, así como recalcar la importancia de la interacción del clima océanico con los recursos pesqueros, hemos incluido nuestras interpretaciones y datos en cuanto a la dinámica y comportamiento de la sardina en aguas baja cali-fornianas. En vista de que existe mucho más información para la sardina que para otros peces pelágicos menores, gracias a estudios que remontan a los años treinta del siglo pasado, principalmente sobre la sardina del Pacífico, usamos el ejemplo de la sardina con mayor frecuencia para ilustrar varias ideas e interpretaciones en torno a estas especies.
Entorno físico
La estructura y organización de una gran variedad de peces pelágicos menores a lo largo del SCC se relacionan estrechamente con la física y la dinámica del clima en los primeros 200 m de la columna de agua (Mackas 2006, Baumgartner et al. 2008, Checkley y Barth 2009, Durazo 2009). La producción biológica estacional de varias especies planctónicas se ve favorecida por la inyección de aguas saladas, frías y ricas en nutrientes a la capa superior mediante las surgencias costeras que se presentan a lo largo del año (Rykaczewski y Checkley 2008). El resultado de este forzamiento es la creación de una zona de transición cerca de la costa que separa las aguas costeras frías de las aguas oceánicas más cálidas y menos densas y salinas. La zona costera es dominada por el transporte de Ekman hacia fuera de la costa y la región oceánica es dominada por el flujo geostrófico (Lynn y Simpson 1987, Durazo y Baumgartner 2002). El agua recién surgida es normalmente transportada mar adentro por filamentos fríos y estructuras de mesoescala (~80-100 km) que se extienden 200-400 km (Mackas 2006, Checkley y Barth 2009). En la zona oceánica (~1000 km de la costa y desde la superficie hasta 300 m de profundidad), el flujo hacia el ecuador de la corriente de California (CC) acarrea agua fría y de baja salinidad a latitudes subtropicales y tropicales (Lynn y Simpson 1987).
En la costa, hay regiones donde se intensifica la surgencia costera inducida por el viento debido a la divergencia del esfuerzo del viento y efectos topográficos. El rotor del esfuerzo del viento induce surgencias afuera de la influencia del borde continental (Landry et al. 2012). Un rotor positivo dentro de la cuenca del Sur de California se asocia con la presencia de un giro ciclónico. El borde sur de este gran remolino se conoce como el Frente de Ensenada (centrado ~31°N). El giro separa la región norcentral de California de la cuenca del Sur de California y las aguas baja californianas en punta Concepción (34°N) (Fig. 1). A causa de este frente, el agua oceánica oligotrófica se transporta hacia la costa, lo cual suprime la producción primaria hacia el sur y conduce a concentraciones relativamente bajas de clorofila en la zona costera frente a Ensenada (Baumgartner et al. 2008). La elevación de la termoclina que sucede alrededor de cabos debido a efectos topográficos se observa en punta Baja (30°N) y punta Eugenia (28°N). Aquí, la surgencia se intensifica debido a la interacción del flujo promedio de la CC con ambos cabos (Barth et al. 2000). Esta región muestra un rotor del esfuerzo del viento negativo, a diferencia de los valores positivos hacia el norte y el sur (Nelson 1977), lo que implica una circulación en dirección de las manecillas del reloj. No obstante, la presencia de una circulación ciclónica casi permanente y aguas relativamente frías durante todo el año (Lynn y Simpson 1987, Durazo 2015) sugiere que la surgen-cia en el área es dominada más por la interacción entre la corriente y los cabos que por el rotor del esfuerzo del viento. La presencia de surgencias intensificadas debido a los cabos proporciona las condiciones necesarias para un buen suministro de nutrientes, mientras que la presencia de una circulación ciclónica proporciona el mecanismo físico para el crecimiento y la supervivencia de larvas. Un rotor del esfuerzo del viento positivo también podría ser importante en el golfo de Ulloa (~26°N), donde existen condiciones adecuadas para una productividad alta debido a la combinación del suministro de agua rica en nutrientes de punta Eugenia, la circulación ciclónica asociada con la divergencia del viento y la contribución de aguas del sur por el transporte inducido por un flujo costero hacia el polo de verano a invierno. Por lo tanto, la variabilidad espacial y temporal del rotor del esfuerzo del viento a lo largo de la península (Durazo 2015) puede jugar un papel importante en el bombeo estacional de nutrientes a la zona eufótica, así como estructurar los gradientes costa-océano de los productores primarios y secundarios frente a Baja California, como ha sido sugerido por Rykaczewsky y Checkley (2008).

Figura 1: Mapa que muestra la ubicación de los sitios mencionados en el texto: punta Concepción (PC), cuenca del Sur de California (SCB), Ensenada (ENS), punta Baja (PB), punta Eugenia (PE), bahía Magdalena (BM) y cabo San Lucas (CSL).
Se usó la hipótesis de Logerwell y Smith (2001) para examinar el paradigma de que "los modelos de reclutamiento basados en el medio ambiente invariablemente fallan al ser actualizados con datos nuevos" (Leggett y Frank 2008). Logerwell y Smith (2001) proponen que los remolinos podrían proporcionar un mecanismo para la expansión mar adentro de un hábitat favorable para el crecimiento y la supervivencia de larvas de sardina con una mayor concentración de clorofila dentro de ellos. Típicamente, los remolinos ciclónicos y anticiclónicos se propagan hacia el oeste a una velocidad de ~2 km por día (Kurian et al. 2011). Sin embargo, a pesar de proporcionar un mecanismo para la expansión mar adentro de un hábitat favorable para las etapas tempranas de sardinas, Nieto et al. (2014) proporcionan evidencia de que la advección mar adentro reduce el éxito del reclutamiento debido a la pérdida de los productos reproductivos de la población. No obstante, es razonable suponer que los remolinos localizados dentro del eje de la CC (ver fig. 5 de Nieto et al. 2014) permitan a larvas y juveniles tempranos alcanzar sitios de crianza y favorecer la supervivencia para que se recluten a la población adulta. Este estudio de Nieto et al. (2014) contradice la hipótesis de Logerwell y Smith (2001) y puede ser usado como la base de una hipótesis mejorada ya que sus resultados indican que el reclutamiento aumenta durante años cálidos de El Niño y es pobre durante años fríos de La Niña, lo que sugiere que el transporte de remolinos aumenta debido a la dinámica de Ekman. Las condiciones de El Niño, mientras tanto, impiden el transporte mar adentro de larvas y juveniles y posiblemente mejoren la supervivencia por el transporte hacia la costa o simplemente por retener una densidad relativamente alta de alimento en la zona costera.
Las escalas espaciales a nivel de cuenca también regulan las características del hábitat del SCC. Los cambios principalmente se asocian con la circulación atmosférica a gran escala que genera cambios importantes en el ambiente oceánico. En el Pacífico nororiental, el campo de viento está determinado por dos centros de presión atmosférica: el centro de baja presión de las islas Aleutianas (Baja Aleutiana), ubicado aproximadamente en 50°N, 170°W, y el centro de alta presión del Pacífico central. Esta combinación se conoce como la Oscilación del Pacífico Norte (OPN, Mackas 2006) centrado al norte de Hawái. Una intensificación de la Baja Aleutiana en invierno genera corrientes y vientos fuertes hacia el polo. La OPN se intensifica en primavera y verano y es responsable de los vientos del noroeste y la intensificación del transporte de Ekman hacia fuera de la costa frente a California y Baja California (Checkley y Barth 2009). En otoño e invierno, un debilitamiento del sistema de alta presión resulta en una disminución del flujo hacia el ecuador (U.S. GLOBEC 1994). Los cambios interanuales a decadales en la posición y magnitud de la OPN modifican los vientos favorables para surgencias, la temperatura superficial del mar (TSM) y el nivel del mar a esas escalas. En el ambiente oceánico, los cambios se perciben como variaciones en las contribuciones relativas de las principales masas de agua en los primeros 300 m, es decir, el flujo hacia el ecuador de agua subártica y el transporte hacia el polo de aguas tropicales y subtropicales.
La Oscilación Decadal del Pacífico (ODP, Mantua et al. 1997) y la Oscilación del Giro del Pacífico Norte (OGPN, Di Lorenzo et al. 2008) son los principales modos de variabilidad en el Pacífico Norte forzados por los centros de presión atmosférica. Las fluctuaciones en estos modos se han asociado con variaciones en salinidad, nutrientes y clorofila, con consecuencias en todos los niveles tróficos (Durazo 2009, Lavaniegos 2009). Di Lorenzo et al. (2013) sugirieron que la Baja Aleutiana controla la ODP y que está asociada con el primer modo de las anomalías de la TSM del Pacífico Norte. La fase cálida de la ODP se asocia con la intensificación de la Baja Aleutiana y un debilitamiento del flujo hacia el ecuador de la CC (King et al. 2011). La respuesta a un debilitamiento de los vientos favorablas para surgencias es un aumento anómalo de la TSM y el nivel del mar cerca de la costa que reduce el gradiente de presión oceánico hacia la costa. La OGPN es la respuesta oceánica al forzamiento de la OPN, que se identifica como el segundo modo de la anomalía del nivel del mar para el Pacífico Norte central y oriental (180-110°W, 25-62°N; Di Lorenzo et al. 2010). La fase positiva de la OGPN se asocia con la intensificación de la OPN, que a su vez intensifica los vientos del noroeste y el flujo hacia el ecuador de la CC.
Otro proceso oceáno-atmósfera que afecta el hábitat oceánico es El Niño/Oscilación del Sur (ENOS). Existen dos tipos de ENOS: El Niño canónico y El Niño que se presenta en el Pacífico central (Kug et al. 2009). Di Lorenzo et al. (2013) propusieron un modelo conceptual en el que la variabilidad del clima en el Pacífico Norte durante varias décadas produce una redistribución hacia el polo del calor proveniente de latitudes tropicales. El calentamiento provocado por ENOS en regiones ecuatoriales modifica la circulación atmosférica zonal y meridional (células de Hadley y Walker), lo cual eventualmente altera los patrones globales de precipitación y evaporación. La redistribución del calor tropical relacionado con cambios en las masas de agua y los campos de estrés del viento (Durazo y Baumgartner 2002) puede tener un efecto de abajo hacia arriba en la cadena alimenticia del ecosistema (U.S. GLOBEC 1994, Checkley y Barth 2009, McFarlane et al. 2010).
Adaptación del ciclo de vida a la variabilidad de las condiciones oceánicas
Las historias de vida de los peces pelágicos menores muestran adaptaciones similares que les permiten acoplarse a las variaciones estacionales de las condiciones del hábitat pelágico, las cuales incluyen la búsqueda de alimento, la reproducción y el crecimiento (Blaxter y Hunter 1982). Para buscar alimento y protegerse de los depredadores, estas especies poseen patrones de migración y un comportamiento agregativo (forman cardúmenes) (Radovich 1982, PFMC 1998). Tanto S. japonicus como T. symmetricus tienen individuos de tamaño relativamente grande, los cuales presuntamente están adaptados para tener mayor rango de movimiento para buscar alimento. Todas las especies tienen reproducción ovípara, nocturna, y desovan en múltiples ocasiones durante un año, por lo que la máxima actividad de desove aparentemente está relacionada con una mayor disponibilidad de alimento (Blaxter y Hunter 1982).
Con excepción de T. symmetricus, todas las especies de peces pelágicos menores pertenecen a niveles tróficos intermedios (2-3); sin embargo, cambios estacionales importantes en el esfuerzo del viento modifican tanto la característica del hábitat como la composición del alimento de que dependen los pelágicos menores (Tabla 1). En particular, las anchovetas se alimentan por filtración o por depredación del zooplancton (alimentación por partículas). En el segundo caso, que es el dominante, tienen la capacidad de seleccionar copépodos y eufáusidos (Van der Lingen et al. 2009). Aunque no lo mencionan Van der Lingen et al. (2009), nosotros consideramos que sólo los individuos juveniles seleccionarían copépodos ya que el tamaño de la presa determina el tamaño del depredador. Entre los pelágicos menores, T. symmetricus es la especie más longeva (>30 años), de mayor fecundidad (1.85 × 106 huevos año-1) y de mayor tamaño (~80 cm). Se alimenta de crustáceos, peces pequeños y moluscos pelágicos (Demer et al. 2012). Las sardinas tienen una red branquial con mayor número de branquiespinas y dientes muy finos que probablemente mejoren la recolección de su principal fuente de alimento (Van der Lingen et al. 2009). Debido a que las sardinas presentan un órgano especial que les permite procesar materia vegetal, son capaces de alimentarse tanto de fitoplancton como de crustáceos (McFarlane et al. 2005, 2010). Las larvas muestran una preferencia por copépodos de ~3 mm (Van der Lingen et al. 2009). La macarela del Pacífico es más selectiva en su preferencia de presas y su dieta incluye calamar y otros moluscos pelágicos, así como peces menores como la anchoveta (CalCOFI 1953, Lo et al. 2010a, Demer et al. 2012; ver Tabla 1 para una comparación de las especies).
Tabla 1: Nivel trófico en relación con los hábitos ocupados por las diferentes etapas de vida de los peces pelágicos menores.

*Transitional areas refer to regions between coastal upwelling and oceanic waters
El uso que hacen las especies de sus ambientes seleccionados en diferentes etapas de sus vidas (larvas, juveniles, adultos) es considerado una adaptación a la variabilidad estacional. El ciclo de vida de la anchoveta se asocia con zonas de surgencia costera. Presenta máxima actividad reproductiva en invierno (Checkley et al. 2009) y sus áreas de desove se presentan en aguas costeras y pueden extenderse hasta ~300 km mar adentro (Blaxter y Hunter 1982). En comparación con otras especies de pelágicos menores, el cha-rrito generalmente se asocia con ambientes oceánicos oligo-tróficos (PFMC 1998, Anderson et al. 2008, Demer et al. 2012) y presenta máxima actividad reproductiva en junio (Macewicz y Hunter 1993). Su centro de abundancia se observa entre 150 y 400 km de la costa (Ahlstrom y Ball 1954). La macarela y sardina del Pacífico ocupan una zona transicional entre la región de surgencia costera y aguas oceánicas durante la primavera. La sardina principalmente se localiza frente a la parte central de California y la macarela frente a la región central de la península de Baja California (Parrish y MacCall 1978, Nevárez-Martínez et al. 2006, Lo et al. 2010b). La sardina presenta máxima actividad reproductiva en primavera y verano, mientras que la macarela solamente en primavera (abril a mayo), con huevos relativamente grandes en el norte y una reducción en el tamaño hacia el ecuador. A diferencia de la sardina, la distribución del desove de la macarela del Pacífico ocurre en parches de muy alta abundancia (Parrish y MacCall 1978, Lo et al. 2010a; ver Tabla 2 para una comparación de las especies).
Tabla 2: Subpoblaciones de peces pelágicos menores y sus preferencias latitudinales asociadas con las características hidrográficas del Sistema de la Corriente de California. Se definen con relación a las actividades humanas y sus preferencias por diferentes características termohalinas, diferentes periodos de reproducción y parámetros poblacinales únicos.

*Preferred spawing temperature is reported for the species, but the range may indicate the presence of stocks.
Una estrategia reproductiva que permite la adaptación de una especie al hábitat que ocupa es la flotabilidad de los huevos, ya que éstos pueden permanecer en los primeros 90 m de la columna de agua durante el tiempo de eclosión de 1.5-4 días (Ahlstrom 1954). El tamaño y la forma de los huevos son características útiles para la identificación de las especies. Se piensa que los huevos de la anchoveta tienen una forma ovalada para reducir el canibalismo (Blaxter y Hunter 1982). Según Moser (1996), los huevos de la sardina son esféricos, relativamente boyantes y de mayor tamaño (1.3-2.1 mm) que los del charrito (0.9-1.1 mm) y la macarela del Pacífico (0.8-1.3 mm). También son importantes las diferencias estacionales en cuanto al volumen del saco vitelino, consistente de proteínas. El peso seco del vitelo de los huevos desovados de invierno y primavera representa ~38% del peso, en comparación con 12-25% de los de verano (Fig. 8 de Blaxter y Hunter 1982). Esto ofrece un periodo de tiempo prolongado para la supervivencia de larvas en condiciones de inanición después de la oclusión.
La advección de larvas de zonas con concentraciones bajas de alimento y/o otros factores desfavorables mejoran sus probabilidades de supervivencia. Su dispersión debido a vientos y corrientes también puede reducir la posibilidad de supervivencia, aunque sus atribuciones específicias (e.g., forma y composición) y el relativamente corto periodo de incubación (<5 días) minimizan su dispersión fuera del área de desove. Conforme una especie extiende su distribución espacial, la selección del área de desove podría ser un mecanismo adaptativo para contrarrestar o usar la variabilidad de las condiciones ambientales, particularmente a escalas más largas como la decadal (Ahlstrom 1960). La colonización de áreas nuevas le permite a una población establecerse en condiciones ambientales más favorables, lo cual es muy evidente en la expansión y contracción de las poblaciones de peces pelágicos menores. Esto es consistente con la asociación entre el hábitat potencial de desove y las condiciones ambientales favorables indicada por Checkley et al. (2000), Lynn (2003) y Van der Lingen etal. (2005). También existe una tendencia hacia diferencias fenotípicas en pelágicos menores en respuesta a la variabilidad ambiental, mientras que hay poca o nula diferenciación genética (Smith 2005).
Las características fisicoquímicas del hábitat ocupado por pelágicos menores están controladas principalmente por la estructura e intensidad del campo de viento, el cual modifica la anchura de la zona oceánica costera y la posición del frente de surgencia. Estas condiciones pueden ser ilustradas mediante una comparación de las condiciones observadas durante 2002 y 2003 en el SCC (Fig. 2), las cuales utilizan escenarios climáticos obtenidos con el modelo numérico de asimilación de datos SODA-POP desarrollado por Carton et al. (2005), disponible en el sitio web de la Universidad de Texas A&M (http://sodaserver.tamu.edu). En 2002 se observaron anomalías positivas (negativas) de salinidad (temperatura) cerca de la costa. Esto es consistente con un incremento del esfuerzo del viento a lo largo de la costa durante un evento de La Niña, que a su vez incrementó el transporte de Ekman hacia fuera de la costa, con la consiguiente elevación de agua subsuperficial proveniente del borde de la plataforma continental que causó un incremento de la salinidad y un decremento de la temperatura en la superficie cerca de la costa. En contraste, en 2003 los vientos se debilitaron y produjeron anomalías positivas de temperatura, el debilitamiento del gradiente de altura dinámica costa-océano, surgencias más débiles y menores salinidades. Las condiciones observadas en 2003 se relacionaron con una reducción del transporte de agua de la CC, junto con una disminución del rotor del esfuerzo del viento y el bombeo de Ekman (Durazo 2009, Durazo et al. 2010). Estas condiciones permanecieron hasta 2006.

Figura 2: Patrones de circulación del esfuerzo del viento en la superficie del mar (flechas) en abril de 2002 y abril de 2003 obtenidos del modelo numérico SODA-POP. Los contornos de color indican las anomalías de magnitud del esfuerzo del viento en referencia a la climatología del esfuerzo del viento de 1958 a 2008. En 2003, la figura muestra un debilitamiento del esfuerzo del viento (0.04 N m-2) frente a la parte central de California, la región donde ocurre principalmente el desove de sardina. El intervalo de contorno es de 0.02 N m-2.
Desde principios de la década de 1990, el principal centro de desove de la sardina se encuentra frente a la parte central de California, con desplazamientos zonales y meridionales asociados con los fenómenos de El Niño y La Niña (Lynn 2003, Song et al. 2012). Durante condiciones de La Niña y una CC más intensa en la primavera de 2002, Baumgartner et al. (2008) observaron un movimiento importante hacia fuera de la costa de la subpoblación subártica que vive en aguas subárticas más frías y de menor salinidad. Su zona de desove se extendió hacia el sur hasta punta Eugenia (28°N), un comportamiento que no fue reflejado por el modelo conceptual de Félix-Uraga et al. (2004). En contraste, debido a una CC más débil y una reducción del transporte de Ekman durante El Niño de 2003, las especies fueron desplazadas hacia el norte de Baja California y centro de California, y hacia la costa. Así mismo, hubo un fuerte reclutamiento en 2004 en aguas frente a California, Oregón y Washington (Lo et al. 2010b, Zwolinski y Demer 2013). En 2003, la estabilidad de la columna de agua probablemente hubiera sido más favorable para el éxito reproductivo de la subpoblación subtropical.
Los cambios biogeográficos relacionados con el hábitat están vinculados a la concentración y densidad del plancton durante las etapas larvarias y adultas, con incrementos en la producción de huevos de sardina durante periodos de alta disponibilidad de alimento (Bakun y Broad 2002). Cuando la ganancia de energía excede los costos de movimiento, las sardinas de la subpoblación norteña empiezan a migrar después de alcanzar 20 cm de longitud y cumplir un año de edad (Zwolinski y Demer 2012). MacCall (2009) sugiere que, a diferencia de otras especies, una ventaja importante de las sardinas y anchovetas en un ambiente fluctuante es que son capaces de transferir su energía reproductiva a la temporada siguiente. Las anchovetas se trasladan a estuarios y zonas de surgencia costera en la cuenca del Sur de California cuando el tamaño de la población disminuye y las sardinas se trasladan a aguas costeras de Baja California (Marr 1960, Checkley et al. 2009). Cuando la población de sardina disminuye, los cardúmenes se mezclan con otros peces pelágicos menores como la anchoveta y la macarela (Bakun y Broad 2002), para reducir así el efecto de la depredación y compensar el menor nivel poblacional (Blaxter y Hunter 1982).
Los cambios poblacionales pueden modificar el potencial reproductivo y están positivamente relacionados con la edad (Hsieh et al. 2006, Anderson et al. 2008). A pesar de que los cambios en la estructura del ecosistema están forzados por variabilidad interannual (El Niño/La Niña), la persistencia en la dinámica atmosférica del Pacífico Norte a escalas decada-les produce regímenes del clima del océano con periodos de unos 30 años. Sorprendentemente, esto aún no parece haber sido afectado por el calentamiento global relacionado con el aumento de gases de efecto invernadero. Un ejemplo de estos cambios de régimen han sido observados en el enfriamiento regional entre 1947 y 1976 que provocó el cambio en la estructura de edades de sardina y macarela en las pesquerías del sur de California. Entre 1916 y 1959, la edad promedio de sardina en todos los puertos fue ~3.5 años (Marr 1960, Hsieh et al. 2006). Durante el colapso de la pesquería de sardina a principios de la década de 1940, las pesquerías de California y la costa del Pacífico noroccidental mostraron edades promedio con modas de 2 a 4 años (San Pedro y Columbia Británica), con un máximo de 8-13 años (Radovich 1982). En 1953, los individuos mayores de 4 años desaparecieron de la pesquería y no aparecieron en las muestras de California y Baja California (CalCOFI 1953). Además, datos de cruceros realizados en la costa durante el verano y otoño de 1950 a 1952 indicaron fallas reproductivas desde 1948, desde el norte de California hasta bahía Magdalena. En las capturas frente a Ensenada, la biomasa capturada en 1952 mostró un decremento de ~2.2 veces en relación con la biomasa capturada en 1951 (21,330 toneladas métricas [t]), así como la desaparición de individuos de 2-4 años pertenecientes a las clases de edad de 1946, 1947 y 1948 (CalCOFI 1953). La macarela mostró una tendencia similar, con una reducción importante en la edad de los individuos, de 5 a 1 años, entre 1929 y 1970 (Hsieh et al. 2006).
Los registros sedimentarios de escamas de sardina también muestran fluctuaciones interdecadales de la abundancia de sardinas en el SCC desde aproximadamente 400 AD, lo que probablemente refleja cambios en el reclutamiento asociado con la expansión/contracción de la población (Field et al. 2009). Esto explica las variaciones en el registro sedimentario de diferentes cuencas anóxicas en la CC, con una expansión de población con densidades altas frente al centro de California y la Columbia Británica, y una contracción en regiones de Baja California y el golfo de California (Parrish y MacCall 1978, Rodríguez-Sánchez et al. 2002). Se han observado resultados similares para la macarela. Las fluctuaciones en abundancia (que incluyen los colapsos de poblaciones) de peces pelágicos menores parecen ser casi periódicos, con periodos de ~60 años (Baumgartner et al. 1992).
Regiones de desove
La definición de una subpoblación explotada require suficiente información para caracterizar las diferentes zonas de desove y la época de reproducción de las diferentes subpoblaciones (tabla 2; MacCall 1986), mientras que la definición operacional depende principalmente de la zona de captura de la pesquería. Es importante reconocer que las distribuciones no son estables ya que las fluctuaciones decadales pueden alterar la ubicación de los centros de desove a lo largo del intervalo latitudinal de las subpoblaciones (Ahlstrom 1960, 1966). Sus rangos meridionales pueden cambiar en periodos de escalas interanuales a decadales según cambian las condiciones oceanográficas, de tal manera que se pueden diferenciar los hábitats de desove por sus propiedades termohalinas como se muestra en la Figura 3 y la Tabla 2. Aquí, definimos a una subpoblación como un grupo de individuos de una población sujeta a explotación humana, con parámetros biológicos singulares tales como tamaño a una edad y diferencias de fecundidad, atributos que dependen principalmente de la disponibilidad de alimento. Esto se demuestra por la baja fecundidad de la sardina del Pacífico en aguas del norte de Baja California donde la disponibilidad de alimento está limitada en comparación con los individuos en aguas del sur de California durante 1994 (ver fig. 11 en Lo et al. 2005).

Figura 3: Hipótesis de los movimientos latitudinales de las subpoblaciones de sardina asociados con las características hidrográficas del hábitat de desove durante el año 2000. En las gráficas de abajo se muestran los cambios geográficos del hábitat de desove de la subpoblación del norte (línea discontinua azul) y del sur (línea discontinua roja). Los hábitats, definidos como hábitats subártico y subtropical, de desove de las dos subpoblaciones se diferencian por las propiedades termohalinas del agua que se muestran en la parte superior de la figura. Los colores y números en la gráfica indican la estacionalidad de temperatura y salinidad durante la recolección de huevos realizada por el programa IMECOCAL en 2000: enero (negro), abril (azul), julio (verde) y octubre (rojo).
Se ha identificado la existencia de tres subpoblaciones de sardina en el SCC, desde el norte de California hasta las aguas frente a la península de Baja California y el golfo de California (Félix-Uraga et al. 2004, Smith 2005). Esto es consistente con los patrones de movimiento establecidos por Clark (1945) para la sardina mediante estudios de marcaje durante el periodo de 1935 a 1944. Los datos morfométricos de otolitos asociados con las temperaturas del agua donde se capturan los individuos (García-Rodríguez et al. 2011) y el análisis de cohortes (Félix-Uraga et al. 2005) proporcionan evidencia adicional de estas tres subpoblaciones de sardina. Los morfotipos probablemente son el resultado de los factores ambientales que modifican las características del organismo ya que no hay evidencia de una separación genética de las subpoblaciones. Aunque la población de anchoveta también consiste de tres subpoblaciones, el análisis de alozimas indica que su estructura genética es muy compleja y diferenciada (Hedgecock 1986). Depósitos marinos del Plio-Pleistoceno y restos de peces ubicados en con-cheros costeros indican que la anchoveta ha estado presente en el SCC durante por lo menos diez millones de años, mientras que la sardina del Pacífico sólo apareció alrededor de hace 15,000 años (Fitch 1969). Las características de las subpoblaciones de peces pelágicos menores en la CC y el golfo de California se describen en la Tabla 3.
Tabla 3: Parámetros demográficos asociados con las poblaciones de peces pelágicos menores que muestran diferencias en las tallas y niveles tróficos entre especies, así como una variación considerable en la madurez sexual, la frecuencia de desove y la fecundidad parcial.

Las expansiones y contracciones a gran escala de los hábitats de las poblaciones de peces pelágicos menores se asocian con cambios considerables de la biomasa. Las variaciones interdecadales en la condición ambiental generan cambios progresivos en la abundancia y distribución de las poblaciones de anchoveta y sardina (Rodríguez-Sánchez et al. 2002, Lecomte et al. 2004). Estos cambios no sólo causan el desplazamiento de sus centros de biomasa sino también afectan la capacidad de acarreo de su hábitat en relación con la alimentación y reproducción (Barange et al. 2009). Cuando una población está en un periodo de contracción, su productividad disminuye y los individuos se mueven hacia refugios para asegurar su supervivencia. Para la anchoveta, estas zonas han sido las aguas en la parte norte del SCC frente a Oregón. En contraste, después del colapso de la población de sardina del Pacífico, que empezó a finales de la década de 1940, ésta se contrajo hacia el sur, a aguas frente a la península de Baja California donde la mortalidad natural y la falta de éxito reproductivo redujeron la biomasa a niveles muy bajos (Marr 1960, Rodríguez-Sánchez et al. 2001).
Perspectiva histórica de los cambios en las poblaciones de peces pelágicos menores
El manejo de los pelágicos menores a lo largo de la costa occidental de la península de Baja California está regulada por la Norma Oficial Mexicana 003-PESC-1993 (DOF 1993) y el plan de manejo de SAGARPA (2012). Estas regulaciones abarcan aspectos técnicos y operacionales de la pesquería. El plan de manejo, cuyo objetivo es la sustentabilidad de los recursos y la mitigación de los impactos ambientales y pesqueros, se basa en un talla mínima legal de captura. Actualmente la productividad de la pesquería se mide como la cantidad de biomasa capturada; sin embargo, debido a las características demográficas únicas y a la respuesta particular a las condiciones ambientales de estas especies, se requiere de un plan de manejo independiente de la pesquería para monitorear y evaluar cada subpoblación a lo largo de la península. Las tallas mínimas de captura y las épocas de veda deberían tomar en cuenta el estatus de la población y los picos de máxima actividad reproductiva en cada región.
Las aguas frente a la península de Baja California se dividen en dos unidades de pesca: una al norte que se extiende desde la frontera entre Estados Unidos y México hasta punta Baja y una al sur que se extiende desde punta Eugenia hasta al sur de bahía Magdalena (Cota-Villavicencio et al. 2010, Torres-Villegas 2012). Las capturas se desembarcan en el puerto de Ensenada en el norte y en puerto San Carlos en bahía Magdalena en el sur. A pesar de que la operación de la flota pesquera se restringe a una distancia de 70 km de la costa (DOF 1993), actualmente opera a una distancia de ~20 km de la costa debido a la falta de refrigeración adecuada (Cota-Villavicencio et al. 2010). Las cuatro especies de pelágicos menores se registran en las capturas de la región norte, pero las capturas en la región de bahía Magdalena consisten de sólo sardina y macarela (Nevárez-Martínez et al. 2006). En la última década, la sardina y macarela, que actualmente están sujetas a un manejo activo, principalmente se congelan para exportación o para consumo nacional (SAGARPA 2012). La biomasa de los desembarques de ambas especies se utiliza como un indicador de la productividad de la pesquería. La anchoveta norteña y el charrito (Trachurus) son de manejo pasivo y no se ha establecido un límite superior para las capturas anuales.
La historia de la operación de la flota de Ensenada muestra cuatro periodos: exploración, sustitución, desarrollo y consolidación (Fig. 4; en referencia a la identificación que se presenta en la fig. 7 de Csirke 1985). La etapa de exploración se extendió de 1929 a 1950. La pesca de sardina comenzó en Ensenada en 1929, y se extendió hasta la isla de Cedros y bahía Magdalena en las décadas de 1940 y 1950, respectivamente, debido a la demanda en el mercado local (Nevárez-Martínez et al. 2006). Al finalizar la década de 1940, la captura de la sardina del Pacífico empezó a disminuir. Estudios de marcaje indicaron un desplazamiento de la subpobla-ción norteña hacia el norte de Baja California, y mostraron que el recurso carecía de regulación y estaba sujeto a una intensa presión de pesca desde el sur de California hasta la Columbia Británica (Clark 1945). Las capturas en los puertos de California disminuyeron gradualmente y el desplazamiento hacia el norte estaba limitado a aguas del centro de California. El área de desove de la subpoblación norteña se desplaza inicialmente hacia la parte central de Baja California en 1949 (CalCOFI 1953). Para 1952, la sardina había dejado de desovar al norte de punta Concepción y se había desplazado hacia la región de punta Baja al sur de bahía Magdalena (Ahlstrom 1960). En cada año subsiguiente se observaron fracasos reproductivos a escala regional debido a la ausencia de alimento, a su pesca no regulada y a condiciones ambientales desfavorables (Marr 1960) hasta el inicio de su recuperación en la década de 1980, confirmado enfáticamente por la reaparición de sardinas en aguas de Columbia Británica en 1992 (McFarlane y Beamish 2001).

Figura 4: Serie de tiempo de las capturas de sardina del Pacífico (Sardinops sagax) realizadas por la flota que opera frente a la parte norte de la península de Baja California, desde la costa hasta 20 km mar adentro. La información incluye las capturas de la isla de Cedros hasta 1994, cuando la flota dejó de operar.
Con el colapso de la pesquería de sardina del Pacífico en California, comenzó una etapa de sustitución, que se caracterizó, por un lado, por la exploración de otros recursos como la anchoveta y, por otro, por el traslado de la flota mexicana al golfo de California (Nevárez-Martínez et al. 2006). La captura de otros pelágicos menores se volvió importante durante el periodo en que colapsó la sardina, con un aumento y expansión de la biomasa de anchoveta entre 1950 y 1952, que eventualmente se convirtió en la pesquería más importante de California (CalCOFI 1953). La distribución de las larvas de T. symmetricus indicaban un núcleo de desove en la parte central de la península de Baja California (entre punta Concepción y punta Baja), ubicada entre 150 y 600 km de la costa durante marzo a julio (CalCOFI 1953). Las capturas del charrito en el sur de California mostraron un aumento en el tamaño de los individuos, de 20.3 a 38.1 cm, con una edad predominante de 2 años y máxima de 6. Durante este periodo, también se encontraron larvas de la macarela del Pacífico durante todo el año, en la misma región donde el charrito realizaba el desove, con abundancias máximas en abril y mayo (CalCOFI 1953). La captura de macarela del Pacífico mostró un comportamiento similar al de la sardina, e incluso el colapso de su pesquería (Parrish y MacCall 1978). Las capturas de macarela, anchoveta y charrito disminuyeron en California pero aumentaron en Baja California (CalCOFI 1953). Los desembarques de anchoveta en Ensenada adquirieron mayor importancia debido al colapso de la anchoveta peruana a principios de la década de 1970, y la demanda provocó una explotación intensiva en el norte de Baja California (Nevárez-Martínez et al. 2006), con una captura máxima de >2.5 x 105t alcanzada en 1981 (ver fig. 1 en Cota-Villavicencio et al. 2010).
En comparación con otros pelágicos menores, la anchoveta muestra mayor sensibilidad a cambios ambientales, los cuales reducen la supervivencia y el reclutamiento de sus juveniles. Con el incremento gradual de temperatura en el SCC después de 1976, el hábitat de desove de la anchoveta se contrajo hacia el norte. Las capturas en Baja California (individuos de edad 0 y 1 año) disminuyeron en importancia con el desplazamiento de sus áreas de desove al sur de California (MacCall 2009). Butler et al. (1993) sugirieron que las mayores temperaturas podrían haber disminuido las tasas de crecimiento de las etapas larvales tempranas después de agotar sus reservas del saco vitelino, lo que redujo el tamaño de las población de larvas en un 74%. Durante este periodo, las capturas ocasionales de sardina y macarela aumentaron, dando paso a la etapa de desarrollo de sus pesquerías en México (Cota-Villavicencio et al. 2010).
A finales de la década de 1980, la pesquería de anchoveta en Baja California colapsó al mismo tiempo que el área de desove se desplazó hacia el norte, al sur de California. En esta region, el desove presentó una amplia distribución en 1997 y de 2005 a 2008, aunque en algunos años se confinó a aguas costeras o fue casi nulo (Bjorkstedt et al. 2010). En Baja California se ha registrado una importante actividad de desove de la anchoveta desde 2006. Datos del programa Investigaciones Mexicanas de la Corriente de California (IMECOCAL) indican desoves importantes del charrito frente a Baja California especialmente en el invierno de 2001, cuando no se registró en California. Las áreas de desove del charrito están ampliamente distribuidas en aguas oceánicas de Baja California e indican un patrón de migración meridional en primavera/verano y otoño/invierno. Su presencia en la región de CalCOFI ha sido limitada a densidades relativamente bajas y durante años cálidos su distribución traslapa con zonas de desove de la sardina tanto frente al sur de California como al norte de Baja California (Baumgartner et al. 2008, Bjorkstedt et al. 2010).
Félix-Uraga et al. (1996) sugirieron que un incremento en el reclutamiento de sardinas posterior a 1984 (>1.5 x 108 individuos) en la pesquería de bahía Magdalena fue resultado de un aumento considerable en las capturas. El incremento en la abundancia de la sardina fue detectado por el aumento (de hasta 16 veces) en las capturas durante el periodo de recuperación de la pesquería de 1984 a 1994. Se observaron individuos de mayor edad (>5 años) en las capturas de bahía Magdalena en 1983, 1988 y 1992, seguido por un fuerte reclutamento en los años subsiguientes (Félix-Uraga et al. 1996, 2004). El año de mayores capturas en Ensenada fue 1989 (8566 t), favorecido por un desplazamiento hacia el norte de la distribución de la subpoblación subtropical (17-20 °C en otoño), con la consecuente disminución de los desembarques en bahía Magdalena en los años posteriores, de 1989 a 1993 (Félix-Uraga et al. 1996). En bahía Magdalena, el reclutamiento presentó una tendencia al alza hasta 2004, a partir del cual el reclutamiento y las capturas presentaron una tendencia a la baja hasta 2010 (SAGARPA 2012). La disponibilidad de la subpoblación subártica frente a Ensenada disminuyó a principios de la década de 1990 debido a su desplazamiento hacia el norte, al sur de California (Félix-Uraga et al. 2004). Este resultado muestra dos elementos que se necesitan para entender la estructura poblacional y el movimiento de la sardina: (1) la información requerida para discriminar entre las dos subpoblaciones en las capturas de Ensenada es limitada antes de 1990 ya que la pesca se enfocaba más en la anchoveta que en la sardina, y (2) con la recuperación de la población de la sardina, ya perceptible a fines de la década de 1980, tanto la subpoblación subártica como la subtropical habían iniciado desplazamientos estacionales hacia el norte a lo largo de la costa, con la subpoblación subártica llegando hasta la Columbia Británica (MacFarlane y Beamish 2001, Lo et al. 2010b).
Frente a Ensenada, la etapa de consolidación de la pesquería comenzó a principios de la década de 1990 y continuó hasta 2013. Los desembarques de sardina han permanecido por arriba de un umbral de 22,5001 (1994), con capturas máximas en 1997 y 2011 de 68,000 y 70,0001, respectivamente (Félix-Uraga et al. 1996, Zwolinski y Demer 2013). La captura de la macarela del Pacífico también aumentó durante este periodo y eventualmente alcanzó un máximo de ~51,000t en 1998 (Nevárez-Martínez et al. 2006, Cota-Villavicencio et al. 2010). Lo et al. (1996) sugirieron que la biomasa de la subpoblación norteña subártica de la sardina fue favorecida por un incremento en el área de desove en primavera, los cuales estuvieron asociados a filamentos de agua fría (13-14.5 °C) en California (que incluye el área alrededor de la bahía de Monterey y Piedras Blancas) y, en menor medida, frente a la península de Baja California, alrededor de bahía Vizcaíno.
El monitoreo regional realizado con sensores de temperatura y salinidad a bordo de embarcaciones en movimiento, junto con la recolección de huevos de peces cerca de la superficie con un sistema para el muestreo continuo de huevos de peces (CUFES, por sus siglas en inglés; Checkley et al. 2000), muestran los intervalos termohalinos y de selección del hábitat por los adultos. Dadas las corrientes relativamente débiles de la CC (<30 cm s-1) y el resultante transporte horizontal limitado de huevos de peces (<26 km d-1), las áreas de desove claramente indican la presencia de adultos. Aquí se propone la hipótesis de un movimiento latitudinal sincrónico del hábitat de desove de las subpoblaciones norteña y sureña de la sardina del Pacífico frente a la península de Baja California, hábitats definidos por la temperatura y salinidad (Fig. 3). Esta idea es consistente con el patrón de movimiento espacial y temporal de estas subpobla-ciones propuesto en el modelo conceptual de Félix-Uraga et al. (2004) y corroborado por el modelo predictivo del hábitat potencial de la sardina (Demer y Zwolinski 2014). El desplazamiento hacia el sur de la subpoblación norteña está asociado con el transporte hacia el ecuador de agua fría del subártico hasta punta Eugenia durante las condiciones frías de La Niña en invierno y primavera, mientras que la subpo-blación sureña domina las capturas en esta región en verano y otoño (Baumgartner et al. 2008, Checkley et al. 2009). No obstante, la disponibilidad de la subpoblación subártica es menor debido a la limitada operación de la flota fuera de la costa (Cota-Villavicencio et al. 2010).
Con base en observaciones histológicas de las gónadas de sardinas provenientes de la captura comercial, la subpobla-ción norteña desova en invierno y primavera (SAGARPA 2012). La máxima producción de huevos ocurre en abril, aunque INAPESCA menciona que en algunos años puede ocurrir en marzo o febrero; sin embargo, como las capturas de sardina están limitadas a 20 km de la costa, estas estimaciones podrían estar fuertemente sesgadas ya que en primavera, las sardinas se trasladan fuera de la costa para desovar y evitar las aguas frías surgidas cerca a la costa. En muestras obtenidas con el sistema CUFES en primavera fuera de los frentes de surgencia y paralelos a la costa, Baumgartner et al. (2008) mostraron que la distribución y concentración relativa de huevos ocurrió entre 50 y 200 km de la costa. La información del hábitat de desove inferido de la presencia de huevos indicó una alta probabilidad de encontrar adultos reproductivos de sardina fuera del alcance de la flota pesquera.
Discusión
Hemos presentado una revisión del ciclo de vida de cuatro especies de pelágicos menores, su relación con el clima del océano y su distribución a lo largo de la costa occidental de la península de Baja California. Esta región es muy heterogénea en cuanto a la hidrografía, batimetría y productividad, y posee una amplia gama de hábitats que varían en el espacio (latitudinal y hacia/fuera de la costa) y el tiempo (de escalas estacionales e interanuales a interdecadales) que son ocupados por peces pelágicos a lo largo de la costa. Los hábitats son modificados por vientos paralelos a la costa, el rotor del esfuerzo del viento y las interacciones entre las corrientes y los cabos, especialmente el cabo prominente formado por punta Eugenia que forma el límite sur de la bahía Vizcaíno en la parte central de la península. El forzamiento por vientos paralelos a la costa en dirección al ecuador genera surgencias costeras que proporcionan el hábitat preferencial de la anchoveta. Mar adentro del área de surgencia, una zona frontal ofrece el suministro de alimentos necesarios para la sardina y la macarela del Pacífico que prefieren condiciones similares en sus hábitats. La región oligotrófica fuera de la costa, mantenida principalmente por el rotor del esfuerzo del viento, es ocupada por T. symmetricus, la especie de mayor tamaño y altamente móvil. La selección del hábitat por las especies descritas proporciona un sistema natural de organización para su separación en unidades que se manejan como subpoblaciones pesqueras. El plan de manejo actual requiere un monitoreo de la biomasa para las especies bajo manejo activo de su pesquería, aunque en el momento no se dispone de información en cuanto a los esfuerzos para cuantificar la biomasa de la sardina y macarela del Pacífico en la costa de la península de Baja California; sin embargo, esta información se podrá recabar en un futuro cercano con el nuevo barco oceanográfico de 62 m que recientemente fue puesto en servicio, equipado con instrumentos hidroacústicos, artes de pesca y un sistema CUFES. Un criterio fundamental sigue siendo el requerimiento de una talla mínima para los peces capturados. El objetivo global del plan de manejo es asegurar la continuidad de los recursos pesqueros al establecer niveles aceptables de explotación, que permiten rendimientos susten-tables de las especies sujetas a un manejo activo.
Uno de las paradigmas en la oceanografía pesquera es que la biomasa desovante (spawning stock biomass, SSB) es un indicador adecuado del potencial reproductivo de una subpoblación (Leggett y Frank 2008). El potencial reproductivo de una subpoblación pesquera es frecuentemente juzgado por el número de reclutas que se incorporan a la población adulta. Se puede usar la producción total de huevos basada en la tasa estimada de mortalidad de huevos y el tiempo de incubación (dependiente de la temperatura) como un indicador del potencial reproductivo que generalmente se correlaciona con la biomasa desovante. A pesar de que el método de producción diaria de huevos (Lasker 1985) es usado para estimar la biomasa desovante, el método requiere conocimiento de los parámetros de adultos, entre ellos la fecundidad parcial, el peso promedio y la proporción de hembras y su frecuencia de desove. Aun así, la relación entre la biomasa desovante y la producción de huevos no proporciona una estimación directa de la productividad que conduce al reclutamiento. El reclutamiento también está sujeto a condiciones ambientales desfavorables (o favorables) tales como el transporte hacia fuera de la costa (o hacia la costa) de huevos y larvas, que puede resultar en su pérdida (o supervivencia), así como en la disponibilidad (o falta) de alimento para larvas recién eclosionadas y en condiciones favorables (o desfavorables) para la supervivencia de individuos juveniles (prere-clutas). Leggett y Frank (2008) citaron a Yaragina y Marshall (2000) para indicar que "la búsqueda de una comprensión integral de los factores que regulan la variabilidad del potencial reproductivo, independiente de la SSB, puede ser tan compleja y tan intrincadamente ligada a factores ambientales y ecológicos, al igual que las causas en la supervivencia de huevos y larvas."
De marzo a junio de 2002 los desembarques de sardina en Ensenada (puerto de El Sauzal) incluyeron individuos juveniles (prereclutas) de menos de 15 cm de largo (menor que la talla legal), de menos de 1 año de edad y de menos de 50 g de peso (Fig. 5), y sugirieron un patrón de reclutamiento que depende del desove del año previo (febrero a julio de 2001). Se observa un contraste importante en cuanto a tamaño y peso entre el primer y el segundo semestre del año. La predominancia de la subpoblación subtropical de sardina en la captura resultó en un cambio abrupto a una talla mayor en julio (mostrado en Fig. 5) y su condición mejoró en julio y agosto en comparación con el primer semestre dominado por individuos de la subpoblación subártica (mostrado en Fig. 6). La disminución de la talla de las sardinas entre agosto y noviembre que se aprecia en la Figura 5 probablemente fue causada por la pesquería, como lo mencionan Hsieh et al. (2006).

Figura 5: Relación entre longitud y peso para las muestras mensuales de sardina del Pacífico (Sardinops sagax) en los desembarques del puerto de El Sauzal, justo al norte de Ensenada, de enero a noviembre de 2002. La línea discontinua roja separa los grupos de peces de 0 y 1 año de edad en la muestra de abril. Las escalas de longitud son de 100 a 200 mm para cada muestra.

Figura 6: Factor de condición promedio (W = peso total, L3 = [longitud furcal]3) vs el índice gonadosomático promedio (GSI; Wo = peso del ovario; Wtot = peso total).
Los desembarques de la flota pesquera de Ensenada sugieren que la disponibilidad de sardinas depende de los movimientos latitudinales de las subpoblaciones en el SCC. La Figura 7 muestra que hay un retraso de uno o dos meses entre los promedios mensuales de la climatología de largo plazo de las capturas y la TSM, lo que indica que la modificación estacional de las condiciones del hábitat induce una migración sincrónica de las subpoblaciones subártica y subtropical en concordancia con el modelo conceptual del movimiento de las subpoblaciones presentada por Félix-Uraga et al. (2004). Esto podría ser una respuesta de la biomasa de ambas subpoblaciones después del movimiento latitudinal de sus hábitats característicos. En verano y otoño, la subpobla-ción sureña se desplaza hacia el norte hasta San Pedro, California, y se contrae hacia la costa debido al calentamiento estacional. En invierno, la subpoblación norteña se desplaza hacia el sur hasta la parte norte y central de la península de Baja California y enseguida hacia mar adentro para desovar en primavera con el fin de evitar el agua fría de surgencia en la costa; por lo tanto, las capturas para 2002 son menores en abril, mayo y junio, como se muestra en la Figura 5. Cabe mencionar que los peces de edad 0 constituyeron alrededor de la mitad de los desembarques durante este periodo (Fig. 5). Esto sugiere que la zona cerca de la costa proporciona refugio contra los depredadores y una mayor concentración de alimento para los peces jóvenes.

Figura 7: Patrón temporal de las capturas de sardina del Pacífico (Sardinops sagax) en las aguas frente al norte de Baja California (1990-2005, línea negra), obtenido de los datos de capturas mensuales de la Subdelegación de Pesca de Ensenada (Baja California, México). Promedios mensuales de la temperatura superficial del mar (SST, línea azul) a ~80 km de la costa, cerca de 31ºN. El ciclo estacional de la SST se calculó utilizando los datos de 1997 a 2004 obtenidos del Pacific Fisheries Environmental Laboratory Live Access Server de la NOAA.
La Figura 7 muestra que los desembarques menores de la subpoblación subártica se asocian con las temperaturas mínimas en primavera y que los desembarques mayores se asocian con las temperaturas más altas a finales de verano y otoño. La proporción entre las capturas de la subpoblación subártica en el primer trimestre (enero a junio) y las capturas de la subpoblación subtropical en el segundo semestre (julio a diciembre) indican que hay menor disponibilidad de la subpoblación subtropical para la flota de Ensenada en años fríos y menor disponibilidad de la subpoblación subártica en años cálidos, como lo muestra la Figura 8 para los años entre 1980 y 2005. Demer y Zwolinski (2014) informaron que la subpoblación subtropical representó 60-70% (de 36,000 a 42,000 t) de las capturas desembarcadas entre mayo y noviembre de los años de 2006 a 2011. En nuestra opinión, sus estimaciones están ligeramente sesgadas ya que este periodo se traslapa con los meses cuando la subpoblación norteña se encuentra frente a Ensenada (mayo y junio, según nuestra Fig. 7).
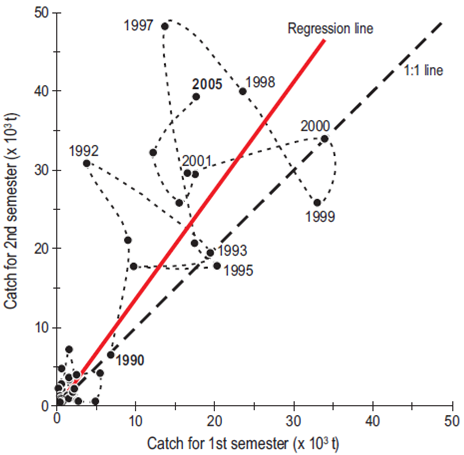
Figura 8: Cambio interanual en las tasas de captura de sardina en aguas frío-templadas frente a Ensenada de 1980 a 2005. La línea de regresión roja muestra el incremento progresivo de la contribución de la subpoblación asociada con aguas templadas (julio a diciembre). Los años más fríos se muestran debajo de la línea de regresión y con relación a la tasa ideal (línea discontinua gruesa). La línea discontinua delgada indica el tiempo de evolución de las capturas.
La falta de diferenciación genética entre la subpoblación subártica y la subpoblación subtropical ha sido difícil de explicar. Nosotros proponemos que durante los periodos de contracción de la subpoblación norteña en las aguas frente a la península de Baja California se mezclan desovadores de ambas subpoblaciones, como sucedió durante el periodo de enfriamiento prolongado que duró unos 30 años, desde finales de la década de 1940 hasta mediados de la década de 1970. Los promedios anuales del índice de la ODP que inician en 1900 claramente muestran este periodo de enfriamiento (http://www.atmos.washington.edu/~mantua/abst.PDO.html).
Según Ahlstrom (1960), las sardinas habían desaparecido de la región al norte de punta Concepción en 1952 y se habían desplazado hacia el sur a aguas frente a la península de Baja California, principalmente entre punta Eugenia en la parte central y cabo San Lucas en la punta de la península. Rodríguez-Sánchez et al. (2001) informaron de la presencia de individuos juveniles dentro del golfo de California a principios de la década de 1960. Cabría pensar que debido a esta mezcla de desovadores frente a Baja California la composición genética sería similar, y que la falta de diferenciación se mantendría conforme la subpoblación subártica se desplazó hacia el norte hasta la Columbia Británica a principios de la década de 1990, durante la recuperación de la población. Esto es consistente con los resultados de Zaitsev et al. (2014), quienes observaron la presencia de agua subártica que se mezcló con agua subtropical superficial frente a bahía Magdalena de enero de 2011 a abril de 2012. De igual manera, en la reunión del Foro Trinacional de la Sardina realizada en Ensenada en 2013, Félix-Uraga et al. (2013) informaron que peces de la subpoblación del norte estuvieron presentes en la bahía Magdalena en 2011 y 2012. Según su resumen, "Los desembarques de sardina del Pacífico disminuyeron progresivamente de 2007 a 2010. Las capturas subsecuentes aumentaron en 2011 y 2012, probablemente porque las sardinas de la subpoblación norteña migraron hacia el sur donde se juntaron con las sardinas de la subpoblación sureña. Hay evidencia de que actualmente se está colapsando la población de sardina del Pacífico en el Sistema de la Corriente de California. Cuando esto sucede, este recurso busca refugio al sur de su rango de distribución, y es probable que se produzca una mezcla de las subpoblaciones norteña y sureña. Sardinas de mayor tamaño y edad que normalmente se registran en la bahía Magdalena podrían ser evidencia de esta migración de la población del norte a la costa sur de la península de Baja California".
El registro sedimentario de la deposición de escamas de sardina que inició en aproximadamente 400 AD indica que el periodo de expansiones y contracciones de la población de sardina es de alrededor de 60 años (Baumgartner et al. 1992). Esto sugiere que una variación del clima oceánico proporciona un mecanismo para la mezcla casi continua de las dos subpoblaciones, que al parecer ha impedido una diferenciación genética importante entre ellas desde su aparición en el SCC hace miles de años.
Smith (2005) realizó una revisión de los diferentes métodos que se han usado para distinguir las subpoblaciones de sardina en el SCC: marcaje (para discernir las historias de migración), conteo de vértebras, diferencias en los tipos de sangre, tasas de crecimiento (tamaño a cierta edad) y de mortalidad natural, y el tiempo y lugar de reclutamiento. Este autor sugirió usar el cambio en el número de vértebras para indicar el crecimiento larval y la temperatura en el sitio de desove. Smith también sugirió usar la microquímica e isótopos estables en otolitos de postlarvas de sardinas para determinar la composición y temperatura del agua de los sitios de desove en el golfo de California y en el SCC (Valle-Rubio 2007). Smith (2005) identificó tres subpoblaciones con nombres que reflejan sus áreas de desove: el golfo de California, la zona costera del sur de la península de Baja California (nuestra subpoblación subtropical sureña), y la región alejada de la costa frente a la parte central de California. Como se sabe, la subpoblación alejada de la costa de California y la subpoblación en la costa del sur de la península de Baja California se traslapan, pero no se mezclan ni desovan juntas en años "normales" en la región entre San Pedro (puerto de pesca en el sur de California) y Ensenada (puerto de pesca en el norte de Baja California).
Parrish et al. (1989) discuten sobre el nivel de separación taxonómica entre sardinas de diferentes ecosistemas y enfati-zan que el nivel de diferencia genética entre subpoblaciones en la misma región debería ser despreciable en relación con el tiempo que se necesita para adquirir diferencias más importantes en escalas de tiempo evolutivo para poblaciones aisladas geográficamente y, consecuentemente, reproductivamente, lo cual resulta en fenotipos distintivos con adaptación y deriva genética. Una población aislada podría mantener su identidad genética, pero en condiciones ambientales cambiantes, desarrollaría una historia de vida completamente diferente. Por lo tanto, es razonable pensar que las subpobla-ciones se pueden distinguir por sus diferencias morfométricas y merísticas aun cuando, según Stepien y Rosenblatt (1996) en su estudio de S. japonicus y T. symmetricus, no hay una deferencia genética detectable.
La pesquería de sardina preferentemente captura adultos, por lo que la población eventualmente consistirá de un mayor número de juveniles (Hsieh et al. 2006). Los individuos juveniles son más susceptibles que los adultos a cambios en su ambiente derivados de la variabilidad del clima oceánico. Anderson et al. (2008) no encontraron evidencia robusta del efecto de la pesca en los juveniles de la población. No obstante, las clases anuales asociadas con el reclutamiento pueden reflejar su mayor presencia en las pesquerías (Zwolinski y Demer 2013). Según Hsieh et al. (2006), la edad promedio en la pesquería de sardina de California disminuyó considerablemente durante el periodo de 1983 a 2004, posiblemente debido a la expansión de la subpoblación subtropical. La mayor presencia de individuos juveniles en la captura de Ensenada durante el primer semestre del año podría ser la causa de la mayor correlación con la ODP durante el periodo de 1997 a 2005 (Fig. 9). La pesca debería homogeneizar las tallas ya que habrá menos adultos en la población. Por lo tanto, la población subtropical probablemente es responsable de la fuerte correlación entre la ODP y la proporción de las capturas del segundo semestre en relación al primero (R2 = 0.8 de 1997 a 2005), en comparación con la falta de correlación en la fase previa del desarrollo de la pesquería (1990 a 1996), cuando la subpoblación norteña (durante su recuperación) dominó la pesquería de Ensenada excepto durante el año previo a El Niño de 1992 (Fig. 8). Entre 2006 y 2010, la subpoblación sureña dominó la captura de Ensenada. Los desembarques de la subpoblación subártica durante este periodo fueron de 22% (12,5401 en 2006) a 51% (18,771 t en 2007) de la captura total anual (Demer y Zwolinski 2014).

Figura 9: Proporción de las capturas del segundo y primer semestre frente a Ensenada con relación al índice de la Oscilación Decadal del Pacífico (PDO). Se muestra la línea de regresión de mínimos cuadrados (R 2 = 0.80) para los datos del periodo de 1990 a 2005.
Las subpoblaciones norteñas de sardina y macarela que habitan aguas subárticas más frías y de baja salinidad parecen estar disminuyendo durante el presente régimen frío que comenzó en 1998 (Lo et al. 2010a, Weber y McClatchie 2012, Zwolinski y Demer 2012). Este declive está asociado con la intensificación del transporte de Ekman (Bjorkstedt et al. 2010). El enfriamiento regional de la temperatura superficial y el aumento del transporte hacia fuera de la costa ha generado un desplazamiento de la biomasa hacia el sur y una mayor dispersión de huevos y larvas hacia fuera de la costa, mientras que los efectos de esta mayor dispersión han disminuido las concentraciones de alimento disponible, lo que limita el tamaño de las clases de edad reclutadas anualmente a la población adulta. Esta respuesta también fue observada durante el periodo de enfriamiento que comenzó a finales de la década de 1940. La biomasa restante tanto de la sardina como la macarela del Pacífico fue empujada hacia el sur a aguas frente al norte de la península de Baja California, una región que es esencialmente un desierto en relación con la disponibilidad de alimento en la región frente al sur y centro de California (fig. 11 en Lo et al. 2005, Baumgartner et al. 2008). Esta carencia de alimento aparentemente fue la causa de fracasos reproductivos (Marr 1960) año tras año hasta que su biomasa combinada había disminuido a una fracción muy pequeña, alrededor de 60001 en 1963 (MacCall 1979). En nuestra opinión, durante el periodo actual se podría desarrollar una situación similar a la ocurrida para ambas especies en las décadas de 1950 y 1960. Esta tendencia también se observa en la reducción de la densidad de huevos de sardina (<50 huevos m-3) observada de 2010 a 2013 en la región central y sur de California, donde las temperaturas varían de 13 a 15 °C (http://swfsc.noaa.gov/).
Los indicadores climáticos sugieren que la subpoblación subártica debería ser la subpoblación de sardina dominante durante el actual periodo de enfriamiento que comenzó en 1998. No obstante, los desembarques en el sur de California y Baja California indican que la subpoblación dominante es la subtropical mientras que la subártica aparentemente se localiza al sur de punta Eugenia. La razón de esta inesperada dominancia de la subpoblación subtropical en el norte de la península de Baja California durante este periodo de enfriamiento aún no es clara. Un efecto es que ha bajado la fecundidad debido al menor tamaño de los individuos. Lo que sí es claro, sin embargo, es la necesidad de que México y los Estados Unidos realicen monitoreos conjuntos que puedan mejorar nuestro entendimiento de la respuesta de las especies al forzamiento ambiental, conocimiento que nos permitiría lograr pesquerías sustentables de peces pelágicos menores que tenemos en común y que son necesarios para asegurar la salud del ecosistema de la CC.
El estudio de la dinámica de las poblaciones de anchoveta y sardina se realiza con diferentes técnicas que reconocen al menos un grado de estructura y que usan características tanto genéticas (para la anchoveta) como morfométricas y merísticas, además de la ubicación y tamaño de sus sitios de desove. En Baja California, las capturas comerciales generalmente se realizan cerca de la costa, dentro de una franja de 20 km, y la discriminación de las subpoblaciones se realiza en relación con la TSM, y podría mejorar si se considera también la salinidad superficial del mar, como se muestra en la Figura 3. La discriminación permite generar series de tiempo relevantes entre el clima del océano y la distribución y, por lo tanto, la disponibilidad del recurso en el espacio y el tiempo, pero no proporciona información de la abundancia de la subpoblación. Se requiere una evaluación objetiva e independiente de la pesquería para la estimación de la abundancia de las poblaciones de peces en tiempo real, lo cual está ahora incorporado en el plan de manejo que cubrirá las especies con manejo activo de su pesquería. Esto permitirá que la flota pesquera opere con mayor eficiencia en cuanto al tiempo y el lugar de búsqueda del recurso, con un ahorro de tiempo y costos operacionales.
Nuestra experiencia con el uso del sistema CUFES en los cruceros del programa IMECOCAL nos ha mostrado que este sistema proporciona una alta resolución de la distribución y abundancia de huevos recolectados cerca de la superficie a lo largo de la ruta del barco, así como una forma indirecta para estimar la biomasa de los peces pelágicos menores que se encuentran en las muestras. A pesar de que sólo se puede muestrear en los primeros 3 a 5 m de la columna de agua, la cobertura en la región de estudio es amplia y se extiende hasta ~220 km de la costa. Se supone que la abundancia de los huevos recolectados representa la abundancia promedio de una franja de 5 km a cada lado de la línea de navegación del barco. Con el pequeño buque oceanográfico (el Ulloa) usado anteriormente no era posible implementar un "mues-treo adaptativo". Esto significa que no era posible parar el barco cuando se identificaba una zona con abundantes huevos para lanzar, hasta 70 m de profundidad, una pequeña red (CalVET) que se usa para recolectar huevos en la capa de mezcla. Con la nueva embarcación de 49 m será posible examinar cada muestra en tiempo real para identificar las que tienen un umbral de >10 huevos en 30 min de bombeo.
Otra desventaja importante del diseño del muestreo actual del programa IMECOCAL es que las líneas hidrográficas están separadas por una distancia de 74 km y, según el teorema de Nyquist (Kelly 1976), sólo se pueden identificar zonas de desove que se extienden una distancia mayor que 148 km entre las líneas de muestreo (en dirección paralela a la costa). Por lo tanto, la distancia entre las líneas se tendría que reducir a menos de 37 km. El diseño del muestreo requiere de por lo menos cuatro cruceros al año para obtener una idea estacional (enero, abril, julio y octubre) del estado anual del ecosistema y poder determinar la distribución y abundancia, así como el cambio estacional en la condición del hábitat de desove. Esto significa que solamente se obtiene información para un periodo de dos a tres semanas en cada crucero y lo que sucede entre los cruceros sólo se puede inferir, puesto que no es factible realizar muestreos con mayor frecuencia debido al costo relacionado con el tiempo del barco. La única alternativa sería realizar en zonas seleccionadas recorridos mensuales con embarcaciones pequeñas a lo largo de líneas, lo cual equivale a intercambiar tiempo por distancia. Además, actualmente la embarcación no cuenta con equipo hidroacústico para localizar y estimar la biomasa de peces. Tampoco cuenta con sistemas de pesca de arrastre para obtener muestras para su identificación y para determinar los parámetros de la población adulta a fin de estimar la biomasa, por lo que es necesario usar peces de las capturas comerciales; sin embargo, como la flota opera tan cerca de la costa, no es posible obtener muestras de individuos adultos alejados de la costa, especialmente en abril, que es el periodo de máxima actividad reproductiva de la subpobla-ción subártica. Se espera que esta situación cambie en unos cuatro o cinco años con la adquisición e instalación de equipo hidroacústico y artes de pesca.
Las características morfométricas y la distribución de las zonas de desove de las subpoblaciones de sardina y anchoveta son evidencia de la adaptación a condiciones ambientales específicas. Esto depende principalmente de la disponibilidad de alimento para cubrir la demanda energética de una población y divide el SCC en hábitats regionales, en los cuales cada subpoblación prefiere un tipo de presa de cierto tamaño. Los individuos de una población usan el exceso de energía para crecimiento y reproducción. Los periodos de máxima actividad reproductiva reflejan una variabilidad estacional de las condiciones ambientales en las cuales las estrategias de reproducción son apropiadas al hábitat. Las anchovetas, que tienen huevos ovalados que carecen de un glóbulo de aceite, desovan en zonas de mayor turbulencia, mientras que las sardinas, que tienen huevos esféricos y ricos en aceite, desovan en condiciones más estratificadas fuera del frente de surgencia. Estas condiciones ambientales parecen ser responsables del desarrollo de las características fenotípicas de las dos subpoblaciones de sardina. La diferenciación genética de las anchovetas probablemente sea resultado de su migración limitada, en contraste con la diferenciación genética de las sardinas cuya mayor migración mantiene esta homogeneización genética. En el caso de las sardinas, las condiciones ambientales desfavorables conducen a un menor reclutamiento y la mezcla de ambas subpoblaciones en los centros de refugio frente a la península de Baja California.
En resumen, el objetivo de esta revisión fue proveer un marco teórico para describir los mecanismos y procesos que alteran el hábitat oceánico y los rasgos de la historia de vida, y que estructuran la población de peces pelágicos menores. Esto incluye una descripción del escenario físico del ambiente que ocupan estas especies, sus ciclos de vida y patrones de distribución en el extremo sur del ecosistema de la CC. Se utilizó una perspectiva histórica para examinar la relación entre las capturas y la disponibilidad de peces para explicar cómo los movimientos de estos peces sensibles a la variabilidad climática determinan cuándo y dónde son capturados, con el fin de ilustrar que el clima determina el éxito o fracaso de una pesquería a través de la disponibilidad del recurso. Hemos presentado descripciones más completas del comportamiento y carácter de tres de las cuatro especies de peces pelágicos menores y su interacción con el clima oceánico del SCC. La poca información sobre T. symmetricus permitió describir la distribución del hábitat y lo que se presenta en las Tablas 1, 2, 3.
El forzamiento ambiental asociado al campo de viento regional es responsable, en gran medida, de la estructura y el mantenimiento de la condición de los hábitats de desove y de la disponibilidad de alimento. La variabilidad climática, en las diferentes escalas temporales y espaciales, modifica la condición del hábitat y afecta la productividad y el reclutamiento de una población. Para monitorear el estado de un ecosistema es necesario desarrollar herramientas que permitan evaluar su productividad en relación a las condiciones ambientales y los efectos de la pesca. El objetivo es construir series de tiempo de las variables ambientales que controlan el tamaño y potencial reproductivo de las clases anuales de las poblaciones pesqueras. Para explicar la falta de diferenciación genética entre las subpoblaciones subártica y subtropical, hemos propuesto que la mezcla e incorporación de individuos de la subpoblación subtropical a la subpoblación subártica resultará en el reclutamiento de juveniles de la subpoblación subtropical a la subpoblación subártica y viceversa, de tal manera que la mezcla genética se haya completado para cuando se estén realizando sus respectivas migraciones. Es importante enfatizar que la determinación de los patrones de movimiento de las subpoblaciones y de las zona de traslape son fundamentales para lograr la sustentabilidad de las pesquerías.
Agradecimientos
Este estudio fue apoyado por el programa IMECOCAL a través del Consejo Nacional de Ciencia y Tecnología (CONACYT, México; proyectos no. 129140, 99252, 23947, 47044, 42569, G35326T, 017P\D1-1297, G0041T y 23804). El Asia-Pacific Data-Research Center del IPRC (http:// apdrc.soest.hawaii.edu) proporcionó los datos de salida del modelo numérico. El primer autor agradece la beca de doctorado otorgada por el CONACYT (269626), así como el apoyo de la UABC. Ed Weber (Southwest Fisheries Science Center) hizo sugerencias valiosas que mejoraron el manuscrito. Los comentarios y sugerencias realizadas por tres revisores anónimos mejoraron sustancialmente este trabajo.
REFERENCIAS
Ahlstrom EH. 1954. Pacific Sardine (Pilchard) Eggs and Larvae and Other Fish Larvae, Pacific Coast - 1952. US Department of the Interior, Fish and Wildlife Service, Washington, DC, 76 pp. [ Links ]
Ahlstrom EH. 1960. Fish spawning in 1957 and 1958. CalCOFI Rep. 7: 173-179. [ Links ]
Ahlstrom EH. 1966. Distribution and Abundance of Sardine and Anchovy Larvae in the California Current Region off California and Baja California, 1951-64: A Summary. Special Scientific Report-Fisheries (534), U.S. Fish and Wildlife Service, Washington, D.C., 71 pp. [ Links ]
Ahlstrom EH, Ball OP. 1954. Description of eggs and larvae of jack mackerel (Trachurus symmetricus) and distribution and abundance of larvae in 1950 and 1951. Fish. Bull. 56: 207-245. [ Links ]
Alheit J, Roy C, Kifani S. 2009. Decadal-scale variability in populations. In: Checkley D, Alheit J , Oozeki Y, Roy C (eds.), Climate Change and Small Pelagic Fish. Cambridge University Press, Cambridge, UK, pp. 64-87. [ Links ]
Anderson CNK, Hsieh C, Sandin SA, Hewitt R, Hollowed A, Beddington J, May RM, Sugihara G. 2008. Why fishing magnifies fluctuations in fish abundance. Nature 452: 835-839. [ Links ]
Bakun A, Broad K. 2002. Climate and Fisheries: Interacting Paradigms, Scales, and Policy Approaches. The IRI-IPRC Pacific Climate-Fisheries Workshop, Honolulu, 14-17 November 2001. International Research Institute for Climate Prediction (IRI), 66 pp. [ Links ]
Barange M, Bernal M, Cergole MC, Cubillos LA, Daskalov GM, de Moor CL, de Oliveira JAA, Dickey-Collas M, Gaughan DJ, Hill K, Jacobson LD, Kõster FW, Massé J, Ñiquen M, Nishida H, Oozeki Y, Palomera I, Saccardo SA, Santojanni A, Serra R, Somarakis S, Stratoudakis Y, Lingen CD, Uriarte A Van der, Yatsu A. 2009. Current trends in the assessment and management of stocks. In: Checkley DM, Roy C, Oozeki Y, Alheit J (eds.), Climate Change and Small Pelagic Fish. Cambridge University Press, Cambridge, UK, pp. 191-255. [ Links ]
Barth JA, Pierce SD, Smith RL. 2000. A separating coastal upwelling jet at Cape Blanco, Oregon and its connection to the California Current System. Deep-Sea Res. II 47: 783-810. [ Links ]
Baumgartner TR, Soutar A, Ferreira-Bartrina V. 1992. Reconstruction of the history of Pacific sardine and northern anchovy populations over the past two millennia from sediments of the Santa Barbara Basin, California. CalCOFl Rep. 33: 24-40. [ Links ]
Baumgartner TR, Durazo R, Lavaniegos B, Gaxiola G, Gómez J, García J. 2008. Ten years of change from IMECOCAL observations in the southern region of the California Current Ecosystem. GLOBEC Int. Newslett. 14: 43-54. [ Links ]
Bjorkstedt E, Goericke R, McClatchie S, Weber E, Watson W, Lo N, Peterson B, Emmett B, Peterson J, Durazo R, Gaxiola-Castro G, Chavez F, Pennington JT, Collins CA, Field J, Ralston S, Sakuma K, Bograd SJ, Schwing FB, Xue Y, Sydeman WJ, Thompson SA, Santora JA, Largier J, Halle C, Morgan S, Kim S, Merkens K, Hildebrand JA, Munger LM. 2010. State of the California Current 2009-2010: Regional variation persists through transition from La Niña to El Niño (and back?). CalCOFI Rep. 51: 1-31. [ Links ]
Blaxter JHS, Hunter JR. 1982. The Biology of the Clupeoid Fishes. Academic Press, New York, NY, 398 pp. [ Links ]
Butler JL, Smith PE, Chyan-Hueilo N. 1993. The effect of natural variability of life-history parameters on anchovy and sardine population growth. CalCOFI Rep. 34: 104-111. [ Links ]
[CalCOFI] California Cooperative Oceanic Fisheries Investigations. 1953. California Cooperative Oceanic Fisheries Investigations, Progress Report, 1 July 1952 to 30 June 1953. Sacramento, CA, 44 pp. [ Links ]
Carton JA, Giese BS, Grodsky SA. 2005. Sea level rise and the warming of the oceans in the Simple Ocean Data Assimilation (SODA) ocean reanalysis. J. Geophys. Res. (Oceans) 110: 1-8. [ Links ]
Checkley DMJ, Barth JA. 2009. Patterns and processes in the California Current System. Prog. Oceanogr. 83: 49-64. [ Links ]
Checkley Jr DM, Dotson RC, Griffith DA. 2000. Continuous, underway sampling of eggs of Pacific sardine (Sardinops sagax) and northern anchovy (Engraulis mordax) in spring 1996 and 1997 off southern and central California. Deep-Sea Res. II 47: 1139-1155. [ Links ]
Checkley DMJ, Ayon P, Baumgartner T, Bernal M, Coetzee JC, Emmett R, Guevara-Carrasco R, Hutchings L, Ibaibarriaga L, Nakata H, Oozeki Y , Planque B, Schweigert J, Stratoudakis Y, Van derLingen CD. 2009. Habitats. In: Checkley D, Alheit J, Oozeki Y , Roy C (eds.), Climate Change and Small Pelagic Fish. Cambridge University Press, Cambridge, UK, pp. 12-44. [ Links ]
Clark FN. 1945. Results of tagging experiments in California waters on the sardine (Sardinops caerulea)Fish. Bull. 61: 1-93. [ Links ]
Cota-Villavicencio A, Troncoso-Gaytán R, Romero-Martínez M, Nevárez-Martínez MO. 2010. Situación de la pesquería de pelágicos menores en la costa noroccidental de Baja California durante las temporadas de pesca 2007 y 2008. Cienc. Pesq. 18: 19-32. [ Links ]
Csirke J. 1985. Informe del grupo de trabajo sobre implicaciones e interacciones de la ordenación de la pesca. In: Csirke J , Sharp GD (eds.), Informes de la consulta de expertos para examinar los cambios en la abundancia y composición por especies de recursos neríticos. Food and Agriculture Organization of the United Nations, Fisheries Report no. 291, Vol. 1, Rome. [ Links ]
Demer DA, Zwolinski JP. 2014. Corroboration and refinement of a method for differentiating landings from two stocks of Pacific sardine (Sardinops sagax) in the California Current. ICES J. Mar. Sci. 71: 328-335. [ Links ]
Demer DA, Zwolinski JP, Byers KA, Cutter GR, Renfree JS, Sessions TS, Macewicz BJ. 2012. Prediction and confirmation of seasonal migration of Pacific sardine (Sardinops sagax) in the California Current Ecosystem. Fish. Bull. 110: 52-70. [ Links ]
Di Lorenzo E, Schneider N, Cobb KM, Franks PJ, Chhak K, Miller AJ, McWilliams JC, Bograd SJ, Arango H, Curchitser E, Powell TM, Riviere P. 2008. North Pacific Gyre oscillation links ocean climate and ecosystem change. Geophys. Res. Lett. 35: L08607 [ Links ]
Di Lorenzo E, Cobb KM, Furtado JC, Schneider N, Anderson BT, Bracco A, Alexander M, Vimont DJ. 2010. Central Pacific El Niño and decadal climate change in the North Pacific Ocean. Nat. Geosci. 3: 762-765. [ Links ]
Di Lorenzo E, Combes V, Keister JE, Strub PT, Thomas AC, Franks PJS, Ohman MD, Furtado JC , Bracco A , Bograd SJ, Peterson WT, Schwing FB, Chiba S, Taguchi B, Hormazabal S, Parada C. 2013. Synthesis of Pacific Ocean climate and ecosystem dynamics. Oceanography 26: 68-81. [ Links ]
Díaz-Viloria N, Sánchez-Velasco L, Pérez-Enríquez R. 2012. Recent population expansion in the evolutionary history of the Californian anchovy Engraulis mordaxHidrobiológica 22: 258-266. [ Links ]
Dickerson TL, Macewicz BJ, Hunter JR. 1992. Spawning frequency and batch fecundity of Chub mackerel, Scomber japonicus, during 1985. CalCOFI Rep. 33: 130-140. [ Links ]
[DOF] Diario Oficial de la Federación. 1993. Norma Oficial Mexicana 003-PESC-1993, para regular el aprovechamiento de las especies de sardina monterrey, piña, crinuda, bocona, japonesa y de las especies anchoveta y macarela, con embarcaciones de cerco, en aguas de jurisdicción federal del océano. DOF, Mexico, DF, 4 pp. [ Links ]
Durazo R. 2009. Climate and upper ocean variability off Baja California, Mexico: 1997-2008. Prog. Oceanogr. 83: 361-368. [ Links ]
Durazo R. 2015. Seasonality of the transitional region of the California Current System off Baja California. J. Geophys. Res. (Oceans) 120: 1173-1196. [ Links ]
Durazo R, Baumgartner TR. 2002. Evolution of oceanographic conditions off Baja California: 1997-1999. Prog. Oceanogr. 54: 7-31. [ Links ]
Durazo R, Ramírez-Manguilar AM, Miranda LE, Soto-Mardones L. 2010. Climatología de variables hidrográficas. In: Gaxiola-Castro G, Durazo R (eds.), Dinámica del Ecosistema Pelágico Frente a Baja California, 1997-2007: Diez Años de Investigaciones Mexicanas de la Corriente de California. Secretaría de Medio Ambiente y Recursos Naturales, México, pp. 25-57. [ Links ]
Félix-Uraga R, Alvarado-Castillo RM, Carmona-Piña R. 1996. The sardine fishery along the western coast of Baja California, 1981 to 1994. CalCOFI Rep. 37: 188-193. [ Links ]
Félix-Uraga R, Gómez-Muñoz VM, Quiñónez-Velázquez C, Melo-Barrera FN, García-Franco W. 2004. On the existence of Pacific sardine groups off the west coast of Baja California and southern California. CalCOFI Rep. 45: 146-151. [ Links ]
Félix-Uraga R, Gómez-Muñoz VM, Quiñónez-Velázquez C, Melo-Barrera FN, Hill K, García-Franco W . 2005. Pacific sardine (Sardinops sagax) stock discrimination off the west coast of Baja California and southern California using otolith morphometry. CalCOFI Rep. 46: 113-121. [ Links ]
Félix-Uraga R, Quiñónez-Velázquez C, Melo-Barrera FN, Hernández-Rivas ME, Torres-Palacios K, Molina-Carrasco FD. 2013. Sardine Fishery in Magdalena Bay, 2012-13. 14th Annual Meeting of the Trinational Sardine Forum, 5-6 December 2013, Ensenada, Baja California, Mexico. [ Links ]
Field DB, Baumgartner TR, Ferreira V, Gutierrez D, Lozano-Montes H, Salvatteci R, Soutar A. 2009. Variability from scales in marine sediments and other historical records. In: Checkley D, Alheit J, Oozeki Y, Roy C (eds.), Climate Change and Small Pelagic Fish. Cambridge University Press, Cambridge, UK, pp. 45-63. [ Links ]
Fitch JE. 1969. Fossil records of certain schooling fishes of the California Current System. CalCOFI Rep. 13: 71-80. [ Links ]
García-Rodríguez FJ, García-Gasca SA, de la Cruz-Agüero J, Cota-Gómez VM. 2011. A study of the population structure of the Pacific sardine Sardinops sagax (Jenyns, 1842) in Mexico based on morphometric and genetic analyses. Fish. Res. 107: 169-176. [ Links ]
Gluyas-Millán MG. 1994. Reproduction, age and length of first maturity of Pacific mackerel Scomber japonicus (Houttuyn, 1872) in Vizcaíno Bay. Cienc. Mar. 20: 409-419. [ Links ]
Hammann MG, Nevárez-Martínez MO, Green-Ruíz Y. 1998. Spawning habitat of the Pacific sardine (Sardinops sagax) in the Gulf of California: Egg and larval distribution 1956-1957 and 1971-1991. CalCOFI Rep. 39: 169-179. [ Links ]
Hedgecock D. 1986. Recognizing subpopulations in California's mixed pelagic fish stocks. In: Hedgecock D (ed.), Identifying Fish Subpopulations. Proceedings of a California Sea Grant Workshop: 27 January 1984. California Sea Grant College Program, Institute of Marine Resources, University of California, La Jolla, CA, pp. 26-31. [ Links ]
Hsieh C, Reiss CS, Hunter JR, Beddington JR, May RM, Sugihara G. 2006. Fishing elevates variability in the abundance of exploited species. Nature 443: 859-862. [ Links ]
Kaplan IC, Brown CJ, Fulton EA, Gray IA, Field JC, Smith ADM. 2013. Impacts of depleting forage species in the California Current. Environ. Conserv. 40: 380-393. [ Links ]
Kelley JC. 1976. Sampling the sea. In: Cushing DH, Walsh JJ (eds.), The Ecology of the Seas. WB Saunders, Philadelphia, PA, pp. 361-387. [ Links ]
King JR, Agostini VN, Harvey CJ, McFarlane G, Foreman MGG, Overland JE, di Lorenzo E, Bond N, Aydin KY. 2011. Climate forcing and the California Current ecosystem. ICES J. Mar. Sci. 68: 1199-1216. [ Links ]
Kramer D 1969. Synopsis of the biological data on the Pacific mackerel, Scomber japonicus, Houttuyn (Northeast Pacific). FAO Species Synopsis no. 40, Circular 302. Washington, D.C. 18 pp. [ Links ]
Kug J-S, Jin F-F, An S-I. 2009. Two types of El Niño events: Cold tongue El Niño and warm pool El Niño. J. Clim. 22: 1499-1515. [ Links ]
Kurian J, Colas F, Capet X, McWilliams JC, Chelton DB. 2011. Eddy properties in the California Current System. J. Geophys. Res. (Oceans) 116: 1-18. [ Links ]
Landry MR, Ohman MD, Goericke R, Stukel MR, Barbeau K, Bundy R, Kahru M. 2012. Pelagic community responses to a deep-water front in the California Current Ecosystem: Overview of the A-Front Study. J. Plankton Res. 34: 739-748. [ Links ]
Lasker R. 1985. An egg production method for estimating spawning biomass of northern anchovy, Engraulis mordaxUS Dept. Commer., NOAA Tech. Rep. NMFS 36, 99 pp. [ Links ]
Lavaniegos BE. 2009. Influence of a multiyear event of low salinity on the zooplankton from Mexican eco-regions of the California Current. Prog. Oceanogr. 83: 369-375. [ Links ]
Lecomte F, Grant WS, Dodson JJ, Rodríguez-Sánchez R, Bowen BW. 2004. Living with uncertainty: Genetic imprints of climate shifts in East Pacific anchovy (Engraulis mordax) and sardine (Sardinops sagax)Mol. Ecol. 13: 2169-2182. [ Links ]
Leggett WC, Frank KT. 2008. Paradigms in fisheries oceanography. Oceanogr. Mar. Biol. Annu. Rev. 46: 331-363. [ Links ]
Lo NCH, Green-Ruiz YA, Cervantes M, Moser HG, Lynn RJ. 1996. Egg production and spawning biomass of Pacific sardine (Sardinops sagax) in 1994, determined by the daily egg production method. CalCOFI Rep. 37: 160-174. [ Links ]
Lo NCH, Macewicz BJ, Griffith DA. 2005. Spawning biomass of Pacific sardine (Sardinops sagax), from 1994-2004 off California. CalCOFI Rep. 46: 93. [ Links ]
Lo NCH, Dorval E, Funes-Rodríguez R, Hernández-Rivas ME, Huang Y, Fan Z. 2010a. Utilities of larval densities of Pacific mackerel (Scomber japonicus) off California, USA, and west coast of Mexico from 1951 to 2008, as spawning biomass indices. Cienc. Pesq. 18: 59-76. [ Links ]
Lo NCH, Macewicz BJ, Griffith DA . 2010b. Biomass and reproduction of Pacific sardine (Sardinops sagax) off the Pacific northwestern United States. Fish. Bull. 108: 174-192. [ Links ]
Logerwell E, Smith P. 2001. Mesoscale eddies and survival of late stage Pacific sardine (Sardinops sagax) larvae. Fish. Oceanogr. 10: 13-25. [ Links ]
Love RH. 2012. Pacific sardine characteristics affecting the conduct of an acoustic clutter experiment off the West Coast of the United States. The Office of Naval Research. Technical Report May 2011-May 2012. Bayou Acoustics, Abita Springs, LA, 33 pp. [ Links ]
Lluch-Belda D, Crawford RJM, Kawasaki T, MacCall AD, Parrish RH, Schwartzlose RA, Smith PE. 1989. World-wide fluctuations of sardine and anchovy stocks: The regime problem. S. Afr. J. Mar. Sci. 8: 195-205. [ Links ]
Lluch-Belda D, Lluch-Cota DB, Hernandez-Vazquez S, Salinas-Zavala CA, Schwartzlose RA. 1991. Sardine and anchovy spawning as related to temperature and upwelling in the California Current System. CalCOFI Rep. 32: 105-111. [ Links ]
Lynn RJ. 2003. Variability in the spawning habitat of Pacific sardine (Sardinops sagax) off southern and central California. Fish. Oceanogr. 12: 541-553. [ Links ]
Lynn RJ, Simpson JJ. 1987. The California Current System: The seasonal variability of its physical characteristics. J. Geophys. Res. 92: 12947-12966. [ Links ]
MacCall AD. 1979. Population estimates for the waning years of the Pacific sardine fishery. CalCOFI Rep. 20: 72-82. [ Links ]
MacCall AD. 1986. Review of the biological rationale for identifying subpopulations in fisheries. In: Hedgecock D (ed.), Identifying Fish Subpopulations. Proceedings of a California Sea Grant Workshop: 27 January 1984. California Sea Grant College Program, Institute of Marine Resources, University of California, La Jolla, CA, pp. 9-13. [ Links ]
MacCall AD. 2009. Mechanisms of low-frequency fluctuations in sardine and anchovy populations. In: Checkley D, Alheit J, Oozeki Y, Claude R (eds.), Climate Change and Small Pelagic Fish. Cambridge University Press, Cambridge, UK, pp. 285-299. [ Links ]
MacCall AD, Stauffer GD. 1983. Biology and fishery potential of jack mackerel (Trachurus symmetricus)CalCOFI Rep. XXIV: 46-56. [ Links ]
Macewicz BJ, Hunter JR. 1993. Spawning frequency and batch fecundity of jack mackerel, Trachurus symmetricus, off California during 1991. CalCOFI Rep. 34: 112-121. [ Links ]
Mackas DL. 2006. Interdisciplinary oceanography of the western North American continental margin: Vancouver Island to the tip of Baja California. In: Robinson AR, Brink KH (eds.), The Global Coastal Ocean: Interdisciplinary Regional Studies and Syntheses. Harvard University Press, pp. 441-501. [ Links ]
MacFarlane G, Beamish RJ 2001. The re-occurrence of sardines off British Columbia characterizes the dynamic nature of regimes. Prog. Oceanogr. 49:151-165. [ Links ]
McFarlane G, MacDougall L, Schweigert J, Hrabok C. 2005. Distribution and biology of Pacific sardines (Sardinops sagax) off British Columbia, Canada. CalCOFI Rep. 46: 144-160. [ Links ]
McFarlane G, Schweigert J, Detering J, Hodes V. 2010. Diet analysis of Pacific sardine (Sardinops sagax) off the west coast of Vancouver Island, British Columbia from 1997 to 2008. CalCOFI Rep. 51: 169-181. [ Links ]
Mantua NJ, Hare SR, Zhang Y, Wallace JM, Francis RC. 1997. A Pacific interdecadal climate oscillation with impacts on salmon production. Bull. Am. Meteorol. Soc. 78: 1069-1079. [ Links ]
Marr JC. 1960. The causes of major variations in the catch of the Pacific sardine, Sardinops caerulea (Girard). In: Rosa J, Murphy G (eds.), Proceedings of the World Scientific Meeting on the Biology of Sardines and Related Species. Food and Agriculture Organization of the United Nations, Rome, pp. 667-791 [ Links ]
Moser H. 1996. The early stages of fishes in the California Current region. CalCOFI Atlas no. 33. Allen Press, Lawrence, KS, 1505 pp. [ Links ]
Nelson CS. 1977. Wind stress and wind stress curl over the California Current. Technical Report, NMFS-NOAA, Monterey, CA, 87 pp. [ Links ]
Nevárez-Martínez MO, Martínez-Zavala, MA, Cotero-Altamirano CE, Jacob-Cervantes ML, Green-Ruiz Y, Gluyas-Millán G, Cota-Villavicencio A, Santos-Molina JP. 2006. Peces pelágicos menores. In: Arreguín-Sánchez F, Beléndez-Moreno L, Méndez Gómez-Humaran I, Solana-Sansores R, Rangel-Dávalos C (eds.), Sustentabilidad y Pesca Responsable en México. Evaluación y Manejo. Instituto Nacional de la Pesca, México, pp. 265-301. [ Links ]
Nieto K, McClatchie S, Weber ED, Lennert-Cody CE. 2014. Effect of mesoscale eddies and streamers on sardine spawning habitat and recruitment success off southern and central California. J. Geophys. Res. (Oceans) 119: 1-10. [ Links ]
[PFMC] Pacific Fishery Management Council. 1998. Amendment 8 (to the northern anchovy fishery management plan) incorporating a name change to: the coastal pelagic species fishery management plan. Technical Report, Pacific Fishery Management Council, Portland, Oregon, 39 pp. [ Links ]
Parrish RH, MacCall AD. 1978. Climatic variation and exploitation in the Pacific mackerel fishery. Fish. Bull. 167: 1-110. [ Links ]
Parrish RH, Nelson CS, Bakun A. 1981. Transport mechanisms and reproductive success of fishes in the California Current. Biol. Oceanogr. 1: 175-203. [ Links ]
Parrish RH, Serra R, Grant WS. 1989. The monotypic sardines, Sardina and Sardinops: Their taxonomy, distribution, stock structure, and zoogeography. Can. J. Fish. Aquat. Sci. 46: 2019-2036. [ Links ]
Peck MA, Reglero P, Takahashi M, Catalán IA. 2013. Life cycle ecophysiology of small pelagic fish and climate-driven changes in populations. Prog. Oceanogr. 116: 220-245. [ Links ]
[PICES] North Pacific Marine Science Organization. 1993. Part 1. Coastal pelagic fishes (report of Working Group 3) In: Hunter JR, Wada T (eds.), PICES Scientific Report no. 1-1993. North Pacific Marine Science Organization, Sidney B.C., Canada, pp. 1-24. [ Links ]
Radovich J. 1982. The collapse of the California sardine fishery. CalCOFI Rep. XXIII: 56-77. [ Links ]
Rodríguez-Sánchez R, Lluch-Belda D, Villalobos H, Ortega-García S. 2001. Large-scale long-term variability of small pelagic fish in the California Current System. In: Kruse GH, Bez N, Booth A, Dorn MW, Hills S, Lipcius RN, Pelletier D, Roy C, Smith SJ, Witherell D (eds.), Spatial Processes and Management of Fish Populations. University of Alaska Sea Grant AK-SG-01-02, Fairbanks, Alaska, pp. 447-462. [ Links ]
Rodríguez-Sánchez R, Lluch-Belda D, Villalobos H, Ortega-García S. 2002. Dynamic geography of small pelagic fish populations in the California Current System on the regime time scale (1931-1997). Can. J. Fish. Aquat. Sci. 59: 1980-1988. [ Links ]
Rykaczewski RR, Checkley DM. 2008. Influence of ocean winds on the pelagic ecosystem in upwelling regions. Proc. Natl. Acad. Sci. 105: 1965-1970. [ Links ]
[SAGARPA] Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. 2012. Plan de manejo pesquero para la pesquería de pelágicos menores (sardinas, anchovetas, macarelas y afines) del noroeste de México. SAGARPA, 54 pp. [ Links ]
Schwartzlose RA, Alheit J, Bakun A, Baumgartner TR, Cloete R, Crawford RJM, Fletcher WJ, Green-Ruiz Y, Hagen E, Kawasaki T, Lluch-Belda D, Lluch-Cota SE, MacCall AD, Matsuura Y, Nevárez-Martínez MO, Parrish RH, Roy C, Serra R, Shust KV, Ward MN, Zuzunaga JZ. 1999. Worldwide large-scale fluctuations of sardine and anchovy populations. S. Afr. J. Mar. Sci. 21: 289-347. [ Links ]
Smith PE. 2005. A history of proposals for subpopulation structure in the Pacific sardine (Sardinops sagax) population off western North America. CalCOFI Rep. 46: 75-82. [ Links ]
Song H, Miller AJ, McClatchie S, Weber ED, Nieto KM, Checkley DM. 2012. Application of a data-assimilation model to variability of Pacific sardine spawning and survivor habitats with ENSO in the California Current System. J. Geophys. Res. (Oceans) 117: 1-15. [ Links ]
Stepien CA, Rosenblatt RH. 1996. Genetic divergence in antitropical pelagic marine fishes (Trachurus, Merluccius, and Scomber) between North and South America. Copeia 3: 586-598. [ Links ]
Torres-Villegas JR. 2012. Gestión de la pesquería de los peces pelágicos menores de Baja California Sur: Propuesta de plan de manejo. Comité Estatal Sistema Producto Pelágicos Menores de Baja California Sur A.C., La Paz, 58 pp. [ Links ]
[U.S. GLOBEC] U.S. Global Ocean Ecosystems Dynamics. 1994. Eastern Boundary Current Program: A Science Plan for the California Current. Report no. 11, Berkeley, CA, 134 pp. [ Links ]
Valle-Rubio S. 2007. Variabilidad natural en la microquímica de otolitos de estadios tempranos de Sardinops sagax caeruleusPhD thesis, Centro de Investigación Científica y de Educación Superior de Ensenada, Ensenada, México, 174 pp. [ Links ]
Van der Lingen CD, Castro L, Drapeau L, Checkley DMJ. 2005. Report of a GLOBEC-SPACC workshop on characterizing and comparing the spawning habitats of small pelagic fish. GLOBEC Rep. 21: 107 pp. [ Links ]
Van der Lingen CD, Bertrand A, Bode A, Brodeur R, Cubillos LA, Espinoza P, Friedland K, Garrido S, Irigoien X, Miller T, Möllmann C, Rodriguez-Sanchez R, Tanaka H, Temming A. 2009. Trophic dynamics. In: Checkley D, Alheit J, Oozeki Y, Roy C (eds.), Climate Change and Small Pelagic Fish. Cambridge University Press, Cambridge, UK, pp. 112-157. [ Links ]
Yaragina NA, Marshall CT. 2000. Trophic influences on interannual and seasonal variation in the liver condition index of Northeast Arctic cod (Gadus morhua)ICES J. Mar. Sci. 57: 42-55. [ Links ]
Weber ED, McClatchie S. 2012. Effect of environmental conditions on the distribution of Pacific mackerel (Scomber japonicus) larvae in the California Current System. Fish. Bull. 110: 85-97. [ Links ]
Zaitsev O, Trasviña-Castro A, Linero-Cueto J, Gaxiola-Castro G, Cepeda-Morales J. 2014. Oceanographic conditions over the continental shelf off Magdalena Bay (Mexico) in 2011-2012. Cienc. Mar. 40: 89-112. http://dx.doi.org/10.7773/cm.v40i2.2314 [ Links ]
Zwolinski JP, Demer DA. 2012. A cold oceanographic regime with high exploitation rates in the Northeast Pacific forecasts a collapse of the sardine stock. Proc. Natl. Acad. Sci. 109: 4175-4180. [ Links ]
Zwolinski JP, Demer DA. 2013. Measurements of natural mortality for Pacific sardine (Sardinops sagax)ICES J. Mar. Sci. 70: 1408-1415. [ Links ]
Zwolinski JP, Emmett RL, Demer DA . 2011. Predicting habitat to optimize sampling of Pacific sardine (Sardinops sagax)ICES J. Mar. Sci. 68: 867-879. [ Links ]
Recibido: Agosto de 2015; Aprobado: Noviembre de 2015











 texto en
texto en 


