Introducción
El movimiento de los organismos es definido como el cambio en su ubicación espacial, consecuencia de una interacción compleja entre factores internos del organismo que promueven su movimiento y que responden al porqué, cómo, cuándo y dónde se mueven y factores externos (bióticos y abióticos) que pudieran influir sobre el movimiento (Nathan et al. 2008). Se ha demostrado que los movimientos de peces pelágicos migratorios como atunes, picudos y dorados son afectados por las condiciones ambientales (e.g., corrientes, cambios de temperatura y concentración de oxígeno con la profundidad), que a su vez son transcendentales en la determinación de su permanencia y preferencia de hábitat (Brill y Lutcavage 2001, Furukawa et al. 2011, Schaefer et al. 2011). Es importante conocer cómo los peces pelágicos rigen sus movimientos y preferencias de hábitat ya que se ha reportado que la vulnerabilidad de estos peces a la pesca es influenciada por factores como la profundidad que habitan, la velocidad a la que viajan, el tiempo de residencia en determinadas áreas y la formación de cardúmenes (Brill y Lutcavage 2001).
El dorado, Coryphaena hippurus Linnaeus, 1758, es una especie epipélagica que se distribuye en mares tropicales y subtropicales (Palko et al. 1982). Es ecológicamente importante por ser un depredador tope en el ecosistema pelágico (Varghese et al. 2013). Es un depredador oportunista (Tripp-Valdez et al. 2010), altamente voraz, con un espectro trófico amplio y de hábitos alimenticios estrechamente relacionados con el ambiente epipelágico (Aguilar-Palomino et al. 1998).
En las costas mexicanas del Pacífico, C. hippurus se ha registrado desde Baja California Sur, donde permanece todo el año (Aguilar-Palomino et al. 1998), hasta el golfo de Tehuantepec, frente a las costas de Oaxaca (Alejo-Plata et al. 2011, Zúñiga-Flores et al. 2011). En México, el dorado está reservado a la pesca deportiva dentro de las 50 millas náuticas medidas a partir de la línea base de costa donde se define el mar territorial (DOF 1995). Además, forma parte de la captura incidental de la pesquería artesanal y de cerco (Aguilar-Palomino et al. 1998, Madrid y Beltrán-Pimienta 2001, Martínez-Rincón et al. 2009).
El dorado se caracteriza por tener una corta vida y un rápido crecimiento (Alejo-Plata et al 2011). Las tallas máximas de captura que se han registrado para la costa noroccidental mexicana son de 192 cm y 30 kg (Madrid y Beltrán-Pimienta 2001). Se ha documentado que en aguas frente a Baja California Sur estos peces alcanzan una talla de madurez poblacional de 80 cm de longitud furcal y durante la época reproductiva (verano-otoño) son desovadores múltiples (Zúñiga-Flores 2011).
La información sobre los movimientos del dorado aún es escasa y principalmente describe los movimientos con relación a la presencia de dispositivos agregadores de peces (Girard et al. 2007, Taquet et al. 2007) y los movimientos en mar abierto (Furukawa et al. 2011, 2014; Merten et al. 2014a, 2014b, 2014c). Se ha descrito que el dorado generalmente permanece a una profundidad por encima de la termoclina (Furukawa et al. 2011) y que sus movimientos pueden regresar al punto de marcado (Girard et al. 2007). Sin embargo, aún se desconocen muchos aspectos sobre sus movimientos, uso del hábitat y preferencias ambientales que permitan identificar hábitats esenciales para la especie en aguas costeras. El objetivo de este estudio fue identificar factores bióticos y abióticos que influyen sobre los movimientos horizontales y verticales del dorado a una fina escala (cada 16 min) y en un corto tiempo (hasta 48 h) en un cuerpo de agua costero en el golfo de California.
Materiales y métodos
Área de estudio y marcado
El estudio se llevó a cabo en el suroeste de la bahía de La Paz (BLP), Baja California Sur, México (Fig. 1). Un total de ocho dorados fueron capturados con caña de pesca y anzuelo en tres localidades (Califín [norte], Quelele y Pichilingue) dentro de BLP entre septiembre y octubre de 2013. Dos individuos fueron utilizados por unas horas para probar el equipo de seguimiento.

Figura 1: (a) Área de estudio y rutas de movimiento de seis dorados (Coryphaena hippurus) en tres sitios dentro de la bahía de La Paz (México): (1) norte de Califín, (2) Quelele y (3) Pichilingue. (b-g) Seguimientos 1-6, respectivamente; los círculos indican el inicio del seguimiento y los triángulos el final.
Una vez capturado un pez, se le colocó en la cubierta de la embarcación sobre una toalla húmeda, se le cubrieron los ojos con una franela para reducir el estrés por iluminación y se le insertó en la boca una manguera de plástico conectada a una bomba sumergible para proveer de un flujo continuo de agua de mar y permitir la oxigenación de las branquias. Para cada individuo, se midió la longitud furcal y total, y se determinó el sexo con base en el dimorfismo sexual descrito por Palko et al. (1982), según el cual los machos se diferencian de las hembras por desarrollar una cresta ósea en la cabeza.
A cada individuo se le colocó de manera externa un transmisor acústico V16TP de tipo continuo con sensores internos de temperatura (precisión 0.12 °C) y profundidad (precisión 0.9 m) (16 mm de diámetro, 71 mm de ancho, 11 g de peso en agua; VEMCO, Halifax, Canadá) atravesando un cincho de plástico con una aguja de acero inoxidable en 1 cm de músculo cerca de la base de la aleta caudal. Todo el proceso de captura y marcado se realizó en un tiempo no mayor que 7 min.
Monitoreo acústico
Se dio seguimiento activo de manera individual a cada organismo. La embarcación fue equipada con un hidrófono direccional VH110 y un receptor acústico VR100 (VEMCO) para detectar las transmisiones acústicas cada 2000 ms desde el pez. El receptor registró la profundidad, la temperatura del agua, la fuerza de la señal (dB) del transmisor acústico y la posición geográfica de la lancha. Previo a los seguimientos continuos se hizo una prueba de rango para los receptores. Se probó el alcance de detección del receptor con respecto a diferentes distancias y profundidades del transmisor acústico. La prueba de rango mostró que la distancia máxima de detección fue de 1260 m a profundidades de 0.5 y 10.0 m. Durante cada seguimiento, se registró la batimetría del área de seguimiento con una ecosonda GPSMAP 431s (Garmin International, Olathe, KS). También, se realizaron lances de un perfilador o CTD (YSI CastAway 11B111032, YSI, Yellow Springs, OH) en la columna de agua cada hora a lo largo de todo el seguimiento para hacer perfiles verticales de temperatura.
Tratamiento de datos
A los datos registrados por el receptor cada 2000 ms se les aplicó la metodología de Ketchum et al. (2014) para eliminar la autocorrelación temporal y los datos falsos, y se obtuvieron series de tiempo con intervalos de 16 min. Después se elaboraron mapas en ArcMap 10 (Esri, 2010) para cada uno de los seguimientos. La distancia mínima a la costa fue calculada en ArcView (Esri, 2010) con base en la posición geográfica del dorado en cada uno de los seguimientos. La base de datos usada para evaluar estadísticamente los movimientos horizontales y verticales fue filtrada a 1 min para utilizar la mayor información posible.
La profundidad de la termoclina se calculó con base en la frecuencia de Brunt-Väisälä. La termoclina se ubica en la profundidad donde se estabiliza la frecuencia vertical de desplazamiento de una masa de agua sobre un gradiente de densidades en la columna de agua (Cushman-Roisin y Beckers 2009).
Modelos
Para determinar qué factores influyeron sobre los movimientos horizontales y verticales de los dorados, se utilizaron modelos aditivos generalizados mixtos. Se construyeron dos modelos para evaluar los movimientos. Para el modelo referente a los movimientos horizontales, la variable de respuesta fue la distancia más cercana a la costa a la cual se encontró el pez y las variables explicativas seleccionadas fueron la batimetría de la zona, la temperatura del agua que registraron los transmisores acústicos, la hora del día y el género. Para el modelo referente a los movimientos verticales, la variable de respuesta fue la profundidad a la cual los peces se desplazaron y las variables explicativas fueron temperatura del agua, batimetría, hora del día, profundidad de la termoclina y género. Todas las variables explicativas fueron continuas, a excepción de género. Para ambos modelos, el efecto al azar corresponde a cada individuo (Tabla 1). Por la naturaleza de los datos de las variables de respuesta, se usó la familia Poisson para el análisis estadístico (Zuur et al. 2009).
Tabla 1: Modelos aditivos generalizados mixtos para evaluar el efecto de las variables explicativas sobre los movimientos de Coryphaena hippurus: R2, coeficiente de determinación ajustado; AIC, criterio de información de Akaike; BIC, criterio de información bayesiano. El mejor ajuste del modelo se muestra en negritas.

Para encontrar el mejor ajuste de los modelos a los datos, se siguió la metodología de Papastamatiou et al. (2013). Los modelos se construyeron evaluando primero de manera individual las variables explicativas y después incorporándolas en conjunto según la contribución de cada una de ellas a la varianza de los datos. El mejor modelo se basó en los criterios de selección estándar (coeficiente de determinación ajustado [R2], criterio de información de Akaike, criterio de información bayesiano). Los supuestos de los modelos se comprobaron en los gráficos de los residuales.
Para analizar el efecto de las variables explicativas sobre la variable de respuesta después de ajustar el modelo, se realizaron los gráficos de efecto. La línea de efecto se interpreta como sigue: valores >0 en el eje y tienen un efecto sobre la variable de respuesta en los valores específicos que corresponden a la variable explicativa. Los modelos aditivos generalizados mixtos se realizaron con el software R 3.0.3 (R Core Team 2014) usando el paquete mgcv (Wood 2006).
Resultados
Se consideraron sólo seis seguimientos de individuos de C. hippurus (tres machos y tres hembras) con registros de más de 20 h, con un intervalo de tallas de entre 67.0 y 83.5 cm de longitud furcal y que, según la talla de madurez sexual reportada por Zúñiga-Flores et al. (2011), fueron juveniles. Tres seguimientos se dieron por terminados (seguimientos 2, 5 y 6; Tabla 2) cuando la posición del dorado no cambió y la lectura del sensor de profundidad de los transmisores acústicos coincidió con el fondo marino también registrado por la ecosonda. La distancia promedio recorrida por hora fue de 1.59 km (±0.106, error estándar) a una velocidad promedio de 0.51 m s-1 (±0.51) (Tabla 2). La profundidad promedio de la termoclina, cuando fue detectada, fue de 34 m (±0.12).
Tabla 2: Longitud furcal, edad y sexo de seis individuos de Coryphaena hippurus marcados y datos de seguimiento. SE, error estándar.

Movimientos horizontales
Los movimientos de los dorados marcados se concentraron en una zona somera (1-80 m de profundidad) del suroeste de BLP (Fig. 1). Dos peces marcados en el sureste cruzaron hacia el extremo opuesto, atravesando casi toda la bahía (seguimientos 5 y 6), mientras que los otros cuatro se movieron en distintas direcciones. Dos de estos cuatro individuos hicieron movimientos hacia el noroeste (seguimientos 2 y 3), uno hacia el sur (seguimiento 1) y uno concentró sus movimientos cerca del lugar de captura (seguimiento 4).
El modelo ajustado para los movimientos horizontales fue el siguiente:
DistCosta = α + f1 (batimetría) + f2 (temperatura del agua) + f3 (hora) + género + (1/seguimiento)
donde DistCosta es la distancia mínima a la costa, a es el intercepto, fn es la función suavizante para cada una de las variables explicativas y (1/seguimiento) es el efecto azaroso de los individuos. Todas las variables explicativas fueron significativas a P < 0.05. El modelo explicó un 45% (R 2 = 0.45, Tabla 2) de la devianza total. La batimetría y la temperatura del agua fueron las variables más importantes, seguidas de la hora y género (Tabla 1).
Los gráficos de efectos de las variables explicativas sobre la distancia más cercana a la costa muestran que la probabilidad de que los dorados se alejen de la costa es cuando la batimetría es profunda (40-120 m), la temperatura del agua es entre 27 y 30 °C y durante la noche (23:00 y 6:00 h). Las hembras se alejaron más de la costa que los machos (Fig. 2).

Figura 2: Modelos aditivos generalizados mixtos para los movimientos horizontales de Coryphaena hippurus. Las gráficas muestran el efecto de las variables explicativas (batimetría, temperatura del agua, hora y género) sobre la variable de respuesta (distancia de la costa). En (a-c), las líneas verticales sobre los ejes x indican la distribución de datos y los ejes y muestran el valor de la variable de respuesta en la escala del predictor lineal; las áreas sombreadas indican el error estándar. En (d), las barras negras sobre el eje x representan el acumulativo de los datos de cada género, las líneas horizontales delgadas representan el valor de la variable de respuesta (distancia de la costa) en escala del predictor lineal y las líneas horizontales discontinuas indican el error estándar.
Movimientos verticales
El intervalo de profundidad para todos los seguimientos fue de 1 a 73 m. Los organismos permanecieron el 80% del tiempo dentro de la capa de mezcla, es decir, por arriba de los 34 m de profundidad; sin embargo, permanecieron un elevado porcentaje de tiempo (45%) en los primeros 10 m (Fig. 3a). Los individuos marcados invirtieron más del 70% del tiempo en aguas con temperaturas de entre 27 y 28 °C (Fig. 3b). Los movimientos verticales indicaron que los individuos se movieron en estratos más superficiales durante las horas de luz en comparación con la noche, como se puede observar en el fragmento de la serie de tiempo de profundidad para el seguimiento 4 (Fig. 4); además, se observó un mayor número de inmersiones verticales desde la superficie hasta más de 70 m de profundidad durante la noche.

Figura 3: (a) Profundidad y (b) temperatura a lo largo de las rutas de movimiento de Coryphaena hippurus.
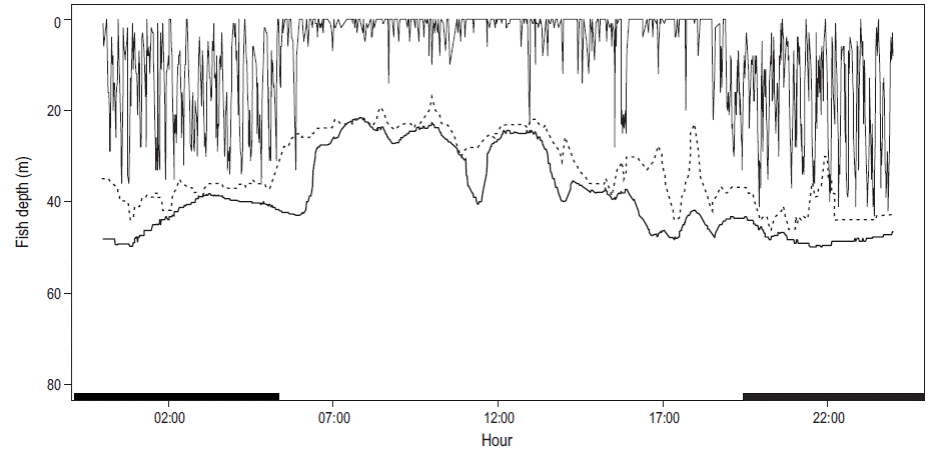
Figura 4: Fragmento de la serie de tiempo de los movimientos verticales para el seguimiento 4 durante 24 h: líneas verticales, profundidad del pez; línea oscura, batimetría; línea punteada, profundidad de la termoclina. Las barras negras sobre el eje x indican horas de oscuridad.
El modelo resultante para los movimientos verticales fue el siguiente:
Profundidad del pez = α + f 1 (temperatura del agua) + f2 (batimetría) + f3 (hora) + f4 (profundidad de termoclina) + género + (1/seguimiento)
Las variables explicativas evaluadas fueron significativas a P < 0.05. La devianza explicada fue de 64%, (R 2 = 0.6, Tabla 1). Las variables explicativas con mayor peso fueron la temperatura del agua y la batimetría, seguidas de la hora del día, la profundidad de la termoclina y el género. La probabilidad de que los peces se mantengan a una profundidad mayor es cuando la temperatura del agua es menor que 28 °C, la profundidad del fondo es mayor que 30 m, entre las 15:00 y las 3:00 h y la profundidad de la termoclina está entre 40 y 60 m. Las hembras nadaron más profundo que los machos (Fig. 5).

Figura 5: Modelos aditivos generalizados mixtos de los movimientos verticales de Coryphaena hippurus. Las gráficas muestran el efecto de las variables explicativas (temperatura del agua, batimetría, hora, profundidad de la termoclina y género) sobre la variable de respuesta (profundidad del pez). En (a-d), las líneas verticales sobre los ejes x indican la distribución de datos y los ejes y muestran el valor de la variable de respuesta en la escala del predictor lineal; las áreas sombreadas indican el error estándar. En (e), las barras negras sobre el eje x representan el acumulativo de los datos de cada género, las líneas horizontales delgadas representan el valor de la variable de respuesta (profundidad del pez) en escala del predictor lineal y las líneas horizontales discontinuas indican el error estándar.
Discusión
Se identificaron los movimientos horizontales y verticales de C. hippurus en BLP en relación con factores bióticos (sexo) y abióticos (temperatura del agua registrada por los transmisores acústicos, batimetría, profundidad de la termo-clina y hora). Se marcaron ocho dorados juveniles, pero sólo se siguieron seis de ellos por un periodo máximo de 48 h en verano. Todos los individuos marcados permanecieron dentro de la BLP y sus movimientos horizontales se concentraron en una zona poco profunda (1-80 m) en el suroeste de la bahía y a temperaturas de entre 27 y 29 °C, lo cual coincide con las temperaturas preferenciales reportadas en otros trabajos (Palko et al. 1982, Campos et al. 1993, Massutí y Morales-Nin 1995, Farrell et al. 2014).
Dos dorados marcados en el sureste de la BLP, un macho y una hembra, presentaron movimientos similares en cuanto a que casi cruzaron la bahía hacia el extremo opuesto. Los otros cuatro individuos se movieron en distintas direcciones, pero no se alejaron mucho de su sitio de captura.
Merten et al. (2014a, 2014b) señalaron que la dirección y tasa de movimiento de los dorados que marcaron en el Atlántico varió según la latitud, longitud y distancia de la costa a la que fueron liberados, pero no indican una conclusión contundente sobre ese comportamiento.
En el presente estudio, los dorados marcados realizaron movimientos verticales en el estrato superior de la columna de agua comprendido entre la superficie y los 34 m de profundidad, por encima de la termoclina, cuando ésta fue detectada. Esto coincide con el carácter epipelágico del dorado y con lo reportado en otros trabajos que mencionan que este pez invierte gran parte de su tiempo en la superficie (Furukawa et al. 2011, Merten et al. 2014c). Se ha propuesto que esta preferencia de permanencia está relacionada con la distribución de su alimento en la columna de agua (Furukawa et al. 2011, Merten et al. 2014c), lo cual concuerda con estudios de hábitos alimenticios de la especie que indican que un importante componente de su dieta son presas epipélagicas que se distribuyen en estratos superficiales del mar (Aguilar-Palomino et al. 1998, Olson y Galván-Magaña 2002, Tripp-Valdez et al. 2010). Aunado a lo anterior, la estratificación térmica en el mar genera una barrera física que es capaz de agregar verticalmente el alimento, incrementando la posibilidad de encontrar presas. Se ha sugerido que el estrato más importante para las interacciones tróficas entre las larvas de peces y zooplancton está en los primeros 30 m de profundidad, independientemente de donde se encuentre la termoclina (Gray y Kingsford 2003), y esta profundidad concuerda con la profundidad a la que los dorados pasaron la mayor parte del tiempo durante el presente estudio (30 m).
Otros autores, han sugerido que la preferencia del hábitat de los dorados en aguas someras es una estrategia para evitar cambios bruscos de temperatura y así disminuir el gasto de energía al permanecer en condiciones isotérmicas arriba de la termoclina (Furukawa et al. 2011, 2014). En este estudio, el dorado cruzó ocasionalmente la termoclina (cuando ésta fue detectada), y este mismo comportamiento también fue reportado por Furukawa et al. (2011) y Merten et al. (2014c).
El dorado realizó inmersiones verticales profundas durante la noche. Es probable que este comportamiento esté relacionado con una estrategia de alimentación, pues de acuerdo con Merten et al. (2014c), este tipo de inmersiones verticales están relacionados con la búsqueda y captura de presas epipelágicas y mesopelágicas. El estudio de estos autores se centró en machos adultos e hicieron hincapié en que dicho comportamiento podría no ser representativo para hembras y juveniles; sin embargo, en este estudio los machos juveniles también presentaron este comportamiento y las hembras juveniles hicieron inmersiones más profundas que los machos juveniles. Dada la limitada información obtenida en este trabajo y que no se tienen datos del comportamiento alimenticio de C. hippurus en BLP, se sugiere realizar investigaciones que corroboren la relación entre sus movimientos verticales y su alimentación.
Una de las limitantes de este estudio fue el número de individuos marcados. Se sugiere que en futuras investigaciones se marque un mayor número de individuos y se genere una base de información que pueda abarcar todo el ciclo anual del dorado y la temporada de pesca deportiva. Por otro lado, en futuras investigaciones es recomendable hacer estudios de hábitos alimenticios de esta especie en BLP.
En resumen, los movimientos de los dorados juveniles dentro de BLP se concentraron cerca de la costa en áreas poco profundas, preferentemente entre la superficie y 30 m de profundidad. Aun cuando se siguieron pocos individuos y durante un corto periodo de tiempo, consideramos que esta información pudiera ser tomada en cuenta para regular la captura en zonas someras dentro de BLP para permitir que los juveniles alcancen la talla de madurez sexual y, por tanto, asegurar la sustentabilidad de la actividad pesquera de esta especie en esta región.











 texto en
texto en 


