Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.41 no.4 Ensenada Dez. 2015
https://doi.org/10.7773/cm.v41i4.2545
Artículos
Estado actual del lobo marino de California (Zalophus californianus) y el elefante marino del norte (Mirounga angustirostris) en el archipiélago San Benito, México
1 Departamento de Pesquerías y Biología Marina, Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional (CICIMAR-IPN), Ave. IPN s/n, Colonia Playa Palo de Santa Rita, 23096, La Paz, Baja California Sur, México.
2 Dipartimento di Scienze della Vita e dell'Ambiente, Università Politecnica delle Marche, Via Brecce Bianche, 60100, Ancona, Italy.
3 Ecology Project International, Guillermo Prieto 1038 e/ Navarro y Encinas, Colonia Centro, La Paz, Baja California Sur, México.
El lobo marino de California (LMC) y el elefante marino del norte (EMN) son los dos pinnipedos más abundantes del archipiélago San Benito (Baja California, México). Este estudio reporta los resultados del primer monitoreo que reúne información de temporadas reproductivas continuas (2012-2015) y a lo largo de un año (2014). La abundancia de LMC declinó en julio de 2014, en comparación con el año previo; sin embargo, la colonia del archipiélago se catalogó como "estable", tomando como base censos históricos. Intraanualmente, la abundancia del LMC fue regulada por crías y hembras adultas, las cuales alcanzaron su pico durante la temporada reproductiva (julio). Adicionalmente, se apoya la hipótesis de que machos subadultos de la costa occidental de Baja California ingresan al golfo de California. Las fluctuaciones del EMN fueron afectadas principalmente por la temporada de reproducción (febrero), cuando se presentó un pico de crías y hembras adultas, así como por la presencia importante de juveniles en mayo y septiembre. El EMN del archipiélago se catalogó como "en declive" con base en conteos de años anteriores. Este monitoreo de alta resolución se complementa con estudios pasados y futuros, y agrega otra dimensión a nuestro entendimiento de esta especies, el cual se basa mayoritariamente en las colonias principales que se ubican en California.
Palabras clave: lobos marinos de California; elefantes marinos del norte; archipiélago San Benito; Baja California; abundancia
The California sea lion (CSL) and the northern elephant seal (NES) are the two most abundant pinniped species inhabiting the San Benito Archipelago (Baja California, Mexico). This study reports the results of the first survey to gather abundance information from continuous breeding seasons (2012-2015) and over the course of a single year (2014). Relative to the previous year, the abundance of CSLs declined in July 2014; however, based on historical censuses, the colony at the archipelago was catalogued as "stable". Intra-annually, the CSL abundance was regulated by pups and adult females, which reached their peak during the breeding season (July). Moreover, we hypothesize that subadult males from the west coast of Baja California enter the Gulf of California. The NES fluctuations were most affected by the breeding season (February), when the number of pups and adult females peaked, and by the important presence of juveniles in May and September. The NES colony at the archipelago was catalogued as "in decline", based on previous countings. This high-resolution survey complements past and future studies in the region, and adds another dimension to our understanding of these species, which is largely based on information from their main rookeries in California.
Key words: California sea lions; northern elephant seals; San Benito Archipelago; Baja California; abundance
Introducción
El archipiélago San Benito (ASB) es el único lugar de México donde coexisten cuatro especies de pinnípedos: el elefante marino del norte, Mirounga angustirostris; el lobo marino de California, Zalophus californianus; el lobo fino de Guadalupe, Arctocephalus philippii townsendi; y la foca común, Phoca vitulina. Las primeras dos especies son las más abundantes (Angell 2014) y ocupan estas islas para eventos importantes de historia de vida, como la reproducción y la muda (Aurioles-Gamboa y Zavala 1994, Le Boeuf y Laws 1994, Garcia-Aguilar 2004a). Este archipiélago, ubicado en la costa oeste de Baja California, se encuentra dentro del rango de distribución de estas especies a lo largo de la costa occidental de Norte América. Es esencial contar con información de diferentes sitios para entender su extensión geográfica en relación con su presencia en México, donde se localizan las colonias en el limite sur de su distribución, y a latitudes mayores (e.g., California, EUA), donde son más abundantes (Lowry et al. 2014).
El lobo marino de California (LMC), Zalophus californianus, pertenece a la familia Otariidae y se considera una especie biomonitora de condiciones ambientales (Szteren y Aurioles-Gamboa 2013). Se encuentra en el Pacifico Norte oriental, particularmente en las islas frente a las costas de California y Baja California, y se ha estimado una población total de alrededor de 350,000 individuos: 238,000 en la costa de California (Carretta et al. 2007), 75,000-87,000 en la costa oeste de Baja California (Lowry y Maravilla-Chávez 2005) y ca 25,000 en el golfo de California (Szteren et al. 2006). La temporada de reproducción del LMC es de junio a agosto, e inicia antes y es más prolongada en el golfo de California que en la costa de California (Garcia-Aguilar y Aurioles-Gamboa 2003a). La mayoria de los machos adultos de las principales loberas de Baja California y el sur de California realizan una migración hacia el norte después de la temporada de reproducción, invernando desde la parte central de California hasta el estado de Washington (EUA). Un menor número de individuos llega hasta Columbia Británica y el sureste de Alaska, observándose en el golfo de Alaska, la peninsula de Alaska y las islas orientales Aleucianas. Otros inidividuos aparentemente permanecen todo el año en el golfo de California y no realizan migraciones largas (Peterson y Bartholomew 1967, Le Boeuf et al. 1983, Elorriaga-Verplancken et al. 2013).
El elefante marino del norte (EMN), Mirounga angustirostris, pertenece a la familia Phocidae y sólo se encuentra en el hemisferio norte, particularmente en el Pacifico Norte oriental y central. Durante la temporada de reproducción se encuentra principalmente en islas y en unos cuantos sitios del territorio continental desde Baja California (México) hasta Oregón (EUA). Se conocen bien 12 colonias reproductivas que se localizan en islas del sur de California y Baja California (Le Boeuf y Laws 1994, Garcia-Aguilar 2004b). Los individuos realizan dos migraciones a sus loberas durante el año, la primera a finales del invierno (diciembre a marzo) para reproducirse y la segunda durante la temporada cálida (primavera/verano) para mudar, pero la duración de esta última varia dependiendo del sexo y la edad. Al final de la temporada reproductiva, las hembras se trasladan a las zonas de alimentación donde permanecen durante unos 70 dias antes de regresar a tierra por un mes para realizar la muda; después de mudar, regresan a las zonas de alimentación por otros ocho meses antes de regresar a las loberas para parir. Los machos adultos permanecen alrededor de cuatro meses en el mar después de la temporada reproductiva y regresan a tierra para mudar durante el verano; después de un mes, regresan al mar por cuatro meses antes de regresar a las zonas de reproducción para aparearse (Stewart y DeLong 1994, Berta et al. 2006). A finales del siglo XIX la población de EMN estaba al borde de la extinción; sólo unas cuantas decenas de individuos sobrevivieron la caceria comercial (Stewart et al. 1994). Durante el siglo pasado, la especie empezó a recuperarse y a recolonizar los sitios que habia habitado antes de ser cazada. La población creció rápidamente y actualmente se estima en 210,000-239,000 individuos (Lowry et al. 2014).
Este trabajo proporciona el primer registro continuo de las poblaciones de Z. californianus y M. angustirostris de México durante años contiguos (temporadas reproductivas de 2012, 2013 y 2014), asi como un registro semicontinuo durante un año (cinco censos durante 2014). Este estudio aporta información que mejora nuestro conocimiento de la ocupación por estas especies del ASB, un área prioritaria para la conservación en México. El objetivo de este trabajo fue evaluar la porción sureña de las poblaciones de LMC y EMN. Se determinó la abundancia total y la abundancia por clases de sexo y edad durante un periodo de tres años, asi como las tendencias de estas especies con base en datos históricos.
Materiales y métodos
El ASB (28.30°N, 115.56°W) se ubica 30 km al noroeste de la isla de Cedros y 75 km al oeste de la peninsula de Baja California, México (Fig. 1). El archipiélago cubre un área total de 6.4 km2 (Boswall 1978, Junak y Philbrick 1999) y está compuesto por tres islas volcánicas: San Benito Este (SBE), San Benito Medio (SBM) y San Benito Oeste (SBO).
De 2012 a 2015, las colonias fueron monitoreadas en verano e invierno, durante las temporadas reproductivas de ambas especies (verano para LMC e invierno para EMN), y en 2014 se realizaron cinco censos a lo largo del año. Se llevaron a cabo un total de 17 censos (8 para LMC y 9 para EMN) en las siguientes fechas: 31 de julio a 12 de agosto de 2012; 6 a 14 de febrero y 2 a 11 de julio de 2013; 4 a 13 de febrero, 30 de abril a 5 de mayo, 30 de junio a 6 de julio, 11 a 14 de septiembre y 5 a 9 de diciembre de 2014; y 17 a 24 de febrero de 2015 (sólo para EMN).
Los censos se realizaron de dos maneras con técnicas comúnmente usadas para monitorear pinnipedos (Le Boeuf et al. 1983, Aurioles-Gamboa y Zavala 1994, Aurioles-Gamboa et al. 2010, Angell 2014). Se realizó un muestreo a pie una vez por viaje de campo en SBM y SBO (3.5 y 10.4 km, respectivamente), teniendo cuidado de acercarse a las colonias con cautela para evitar que los animales se asustaran e ingresaran al mar. En SBE se realizó un censo por viaje de campo (7.5 km) desde una embarcación a una distancia promedio de 30 m para no provocar una estampida. Se utilizó la misma metodología durante todos los censos para garantizar la coherencia. Estas dos formas de realizar los conteos (i.e., en tierra y desde una embarcación) se complementaron ya que maximizaron la eficiencia de los censos para la localidad específica y permitieron registrar el mayor número posible de animales en cada sitio (Aurioles-Gamboa et al. 2010).
Los individuos de las dos especies se clasificaron en cinco categorías según la edad y el sexo: crías, juveniles, machos subadultos, machos adultos y hembras adultas. Todos los animales no bien identificados fueron clasificados como misceláneos (Aurioles-Gamboa et al. 1983, 2010; Le Boeuf y Laws 1994; Angell 2014). No se separaron las subcategorías de los machos subadultos de LMC y EMN.
Factores de corrección
Se ha encontrado que los censos de pinnípedos subestiman la población; sin embargo, es posible aplicar, a los datos, factores de corrección publicados por otros autores para mitigar esta subestimación. Para la temporada de reproducción (julio a agosto), se aplicó el factor de corrección propuesto por Le Boeuf et al. (1983) a los datos de las crías de LMC (+50%) censadas desde la embarcación (SBE) para compensar el esfuezo realizado en tierra y las crías ocultas. De acuerdo con Bonnell y Ford (1987), se aplicó otro factor de corrección a los datos de todas las hembras adultas de LMC (+23% en julio y +54% en agosto), bajo el supuesto de que algunas hembras se estaban alimentando en el mar.
Se aplicaron otros factores de corrección para obtener el tamaño de las colonias para las temporadas de reproducción más recientes: julio de 2014 para el LMC y febrero de 2015 para el EMN. El número de crías contadas se multiplicó por el inverso de la proporción de crías en la colonia (McCann 1985, Boveng 1988), usando para este enfoque una proporción conocida (0.209) de crías de LMC para la costa oeste de Baja California (Lowry y Maravilla-Chávez 2005). También se estimó un tamaño mínimo de la colonia de LMC, de forma conservadora, como dos veces el número de crías (corregido según Le Boeuf et al. [1983]) más el resto de los individuos de las otras categorías (machos adultos, machos subadultos, juveniles y misceláneos). En el caso del EMN, como las hembras adultas no se encuentran en tierra al mismo tiempo durante la temporada de reproducción (Reiter et al. 1981, Rothery y McCann 1987, Condit et al. 2007), se usó el modelo desarrollado por Rothery y McCann (1987), y también usado por García-Aguilar (2004b), para describir la distribución temporal de las hembras de EMN en el ASB. Este modelo proporciona un factor de corrección, que representa la proporción esperada de hembras en tierra en una fecha dada, en relación con el número total de hembras que ocuparon el ASB durante toda la temporada reproductiva (Galimberti y Sanvito 2001). Con base en este modelo para el EMN, la proporción esperada de hembras adultas del 17 al 24 de febrero de 2015, en relación con el número total de hembras adultas que llegaron al ASB durante toda la temporada reproductiva, fue de 13.68%. Puesto que García-Aguilar (2004b) estimó que 76% de todas las hembras del ASB tienen crías, se calculó el número total de crías a partir de esa proporción. El tamaño mínimo de la colonia se calculó, de forma conservadora, como la suma de la producción de crías más el número total de hembras adultas (ambos según los criterios de García-Aguilar [2004b]) más el resto de las categorías (machos adultos y subadultos).
Análisis de tendencias para ambas especies
Se usaron los conteos históricos de las crías de LMC (Lowry y Maravilla-Chávez 2005, García-Aguilar et al. 2013) y EMN (Álvarez-Coronado 2003, García-Aguilar 2004a) para determinar las tendencias de ambas colonias. Se calculó la tasa intrínseca de incremento (r) mediante regresión lineal, donde y (variable dependiente) es el loge del número de crías (datos históricos y documentados aquí) en las temporadas de reproducción y x (variable independiente) es el tiempo (años); r es la pendiente y la tasa finita se calcula como λ = er (Caughley y Birch 1971, Caughley 1977).
Abundancia relativa durante 2014
La abundancia relativa (AR) se calculó para las categorías más abundantes de cada especie durante los muestreos de 2014: AR = Cx,i /ni , donde Cx,i es el número de animales de la categoría x enumerados en el censo i y ni es el número total de animales (incluyendo todas las categorías) contados en el censo.
Se realizó una prueba x 2 para identificar las diferencias significativas en la abundancia de LMC y EMN durante las diferentes temporadas de reproducción y a lo largo de 2014.
Resultados
Lobos marinos de California en el archipiélago San Benito
La mayor abundancia de LMC se registró en julio de 2012 (7,501 individuos), julio de 2013 (8,859 individuos) y julio de 2014 (7,136 individuos). Con base en los criterios de Le Boeuf et al. (1983) y Bonnell y Ford (1987), la abundancia de LMC para cada julio fue de 9,420, 10,164 y 8,022 individuos, respectivamente. Estos valores difirieron significativamente de año a año (x 2 = 257, g.l. = 2, P < 0.05).
Durante 2014, los censos de LMC se realizaron cada dos o tres meses: a principios de febrero, mayo, julio, septiembre y diciembre. El mayor número de LMC se registró en julio, seguido por septiembre, diciembre, febrero y mayo (Tablas 1, 2). Se observaron diferencias significativas entre los diferentes meses de 2014 (x 2 = 5,345, g.l. = 4, P < 0.05).
Tabla 1: Abundancia del lobo marino de California (Zalophus californianus) por clases de edad y sexo en el archipiélago San Benito durante 2012-2014: AM, machos adultos; SM, machos subadultos; F, hembras; J, juveniles; P, crías; M, misceláneos.

Tabla 2: Factor de corrección (Le Boeuf et al. 1983, Bonnell y Ford 1987) para hembras adultas y crías de lobo marino de California (Zalophus californianus) durante las temporadas de reproducción (2012-2014).

Uncorrected/*corrected data
El factor de corrección adicional (McCann 1985, Boveng 1988, Lowry y Maravilla-Chávez 2005), aplicado sólo para la temporada de reproducción de 2014, dio como resultado una abundancia de 13,885 crías y un tamaño mínimo de la colonia de 7,633 individuos.
Abundancia relativa por clases de sexo y edad de lobos marinos de California durante 2014
En febrero de 2014, 49% de los LMC fueron crías y 39% fueron hembras adultas. En mayo de 2014, las crías y las hembras también predominaron (52% y 38%, respectivamente). Este patrón continuó en julio cuando la población total consistió principalmente de crías (40%) y hembras adultas (40%). En septiembre y diciembre de 2014, las crías representaron la mayor proporción de la colonia (62% y 64%, respectivamiente), seguidas por las hembras (25% y 27%, respectivamente). Ninguna de las otras clases (machos adultos, machos subadultos y juveniles) conformaron más del 8% de la colonia.
Elefantes marinos del norte en el archipiélago San Benito
Las mayores abundancias de EMN se registraron durante las temporadas de reproducción de 2013 (n = 2,293), 2014 (n = 1,930) y 2015 (n = 1,633). Se encontraron diferencias significativas entre los diferentes años (x 2 = 129.7, g.l. = 2, P < 0.05).
A diferencia de los LMC, los EMN estuvieron poco representados en el verano de tanto 2012 (n = 251) como 2013 (n = 210) (Tabla 3). Durante 2014, la abundancia fue mayor en mayo (n = 3,050), disminuyó fuertemente en julio (n = 168) y aumentó de nuevo en septiembre (n = 481) y diciembre (n = 620) (Tabla 3). Se observaron diferencias significativas de la abundancia de EMN entre los diferentes meses de 2014 (x 2 = 4,689.8, g.l. = 4, P < 0.05).
Tabla 3: Abundancia del elefante marino del norte (Mirounga angustirostris) por clases de edad y sexo en el archipiélago San Benito durante 2012-2014: AM, machos adultos; SM, machos subadultos; F, hembras; J, juveniles; P, crías; M, misceláneos.

* Beginning of the breeding season
Con base en los criterios de Rothery y McCann (1987) y García-Aguilar (2004b), se calculó un total de 2,010 hembras adultas y 1,528 crías durante la temporada reproductiva de 2015 (17 a 24 de febrero). El tamaño mínimo de la colonia fue de 3,690 individuos.
Abundancia relativa por sexo y clase de edad de elefantes marinos del norte durante 2014
En el invierno (febrero de 2014), las crías representaron 57% de la colonia de EMN y las hembras adultas 35%. En febrero también se registraron machos adultos y subadultos (7%). Los juveniles fueron los más abundantes en mayo de 2014 (88%). La menor abundancia se registró en julio cuando sólo machos y juveniles conformaron la colonia. En septiembre de 2014, los juveniles representaron 95% de la colonia. En diciembre, las hembras representaron casi la mitad de la colonia (43%), seguidas por juveniles (30%), machos adultos y subadultos (18%) y crías recién nacidas (9%).
Discusión
Lobo marino de California
Se registró una abundancia de 7,136-8,859 individuos durante la temporada de reproducción del LMC, lo que sugiere que alrededor de 10% de la población de la costa oeste de Baja California habita el ASB. Estudios previos realizados en la zona registraron abundancias similares durante la temporada de reproducción: 7,790 en 2000 (Hernández-Camacho y Aurioles-Gamboa 2000) y 5,489 en 2007 (Pablo 2009). De los diferentes años estudiados aquí, 2013 y 2014 son los más comparables ya que en ambos años fue posible recolectar datos en fechas similares, durante la temporada reproductiva. En comparación con 2013, la abundancia de LMC disminuyó en julio de 2014, particularmente la abundancia de crías y hembras adultas. Es difícil determinar la causa de esta disminución; sin embargo, una hipótesis es que el calentamiento (1-4 °C arriba de lo normal) de gran escala (2,000 km de ancho y 100 m de profundidad) que ocurrió en el océano Pacífico en el otoño de 2013 y de nuevo en la primavera de 2014 provocó una disminución de la productividad primaria y la subsecuente disponibilidad de presas (Kintisch 2015). Durante otros eventos de calentamiento se ha observado que hembras pasan más tiempo en el mar y que la tasa de mortalidad de las crías es mayor (Aurioles-Gamboa y Le Boeuf 1991). Este calentamiento del océano Pacífico ha influenciado la disponibilidad de presas (e.g., desove de sardina en sitios alejados de la costa) y se ha vinculado a altas tasas de mortalidad de LMC en loberas del sur de California en 2013 y 2014 (NOAA Fisheries 2014).
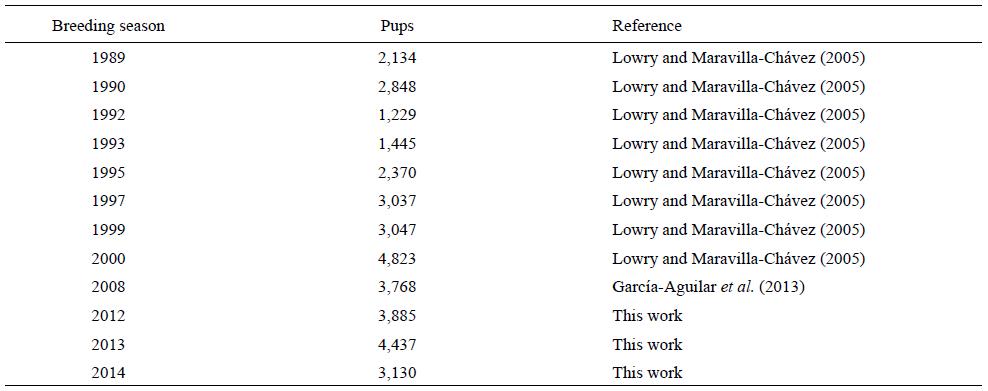
Con base en datos históricos de las crías de LMC (Lowry y Maravilla-Chávez 2005, García-Aguilar et al. 2013) y nuestros datos (Tabla 4), la colonia del ASB mostró un aumento anual de 4.3% entre 1989 y 1999 (r = 0.0421, R 2 = 0.18, P = 0.35); sin embargo, en años recientes (2000-2014), se observa una tendencia negativa (-1.93%) (r = -0.0191, R 2 = 0.44, P = 0.23). Ya que estas variaciones no fueron significativas, la colonia se catalogó como "estable", pero este estado podría cambiar eventualmente y es importante seguir monitoreando esta tendencia durante los siguientes años.
Tabla 4: Conteos históricos de crías de lobo marino de California (Zalophus californianus) en el archipiélago San Benito.
Variación intraanual
La abundancia de la colonia de LMC varió a lo largo de 2014; las variaciones estuvieron reguladas principalmente por el número de crías recién nacidas y de hembras adultas. El número más alto de LMC se registró durante la temporada de reproducción (verano), cuando la mayoría de los animales se encuentran en tierra. Durante este periodo, las hembras adultas dan a luz entre finales de mayo y mediados de julio. El comienzo de la época de crías también explica la baja abundancia previa de hembras en mayo, cuando muchas hembras todavía se encuentran en el mar buscando alimento antes de parir. En verano, las crías recién nacidas permanecen en tierra o cerca de la costa durante sus primeros meses de vida y los machos adultos se encuentran en sus territorios de reproducción o patrullando los alrededores (Peterson y Bartholomew 1967, Le Boeuf et al. 1983). Los machos adultos estuvieron ausentes o fueron escasos a lo largo del año excepto en julio cuando la razón de hembras a machos fue de 12.7:1 (2012), 6.5:1 (2013) y 7:1 (2014). Estas razones son típicas de sistemas de apareamiento poligínico y son similares a los documentados para California (7-10:1) (Peterson y Bartholomew 1967) y el golfo de California (6:1 y 11:1) (García-Aguilar y Aurioles-Gamboa 2003a).
Los machos adultos inician su migración al finalizar la temporada de reproducción (Odell 1975), lo que explica su ausencia fuera del verano, mientras que las hembras adultas mostraron una alta fidelidad al sitio durante el mismo periodo de tiempo. Los machos subadultos representaron un pequeño porcentaje de la población a lo largo del año y aumentaron en número de febrero a julio cuando se registró la mayor abundancia. En el sur del golfo de California sucede lo contrario ya que los machos jóvenes son escasos en verano y más abundantes de septiembre a enero cuando se registra la mayor abundancia (Aurioles-Gamboa et al. 1983). Esta diferencia entre el sur del golfo y el ASB apoya la hipótesis de que algunos machos subadultos de sitios en la costa occidental de Baja California ingresan al golfo y permanecen los siguientes meses en el área (Aurioles-Gamboa et al. 1983).
El número de crías fue consistentemente mayor que el número de hembras adultas. Esto se puede atribuir a que debido a su estrategia de alimentación, es imposible contar todas las hembras en tierra. El periodo de lactancia del LMC es largo, de 12+ meses, durante el cual las hembras alternan su cuidado maternal con viajes de alimentación en el mar (Antonelis et al. 1990).
Las crías no cuentan con una capa gruesa de grasa que sirva como reserva energética y necesitan ingerir cantidades grandes de leche. Conforme crecen, sus reservas energéticas y su habilidad de ayunar aumentan (García-Aguilar y Aurioles-Gamboa 2003b), permitiéndoles a las hembras realizar viajes de alimentación más largos y reducir el tiempo que permanecen en tierra. Conforme avanza la temporada, las crías se vuelven más activas hasta aventurar mar adentro (Peterson y Bartholomew 1967), dando lugar a una mortalidad elevada de crías alrededor de los seis meses de edad (Aurioles-Gamboa y Sinsel 1988). Estos factores podrían explicar la disminución de la abundancia de tanto hembras adultas como crías fuera de la temporada de reproducción, registrándose la menor abundancia en mayo.
Elefante marino del norte
En invierno, la abundancia del EMN fue similar o mayor que lo documentado anteriormente. Hernández-Camacho y Aurioles-Gamboa (2000) observaron 1,900-2,170 individuos, mientras que Pablo (2009) contó aproximadamente 2,400. Nuestro conteo para el verano es similar a lo encontrado por Maravilla-Chávez y Lowry (1996), quienes contaron 331 individuos a principios de agosto. Aunque especulativo, se puede vincular el calentamiento de 2014 a la disminución de crías recién nacidas en 2014 y 2015 en relación con 2013. No obstante, con base en estudios previos (Álvarez-Coronado 2003, García-Aguilar 2004a) y nuestros datos (Tabla 5), la colonia de EMN en el ASB ha mostrado una tendencia anual de -3.2% (r = -0.0318, R2 = 0.76, P < 0.02) durante los pasados 15 años, por lo que se cataloga esta colonia como "en declive". En vista de que esta tendencia ha prevalecido durante más de una década, podría no ser preciso relacionarla a anomalías oceanográficas recientes.
Tabla 5: Conteos previos de crías de elefante marino del norte (Mirounga angustirostris) en el archipiélago San Benito.

La temporada de reproducción del EMN inicia en diciembre y finaliza en febrero (Scheffer 1958, Le Boeuf y Mate 1978, Le Boeuf et al. 2011). En diciembre, no registramos un gran número de animales en tierra. Las principales categorías observadas fueron hembras preñadas y juveniles, seguidos por las primeras crías recién nacidas (n = 54), así como algunos machos subadultos y adultos. En febrero se contó un mayor número de individuos, principalmente hembras y crías recién nacidas (n = 1,004-1,504), así como machos adultos patrullando sus harenes, lo cual es típico de animales poligínicos (Le Boeuf y Laws 1994). En 2015 se registró un número relativamente bajo de hembras adultas, posiblemente porque el censo se realizó hacia el final de la temporada de reproducción del EMN cuando varias hembras ya habían inciado su migración después del periodo de lactancia de 25-28 días (Le Boeuf y Laws 1994). Las crías son destetadas de forma abrupta y sus madres regresan al mar para buscar alimento antes de volver a tierra para mudar a finales de la primavera (Le Boeuf y Laws 1994, Le Boeuf et al. 2000). Las crías destetadas permanecen en tierra durante ~2.5 meses antes de aventurar mar adentro (Le Boeuf et al. 1994, Thorson y LeBoeuf 1994). La gran diferencia entre el número de hembras adultas y crías durante la temporada reproductiva se debe a que nosotros registramos estos datos cuando las crías permanecían en tierra pero algunas madres ya habían iniciado su migración.
La proporción sexual operacional (H:M) varió durante las diferentes temporadas de reproducción: 5.8:1 en 2013, 9.9:1 en 2014 y 4.7:1 en 2015. La razón obtenida en un estudio previo realizado en el ASB y la isla de Cedros en 1999 y 2000 fue 4:1 y 4.6:1, respectivamente (Hernández-Camacho y Aurioles-Gamboa 2000). Un número incierto de hembras adultas ya había comenzado su migración cerca del final de la temporada reproductiva y esto podría haber llevado a la subestimación de estas razones.
Variación intraannual
La mayoría de los EMN no se contaron durante la temporada de reproducción, sino más bien en mayo cuando la mayoría de los individuos en tierra eran juveniles nacidos en el invierno anterior (2014) o unos pocos años antes; los demás individuos eran hembras adultas regresando de su migración después de la temporada postreproductiva. Las hembras adultas y algunos juveniles se congregan en las islas para mudar (como ha sido señalado por Le Boeuf y Laws 1994), mientras que los machos adultos, subadultos y juveniles realizan la muda en verano después de regresar de su migración postreproductiva (machos adultos) que dura alrededor de cuatro meses (Stewart y DeLong 1994, Le Boeuf et al. 2000). Por lo tanto, en julio los machos adultos, subadultos y juveniles representaron la mayoría de los individuos en el archipiélago. Después de mudar, las hembras adultas y luego los machos adultos realizan su segunda migración, la cual dura ocho y cuatro meses, respectivamente (Le Boeuf et al. 2000). Los juveniles de la isla de Año Nuevo, California, realizan dos viajes de alimentación al año y cada uno dura alrededor de cinco meses (Le Boeuf y Laws 1994, Le Boeuf et al. 1994). Este comportamiento explicaría las abundancias máximas de juveniles en el ASB dos veces al año, en primavera (mayo) y otoño (septiembre), las mismas temporadas en que se han registrado picos de abundancia en la isla de Año Nuevo (Le Boeuf et al. 1994).
Este estudio es importante no sólo por mejorar nuestro conocimiento de estas especies de pinnípedos protegidos, sino también por conectar estos datos y estas interpretaciones con estudios pasados y futuros en este y otros sitios de Baja California. Al ampliar la extensión geográfica de los datos de estas especies, nuestro estudio proporciona evidencia sólida de las variaciones temporales y un análisis de cómo estas colonias en el límite sur de su distribución se asemejan a sus homólogos a latitudes mayores, donde sus abundancias son mayores y donde se han realizado la mayoría de los estudios. Se requiere realizar más censos para entender los cambios de abundancia a largo plazo de estas especies y otras similares en México, que frecuentemente habitan áreas protegidas que requieren ser monitoreadas constantemente para asegurar su conservación adecuada.
Agradecimientos
Este trabajo fue financiado por el Consejo Nacional de Ciencia y Tecnología (CONACYT, México, proyecto número CB-181876). Agradecemos a la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT, México), a través de la Dirección General de Vida Silvestre, el otorgamiento de los permisos SGPA/DGVS/11309/12 y 11744/13. También agradecemos a la Cooperativa Pesquera "Pescadores Nacionales de Abulón" de la isla de Cedros el apoyo brindado en el campo. GF agradece la beca otorgada por la Università Politecnica delle Marche (Ancona, Italia) y Campus World Project. FREV agradece el apoyo del Instituto Politécnico Nacional a través del Programa de Contratación por Excelencia. Finalmente, agradecemos la valiosa contribución de los revisores anónimos.
REFERENCIAS
Álvarez-Coronado GC. 2003. Estructura y dinámica poblacional del elefante marino del norte (Mirounga angustirostris) en las islas San Benito, Baja California, México. BSc thesis, Universidad Autónoma de Baja California, Ensenada, México, 79 pp. [ Links ]
Angell O. 2014. Abundancia y estructura de las colonias de pinnípedos que habitan el Archipiélago San Benito, B.C., México, en el verano e invierno (2012-2013). BSc thesis, Universdiad Autónoma de Baja California Sur, La Paz, México, 61 pp. [ Links ]
Antonelis GA, Stewart BS, Perryman WF. 1990. Foraging characteristics of female northern fur seals (Callorhinus ursinus) and California sea lions (Zalophus californianus)Can. J. Zool. 68: 150-158. [ Links ]
Aurioles-Gamboa D, Sinsel F. 1988. Mortality of California sea lion pups at Los Islotes, Baja California Sur, Mexico. J. Mammal. 69: 180-183. [ Links ]
Aurioles-Gamboa D, Le Boeuf BJ. 1991. Effects of the El Niño 1983 on the California sea lion population in Mexico. In: Trillmich F, Ono K (eds.), Pinnipeds and El Niño: Responses to Environmental Stress. Springer-Verlag, New York, pp. 112-118. [ Links ]
Aurioles-Gamboa D, Zavala G. 1994. Ecological factors that determine distribution and abundance of the California sea lion Zalophus califorianus in the Gulf of California. Cienc. Mar. 20: 535-553. [ Links ]
Aurioles-Gamboa D, Sinsel F, Fox C, Alvarado E, Maravilla O. 1983. Winter migration of subadult male California sea lions (Zalophus californianus) in the southern part of Baja California. J. Mammal. 64: 513-518. [ Links ]
Aurioles-Gamboa D, Elorriaga-Verplancken FR, Hernández-Camacho CJ. 2010. The current status of Guadalupe fur seal (Arctocephalus townsendi) on the San Benito Islands, Mexico. Mar. Mammal Sci. 26: 402-408. [ Links ]
Berta A, Sumich JL, Kovacs KM. 2006. Marine Mammals: Evolutionary Biology. Elsevier, 547 pp. [ Links ]
Bonnell DJ, Ford RG. 1987. California sea lion distribution: A statistical analysis of aerial transect data. J. Wildl. Manage. 51: 13-20. [ Links ]
Boswall J. 1978. The birds of the San Benito Islands, Lower California, Mexico. Bristol Ornithol. 11: 23-30. [ Links ]
Boveng P. 1988. Status of the northern elephant seal population along the U.S. West coast. National Marine Fisheries Service Center Administrative Report LJ-88-05. SWFC, La Jolla, CA. [ Links ]
Carretta JV, Forney KA, Muto MM, Barlow J, Baker J, Hanson B, Lowry MS. 2007. U.S. Pacific marine mammal stock assessments: 2006. Technical memorandum NOAA-TM-NMFS-SWSC. [ Links ]
Caughley G. 1977. Analysis of Vertebrate Populations. John Wiley, The Blackburn Press, London, 234 pp. [ Links ]
Caughley G, Birch LC. 1971. Rate of increment. J. Wildl. Manage. 35: 658-663. [ Links ]
Condit R, Le Boeuf BJ, Morris PA, Sylvan, M. 2007. Estimating population size in an asynchronous aggregation: A model and test with elephant seals counts. Mar. Mammal Sci. 23: 834-855. [ Links ]
Elorriaga-Verplancken FR, Aurioles-Gamboa D, Newsome SD, Martínez-Díaz S. 2013. 515N and 513C values in dental collagen as a proxy for sex and age variation in foraging strategies of California sea lions. Mar. Biol. 160: 641-652. [ Links ]
Galimberti F, Sanvito S. 2001. Modeling female haul-out in southern elephant seals (Mirounga leonina)Aquat. Mamm. 27: 92-104. [ Links ]
García-Aguilar MC. 2004a. Demografía y ecología de la conducta del elefante marino del norte (Mirounga angustirostris) en las Islas San Benito, Mexico. PhD thesis, Centro de Investigación Científica y de Educación Superior de Ensenada, México, 148 pp. [ Links ]
García-Aguilar MC. 2004b. Breeding biology of the northern elephant seal (Mirounga angustirostris) at the Isla San Benito del Oeste, Eastern Pacific, Mexico. Aquat. Mamm. 30: 289-295. [ Links ]
García-Aguilar MC, Aurioles-Gamboa D. 2003a. Breeding season of the California sea lion (Zalophus californianus) in the Gulf of California, Mexico. Aquat. Mamm. 29: 67-76. [ Links ]
García-Aguilar MC, Aurioles-Gamboa D. 2003b. Maternal care in the California sea lion R Los Islotes, Gulf of California, Mexico. Cienc. Mar. 29: 573-583. [ Links ]
García-Aguilar MC, Gutiérrez-García D, de la Cueva H. 2013. Terrestrial habitat segregation between the Guadalupe fur seal (Artocephalus townsendi) and the California sea lion (Zalophus californianus) at Islas San Benito, Mexico. Aquat. Mamm. 39: 54-60. [ Links ]
Hernández-Camacho C, Aurioles-Gamboa D. 2000. Estudios sobre el estado de las poblaciones de pinnípedos de las islas San Benitos y Cedros, Baja California. Informe Final de Investigación, CICIMAR-IPN, La Paz, BCS, México, 46 pp. [ Links ]
Junak SA, Philbrick R. 1999. Flowering plants of the San Benito Islands, Baja California, Mexico. Proceedings of the 5th California Islands Symposium. Santa Barbara Museum of Natural History, Santa Barbara, California, pp. 235-246. [ Links ]
Kintisch E. 2015. "The Blob" invades Pacific, flummoxing climate experts. Science 348: 17-18. [ Links ]
Le Boeuf BJ , Mate BR. 1978. Elephant seals colonize additional Mexican and Californian islands. J. Mammal. 59: 621-622. [ Links ]
Le Boeuf BJ , Laws RM. 1994. Elephant seals: An introduction to the genus. In: Le Boeuf BJ , Laws R (eds.), Elephant Seals: Population Ecology, Behaviour and Physiology. University of California Press, California, pp. 1-26. [ Links ]
Le Boeuf BJ, Aurioles-Gamboa D, Condit R, Fox C, Gisiner R, Romero R, Sinsel F. 1983. Size and distribution of the California sea lion population in Mexico. Proc. Calif. Acad. Sci. 43: 77-85. [ Links ]
Le Boeuf JB, Morris P, Reiter J. 1994. Juvenile survivorship of northern elephant seals. In: Le Boeuf BJ, Laws R (eds.), Elephant Seals: Population Ecology, Behaviour and Physiology. University of California Press, California , pp. 121-136. [ Links ]
Le Boeuf BJ, Crocker DE, Costa DP, Blackwell SB, Webb PM, Houser DS. 2000. Foraging ecology of northern elephant seals. Ecol. Monogr. 70: 353-382. [ Links ]
Le Boeuf BJ, Richard R, Condit R, Morris PA, Reiter J. 2011. The northern elephant seal (Mirounga angustirostris) rookery at Año Nuevo: A case study in colonization. Aquat. Mamm. 37: 486-501. [ Links ]
Lowry MS, Maravilla-Chávez O. 2005. Recent abundance of California sea lions in western Baja California, Mexico, and the United States. In: Garcelon DK, Schwemm CA (eds.), Proceedings of the 6th California Islands Symposium, Ventura, California, pp. 485-497. [ Links ]
Lowry MS, Condit R, Hatfield B, Allen SG, Berger R, Morris PA, Le Boeuf BJ, Reiter J. 2014. Abundance, distribution, and population growth of the northern elephant seal (Mirounga angustirostris) in the United States from 1991 to 2010. Aquat. Mamm. 40: 20-31. http://dx.doi.org/10.1578/AM.40.L2014.20 [ Links ]
Maravilla-Chávez MO, Lowry MS. 1996. Censos de pinnípedos en islas de la costa occidental de la península de Baja California, México (Julio/Agosto 1992). Cienc. Pesq. 13: 73-77. [ Links ]
McCann ST. 1985. Size, status, and demography of southern elephant seal (Mirounga leonina) populations. In: Ling JK, Bryden MM (eds.), Studies of Sea Mammals in South Latitudes. South Australian Museum, Northfield, pp. 1-17. [ Links ]
NOAA Fisheries. 2014. FAQs on the 2013 California Sea Lion UME Investigation. [accessed 15 March 2015]. http://www.nmfs.noaa.gov/pr/health/mmume/casealion2013_investigation.htm. [ Links ]
Odell DK. 1975. Breeding biology of the California sea lion, Zalophus californianusRapp. P.-v. réun. Cons. Int. Explor. Mer 169: 374-378. [ Links ]
Pablo RN. 2009. Amplitud, nivel y superposición trófica de los pinnípedos de Islas San Benito, B.C.S, México. MSc thesis, Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional (CICIMAR-IPN), La Paz, México, 110 pp. [ Links ]
Peterson RS, Bartholomew GA. 1967. The natural history and behavior of the California sea lion. American Society of Mammalogists, Special Publication 1: 79. [ Links ]
Reiter J, Panken KJ, Le Boeuf BJ. 1981. Female competition and reproductive success in northern elephant seals. Anim. Behav. 29: 670-687. [ Links ]
Rothery P, McCann ST. 1987. Estimating pup production of elephant seals at South Georgia. Symp. Zool. Soc. Lond. 58: 211- 223. [ Links ]
Scheffer VB. 1958. Seals, sea lions and walruses. A review of the Pinnipedia. Stanford University Press, Stanford, California, 179 pp. [ Links ]
Stewart SB, De Long RL. 1994. Postbreeding foraging migrations of northern elephant seals. In: Le Boeuf BJ, Laws R (eds.), Elephant Seals: Population Ecology, Behaviour and Physiology. University of California Press, California , pp 49-61. [ Links ]
Stewart BS, Yochem RK, Huber HR, Delong RL, Jameson RJ, Sydeman WJ, Allen SG, Le Boeuf BJ. 1994. History and present status of northern elephant seals. In: Le Boeuf BJ , Laws R (eds.), Elephant Seals: Population Ecology, Behaviour and Physiology, University of California Press, California , pp. 29-48. [ Links ]
Szteren D, Aurioles-Gamboa D. 2013. Trace elements in bone of Zalophus californianus from the Gulf of California: A comparative assessment of potentially polluted areas. Cienc. Mar. 39: 303-315. http://dx.doi.org/10.7773/cm.v39i3.2268 [ Links ]
Szteren D, Aurioles-Gamboa D, Gerber LR. 2006. Population status and trends of the California sea lion (Zalophus californianus californianus) in the Gulf of California, Mexico. In: Trites AW, Atkinson SK, DeMaster DP, Fritz LW, Gelatt TS, Rea LD, Wynne KM (eds.), Sea Lions of the World. Alaska Sea Grant College Program, Fairbanks, pp. 369-384. [ Links ]
Thorson PH, Le Boeuf BJ. 1994. Developmental aspects of diving on northern elephant seal pups. In: Le Boeuf BJ , Laws R (eds.), Elephant Seals: Population Ecology, Behaviour and Physiology. University of California Press, California , pp. 271-289. [ Links ]
Recibido: Junio de 2015; Aprobado: Octubre de 2015











 texto em
texto em 



