Introducción
A nivel global, las actividades relacionadas con la acuacultura han crecido a una tasa anual del 8.8% en los últimos 30 años debido al incremento en la demanda de productos derivados de la acuacultura (Jensen et al. 2014) y al mejoramiento en las líneas de producción (Asche 2008). El promedio anual de consumo de organismos acuáticos aumentó de 16 kg por persona en el año 2000 a 18.6 kg por persona en 2010 (FAO 2012). Se espera que para 2018, más de la mitad de la demanda global de organismos acuáticos será proporcionada por sistemas de cultivo intensivos. Además, se pronostica que las actividades relacionadas con la acuacultura proveerán 22 millones de toneladas de pescado adicionales para el año 2022 (FAO 2012).
Los sistemas de cultivo contienen varios compuestos químicos que pueden ser dañinos para los organismos cultivados y el ambiente. Si estos compuestos no son eliminados, se presenta una persistente acumulación de nutrientes (i.e., eutrofización), especialmente en sistemas de circulación semicerrados o cerrados donde el intercambio de agua es poco o nulo (Bouwman et al. 2013). Los organismos cultivados convierten cerca del 10-35% del nitrógeno y fósforo en biomasa y el resto es liberado directamente al estanque de cultivo en forma de nutrientes orgánicos o inorgánicos (Shimoda et al. 2007, Herbeck et al. 2014). Como resultado, las descargas de los sistemas de cultivo contienen una cantidad considerable de compuestos de nitrógeno y fósforo (Schneider et al. 2005, Buhmann y Papenbrock 2013, Barraza-Guardado et al. 2014, Herbeck et al. 2014). De estos compuestos, el amonio (NH4 +) y nitrito (NO2 -) son tóxicos para los organismos cultivados, y el nitrato (NO3 -) es tóxico únicamente en concentraciones altas (Camargo et al. 2005). Si las aguas de estos sistemas de cultivo son descargadas sin un tratamiento previo, el amonio, nitrito, nitrato y fosfato (PO4-3) pueden causar eutrofización en los cuerpos de agua donde son descargados (Herbeck et al. 2014). El nitrato y fosfato son considerados nutrientes limitantes en ambientes de agua dulce y marinos (Sundareshwar et al. 2003). Como consecuencia, una concentración alta de estos nutrientes puede causar florecimientos de algas masivos, los cuales pueden afectar el aspecto y los ciclos bioquímicos de los ambientes costeros.
Como resultado de los problemas ambientales causados por las altas concentraciones de nutrientes en las granjas acuícolas y de las restricciones implementadas por parte de agencias federales, ingenieros y ecólogos han desarrollado varios tipos de tratamientos para el uso óptimo de los efluentes de los sistemas de cultivo. Algunas de las técnicas más utilizadas incluyen ósmosis inversa (Schoeman y Steyn 2003), intercambio iónico (Kim y Benjamin 2004), electrodiálisis (Menkouchi Sahli et al. 2006), carbono activado (Sison et al. 1995), desnitrificación química (Hu et al. 2002) y tratamiento con microorganismos (Zaitsev et al. 2008). A pesar de que estas técnicas son efectivas para la remoción de nutrientes en aguas contaminadas, el costo operacional es considerable. Debido a esto, es necesario desarrollar métodos relativamente económicos para contrarrestar las condiciones de eutrofización (Páez-Osuna et al. 2003, Huang et al. 2012). Los humedales naturales y artificiales han sido sugeridos como sistemas económicos para filtrar efluentes provenientes de la acuacultura (Lin et al. 2002, 2003). Las macrófitas acuáticas dentro de los humedales juegan un papel importante en la remoción de nutrientes. Los procesos de transformación de compuestos nitrogenados en el suelo de los humedales incluyen la amonificación seguida de la nitrificación y desnitrificación (Maltais-Landry et al. 2009, Buhmann y Papenbrock 2013). En los sedimentos de los humedales, el 80-90% del fósforo se encuentra en forma orgánica, otra parte es incorporada a las plantas y una pequeña parte se encuentra en forma de ortofosfatos (Buhmann y Papenbrock 2013).
Los humedales de mangle son uno de los ecosistemas costeros más productivos en las regiones tropicales y subtropicales (Kristensen et al. 2008). Los mangles son considerados como un grupo de plantas tolerantes a los efluentes de las granjas acuícolas debido a su demanda enorme de nutrientes (Yang et al. 2008, Huang et al. 2012, Bao et al. 2013). Particularmente, estas plantas juegan un rol crítico en la remoción y degradación de contaminantes como metales pesados, pesticidas y compuestos nitrogenados y fosfatados (Kristensen et al. 2008, Reef et al. 2010, Adame y Lovelock 2011, Bayen 2012). Por lo tanto, el uso de los manglares ha sido considerado como un método relativamente simple y de bajo costo para el tratamiento de aguas provenientes de sistemas de cultivo (Ye et al. 2001, Huang et al. 2012, De-León-Herrera et al. 2015).
En décadas recientes se han utilizado a los mangles para la remoción de compuestos nitrogenados y fosfatados. Por ejemplo, Wong et al. (1997) evaluaron la tasa de remoción de carbono y nitrógeno orgánico en dos localidades intermareales con manglares de Kandelia candel y Aegiceras corniculatum, y sus resultados sugieren que estas dos especies de mangle presentan un gran potencial para la remoción de nutrientes. Tam y Wong (1995) midieron la tasa de retención de nutrientes y metales pesados en dos tipos de suelo de manglar y demostraron que los manglares actúan como trampas de fósforo y metales pesados pero son menos eficientes en la retención de nitrógeno. Wu et al. (2008) estudiaron el uso potencial de K. candel como tratamiento secundario de agua residual municipal e indicaron que es factible el uso de esta especie para la remoción de carbono orgánico disuelto, amonio y ortofosfatos. Yang et al. (2008) utilizaron una planta piloto con K. candel, A. corniculatum y Sonneratia caseolaris para la remoción de materia orgánica y nutrientes, y encontraron que S. caseolaris y A. corniculatum tuvieron una mejor eficiencia en el tratamiento de agua en comparación con K. candel. Después de examinar un humedal de Sonneratia apetala expuesto a tres niveles de concentración de agua residual, Zhang et al. (2010) indicaron que la especie tiene un gran potencial para la remoción de nutrientes y metales pesados. Moroyoqui-Rojo et al. (2012) estudiaron el uso potencial de Laguncularia racemosa y Rhizophora mangle en la remoción de nutrientes inorgánicos en estanques con camarón y encontraron que las dos especies presentaron una tasa similar de remoción de nutrientes. De-León-Herrera et al. (2015) midieron la tasa de remoción de nutrientes inorgánicos de sistemas de cultivo cerrados que contenían una población de Dormitator latifrons y tres especies de mangle (Avicennia germinans, L. racemosa y R. mangle), y sugirieron que las tres especies de mangle pueden ser utilizadas para la óptima remoción de compuestos nitrogenados y fosfatados.
Varios estudios se han centrado en el tratamiento de agua con K. candel, que es de latitudes tropicales. Moroyoqui-Rojo et al. (2012) y De-León-Herrera et al. (2015) investigaron la remoción de nutrientes con las tres especies de mangle (A. germinans, L. racemosa, and R. mangle) típicas de latitudes subtropicales en el continente americano, pero en tanques cerrados sin filtro biológico (e.g., grava y arena). Por tal motivo, el objetivo de este trabajo fue investigar la remoción de nutrientes inorgánicos (amonio, nitrito, nitrato y fosfato) provenientes de peces poecílidos por medio de filtros biológicos de grava y arena, y plántulas de L. racemosa y R. mangle en tanques con recirculación periódica.
Materiales y métodos
Recolecta y monitoreo de los propágulos y frutas de mangle
Durante agosto, se recolectaron propágulos de mangle rojo (R. mangle) y frutas de mangle blanco (L. racemosa) en la laguna costera del estero de Urías, noroeste de México (23°13'-23°11'N, 106°23'-106°21'W). Todas las muestras fueron transportadas en cajas de plástico al Laboratorio de Conservación y Restauración de Ecosistemas Costeros del Instituto de Ciencias del Mar y Limnología (UNAM), unidad Mazatlán (México). Los propágulos de mangle rojo fueron depositados en cubetas de plástico con agua dulce durante un mes para el desarrollo óptimo del sistema radicular. Las frutas de mangle blanco fueron sembradas en charolas de poliuretano (68 × 34 cm) utilizando como sustrato una mezcla de dolomita y vermiculita (Sunshine Mix #3). Después de un mes (i.e., septiembre), las plántulas de ambas especies fueron transportadas a un tanque de agua en donde se realizaron incrementos de 10 de salinidad por mes hasta alcanzar una concentración de 35-40 en diciembre. En este tanque de agua, todas las plántulas fueron arregladas en forma hidropónica sobre una base de madera. A partir de enero, todas las plántulas fueron transportadas a los tanques experimentales. La medición de la altura de ambas especies se realizó mensualmente hasta agosto (i.e., siete meses). Todas las plántulas fueron medidas con una regla flexible de 1 m de largo. Para las muestras de mangle rojo, se tomó la medida desde el primer anillo de crecimiento hasta la parte apical del tallo principal. Para las plántulas de mangle blanco, la medida se tomó desde la base del tallo hasta la parte apical del tallo principal.
Recolecta de los peces poecílidos
Los peces poecílidos (Poeciliidae) fueron recolectados durante diciembre en la zona de manglar dentro del estero de Urías con una red tipo cuchara (luz de malla de 0.5 cm). Los organismos fueron transportados en recipientes de plástico de 100 × 35 cm y posteriormente confinados en un tanque de 450 L con salinidad de 35. Los organismos fueron alimentados una vez al día con un compuesto comercial balanceado a una tasa de 2.56 g por día. En enero, los peces fueron distribuidos en los tanques experimentales, y se midió la longitud de todos los peces mensualmente hasta el final del experimento (i.e., siete meses) con una regla biométrica estandarizada para peces.
Diseño y construcción de los sistemas experimentales
Se construyeron seis sistemas de recirculación vertical de agua con una salinidad de 35. Cada sistema estaba constituido por dos tanques de polivinilo (Polyplas) de 450 L (Fig. 1). En el primer arreglo de tanques se confinaron 150 peces poecílidos por tanque, mientras que el segundo arreglo de tanques contenía un filtro biológico conformado por una capa de 14 cm de grava (θ = 5 mm) y 14 cm de arena. De los seis tanques con filtro biológico, dos no contenían plántulas (i.e., control) y los cuatro restantes contenían un arreglo de 34 plántulas de mangle rojo o blanco (dos réplicas por especie) flotando sobre láminas perforadas de poliuretano de 1 cm de espesor.
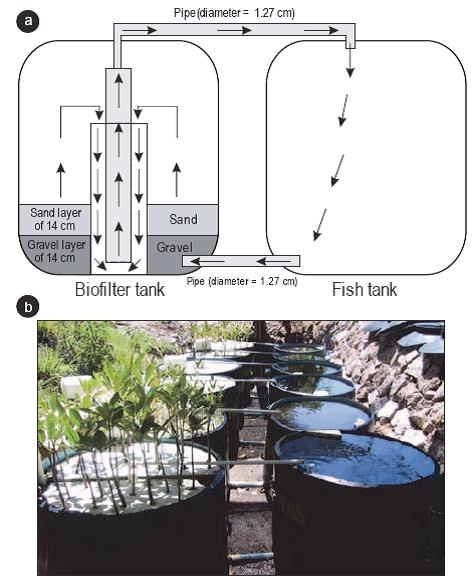
Figura 1: Esquema (a) y fotografía (b) de los sistemas de recirculación de agua. Los seis tanques de la derecha contenían a los peces poecílidos y los seis de la izquierda contenían el filtro biológico ya sea con plántulas de Laguncularia racemosa o Rhizophora mangle, o sin plántulas (i.e., control). Las flechas negras indican el sentido de circulación del agua.
Los tanques de cada sistema estaban conectados por dos tubos de plástico (1.27 cm de diámetro), uno en la parte superior y otro en la parte inferior, por donde se llevó a cabo el intercambio de agua (Fig. 1). Para que el agua circulara entre ambos tanques, se utilizaron tres bombas de aire (Elite 802, 115 V) con dos salidas de aire hacia el tanque con filtro biológico. Cada salida suministraba aire a un sistema de recirculación por medio de una manguera (0.64 cm de diámetro) que llegaba hasta la parte media del sistema. El agua fluía de la parte inferior del tanque de los peces hacia la parte inferior del tanque de las plántulas. Una vez en el tanque de las plántulas, el agua circulaba en forma vertical por el biofiltro de arena y grava hasta la parte media del tanque. En el centro del biofiltro se colocó un tubo de PVC de 10.16 cm de diámetro y dentro del mismo se instaló otro tubo de PVC, pero de 1.91 cm de diámetro, conectado a un tubo horizontal (1.27 cm de diámetro) por donde el agua regresaba al tanque de los peces.
Toma de muestras de agua y medición de nutrientes
La toma de muestras para analizar la calidad del agua de los tanques se realizó de enero a agosto. Antes de cada toma de muestra de agua, se mantuvieron a los peces en ayuno por un periodo de 24 h para evitar que el alimento influyera en la medición de nutrientes. La recirculación de agua entre ambos tanques se realizó cada 10 días durante 24 h. Dentro de este periodo de tiempo, se realizaron cuatro muestreos de agua. El primer muestreo se realizó antes de iniciar la recirculación de agua (0 h), el segundo se hizo al pasar las primeras 8 h (primera recirculación), el tercero después de 16 h (segunda recirculación) y el cuarto depués de 24 h (tercera recirculación). Se agruparon los valores mensuales en tres temporadas: invierno (enero a marzo), primavera (abril a junio) y verano (julio a agosto). Las muestras de agua fueron tomadas por duplicado (i.e., pseudoréplicas) en botellas de plástico de 125 mL de cada uno de los tanques con biofiltro. Para cada muestra, se analizó el contenido de amonio, nitrito, nitrato y fosfatos mediante las técnicas espectrofotométricas descritas por Strickland y Parsons (1972). Además, semanalmente se midió la temperatura del agua con un termómetro (Brannan) y la salinidad con un refractómetro (Atago #80-124). Para calcular la eficiencia en la remoción de nutrientes en el sistema experimental, se utilizó la ecuación descrita por Paniagua-Michel y García (2003):
R = ((E-S)/E)100
donde R corresponde al porcentaje de remoción, E es la concentración promedio de nutrientes al inicio de la recirculación (i.e., 0 h) y S es la concentración promedio de nutrientes al final de la recirculación (i.e., 24 h).
Análisis estadístico
El crecimiento de las plántulas de mangle fue analizado mediante regresiones lineales. Se utilizó el coeficiente de determinación (R2) y análisis de varianza para examinar la asociación lineal entre la altura de las plántulas y el periodo de tiempo. Se utilizó la prueba no paramétrica de Kruskal-Wallis para evaluar la diferencia en el crecimiento de las plántulas así como la diferencia en los valores de temperatura, salinidad y contenido de nutrientes entre los tanques que contenían mangles y los tanques de control. El crecimiento de los peces poecílidos en los seis sistemas de recirculación fue evaluada por medio de regresiones logarítmicas.
Resultados
Crecimiento de las plántulas de mangle y los peces poecílidos
Se registró una diferencia significativa (P < 0.05) en el crecimiento de las plántulas de mangle entre los tanques experimentales. En particular, L. racemosa mostró una mayor pendiente (1.85 cm por mes) en comparación con las plántulas de R. mangle (0.85 cm por mes) (Fig. 2a). No se observaron diferencias significativas (P > 0.05) en la longitud de los peces entre los tratamientos (Fig. 2b).
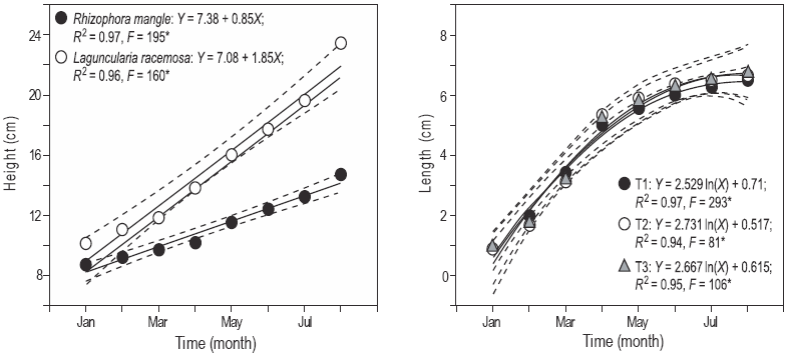
Figura 2: Altura de las plántulas de mangle (a) y longitud de los peces poecílidos (b) de enero a agosto. T1 representa el sistema con Rhizophora mangle, T2 representa el sistema con Laguncularia racemosa y T3 representa el control. Cada gráfica muestra la ecuación lineal o logarítmica, el coeficiente de determinación (R 2) y el valor de la prueba F. Los asteriscos indican valores significativos de la prueba F a α = 0.05. El número de plántulas medidas mensualmente fue de 68 por tratamiento, y la muestra de peces fue de 300 por tratamiento.
Propiedades fisicoquímicas del agua y contenido de nutrientes
La temperatura del agua en los tanques experimentales fue de 24.5 °C de enero a marzo y osciló entre 35 y 37 °C de abril a agosto (Fig. 3a). La temperatura del agua no presentó diferencia significativa (P > 0.05) entre los tres tratamientos. La salinidad presentó las mayores concentraciones en enero, julio y agosto (~35), y la menor concentración ocurrió en marzo (~27). Sin embargo, no se presentaron diferencias significativas (P > 0.05) entre los tres tratamientos (Fig. 3b).
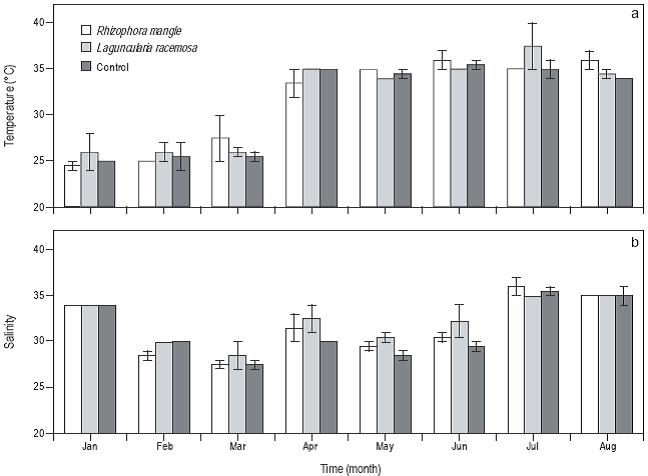
Figura 3: Serie de tiempo para la temperatura del agua y salinidad en los sistemas de control, con Laguncularia racemosa y con Rhizophora mangle. Las barras de error representan la primera desviación estándar. El número de mediciones de la temperatura y salinidad por tratamiento fue de ocho por mes.
Se observaron diferencias significativas en el porcentaje de remoción y la variabilidad temporal (enero a agosto) del nitrógeno inorgánico disuelto (NH4 +, NO2 - y NO3 -) en los tres tratamientos durante el periodo de 24 h de recirculación de agua (Fig. 4). Durante los primeros tres meses de muestreo (i.e., invierno), el porcentaje de remoción en el tratamiento de control fue muy bajo (32 ± 10%) en comparación con los tratamientos con L. racemosa (78 ± 10%) y R. mangle (75 ± 7%) (Fig. 4a). Durante la primavera, el porcentaje disminuyó en los tratamientos de control (29 ± 8%) y en los tratamientos con R. mangle (70 ± 15%), pero aumentó en los tratamientos con L. racemosa (82 ± 10%) (Fig. 4b). Durante los últimos dos meses del experimento (i.e., verano), el porcentaje final de remoción en los tratamientos de control aumentó a 42 ± 8%, pero aumentó considerablemente en los tratamientos con L. racemosa (90 ± 13%) y R. mangle (90 ± 11%) (Fig. 4c).
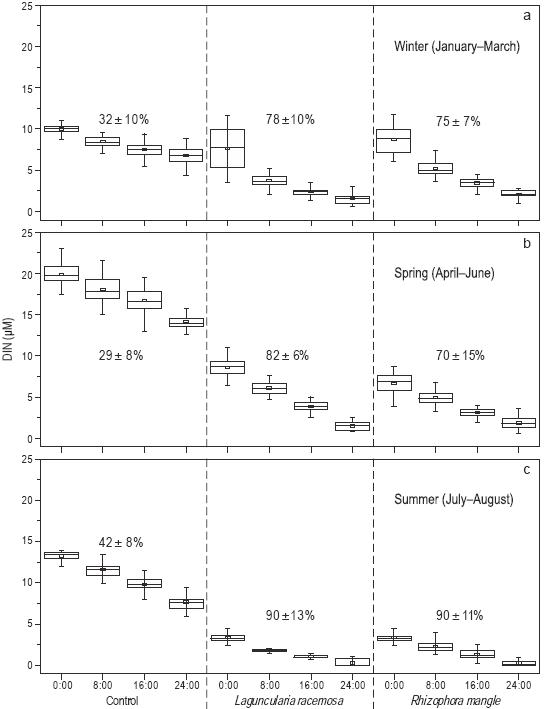
Figura 4: Porcentaje de remoción (promedio y desviación estándar) y variabilidad temporal durante el invierno (a), primavera (b) y verano (c) del nitrógeno inorgánico disuelto (DIN: NH4 +, NO2 - y NO3 -) en los tres tratamientos durante los periodos de 24 h de recirculación de agua. Cada diagrama de caja muestra la media (cuadro pequeño), la muestra mínima, el cuartil menor (parte inferior de la caja), la mediana (parte media de la caja), el cuartil mayor (parte superior de la caja) y la muestra máxima. El número total de muestras mensuales por nutriente fue de 24.
Se observaron diferencias significativas en el porcentaje de remoción de fósforo inorgánico disuelto (PO4 -3) (Fig. 5). En invierno, el porcentaje fue menor en los tratamientos de control (48 ± 12%) en comparación con los tratamientos que contenían L. racemosa (62 ± 18%) y R. mangle (55 ± 21%) (Fig. 5a). Los porcentajes disminuyeron ligeramente en los tres tratamientos durante la primavera, cuando los valores fueron 45 ± 16%, 41 ± 24% y 53 ± 25% para los tratamientos de control, los tratamientos con L. racemosa y los tratamientos con R. mangle, respectivamente (Fig. 5b). En verano, el porcentaje de remoción en los tratamientos de control se mantuvo similar (45 ± 14%), mientras que en los tratamientos con L. racemosa aumentó a 44 ± 37% y en los tratamientos con R. mangle disminuyó a 35 ± 39% (Fig. 5c).
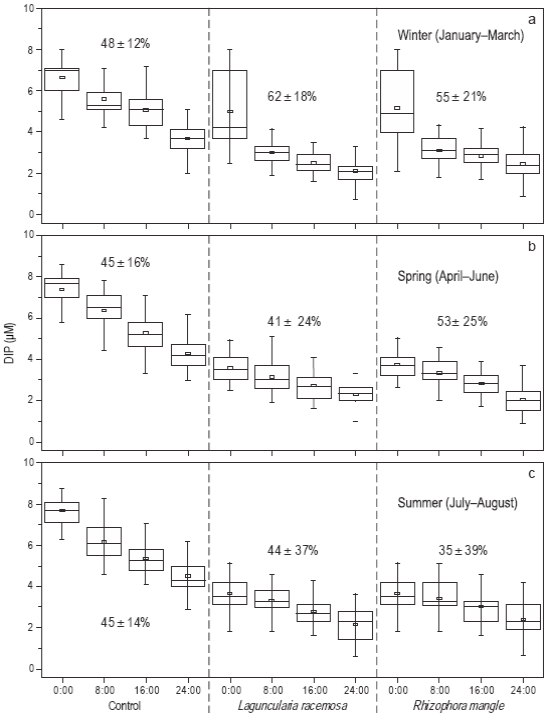
Figura 5: Porcentaje de remoción (promedio y desviación estándar) y variabilidad temporal durante el invierno (a), primavera (b) y verano (c) del fósforo inorgánico disuelto (DIP: PO4 -3) en los tres tratamientos durante los periodos de 24 h de recirculación de agua. Cada diagrama de caja muestra la media (cuadro pequeño), la muestra mínima, el cuartil menor (parte inferior de la caja), la mediana (parte media de la caja), el cuartil mayor (parte superior de la caja) y la muestra máxima. El número total de muestras mensuales fue de 24.
Discusión
Debido a la constante expansión de las actividades relacionadas con la acuacultura, es necesario entender hasta qué grado los mangles pueden ser utilizados como biofiltro para la reducción de la eutrofización típica de las pozas de acua-cultura. En este estudio, se analizaron los porcentajes de remoción de nutrientes (NH4 +, NO2 -, NO3 - y PO4 -3) en tanques de recirculación cerrados por medio de dos especies de mangle típicas de las zonas semiáridas de México.
El crecimiento lineal de las plántulas de mangle fue un reflejo de la remoción de nutrientes inorgánicos disueltos (nitrógeno y fósforo) en los tanques experimentales. La tasa de remoción de nitrógeno se incrementa de acuerdo con la biomasa y el grado de cobertura de las plantas acuáticas (Tanner et al. 1995, Yang et al. 2008, De-León-Herrera et al. 2015). El ciclo del nitrógeno en humedales es complejo y es discutido en detalle por Reed et al. (1995). En particular, la mayor pérdida de nitrógeno en el sistema de experimentación fue por desnitrificación. La desnitrificación es un proceso de respiración anaerobia hecha por cierto género de bacterias, en el cual el nitrato y nitrito son usados como terminales aceptoras de electrones para la oxidación de compuestos orgánicos y son reducidos a productos gaseosos tales como N2O y N2 (Gersberg et al. 1983). Sin embargo, los procesos de formación de productos intermedios durante la nitrificación y desnitrificación en humedales no son claros (Tam et al. 2009). En general, los nitratos pueden ser removidos por el proceso de desnitrificación y la asimilación de las plantas. Las plántulas de mangle no solo absorben nitrato para su crecimiento, sino también mejoran la eficiencia en los procesos de nitrificación y desnitrificación (Wu et al. 2008). Los resultados del presente estudio indican que el crecimiento de las plántulas de L. racemosa y R. mangle se debió a la absorción del nitrógeno y fósforo derivados de los residuos metabólicos de los peces poecílidos y del exceso de alimento.
La tasa de crecimiento de los mangles depende de los nutrientes en el sistema (Saenger 2002). Sin embargo, las plántulas de L. racemosa presentan un incremento en altura más rápido comparadas con R. mangle en una variedad de condiciones experimentales (e.g., Cardona-Olarte et al. 2006, Krauss et al. 2006, Moroyoqui-Rojo et al. 2012, Monroy-Torres et al. 2014, De-León-Herrera et al. 2015). Durante el experimento, las plántulas de mangle siguieron este mismo patrón de crecimiento; sin embargo, los resultados del análisis indican que no hay diferencias con respecto a la remoción de nutrientes entre las dos especies. Esto sugiere que L. racemosa y R. mangle tienen diferentes adaptaciones metabólicas dependiendo de la concentración de nutrientes que se presente. Se sugiere que una de las razones por las cuales ambas especies presentaron diferencias en el incremento de altura pero una similar incorporación de nutrientes se debe a patrones morfológicos típicos de ambas especies. Por ejemplo, los nutrientes asimilados por las plántulas de R. mangle pueden ser utilizados en el desarrollo de hojas nuevas, las cuales son de mayor tamaño comparadas con L. racemosa (Flores-de-Santiago et al. 2012). Adicionalmente, la densidad del tallo de las plántulas de R. mangle es mayor que la del tallo de L. racemosa (Flores-Verdugo et al. 1990). Una ventaja de esta diferencia en crecimiento pudiera ser el uso de R. mangle en procesos de biorremediación donde se presenten restricciones en las dimensiones físicas de los sistemas de cultivo, tales como en nuestro experimento, mientras que en grandes extensiones de cultivo (e.g., granjas de acuacultura) se pudiera utilizar L. racemosa por su rápido crecimiento.
Un problema que puede limitar la eficiencia en la remoción de compuestos nitrogenados puede ser la insuficiencia de oxígeno. El oxígeno es requerido para acelerar la minerali-zación y es esencial para el proceso de nitrificación (Bowmer 1987). A diferencia de los sistemas cerrados sin oxigenación (e.g., De-León-Herrera et al. 2015), nuestro diseño experimental contaba con dos bombas de aire y un filtro de grava y arena. Se considera que el incremento en el nivel de oxígeno y el filtro biológico dieron como resultado un porcentaje de remoción de nitrógeno del 90%. Se observaron microalgas en todos los sistemas de cultivo durante los experimentos. Estas microalgas pueden afectar las mediciones de remoción de nutrientes en los sistemas debido a que son típicas de climas subtropicales y necesitan de los nutrientes inorgánicos para su crecimiento. A pesar de que todos los sistemas presentaron microalgas, es clara la diferencia en la remoción de nutrientes entre los tratamientos de control y los tratamientos con las plántulas de mangle. Por tal motivo, se cree que las microalgas no afectaron en gran medida los resultados obtenidos en este trabajo. Además, la variabilidad en la temperatura y salinidad no fueron factores limitantes en la tasa de remoción de nutrientes y crecimiento de los peces debido a que no se presentaron diferencias entre los tres tratamientos.
La asimilación de compuestos fosfatados en los humedales implica muchos caminos y es considerado un ciclo bio-geoquímico complejo. Los principales mecanismos de reducción incluyen la sedimentación de partículas de fósforo, la adsorción del fósforo soluble en las partículas de arcilla y la asimilación por parte de las macrófitas acuáticas (Greenway y Woolley 1999). A pesar de que las concentraciones de PO4 -3 son menores comparadas con los compuestos nitrogenados en las pozas de acuacultura, el PO4 -3 es considerado un nutriente limitante en los bosques de mangle (Ye et al. 2001). El principal mecanismo de la reducción de compuestos fosfatados puede ser la asimilación por parte de las plantas de mangle (Greenway y Woolley 1999).
Una cantidad considerable de estudios han demostrado el uso de los mangles para la disminución de los nutrientes en ambientes costeros (e.g., Wong et al. 1997, Chu et al. 1998, Boonsong et al. 2003). Sin embargo, pocos estudios han hecho comparaciones entre diferentes especies de mangle (Yang et al. 2008, Ye et al. 2001), especialmente en zonas semiáridas. La remoción de nutrientes por L. racemosa y R. mangle en ambientes semiáridos puede ser menor comparada con la remoción por especies tropicales como Bruguiera gymnorrhiza, Rhizophora stylosa, A. corniculatum y K. candel (De-León-Herrera et al. 2015); sin embargo, al implementar un filtro de grava y arena en el fondo de los tanques experimentales del presente estudio, la remoción de nitrógeno por las plántulas de L. racemosa y R. mangle fue del 90%, similar a la remoción por especies tropicales como K. candel (92.7%) y B. gymnorrhiza (98%) (Ye et al. 2001, Huang et al. 2012). Por otro lado, las plántulas de L. racemosa y R. mangle presentaron resultados no satisfactorios respecto a la remoción de PO4 -3 (35-44%). Consecuentemente, el entendimiento de los procesos relacionados con los mangles como exportadores o importadores de fosfato depende de la localidad y los factores ambientales, los cuales afectan las respuestas biológicas.
Las diferencias observadas en la remoción de nitrógeno disuelto por parte de las plántulas de L. racemosa y R. mangle indican que estos mangles de una región semiárida son capaces de remover una cantidad considerable de nitrógeno inorgánico en tanques con recirculación. Sin embargo, es necesario entender los procesos de transformación de nutrientes dentro de los mangles para poder optimizar los parámetros operacionales, los cuales incluyen el diseño físico y biológico de los sistemas de tratamiento.











 texto en
texto en 


