Introducción
Los corales pétreos son organismos con capacidad de reproducirse asexual y sexualmente. En la reproducción sexual, los gametos de ambos sexos intercambian material genético durante la fecundación y forman una larva. Una vez alcanzado el estadio de competencia, la larva experimenta asentamiento y metamorfosis hasta desarrollar una colonia. Usualmente, estos procesos suceden en periodos anuales (Harrison y Wallace 1990, Harrison 2011). Este tipo de reproducción favorece la dispersión de la especie y garantiza la variabilidad mediante la recombinación del material genético (Fadlallah 1983).
El patrón reproductivo de una especie de coral incluye procesos como la gametogénesis y la actividad reproductiva, los cuales están determinados por las condiciones ambientales en donde se desarrolla la especie (Harrison 2011). Durante periodos de estrés, algunos procesos reproductivos pueden ser afectados o inhibidos y, consecuentemente, hay una reducción en la fecundidad o el éxito reproductivo (Harrison et al. 1984, Tanner 1996, Cortés 1997). La temperatura es uno de los principales factores abióticos que controlan el inicio del proceso reproductivo, pero el fotoperiodo, los patrones del viento o corrientes, los ciclos lunares y la irradianza también pueden actuar como señales para iniciar y sincronizar los ciclos reproductivos (Harrison 2011). Por el contrario, algunos factores que causan inhibición del proceso reproductivo son las temperaturas extremas que rebasan los límites de termotolerancia de la especie y los factores relacionados con la condición lumínica del área (i.e., turbidez, sedimentación, luz ultravioleta).
Las comunidades coralinas en las aguas del Pacífico frente a la costa occidental de México están descritas como algunas de las más importantes del Pacífico Oriental Tropical (POT). Se caracterizan por estar formadas por colonias pequeñas con distribución en parche y que pueden formar agregaciones densas o espaciadas (Glynn y Ault 2000, Glynn et al. 2000), construidas principalmente por especies pertenecientes a los géneros Pocillopora (>90% cobertura), Pavona (<5% cobertura) y Porites (<1% cobertura) (Glynn y Leyte-Morales 1997, Reyes-Bonilla y López-Pérez 1998, López-Pérez y Hernández-Ballesteros 2004).
Pavona gigantea Verrill, 1869 es un coral hermatípico endémico del Pacífico oriental (Glynn y Ault 2000) y es de los más comunes y más ampliamente distribuidos frente a la costa occidental de México (Reyes-Bonilla et al. 2005). Existe limitada información sobre la actividad reproductiva de esta especie, ya que sólo se cuenta con algunos registros para el Pacífico ecuatorial y las costas occidentales del centro y sur de México (Glynn et al. 1996, Carpizo-Ituarte et al. 2011, Rodríguez-Troncoso et al. 2011). Estudios genéticos (Saavedra-Soleto et al. 2011) sugieren que las poblaciones de P. gigantea frente a la costa occidental de México se encuentran genéticamente aisladas, lo que las hace vulnerables a perturbaciones y extirpaciones locales y, en última instancia, compromete la conectividad regional de la especie. A gran escala, sin embargo, se ha comprobado que las poblaciones del sur pueden ser de relevancia para las poblaciones del centro y aun para aquellas que se desarrollan en el golfo de California (Saavedra-Soleto et al. 2011).
La actividad reproductiva de los corales pétreos puede presentar diferencias espaciales debidas a las condiciones ambientales locales y a la historia de vida de la especie (Somero 2005). Registros en Centroamérica muestran que algunas especies pueden desarrollar gametos durante todo el año y presentar variaciones espaciales a microescala (i.e., decenas de metros) asociadas, principalmente, a fluctuaciones de temperatura y nutrientes ocasionadas por sur-gencias (Glynn et al. 1996). En las aguas del Pacífico frente a la parte central y sur de México, el inicio de la actividad gametogénica está directamente asociada al incremento de la temperatura superficial del mar (TSM) durante el verano (Carpizo-Ituarte et al. 2011, Rodríguez-Troncoso et al. 2011); sin embargo, hasta la fecha no se ha reportado la presencia de gametos maduros o alguna evidencia de desove y se carece de información respecto a las variaciones reproductivas a nivel de mesoescala en la región.
La información respecto al éxito reproductivo, considerado desde la formación y liberación de gametos hasta el asentamiento larval, es esencial para el entendimiento del desarrollo, permanencia y recuperación de las comunidades y arrecifes coralinos de la región luego de perturbaciones naturales o antropogénicas. En este sentido, la presente contribución aporta información respecto al ciclo reproductivo de P. gigantea frente a la costa occidental de Oaxaca (México), analiza sus variaciones espaciotemporales y evalúa si la reproducción está influenciada por las variaciones ambientales en el área.
Materiales y método
Área de estudio
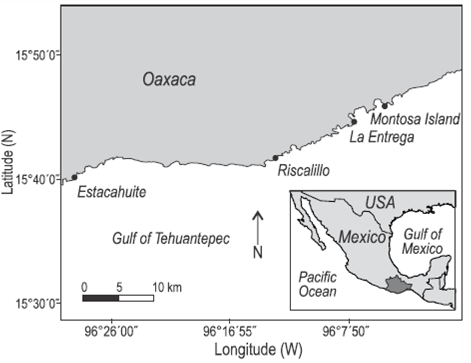
La recolecta de muestras se realizó en las playas Estacahuite, Riscalillo y La Entrega y frente a isla Montosa, ubicadas en el corredor costero denominado Mazunte-Bahías de Huatulco (15°39'N, 96°33'W; 15°45'N, 96°04'W) frente a la costa de Oaxaca (Fig. 1). A pesar de su cercanía entre sí, los cuatro sitios poseen características y dimensiones distintas. La Entrega tiene una superficie arrecifal de 3.51 ha con profundidad máxima de 13.3 m; Riscalillo, una superficie arrecifal de 3.51 ha con profundidad máxima de 10 m; Estacahuite, una superficie arrecifal de 2.30 ha con profundidad máxima de 20 m (López-López 2011); e isla Montosa, superficie arrecifal de 11.8 ha con profundidad máxima de 11.6 m (Glynn y Leyte-Morales 1997). La distancia máxima entre los sitios de muestreo es de 45 km.
El clima de la región es de tipo cálido subhúmedo, con precipitación menor que el 5% del porcentaje anual durante el verano (García 1973). Las localidades de muestreo forman parte de la zona de influencia del golfo de Tehuantepec. En el área de estudio se presentan escasas descargas de ríos, sedimentos arenosos y surgencias estacionales que producen valores bajos de temperatura y oxígeno disuelto y altas concentraciones de nutrimentos (Tapia-García et al. 2007).
En el golfo de Tehuantepec, durante el invierno y la primavera, se presentan vientos del norte, denominados tehuanos, en dirección perpendicular a la costa; estos vientos se producen por una diferencia de presión atmosférica entre el golfo de México y el Pacífico tropical (Steenburgh et al. 1998). Los vientos tehuanos generan remolinos de mesoescala que pueden afectar hasta decenas de kilómetros y producir un decremento en la TSM, lo cual promueve la formación de una termoclina somera y genera anomalías térmicas y cambios en la concentración de clorofila (Kessler 2002, Fernández-Álamo y Farber-Lorda 2006).
Muestreo
Se realizaron muestreos mensuales de mayo de 2010 a mayo de 2012. En cada localidad se recolectaron, mediante buceo autónomo, fragmentos de aproximadamente 3 cm2 de cinco colonias de P. gigantea elegidas al azar. Las colonias seleccionadas midieron más de 30 cm de diámetro y no presentaron signos de blanqueamiento. Los fragmentos fueron fijados in situ con formaldehido al 10% en agua de mar durante 24 h, y luego se conservaron en alcohol etílico al 70% a temperatura ambiente hasta su procesamiento. Cada fragmento se descalcificó individualmente en una solución de ácido acético al 10% durante 24 h. El tejido fue deshidratado en un tren de ocho pasos con alcohol etílico (70%, 80%, 90%, 90%, 96%, 96%, 100% y 100%) y dos pasos de aclarado con Citrisol en el procesador automático de tejidos Leica TP102. Los tejidos fueron incluidos en Paraplast en el incluidor de tejidos Leica EG1160. Se realizaron cortes de 6 μm de grosor con un micrótomo semiautomático Leica RM2145. Las laminillas fueron teñidas mediante la técnica hematoxilina-eosina y montadas con resina sintética. Las observaciones del tejido coralino se realizaron en un microscopio óptico Carl Zeiss AxioScope, y se foto-documentaron mediante una cámara digital AxioCam ERc 5s. Se midieron los ovocitos mediante el programa AxioVisionRel v2.0 para Windows, y se obtuvo el diámetro máximo de las células. Para delimitar los estadios de reproducción, se utilizaron los criterios de Glynn et al. (1996), Carpizo-Ituarte et al. (2011) y Rodríguez-Troncoso et al. (2011).
Variables ambientales
Se midió la TSM in situ en cada localidad mediante una sonda multiparamétrica Hanna HI9828 (precisión ±0.15 °C). Los valores del coeficiente de atenuación difusa (Kd490) y de la radiación fotosintéticamente disponible (PAR, por sus siglas en inglés) fueron extraídos de imágenes de satélite (Aqua-MODIS, http://oceancolor.gsfc.nasa.gov). Debido a que, por factores meteorológicos, los datos para los días de muestreo no estaban disponibles, las imágenes utilizadas para la extracción de datos son resultado del promedio de ocho días antes de la fecha de cada muestreo. Las imágenes Aqua-Modis (nivel 3 de procesamiento, resolución de 9 × 9 km) fueron procesadas mediante el programa Wam statist. Los datos de iluminación lunar (%) y fotoperiodo fueron extraídos de la base de datos Weather Underground (http:// www.wunderground.com/, resolución de 1 × 1 km) para cada día de muestreo.
Análisis de datos
Se obtuvo la proporción de sexos y el porcentaje de colonias con actividad reproductiva para ambos sexos. Los datos de cada una de las variables ambientales y el porcentaje de colonias con actividad reproductiva se analizaron mediante pruebas de normalidad (Kolmogorov-Smirnov, P < 0.05) y homogeneidad de varianza. Debido a que los datos no fueron normales ni homocedásticos, se realizó un análisis de varianza no paramétrico de Kruskal-Wallis para evaluar posibles diferencias entre localidades. Debido a que no se detectaron diferencias significativas entre localidades respecto a las variables ambientales (TSM, H(3, 68) = 0.265, P = 0.966; PAR, H(3, 68) = 0.307, P = 0.959; Kd490, H(3, 68) = 2.499, P = 0.475), los datos se promediaron para obtener un valor mensual para el área de estudio. La relación entre los promedios de las variables ambientales y el porcentaje de colonias con actividad reproductiva de hembras y machos se evaluó mediante un análisis de regresión lineal múltiple con el fin de detectar si la actividad reproductiva de P. gigantea estaba relacionada con las condiciones ambientales del área y determinar la o las variables más importantes en el proceso reproductivo de la especie. Los análisis estadísticos fueron realizados con el programa Statistica v.6.
Resultados
Reproducción
Pavona gigantea presentó tres periodos reproductivos durante el estudio: mayo-septiembre de 2010, abril-agosto de 2011 y abril-mayo de 2012. La especie mostró un comportamiento reproductivo gonocórico en la mayoría de las colonias (Fig. 2a) y hermafroditismo en una sola colonia (Fig. 2b). La maduración fue de tipo asincrónica y la proporción de sexos fue de 1:1.5 (macho:hembra).

Figura 2: Actividad reproductiva de Pavona gigantea frente a la costa de Oaxaca (sudoeste de México). (a) Pólipo gonocórico completo (4x) y (b) pólipo hermafrodita (4x). Abreviaciones: sp IV, espermiarios en estadio IV; gvc, cavidad gastrovascular; ov III, ovocito en estadio III.
Respecto al desarrollo, las células germinales femeninas presentaron un arreglo en forma de cordones que se extendió del mesenterio hacia la cavidad gástrica del pólipo. Se observaron cuatro estadios de maduración de ovocitos (Fig. 3). Los ovocitos en estadio I (5-30 μm de diámetro) se observaron durante mayo de 2010; presentaron una forma ovalada y el núcleo abarcó la mayor parte del citoplasma de la célula (Fig. 3a). Los ovocitos en estadio II (31-50 μm de diámetro) se observaron en mayo y junio de 2010 y presentaron un núcleo y nucléolo bien definidos, además de empaquetamiento de los ovocitos previtelogénicos en forma de cordones (Fig. 3b). Los ovocitos en estadio III (51-100 μm de diámetro) se presentaron durante toda la época reproductiva, estaban parcialmente vitelados y presentaron núcleo, nucléolo y vacuolas lipídicas, así como simbiontes en la periferia de la célula (Fig. 3c). Los ovocitos en estadio IV (>100 de diámetro) se observaron solamente en junio de 2010 y agosto de 2011; se consideraron gametos maduros y se caracterizaron por la migración y reducción del núcleo, que se encontró del lado opuesto al citoplasma (Fig. 3d).

Figura 3: Estadios de desarrollo de células reproductivas de Pavona gigantea frente a la costa de Oaxaca, (sudoeste de México). (a) Ovocito estadio I (ov I), (b) ovocito en estadio II, (c) ovocito en estadio III (ov III), (d) ovocito en estadio IV, (e) espermiarios en estadio II, y (f) espermiarios en estadio IV (100x). Abreviaciones: zx, simbionte; nc, núcleo; nl, nucléolo; vc, vacuolas.
Por otra parte, los espermiarios se observaron contenidos en sacos que se originaron del mesenterio y se extendieron hacia la cavidad gástrica. El 85.7% de las colonias masculinas presentaron células maduras. Los espermatocitos en estadio II se observaron solamente en junio de 2011 y mayo de 2012, y presentaron núcleos prominentes que iniciaban la migración a la periferia del saco para formar empaquetamientos (Fig. 3e). Durante el estadio IV se observaron espermátidas, claramente reducidas en tamaño como producto de la eliminación del citoplasma durante la espermiogénesis; además, se observó la migración de los racimos hacia la periferia del espermiario, donde fue posible observar los flagelos alineados hacia la región central (Fig. 3f).
Las colonias recolectadas en Riscalillo presentaron la mayor actividad reproductiva (13.63%, n = 85) y una proporción de sexos de 1:3 (M:H), mientras que aquellas muestrea-das en La Entrega presentaron la menor actividad reproductiva (7.78%, n = 90) y una proporción de sexos de 1:0.75 (M:H). Las colonias recolectadas en Estacahuite e isla Montosa se caracterizaron por la presencia de ovocitos y espermiarios maduros durante agosto de 2011 (Tabla 1). No obstante lo anterior, el analisis de varianza evidencio que no existieron diferencias significativas en la actividad reproductiva de P. gigantea entre sitios (H(3, 68) = 4.029, P = 0.2583).
Tabla 1: Presencia de células sexuales femeninas y masculinas y estadios de desarrollo (números romanos) en las muestras de Pavona gigantea recolectadas en cuatro localidades frente a la costa de Oaxaca (México) de mayo de 2010 a mayo de 2012. Los recuadros grises marcan la presencia de células maduras masculinas y femeninas en el mismo espacio y al mismo tiempo.

Variación temporal de la actividad reproductiva
Durante los tres periodos reproductivos registrados en el estudio, más del 20% de las colonias de P. gigantea presentaron actividad reproductiva (junio de 2010, agosto de 2011, mayo de 2012). El pico reproductivo durante el periodo de estudio ocurrió en junio de 2010 y se observaron lapsos de inactividad entre épocas reproductivas.
La actividad reproductiva se observó cuando la TSM fue de entre 28 y 31 °C (Fig. 4), la PAR fue mayor que 48 mol fotones m-2 día (Fig. 5), Kd490 fue menor que 0.1490 nm m-1 (Fig. 6) y el fotoperiodo duró más de 12 h (Fig. 7). Por el contrario, el porcentaje de iluminación lunar del día de muestreo no mostró relación con la actividad reproductiva (Fig. 8); sin embargo, los meses en los cuales se observaron ovocitos maduros (junio de 2010, agosto de 2011) coincidieron con los altos porcentajes de iluminación lunar.

Figura 4: Relación de la temperatura (SST) in situ con el porcentaje de colonias de Pavona gigantea con actividad reproductiva (RAC) (mediana y desviación estándar) frente a la costa de Oaxaca (sudoeste de México).
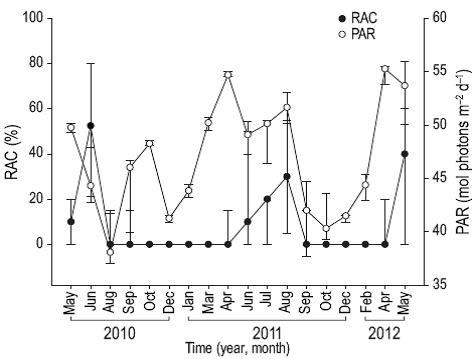
Figura 5: Relación de la radiación fotosintéticamente disponible (PAR) con el porcentaje de colonias de Pavona gigantea con actividad reproductiva (RAC) (mediana y cuartiles) frente a la costa de Oaxaca (sudoeste de México).

Figura 6: Relación del coeficiente de atenuación difusa (Kd490) con el porcentaje de colonias de Pavona gigantea con actividad reproductiva (RAC) (mediana y cuartiles) frente a la costa de Oaxaca (sudoeste de México).
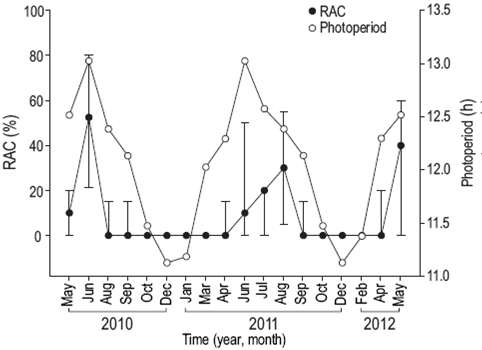
Figura 7: Relación del fotoperiodo con el porcentaje de colonias de Pavona gigantea con actividad reproductiva (RAC) (mediana y desviación estándar) frente a la costa de Oaxaca (sudoeste de México).

Figura 8: Relación del porcentaje de iluminación lunar con el porcentaje de colonias con actividad reproductiva (RAC) (mediana y desviación estándar) frente a la costa de Oaxaca (sudoeste de México).
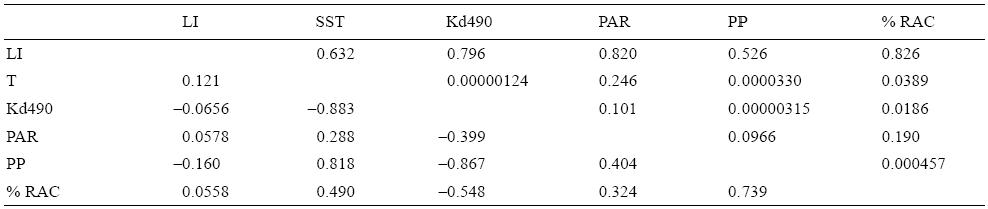
El modelo de regresión lineal múltiple explicó el 69.6% de la variación en el porcentaje de colonias con actividad reproductiva cuando se consideraron ambos sexos (R = 0.834, n = 18, P = 0.007), el 67% cuando solo las hembras fueron consideradas (R = 0.818, n = 18, P = 0.012) y el 51% cuando solo los machos fueron considerados (R = 0.714, n = 18, P = 0.09). Así, el modelo fue significativo para explicar la variabilidad en la actividad reproductiva de P. gigantea cuando ambos sexos o solo las hembras fueron incluidos en el ánalisis, pero no significativo cuando solo los machos fueron incluidos; es decir, existen indicios para sugerir que el desarrollo de ovocitos en esta especie de coral esta significativamente influenciado por cambios en las condiciones ambientales de la región. Al respecto, el análisis evidenció que el porcentaje de colonias con actividad reproductiva tiene una alta correlación con el fotoperiodo (R = 0.739), y una relación inversa con el Kd490 (R = -0.548), la TSM (R = 0.49), el PAR (R = 0.324) y el porcentaje de iluminación lunar (R = 0.056). Lo anterior sugiere que, en el área de estudio, el patrón reproductivo de P. gigantea está relacionado principalmente con la extensión del fotoperiodo y en menor medida con la iluminación lunar (Tabla 2).
Tabla 2: Correlación de las variables ambientales con el porcentaje de colonias con actividad reproductiva (% RAC) en aguas del Pacífico frente a la costa de Oaxaca, México. Diagonal superior, valores de P; diagonal inferior, valores de correlación. LI, luminosidad lunar; SST, temperatura superficial del mar; Kd490, coeficiente de atenuación difusa; PAR, radiación fotosintética disponible; PP, fotoperiodo.
Discusión
En el área de estudio, las colonias de P. gigantea fueron gonocóricas, a excepción de una colonia hermafrodita observada en Estacahuite en julio de 2011. Tanto en la zona de estudio como en otros sitios del POT, se ha registrado un comportamiento reproductivo similar (Glynn et al. 1996, Rodríguez-Troncoso et al. 2011) denominado cosexualidad secuencial, donde los corales tienen la capacidad de iniciar su vida reproductiva como machos, subsecuentemente madurar como hermafroditas y consecuentemente generar colonias protándricas-hermafroditas (Fadlallah 1983, Harrison 2011). Se ha sugerido que la cosexualidad secuencial puede garantizar la reproducción sexual y aumentar la conectividad entre poblaciones (Fadlallah 1983, Harrison y Wallace 1990), pero también puede reducir la variabilidad genética y con ello aumentar la probabilidad de extirpación local o regional de la especie en cuestión. Debido a la baja cantidad de muestras hermafroditas en el presente trabajo y en los estudios previos, no se puede determinar con exactitud si P. gigantea tiene la capacidad para desarrollar cosexualidad secuencial, por lo que más estudios al respecto son necesarios.
En el área de estudio, P. gigantea mostró maduración sexual asincrónica. Esto concuerda con lo reportado previamente para las aguas frente a la costa sudoccidental de México (Rodríguez-Troncoso et al. 2011), pero difiere de la maduración sincrónica observada para la misma especie en el Pacífico frente a Centroamérica (Glynn et al. 1996) y la parte centro-occidental del México (Carpizo-Ituarte et al. 2011). La variación en el comportamiento reproductivo de la especie en la región puede ser ventajosa, pues le permite tener múltiples desoves durante su periodo reproductivo; además, la maduración asincrónica entre colonias de sexos distintos promueve el intercambio de material genético entre localidades (Harrison y Wallace 1990).
A diferencia de estudios previos frente a la costa occidental de México (Carpizo-Ituarte et al. 2011, Rodríguez-Troncoso et al. 2011), en el presente estudio se observaron los cuatro estadios de desarrollo de los ovocitos, así como células intersticiales, lo cual es indicativo de la producción de oogonias y espermatogonias (Szmant-Froelich et al. 1985). La presencia de los cuatro estadios de maduración sugiere que las condiciones ambientales en la zona de estudio fueron adecuadas para que la gametogénesis fuera exitosa, aunque pudieran no haber sido lo suficientemente favorables como para concluir la maduración de los ovocitos y el desove de los mismos.
Adicionalmente, la presencia de células sexuales maduras de ambos sexos en las localidades de Estacahuite e isla Montosa durante agosto de 2011 sugiere que tanto la fase final de la gametogénesis como el posible desove pudieron haberse llevado a cabo durante este mes, puesto que para septiembre del mismo año comenzó el periodo de reposo en ambas localidades. Los resultados anteriores podrían constituir el primer indicio de reproducción sexual exitosa de P. gigantea frente a la costa occidental de México, dado que a la fecha no había sido posible observar células sexuales maduras, femeninas y masculinas, en el mismo tiempo y espacio. Aunque son necesarios más estudios al respecto, agosto podría ser uno de los meses más probables para que se lleve a cabo la liberación de gametos en el área de estudio. Las condiciones ambientales en agosto fueron TSM de 29.88 °C, fotoperiodo de 12.41 h e iluminación lunar del 99%, lo que sugiere que estas condiciones son favorables para que los ovocitos maduren a estadio IV. Según experimentos numéricos, el transporte de partículas en agosto es cercano a la costa (Lara-Hernández 2012), lo que podría garantizar el autoreclutamiento, además de la conecti-vidad hacia sistemas arrecifales en latitudes más altas (i.e., Zihuatanejo) (López-Pérez et al. 2012).
Los resultados del presente estudio sugieren que el periodo reproductivo de P. gigantea está asociado a la variación estacional que ocurre en la región. La actividad reproductiva inició a finales de la época de secas, lo que coincide con fuertes vientos del norte, y se mantuvo durante la época de lluvias en verano. Aunque este es un comportamiento observado frente a la costa occidental de México (Carpizo-Ituarte et al. 2011) y de Centroamérica (Glynn et al. 1996), estudios previos en la zona de estudio indican que la especie puede tener periodos de gametogénesis tanto estacionales como mensuales (Glynn et al. 1996, Carpizo-Ituarte et al. 2011, Rodríguez-Troncoso et al. 2011). En conjunto, los resultados señalan que el comportamiento reproductivo de P. gigantea en el Pacífico oriental tropical ocurre preferentemente durante la temporada cálida (Glynn et al. 1996, Carpizo-Ituarte et al. 2011, Rodríguez-Troncoso et al. 2011, este estudio), aunque es lo suficientemente dinámico para variar en espacio y tiempo en relación con, posiblemente, oscilaciones en las condiciones oceanográficas locales y regionales moduladas por variaciones interanuales. Esto último es apoyado por la relación significativa observada entre el porcentaje de colonias con actividad reproductiva (i.e., ambos sexos y hembras) de P. gigantea y la variación estacional e interanual a mesoescala en la zona de estudio, lo cual indica que la reproducción de esta especie de coral en la región esta acoplada con las variaciones ambientales locales.
Contrario a lo que se ha observado en otras especies y áreas (Levy et al. 2007), la variable que mostró menor relación con la actividad reproductiva fue el porcentaje de iluminación lunar. Se ha documentado repetidas veces que la radiación lunar se relaciona con el ciclo reproductivo de corales (Stoddart y Black 1985); de hecho, la percepción de la luz lunar es fundamental para el desove de los corales (Harrison y Wallace 1990). Por otro lado, los valores de Kd490 se relacionaron de manera inversa con la actividad reproductiva, lo cual resultó contrario a la relación de PAR con la actividad reproductiva; es decir, cuando los picos reproductivos fueron mayores, los valores de Kd490 estuvieron cercanos a cero y los de la PAR fueron elevados. Lo anterior indica que la luz puede ser de suma importancia para determinar el porcentaje de colonias de P. gigantea con actividad reproductiva en la zona de estudio. Existe una miríada de estudios que indican que la luz representa la fuente principal de energía en corales hermatípicos ya que los simbiontes utilizan energía solar para fijar dióxido de carbono y metabolizarlo en oxígeno y en compuestos de carbono, los cuales son translocados a las células del coral (Yellowlees et al. 2008). De esta manera, los simbiontes contribuyen a la nutrición, respiración, crecimiento y reproducción de los corales (Stat et al. 2008, Yellowlees et al. 2008, Stambler 2011). Esta contribución puede verse afectada por los niveles de turbidez que, al aumentar, pueden disminuir, entre otras cosas, la capacidad fotosintética del simbionte; así, un aumento en la PAR puede traducirse en mayor energía para el metabolismo del hospedero.
Durante este estudio, la gametogénesis ocurrió cuando la TSM fue de 28 a 31 °C. Esto concuerda con Rodríguez-Troncoso et al. (2011) y Carpizo-Ituarte et al. (2011), quienes registraron, respectivamente, que la gametogénesis ocurrió cuando la TSM fue de 27 °C frente a la zona sur (La Entrega, Oaxaca) y 28.5 °C frente a la zona central (bahía Banderas, Nayarit) de la costa occidental de México.
La variable que mostró la mayor relevancia en la actividad reproductiva de P. gigantea en la región de estudio fue el fotoperiodo. Los simbiontes son los proveedores energéticos más importantes para los corales pétreos (Muscatine 1990, Stambler 2011); de hecho, la energía que transfiere Symbiodinium al hospedero cubre los requerimientos energéticos diarios del coral y, además, contribuye con la actividad reproductiva. Adicionalmente, el fotoperiodo junto con otras condiciones ambientales del golfo de Tehuantepec puede actuar como sincronizador del ciclo gametogénico, como ha sido sugerido por Benítez-Villalobos y Martínez-García (2012) para otros invertebrados. Pudiera ser el caso, también, que el fotoperiodo se combine con temperaturas cálidas y así module la maduración de gametos en la región.
El presente estudio demostró que la actividad reproductiva de P. gigantea se desarrolló en respuesta a los cambios estacionales e interanuales a mesoescala que ocurren en el golfo de Tehuantepec, lo cual concuerda con lo observado en otras especies de coral y para otras regiones (Harrison y Wallace 1990). Queda por resolver si este mismo patrón ambiental gobierna la actividad reproductiva de otras especies de coral que construyen arrecifes en la región (i.e., Pocillopora spp., Porites spp.). Este tipo de información es relevante no solo a nivel local (i.e., Oaxaca), sino también regional, ya que la conectividad entre las comunidades y arrecifes coralinos del POT depende del buen manejo de sistemas.











 texto em
texto em