Introducción
El pejerrey argentino, Odontesthes bonariensis (Valenciennes 1833), es uno de los recursos pesqueros de mayor importancia en estuarios y ríos de la región sudoccidental de Sudamérica. Esta especie está distribuida en diferentes ambientes como embalses, lagos, ríos, albuferas y estuarios en Argentina, Uruguay, Brasil y Chile, y ha sido introducida en otros países de Sudamérica (e.g., Bolivia y Perú) y en otros continentes (e.g., Europa y Asia) (Chiba et al. 1989, Gandolfi et al. 1991, Brian y Dyer 2006, Avigliano y Volpedo 2013a). En Argentina, Brasil y Uruguay se distribuye en la cuenca del Plata y en cuerpos de agua lénticos como embalses, lagos y lagunas, tanto artificiales como naturales (Brian y Dyer 2006, Tombari y Volpedo 2008, Avigliano y Volpedo 2013a). En líneas generales, durante el estadio larval y juvenil, esta especie se alimenta principalmente de plancton, mientras que en el estadio adulto, incorpora además otros organismos como moluscos gasterópodos y crustáceos (Escalante y Grosman 2001). Sin embargo, en cuerpos de agua lóticos donde el plancton es relativamente escaso, como en el estuario del Río de la Plata, la dieta del pejerrey está basada principalmente en moluscos y peces (Escalante y Grosman 2001). La diferenciación sexual del pejerrey es termo-dependiente. Normalmente existen dos periodos de desove, uno de marzo a abril y el otro comprendido de agosto a noviembre (Barco 1986). Esta especie alcanza la madurez sexual entre el primer y segundo año de vida (talla total de ~140 mm), según las diferentes regiones (Barco 1986).
El pejerrey representa el segundo recurso pesquero de agua dulce más importante de Argentina y Uruguay, y una gran proporción de la producción es exportada a Europa (Italia, Países Bajos y Ucrania), Rusia y los Estados Unidos de América (MINAGRI 2014). El volumen de pejerrey exportado proviene exclusivamente de la cuenca baja del Plata (estuario del Río de la Plata, río Uruguay y río Paraná) y se ha incrementado en los últimos años, pasando de 64 t en 2007 a 551 t en 2012, con un pico de exportación de 724 t en 2008 (MINAGRI 2014).
En la cuenca baja del Plata se ha sugerido la existencia de dos poblaciones pesqueras con alto grado de conectividad, una correspondiente al río Uruguay y delta del Paraná y la otra al estuario del Río de la Plata (Avigliano et al. 2014). Sin embargo, no hay datos sobre el estado de estas poblaciones ni registros históricos de capturas. Además, no hay información sobre la conectividad de estas poblaciones con las de otras cuencas de la región, como el río Negro (Uruguay) o el río Salado (Argentina), entre otras. Particularmente, la cuenca del Salado está conectada con una gran cantidad de cuerpos de agua lénticos de la llanura pampeana (e.g., lagunas Chascomús, Barranca, Adela, Chis Chis, El Burro) donde la especie es capturada a nivel de subsistencia, pesca deportiva y, en menor medida, comercial. A pesar de la importancia que reviste este recurso, no existen normativas de manejo específicas para el pejerrey en la cuenca del Plata. Identificar las poblaciones pesqueras es de suma importancia para generar herramientas específicas de cada una que contribuyan al manejo sustentable de las poblaciones de pejerrey.
Entre las herramientas más utilizadas para la identificación de las poblaciones pesqueras están los métodos de captura-recaptura, el análisis de estructura de tallas, la identificación genética y el análisis de la morfometría y microquímica de los otolitos (e.g., Park y Moran 1994). Los otolitos de los peces teleósteos, alojados en el aparato vestibular, son complejos cuerpos policristalinos compuestos principalmente por carbonato de calcio y pequeñas cantidades de otros minerales (elementos traza) inmersos dentro de una matriz orgánica (Campana 1999). En determinadas especies, la concentración de algunos de estos elementos, tales como el estroncio, bario, zinc y magnesio, está relacionada con la concentración de los mismos en el agua (Campana 1999, Sturrock et al. 2012, Avigliano 2014). Estas características, sumadas al hecho de que son estructuras metabólicamente inertes y acelulares que incorporan elementos químicos en forma constante del agua, hacen que los otolitos sean una herramienta muy útil para estudios de poblaciones pesqueras e historia de vida de los peces (Campana 1999; Avigliano y Volpedo 2013b; Avigliano et al. 2014, 2015a, 2015b, 2015c).
Debido a que existe una relación positiva entre la salinidad y la relación estroncio:calcio (Sr:Ca) del agua y del otolito de algunas especies de peces (Secor et al. 1995, Zlokovitz et al. 2003, Kraus y Secor 2004, Schuchert et al. 2010, Tabouret et al. 2010, Avigliano et al. 2014), se han desarrollado estudios que permiten relacionar parámetros del agua (Sr:Ca y salinidad) con la relación Sr:Ca de los otolitos para identificar rutas migratorias y poblaciones pesqueras (e.g., Secor et al. 1995; Zlokovitz et al. 2003; Tabouret et al. 2010; Avigliano et al. 2015b, 2015c). Otra herramienta ampliamente utilizada para la determinación de poblaciones pesqueras es la morfometría del otolito (e.g., Longmore et al. 2010, Cañás et al. 2012, Avigliano et al. 2014, Keating et al. 2014, Vieira et al. 2014). El análisis de la morfometría de los otolitos permite generar una descripción cuantitativa de la forma y el contorno que puede compararse estadísticamente (Lestrel 1997). Entre los índices morfométricos más utilizados están la circularidad, rectangularidad, elipticidad, factor de forma y área del sulcus/área del otolito (e.g., Volpedo etal. 2008, Longmore et al. 2010, Cañás et al. 2012, Tuset et al. 2013, Avigliano et al. 2014). De hecho, ambas metodologías se han usado conjuntamente en estudios recientes (e.g., Longmore et al. 2010, Avigliano et al. 2014).
En este contexto, se comparó la relación Sr:Ca y morfometría del otolito sagitta de una especie eurihalina, el pejerrey O. bonariensis, entre diferentes ambientes de Argentina (diques, lagos, lagunas y estuarios) con el fin de evaluar el uso de estas variables como marcadores de hábitat. Esta información es de gran importancia para estudios de identificación de poblaciones pesqueras e interconectividad y para el desarrollo de políticas de manejo.
Materiales y métodos
Área de estudio
Se estudiaron cuerpos de agua ubicados en tres diferentes regiones de Argentina (fig. 1). En el noroeste las muestras fueron colectadas en los embalses artificiales Los Alisos (24°11'S, 65°18'W) y Cabra Corral (25°27'S, 65°27'W). El embalse Los Alisos está ubicado a 1260 m sobre el nivel del mar, y tiene una conductividad eléctrica menor que 250 μScm-1 y profundidad máxima de 22 m. El embalse Cabra Corral está ubicado a 1100 m sobre el nivel del mar, en el Río Juramento, y tiene conductividad eléctrica media de 421 μScm-1 y profundidad máxima de 90 m (Muñoz et al. 2005). Estos diques no están conectados entre sí, y el clima de la región es del tipo subtropical semiárido.
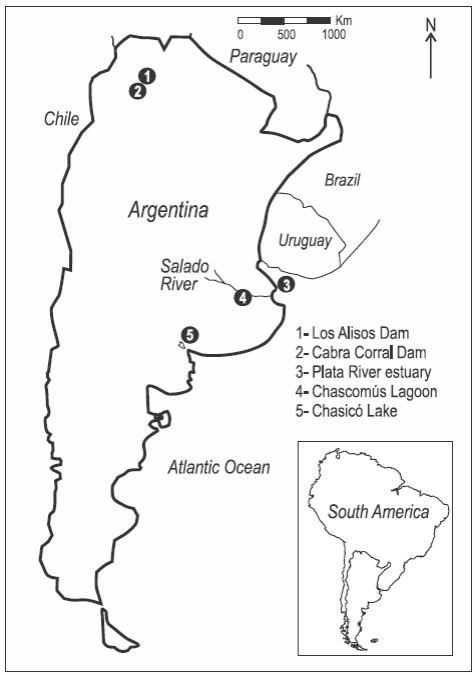
Figura 1: Área de estudio. Los puntos numerados indican los sitios de muestreo de agua y captura de pejerrey (Odontesthes bonariensis).
En la llanura pampeana (pampa húmeda) las muestras se recolectaron en el estuario del Río de la Plata (35°3'5.09"S, 57°2'47.79"W) y la laguna Chascomús (35°34'00"S, 58°01'00"W). El estuario del Río de la Plata recibe las aguas de la cuenca del Plata y descarga sobre el océano Atlántico. El intervalo de conductividad eléctrica es de 67 a 30,300 μScm-1 (Avigliano y Volpedo 2013b) y la profundidad media se encuentra entre 5 y 25 m (Guerrero et al. 2010). La laguna Chascomús está ubicada a 10 m sobre el nivel del mar y forma parte de la cuenca inferior del río Salado. La conductividad media es de 2200 μScm-1 y la profundidad máxima es de 3.4 m (Llames et al. 2009). El clima de la región es templado-cálido y se caracteriza por un régimen hidrológico que alterna entre períodos de inundaciones y sequías (Vervoorst 1967). Estas inundaciones producen canales que conectan la laguna de Chascomús con el estuario del Río de la Plata a través del río Salado.
El lago Chasicó (38°36'39.41"S, 63°4'48.68"W) es independiente del resto de los sistemas estudiados y está ubicado a -20 m sobre el nivel del mar en una zona de transición entre la región Pampeana y la Patagonia. Posee agua con elevada conductividad (38.800 μScm-1) y profundidad máxima de 16 m (Avigliano et al. 2012).
Recolecta de muestras
Las muestras de agua y peces fueron recolectadas simultáneamente entre agosto y septiembre de 2011 en los embalses Los Alisos y Cabra Corral, el estuario del Rio de la Plata, la laguna Chascomús y el lago Chasicó. Las muestras de agua fueron recolectadas manualmente por triplicado a 0.5 m de profundidad con botellas de polietileno previamente lavadas tres veces con agua destilada y agua del sitio de muestreo. Estas muestras fueron acidificadas al 0.2% (v/v) (pH < 2) con ácido nítrico y trasladadas al laboratorio en oscuridad a 4 °C. Posteriormente fueron filtradas al vacío con filtros Whatman GF/F de 0.45 μm. Las muestras se mantuvieron a 4°C hasta su análisis. Los métodos de recolecta, preservación, preparación y análisis fueron realizados acorde a los métodos estandarizados (APHA 1995).
Los ejemplares de O. bonariensis fueron capturados con redes de tres mallas de multifilamento (malla interna de 3×3 cm, mallas externas de 10 × 10 cm) y con anzuelo. Estos peces fueron trasladados al laboratorio a 4 °C donde se registró la talla y se extrajeron los otolitos sagittae. En todos los casos, se trabajó con ejemplares adultos y sexualmente maduros (talla de madurez sexual aproximada = 140 mm, Barco 1986). La estadística descriptiva referente a la talla y el número de individuos utilizados por sitio de estudio se muestran en la tabla 1.
Determinación de Sr y Ca en agua y otolitos
La concentración de Ca en el agua fue determinada por triplicado mediante el método volumétrico de titulación con ácido etilendiaminotetraacético (EDTA) (APHA 1995). La concentración de Sr en agua fue determinada por triplicado mediante un espectrómetro de emisión óptica con plasma de acoplamiento inductivo (ICP-OES, PerkinElmer Optima 2000 DV, Überlingen, Alemania), equipado con un nebulizador de flujo cruzado, cámara Scott y antorcha de cuarzo (método 200.7, EPA 1994). Se utilizó un eje de visión radial atenuado (límite de detección = 12 μgL-1). Las muestras fueron introducidas al equipo por medio de un muestreador automático Perkin-Elmer AS-90 Plus. En todos los casos se realizaron calibraciones externas utilizando el estándar Quality Control Standard 21 (QCS 21), PerkinElmer Pure (EUA). Cada 10 muestras, se analizaron un blanco y una muestra de concentración conocida preparada a partir del estándar QCS 21 para determinar si había interferencia y contaminación cruzada. El agua utilizada en todo el estudio se obtuvo de un sistema de purificación de agua Milli-Q (Millipore, São Paulo, Brasil) con una resistividad de 18.2 MOhm cm.
Los resultados fueron revisados y evaluados en relación con las muestras de concentración conocida. Los resultados registrados fueron corregidos según un blanco control. Posteriormente, se calcularon las relaciones Sr:Ca.
En este estudio se utilizó únicamente el otolito sagitta derecho (Los Alisos, N = 15; Cabra Corral, N = 15; Río de la Plata, N = 154; Chascomús, N = 17; Chasicó, N = 48). Los otolitos fueron limpiados con agua Milli-Q y secados. Cada uno fue pesado con una balanza analítica (error <0.001 g) y digerido en ácido nítrico al 50% sobre un baño de arena calentado entre 400-450 °C durante 1 h (Avigliano et al. 2014). La concentración de Sr en otolito se determinó por ICP-OES y la de Ca por el método de titulación con EDTA (APHA 1995). El equipamiento, procedimiento y control de calidad empleados en los procedimientos fueron detallados previamente para las determinaciones de Sr y Ca en agua.
La eficiencia del proceso de digestión de los otolitos fue verificada con el material de referencia FEBS-1 (Otolith Certified Reference Material, National Research Council, Canadá) y se obtuvo un porcentaje de recuperación del material de referencia aceptable (93% para Sr y 110% para Ca). Todas las determinaciones para los otolitos fueron realizadas por triplicado.
Morfometría de los otolitos
Los otolitos sagittae derechos de todos los ejemplares capturados fueron fotografiados con un microscopio estereoscópico (Leica EZ4 HD). Se registraron las siguientes variables morfométricas sobre las imágenes mediante el procesador de imágenes Image-ProPlus 4.5: longitud del otolito (LO), anchura del otolito (AO) y perímetro del otolito (PO), en milímetros; y área del otolito (SO) y área del sulcus (SS), en milímetros cuadrados. Posteriormente, se calcularon los siguientes índices de forma: circularidad (PO2/AO), rectan-gularidad (SO/[LO × AO]), elipticidad (LO-AO/LO+ AO), factor de forma ([4π × SO/PO2]) y SS/SO. La nomenclatura de los índices utilizados fue tomada de Tuset et al. (2013) y Volpedo et al. (2008). La circularidad da información acerca de la complejidad del contorno de los otolitos (Tuset et al. 2003). La rectangularidad da información sobre la aproximación a una forma rectangular o cuadrada, siendo igual a 1 un rectángulo o cuadrado perfecto. La elipticidad refleja la similitud del otolito con una elipse, tendiendo a la circularidad con valores cercanos a 0. El factor de forma es un valor adi-mensional que indica la similitud del contorno de los otolitos respecto de un círculo y sus valores están comprendidos entre 0 y 1, siendo un valor de 1 para un círculo perfecto (Tuset et al. 2003). El índice SS/SO determina qué porcentaje de la superficie del otolito está ocupado por el sulcus. El sulcus es el área de contacto entre el otolito y la mácula nerviosa que transmite al cerebro información relacionada con la posición relativa del pez en la columna de agua y con la captación auditiva (Volpedo et al. 2008).
Análisis estadístico
La relación Sr:Ca del agua fue comparada entre los sitios de muestreo mediante el análisis no paramétrico de Kruskal-Wallis. La variable Sr:Ca de los otolitos fue transformada con la función log(x + 1) debido al incumplimiento de los supuestos de normalidad y homogeneidad de la varianza (pruebas de Shapiro-Wilk y Levene, respectivamente). Después de la comprobación de estos supuestos, se utilizó el análisis de covarianza (ANCOVA) para determinar si existía un efecto del peso de los otolitos sobre la relación Sr:Ca. La relación Sr:Ca correlacionó positivamente con el peso del otolito y fue corregida substrayendo la pendiente común del ANCOVA (P < 0.01, b = 0.033) (Longmore et al. 2010, Kerr y Campana 2014, Avigliano et al. 2015b). Este ajuste eliminó el efecto del peso de los otolitos sobre la variable Sr:Ca transformada (ANCOVA (P > 0.05). Finalmente, la relación Sr:Ca del oto-lito fue comparada entre los sitios de estudio mediante el análisis de la varianza (ANOVA) univariado y la comparación múltiple de Tukey. Las relaciones medias de Sr:Ca del agua y otolitos fueron representadas en gráficos de cajas.
Las variables morfométricas no se ajustaron a la distribución normal y homogeneidad de la varianza (Shapiro-Wilk, P < 0.01; Levene, P > 0.05), y por este motivo fueron transformadas con la función log(x + 1). Posteriormente, se utilizó el ANCOVA con el fin de corregir el efecto de la longitud del otolito sobre las variables estudiadas (P < 0.01). Las constantes utilizadas para la corrección fueron las siguientes: circularidad, b = -0.03; rectangularidad, b = -0.01; elipticidad, b = -0.01; factor de forma, b = 0.17; SS/SO, b = -0.003. Las variables morfométricas fueron analizadas mediante un ANOVA usando la prueba de Tukey para evaluar las diferencias entre sitios. Por otro lado, el análisis multivariado de la varianza (MANOVA) fue aplicado para evaluar la existencia de diferencias significativas entre los sitios de estudio considerando todas las variables morfométricas en simultáneo. Posteriormente, se aplicó la prueba de comparación de pares T2 de Hotelling para evaluar las diferencias entre los sitios de muestreo.
Un análisis discriminante canónico (ADC) fue realizado utilizando los índices morfométricos con el fin de obtener la matriz de clasificación cruzada y determinar la capacidad de estas variables para la identificación del sitio de origen de los peces (e.g., Longmore et al. 2010, Kerr y Campana 2014). Los coeficientes estandarizados de las funciones discriminantes canónicas fueron utilizados para determinar la contribución de cada variable en la discriminación de grupos. El programa InfoStat fue utilizado para todos los análisis estadísticos.
Resultados
Relación Sr:Ca en agua y otolitos
Se observaron altos valores de Sr:Ca en las muestras de agua del lago Chasicó (Kruskal-Wallis, P < 0.001). Los valores fueron bajos en las muestras de agua del dique Los Alisos y el estuario del Río de la Plata, y no hubo diferencias entre estos dos sitios (Kruskal-Wallis, P > 0.05) (fig. 2a). Se observaron valores intermedios en las muestras de agua del dique Cabra Corral y la laguna Chascomús (P > 0.05) (fig. 2a).
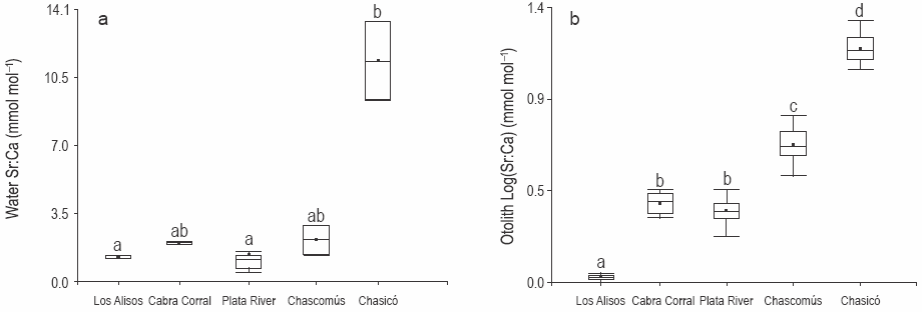
Figura 2: Relación Sr:Ca media del agua (a) y de los otolitos (b) por sitio de estudio. Las barras indican la desviación estándar.
No se observaron diferencias significativas en la relación Sr:Ca de los otolitos de los pejerreyes provenientes de Cabra Corral y del Río de la Plata (ANOVA, P < 0.05). Sin embargo, las relaciones Sr:Ca de los otolitos del resto de las áreas de estudio difirieron entre sí (P < 0.05), y fueron significativamente menor en los otolitos de los pejerreyes del dique Los Alisos y mayor en los peces del lago Chasicó (fig. 2b).
Morfometría de los otolitos
Una imagen representativa de los otolitos de cada sitio de estudio se muestra en la figura 3.
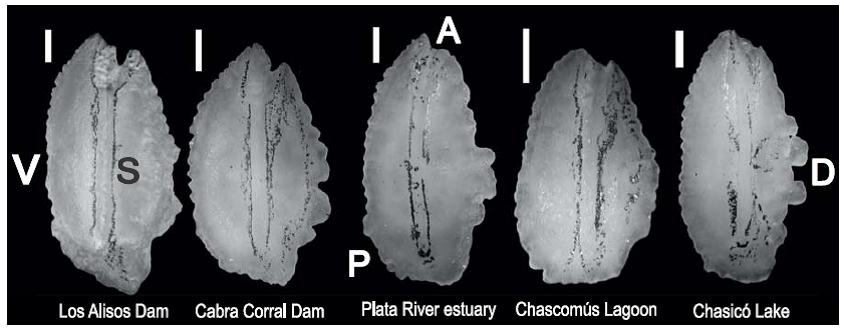
Figura 3: Otolitos sagitta derechos de Odontesthes bonariensis correspondientes a cada sitio de estudio. El sulcus fue pintado con grafito bajo lupa (20*) para mayor visualización. A, anterior; D, dorsal; S, sulcus; V, ventral; P, posterior. Barra = 1 mm.
Valores significativamente altos de circularidad y elipticidad fueron observados para los otolitos de los peces capturados en el lago Chasicó (tabla 2), resultando en otolitos con elevada complejidad de borde y morfología elíptica. Los índices de rectangularidad y circularidad fueron significativamente bajos para la laguna de Chascomús (P < 0.05), mientras que el factor de forma fue significativamente alto (P < 0.05). Esto indica una morfología tendiente a la circularidad con baja complejidad de borde. Por otro lado, la relación SS/SO fue mayor en este cuerpo de agua (tabla 2).
Tabla 2: Media ± desviación estándar de los índices morfométricos transformados con la función log(x + 1) por sitio de estudio. Las letras diferentes indican diferencias estadísticamente significativas (ANOVA, P < 0.05).
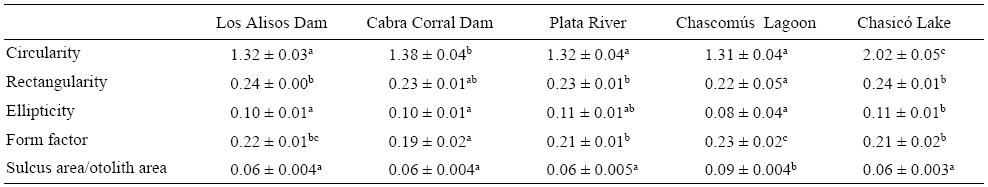
Los otolitos de los peces del estuario del Río de la Plata tendieron a la morfología elíptica-cuadrada relacionada con valores elevados de elipticidad y rectangularidad (tabla 2). Asimismo, el borde del otolito presentó baja complejidad. El menor valor de factor de forma se observó en los otolitos de Cabra Corral, lo que indica una tendencia a la forma cuadrada (tabla 2). El Dique Los Alisos estuvo asociado elevados índices de rectangularidad y baja complejidad de borde.
El MANOVA mostró diferencias significativas para las variables morfométricas entre los sitios de estudio (P < 0.05). Acorde a la prueba T2 de Hotelling, no se hallaron diferencias significativas entre Los Alisos y Chascomús (P > 0.05). Sin embargo, Cabra Corral, Río de la Plata y Chasicó difirieron entre si y se diferenciaron de los Alisos y Chascomús (P < 0.001).
El ADC (fig. 4) mostró una clara separación de los ejemplares provenientes del lago Chasicó respecto del resto de los cuerpos de agua. Por otro lado, la nube de dispersión correspondiente a los otolitos de los pejerreyes de la laguna Chascomús tendió a separarse de la del Río de la Plata. Se observó una superposición entre los valores de los otolitos de los pejerreyes provenientes de los diques de Los Alisos y Cabra Corral. El primer eje canónico explicó el 99.8% de la variación entre grupos. Según los coeficientes estandarizados de las funciones discriminantes canónicas obtenidos (CE), los índices que más contribuyeron a la discriminación sobre este eje fueron circularidad (CE = 2.27) y el factor de forma (CE = 2.05), seguidos de rectangularidad (CE = -0.51), SS/ SO (CE = -0.42) y elipticidad (CE = -0.04). La tabla de clasificación cruzada del ADC (tabla 3) mostró un alto porcentaje de individuos bien clasificados para el Lago Chasicó (100%) y los Alisos (80%). Por otro lado, el porcentaje de peces bien clasificados fue moderado para Chascomús, Cabra corral y el Río de la Plata (60-64.7%).
Discusión
La concentración de los elementos depositados en los otolitos puede ser afectada en gran medida por la composición química del agua y en menor medida por la temperatura y la dieta (Campana 1999, Wells et al. 2003, Ranaldi y Gagnon 2008, Brown y Severin 2009, Sturrock et al. 2012). En general, la concentración de Sr en los otolitos de especies de agua dulce, estuarinas y anádromas se correlaciona positivamente con la salinidad del agua (e.g., Kraus y Secor 2004, Sturrock et al. 2012); sin embargo, esta relación depende de la especie y debe ser evaluada previamente a la aplicación en estudios de identificación de poblaciones pesqueras, conectividad o migración. Particularmente para las especies marinas, la relación entre el Sr del otolito y la salinidad tiende a ser débil (Brown y Severin 2009, Sturrock et al. 2012). Brown y Severin (2009) indicaron que la relación Sr:Ca del agua es más homogénea en ambientes marinos que en ambientes de agua dulce o ambientes salobres. Por lo tanto, la variación del Sr:Ca en los otolitos de especies marinas está fuertemente influenciada por factores fisiológicos, más que el resultado de la exposición a entornos heterogéneos (Campana 1999, Brown y Severin 2009).
El pejerrey O. bonariensis es una especie altamente plástica que tolera intervalos de salinidad amplios y habita tanto en ambientes dulceacuícolas como salobres, ya sean ríos, lagunas, estuarios o albuferas (Brian y Dyer 2006, Avigliano y Volpedo 2013a). En este trabajo se encontró una tendencia similar para las relaciones Sr:Ca del agua y otolitos. Además, si bien el estuario del Río de la Plata presenta un rango amplio de conductividad, estas tendencias son consistentes con la salinidad o conductividad reportada para estos cuerpos de agua (Muñoz et al. 2005, Llames et al. 2009, Avigliano et al. 2012, Avigliano y Volpedo 2013b). Esto sugiere que la salinidad de los sitios de estudio está relacionada positivamente con la relación Sr:Ca del agua y del otolito, tal como indicaron otros autores para diferentes especies estuarinas y dulceacuícolas en diversos sistemas acuáticos (Brown y Severin 2009, Sturrock et al. 2012). El hecho de que la incorporación de Sr en otolitos sea afectada por el medio ambiente hace de este elemento una herramienta potencial para futuros estudios sobre los desplazamientos de peces y la identificación de poblaciones pesqueros. En este sentido, la relación Sr:Ca del otolito resultó ser buen marcador de hábitat para el pejerrey. Otros autores reportaron que la relación Sr:Ca del otolito es un buen indicador de hábitat para algunas especies eurihalinas de Sudamérica, como la sardina Lycengraulis grossidens (Mai et al. 2014) y la corvina Micropogonias furnieri (Albuquerque et al. 2012). Ibáñez et al. (2012) utilizaron la relación Sr:Ca para el estudio de patrones de desplazamiento de diferentes especies de mugílidos del mar Caribe, mientras que Hedger et al. (2008) aplicaron esta metodología para otras especies del hemisferio norte con gran tolerancia a la salinidad, como Anguilla rostrata.
Otras metodologías como la morfología y morfometría del otolito han sido ampliamente utilizadas para la diferenciación de poblaciones pesqueras (Longmore 2010, Cañás et al. 2012, Keating et al. 2014, Vieira et al. 2014), e incluso para identificar especies actuales (Tuset et al. 2013, Zhuang et al. 2014) o fosilizadas (Reichenbacher et al. 2009, Reichenbacher y Reichard 2014). Sin embargo, los estudios que relacionan las variables morfométricas con diferentes ambientes o patrones ecomorfologicos son escasos (Nelson etal. 1994; Volpedo y Fuchs 2010; Avigliano et al. 2012, 2014).
Estudios previos han reportado una relación positiva entre la salinidad o conductividad y la tendencia a la elipticidad en otolitos de O. bonariensis del lago Chasicó (Avigliano et al. 2012) y del estuario del Río de la Plata (Avigliano et al. 2014). En estos estudios se utilizó el índice anchura:longitud del otolito como indicador de elipticidad. Acorde con estos autores, en nuestra investigación se observó una morfología del otolito elíptica o elíptica-cuadrada en los sistemas de mayor salinidad como el lago Chasicó y el estuario del Río de la Plata. Los sistemas con menor salinidad, como la laguna de Chascomús y los diques Los Alisos y Cabra Corral, presentaron elipticidad relativamente baja (tabla 2).
Diferentes autores relacionan el tamaño del sulcus con la movilidad (Lombarte y Popper 1994, Arellano et al. 1995, Tuset et al. 2003, Avigliano et al. 2014). Por ejemplo, en algunas especies del genero Merluccius, este índice estaría relacionado con el uso de la columna de agua; sin embargo, en algunas especies del género Mullus estaría asociado a diferencias en el comportamiento de alimentación (Aguirre y Lombarte 1999). Avigliano et al. (2014) han reportado que SS/SO tiende a ser mayor en las poblaciones de O. bonariensis que realizan grandes migraciones en el estuario del Río de la Plata. En este trabajo la relaciones entre los desplazamientos y el tamaño relativo del sulcus no fue evidente ya que el índice SS/SO par el Río de la Plata, donde se hallan las poblaciones migrantes, fue similar o significativamente inferior al obtenido para los cuerpos de agua lénticos (tabla 2). Esto podría deberse a diferentes motivos. En primer lugar, en este trabajo se consideraron únicamente variables en dos dimensiones, y es posible que la profundidad del sulcus muestre diferencias dependiendo de los diferentes ambientes estudiados y hábitos de las poblaciones (ver Tuset et al. 2003). En segundo lugar, la presencia de una población con una menor característica migratoria, que tiende a permanecer más tiempo en aguas salobres del estuario del Río de la Plata (Avigliano et al. 2014), podría tener un efecto negativo en el índice SS/SO; sin embargo esta última opción es poco factible debido a que las dos poblaciones conocidas migran (en menor o mayor medida) en el período reproductivo y se superponen considerablemente en la zona de muestreo (Avigliano et al. 2014).
Excluyendo la elipticidad, los índices calculados para los otolitos de los pejerreyes del estuario del Río de la Plata estuvieron dentro del intervalo obtenido para el resto de los sitios de estudio (tabla 2). Esto podría deberse al comportamiento migratorio de la especie en el estuario, ya que una de las poblaciones que se distribuye en aguas salobres de la bahía Samborombón durante el verano (noviembre-mayo) se desplaza con fines reproductivos hacia los grandes ríos del delta del Paraná (agua dulce) en los meses fríos del año (junio-octubre) (Avigliano y Volpedo 2013b). En este sentido, los peces del estuario estarían sometidos a importantes cambios de hábitats con gran variabilidad tanto en temperatura como en salinidad, lo cual se reflejaría en la morfometría de los otolitos.
Las diferencias halladas con las pruebas multiparamétricas sugieren la existencia de alta disimilaridad en la morfología de los otolitos, particularmente en los índices de circularidad, factor de forma y rectangularidad. Los porcentajes de clasificación del ADC fueron similares a los obtenidos por otros autores (ver por ejemplo Tuset et al. 2003) que indicaron que los índices de forma de los otolitos pueden ser utilizados como marcadores naturales, no sólo para separar especies sino también para identificar poblaciones. En este sentido, las variables morfométricas estudiadas en este trabajo serían útiles como marcadores del hábitat.
En conclusión, los resultados de este trabajo indican que la relación Sr:Ca y la morfometría del otolito son buenos indicadores de hábitat para el pejerrey O. bonariensis. La información aquí presentada es un punto de referencia para el estudio de la biología y dinámica poblacional (historia de vida, identificación de poblaciones pesqueras, etc.) de especies eurihalinas, en especial O. bonariensis. En este sentido, las variables estudiadas pueden ser utilizadas en diferentes cuencas de Sudamérica donde la especie se encuentra distribuida (e.g., cuenca del Plata, sistema de Lagoa dos Patos) para identificar diferentes poblaciones pesqueras y evaluar el grado de conexión entre las mismos. Esta información es de vital importancia para gestión y manejo de los recursos pesqueros.











 texto en
texto en 





