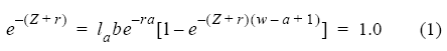INTRODUCCIÓN
Resiliencia es la habilidad de las especies para recuperarse después de un cambio debido a perturbaciones naturales o derivadas de actividades humanas (Doak et al. 1998). En la ciencia pesquera, la resiliencia se refiere a la capacidad de las poblaciones bajo explotación para sobreponerse a la presión pesquera, y se han desarrollado métodos sencillos, como el potencial de recuperación (r 2M), para medir de una forma relativa la capacidad de recuperación de una población a la presión pesquera (Au y Smith 1997).
Los depredadores tope, como los tiburones, evolucionaron bajo presiones de mortalidad natural bajas en comparación con otros peces (Clarke et al. 2007). En consecuencia, se piensa que estos organismos presentan baja resiliencia y sus poblaciones son más susceptibles a la sobrepesca o degradación ambiental (Bonfil 1994, Castro et al. 1999, Fowler et al. 2005, Clarke et al. 2007). Se ha estimado que durante las últimas décadas las poblaciones de depredadores marinos tope se han reducido en al menos un orden de magnitud, debido principalmente a la presión pesquera (Myers y Worm 2005). Además, en muchas regiones alrededor del mundo se han registrado decrementos significativos en las capturas de tiburón (Baum y Myers 2004, Shepherd y Myers, 2005, Cortés et al. 2007), y a la fecha no hay reportes acerca de la recuperación de alguna población de tiburón después de una sobreexplotación.
Entre los tiburones, sin embargo, existe una amplia gama de capacidades productivas, relacionadas con variaciones en sus características de historia de vida (Walker 1998, Stevens et al. 2000). Tales diferencias repercuten en que algunas especies sean más resilientes a la presión pesquera que otras (Smith et al. 1998, Stevens et al. 2000). Por ejemplo, la musola suave, Mustelus antarcticus, considerada como una de las especies de tiburón con productividad biológica alta, ha mantenido niveles de captura sostenibles bajo cuidadosos esquemas de manejo en Australia, mientras que el tiburón vitamínico, Galeorhinus galeus, ha decrecido a pesar de esquemas similares de manejo, probablemente debido a su menor productividad biológica (Walker 1998).
La región que comprende la entrada del golfo de California (GC), incluyendo las aguas costeras de Nayarit y sur de Sinaloa, así como las aguas alrededor de la isla Isabel y el archipiélago de las islas Marías, es una de las más antiguas y tradicionales regiones de pesca de tiburón en el Pacífico mexicano. Durante al menos siete décadas, la pesquería artesanal de tiburón ha operado en esta área, donde se captura una gran variedad de tiburones, algunos de alto valor comercial (Pérez-Jiménez et al. 2005, Moncayo-Estrada et al. 2006, Torres-Herrera y Tovar-Ávila 2014).
Algunos estudios se han llevado a cabo en la entrada del GC para determinar la composición específica de las capturas de tiburón (Saucedo-Barrón 1982, Soriano-Velásquez et al. 2005, Torres-Herrera y Tovar-Ávila 2014) y su abundancia relativa (Pérez-Jiménez et al. 2005). Sin embargo, la falta de información de las capturas por especie en México dificulta el uso de métodos cuantitativos para determinar el estado de las poblaciones y los niveles sostenibles de explotación. No obstante, la comparación de la información reportada en esos estudios puede ser útil para detectar impactos negativos de la pesquería, ya que los cambios en la composición específica y tallas de las capturas pueden utilizarse como indicadores de la estabilidad de una población (Wholfarth 1986, McAllister et al. 1992).
La posible extirpación de algunas especies de tiburón en el sur del GC, por ejemplo del tiburón cabeza de pala, Sphyrna tiburo (descrita como abundante por Hernández-Carvallo en 1967), ha sido reportada (Pérez-Jiménez 2014). Sin embargo, los niveles de captura de tiburón en el área han permanecido altos durante las últimas décadas y aparentemente han incrementado en años recientes en la región central de Nayarit (Torres-Herrera y Tovar-Ávila 2014). La contribución de Nayarit a la producción de tiburón del Pacífico mexicano durante los últimos 30 años ha sido de 879 t (4.5% del total) por año en promedio, y en 2011 este estado contribuyó con 1594 t, su nivel máximo desde 1981 (SEPESCA 1988; SEMARNAP 1998, 2004; SAGARPA 2012) (Fig. 1).
A lo largo de las últimas tres décadas, los desembarques de tiburón de la flota artesanal de Nayarit han estado representados principalmente por tres especies: la cornuda común, Sphyrna lewini (Griffith y Smith 1834); el cazón bironche, Rhizoprionodon longurio (Jordan y Gilbert 1882); y el tiburón sedoso, Carcharhinus falciformis (Muller y Henle 1839) (Saucedo-Barrón 1982, Pérez-Jiménez et al. 2005, SorianoVelásquez et al. 2005, Torres-Herrera y Tovar-Ávila 2014). Las tres especies muestran una resiliencia aparentemente alta, en vista de los altos niveles de captura durante un periodo prolongado.
El objetivo de este estudio fue analizar el nivel de resiliencia de estas tres especies, con base en su potencial de recuperación (r 2M), estimado con nueva información disponible sobre sus parámetros de historia de vida en la región. Asimismo, información de captura obtenida durante muestreos biológico-pesqueros, datos reportados en estudios previos e información de la pesquería fueron utilizados para explicar su aparente estabilidad en las capturas.
MATERIALES Y MÉTODOS
De marzo de 2007 a junio de 2010, se llevaron a cabo muestreos biológicos de los desembarques de la pesquería artesanal de tiburón en diversas localidades a lo largo de la costa de Nayarit (México). Los muestreos se realizaron mensualmente o cada dos meses en los principales sitios de desembarque de las tres localidades pesqueras más importantes (La Cruz de Huanacaxtle, San Blas e isla Isabel), y ocasionalmente en localidades más pequeñas o de menor importancia (La Peñita de Jaltemba, Chacala, Boca de Camichín y Boca del Asadero) en cuanto a los desembarques de tiburón. Para facilitar la comparación con los estudios previos, los datos recolectados fueron agrupados en dos regiones: (1) Nayarit central (NC), que incluyó isla Isabel, San Blas, Boca del Asadero y Boca de Camichín; y (2) Nayarit sur (NS), que incluyó La Cruz de Huanacaxtle, La Peñita de Jaltemba y Chacala (Fig. 2).
Las especies de tiburón fueron identificadas usando las guías de Compagno et al. (1995) y Castro et al. (2002). Todos los especímenes fueron sexados. Cuando fue posible se midió la longitud total (LT) con una cinta de fibra de vidrio al centímetro más cercano, de la punta de la nariz a la punta del lóbulo superior de la aleta caudal, extendida de acuerdo con el eje del cuerpo (Compagno 2001). La LT de los especímenes descargados sin cabeza fue estimada a partir de la longitud alternativa (LA) (distancia del origen de la primera aleta dorsal a la muesca precaudal) utilizando las siguientes ecuaciones: Sphyrna lewini: LT = LA(2.18) + 5.157 (r 2 = 0.95, n = 163) (Gallegos-Camacho y Tovar-Ávila 2011); Rhizoprionodon longurio: LT = LA(1.99) + 6.23 (r 2 = 0.93, n = 87 ); y Carcharhinus falciformis: LT = LA(2.29) + 10.50 (r 2 = 0.95, n = 391) (Ramírez-Santiago et al. 2006).
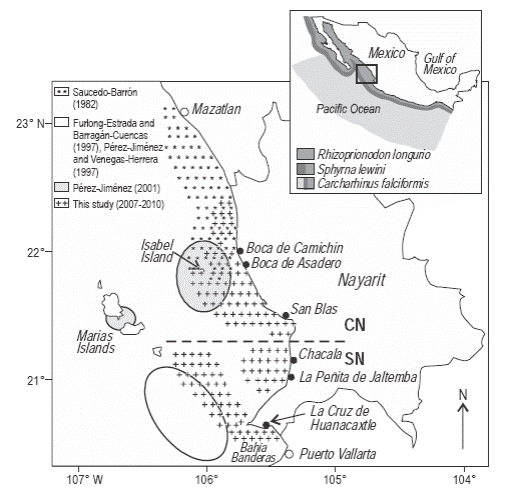
Figura 2 Localidades muestreadas (●) en Nayarit (CN, Nayarit central; SN, Nayarit sur) durante el presente estudio. Zonas de pesca de tiburón registradas en este estudio y en estudios previos. La distribución de Rhizoprionodon longurio, Sphyrna lewini y Carcharhinus falciformis en el Pacífico mexicano (Compagno et al. 1995) se presenta en el mapa superior.
Comparación de la composición de la captura
El porcentaje de cada especie en las capturas, su distribución de tallas y la proporción de organismos maduros (con base en la longitud de madurez reportada para cada especie) reportados en los estudios previos realizados en la región (Saucedo-Barrón 1982, Furlong-Estrada y Barragán-Cuencas 1997, Pérez-Jiménez y Venegas-Herrera 1997, Pérez-Jiménez 2001, Soriano-Velásquez et al. 2005) fueron estimados y comparados con aquellos observados durante el presente estudio, para determinar posibles cambios en la composición de las capturas y por tanto en la estructura poblacional.
Tasas de incremento poblacional y potencial de recuperación
Las tasas intrínseca (r) y finita (λ = er) de incremento poblacional para las poblaciones no explotadas fueron estimadas para cada especie, utilizando una forma simplificada de la ecuación de Euler-Lotka (Au y Smith 1997):
donde α es la edad de madurez, w es la edad reproductiva máxima, lα es la supervivencia a la edad x, b es la fecundidad a la edad x (en número de hembras nacidas anualmente por hembra adulta) y Z es la mortalidad total, la cual equivale a la mortalidad natural (M) en poblaciones no explotadas.
El potencial de recuperación (r2M ) fue estimado en tres pasos consecutivos (Au y Smith 1997). Primero, r fue determinada para la población sin explotar con la ecuación antes señalada. Segundo, la supervivencia de los preadultos (lα ) fue estimada suponiendo que el rendimiento máximo sostenible (RMS) se alcanza a una Z = 2M. Finalmente, r2M fue obtenida eliminando la presión pesquera de la población (retornando Z = M) pero conservando el incremento del valor de lα, 2M . Dos escenarios alternos fueron estimados usando valores más conservadores de mortalidad necesaria para alcanzar el RMS (1.25M y 1.50M), los cuales Simpfendorfer (2005) sugiere como más probables para los tiburones.
Los parámetros de historia de vida de las especies utilizados en la ecuación modificada de Euler-Lotka fueron obtenidos de estudios realizados en el GC o, en su ausencia, en áreas cercanas (Tabla 1). La M de cada especie fue estimada a través del método indirecto propuesto por Hoenig (1983):
donde Z ≈ M y Tmax es la edad máxima en años.
Este método indirecto es el más usado para estimar la M de especies de tiburón (Simpfendorfer 2005) y ha sido utilizado también en evaluaciones de riesgo ecológico para elasmobranquios (Braccini et al. 2006, Tovar-Ávila et al. 2010, Furlong-Estrada et al. 2014).
Tabla 1 Parámetros biológicos reportados para Sphyrna lewini, Rhizoprionodon longurio y Carcharhinus falciformis en el océano Pacífico. sa, talla de madurez (cm); ω, edad máxima (años); α, edad de madurez (años); F, fecundidad (promedio de crías); b, fecundidad promedio/2 (crías de hembra por hembra adulta); y M, mortalidad natural.
| Species | Sa | ω | α | F | b | m | Reference |
| S. lewini | 220 | 17-35* | 5.8-11.6* | 22.0 | 11.00 | 0.12-0.25 | Bejarano-Álvarez (2010), Anislado-Tolentino et al. (2008), Gallegos-Camacho (2009) |
| R. longurio | 92 | 10 | 4.0 | 7.5 | 3.75 | 0.42 | Márquez-Farías et al. (2005), Corro-Espinosa et al. (2011), Tovar-Ávila et al. (2011) |
| C. falciformis | 182 | 16-31 | 7.0-16.0 | 5.0 | 2.50 | 0.13-0.26 | Sánchez de Ita et al. (2010), Hoyos-Padilla et al. (2012), Mondragón-Sánchez (2015) |
* Age estimates assuming the formation of two growth bands per year in the vertebrae (Anislado-Tolentino et al. 2008) and one growth band per year ((Gallegos-Camacho 2009).
La incertidumbre en los parámetros de historia de vida de C. falciformis y S. lewini fue incorporada, en el caso de la fecundidad, utilizando el promedio de los valores reportados, y en el caso de la edad máxima, edad de madurez y M resultante, la incertidumbre se incorporó al utilizar los valores máximos reportados para establecer un escenario alterno.
La productividad, y por tanto la resiliencia, para cada especie fue categorizada como baja (r2M < 0.04), media (r2M = 0.04-0.07) o alta (r2M > 0.08), y comparada con aquellas registradas previamente por Smith et al. (1998) para las tres especies.
RESULTADOS
Análisis de la composición de captura
La proporción de los desembarques muestreados en cada estudio fue variable. Furlong-Estrada y Barragán-Cuencas (1997) y Pérez-Jiménez (2001) reportaron muestreos del 80% de la captura total en sus respectivos estudios, mientras que Soriano-Velásquez et al. (2005) registraron aproximadamente el 50% de los desembarques. Aunque Saucedo-Barrón (1982) no precisa el porcentaje muestreado de las capturas, con base en su descripción metodológica se estima que la muestra fue de más del 50% del total de los desembarques de tiburón. Se estimó una menor cobertura de muestreo de los desembarques para el presente estudio (aproximadamente el 25%) debido al mayor número de localidades estudiadas.
Los estudios previos fueron llevados a cabo durante la principal temporada de pesca de tiburón en la región, la cual ocurre de a finales del otoño a finales de la primavera (noviembre a abril). Aunque el presente estudio incluyó muestreos durante el verano, la mayoría de las muestras fueron obtenidas durante la temporada principal de pesca, particularmente durante marzo en NC (58%). Por lo tanto, se considera que el presente estudio puede ser comparado con los estudios señalados.
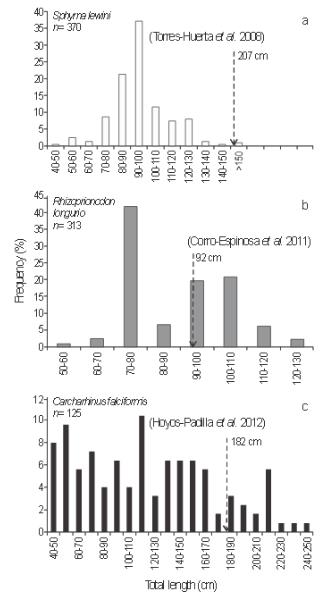
Figura 3 Distribución de frecuencias de longitud de Sphyrna lewini (a) y Rhizoprionodon longurio (b) en Nayarit central y de Carcharhinus falciformis (c) in Nayarit sur, durante el presente estudio (2007-2010). La talla de madurez reportada para cada especie está representada por la flecha.
Un total de 1082 tiburones fueron muestreados durante 2007-2010. Los desembarques de tiburones estuvieron compuestos principalmente por S. lewini, R. longurio y C. falciformis. En NC se registraron 788 tiburones (73% de los organismos registrados en todas las localidades), de los cuales 381 correspondieron a S. lewini (48%) y 314 a R. longurio (40%), representando en conjunto el 88% del total de la captura de tiburón en NC. De manera similar, estas dos especies compusieron el 86% de las capturas de tiburón muestreadas en el norte de Nayarit, sur de Sinaloa e isla Isabel durante la temporada de pesca 1980-1981 (Saucedo-Barrón 1982), y el 95% de las capturas de tiburón muestreadas en isla Isabel durante la temporada de pesca 2000-2001 (Pérez-Jiménez 2001).
En NS, se registró un total de 128 especímenes de C. falciformis, representando la especie de tiburón más abundante (44%) en esta región. El número de C. falciformis registrado en estudios previos fue considerablemente mayor, aunque la proporción en los desembarques fue similar. En los desembarques de tiburón en La Cruz de Huanacaxtle, esta especie fue las más abundante (49%) durante 2004 (n = 379) (Soriano-Velásquez et al. 2005) (Tabla 2), mientras que durante la temporada de pesca 1995-1996, fue la segunda más frecuente (27.5%), detrás de Sphyrna zygaena (35%) (n = 2004) (Furlong-Estrada y Barragán-Cuencas 1997, Pérez-Jiménez y Venegas-Herrera 1997).
Casi el total (99%) de los especímenes de S. lewini registrados en NC midieron <150 cm LT, por debajo de la talla de madurez estimada para esta especie (207 cm LT, Torres-Huerta et al. 2008); 66% de los especímenes midió entre 75 y 105 cm LT (Fig. 3, Tabla 2). Por otro lado, 45% de los especímenes de R. longurio registrados en NC tuvieron una LT igual o mayor que la talla de madurez reportada para la especie (92 cm LT, Corro-Espinosa et al. 2011), y 89% midió entre 70 y 110 cm LT (Fig. 3, Tabla 2). De forma similar, un alto porcentaje de juveniles de S. lewini y preadultos (organismos con talla cercana a la talla de madurez) de R. longurio fueron registrados en las capturas del norte de Nayarit, isla Isabel y sur de Sinaloa durante 1980-1981 (Saucedo-Barrón 1982) y de isla Isabel durante 2000-2001 (Pérez-Jiménez 2001) (Tabla 2).
Un alto porcentaje (85%) de los especímenes de C. falciformis registrados en la región NS midió menos que la talla de madurez reportada (182 cm LT, Hoyos-Padilla et al. 2012), y el 55% de los especímenes midió entre 40 y 120 cm LT (Fig. 3, Tabla 2). Al contrario, un alto porcentaje (55% y 40%) de organismos maduros fueron registrados previamente en La Cruz de Huanacaxtle por Furlong-Estrada y Barragán-Cuencas (1997) y Soriano-Velásquez et al. (2005), respectivamente (Tabla 2).
Tabla 2 Abundancia relativa en la captura total, intervalo de tallas de captura e intervalo de tallas más comunes (longitud total [TL] en centímetros), y proporción de organismos maduros e inmaduros de Sphyrna lewini, Rhizoprionodon longurio y Carcharhinus falciformis, así como los principales métodos de captura usados en la entrada del golfo de California, registrados en el presente estudio y en estudios previos.
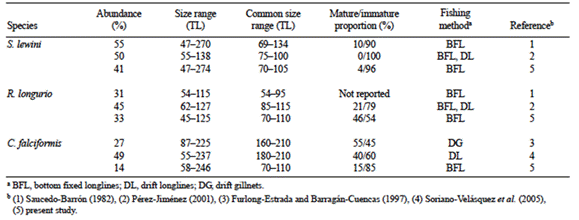
Tabla 3 Tasas intrínseca (r) y finita (X) de incremento poblacional, potencial de recuperación (r2M) y categorías de r2M de Sphyrna lewini, Rhizoprionodon longurio y Carcharhinus falciformis, estimados en el presente estudio. Los valores r2M reportados por Smith et al. (1998) para estas especies son también presentados.
* Estimated value for the Atlantic sharpnose shark (Rhizoprionodon terraenovae).
Tasas de incremento poblacional y potencial de recuperación
Rhizoprionodon longurio presentó las tasas más altas de incremento poblacional y una mayor productividad (r2M = 0.83), mientras que C. falciformis y S. lewini presentaron tasas menores de incremento poblacional y valores de productividad medios (r2M = 0.053 y 0.062, respectivamente) (Tabla 3, Fig. 4). Sin embargo, en el escenario alterno realizado para C. falciformis y S. lewini considerando el límite superior de las estimaciones de edad de madurez y longevidad, ambas especies descendieron a la categoría de productividad baja (r2M = 0.023 para C. falciformis y r 2M = 0.033 para S. lewini) (Fig. 4).
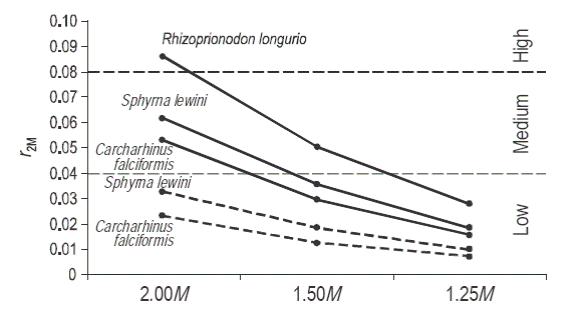
Figura 4 Potencial de recuperación (r 2M) para Rhizoprionodon longurio, Sphyrna lewini y Carcharhinus falciformis usando diferentes valores de mortalidad para alcanzar el rendimiento máximo sostenible. La línea punteada representa los escenarios para C. falciformis y S. lewini obtenidos con el límite superior de las estimaciones de edad de madurez y edad máxima.
Todas las especies descendieron en la categoría de productividad en los escenarios alternos considerando una M menor para alcanzar el RMS (1.50 y 1.25M). En el escenario de 1.50M, R. longurio descendió a la categoría media y las dos especies restantes descendieron a la categoría de resiliencia baja, mientras que en el escenario de 1.25M las tres especies se ubicaron en la categoría baja (Fig. 4).
DISCUSIÓN
Durante las últimas décadas, las tres especies analizadas, junto con el tiburón azul (Prionace glauca), han sido las especies de tiburón más frecuentes en las capturas de la pesquería artesanal a lo largo de la costa del Pacífico mexicano y han contribuido sustancialmente a sostener esta actividad (CONAPESCA-INP 2004). Las capturas de S. lewini, R. longurio y C. falciformis son importantes desde Sinaloa hasta el sur de la costa mexicana del Pacífico, pero son esporádicas en el centro y norte del GC (Bizarro et al. 2009a, Smith et al. 2009).
Sphyrna lewini es quizás la especie de tiburón más importante en las capturas en varias regiones del Pacífico mexicano, como en la región central (estados de Jalisco, Colima, Michoacán y Guerrero) (Madrid et al. 1997, Anislado-Tolentino y Robinson-Mendoza 2001). En el sur del Pacífico mexicano, esta especie es también un componente importante de los desembarques de la flota artesanal; por ejemplo, en Oaxaca, contribuyó con 64% de las capturas de tiburón registradas durante septiembre de 2004 hasta junio de 2006 (n = 1233) (Bejarano-Álvarez et al. 2010), mientras que en Chiapas fue el segundo tiburón más común y contribuyó con el 29% de la captura total (n = 37,669) durante 1996-2003 (Soriano-Velásquez et al. 2006).
Rhizoprionodon longurio es un componente importante de las capturas de la pesquería artesanal en Mazatlán, Sinaloa (Márquez-Farías et al. 2005). Este pequeño tiburón costero tiene gran importancia comercial para muchas comunidades costeras del sur de Sinaloa y Nayarit (Corro-Espinosa et al. 2011). Aunque su distribución geográfica alcanza la costa del Perú (Compagno 1999), aparentemente su importancia pesquera fuera de la entrada del GC no es muy notable.
Carcharhinus falciformis representa también una especie importante para las pesquerías de tiburón en el centro y sur del Pacífico mexicano. En Chiapas representó 60% de la captura total de tiburón durante 1996-2003 (Soriano-Velásquez et al. 2006), y en Oaxaca representó 36% de los desembarques de tiburón durante 2004-2005 (n = 1187) (Alejo-Plata et al. 2006). Además, C. falciformis contribuye significativamente a las capturas de la flota semi-industrial que opera en el Pacífico central mexicano, representando el 88% de los desembarques durante 2006-2007 (n = 1962) (Cruz et al. 2011) y el 53% de las capturas de la flota palangrera durante 2003-2011 (Santana-Hernández y Flores-Valdez 2013).
Las especies analizadas están ampliamente distribuidas en la entrada del GC (Compagno et al. 1995) (Fig. 2); no obstante, S. lewini muestra hábitos notablemente costeros y usualmente se encuentran entre los 0-30 m de profundidad (Compagno et al. 1995), por lo que puede ser fácilmente alcanzado por los sistemas de captura utilizados por la pesquería artesanal (palangres y redes). En las aguas costeras del sur de Sinaloa y norte de Nayarit, las capturas de la pesquería artesanal están compuestas por un gran número de juveniles de S. lewini durante cierta temporada del año (Saucedo-Barrón 1892, Pérez-Jiménez et al. 2005, Torres-Huerta et al. 2008). Esta especie es también capturada comúnmente de manera incidental por la pesquería de arrastre de camarón en la región.
Rhizoprionodon longurio, es un tiburón pequeño de hábitos costeros, comúnmente encontrado cerca de la superficie (0-30 m de profundidad). Esta especie ha sido catalogada como el tiburón costero más abundante en ciertas áreas del GC (Compagno et al. 1995). La predominancia de preadultos (cerca de la talla de madurez) y adultos en las capturas se debe probablemente al tamaño de los anzuelos y luz de malla de las redes que utiliza la pesquería artesanal y que incrementan su susceptibilidad de captura (Furlong-Estrada et al. 2014).
Carcharhinus falciformis fue una especie importante para la pesquería de La Cruz de Huanacaxtle (en NS) hace dos décadas, cuando se capturaban grandes especímenes principalmente lejos de la costa, en el sur del archipiélago de las islas Marías (Pérez-Jiménez et al. 2005). En la actualidad, debido al incremento en los costos de viaje, la pesca de tiburón se realiza principalmente en aguas costeras, donde se encuentran organismos juveniles, y la pesca en aguas lejanas se ha vuelto ocasional (Furlong-Estrada et al. 2014). Esto explica, en parte, la variación en la abundancia y talla observada entre los estudios previos y el presente. Otros factores que afectan su distribución, como las condiciones o anomalías oceanográficas como El Niño/Oscilación del Sur (ENOS), el cambio climático y la contaminación marina, pueden estar jugando también un papel importante en su abundancia en los desembarques (Dulvy et al. 2003).
Los valores de r2M estimados para R. longurio en el presente estudio fueron similares a los registrados por Smith et al. (1998), aunque la información utilizada por Smith et al. (1998), provino de otra especie del mismo género (Rhizoprionodon terraenovae) debido a la falta de información biológica en ese tiempo. Nueva información disponible (Pérez-Jiménez et al. 2005, Márquez-Farías et al. 2005, Castro 2009, Corro-Espinosa et al. 2011) ha confirmado, sin embargo, que algunas características biológicas de R. longurio en el sur del GC son similares a quellas estimadas para R. terraenovae en el golfo de México (Márquez-Farías y Castillo-Géniz 1998) y R. taylori en el norte de Australia (Simpfendorfer 1999). Estas especies se caracterizan por su talla pequeña, crecimiento rápido, madurez temprana y cortos periodos de gestación y ciclo ovárico, que explicaría su productividad biológica relativamente alta entre los tiburones.
Cambios notables en la abundancia de las capturas de R. longurio entre un año y otro han sido observados por los pescadores mismos. Esto podría estar relacionado con los patrones migratorios de esta especie hasta ahora desconocidos. Carlson et al. (2008) registró movimientos de distancias largas (más de 399 km) para juveniles de R. terraenovae, incluyendo incursiones hacia aguas profundas, sin una preferencia a un área determinada. Como su congénere del Atlántico, R. longurio pudiera tener un comportamiento migratorio similar, el cual podría explicar sus ausencias parciales en algunas temporadas de pesca y puede también actuar a favor de su resiliencia al disminuir su susceptibilidad de captura. Investigaciones sobre las rutas migratorias de esta y otras especies de tiburón son urgentemente necesarias.
El r2M estimado para S. lewini, fue mayor al reportado por Smith et al. (1998). Sin embargo, en el escenario alterno, utilizando el límite superior de las estimaciones de edad de madurez y edad máxima, la productividad descendió a la categoría baja. Tal incertidumbre en los parámetros relacionados con la edad se debe principalmente a la interpretación de la periodicidad en la formación de bandas de crecimiento en las vértebras (una o dos por año), y el consecuente efecto de los parámetros relacionados con la edad en el modelo utilizado. Hasta que se realicen estudios de validación en esta especie, esta incertidumbre persistirá, pero el principio precautorio sugeriría considerar la productividad más baja, el cual representa un mayor riesgo de sus poblaciones a la presión pesquera.
Actualmente, la pesca artesanal de tiburón en el área de estudio se realiza predominantemente en aguas costeras, donde la mayoría de juveniles de S. lewini son capturados, debido a la distribución de esta especie y al limitado radio de operaciones de la flota artesanal. Simpfendorfer (1999) mostró que la supervivencia de neonatos (edad 0-1 años) de Carcharhinus obscurus (una especie con historia de vida similar a S. lewini) tiene relativamente poca influencia en la tasa intrínseca de incremento poblacional (r), mientras que la supervivencia de los preadultos y adultos es crítica para el mantenimiento de la población. Consecuentemente, la relativa baja presión pesquera sobre los adultos de S. lewini en comparación con los juveniles en la entrada del GC ha actuado tal vez de manera inadvertida en favor de la estabilidad poblacional.
Algunos estudios de edad y crecimiento en C. falciformis realizados en el océano Pacífico (Joung et al. 2008, Sánchezde Ita et al. 2010) concuerdan que esta especie tiene un crecimiento lento y madurez sexual tardía, que se aproxima a los siete u ocho años de edad. Sin embargo, un análisis reciente de la edad de esta especie realizado en la entrada del GC sugiere la posibilidad de que su edad de madurez y edad máxima sean mayores que las previamente reportadas (Mondragón-Sánchez 2015). El escenario alterno estimado con estos parámetros ubicó a la especie en la categoría r2M baja, lo cual indica una disminuida capacidad de recuperación y que la especie requiere de cuidadosas medidas de manejo.
Durante las décadas de 1980 y 1990, una flota pesquera artesanal proveniente de Chiapas capturó intensivamente tiburones a lo largo de la costa del Pacífico mexicano, incluyendo la entrada del GC, siguiendo su migración (Pérez-Jiménez et al. 2005). Carcharrhinus falciformis fue una de las especies más apreciadas por estos pescadores, y las capturas estaban conformadas principalmente por organismos adultos (Furlong-Estrada y Barragán-Cuencas 1997). Esta flota desapareció a principios de la década del 2000 (Bizarro et al. 2009b), probablemente debido a la disminución en el rendimiento causada por la reducción de algunas poblaciones de tiburón. Es probable que la actual estabilidad en las capturas de C. falciformis también este asociada con el decremento de la presión pesquera sobre los adultos reproductores.
Los escenarios 1.50M y 1.25M, señalados como más acordes con las características biológicas de los tiburones, indican que todas las especies analizadas tienen una baja productividad y sus poblaciones son incapaces de soportar un régimen de explotación intensa. Sólo R. longurio presentaría una productividad media e hipotéticamente sería capaz de sostener una pesquería dirigida, pero aun así deben implementarse medidas de manejo cuidadosas.
La consistencia en la proporción de captura de estas tres especies en las últimas tres décadas, así como la estabilidad de los desembarques en Nayarit, sugiere una aparente estabilidad en sus poblaciones. Sin embargo, la estabilidad también podría relacionarse con ciertos aspectos de la pesquería artesanal que opera en esta área y que inadvertidamente han contribuido en el mantenimiento de las capturas.
En conclusión, de acuerdo con los desembarques y la composición de la captura, estas tres especies de tiburones siguen mostrando signos de estabilidad en la entrada del GC. En el caso de S. lewini y C. falciformis, es probable que los cambios en la pesquería jueguen inadvertidamente un papel más importante en su aparente estabilidad, puesto que sus características de historia de vida (capacidad de resiliencia) les proveen de una baja productividad biológica. Pero en el caso de R. longurio, las características de historia de vida le proveen de una mayor productividad biológica y, en consecuencia, pueden tener un papel importante en su resiliencia. La aplicación efectiva de las medidas de manejo, como la reciente aplicación de la veda (Diario Oficial de la Federación, México, 11 de junio de 2012) establecida en aguas mexicanas para proteger algunas especies de tiburón durante su época de reproducción, es necesaria. Además, son urgentes las investigaciones acerca de las tendencias de captura e índices de abundancia para determinar los niveles óptimos de extracción en la región.
AGRADECIMIENTOS
Este estudio fue financiado por el Instituto Nacional de Pesca (INAPESCA) de México. El primer autor fue apoyado con una beca doctoral del Consejo Nacional de Ciencia y Tecnología (CONACYT, México). Agradecemos los valiosos comentarios de Elizabeth Brooks para mejorar el manuscrito.











 nueva página del texto (beta)
nueva página del texto (beta)