INTRODUCCIÓN
Las praderas de fanerógamas marinas se distribuyen por todo el mundo y se encuentran entre los ecosistemas marinos más productivos, proporcionando muchos bienes y servicios; sin embargo, también se encuentran entre los ecosistemas costeros más amenazados, con tasas de pérdida comparables a las de los arrecifes coralinos y manglares (Waycott et al. 2009). Aunque la pérdida de fanerógamas marinas ha sido atribuida a varias causas, la sedimentación es una de las principales (Short y Wyllie-Echeverria 1996, Duarte 2002, Orth et al. 2006, Cabaço et al. 2008), ya que éstas típicamente se encuentran en aguas someras y sustratos suaves donde son más susceptibles a ser enterradas por procesos físicos que redistribuyen los sedimentos (Marbà et al. 1994, Cabaço y Santos 2007). Las fanerógamas marinas son particularmente sensibles a una sedimentación intensa (Marbà y Duarte 1994, Duarte et al. 1997, Terrados 1997).
Las comunidades macrofaunales que habitan las praderas marinas también se ven afectadas por cambios en la dinámica de la sedimentación costera. Los eventos de sedimentación, ya sea naturales o antropogénicos, pueden provocar asfixia y mortalidad (e.g., Peterson et al. 2000, Thrush et al. 2004, Erftemeijer y Robin Lewis 2006, Colosio et al. 2007) si los animales no pueden moverse o lidiar con el enterramiento. La respuesta de las comunidades bentónicas al enterramiento, al igual que su recuperación, depende de factores como el tamaño de grano, la morfología costera (e.g., Martin et al. 2005, Colosio et al. 2007) y la habilidad de las especies para migrar a la superficie del sedimento recién depositado (Schratzberger et al. 2000, Hinchey et al. 2006). Los eventos de enterramiento a diferentes escalas espaciales y temporales pueden ser un factor determinante para las comunidades de macrofauna.
La fanerógama marina Cymodocea nodosa (Ucria) Ascherson, de amplia distribución en el mar Mediterráneo, llega a formar grandes praderas en zonas someras de lagunas costeras y ensenadas resguardadas (Marbà et al. 1996). También proporciona alimento y refugio a diferentes comunidades de invertebrados y peces (Tuya et al. 2001, Espino et al. 2011). No obstante, esta especie crece en zonas dinámicas con importante movimiento sedimentario (Duarte y Sand-Jensen 1990, Gambi et al. 1998). Los efectos de la sedimentación en C. nodosa han sido documentados previamente, pero existen pocos trabajos de los efectos en la fauna asociada. En este estudio se realizó un experimento manipulativo en el campo para examinar los efectos de un enterramiento súbito y puntual a pequeña escala sobre la fauna bentónica associada a C. nodosa. Según nuestro conocimiento, éste es el primer estudio que evalúa cómo la sedimentación afecta la comunidad macrofaunal asociada a C. nodosa. Específicamente, se analizó la respuesta durante varios días (5 días) y varias semanas (54 días) de la comunidad macrofaunal associada a C. nodoso a un evento único de enterramiento moderado (7 cm) o intenso (13 cm).
MATERIALES Y MÉTODOS
Sitio de estudio y diseño experimental
El sitio de estudio fue una pradera mixta de C. nodosa, Posidonia oceanica y Caulerpa prolifera, de aproximadamente 1 m de profundidad, localizada cerca del Centro de Investigación Marina de Santa Pola (CIMAR) en el cabo de Santa Pola, sureste de España (Fig. 1). Dentro del área de estudio, se identificaron nueve parches dominados principalmente por C. nodosa donde se establecieron tres parcelas de 1 m2, separadas entre sí por una distancia de 1 m, para cada tratamiento de enterramiento (enterramiento intenso, enterramiento moderado y sin enterramiento [control]). Los tratamientos fueron asignados aleatoriamente a las parcelas. Para no interferir con el movimiento de la fauna, no se emplearon paredes rígidas para delimitar las parcelas, que se marcaron empleando únicamente barras de hierro y boyas en las esquinas. Antes del enterramiento, se realizaron tres conteos al azar de la densidad de los haces de C. nodosa en cada parcela con un cuadrado de metal de 10 × 10 cm.

Figura 1 Representación gráfica (fuera de escala) del montaje experimental en frente de la playa del Centro de Investigación Marina de Santa Pola (CIMAR), SE de España. Los cuadros negros indican las parcelas experimentales, y las letras indican el tratamiento de enterramiento (c = control, m = moderado, i = intenso) y los números la réplica.
El día 0 del experimento se recolectó sedimento de la playa adyacente, compuesto principalmente por arena fina, (típico de eventos súbitos de enterramiento en esta región del Mediterráneo; Manzanera et al. 1998, 2011; González-Correa et al. 2009). Después de retirar los fragmentos de desechos grandes (e.g., piedras, palos, basura, etc.), el sedimento se colocó en contenedores que fueron transportados en una embarcación pequeña a las praderas marinas, donde se tuvo cuidado de minimizar el pisoteo del hábitat. En cada parcela, un tubo de ~0.5 m de diámetro se sostuvo aproximadamente 30 cm por arriba del fondo para que el otro extremo del tubo quedara expuesto por arriba de la línea del agua. El tubo fue utilizado como embudo para vertir el sedimento sobre la parcela. Se hizo un esfuerzo para distribuir la arena homogéneamente en toda la parcela y se usó un tubo de respiración para observar el evento de enterramiento. Las mediciones de la profundidad del sedimento realizadas en toda la parcela confirmaron que se virtieron aproximadamente 7 y 13 cm de sedimento sobre las parcelas sometidas a enterramiento moderado o intenso, respectivamente (ver Fig. 2). El enterramiento moderado cubrió como la mitad de la superficie foliar de C. nodosa y el intenso casi toda. El experimento comenzó el 1 de septiembre de 2011 (día 0) y finalizó el 25 de octubre de 2011 (día 54).
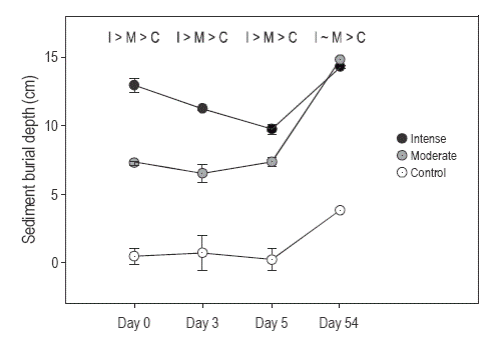
Figura 2. Profundidad del sedimento de enterramiento en cada tratamiento al tomar un núcleo de sedimento para evaluar la macrofauna. Se tomaron tres muestras para cada tratamiento en los días 0, 3 y 5, y dos muestras para los tratamientos control y de enterramiento intensivo en el día 54. Se muestra la profundidad del sedimento en la única parcela de enterramiento moderado que sobrevivió al día 54 como referencia. Las letras indican las diferencias entre los tratamientos según la prueba HSD de Tukey por pares después de detectar una interacción significativa; las pruebas por pares se realizaron para cada tiempo.
Dinámica de enterramiento y mediciones de las plantas
Para evaluar la consistencia de los tratamientos, se midió la profundidad del sedimento vertido en las parcelas el día 0, inmediatamente después del enterramiento, y los días 3, 5, y 54 después de añadir el sedimento. Se insertó al azar una regla en el sedimento hasta alcanzar el fondo firme y se registraron un promedio de cinco mediciones por parcela. El fondo natural era compacto y fácilmente distinguible de la arena añadida por presentar resistencia a la regla. También se vigiló si había sedimentación en las parcelas no enterradas (parcelas control) durante el experimento midiendo la distancia entre la parte superior de las barras de hierro y el fondo. El depósito de sedimento en las parcelas control después del enterramiento se derivó como la diferencia entre la distancia de la parte superior de la barras de hierro y el fondo ese día y la distancia medida el día 0.
También se midió la superficie foliar el día 0 antes del enterramiento y el día 5 después del evento. En cinco sitios aleatorios de cada parcela, se midió la longitud de la superficie foliar (i.e., longitud de la parte inferior a la parte superior de la hoja más larga entre los haces ubicados dentro de un círculo de ~3 cm alrededor de la regla); las cinco mediciones se promediaron para obtener una superficie foliar media por parcela. Se calcularon los cambios en la superficie foliar como la diferencia entre el valor medio 5 días después del enterramiento y el valor antes del evento. Reconocemos que las mediciones de fanerógamas marinas de sólo 5 días tienen un valor limitado, pero consideramos que esta información representa un resultado adicional potencialmente útil para realizar comparaciones con reportes previos sobre cómo responde la foliación a un evento de enterramiento. Una cuantificación minuciosa de los efectos de enterramiento sobre C. nodosa no era el objetivo de este experimento, sino más bien la respuesta de su comunidad macrofaunal ya que ha sido poco estudiada.
Mediciones de la macrofauna
Para evaluar la respuesta de la comunidad de fauna macrobentónica asociada a C. nodosa al enterramiento, se recolectaron núcleos de sedimento con un tubo de PVC (8.3 cm de diámetro) en cada parcela antes del enterramiento y en los días 3, 5 y 54 después del evento. Se insertó el nucleador dentro del sedimento añadido y después dentro del sedimento natural hasta una profundidad de 10 cm. Esto equivalió a núcleos de aproximadamente 10 cm para las parcelas control, 17 cm para las parcelas expuestas a enterramiento moderado (10 cm más los 7 cm añadidos) y 23 cm para las parcelas expuestas a enterramiento intenso (10 cm más los 13 cm añadidos) (ver Fig. 2). Los núcleos se colocaron en bolsas de luz de malla de 0.5 mm, se lavaron en el campo y se transportaron al laboratorio donde se tamizaron cuidadosamente a través de una malla de 0.5 mm de abertura. La macrofauna fue identificada hasta el nivel taxonómico más bajo posible según el tiempo y la experiencia y, por lo tanto, algunos taxones se combinaron en categorías de orden superior. Los taxones (N = 12) considerados aquí son los siguientes: Nemertea y Nematoda (nivel filo); Gastropoda, Bivalvia, Polychaeta y Pycnogonida (nivel clase); Oligochaeta (nivel subclase); y Amphipoda, Cumacea, Decapoda, Harpacticoida e Isopoda (nivel orden). Todas las etapas de vida encontradas fueron adscritas a los taxones apropiados. Reconocemos que este nivel de resolución sólo puede detectar los cambios en la composición de la comunidad macrofaunal que suceden a un alto nivel taxonómico (i.e., orden y superior). Algunos investigadores han mostrado que los impactos de eventos estresantes pueden volverse menos perceptibles cuando se cambia el análisis de niveles taxonómicos bajos (i.e., especie, género y familia) a más altos; sin embargo, se han detectado tendencias similares con varios niveles taxonómicos (e.g., Warwick 1988, Olsgard y Somerfield 2000, Dethier y Schoch 2006). Por lo tanto, nuestro estudio podría estar omitiendo algunos de los impactos del enterramiento en la composición de la comunidad que suceden a bajos niveles taxonómicos.
Los organismos recolectados antes del enterramiento y en los días 3 y 5 después del evento fueron procesados inmediatamente en el laboratorio, donde fueron identificados, contados y clasificados como vivos o muertos. Los crustáceos y anfípodos fueron clasificados como vivos si se movían o si se movían en respuesta a la estimulación; los bivalvos se clasificaron como vivos si la concha estaba bien cerrada y como muertos si presentaban tejido dentro de una concha abierta; los poliquetos y otros gusanos fueron clasificados como vivos si el animal estaba entero y se movía, o si se movía en respuesta a la estimulación, y fueron clasificados como muertos si sólo se encontraba la cabeza. Los organismos recolectados el día 54 después del enterramiento fueron fijados en formalina para su posterior identificación. Las mediciones de la macrofauna incluyeron abundancia, riqueza taxonómica (i.e., número de taxones) y el índice de diversidad de Shannon-Wiener (H', definido como ( (Pi × log (Pi)) donde Pi es la abundancia proporcional de cada taxón). La abundancia se expresó por área de superficie y por volumen. La abundancia por área de superficie corresponde al número de individuos dividido por el área de superficie del núcleo. La abundancia por volumen corresponde al número de individuos dividido por el volumen total muestreado por el núcleo (i.e., 10 cm por debajo de la superficie del fondo más el sedimento por encima en las parcelas enterradas).
Análisis estadísticos
Los cambios en la profundidad del sedimento en las parcelas fueron evaluados mediante un análisis de varianza (ANOVA) de dos vías, con la intensidad de enterramiento y el tiempo desde el enterramiento como factores, seguido por comparaciones múltiples con la prueba HSD (honestly significant difference) de Tukey según fuera apropiado. Los cambios en la altura de la superficie foliar fueron comparados entre los tres tratamientos de enterramiento mediante un ANOVA de una vía, seguido por comparaciones múltiples con la prueba HSD de Tukey.
La respuesta de la macrofauna al enterramiento se analizó mediante un ANOVA de dos vías con medidas repetidas, con intensidad de enterramiento como factor entresujetos y tiempo como el factor intrasujetos. Se realizaron análisis separados para la fauna viva y total (i.e., viva + muerta). Estuvimos particularmente interesados en el término de interacción entre la intensidad del enterramiento y el tiempo ya que este término mostró si las diferencias (o falta de diferencias) en las métricas de la fauna medidas entre las parcelas antes del evento permanecían inalteradas (interacción no significativa) o se habían modificado (interacción significativa) después del enterramiento de las parcelas. Así, una interacción significativa indicaría impactos de enterramiento significativos, mientras que una interacción no significativa indicaría impactos no detectables. Si se obtuvo un término de interacción significativa, se realizaron comparaciones múltiples con la prueba HSD de Tukey entre los tratamientos para investigar más a fondo la respuesta de la macrofauna.
Para todos los análisis, la significación se definió como α = 0.05. El índice de diversidad de Shannon-Wiener se calculó con Primer v6.0 y todas las pruebas estadísticas (incluyendo el análisis del poder estadístico para las pruebas realizadas) se realizaron con SigmaPlot 11.0, después de confirmar los supuestos de las pruebas paramétricas.
RESULTADOS
Antes del enterramiento, la densidad de C. nodosa varió, entre parcelas, de 467 ± 58 a 733 ± 102 haces m-2 y no hubo diferencias significativas entre tratamientos (F 2,6 = 3.09; P = 0.12). Los tres tratamientos mostraron un aumento en la altura de la superficie foliar 5 días después del comienzo del experimento, pero el aumento fue mayor en las parcelas sometidas a enterramiento intenso (Fig. 3) (F 2,6 = 6.80; P = 0.029; prueba HSD de Tukey, control vs intenso P = 0.0312, control vs moderado P = 0.0671, moderado vs intenso P = 0.8115).
El experimento fue diseñado para estudiar la respuesta de la macrofauna a un enterramiento durante un periodo de casi dos meses (54 días); sin embargo, inesperadamente se perdieron cuatro de las nueve parcelas (una parcela control, dos parcelas de enterramiento moderado y una de enterramiento intenso) antes del día 54 del experimento. No fue posible encontrar las piquetas para esas parcelas y el sedimento vertido en las tres parcelas perdidas había sido arrastrado por el mar por lo que estas parcelas eran indistinguibles del fondo natural circundante. Esto resulta ser interesante ya que sugiere que los eventos de enterramiento súbito y puntual a pequeña escala son de poca duración en el sitio de estudio, el cual se ubica en una zona abierta y típicamente expuesta a vientos intensos y fuerte oleaje. Esta pérdida generó un desbalance en el diseño del ANOVA y, de hecho, no hubo una replicación para enterramiento moderado al día 54. Además, las dos parcelas control restantes ganaron sedimento (~3 cm, ver abajo) y ya no podían ser consideradas controles verdaderos. Por lo tanto, restringimos el ANOVA de dos vías con medidas repetidas a los primeros 5 días del experimento. Para un mayor entendimiento de los efectos del enterramiento a lo largo del experimento (54 días), se compararon las parcelas con enterramiento intenso a los días 5 y 54 mediante una prueba t por pares y se puso esta comparación en contexto de los resultados del ANOVA para los primeros 5 días.

Figura 3 Efecto de un enterramiento a pequeña escala sobre la altura de la superficie foliar de Cymodocea nodosa medida antes del enterramiento y 5 días después del evento. Las letras indican los resultados de la prueba HSD de Tukey. En todas las figuras, los datos se presentan como la media ± error estándar.
Dinámica sedimentaria y respuesta a enterramiento durante 5 días
Al comparar la profundidad del sedimento en los tres tratamientos durante 5 días de enterramiento se observó una interacción significativa entre el tratamiento y el tiempo (F 4,15 = 3.63; P = 0.0292; Fig. 2). Para cada tiempo se realizaron pruebas por pares y los tres tratamientos permanecieron distintos durante los primeros 5 días del experimento (prueba HSD de Tukey, P < 0.05; Fig. 2). A pesar de que la profundidad del sedimento en las parcelas sometidas a enterramiento intenso disminuyó y presentó una tendencia a igualarse a la de las parcelas sometidas a enterramiento moderado, la profundidad del sedimento en las parcelas de enterramiento tanto moderado como intenso fue mayor que en las parcelas control (Fig. 2).
Se identificó un total de 12 taxones superiores de macrofauna bentónica (Tabla 1). Los bivalvos, poliquetos y gasterópodos fueron los taxones dominantes, y entre los menos comunes se encontraron los oligoquetos, decápodos y anfípodos. Los resultados en cuanto a abundancia fueron similares analizados ya sea por área de superficie o volumen (Tabla 2). No se observó una interacción significativa entre tratamiento y tiempo para la fauna viva o total expresada en base al área de superficie o volumen (Tabla 2, Fig. 4), lo que sugiere que el enterramiento no afectó significativamente la abundancia macrofaunal.
Se encontró una interacción significativa entre tratamiento y tiempo para la riqueza de taxones vivos, lo que indica que el enterramiento tuvo un efecto significativo (Tabla 2, Fig. 5). La riqueza de taxones vivos no difirió significativamente entre los tratamientos antes del enterramiento; sin embargo, para el día 3 después del evento, las parcelas control presentaron una mayor riqueza que las parcelas sometidas a enterramiento moderado e intenso. Curiosamente, estas diferencias significativas entre los tratamientos habían desaparecido para el día 5 (Fig. 5), lo que sugiere una recuperación rápida de los impactos negativos del enterramiento observados durante los primeros tres días del experimento. En las parcelas control, consistentemente se observaron gasterópodos, bivalvos y poliquetos, pero el día 3 también se encontraron decápodos, isópodos, oligoquetos y anfípodos, por lo que se registraron los valores más altos de riqueza durante el experimento. Las parcelas enterradas también consistentemente presentaron gasterópodos, bivalvos y poliquetos, y ocasionalmente nematodos o copépodos. La riqueza taxonómica total (i.e., individuos vivos + muertos) aparentemente no resultó afectada por el enterramiento según lo demuestra el término de interacción no significativa (Tabla 2, Fig. 5). El enterramiento aparentemente tampoco afectó la diversidad viva y total (Tabla 2, Fig. 5).
Tabla 1 Abundancia media (±DE) por decímetro cuadrado de la fauna total (viva + muerta) de taxones superiores encontrada en el prado de la fanerógama marina Cymodocea nodosa examinado en un experimento de enterramiento a escala pequeña.

Tabla 2 Resultados de los análisis de varianza de dos vías con medidas repetidas realizados para la abundancia macrofaunal (# individuos), riqueza de taxones (# taxones) y el índice de diversidad de Shannon-Weiner (H'). Los datos se analizaron por área de superficie y por volumen para abundancia, con tratamiento como factor y tiempo como la medida repetida. La potencia (1 - β) es la potencia de la prueba realizada.

Dinámica sedimentaria durante 54 días y comparación de las parcelas sometidas a enterramiento intenso entre los días 5 y 54
Después de 54 días del experimento se observó sedimentación adicional en las parcelas aún existentes (ca 3, 8 y 5 cm en las parcelas control, de enterramiento moderado y de enterramiento intenso, respectivamente; Fig. 2). Esto sugiere que, una vez depositado, el sedimento en el sitio de estudio se mueve de un lugar a otro con bastante rapidez, una sugerencia que también es respaldada por el hecho de que tres de las parcelas originalmente enterradas habían desaparecido para el día 54. Las dos parcelas de enterramiento intenso restantes, sin embargo, presentaron una profundidad de sedimento significativamente mayor que las parcelas control (t = 105, P = 0.006).
Hay que reconocer que las parcelas control que aún permanecían para el día 54 ya no servían como verdaderos controles por el depósito inesperado de sedimento. No obstante, aprovechamos el hecho que dos de las parcelas sometidas a enterramiento intensivo aún permanecían para el día 54 y se compararon, mediante pruebas t por pares, entre los días 5 y 54 para entender mejor los efectos del enterramiento. No se observaron diferencias significativas para la abundancia total analizada en base al área de superficie (t = 0.618, P = 0.648, potencia = 0.093) o volumen (t = 0.394, P = 0.761, potencia = 0.093), ni para la riqueza total (t = 9.0, P = 0.07, potencia = 0.51); sin embargo, la diversidad total fue mayor el día 54 que el día 5 (t = 158.31, P = 0.004, potencia = 1.00).

Figura 4. Abundancia media de la macrofauna bentónica asociada a Cymodocea nodosa en respuesta a 54 días de enterramiento por sedimento. Los paneles (a) y (c) representan la abundancia de fauna viva y total, respectivamente, por área de superficie. Los paneles (b) y (d) representan la fauna viva y total, respectivamente, por volumen.
DISCUSIÓN
Este experimento fue diseñado para examinar los efectos de un enterramiento súbito y puntual a pequeña escala en la comunidad de fauna macrobentónica asociada a C. nodosa. Debido a eventos inesperados (i.e., pérdida de cuatro de las nueve parcelas experimentales por dispersión de sedimento), se enfocó principalmente en los resultados obtenidos para los primeros 5 días del experimento. Tres días después del enterramiento se observó una disminución significativa de la riqueza de taxones vivos en las parcelas enterradas en relación con las parcelas control. La disminución fue similar para las parcelas sometidas a enterramiento moderado (7 cm) e intenso (13 cm) en relación con las parcelas control. Estudios previos también han documentado una reducida diversidad taxonómica después de eventos de enterramiento en Florida (Rakocinski et al. 1996) y Carolina del Norte (Peterson et al. 2000). El enterramiento parece tener efectos adversos para algunos de los taxones encontrados en este estudio; sin embargo, los gasterópodos, bivalvos y poliquetos consistentemente aparecieron en los núcleos, independientemente del tratamiento o tiempo, lo que sugiere que estos taxones en particular poseen mecanismos para hacer frente a los eventos de sedimentación. Estos mecanismos probablemente sean específicos de las especies (como lo demuestran, e.g., Defeo et al. 1997, Leewis et al. 2012, Van Tomme et al. 2013) y dependientes de la profundidad, duración y frecuencia de los enterramientos (e.g., Nichols et al. 1978, Lynch 1994, Schratzberger et al. 2000). Varias especies son capaces de migrar distancias considerables a través del sedimento y algunos inidividuos pueden llegar hasta profundidades de 30 cm (i.e., poliquetos en una pradera de C. nodosa en las islas Canarias, Brito et al. 2005). En el presente estudio no observamos un impacto significativo en la riqueza taxonómica total (e.g., individuos vivos + muertos), posiblemente porque la fauna muerta en las parcelas enterradas elevó la riqueza taxonómica en esos parceles a niveles similares a los de las parcelas control. No obstante, el poder estadístico para el análisis de la riqueza taxonómica total fue baja y esto también podría explicar por qué el enterramiento no afectó significativamente esta métrica.
Tampoco se observaron efectos significativos del enterramiento sobre la abundancia (analizada ya sea por área de superficie o volumen) o diversidad de individuos vivos. Reportes previos han documentado impactos significativos en estas métricas macrofaunales (e.g., Peterson et al. 2000, Menn et al. 2003), pero otros no. Por ejemplo, Gorzelany y Nelson (1987) no observaron un impacto significativo en la abundancia o riqueza de fauna bentónica en respuesta a un enterramiento debido al relleno de una playa en la costa este de Florida, y Leewis et al. (2012) no encontraron efectos negativos a largo plazo de la regeneración de playas sobre la abundancia de cuatro especies dominantes de la macrofauna playera en los Países Bajos. En el presente estudio, el poder estadístico para los análisis de abundancia y diversidad fue bajo y es probable que no se hayan detectados efectos significativos del enterramiento en estas métricas debido al tamaño de muestra limitado. De hecho, las gráficas de la abundancia (Fig. 4a, b) y diversidad (Fig. 5b) de individuos vivos visualmente sugieren un efecto negativo del enterramiento sobre estas métricas, especialmente el día 3, pero las diferencias no son estadísticamente significativas.

Figura 5. Riqueza media de la macrofauna viva (a) y total (c) en respuesta a 54 días de enterramiento. Los paneles (b) y (d) representan la diversidad media de la macrofauna viva y total (índice de Shannon-Wiener, H'), respectivamente. Las letras en (a) señalan los resultados de la comparación de los tratamientos de enterramiento en cada tiempo de muestreo mediante la prueba HSD de Tukey, depués de un término de interacción significativa del análisis de varianza de dos vías con medidas repetidas; ns indica no significativo.
Además de la baja replicación, la variabilidad inherente de la distribución típicamente exhibida por las comunidades macrofaunales (e.g., Minshall y Minshall 1977, Underwood y Chapman 1996) representa otra razón potencial de por qué el enterramiento no tuvo un efecto significativo en la abundancia y diversidad de individuos vivos. Es posible que la abundancia de algunos taxones haya sido menor debido a la temporada del año y/o la hora del día en que se realizaron los muestreos. Nuestro experimento comenzó a principios de septiembre y, según Gambi et al. (1998), la diversidad y abundancia de poliquetos en otras zonas someras del Mediterráneo es menor en verano. Así mismo, nuestros muestreos se realizaron durante el día y Raso et al. (2006) registraron una mayor abundancia de decápodos durante la noche y una ausencia o baja presencia de varias especies de cangrejos ermitaños durante el día en praderas de C. nodosa. Por lo tanto, las bajas abundancias relacionadas con forzamientos estacionales o diurnos podrían haber contribuido a enmascarar aún más los impactos del enterramiento. No se observaron efectos estadísticamente significativos en la abundancia y diversidad total, probablemente porque, además de las razones mencionadas arriba, los animales muertos elevaron estas métricas en las parcelas enterradas a valores similares a los de las parcelas control.
Nuestros resultados sugieren que, a pesar de la evidencia de efectos deleitérios sobre la comunidad de macroinvertebrados 3 días después del enterramiento, se pueden observar signos de recuperación tan pronto como 5 días depués del evento. La riqueza de taxones vivos en las parcelas enterradas fue significativamente menor que en las parcelas control 3 días después del enterramiento, pero esta menor riqueza no persistió después de 5 días. Esto podría deberse más bien a una disminución de la riqueza en las parcelas control del día 3 al día 5 que a un aumento en las parcelas enterradas durante estos días. Las gráficas de la abundancia y diversidad de individuos vivos sugieren que las diferencias entre las parcelas control y las enterradas el día 3 son menos aparentes el día 5, pero esto es sólo una especulación ya que no se encontraron diferencias estadísticamente significativas entre las gráficas para estas métricas.
La comparación de las parcelas después de 5 y 54 días de enterramiento intensivo proporciona mayor evidencia de que las comunidades macrofaunales pueden recuperarse de un enterramiento súbito y puntual. Los valores de abundancia total (tanto por área de superficie como volumen) y de riqueza total registrados el día 54 son altos en comparación con los registrados el día 5, aunque no se detectaron diferencias significativas. La diversidad total de las parcelas sometidas a enterramiento intensivo fue significativamente mayor el día 54 que el día 5. Así mismo, estas comparaciones indican una elevada abundancia, riqueza y diversidad en las dos parcelas del tratamiento intensivo que aún existían para el día 54 en comparación con los valores registrados después de 5 días. La evidencia de recuperación proporcionada por la comparación de las parcelas sometidas a enterramiento intensivo durante 5 y 54 días sólo puede ser conjetural, ya que (1) la mayoría de las diferencias no fueron estadísticamente significativas, (2) para el día 54 ya no existían controles verdaderos y (3) no se determinó la abundancia relativa de la fauna viva y muerta para los conteos totales. No obstante, estos resultados sugieren que la macrofauna se puede recuperar de un enterramiento repentino y puntual a pequeña escala en el plazo de unas semanas. De hecho, estudios previos han documentado una recuperación total o parcial de la macrofauna después de enterramientos de meses a años de duración (e.g., Hackney et al. 1996, Rakocinski et al. 1996).
A pesar de que los resultados del presente trabajo son algo limitados, ofrecen evidencia sugerente de que los eventos repentinos y puntuales de enterramiento a pequeña escala pueden tener efectos negativos sobre las comunidades macrobentónicas de taxones superiores asociadas a C. nodosa, y que las comunidades se pueden recuperar dentro de unas semanas. Aquí limitamos nuestra discusión a taxones superiores y reconocemos que una evaluación de los taxones de nivel inferior proporcionaría respuestas específicas de los taxones y un mejor entendimiento de los efectos de enterramiento en estas praderas de fanerógamas marinas. Según nuestro conocimiento, éste es el primer estudio que examina directamente los efectos de enterramiento en la macrofauna bentónica asociada a C. nodosa y, por lo tanto, consideramos que los resultados tienen valor ya que este tema ha sido poco estudiado. Una recuperación rápida por las comunidades macrofaunales de taxones superiores en las praderas de C. nodosa podría ser una adaptación al frecuente depósito y movimiento de sedimentos en zonas costeras someras donde típicamente se encuentran estas praderas. Se necesitan más estudios para caracterizar completamente los efectos de los eventos de enterramiento de diferente intensidad, duración y frecuencia sobre las comunidades macrofaunales en las praderas marinas. Se debe prestar especial atención a las praderas en zonas someras con alta sedimentación, así como a factores que pueden regular la respuesta de la macrofauna al enterramiento, tal como la competencia intraespecífica e interespecífica, el potencial migratorio, los procesos de facilitación y la preferencia de sustrato.
AGRADECIMIENTOS
Los autores agradecen a la Universidad del Sur de Alabama, Dauphin Island Sea Lab, la Universidad de Alicante y CIMAR su colaboración y apoyo para poder realizar este experimento como parte de un programa para estudiar en el extranjero. DJ Dalrymple, ES Darrow y MN Schrandt recibieron apoyo del Departamento de Ciencias Marinas de la Universdidad del Sur de Alabama. Se agradece a los revisores anónimos cuyos comentarios ayudaron a mejorar el manuscrito.
Traducido al español por Christine Harris.











 nueva página del texto (beta)
nueva página del texto (beta)


