INTRODUCCIÓN
Los dinoflagelados fotosintéticos del género Symbiodinium viven en simbiosis con una amplia variedad filética de hospederos invertebrados marinos que incluye a corales, anémonas y medusas. La mayoría de los clados de Symbiodinium son simbiontes obligados de los corales formadores de arrecife, y por ello, los arrecifes de coral son altamente dependientes de la maquinaria fotosintética de estos microorganismos (Trench 1993). Se han llevado a cabo muchos estudios que han intentado elucidar las múltiples vías por las cuales los mecanismos fisiológicos y de interacción simbiótica son controlados y regulados en estos microorganismos fotosintéticos. Por ejemplo, han habido reportes del efecto de la temperatura elevada sobre la simbiosis (Gates et al. 1992), del blanqueamiento mediado por ROS (Lesser 1996, Franklin et al. 2004), del origen del simbiosoma (Wakefield y Kempf 2001), del reconocimiento coraldinoflagelado (Wood-Charlson et al. 2006), de las diferencias genéticas en Symbiodinium (Loram et al. 2007), entre otros. Sin embargo, la mayoría de estos estudios se han llevado a cabo usando estrategias bioquímicas y de biología celular, y las estrategias genómicas y transcriptómicas, sólo han sido aplicadas recientemente (Kuo et al. 2004, Chen et al. 2005, Rodriguez-Lanetty et al. 2006, Forêt et al. 2007, Leggat et al. 2007, Miller et al. 2007, Schwarz et al. 2008, Voolstra et al. 2009, Shoguchi et al. 2013, revisado en Shinzato et al. 2014).
Las técnicas de transformación proveen una herramienta poderosa que permite la introducción y expresión de genes específicos en un organismo vivo para estudios de genómica funcional. De esta manera, los métodos reproducibles y confiables de transformación genética son una herramienta clave para entender la fisiología y biología celular de estos dinoflagelados fotosintéticos. En un aspecto más importante, estas herramientas son esenciales para analizar y entender los mecanismos celulares y moleculares subyacentes a la simbiosis entre cnidarios y dinoflagelados, como la señalización intersocio, la coordinación de la división celular y el control del transporte de nutrientes, y para identificar genes blanco y sus vías asociadas involucradas en el establecimiento y mantenimiento de la simbiosis. La transformación exitosa de microalgas mediante perlas de vidrio ha sido documentada previamente (Kindle 1990, León-Bañares et al. 2004); sin embargo, a la fecha sólo existe un reporte de la transformación de los dinoflagelados del género Symbiodinium en cultivo (ten Lohuis y Miller 1998). En este trabajo reportamos un método simple de transformación en presencia de perlas de vidrio y polietilenglicol (PEG), lo cual permitió la incorporación de plásmido en las células dinoflageladas simbióticas del género Symbiodinium en cultivo. Usando este procedimiento, fuimos capaces de transformar tres diferentes clados de Symbiodinium en cultivo con un vector pCB302 que contenía una construcción de gfp-AtRACK1C y un gen de resistencia para el herbicida Basta basado en glufosinato de amonio. Adicionalmente, otro clado de Symbiodinium, S. pulchrorum fue transformado con un vector pCAMBIA-1390 que contenía el dominio 2 de unión a actina de la fimbrina (FABD2) fusionado a gfp y a un gen para selección con higromicina. La microscopía reveló la expresión exitosa de las proteínas gfp híbridas, que fue observada como la aparición gradual de fluorescencia amarilla a verde dentro de las células, al momento de la selección con el herbicida Basta o higromicina. Este es el primer reporte del uso de vectores dirigidos a plantas, perlas de vidrio y polietilenglicol para transformar estos dinoflagelados con pared celular.
MATERIALES Y MÉTODOS
Cultivos de células de Symbiodinium
Los cultivos de dinoflagelados de Symbiodinium kawagutii Trench & Blank (de ahora en adelante referido como S. kawagutii, Symbiodinium sp. Mf11.5b.1 (de ahora en adelante referido como S. Mf11), Symbiodinium microadriaticum ssp. microadriaticum (de ahora en adelante referido como S. KB8) y Symbiodinium pulchrorum R.K. Trench (de ahora en adelante referido como S. pulchrorum), fueron rutinariamente mantenidos en nuestro laboratorio en medio ASP8A bajo fotoperiodos cíclicos de 12 h luz/oscuridad a 25 ºC, y una intensidad de luz de 80 µmol quanta m-2 s-1 (Castillo Medina et al. 2013). Para el éxito de la transformación se requirió que los cultivos fueran axénicos. Esto fue logrado suplementando el medio ASP-8A con 50 µg mL-1 de kanamicina y 5 µg mL-1 de anfotericina B (ASP-8A-M). Todos los cultivos fueron manipulados en condiciones estériles en todo momento hasta el montaje para las observaciones en el microscopio.
Determinación del crecimiento de tres cultivos celulares de Symbiodinium en presencia de un herbicida que contiene glufosinato de amonio
Las células de S. kawagutii, S. Mf11, y S. KB8 (1 × 105 células mL-1), en fase logarítmica de crecimiento, fueron incubadas en medio ASP-8A con 1 mg mL-1 del herbicida glufosinato de amonio. Las densidades celulares fueron estimadas mediante conteo por duplicado con un hemocitómetro (Hausser Scientific, Horsham, PA) cada 2-3 días. Todos los tratamientos de los cultivos se llevaron a cabo por triplicado. Los datos se presentan como la media ± la desviación estándar.
Construcciones de plásmidos
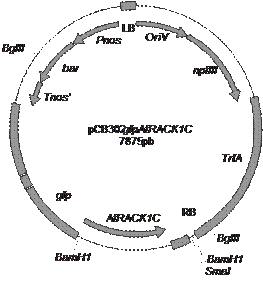
Un plásmido pCB302 fue construido para contener una fusión de gfp y AtRACK1C. El gen de AtRACK1C clonado en un vector pUNI51 (clona U13308) fue una amable donación del Instituto Salk. La secuencia codificante de AtRACK1C fue amplificada mediante PCR e insertada en el vector binario pCB302. La construcción fue mantenida y propagada en la cepa TOP10 de Escherichia coli. Esta construcción contiene un promotor doble CaMV35S del virus del mosaico de la coliflor y el gen bar para la resistencia al herbicida Basta (Fig. 1). El vector binario pCAMBIA-1390 (Cambia Labs, Brisbane, Australia) que contiene la secuencia codificante de FABD2 fusionado a la gfp mutada en S65T (sGFP pero referida como GFP, Wang et al. 2004) fue una amable donación del Dr. Elison Blancaflor (Samuel Roberts Noble Foundation, Ardmore, OK). Esta construcción tiene genes de resistencia a kanamicina e higromicina, y la fusión FABD2-gfp está bajo el control del promotor CaMV35S. Los plásmidos fueron purificados usando el sistema de purificación para ADN Wizard Plus SV Minipreps (Promega Corporation, Madison, WI), de acuerdo con las instrucciones del fabricante.
Transformación de Symbiodinium spp.
Se intentó un método de transformación para Symbiodinium y Amphidinium registrado previamente por ten Lohuis y Miller (1998), pero sustituimos las fibras de carburo de silicio (SiC) por perlas de vidrio para producir abrasión de la pared. Las transformaciones de S. kawagutii, S. Mf11 y S. KB8 se realizaron colocando 1.3 × 107 células en 1 mL de medio de cultivo en un tubo de plástico de 2 mL con fondo cónico (Denville Scientific, Inc., Metuchen, NJ) que contenía un volumen seco de 200 µL (aproximadamente 500 mg) de perlas de vidrio lavadas con ácido y estériles (Cat. No. G8772; 425-600 µm de tamaño de malla; Sigma, St. Louis, MO). Después, la suspensión se adicionó con 350 µL de 20% polietilenglicol (PEG-3500, Sigma), seguido de 50 µL que contenían 25 µg de plásmido para alcanzar un volumen final de 1.4 mL excluyendo el volumen de las perlas de vidrio. Después, el tubo fue agitado vigorosamente (4200 rpm) durante 90 s en un batidor de partículas (bead beater). Seguido a esta exposición al plásmido, las células se dejaron recuperando en medio ASP-8A por 24 h. Luego, las células transformadas fueron seleccionadas mediante la adición de 1 mg mL-1 de Basta (Bayer, Research Triangle Park, NC) y 50 µg mL-1 de kanamicina al medio de cultivo. Los cultivos fueron mantenidos en la misma solución bajo condiciones estándar de fotoperiodo y monitoreados para la aparición de fluorescencia verde. Para determinar la frecuencia de transformación, el conteo celular inicial (1.3 × 107) del cultivo usado para la transformación fue tomado como el total para la normalización. Se hicieron tres diferentes observaciones de alícuotas de 10 µL (para cada uno de los cultivos transformados evaluados) después de la selección, y las células verdes fluorescentes fueron cuantificadas en cada muestra. El número de células cuantificadas fue convertido a concentración de células y extrapolado al número de células totales multiplicando por el volumen total (25 mL). Los números totales de cada cultivo triplicado fueron promediados y se registró la media ± el error estándar. La frecuencia de transformación fue registrada como éste número por cada 106 células. Alternativamente, la construcción pCAMBIA1390 FABD2-gfp fue transformada en S. pulchrorum como se describió anteriormente pero usando 3 mg mL-1 de higromicina en el medio de cultivo para seleccionar a las células transformadas. La frecuencia de transformación no se determinó en este cultivo.
Microscopía
Las células fueron observadas bajo contraste de fases y epifluorescencia en un microscopio Zeiss Axioskop 40 (Carl Zeiss, Göttingen, Alemania) con los objetivos de 40× y 63× y el filtro de excitación/emisión de FITC. Los datos fueron adquiridos con una cámara Canon PowerShot A640 (Canon Inc., Japan) y el programa AxioVision (Carl Zeiss). La deconvolución fue realizada con el complemento DeconvolutionLab del programa NIH-ImageJ usando el algoritmo Tikhonov-Miller.
RESULTADOS
Transformación exitosa y reproducible de Symbiodinium
Cuando aplicamos nuestro procedimiento modificado a tres diferentes clados de Symbiodinium, pudimos observar, en algunas de las células, la fluorescencia verde de la expresión de GFP-AtRACK1C después de 8-26 días en el medio de selección (medio de cultivo ASP-8A con Basta, fig. 2a-f). En los cultivos de S. kawagutii (Fig. 2b) y S. KB8 (Fig. 2d) observamos mayormente células con fluorescencia roja proveniente de los pigmentos fotosintéticos y algunas células verdes fluorescentes, pero en los cultivos de S. Mf11 observamos más células verdes fluorescentes en esta etapa (Fig. 2f), indicando que las perlas de vidrio fueron efectivas para romper la pared celular, lo cual permitió la entrada del plásmido y su expresión dentro de las células. Usando este método, reproducimos exitosamente y obtuvimos una tasa de transformación por cada 106 células de 65 ± 5 para S. Mf11, 74 ± 8 para S. KB8 y 107 ± 7 para S. kawagutii. Aunque sólo unas pocas células transformadas de S. kawagutii fueron observadas en un estado temprano de selección (Fig. 2b), nosotros observamos que este clado fue el más susceptible a la transformación, pues consistentemente alcanzó el número más alto de células verdes fluorescentes después de la selección completa (datos no mostrados). Esto se reflejó en su mayor frecuencia de transformación (107 ± 7 transformantes por cada 106 células). El herbicida con glufosinato de amonio como el componente activo efectivamente promovió la muerte de las células no transformadas (Fig. 3). Por el contrario, las células de Symbiodinum transformadas que albergaban el gen de resistencia bar fueron capaces de sobrevivir después de la incubación en medio de selección con 1 mg mL-1 de Basta.

Figura 2 Transformación mediada por perlas de vidrio y PEG con el plásmido pCB302-gfp-AtRACK1C en Symbiodinium spp. Las células de Symbiodinium kawagutii (a, b), Symbiodinium KB8 (c, d) y Symbiodinium Mf11 (e, f) fueron transformadas usando perlas de vidrio, PEG y el plásmido pCB302-gfp-AtRACK1C. Las células fueron observadas bajo microscopía de contraste de fases (a, c, e) y epifluorescencia (b, d, f) después de 8 (a, b), 25 (c, d) ó 26 (e, f) días de selección con Basta. Las barras equivalen a 30 µm (a, b), 20 µm (c, d) y 25 µm (e, f).

Figura 3 Determinación del crecimiento de cultivos de células de Symbiodinium en presencia del herbicida con glufosinato de amonio. Células de (a) Symbiodinium KB8, (b) Symbiodinium Mf11 y (c) Symbiodinium kawagutii. Línea sólida: células en medio ASP-8A; línea discontinua: células en medio ASP-8A con 1 mg mL-1 de glufosinato de amonio. El conteo celular fue realizado usando un hemocitómetro cada 2-3 días durante 21 días. Los cultivos fueron crecidos y analizados por triplicado. Los datos son presentados como la media ± desviación estándar.
Para apoyar aún más nuestros hallazgos y la reproducibilidad del método, transformamos otro vector de expresión (pCAMBIA-1390-FABD2-gfp) en un clado diferente de Symbiodinium, S. pulchrorum, con un plásmido que contenía un gen de resistencia distinto (higromicina). Nuestro método de transformación con estas variantes fue también exitoso y fuimos capaces de obtener células transformadas mediante la selección en el medio ASP-8A que contenía higromicina (Fig. 4a, flecha hacia arriba, y 4b, d). En un estado temprano de selección, observamos una mezcla de células fluorescentes rojas no transformadas (Fig. 4a, flecha hacia abajo) y células transformadas (Fig. 4a, flecha hacia arriba), aun cuando ambas fueron idénticas bajo óptica de contraste de fases (Fig. 4c, flechas). Cuando la selección completa fue lograda, la observación bajo epifluorescencia de las células transformadas, a mayor aumento, reveló un patrón reticular fluorescente tipo rejilla de haces gruesos de microfilamentos en su mayoría (Fig. 4d, cabeza de flecha). Estos resultados indicaron que la transformación transitoria pudo ser lograda en un filotipo diferente de Symbiodinium usando un vector dirigido a plantas diferente de pCB302.
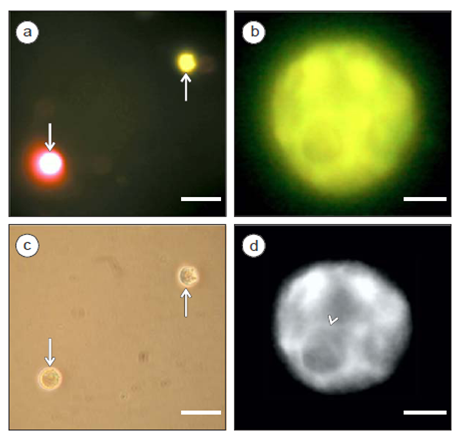
Figura 4. Marcaje in vivo del citoesqueleto de actina en células de Symbiodinium pulchrorum por transformación con un vector de expresión pCAMBIA-1390-FABD2-gfp (Wang et al. 2004). Imágenes de epifluorescencia convencional de células de S. pulchrorum después de la transformación con FABD2-gfp (a, b, d). En un estado de selección temprana en medio con higromicina, se detectó una población mezclada de células amarillas transformadas (a, flecha hacia arriba) y rojas no transformadas (a, flecha hacia abajo). La óptica de contraste de fases (c) no mostró diferencia entre las mismas células transformadas y no transformadas. Después de la selección completa, las observaciones a mayor aumento revelaron un patrón tipo rejilla de haces gruesos de microfilamentos (d, cabeza de flecha). La imagen en (b) estuvo sujeta a deconvolución (ver Materiales y Métodos), lo cual resultó en una imagen con resolución mejorada en (d). Las barras equivalen a 30 µm (a, c) y a 5 µm (b, d).
DISCUSIÓN
En este trabajo, hemos aplicado exitosamente, por primera vez, un procedimiento de transformación mediado por perlas de vidrio a células de Symbiodinium en cultivo. A la fecha solamente existe un reporte de transformación de Symbiodinium (ten Lohuis y Miller 1998), y no existen reportes posteriores de su reproducibilidad y/o aplicación por otros grupos. Estos autores documentaron la transformación de los dinoflagelados Amphidinium sp. y Symbiodinium microadriaticum Freudenthal. Ellos usaron construcciones de plásmidos que contenían los genes de resistencia codificantes para neomicina fosfotransferasa (nptII) e higromicina fosfotransferasa (hpt), con β-glucoronidasa como el gen reportero, y obtuvieron una eficiencia de 5-24 transformantes por cada 107 células con su método. Nosotros pudimos reproducir ese método de transformación con la leve modificación del uso de perlas de vidrio en lugar de fibras de SiC, ya que consideramos que las perlas de vidrio producirían el mismo efecto que las fibras de SiC sin sus desventajas de baja eficiencia de transformación (Songstad et al. 1995) ni el peligro a la salud que ellas representan (Dunahay et al. 1997). Además, las perlas de vidrio son baratas y no tóxicas. Consecuentemente, un procedimiento de transformación con este material es simple y no requiere del acceso a equipo especializado.
En efecto, nosotros obtuvimos transformaciones exitosas de las células de Symbiodinium introduciendo el plásmido mediante perlas de vidrio con mayor eficiencia (hasta 107 ± 7 por cada 106 células) que aquella del procedimiento registrado previamente (5-24 por cada 107 células; ten Lohuis y Miller 1998). Es importante notar que muchas pruebas se llevaron a cabo sin éxito en las cuales, ya sea las perlas de vidrio, el PEG, o ambos fueron omitidos en el protocolo de transformación (datos no mostrados). Otra observación importante fue el hecho de que los cultivos tuvieron que mantenerse axénicos mediante el uso de antibióticos a fin de lograr una transformación exitosa y libre de contaminantes. Esto fue posible porque se sabe que los cultivos de Symbiodinium son resistentes a varios antibióticos (ten Lohuis y Miller 1998, Soffer et al. 2008).
Tal como se registró previamente para la expresión de los genes reporteros GUS y hpt (ten Lohuis y Miller 1998), los promotores CaMV35S y nos fueron suficientes y eficientes para conducir la expresión de las construcciones génicas que contenían las secuencias de gfp fusionadas, y de los genes bar y hpt de los vectores pCB302 y pCAMBIA-1390, respectivamente. De esta manera, estos promotores podrían ser usados para el diseño futuro de vectores de expresión en Symbiodinium.
Debido a que las células de Symbiodinum son fotosintéticas y que los vectores pCB302 contienen el gen bar para la resistencia a herbicidas a base de glufosinato de amonio, nosotros hipotetizamos que este herbicida (usado convencionalmente para seleccionar plantas y células vegetales transformadas) sería metabolizado de manera similar y representaba un buen agente de selección para células de Symbiodinium transformadas. El glufosinato inhibe la actividad de la enzima glutamina sintetasa, lo que resulta en una rápida acumulación de amonio e inhibición de la fotosíntesis (Wendler et al. 1990), mientras que la expresión del gen bar (el cual codifica para la enzima fosfinotricina N-acetil transferasa) resulta en la rápida conversión del glufosinato al metabolito no fitotóxico N-acetil L-glufosinato, y confiere resistencia al herbicida en las células transformadas. Esto probablemente también fue cierto para las células de Symbiodinium ya que la incubación de diferentes clados de células tipo silvestre de Symbiodinium en presencia de este tipo de herbicida promovió muerte celular (Fig. 3); por el contrario, las células transformadas con el plásmido pCB302 que contenía el gen de resistencia bar sobrevivieron. Debe notarse que en la selección usual con Basta de plantas transformadas, comúnmente se utiliza una concentración de 20 mg L-1 del herbicida (Akama et al. 1995). Ya que observamos que esta concentración no fue suficiente para la selección de las células transformadas de Symbiodinum, aumentamos la concentración de Basta hasta 1 mg mL-1, la cual no fue dañina para las células transformadas, y obtuvimos una buena selección.
Las células transformadas tratadas con Basta mostraron una mezcla de células rojas conteniendo clorofila (no transformadas) y células verdes (transformadas) (Fig. 2b, d, f). Al final del proceso de selección, casi todas las células transformadas mostraron la fluorescencia verde y la cantidad de células con fluorescencia roja fue mínima. La fluorescencia observada mostró un patrón sugerente de localización citoplásmica, como se esperaría para RACK1 y otras proteínas de señalización.
Al final de la selección, la sobreexpresión de las proteínas fusionadas a GFP produjo células de Symbiodinium fluorescentes con apariencia verduzca bajo el microscopio de epifluorescencia. Esto fue inusual ya que la combinación de la fluorescencia roja de la clorofila y la GFP debió haber resultado en células fluorescentes de apariencia naranaja-amarilla. Además, observamos colores de fluorescencia intermedia y pigmentación intermedia en las células durante el proceso de selección. Aunque no tenemos datos que expliquen esta observación, una posibilidad es que la sobreexpresión en sí misma de las proteínas fusionadas a GFP podría afectar a las vías que llevan a la síntesis de la clorofila y/o pigmentos fotosintéticos similares. De hecho, esto no sería un efecto inusual en las células transformadas con RACK1, ya que esta es una proteína de andamiaje que puede interactuar con un amplio rango de proteínas de señalización y regular procesos fisiológicos como la división celular, transducción de señales y rutas metabólicas (revisado en Adams et al. 2011). El efecto de la sobreexpresión heteróloga de RACK1 en Symbiodinium y su posible relación con el metabolismo de pigmentos fotosintéticos amerita mayor investigación.
Además del uso del vector pCB302 con resistencia a Basta, nos dimos a la tarea de probar la reproducibilidad del procedimiento transformando un clado diferente de Symbiodimiun, S. pulchrorum, con otro vector de expresión que contenía una construcción y una caja de selección alternas que pudieran proporcionar un tipo diferente de patrón de fluorescencia asociado. Nuestra estrategia de selección fue reproducir la susceptibilidad de Symbiodinium al antibiótico higromicina que fue previamente explotado en el reporte previo de transformación (ten Lohuis y Miller 1988). De manera análoga a la selección con Basta, el proceso de selección con higromicina fue exitoso, pues una mezcla de células transformadas y no transformadas fue detectada en las etapas tempranas de selección (Fig. 4a), y todas ellas mostraron fluorescencia amarilla en estados posteriores (Fig. 4b, d). Otra evidencia de expresión heteróloga fue el hecho de que las células transformadas observadas bajo epifluorescencia mostraron un patrón reticular tipo rejilla de microfilamentos aglomerados densamente. El patrón de organización fue diferente a aquel observado con la expresión de GFP-AtRACK1C y muy similar a lo que ha sido observado con FITC-faloidina y anticuerpos antiactina en S. kawagutii (Villanueva et al. 2014). En conjunto, nuestros datos demuestran que la introducción de genes foráneos a diferentes clados de Symbiodinium con dos vectores distintos de expresión conteniendo genes de resistencia diferentes, mediada por la agitación vigorosa con perlas de vidrio y PEG, proporciona un procedimiento exitoso y reproducible para la transformación transitoria de Symbiodinium spp. de una manera simple.
Las estrategias de genómica funcional todavía no han sido aplicadas a Symbiodinium debido precisamente a la falta de un método reproducible y confiable para estas células, y el procedimiento reportado en este trabajo debe aliviar este problema. Los métodos de transformación mediados por perlas de vidrio tienen la ventaja importante de producir tasas aceptables de transformación sobre otros protocolos de transformación genética disponibles. El presente trabajo además confirma que la aplicación de la transformación mediada por perlas de vidrio y PEG resulta en un método viable para introducir genes de interés en Symbiodinium spp., y que este método es una opción para su transformación genética.











 nova página do texto(beta)
nova página do texto(beta)