Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.40 no.2 Ensenada jun. 2014
https://doi.org/10.7773/cm.v40i2.2393
Artículos
Patrones de crecimiento y reproducción de la concha nácar, Pteria sterna, cultivada en un ambiente tropical de México: Implicaciones para el cultivo de perlas
Growth and reproduction patterns of the winged pearl oyster, Pteria sterna, cultivated in tropical environments of Mexico: Implications for pearl farming
Irene Serna-Gallo1, Javier MJ Ruíz-Velazco1,2, Héctor Acosta-Salmón3, Emilio Peña-Messina1,2, Guadalupe Torres-Zepeda4, Pedro E Saucedo3,*
1 Posgrado en Ciencias Biológico Agropecuarias, Universidad Autónoma de Nayarit (UAN), Ciudad de la Cultura Amado Nervo, CP 63190 Tepic, Nayarit, México.
2 Escuela Nacional de Ingeniería Pesquera, Universidad Autónoma de Nayarit (UAN), San Blas, Nayarit, México.
3 Centro de Investigaciones Biológicas del Noroeste (CIBNOR), Av. Instituto Politécnico Nacional 195, Col. Playa de Santa Rita Sur, CP 23090 La Paz, Baja California Sur, México.
4 Unidad Académica de Ecología Marina, Universidad Autónoma de Guerrero (UAG), Av. Gran Vía Tropical, Acapulco, Guerrero, México.
* Corresponding author.
E-mail: psaucedo04@cibnor.mx
Received January 2014
Accepted April 2014.
RESUMEN
La concha nácar Pteria sterna sostiene una creciente industria perlera en la región subtropical del noroeste de México. En ambientes tropicales del país, el cultivo de perlas puede ser redituable, pero la poca información sobre la biología y ecología de la especie limita la definición de protocolos para la creación de granjas perleras. Se determinó el crecimiento absoluto, la tasa de crecimiento, los estadios reproductivos, los cambios en la talla de ovocitos y la talla de primera madurez de juveniles de P. sterna cultivados en la bahía de Acapulco durante el ciclo anual 2009-2010, y se comparó su respuesta en esta área tropical con registros de la especie para otras áreas subtropicales de México. Se comparó el modelo de crecimiento de von Bertalanffy con uno propuesto en este estudio para fines acuaculturales. La tasa de crecimiento fue mayor durante los primeros seis meses (5.3 mm mes-1) y disminuyó a 3 mm mes-1 hasta que los juveniles alcanzaron la talla de 60 mm en un año. El crecimiento fue máximo en febrero y mínimo de julio a septiembre. Ambos modelos describieron bien el crecimiento de P. sterna, pero el ajuste y la estimación de los parámetros fue mejor con el modelo propuesto. La gametogénesis inició en diciembre de 2009 a una talla de 50.9 mm en los machos y 59.5 mm en las hembras; el desarrollo de la gónada fue continuo el resto del año, con un pico de desove en febrero-marzo (~25-26 °C; 2.8 μg L-1 de clorofila a) que coincidió con el máximo del índice gonádico y la mayor talla de los ovocitos. En comparación con ambientes subtropicales, la especie utiliza una estrategia diferente para el manejo de la energía para el crecimiento y reproducción en un ambiente tropical; en la bahía de Acapulco P. sterna puede alcanzar la talla optima de injerto para producción de perlas (70-80 mm de altura de la concha) en 15-17 meses.
Palabras clave: Pteria sterna, crecimiento, reproducción, bahía de Acapulco, cultivo de perlas.
ABSTRACT
The winged pearl oyster, Pteria sterna, sustains a growing pearl industry in northwestern Mexico, where a subtropical climate prevails. In tropical areas of Mexico, pearl cultivation may be profitable, but insufficient information on the biology and ecology of the species limits the definition of protocols for creating pearl farms. We measured absolute growth, growth rate, reproductive stages, changes in oocyte size, and size at first maturity of juvenile P. sterna cultivated in Bahía de Acapulco over one annual cycle (2009-2010), and compared their response in this tropical area with reports from subtropical areas of Mexico. We also compared the von Bertalanffy growth model with one proposed in this study for aquaculture purposes. The growth rate was higher during the first six months (5.3 mm month-1) and then decreased to 3 mm month-1 until juveniles reached a size of 60 mm in one year. Growth rates were higher in February and lower in July through September. Both models described well the growth of P. sterna, but the adjustment and the estimation of parameters was better with the proposed model. Gametogenesis started in December 2009 at 50.9 mm (males) and 59.5 mm (females); gonad development occurred continuously throughout the year with a peak in February-March (~25-26 °C; 2.8 μg L-1 chlorophyll a concentration), when the gonad index was highest and oocytes were larger. When compared to other studies conducted in subtropical areas, the species uses different strategies to channel available energy into growth and reproduction in tropical regions; P. sterna grows quickly in Bahía de Acapulco and may obtain the size necessary for grafting (70-80 mm shell height) in 15-17 months.
Key words: Pteria sterna, growth, reproduction, Bahía de Acapulco, pearl cultivation.
INTRODUCCIÓN
La perlicultura (cultivo de perlas) es una industria bien establecida y redituable que proporciona trabajo e ingreso a familias y comunidades enteras (Taylor y Strack 2008). Esta actividad ha contribuido de forma significativa al desarrollo socioeconómico y cultural de numerosos países de Asia y en el Pacífico Sur (Fong 2005). En México, la presencia de ostras perleras y perlas motivó la colonización de la península de Baja California en el siglo XVI y promovió su posterior desarrollo social y económico (McLaurin-Moreno y Arizmendi-Castillo 2002, Cariño y Monteforte 1995). Hoy en día, la producción de perlas en México es una actividad creciente que depende principalmente de una especie: la concha nácar alada, Pteria sterna (Gould 1851), (McLaurin-Moreno et al. 1997, Ruíz-Rubio et al. 2006). Esta especie produce perlas multicolor de alta calidad y muy valoradas en el mercado internacional (Kiefert et al. 2004). Sin embargo, los problemas recurrentes para el aseguramiento de semilla vía la recolecta con colectores artificiales o su producción de forma controlada en laboratorio han limitado la disponibilidad continua y suficiente de ostras para las operaciones de perlicultura y el crecimiento de la industria.
Pteria sterna se distribuye a lo largo de un amplio margen de línea costera tropical y subtropical en el océano Pacífico oriental, desde el estado de Baja California, México, hasta Perú (Keen 1971). En el golfo de California, donde el intervalo de distribución de la especie es subtropical, se han estudiado algunos de los factores principales que influencian la producción de perlas, incluyendo los métodos de cultivo en campo (Monteforte 2013), el desarrollo y crecimiento de juveniles y adultos (Bückle-Ramírez et al. 1992, Saucedo y Monteforte 1997a, Martínez-Fernández et al. 2004) y la reproducción (Saucedo y Monteforte 1997b, Vite-García y Saucedo 2008, Cáceres-Puig et al. 2009). En general, estos estudios muestran que, en comparación con otras especies de ostras perleras que se reproducen en verano cuando la temperatura del agua se incrementa y la productividad primaria disminuye, P. sterna se reproduce entre invierno y primavera cuando la temperatura del agua disminuye y la productividad primaria aumenta. Las implicaciones ecofisiológicas de este tipo de regulación y respuesta diferencial aún se están investigando (González-Jiménez 2013).
Los estudios relacionados con el cultivo en campo, el crecimiento y la reproducción de P. sterna en otros sitios de distribución tropical donde la especie también está presente son muy escasos. En la bahía de Acapulco, estado de Guerrero, México, se ha evaluado la recolecta estacional de semilla en campo (Torres-Zepeda et al. 2002) y el crecimiento y la supervivencia de juveniles en cultivo en suspensión (Cantú-Cantú 2003). Los estudios demuestran que el reclutamiento de semilla de P. sterna es continuo casi todo el año y que la especie está bien adaptada a las condiciones de la bahía de Acapulco, lo cual ofrece la oportunidad de incrementar la producción mediante programas de acuicultura.
El cultivo de perlas en Acapulco y la costa del Pacífico en México puede ser una actividad rentable que se alinea bien con las principales actividades económicas de la región, como la producción de joyería y el ecoturismo. Para ello, es necesario realizar estudios de base sobre la biología y ecología de la especie.
En el presente trabajo se estudiaron el crecimiento absoluto, la tasa de crecimiento, el desarrollo gonadal, los cambios en la talla de ovocitos y la talla de primera madurez de juveniles de P. sterna en condiciones de cultivo en suspensión en la bahía de Acapulco durante un ciclo anual (2009-2010). El objetivo principal fue comparar la respuesta de las ostras en este ambiente tropical con los reportes previos de la especie en otros sitios subtropicales del golfo de California. Considerando que los modelos de crecimiento proporcionan herramientas útiles para entender la adecuación de las ostras para la perlicultura (Sims 1994), también se propuso comparar el modelo clásico de crecimiento de von Bertalanffy con uno desarrollado en este estudio que tiene aplicaciones para la acuicultura.
MATERIALES Y MÉTODOS
Origen de las ostras y diseño experimental
El presente estudio se llevó a cabo en la bahía de Acapulco (16°50' N, 99°54' W), donde el clima es tropical, el aire cálido y subhúmedo, y el mar presenta corrientes frías de fondo que permiten un florecimiento continuo de fitoplancton para promover una alta productividad la mayor parte del año (Cantú-Cantú 2003).
En mayo de 2009, una generación de semillas silvestres fue reclutada mediante un sistema operado por la Universidad Autónoma de Guerrero. El sistema estuvo formado por un buque de investigación estacionario, del cual se colgaron una serie de líneas verticales de recolecta. En cada línea se colocaron ya sea colectores artificiales o estructuras de cultivo.
En julio de 2009, una vez finalizada la recolecta, los juveniles de dos meses de edad (13.2 ± 0.52 mm de altura de la concha SE; 0.75 ± 0.074 g SE) fueron transferidos a canastas de cultivo tipo Nestier (50 x 50 x 10 cm; 10 mm2 de apertura de poro). Las canastas Nestier fueron organizadas en tres grupos o lotes replicados, los cuales se colgaron de las líneas verticales del buque de investigación, a una profundidad de 12 m. Cada lote de cultivo tenía a su vez cuatro niveles de canastas Nestier, y cada nivel el mismo número de ostras sembradas a una densidad constante: 100 ostras por nivel durante los primeros dos meses, 75 ostras por nivel el tercer mes, y 50 ostras por nivel en los meses subsiguientes (Monteforte et al. 2005). En los primeros dos meses, las ostras fueron colocadas en mallas plásticas (1 mm2 de luz de malla) dentro de las canastas Nestier para prevenir la pérdida de juveniles de talla pequeña; la malla fue retirada el tercer mes cuando las ostras alcanzaron ~20 mm de altura de la concha. Se adoptó un protocolo de reposición de ostras para mantener constante la densidad de siembra en las canastas Nestier a lo largo del estudio (Monteforte et al. 2005). Para ello, las ostras muertas fueron removidas y repuestas cada mes por ostras vivas tomadas de los lotes de réplica mantenidos bajo las mismas condiciones de cultivo que los lotes experimentales. Durante la fase de engorda, se registraron los cambios estacionales en la temperatura del agua (±0.1 °C) y la concentración de clorofila a (±0.1 μg L-1) mensualmente a la misma profundidad de cultivo (12 m) utilizando una sonda portátil (YSI modelo 6920, Yellow Springs, OH).
Crecimiento absoluto y tasa de crecimiento
Cada mes durante el ciclo anual, 30 juveniles de ostra seleccionados aleatoriamente de cada lote de canastas Nestier fueron medidos para registrar la altura de la concha (0.1 mm), pesados para obtener el peso fresco total con concha (0.1 g) y preservados en una solución de formaldehido al 10% por 48 h. Transcurrido este tiempo, los juveniles fueron enjuagados y removidos de la concha, y se tomaron muestras del tejido gonadal, las cuales se preservaron en etanol al 70% para determinar los estadios de desarrollo gonadal.
El crecimiento absoluto y la tasa de crecimiento fueron determinados a partir de los datos mensuales de altura de la concha y peso fresco total de las ostras (Saucedo et al. 1998). Para calcular la tasa de crecimiento (en mm mes-1 y g mes-1), la diferencia entre las tallas final e inicial fue dividida entre el tiempo de cultivo (en meses).
Modelos de crecimiento
Se evaluaron dos modelos para comparar el crecimiento en talla (altura) de los juveniles de P. sterna en la bahía de Acapulco. El primero representó una modificación del modelo de Ratkowsky (1986), el cual considera que los intervalos de tiempo son iguales, el tiempo inicial es cero y solo existe un dato de crecimiento para cada intervalo de tiempo. Para su aplicación en acuicultura, el modelo también incorpora la duración del periodo de cultivo (c). Los detalles del modelo propuesto pueden ser consultados en Hernández-Llamas y Ratkowsky (2004) y Ruíz-Velazco et al. (2010).

donde Li y Lf son las tallas (alturas) inicial y final, k es la tasa a la cual cambia estacionalmente L, y t es el tiempo.
Los resultados del modelo propuesto fueron comparados con los resultados obtenidos con el modelo clásico de crecimiento de von Bertalanffy:

donde L∞ es el crecimiento asintótico, k es una constante, y t0 es el tiempo al cual el crecimiento inicial es cero.
Para el ajuste de ambos modelos, se compararon como variables de respuesta la suma de cuadrados residuales, la facilidad de convergencia y la interpretación biológica de los parámetros de crecimiento (Ratkowsky 1986, Hernández-Llamas y Ratkowsky 2004). Esto se evaluó en una muestra de 14 datos representativos del crecimiento individual.
Reproducción
Las muestras de tejido gonadal preservadas fueron deshidratadas, incluidas en Paraplast X-tra (SPI Supplies, West Chester, PA) y seccionadas con un micrótomo a 3-4 μm a lo largo del eje antero-posterior del cuerpo (Kim et al. 2006). Posteriormente, las muestras fueron teñidas con hematoxilina-eosina y analizadas bajo un microscopio óptico a 10x y 40x de aumento para caracterizar el ciclo reproductivo a partir de cinco estadios básicos (indiferenciado, desarrollo, maduro, desove y postdesove). Se identificó el sexo dominante (indiferenciado, hembra y macho) y se calculó la proporción sexual (Saucedo y Monteforte 1997b).
Dado que las ostras perleras tienen gónadas difusas, se calculó un índice gonádico asignando categorías numéricas a cada estadio de desarrollo: 0 = indiferenciado o postdesove; 1 = en desarrollo; 2 = maduro, y 3 = desove (Heffernan et al. 1989). Con estos datos, se aplicó la fórmula del índice gonádico (IG):

En la fórmula, el número de ostras (n) en cada estadio se multiplicó por el valor numérico asignado a cada estadio reproductivo (2, 3, 4).
Los cambios estacionales en la talla de los ovocitos se determinaron de acuerdo con lo propuesto por Grant y Tyler (1983). Treinta ovocitos completos seleccionados en tres campos aleatorios del ovario fueron fotografiados y procesados en la computadora con el programa Image Pro Plus (v6.0, Media Cybernetics, Bethesda, MD) para calcular su diámetro promedio (μm). Sólo los ovocitos en estadios avanzados de desarrollo (vitelogénicos) y maduros (postvitelogénicos) se consideraron para el análisis.
La talla de primera madurez se determinó bajo el supuesto de que todas las ostras jóvenes de este estudio provinieron de la misma cohorte y, por tanto, sus tallas promedio eran homogéneas. Con base en esto, la talla/edad de primera madurez representó el momento en que el 50% de la población en cultivo alcanzó el estadio de madurez sexual (Campbell y Ming 2003).
Tratamiento estadístico de datos
Los valores de talla inicial de juveniles fueron analizados para determinar la normalidad de los datos con la prueba de Kolmogorov-Smirnov y la homogeneidad de varianzas con la prueba de Levene (Sokal y Rohlf 1981). Para ambos modelos (von Bertalanffy y el propuesto en este estudio), el ajuste de datos y la estimación de parámetros se realizó mediante un análisis de regresión no lineal utilizando Statistica (StatSoft v8.0, Tulsa, OK). Se corrieron análisis de correlación para determinar la relación entre las tasas de crecimiento y los parámetros ambientales. Se realizaron análisis de varianza de una vía para detectar diferencias significativas en el índice gonádico y la talla de ovocitos en función del tiempo. Según se requirió, se aplicaron comparaciones a posteriori de medias con la prueba de Tukey. El nivel de significancia de todas las pruebas se determinó a P < 0.05.
RESULTADOS
Cambios estacionales en la temperatura del agua y concentración de clorofila a
La temperatura del agua varió 5 °C durante el ciclo anual; el valor máximo (~30 °C) se registró entre agosto y octubre de 2009 y el mínimo (~25 °C), entre marzo y mayo de 2010. Los cambios en la concentración de clorofila a fueron más marcados; el valor máximo se resgistró en junio de 2010 (7.1 μg L-1) y el mínimo en julio (0.5 μg L-1) y octubre (0.9 μg L-1) de 2009.
Crecimiento absoluto y tasa de crecimiento
El incremento total en la altura de la concha fue de 46.9 μm, desde el inicio del experimento en julio de 2009 (13.2 mm) hasta el final en junio de 2010 (60.1 mm). El patrón de incremento fue pronunciado durante los primeros seis meses y luego se niveló y disminuyó hacia mayo-junio de 2010, lo cual sugiere una asíntota (fig. 1a).

El incremento en el peso fresco total (con concha) fue de 37.2 g, desde julio de 2009 (0.75 g) hasta junio de 2010 (37.9 g). El incremento también fue marcado los primeros seis meses y decreció gradualmente en los meses subsecuentes, pero los datos no indicaron una asíntota (fig. 1b).
La tasa de crecimiento en altura de la concha fue mayor en febrero de 2010 (7.65 mm mes-1) y menor en mayo de 2010 (0.7 mm mes-1); la tasa de crecimiento promedio fue de 4.27 mm mes-1 para todo el ciclo anual (fig. 2a). La tasa de crecimiento en peso fresco fue mayor en febrero (7.57 g mes-1) y menor en julio (0.47 g mes-1) de 2010; la tasa de crecimiento promedio fue de 3.38 g mes-1 para el ciclo anual (fig. 2b).
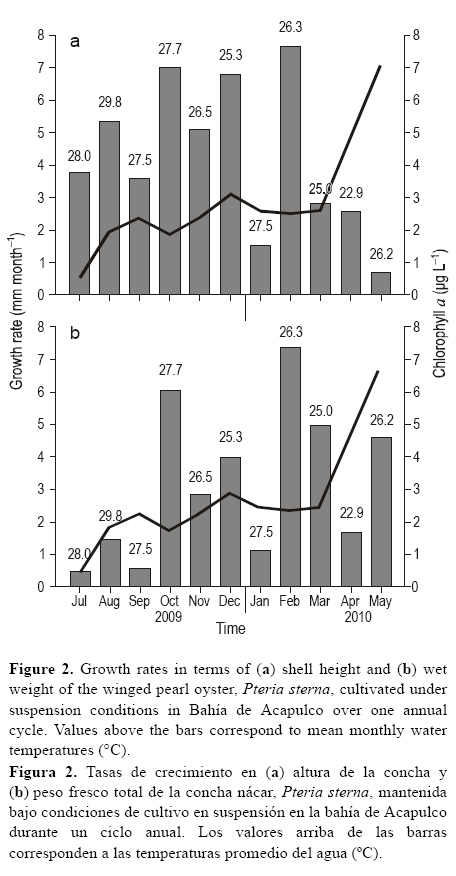
La relación entre la tasa de crecimiento y la temperatura del agua fue significativa y negativa (P < 0.05; r = -0.62). Por el contrario, la relación entre la tasa de crecimiento y la concentración de clorofila a no fue significativa (P > 0.05; r = 0.26).
Modelos de crecimiento
Tanto el modelo propuesto en este estudio (fig. 1a) como el de von Bertalanffy (fig. 1b) se ajustaron significativamente (P < 0.05) a los datos de crecimiento (altura de la concha). Sin embargo, en comparación con el modelo propuesto, el modelo de von Bertalanffy careció de convergencia de los valores iniciales y mostró una desproporción de los valores en los parámetros estimados para los datos 8, 9, y 12, los cuales no fueron comparables con los otros casos (tabla 1).
La suma de cuadrados residuales fue similar con ambos modelos, pero el modelo propuesto generó valores más pequeños que el modelo de von Bertalanffy (tabla 1), sugiriendo un mejor ajuste para el crecimiento de P. sterna bajo las condiciones de cultivo en suspensión en la bahía de Acapulco.
Reproducción
Según el análisis histológico, los juveniles estuvieron sexualmente inactivos de julio a noviembre de 2009 (fig. 3a). Las gónadas comenzaron a desarrollarse en diciembre de 2009, pero sólo en un 7% de la población muestreada. El desarrollo de los gametos fue continuo de enero a junio de 2010 (~35%) y alcanzó el pico de maduración en marzo de 2010 (23%). El desove también fue continuo de enero (7%) a junio (21%), con un pico en abril (36%) de 2010. El estadio de postdesove se presentó en diciembre-enero y abril-junio de 2010 (7% y 44%, respectivamente).

Los cambios estacionales en el diámetro de los ovocitos fueron significativos (P < 0.05). Los valores máximos se registraron en marzo de 2010 (39.8 μm) y los mínimos en junio de 2010 (22.1 μm); el diámetro promedio para todo el ciclo anual fue de 32.4 μm (fig. 3b).
Los machos fueron más numerosos que las hembras durante la mayor parte del ciclo anual, y la proporción sexual de hembra a macho fue de 0.59:1. Adicionalmente, un 6% de la población muestreada se encontró sexualmente indiferenciada y un 3% correspondió a ostras hermafroditas.
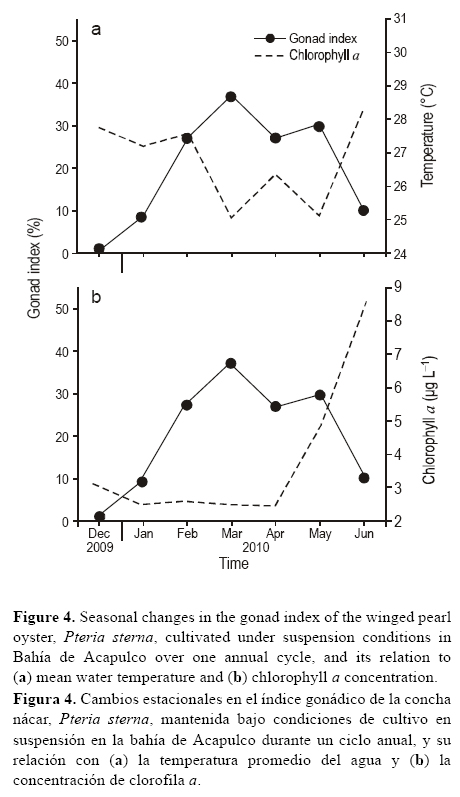
Los cambios estacionales en el índice gonádico fueron significativos (P < 0.05) y consistentes con las variaciones en la talla de los ovocitos, y mantuvieron una relación inversa con la temperatura del agua (fig. 4a) y la concentración de clorofila a (fig. 4b). El valor máximo del índice gonádico (37%) se observó en marzo de 2010 (25 °C; 2.25 μg L-1) y el mínimo (1%) en diciembre de 2009 (28 °C; 3.1 μg L-1).
La frecuencia acumulada de tallas para machos y hembras se ajustó significativamente a un modelo logístico (r = 0.99). Esto reveló que los machos alcanzaron la talla de primera madurez a los 50.9 mm de altura de la concha y las hembras a 59.5 mm (fig. 5a, b).

DISCUSIÓN
A nivel mundial, la mayor industria perlera se encuentra circunscrita a las regiones tropicales de Asia y el Pacífico Sur, particularmente en el norte de Australia, China, la Polinesia Francesa, Indonesia y las Filipinas (Taylor y Strack 2008). Las especies que se utilizan para el cultivo de perlas en estos países son del género Pinctada (P. fucata, P. margaritifera, P. maxima); no obstante, la concha nácar Pteria penguin, de distribución tropical, ha incrementado en valor para la producción de medias perlas (mabés) de alta calidad comercial (Kishore et al. 2013). De forma similar, P. sterna puede ser cultivada con éxito en ambientes tropicales, a pesar de su preferencia por climas subtropicales y templados y, por tanto, es un candidato viable para el cultivo de perlas a lo largo de la costa este del océano Pacífico latinoamericano, incluyendo México.
La tasa de crecimiento en altura de la concha de los juveniles de P. sterna fue más rápida de julio a diciembre de 2009 (5.3 mm mes-1) y disminuyó en un 41% de enero a abril de 2010 (3 mm mes-1), lo cual coincidió con el inicio de la actividad reproductiva (el índice gonádico y el diámetro de los ovocitos incrementaron). Este patrón de crecimiento mantuvo una relación inversa y negativa con la temperatura del agua, con valores máximos en primavera y mínimos en verano. La tasa promedio de crecimiento calculada para este estudio (4.27 mm mes-1) es ~20% mayor que la tasa máxima de crecimiento (3.5 mm mes-1) registrada para juveniles de P. sterna cultivados en bahía de La Paz (sur del golfo de California) a una talla inicial de 42.9 mm (Saucedo y Monteforte 1997a). Por el contrario, los juveniles de P. sterna cultivados en bahía de los Ángeles (centro del golfo de California) crecieron el doble de rápido (7.2 a 11.3 mm mes-1) en verano y otoño, y un 15% más lento (3.6 mm mes-1) en invierno (Bückle-Ramírez et al. 1992). Estas diferencias son posiblemente el reflejo de variaciones en las condiciones ambientales típicas de áreas tropicales y subtropicales; la bahía de Acapulco presenta pocas variaciones estacionales, y en este estudio la temperatura del agua y la concentración de clorofila a variaron 5 °C y 6.6 μg L-1, respectivamente, entre invierno y verano. Bahía de La Paz (24°16' N, 110°19' W) es una zona transicional y relativamente poco productiva (Sicard et al. 2006), donde la temperatura del agua llega a variar en promedio 12 °C y la productividad primaria entre 5 y 6 mg L-1 en años normales no influenciados por eventos ENSO (Romo-Piñera 2010, Martínez-López et al. 2001). En bahía de los Ángeles (28°56' N, 113°33' W), las variaciones en la temperatura del agua y la concentración de clorofila a son más marcadas y oscilan entre ~14 °C y 12 μg L-1, respectivamente (Muñoz-Barbosa et al. 1991). Bahía de los Ángeles es un Centro de Actividad Biológica con alta productividad primaria todo el año, lo cual ofrece condiciones óptimas para el crecimiento rápido y la reproducción continua de organismos filtradores (Lluch-Belda 1999).
Se ha reportado que las ostras perleras de talla media, como P. sterna, crecen de forma constante durante el primer año de vida (Sims 1994). Considerando que 70-80 mm de altura de la concha es la talla recomendada para injertar P. sterna en las granjas perleras del golfo de California (SEMARNAT 2013; Kiefert et al. 2004; Douglas McLaurin, com. pers.), se estima que en la bahía de Acapulco esta talla se alcanza entre 15 y 17 meses de edad. Este tiempo es consistente con la edad (16-18 meses) a la que se injerta P. sterna en Guaymas, Sonora (D McLaurin, com. pers.). Otras especies de ostras perleras de menor talla crecen rápidamente durante los primeros 5-6 meses y pueden alcanzar la talla de injerto en 12-14 meses, entre éstas, Pinctada fucata en la India (Chellam 1978) y Pteria colymbus en Venezuela (Lodeiros et al. 1999). Por el contrario, P. penguin es de mayor talla y alcanza hasta 170-180 mm de altura, por lo que requiere entre 16 y 17 meses para alcanzar la talla comercial de injerto de 100 mm en Australia (Millione y Southgate 2012).
El modelo clásico de crecimiento de von Bertalanffy ha sido ampliamente utilizado en estudios de pesquerías para comparar datos observados y calculados; sin embargo, también ha recibido críticas en lo referente a la precisión de los parámetros estimados. Por tanto, algunos autores han propuesto modificaciones a la ecuación general (ver Roff 1980, Ratwkosky 1986, Hernández-Llamas y Ratwkosky 2004), particularmente cuando la edad de la especie se desconoce o cuando los datos no cubren un intervalo amplio de tallas para mostrar una asíntota en la curva de crecimiento (Pouvreau y Prasil 2001). Cuando esto ocurre, y el modelo de von Bertalanffy no puede determinar con precisión la asíntota en la curva de crecimiento, los parámetros de L∞ y K pueden estar desproporcionados y no ser comparables con los valores registrados en la literatura. Esto podría explicar los parámetros de crecimiento tan variables que se han registrado para juveniles cultivados de algunas especies de ostras perleras como P. margaritifera en las islas Cook (L∞ =156.7 a 309.7 mm; Sims 1994), P. penguin en Australia (L∞ = 283.6 a 822.5 mm; Millione y Southgate 2012) y P sterna en bahía de La Paz (L∞ = 68.8 mm; Saucedo y Monteforte 1997a) y bahía de los Ángeles (L∞ = 146 mm; Bückle-Ramírez et al. 1992). La propuesta de modificar el modelo de Ratkowsky (1986) permite lidiar con la convergencia de los valores iniciales y la interpretación de los parámetros de Li y Lf para la descripción del crecimiento exponencial o asintótico de una especie (Hernández-Llamas y Ratkowsky 2004). En comparación con el modelo de von Bertalanffy, los parámetros del modelo propuesto en este estudio se ajustaron mejor al patrón de crecimiento de P. sterna cultivada en la bahía de Acapulco. Lee et al. (2008) también registraron que el crecimiento de P. maxima cultivada en Indonesia se describe de forma más precisa con una modificación especial del modelo de von Bertalanffy (los otros modelos evaluados fueron el modelo de Gompertz, el de Richards y el logístico).
Pteria sterna inició la gametogénesis en diciembre de 2009, a una talla promedio de 50.9 mm (machos) y 59.5 mm (hembras); no hubo evidencia de actividad reproductiva a tallas menores. Se ha registrado que la especie madura a una talla de 39 mm en bahía de La Paz (Saucedo y Monteforte 1997b) y a 63 mm (machos) y 75 mm (hembras) en bahía de los Ángeles (Ana Karen Meza-Buendía, datos no publicados). En diciembre, la presencia de gónadas en desarrollo fue tan sólo del 7% y en estadio de postdesove del 93%. Este resultado sugiere que la gametogénesis en diciembre fue incipiente y finalizó ya sea con un breve desove que no se detectó histológicamente, o con una rápida reabsorción de los gametos no liberados al medio para la fertilización, posiblemente como reflejo de un débil mecanismo de los juveniles para sustentar la gametogénesis (Cáceres-Puig et al. 2009). Después de diciembre, la gametogénesis y el desove ocurrieron de forma continua todo el año, y alcanzaron un pico máximo en marzo. Esto confirma el comportamiento típico de una especie tropical (Freites et al. 2010), así como el carácter multi-desovador de P. sterna. En el golfo de California, la especie presenta picos en la actividad de desove en febrero y agosto en bahía de los Ángeles (Hernández-Díaz y Bückle-Ramírez 1996) y de febrero a mayo en bahía de La Paz (Saucedo y Monteforte 1997b, Vite-García y Saucedo 2008). En general, estos picos de desove coinciden con la disminución en la temperatura del agua entre invierno (25 °C) y primavera (22 °C). En el presente estudio, estas temperaturas ocurrieron en febrero y marzo y coincidieron con el pico principal de desove y con los valores máximos del índice gonádico y del diámetro de ovocitos. Con base en estos resultados, se supuso que la especie se encontraba energéticamente más fuerte y preparada para soportar la cirugía del injerto en invierno y primavera. En contraste, las temperaturas del agua en verano son altas y las ostras están energéticamente agotadas, por lo que su uso para la perlicultura no es recomendable. En apoyo a esta sugerencia, González-Jiménez (2013) documentó que el marco óptimo para la actividad de P. sterna se alcanza a los 22 °C y el límite crítico a los 28 °C.
La actividad reproductiva estuvo inversamente relacionada con los factores ambientales. En general, los valores máximos del índice gonádico y el diámetro de ovocitos se correspondieron con valores bajos de la temperatura del agua y de la concentración de clorofila a. Esto sugiere que, en ambientes tropicales, P. sterna utiliza una estrategia conservadora para regular la gametogénesis en primavera, principalmente a partir de la energía almacenada en tejidos somáticos. En cambio, la especie utiliza una combinación de estrategias, conservadora y oportunista, para sostener la gametogénesis en ambientes subtropicales (bahía de La Paz), primero a partir de la energía tomada del alimento cuando la productividad primaria es alta en invierno y luego de las reservas energéticas en primavera cuando la productividad declina (Vite-García y Saucedo 2008, Cáceres-Puig et al. 2009).
Los resultados de este estudio muestran que P. sterna crece rápidamente en las condiciones tropicales de la bahía de Acapulco y puede alcanzar la talla sugerida de injerto de 70-80 mm en 15-16 meses. La especie utiliza estrategias diferentes para canalizar la energía disponible del medio para actividades de crecimiento y reproducción en la bahía de Acapulco, en comparación con otras áreas subtropicales o templadas. Estos hallazgos no sólo proveen un mejor entendimiento de los requerimientos fisiológicos de la especie a lo largo de un gradiente de distribución geográfica más amplio en México, sino que son relevantes para el establecimiento potencial de granjas perleras en la bahía de Acapulco. En esta área, se recomienda injertar P. sterna en invierno y primavera.
AGRADECIMIENTOS
El presente estudio fue financiado por el Consejo Nacional de Ciencia y Tecnología (CONACYT, México, proyecto No. 81249) y el Fondo Mixto CONACYT-Gobierno del Estado de Guerrero (proyecto no. 2008-01). El estudio fue parte de una tesis de maestría de ISG, quien fue recipiente de una beca de CONACYT. Los autores agradecen a Carmen Rodríguez-Jaramillo y María Eulalia Meza-Chávez (CIBNOR) su ayuda en el procesamiento histológico de muestras y a Diego García-Paredes (UAN) el apoyo durante las salidas de campo. Se agradece también a Ira Fogel (CIBNOR) la edición del texto en inglés. Douglas McLaurin, injertador profesional de la compañia Perlas del Mar de Cortez proporcionó información valiosa no publicada.
REFERENCIAS
Bückle-Ramírez LF, Voltolina-Lobina D, Morales-Guerrero E, Valenzuela-Buriel F. 1992. Spat settlement and growth of Pteria sterna (Gould) (Mollusca, Bivalvia) in Bahía de los Ángeles, Baja California, Mexico. Trop. Ecol. 33: 137-147. [ Links ]
Cáceres-Puig JI, Cáceres-Martínez C, Saucedo PE. 2009. Annual reproductive effort of Pacific winged pearl oyster Pteria sterna and its relation with the timing for planning pearl seeding operations. J. Shellfish Res. 28: 471-476. [ Links ]
Campbell A, Ming MD. 2003. Maturity and growth of Pacific geoduck clam, Panopea abrupta, in southern British Columbia, Canada. J. Shellfish Res. 22: 85-90. [ Links ]
Cantú-Cantú P. 2003. Crecimiento y supervivencia en fase de preengorda de la concha nácar Pteria sterna (Gould 1851) en un sistema de cultivo de suspensión bajo diferentes densidades con semilla silvestre en la Bahía de Acapulco, Guerrero (México): julio de 2001 a enero de 2002. In: Memorias del Congreso Iberoamericano Virtual de Acuicultura (CIVA, http://www.revistaaquatic.com/civa2003), pp. 161-176. [ Links ]
Cariño MM, Monteforte M. 1995. History of pearling in the Bay of La Paz, South Baja California, Mexico (1533-1914). Gems Gemol. 31: 88-108. [ Links ]
Chellam A. 1978. Growth of pearl oyster Pinctada fucata in the pearl culture farm at Veppalodai. Indian J. Fish. 25: 77-83. [ Links ]
Fong QSW. 2005. Economic feasibility of small-scale black-lipped pearl oyster (Pinctada margaretifera) pearl farming in the Central Pacific. Aquacult. Econ. Manage. 9: 347-368. [ Links ]
Freites L, Montero L, Arrieche D, Babarro JM, Saucedo PE, Córdova C, García N. 2010. Influence of environmental factors on the reproductive cycle of the eared ark Anadara notabilis (Röding 1798) in northeastern Venezuela. J. Shellfish Res. 29: 69-75. [ Links ]
González-Jiménez A. 2013. Efecto de la temperatura y concentración de alimento sobre la ecofisiología de la concha nácar Pteria sterna bajo condiciones controladas de laboratorio. MSc thesis, Universidad del Mar, Puerto Ángel, Oaxaca, México, 98 pp. [ Links ]
Grant A, Tyler PA. 1983. The analysis of data in studies of invertebrate reproduction. II. The analysis of oocyte size/ frequency data, and comparison of different types of data. Int. J. Invert. Reprod. 6: 271-283. [ Links ]
Hadj-Taieb A, Ghorbel M, Hadj-Hamida NB, Jarboui O. 2013. Sex ratio, reproduction, and growth of the gilthead sea bream, Sparus aurata (Pisces: Sparidae), in the Gulf of Gabes, Tunisia. Cienc. Mar. 39: 101-112. [ Links ]
Heffernan P, Walker L, Carr J. 1989. Gametogenic cycles of three bivalves in Wassaw Sound, Georgia. I. Mercenaria mercenaria (Linnaeus 1758). J. Shellfish Res. 8: 51-60. [ Links ]
Hernández-Díaz A, Bückle-Ramírez LF. 1996. Gonadal cycle of Pteria sterna (Gould 1851) (Mollusca, Bivalvia) in Baja California, Mexico. Cienc. Mar. 22: 495-509. [ Links ]
Hernández-Llamas A, Ratkowsky DA. 2004. Growth of fishes, crustaceans and molluscs: estimation of the von Bertalanffy, Logistic, Gompertz and Richards curves and a new growth model. Mar. Ecol. Prog. Ser. 282: 237-244. [ Links ]
Keen M. 1971. Sea Shells of Tropical West America. Marine Mollusks from Baja California to Peru. 2nd ed. Stanford University Press, Stanford, California, 1064 pp. [ Links ]
Kiefert L, McLaurin D, Arizmendi E, Hanni HA, Elen S. 2004. Cultured pearls from the Gulf of California, Mexico. Gems Gemol. 40: 26-38. [ Links ]
Kim Y, Ashton-Alcox KA, Powell EN. 2006. Histological Techniques for Marine Bivalve Molluscs: Update. NOAA Technical Memorandum NOS NCCOS 27, Silver Spring, Maryland, 64 pp. [ Links ]
Kishore P, Southgate PC, Seeto J, Hunter J. 2013. Factors influencing the quality of half-pearls (mabé) produced by the winged pearl oyster, Pteria penguin (Röding 1758). Aquacult. Res.: 1-8 http://dx.doi.org/10.1111/are.12228. [ Links ]
Lee AM, Williams A, Southgate PC. 2008. Modelling and comparison of growth of the silverlip pearl oyster Pinctada maxima (Jameson Mollusca: Pteriidae) cultured in west Papua, Indonesia. Mar. Freshwat. Res. 59: 22-31. [ Links ]
Lodeiros CJ, Rengel JJ, Himmelman JH. 1999. Growth of Pteria colymbus (Roding 1798) in suspended culture in Golfo de Cariaco, Venezuela. J. Shellfish Res. 18: 155-158. [ Links ]
Lluch-Belda D. 1999. Centros de Actividad Biológica en la costa de Baja California. In: Lluch-Belda D, Elorduy-Garay J, Lluch-Cota SE, Ponce-Díaz G (eds) BAC's: Centros de Actividad Biológica del Pacífico Mexicano. Centro de Investigaciones Biológicas del Noroeste. La Paz, Mexico, pp. 49-64. [ Links ]
Martínez-Fernández E, Acosta-Salmón H, Rangel-Dávalos C. 2004. Ingestion and digestion of ten species of microalgae by winged pearl oyster Pteria sterna (Gould 1851) larvae. Aquaculture 230: 419-425. [ Links ]
Martínez-López A, Cervantes-Duarte R, Reyes-Salinas A, Valdez-Holguín JE. 2001. Cambio estacional de clorofila a en la Bahía de La Paz, BCS, México. Hidrobiologica 11: 45-52. [ Links ]
McLaurin-Moreno D, Arizmendi-Castillo E. 2002. Five centuries of Mexican pearls. Australian Gemmologist. 21: 190-201. [ Links ]
McLaurin-Moreno D, Arizmendi-Castillo E, Farell S, Nava M. 1997. Pearls and pearl oysters from the Gulf of California, Mexico: An update. Australian Gemmologist. 19: 497-502. [ Links ]
Millione M, Southgate PC. 2012. Growth of the winged pearl oyster, Pteria penguin, at dissimilar sites in northeastern Australia. J. Shellfish Res. 31: 13-20. [ Links ]
Monteforte M. 2013. Instalación y operación de granjas perleras: Un manual para Pinctada mazatlanica y Pteria sterna. Editorial Academica Española, Barcelona, España, 184 pp. [ Links ]
Monteforte M, Bervera H, Ramírez JJ, Saucedo PE, López C. 2005. Effect of stocking density on growth and survival of the rainbow pearl oyster Pteria sterna (Gould 1852) during nursery and late culture in Bahía de La Paz, BCS, Mexico. Aquacult. Int. 13: 391-407. [ Links ]
Muñoz-Barbosa A, Gaxiola-Castro G, Segovia-Zavala JA. 1991. Temporal variability of primary productivity, chlorophyll and seston in Bahía de los Ángeles, Gulf of California. Cienc. Mar. 17: 47-68. [ Links ]
Pouvreau S, Prasil V. 2001. Growth of the blacklip pearl oyster, Pinctada margaritifera, at nine culture sites in French Polynesia: Synthesis of several sampling designs conducted between 1994 and 1999. Aquat. Living Resour. 145: 155-163. [ Links ]
Ratkowsky DA. 1986. Statistical properties of alternative parameterizations of the von Bertalanffy growth curve. Can. J. Fish. Aquat. Sci. 43: 742-747. [ Links ]
Roff DA. 1980. A motion for the retirement of the von Bertalanffy function. Can. J. Fish. Aquat. Sci. 37: 127-129. [ Links ]
Romo-Piñera AK. 2010. Estrategia reproductiva de Megapitaria squalida (Sowerby 1835) en dos zonas de Baja California Sur, Mexico. PhD thesis, Centro Interdisciplinario de Ciencias Marinas del IPN, La Paz, BCS, Mexico, 107 pp. [ Links ]
Ruíz-Rubio H, Acosta-Salmón H, Olivera A, Southgate PC, Rangel-Dávalos C. 2006. The influence of culture method and culture period on quality of half-pearls ('mabe') from the winged pearl oyster Pteria sterna, Gould 1851. Aquaculture 254: 269-274. [ Links ]
Ruíz-Velazco JMJ, Hernández-Llamas A, Gómez-Muñoz VM, Magallón FJ. 2010. Dynamics of intensive production of shrimp Litopenaeus vannamei affected by white spot disease. Aquaculture 300: 113-119. [ Links ]
Saucedo PE, Monteforte M. 1997a. In situ growth of pearl oyster Pinctada mazatlanica (Hanley 1856) and Pteria sterna (Gould 1851) under repopulation conditions at Bahía de La Paz, Baja California Sur, Mexico. Aquac. Res. 28: 367-368. [ Links ]
Saucedo PE, Monteforte M. 1997b. Breeding cycle of pearl oysters Pinctada mazatlanica and Pteria sterna (Bivalvia: Pteriidae) at Bahia de La Paz, Baja California Sur, Mexico. J. Shellfish Res. 16: 103-110. [ Links ]
Saucedo PE, Monteforte M, Blanc F. 1998. Changes in shell dimensions of pearl oysters Pinctada mazatlanica (Hanley 1856) and Pteria sterna (Gould 1851) during growth as criteria for Mabé pearl implants. Aquacult. Res. 29: 801-814. [ Links ]
SEMARNAT. 2013. Norma Oficial Mexicana NOM-058-PESC/ SEMARNAT-2010. Regulación del cultivo de las ostras perleras: madreperla (Pinctada mazatlanica), concha nácar (Pteria sterna), madreperla del Atlántico (Pinctada imbricata) y la ostra perlera alada del Atlántico (Pteria colymbus) en aguas marinas de jurisdicción federal de los Estados Unidos Mexicanos. Diario Oficial de la Federación. Mexico City. [ Links ]
Sicard MT, Maeda-Martínez AN, Lluch-Cota SE, Lodeiros CJ, Roldán-Carrillo L, Mendoza-Alfaro R. 2006. Frequent monitoring of temperature: An essential requirement for site selection in bivalve aquaculture in tropical-temperate transition zones. Aquacult. Res. 37: 1040-1049. [ Links ]
Sims NA. 1994. Growth of wild and cultured black-lip pearl oysters Pinctada margaritifera (L.) (Pteriidae; Bivalvia) in the Cook Islands. Aquaculture 122: 181-191. [ Links ]
Sokal RR, Rohlf FJ. 1981. Biometry. 2nd ed. WH Freeman, San Francisco, California, 891 pp. [ Links ]
Taylor J, Strack E. 2008. Pearl production. In: Southgate PC, Lucas JS (eds.), The Pearl Oyster: Biology and Culture. Elsevier Science Publishers, Amsterdam, pp. 273-302. [ Links ]
Torres-Zepeda MG, Morales-Salvador J, Peralta-Montes L. 2002. Evaluación de la captación estacional y batimétrica de semilla de la madreperla Pinctada mazatlanica (Hanley 1856) y la concha nácar Pteria sterna (Gould 1851) en colectores artificiales en la Bahía de Acapulco (Guerrero, México). In: Memorias del Congreso Iberoamericano Virtual de Acuicultura (CIVA, http://www.revistaaquatic.com/civa2002), pp. 388-408. [ Links ]
Vite-García MN, Saucedo PE. 2008. Energy storage and allocation during reproduction of pearl oyster Pteria sterna (Gould 1851) at Bahía de La Paz, Baja California Sur, México. J. Shellfish Res. 27: 375-383. [ Links ]














