Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.39 no.3 Ensenada sep. 2013
Artículos
Pastoreo del dinoflagelado Noctiluca scintillans sobre el dinoflagelado productor de toxinas paralizantes Gymnodinium catenatum: ¿Elimina el pastoreo células durante un florecimiento?
Grazing of the dinoflagellate Noctiluca scintillans on the paralytic toxin-producing dinoflagellate Gymnodinium catenatum: Does grazing eliminate cells during a bloom?
José J Bustillos-Guzmán1*, Christine J Band-Schmidt2, David J López-Cortés1, Francisco E Hernández-Sandoval1, Erick Núñez-Vázquez1, Ismael Gárate-Lizárraga2
1 Centro de Investigaciones Biológicas del Noroeste (CIBNOR), Instituto Politécnico Nacional 195, Col. Playa Palo de Santa Rita Sur, La Paz, Baja California Sur, 23096, México.
2 Centro Interdisciplinario de Ciencias Marinas-Instituto Politécnico Nacional (CICIMAR), Departamento de Plancton y Ecología Marina, Av. Instituto Politécnico Nacional s/n, La Paz, Baja California Sur, 23096, México.
* Corresponding author.
E-mail: jose04@cibnor.mx
Received October 2012
Received in revised form April 2013
Accepted April 2013
RESUMEN
Se monitoreó la temperatura y los nutrientes durante una proliferación de Noctiluca scintillans y Gymnodinium catenatum en la bahía de La Paz, golfo de California. También, bajo condiciones de laboratorio, se mezclaron diferentes concentraciones de G. catenatum (312, 625, o 1015 células mL-1) con 0.53 células de N. scintillans mL-1 a fin de evaluar las tasas de pastoreo. La experimentación se llevó a cabo en 750 mL de cultivo durante un periodo de cinco días. La temperatura superficial mostró claramente un periodo de transición de agua fría a caliente durante la proliferación. Las observaciones de campo y las de laboratorio mostraron que N. scintillans se alimentaba de G. catenatum. En el laboratorio, más del 70% de N. scintillans contenía células de G. catenatum en sus vacuolas. La tasas de ingestión variaron ampliamente; los valores más altos variaron de 30 a 40 células de G. catenatum h-1 en cada célula de N. scintillans. No se observó una relación entre las diferentes concentraciones de G. catenatum ofrecidas y la tasa de ingestión. Al final del experimento se observaron tasas de ingestión bajas de 1a 3 células de G. catenatum h-1 en cada célula de N. scintillans. La concentración de N. scintillans se duplicó aproximadamente cada 48 h; sin embargo, observamos numerosos trofontes saliendo de su cubierta externa, lo cual sugiere que existió daño celular. Estos datos indican que N. scintillans ingiere a G. catenatum pero la presa parece dañar al depredador en un corto plazo.
Palabras clave: Gymnodinium catenatum, Noctiluca scintillans, pastoreo, biocontrol, bahía de La Paz.
ABSTRACT
Temperature and nutrient concentrations were measured during a mixed bloom of Noctiluca scintillans and Gymnodinium catenatum in La Paz Bay, Gulf of California. Under laboratory conditions, we offered three concentrations of G. catenatum (312, 625, or 1015 cells mL-1) to 0.53 N. scintillans cells mL-1 to study predation rates. Experiments were carried out with 750 mL of culture during a five-day period. Sea surface temperature clearly showed a transitional period from colder to warmer water during the bloom. Field and laboratory data showed that N. scintillans fed on G. catenatum. During the trial, more than 70% of N. scintillans cells contained G. catenatum cells in their vacuoles. Ingestion rates varied; the highest ranged from 30 to 40 G. catenatum cells h-1 in each N. scintillans cell. A clear relation to the concentration of the diet was not evident. Low values of 1 to 3 G. catenatum cells h-1 in each N. scintillans cell were typical at the end of the trial. Noctiluca scintillans doubled in concentration about every 48 h; however, numerous trophonts were observed leaving the cytoplasmic membrane, suggesting cell damage. These data indicate that N. scintillans ingests G. catenatum cells but the prey appears to damage predator cells in a relatively short time.
Key words: Gymnodinium catenatum, Noctiluca scintillans, grazing, biocontrol, La Paz Bay.
INTRODUCCIÓN
Noctiluca scintillans (Macartney) Kofoid y Swezy 1921 es un dinoflagelado heterótrofo grande que forma florecimientos algales evidentes en todo el mundo (Elbrächter y Qi 1998). Tiene un ciclo de vida complejo con al menos 12 estadios, en los cuales tanto los trofontes maduros como los pequeños que han desarrollado completamente el tentáculo tienen capacidad fagotrófica (Fukuda y Endoh 2006). Su papel como depredador sobre diatomeas, dinoflagelados y mesozooplancton ya ha sido documentado (Quevedo et al. 1999, Fonda-Umani et al. 2004, Escalera et al. 2007), así como su papel como vector de toxinas (Escalera et al. 2007). En el golfo de California, N. scintillans es una especie importante del plancton y una de las principales formadoras de florecimientos algales (Gárate-Lizárraga 1991, Cortés-Altamirano et al. 1995, Cortés-Altamirano y Alonso-Rodríguez 1997). Como depredador, sus vacuolas alimenticias pueden contener algas tóxicas y jugar un papel importante en la dinámica de los florecimientos algales nocivos (Alonso-Rodríguez et al. 2005, Escalera et al. 2007, Azanza et al. 2009). Los procesos de bioconversión o excreción de la saxitoxina a sus análogos de menor potencia proveen información adicional para esta sugerencia (Azanza et al. 2009, Frangópulos et al. 2011). El dinoflagelado Gymnodinium catenatum Graham 1943 es uno de los principales productores de toxina paralizante de moluscos y formadores de florecimientos de la costa oeste de México. Esta especie ha sido responsable del envenenamiento de animales y humanos (revisado por Band-Schmidt et al. 2010). Hasta donde se conoce, la interacción de estas dos especies como depredador y presa en condiciones naturales sólo ha sido observada por Alonso-Rodríguez et al. (2005), quienes describieron que en las vacuolas de N. scintillans había G. catenatum durante un florecimiento en las costas de Sinaloa. Estos autores concluyeron que N. scintillans juega un papel importante en la dinámica del florecimiento de G. catenatum y sugirieron que N. scintillans podría ser usado como un agente de biocontrol de G. catenatum.
De marzo a abril de 2007, dentro de nuestro plan de monitoreo, encontramos a G. catenatum y N. scintillans en la bahía de La Paz en el golfo de California. Durante este florecimiento, se observó que un porcentaje importante de N. scintillans contenía células de G. catenatum en sus vacuolas. La coexistencia de ambas especies en la bahía nos dió la oportunidad de determinar la capacidad depredadora de N. scintillans sobre G. catenatum en condiciones de laboratorio y en el campo.
El propósito de este trabajo fue confirmar la capacidad depredadora de N. scintillans sobre G. catenatum, enfocándonos en determinar la proporción de N. scintillans que contenía células de G. catenatum y las tasas de depredación en condiciones de laboratorio. De forma paralela, se midieron las condiciones físicas y químicas en el ambiente para entender las condiciones ambientales que favorecieron la presencia de ambas especies en la bahía de La Paz.
MATERIALES Y MÉTODOS
Mediciones en el campo
Como parte del programa de monitoreo, se tomaron muestras en cinco estaciones (fig. 1) localizadas dentro del área del florecimiento de N. scintillans y áreas colindantes. La temperatura superficial del agua de mar se determinó con un termómetro de cubeta, y los análisis de nutrientes (nitrato, fosfato y amonio) se realizaron con un autoanalizador de iones de flujo contínuo (QuikChem 8000 Series, Lachat Instruments, Milwaukee, WI) y mediante métodos espectrométricos descritos por Strickland y Parsons (1972) .

Aislamiento y cultivo de Gymnodinium catenatum
Se recolectaron células vegetativas de G. catenatum en bahía Concepción en el golfo de California mediante arrastres verticales con red de fitoplancton de 20 μm de luz de malla. El concentrado celular se tamizó a través de una malla de 60 μm para eliminar organismos de mayor tamaño. Este concentrado se colocó en recipientes de cultivo de tejidos de 250 mL que contenían agua de mar enriquecida con medio f/2 modificado adicionando H2SeO3 (0.01 μM L-1) y la concentración de CuSO4 reducida a 0.01 μM L-1 (Anderson et al. 1984). En el laboratorio, las células vegetativas de G. catenatum se aislaron de los cultivos enriquecidos mediante micropipetas bajo un microscopio invertido (Axio Vert 100, Carl Zeiss, Oberkochen, Alemania). Las células individuales y cadenas se transfirieron a placas de 96 pozos que contenían medio f/2 modificado y se mantuvieron a 20 ± 1 °C con una iluminación de 150 μmol fotones m-2 s-1 con lámparas fluorescentes en un ciclo de luz:oscuridad 12:12. Para los experimentos, se utilizó la cepa GCCV-7 de G. catenatum. Los detalles de la cepa aislada se pueden consultar en los archivos de la Colección de Dinoflagelados Marinos (CODIMAR) del CIBNOR, La Paz, México (Morquecho 2008). Para obtener suficiente biomasa para los experimentos de pastoreo, la cepa GCCV-7 se cultivó en siete matraces de 1 L en medio f/2 modificado (Band-Schmidt et al. 2005) a 24-26 °C ± 1 °C con agua de mar obtenida de la bahía de La Paz (34 de salinidad) y con una iluminación de 150 μmol fotones m-2 s-1 proporcionada con lámparas fluorescentes en un ciclo luz:oscuridad 12:12. El agua de mar y los nutrientes se esterilizaron por filtración (0.22 μm). Los cultivos se mantuvieron en matraces de 1000 mL de 9 a 18 días antes de cosechar las células para el experimento.
Noctiluca scintillans
Las células de N. scintillans del florecimiento presentado en Marzo de 2007 en la bahía de La Paz en el golfo de California se recolectaron mediante arrastres verticales de plancton (60 μm luz de malla) en una estación (24°12.90' N, 110°19.57' O; fig. 1). Las muestras de plancton se transportaron inmediatamente al laboratorio en una hielera de 150 L en oscuridad. Las células de dinoflagelados se agitaron suavemente, y se tomaron muestras de 5 mL y 20 mL para realizar conteos bajo un microscopio óptico (20x). Suavemente se vacío una alícuota de ~400 células de N. scintillans en matraces de 1000 mL con 750 mL de cultivo de G. catenatum.
Se probaron tres concentraciones de G. catenatum (312, 625 y 1015 células mL-1) con N. scintillans (~0.53 células mL-1). Cada tratamiento se realizó por triplicado. Se mezcló G. catenatum (sin N. scintillans) con agua de mar filtrada a través de un filtro de 0.22 μM GF/F que se recolectó en la misma localidad que se recolectó a N. scintillans y se colocó en un matraz en la misma proporción que los matraces utilizados para calcular las tasas de crecimiento. Una alícuota de N. scintillans fue colocada en agua de mar sin alimento y se utilizó como control. Las condiciones fueron las mismas que se emplearon para el mantenimiento de los cultivos de G. catenatum. Una vez montado el experimento, se tomaron muestras de 2 mL del cultivo de G. catenatum a las 0, 24, 48, 72 y 120 h para su conteo. Se fijó una muestra de 100 mL con lugol para calcular la proporción de N. scintillans con y sin G. catenatum dentro de sus vacuolas. Estás concentraciones se basaron en las abundancias previas registradas en florecimientos de N. scintillans (Uhlig y Sahling 1990, Kirchner et al. 1996, Cortés-Altamirano et al. 2007) y G. catenatum (Band-Schmidt et al. 2010, Hallegraeff et al. 2012, Quijano-Scheggia et al. 2012).
Tasas de ingesta
Las tasas de ingesta (TI) se estimaron de acuerdo con Frost (1972): TI (número de G. catenatum/N.scintillans-1 h-1) = tasa de filtración (mL eliminados por cada Noctiluca h-1) x concentración celular (G. catenatum mL-1). Los cambios de N. scintillans por crecimiento (CR) o mortalidad (-CR) se determinaron de acuerdo con Bamstedt et al. (2000): CR o -CR = [ln(Nt+1)/ln(Nt)] /t, donde Nt y Nt+1 son las concentraciones celulares al tiempo t y t +1, respectivamente. Este valor se dividió por ln(2) para expresar los resultados de divisiones por día.
Observaciones de Noctiluca scintillans
Se observaron las células vivas del campo y del laboratorio bajo un microscopio invertido. Se realizaron observaciones de N. scintillans y G. catenatum en cada tratamiento por triplicado a las 0, 24, 48, 72 y 120 h después de la incubación. Se tomaron fotografías de células vivas utilizando el software de análisis de imágenes (Image-Pro Plus, Media Cybernetics, Bethesda, MD) y una cámara digital acoplada a un microscopio (Olympus BX41, Olympus America, Central Valley, PA).
Análisis estadísticos
Se realizó un análisis de varianza (ANOVA) para determinar diferencias significativas en el crecimiento exponencial y las tasas de ingesta. Para determinar el efecto de cada tratamiento a cada intervalo de tiempo en cada variable respuesta, se llevó a cabo un ANOVA de una sola vía. Para determinar la normalidad de los datos, se aplicó una prueba de Kolmogorov-Smirnov. Si los datos no se ajustaban a la distribución, éstos se transformaban a logaritmo. Todos los análisis se llevaron a cabo utilizando el programa Statistica 5.0 (StatSoft, Tulsa, OK) con un nivel mínimo de significancia de α = 0.05.
RESULTADOS Y DISCUSIÓN
Condiciones hidrológicas en la bahía de La Paz durante el florecimiento de Noctiluca scintillans
La temperatura superficial en la bahía de La Paz (Marzo, 2007) fue de entre 20 y 21.9 °C. Las concentraciones de nutrientes fueron relativamente bajas (<3 μmol L-1) excepto las del silicato (tabla 1). Los valores de silicatos en el área han sido altos (Lechuga-Devéze et al. 1986, Cervantes-Duarte et al. 2001, Reyes-Salinas et al. 2003) y se deben a los aportes terrestres externos (lluvia y partículas ricas en sílice), así como al transporte eólico (Cervantes-Duarte et al. 2001). Los perfiles verticales de temperatura mostraron de manera clara el periodo transicional de condiciones de mezcla a condiciones de estratificación en la bahía (Hernández-Sandoval et al. 2009). Estas condiciones se han asociado con la proliferación de N. scintillans en el sur del golfo de California, incluyendo la bahía de La Paz (Gárate-Lizárraga 1991, Cortés-Altamirano y Alonso-Rodríguez 1997) y también de G. catenatum (Cortés-Altamirano y Núñez-Pasten 1992, Cortés-Altamirano y Alonso-Rodríguez 1997, Cortés-Altamirano et al. 1999, Alonso-Rodríguez et al. 2005). En este caso, la proliferación de N. scintillans probablemente fue debida a las corrientes de advección o del viento desde las áreas adyacentes donde las condiciones físicas y químicas fueron adecuadas para su crecimiento. En el presente estudio, las condiciones hidrológicas fueron similares a las encontradas en otros eventos cuando G. catenatum estuvo presente en la bahía de La Paz (Hernández-Sandoval et al. 2009) y la bahía de Mazatlán (Cortés-Altamirano et al. 1999). Las aguas relativamente frías y ricas en nutrientes y la proliferación de G. catenatum en la bahía de Mazatlán han sido producto de eventos de surgencias (Cortés-Altamirano et al. 1999, Alonso-Rodríguez 2004) en el golfo de California.
Interaccion de Noctiluca scintillans y Gymnodinium catenatum
Las observaciones de campo muestran claramente que N. scintillans ingiere G. catenatum (fig. 2). Se registraron numerosas vacuolas que contenían células de G. catenatum individuales o en cadenas tanto en trofontes maduros (fig. 2a) como en organismos pequeños (fig. 2b). En algunos casos se observaron hasta 40 células de G. catenatum dentro de N. scintillans (datos no mostrados). En las muestras de campo, 22% de N. scintillans se encontraron con al menos una célula de G. catenatum en sus vacuolas (fig. 3), lo que sugiere que la población de N. scintillans aún estaba alimentándose. El porcentaje se incrementó a 70% y 94% en las muestras de los experimentos realizados (fig. 3). El análisis estadístico no mostro diferencias significativas en los porcentajes de N. scintillans con la presa en su interior entre las tres concentraciones de G. catenatum probadas, lo que sugiere que no existió una saciedad del alimento.


La dieta natural de N. scintillans incluye varias presas, como fitoplancton, nauplios, huevos de zooplancton, detritus orgánico y bacterias (Schaumann et al. 1988, Kirchner et al. 1996, Elbrächter y Qi 1998, Quevedo et al. 1999). Se han documentado algunos aspectos negativos del pastoreo de Noctiluca sobre huevos de Acartia clausi y nauplios. En las costas Cantabrianas (España), N. scintillans ingirió 73% de la totalidad de los huevos de Acartia clausi, lo que llevó a sugerir un efecto negativo en el reclutamiento de los nauplios a la población (Quevedo et al. 1999). Nuestros resultados confirman los resultados de Alonso-Rodríguez et al. (2005) y Albinsson et al. (2006) sobre la ingesta que N. scintillans realiza sobre G. catenatum, además de que el alto porcentaje de N. scintillans con G. catenatum en el interior de sus vacuolas sugiere que esta presa es de alta aceptación. Las tasas de ingesta variaron de 0 a 19.4 células h-1 (fig. 4). Estas tasas fueron variables dentro del mismo tratamiento (como lo demuestra la desviación estándar), y no se observó un patrón de consumo claro relacionado con las diversas dietas ni con el tiempo de experimentación. Sin embargo, en el tratamiento con densidad intermedia y alta de la presa es evidente que la tasa de consumo disminuyó luego de las 48 h. Hansen et al. (2004) encontraron que la forma verde de N. scintillans alimentado con Pyrodinium bahamense var. compressum tuvo una tasa de ingesta de de ~16 células de P. bahamense d-1 a una densidad de 540 células mL-1. Estos autores observaron que las tasas de ingesta incrementaron linealmente con el incremento de la concentración de la presa, aunque tampoco observaron saciedad. Nakamura (1998) registraron que cuando N. scintillans fue alimentada con dos especies de rafidofitas, Chattonella antiqua y Heterosigma akashiwo, las tasas de ingesta aumentaron linealmente con la concentración de la presa, y estas tasas alcanzaron 4.1 células de C. antiqua h-1 y 62.5 células de H. akashiwo h-1 a la máxima concentración de la presa de ~500 células de C. antiqua mL-1 y ~11,000 células de H. akashiwo mL-1. En este último estudio, las especies con un diámetro esférico menor (diámetro <5μm), tal como Isochrysis galbana y Chlamydomonas parkeae, no fueron adecuadas como presa. Esto demuestra la importancia del tamaño de la presa ya que N. scintillans ingiere en mayor cantidad presas de mayor tamaño. El diámetro de las células de G. catenatum utilizadas en nuestros experimentos oscilaron entre 20 y 30 Lim. Las tasas de ingesta en el presente estudio fueron relativamente altas; sin embargo, hasta donde sabemos, no existen trabajos sobre la ingesta de N. scintillans sobre G. catenatum, por lo que la comparación realizada anteriormente debe tomarse con precaución. De acuerdo con Yilmaz et al. (2005), N. scintillans tiene una estrategia de alimentación oportunista tipo r. Esta estrategia es evidente en este trabajo, sugerida por las altas tasas de consumo mostradas. Bajo condiciones naturales, se han observado hasta 18 huevos de A. clausi (Quevedo et al. 1999) o 27 huevos de copépodos (Daan 1987) en una sola célula de N. scintillans. Nuestros resultados sugieren también que este dinoflagelado tiene una capacidad alta de pastoreo. Otras características, aparte del tamaño, como la toxicidad o el perfil de toxinas del dinoflagelado pueden tener un efecto en las tasas de pastoreo. La cepa utilizada en este trabajo es de las menos tóxicas de otras cepas aisladas de las costas mexicanas (promedio 13 pg STXeq célula-1), con un perfil dominado por las toxinas sulfocarbamoil tipo C (Band-Schmidt et al. 2010). Este grupo de toxinas son las menos potentes de los análogos de la saxitoxina (Oshima 1995).

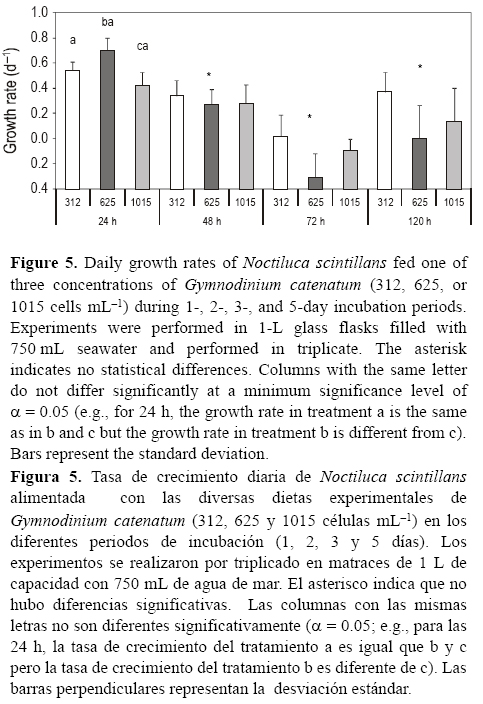
El crecimiento de N. scintillans fue importante en todas las dietas, casi duplicándose en el primer día (de 0.43 a 0.70 d-1) y luego disminuyendo ligeramente hasta el tercer día de incubación, cuando se observó un crecimiento nulo o negativo (fig. 5). En el día 5, se observó un crecimiento positivo en los tratamientos de menor y mayor concentración de G. catenatum (0.37 y 0.14 d-1, respectivamente). Sin embargo solo se encontraron diferencias significativas para el día 1 entre los tratamientos con 625 y 1015 células mL-1. Noctiluca scintillans, incubada sólo en agua de mar y medio de cultivo (dos controles), también tuvo un crecimiento positivo hasta el día 1 (0.40 d-1), pero las células murieron luego de ese tiempo (datos no mostrados). Estos resultados sugieren que N. scintillans pudo crecer debido a su capacidad fotosintética o debido al alimento que había ingerido previo a su captura (G catenatum y otras presas). Aunque si consideramos que luego del tercer día hubo un crecimiento nulo o negativo, entonces podemos suponer que G. catenatum puede ser una presa con un contenido nutricional bajo o bien que produce metabolitos que afectan el crecimiento de N. scintillans luego de alimentarse con G. catenatum por un tiempo relativamente largo. La muerte también pude asociarse a los metabolitos tóxicos del mismo N. scintillans por la alta densidad utilizada. Azanza et al. (2009) observaron que al alimentar a N. scintillans con P. bahamense y luego con una presa alternativa o sustancias orgánicas, la depredación sobre el dinoflagelado disminuyó y el crecimiento de N. scintillans fue mayor cuando tenía las presas adicionales.
Al final de los experimentos se encontraron muchas células de N. scintillans deformadas. Estas células se parecían a los cigotos de los estadios iniciales de desarrollo pero con una cubierta externa flácida a su alrededor (fig. 6a, b). Algunos de estos cigotos tenían vacuolas con células de G. catenatum (fig. 6b). Según Fukuda (Tohoku University, Japón; com. pers.), los trofontes maduros dejan su cubierta externa y se transforman en células esféricas, tipo cigoto, cuando hay un daño a la célula para luego renovarse. De lo anterior, es factible pensar que a pesar de que N. scintillans se alimenta de G. catenatum, este dinoflagelado no fue un alimento adecuado durante las incubaciones. Frangópulos et al. (2000) ha documentado que tanto la fecundidad como la producción de huevos por A. clausi fueron afectados cuando los adultos fueron alimentados con el dinoflagelado productor de toxinas paralizantes Alexandrium minimum por varios días. Estos autores también sugieren que el copépodo al alimentarse llega a un umbral que se autolimita por la asimilación de las toxinas. Esto se interpreta como la utilización de parte de la energía asimilada para eliminar o manejar las toxinas, por lo que menos energía se canaliza hacia la producción de huevos (Dutz 1998). Esto es consistente con nuestra observación de cigotos de N. scintillans que se desprendieron de la membrana celular luego de la ingestión de células tóxicas por varios días.

CONCLUSIONES
Noctiluca scintillans ejerce una depredación importante sobre el dinoflagelado G. catenatum, tanto en condiciones naturales como en condiciones de laboratorio; sin embargo, esta presa parece no ser adecuada para sostener el crecimiento de N. scintillans por más de cinco días, probablemente debido al daño bioquímico ejercido por G. catenatum. La utilización de N. scintillans como biocontrol de florecimientos de G. catenatum se apoya con estos resultados; sin embargo, el hecho de que no hubo diferencias en las tasa de ingesta en las diversas densidades de G. catenatum ofrecidas indica que N. scintillans tiene una capacidad de biocontrol limitada. Si la capacidad de excreción/biotransformación de toxinas paralizantes de N. scintillans registrada por Azanza et al. (2009) se aplica a este modelo, entonces el consumo de N. scintillans podría ser adecuado para controlar las toxinas producidas por G. catenatum. También se debe considerar que N. scintillans es un productor de amonio (Montani et al. 1998), que posiblemente sea un estimulador del crecimiento de G. catenatum. Este es un tema que debe investigarse, ya que se ha demostrado que G. catenatum tiene una alta afinidad hacia el amonio (Yamamoto et al. 2004). Se debe investigar lo que sucede con las toxinas, así como el número adecuado de células de Noctiluca que pueden utilizarse para controlar a la población G. catenatum, antes de su utilización como biocontrol de G. catenatum; también es necesario comprender la participación de N. scintillans en la dinámica del florecimiento.
AGRADECIMIENTOS
Este estudio fue financiado con los proyectos institucionales SIP 2013-0942 (CICIMAR), PC3.1 y PC3.2 (CIBNOR), y proyectos CONACyT (SEP 2007-84064, SNI2008-90102, 178227). Agradecemos a J Bashan por prestarnos la cámara y el microscopio y a Ira Fogel la edición del trabajo en inglés. También agradecemos a los revisores anónimos sus sugerencias, que ayudaron a mejorar este trabajo.
REFERENCIAS
Albinsson ME, Blackburn SI, Legrand C. 2006. The effect of Noctiluca scintillans on harmful algal species of southeastern Australia. Abstract of ISSHA 12th International Conference on Harmful Algae (Copenhagen, Denmark), p. 123. [ Links ]
Alonso-Rodríguez R. 2004. Hidrología y condiciones ambientales que determinan la proliferación de dinoflagelados causantes de mareas rojas en la bahía de Mazatlán, Sin., México. PhD thesis, Centro de Investigaciones Biológicas del Noroeste, La Paz, BCS, México, 117 pp. [ Links ]
Alonso-Rodríguez R, Ochoa JL, Uribe-Alcocer M. 2005. Grazing of heterotrophic dinoflagellate Noctiluca scintillans (Mcartney) Kofoid on Gymnodinium catenatum Graham. Rev. Latinoam. Microbiol. 47: 6-10. [ Links ]
Anderson DM, Kulis DM, Binder BJ. 1984. Sexuality and cyst formation in the dinoflagellate Gonyaulax tamarensis: Cystyield in batch cultures. J. Phycol. 20: 418-425. http://dx.doi.org/10.1111/j.0022-3646.1984.00418.x [ Links ]
Azanza RV, Cruz LJ, Cariño FA, Blanco AG, Butardo Jr VM. 2009. Paralytic shellfish toxin concentration and cell density changes in Pyrodinium bahamense - Noctiluca scintillans feeding experiments. Toxicon 55: 1017-1023. http://dx.doi.org/10.1016/j.toxicon.2009.09.017 [ Links ]
Bamstedt U, Gifford DJ, Irigoin X, Atkinson A, Roman M. 2000. Feeding. In: Harris R, Wiebe P, Lenz J, Skjoldal HR, Huntley M (eds.), ICES Zooplankton Methodology Manual. Academic Press, London, pp. 297-399. [ Links ]
Band-Schmidt CJ, Bustillos-Guzmán J, Gárate-Lizárraga I, Lechuga-Devéze CH, Reinhard K, Luckas B. 2005. Paralytic shellfish toxin profile in strains of the dinoflagellate Gymnodinium catenatum Graham and the scallop Argopecten ventricosus G.B. Sowerby II from Bahía Concepción, Gulf of California, Mexico. Harmful Algae 4: 21-31. http://dx.doi.org/10.1016/j.hal.2003.10.004 [ Links ]
Band-Schmidt CJ, Bustillos-Guzmán JJ, López-Cortés DJ, Gárate-Lizárraga I, Núñez-Vázquez EJ, Hernández-Sandoval FE. 2010. Ecological and physiological studies of Gymnodinium catenatum in the Mexican Pacific: A review. Mar. Drugs 8: 1935-1961. http://dx.doi.org/10.3390/md8061935 [ Links ]
Cervantes-Duarte R, Aguirre-Bahena F, Reyes-Salinas A, Valdez-Holguín JE. 2001. Caracterización hidrológica de una laguna costera de Baja California Sur, México. Oceánides 16: 93-105. [ Links ]
Cortés-Altamirano R, Núñez-Pastén A. 1992. Doce años (1979-1990) de registros de mareas rojas en la Bahía de Mazatlán, Sin., México. An. Inst. Cienc. Mar Limnol. Univ. Nac. Auton. Mex. 19: 113-121. [ Links ]
Cortés-Altamirano R, Hernández-Becerril DU, Luna-Soria R. 1995. Mareas rojas en México: Una revisión. Rev. Latinoam. Microbiol. 37: 343-52. [ Links ]
Cortés-Altamirano R, Alonso-Rodríguez R. 1997. Mareas rojas durante 1997 en la Bahía de Mazatlán, Sinaloa, México. Ciencias del Mar 15: 31-37. [ Links ]
Cortés-Altamirano R, Núñez-Pasten A, Pasten-Miranda N. 1999. Abundancia anual de Gymnodinium catenatum Graham dinoflagelado tóxico de la costa este del Golfo de California. Ciencia y Mar 7: 50-56. [ Links ]
Cortés-Altamirano R, Serrano-Hernández DE, Sierra-Beltrán AP. 2007. A bloom of Noctiluca scintillans and its possible cysts in the Gulf of California, Mexico. Harmful Algae News 34: 6-7. [ Links ]
Daan R. 1987. Impact of egg predation by Noctiluca miliaris on the summer development of copepod populations in the southern North Sea. Mar. Ecol. Prog. Ser. 37: 9-17. [ Links ]
Dutz J. 1998. Repression of fecundity in neritic copepod Acartia clausi exposed to the toxic dinoflagellate Alexandrium lusitanicum: Relationship between feeding and egg production. Mar. Ecol. Prog. Ser. 175: 97-107. http://dx.doi.org/10.3354/meps175097 [ Links ]
Elbrächter M, Qi Y-Z. 1998. Aspects of Noctiluca (Dinophyceae) population dynamics. In: Anderson DM, Cembella AD, Hallegraeff GM (eds), Physiological Ecology of Harmful Algal Blooms. NATO ASI Ser. G 41. Springer-Verlag, Berlin, pp. 315-335. [ Links ]
Escalera L, Pazos Y, Moroño Á, Reguera B. 2007. Noctiluca scintillans may act as a vector of toxigenic microalgae. Harmful Algae 6: 317-32. http://dx.doi.org/10.1016/j.hal.2006.04.006 [ Links ]
Fonda-Umani S, Beran A, Parlato S, Virgilio D, Zollet T, DeOlazabal A, Lazzarini B, Cabrini M. 2004. Noctiluca scintillans (Mccartney) in the Northern Adriatic Sea: Long-term dynamics, relationship with temperature and eutrophication, and role in the food web. J. Plankton Res. 26: 545-561. http://dx.doi.org/10.1093/plankt/fbh045 [ Links ]
Frangópulos MC, Guisande C, Maneiro I. Rivero I, Franco J. 2000. Short- and long-term effects of the toxic dinoflagellate Alexandrium minutum on the copepod Acartia clausi. Mar. Ecol. Prog. Ser. 203: 161-169. http://dx.doi.org/10.3354/meps203161 [ Links ]
Frangópulos M, Spyrakos E, Guisante C. 2011. Ingestion and clearance rates of the red Noctiluca scintillans fed on the toxic dinoflagellate Alexandrium minutum (Halim). Harmful Algae 10:304-309. http://dx.doi.org/10.1016/j.hal.2010.11.002 [ Links ]
Frost BW. 1972. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus. Limnol. Oceanogr. 17: 805-815. [ Links ]
Fukuda Y, Endoh H. 2006. New details from the complete life cycle of the red-tide dinoflagellate Noctiluca scintillans (Ehrenberg) McCartney. Eur. J. Protistol. 42: 209-219. [ Links ]
Gárate-Lizárraga I. 1991. Análisis de una marea roja causada por Noctiluca scintillans (McCartney) Ehrenberg en Bahía Concepción, Baja California Sur, en febrero de 1989. Rev. Invest. Cient. 2: 35-43. [ Links ]
Hallegraeff GM, Blackburn SI, Doblin MA, Bolch CJS. 2012. Global toxicology, ecophysiology and population relationships of the chainforming PST dinoflagellate Gymnodinium catenatum. Harmful Algae 14: 130-143. http://dx.doi.org/10.1016/j.hal.2011.10.018 [ Links ]
Hansen JP, Miranda L, Azanza R. 2004. Green Noctiluca scintillans: A dinoflagellate with its own greenhouse. Mar. Ecol. Prog. Ser. 275: 79-87. http://dx.doi.org/10.3354/meps275079 [ Links ]
Hernández-Sandoval FE, López-Cortés DJ, Núñez-Vázquez EJ, Band-Schmidt CJ, Gárate-Lizárraga I, Bustillos-Guzmán JJ, 2009. Comparative paralytic shellfish toxin profile in six bivalve molluscs during the first outbreak of Gymnodinium catenatum in Bahía de La Paz, Mexico. 2007. Hidrobiológica 19: 245-256. [ Links ]
Kirchner M, Sahling G, Uhlig G, Gunkel W, Klings KW. 1996. Does the red tide-forming dinoflagellate Noctiluca scintillans feed on bacteria? Sarsia 81: 45-55. [ Links ]
Lechuga-Devéze CH, García-Pámanes J, Bustillos-Guzmán JJ. 1986. Condiciones ecológicas de una laguna costera de la costa oeste del Golfo de California. Turbiedad y clorofila a. Cienc. Mar. 12(1): 19-31. [ Links ]
Morquecho L. 2008. Colección de Dinoflagelados Marinos (CODIMAR). Centro de Investigaciones Biológicas del Noroeste, S.C. La Paz, BCS, México, http://www.cibnor.mx/es/investigacion-joomla/colecciones-biologicas/codimar. [ Links ]
Montani S, Pithakpol S, Tad K. 1998. Nutrient regeneration in coastal seas by Noctiluca scintillans, a red tide-causing dinoflagellate. J. Mar. Biotechnol. 6: 224-228. [ Links ]
Nakamura Y. 1998. Growth and grazing of a large heterotrophic dinoflagellate, Noctiluca scintillans, in laboratory cultures. J. Plankton Res. 20: 1711-1720. http://dx.doi.org/10.1093/plankt/20.9.1711 [ Links ]
Oshima Y. 1995. Post-column derivatization liquid chromatographic method for paralytic shellfish toxins. J. AOAC Int. 78: 528-532. [ Links ]
Quevedo M, González-Quiros R, Anadon R. 1999. Evidence of heavy predation by Noctiluca scintillans on Acartia clausi (Copepoda) eggs off the central Cantabrian coast (NW Spain). Oceanol. Acta 22: 127-131. [ Links ]
Quijano-Scheggia S, Olivos-Ortiz A, Bustillos-Guzmán JJ, Garcés E, Gaviño-Rodríguez J, Galicia-Pérez MC, Patiño-Barragán M, Band-Schmidt CJ, Hernández-Sandoval FJ, López-Cortés D. 2012. Bloom of Gymnodinium catenatum Graham in Bahía Santiago and Bahía Manzanillo, Colima, Mexico. Rev. Biol. Tropical 60: 173-186. [ Links ]
Reyes-Salinas A, Cervantes-Duarte R, Morales-Pérez RA, Valdez-Holguín JE. 2003. Variabilidad estacional de la productividad primaria y su relación con la estratificación vertical en la Bahía de La Paz, BCS. Hidrobiológica 13: 103-110. [ Links ]
Schaumann K, Gerdes D, Hesse KJ, 1988. Hydrographic and biological characteristics of a Noctiluca scintillans red tide in the German Bight, 1984. Meeresforschung 32: 77-91. [ Links ]
Strickland JDH, Parsons TR. 1972. A Practical Handbook of Seawater Analysis. 2nd ed. Bull. Fish. Res. Bd. Canada, Ottawa, 310 pp. [ Links ]
Uhlig G, Sahling G. 1990. Long-term studies on Noctiluca scintillans in the German Bight. Population dynamics and red tide phenomena 1968-1988. Neth. J. Sea Res. 25: 101-112. [ Links ]
Yamamoto T, Oh SJ, Kataoka Y. 2004. Growth and uptake kinetics for nitrate, ammonium and phosphate by the toxic dinoflagellate Gymnodinium catenatum isolated from Hiroshima Bay, Japan. Fish. Sci. 70: 108-115. [ Links ]
Yilmaz IN, Okus E, Yuksek A. 2005 Evidences for influence of a heterotrophic dinoflagellate (Noctiluca scintillans) on zooplankton community structure in a highly stratified basin. Estuar. Coast. Shelf Sci. 64: 475-485. [ Links ]














