Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.39 no.3 Ensenada sep. 2013
Artículos
Hábitos temporales de alimentación de la corvina blanca Micropogonias furnieri en una laguna costera poco profunda (océano Atlántico sudoccidental, Uruguay)
Temporal feeding habits of the whitemouth croaker Micropogonias furnieri in a shallow coastal lagoon (southwestern Atlantic Ocean, Uruguay)
Daniela Olsson1, Florencia Forni1, Gustavo Saona1, José Verocai2, Walter Norbis1*
1 Laboratorio de Fisiología de la Reproducción y Ecología de Peces, Departamento de Biologia Animal, Instituto de Biología, Facultad de Ciencias, Universidad de la República, Iguá 4225, Montevideo, Uruguay.
2 Sección de Oceanología, Instituto de Ecología y Ciencias Ambientales, Facultad de Ciencias, Universidad de la República, Iguá 4225, Montevideo, Uruguay.
* Corresponding author.
E-mail: walter.norbis@gmail.com
Received August 2012
Received in revised form February 2013
Accepted February 2013
RESUMEN
Fueron analizados los contenidos estomacales de 2915 individuos de la corvina blanca, Micropogonias furnieri, entre 15.6 y 42.0 cm longitud total, recolectados en la laguna costera de Rocha, Uruguay, de 1997 a 1999. El 56% de los individuos (n = 1646) fue encontrado con contenido en sus estómagos. Se identificaron seis ítems alimenticios y se clasificaron como crustáceos (49%), poliquetos (26%), restos vegetales (15%), moluscos, juveniles de peces, y restos no identificados (éstos últimos representaron menos que el 5% del total de contenidos estomacales). Se encontró una gran proporción de estómagos con alimento de febrero a agosto de 1998, en simultaneo con bajos índices gonadosomáticos y un descenso en la temperatura del agua. Los crustáceos predominaron como ítem alimenticio desde noviembre de 1997 hasta marzo de 1998 y de noviembre a diciembre de 1998 (verano austral), mientras que los poliquetos predominaron desde abril hasta octubre de 1998 y en enero y febrero de 1999. La disponibilidad de poliquetos y su mayor frecuencia de ocurrencia en los estómagos antes del periodo reproductivo podría jugar un rol importante en la reproducción de la especie. La frecuencia de alimentación estuvo correlacionada con las clases de talla. Los peces más pequeños (<25 cm) depredaron sobre poliquetos y restos vegetales, mientras que los peces más grandes se alimentaron principalmente de crustáceos y peces. Los hábitos de alimentación temporales de M. furnieri en esta laguna costera mostraron una utilización selectiva y oportuna de los ítems presa a lo largo del año, de acuerdo con el ciclo de reproducción de la especie y la variación de la temperatura.
Palabras clave: alimentación, corvina blanca, laguna costera, Uruguay.
ABSTRACT
We analyzed the stomach contents of 2915 individuals of the whitemouth croaker, Micropogonias furnieri, ranging from 15.6 to 42.0 cm total length, collected from a coastal lagoon in Rocha, Uruguay, during 1997-1999. A total of 56% (n = 1646) of individuals were found with content in their stomachs. Six food items were identified and classified as crustaceans (49%), polychaetes (26%), vegetal debris (15%), molluscs, juvenile fishes, and unidentified contents, the latter three representing less than 5% of the total stomach contents. Fishes displayed a higher proportion of stomachs with food between February and August 1998, simultaneous with a low gonadosomatic index and a decrease in water temperature. Crustaceans were the dominant food item from November 1997 to March 1998 and from November to December 1998 (austral summer), whereas polychaetes were predominant from April to October 1998 and from January to February 1999. Availability of polychaetes and their higher frequency of occurrence in the stomachs before the reproductive period could play an important role in the reproduction of the species. Feeding frequency was correlated with length classes. Smaller fishes (<25 cm) preyed on polychaetes and vegetal debris, whereas larger fishes fed mainly on crustaceans and fishes. The temporal feeding habits of M. furnieri in this coastal lagoon showed selective and opportune utilization of prey items according to annual variability in reproductive status and water temperature.
Key words: feeding, whitemouth croaker, coastal lagoon, Uruguay.
INTRODUCCIÓN
Los estudios orientados al modelado de ecosistemas, que toman en cuenta muchas especies, requieren del conocimiento de los requerimientos alimenticios e interacciones tróficas de los organismos constituyentes (Palomares y Pauly 1999, Bozec et al. 2004). Tal conocimiento es a menudo difícil de obtener para una especie que constituye el objeto de análisis en el sistema. Las relaciones entre el alimento y la alimentación en peces en las lagunas costeras del océano Atlántico sudoccidental, particularmente en Uruguay, están poco documentadas (Araujo 1984, Castello 1985, Norbis y Galli 2004, Rodríguez-Graña et al. 2008).
La corvina blanca, Micropogonias furnieri (Desmarest 1823), es una especie demersal eurihalina costera. Su distribución se extiende desde la península de Yucatán (México, 28° N), a lo largo de la costa sur del Caribe y de la costa este de Sudamérica, hasta el golfo de San Matías (Argentina, 41° S) (Isaac 1988). La especie es particularmente abundante en el Río de la Plata y es el principal recurso para las pesquerías costeras y artesanales de Uruguay y Argentina (Arena 1990, Norbis 1995). La amplia distribución de la corvina blanca es el resultado de su gran adaptabilidad, en particular en sus hábitos de alimentación. Muchos autores han analizado el alimento y los hábitos alimenticios de esta especie en estuarios y en la plataforma continental (Puig 1986, Sánchez et al. 1991, Masello et al. 2002, Chaves y Umbria 2003, Mandali y Paes 2005, Mendoza-Carranza y Vieira 2008), la zona de rompiente marina (Texeira et al. 1992) y las lagunas costeras (Mandali y Paes 1998, Hozbor y Garcia de la Rosa 2000), y algunos han considerando las características de la población (Goncalvez et al. 1999, Mandali y Paes 1998), pero ninguno ha analizado los cambios en los hábitos alimenticios en el tiempo. La corvina blanca tiene un ciclo de reproducción sincronizado con oscilaciones anuales en la temperatura, con un período de desove durante la fase cálida y un período de reposo durante la fase fría (Vizziano 2002, Vizziano et al. 2002). La disponibilidad de alimento durante el otoño y el invierno (hemisferio Sur) puede ser crítica para una maduración y una reproducción óptima de la corvina blanca dentro de la laguna. El objetivo de este trabajo fue analizar los hábitos alimenticios temporales (por mes) de la corvina blanca en una laguna costera poco profunda del océano Atlántico sudoccidental, y explorar sus relaciones con el ciclo reproductivo y la variabilidad ambiental.
MATERIALES Y MÉTODOS
La laguna de Rocha es poco profunda (profundidad media = 0.6 m; área = 72 km2), salobre y micromareal, se encuentra dentro de una cuenca de aproximadamente 1216 km2, ubicada en la costa suroeste de Sudamérica (34°33' S, 54°22' W), y es parte de la reserva de la biósfera MaB/UNESCO (fig. 1). La laguna está separada del océano por una barra de arena paralela a la costa, la cual se abre ocasionalmente debido a la acción de las tormentas del sur (gobernado por efecto del viento), aportes de agua dulce (como consecuencia de la lluvia) o acciones humanas. El efecto del viento causa un fuerte gradiente de salinidad dentro de la laguna (Pintos et al. 1991, Conde et al. 2000).

Los muestreos de la corvina fueron realizados entre noviembre de 1997 y febrero de 1999 (tabla 1) en el área sur de la laguna cerca de la barra de arena donde las características hidrodinámicas están mas influenciadas por las aguas costeras marinas (fig. 1) y donde la especie presenta una mayor frecuencia de ocurrencia y abundancia. La salinidad y la temperatura del agua fueron registradas mensualmente en el mismo punto donde se realizó la captura de los peces. Estos parámetros fueron medidos con un multiparámetro (Yellow Springs Instruments, Estados Unidos). Los peces fueron capturados al atardecer utilizando una red de arrastre de playa (40 mm de malla en las alas y 10 mm en el copo, abertura vertical de 1 m y 200 m de longitud) operada desde una profundidad de 70-80 cm hasta la línea de costa. Esta red es la más apropiada para una laguna costera y captura la mayoría de los intervalos de longitud de la corvina blanca en la laguna Rocha (Saona et al. 2003). La longitud total (LT) de todos los individuos capturados fue medida al milímetro más cercano para ambos sexos. Los estómagos intactos con contenido fueron extraídos, trasladados al laboratorio y examinados en condiciones relativamente frescas.
Los ítems alimenticios se identificaron al mínimo taxón posible utilizando una lupa binocular, excepto para los poliquetos. Los poliquetos fueron identificados solamente para conocer la especie, pero se consideraron como un único grupo para los análisis. Los ítems presa fueron agrupados en categorías taxonómicas altas (crustáceos, moluscos, poliquetos, peces, restos vegetales e ítems no identificados) con propósitos comparativos (tabla 2). El número de estómagos vacíos fue también registrado para comparar la proporción de peces con o sin contenido estomacal en cada mes de captura. Se utilizó una prueba de chi-cuadrado (Sokal y Rohlf 1995) para determinar si no existían diferencias significativas (α = 0.05) entre la proporción de estómagos con y sin alimento por mes.
La intensidad de alimentación por mes fue calculada utilizando el índice de alimentación (FI) (Hureau, 1970), definido como: FI = ƒs/ƒs + es), donde ƒs es el número de estómagos con contenido alimenticio y es es el número de estómagos vacíos por muestreo. Para cada ítem presa, se calculó la frecuencia de ocurrencia (%Fi): Fi = 100 x (si /Sc) (Hyslop, 1980), donde si es el número de estómagos que contienen la presa i, (excepto para poliquetos) y Sc es el número de estómagos con contenido. Utilizando el coeficiente de correlación no paramétrico (rs) de Spearmann (Sokal y Rohlf 1995), se analizaron las relaciones entre FI y el índice gonadosomático (IG) (calculado como IG = (peso gónada/peso corporal total) x 100) (Vizziano et al. 2002) y entre la temperatura y la salinidad en el punto de muestreo por mes.
Se aplicó la prueba de independencia G (Sokal y Rohlf 1995) a las frecuencias de ocurrencias absolutas de las categorías taxonómicas de las presas (crustáceos, moluscos, poliquetos, peces, restos vegetales e ítems no identificados) para conocer si el consumo de esos ítems fue dependiente de la talla de la corvina blanca. Para este propósito, las corvinas blancas fueron separadas en seis clases de talla (1: 15-20 cm; 2: 21-25 cm; 3: 26-30 cm 4: 31-35 cm; 5: 36-40 cm; 6: 41-45 cm) de acuerdo con Masello et al. (2002) con fines comparativos. Fue aplicado el índice de Morisita (Smith y Zaret 1982) para analizar la superposición de dieta entre las tallas. El intervalo de este índice va de cero a uno, y cuando el valor excede 0.6 puede ser considerado como una superposición biológica significativa (Langton 1982).
Se analizaron las matrices de frecuencia de ocurrencia de ítems presa por mes (M1) y para clases de talla para cada mes (M2) utilizando un análisis factorial de correspondencias (CA) (ter Braak y Smilauer 1998, Marshall y Elliott 1997). Los datos de frecuencia de ocurrencia fueron transformados logarítmicamente (ln (x + 1)) (Jackson 1993, 1997). Los primeros tres ejes de las ordenaciones CA de los ítems presa fueron entonces comparados utilizando el análisis de Procrustes y la prueba de aleatorización (PROTEST) con la aplicación de 10,000 permutaciones al azar (Jackson 1995, Peres-Neto y Jackson 2001). El PROTEST permite analizar la concordancia en la ordenación multivariada y el valor m12 es un buen ajuste estadístico. Valores pequeños de m12 indican alta concordancia entre las matrices.
RESULTADOS
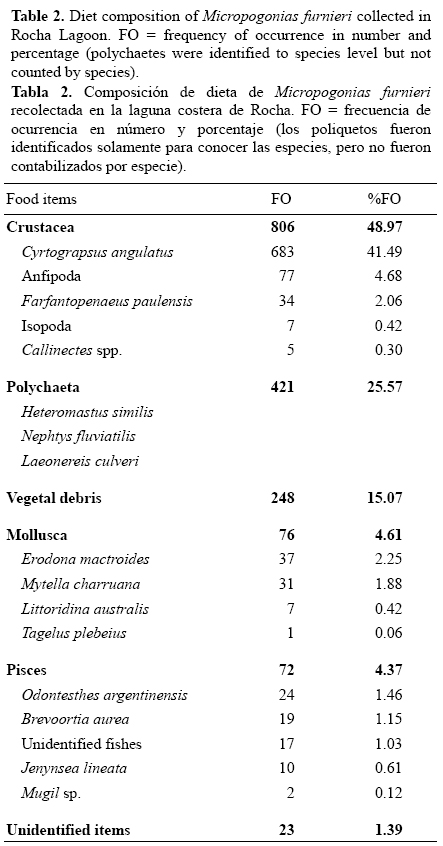
La variación en la temperatura del agua describió un ciclo estacional a lo largo del período de estudio. Las temperaturas disminuyeron de 19 °C en abril (otoño austral) a 11 °C en agosto (invierno austral), seguidas de un incremento de 12.5 °C a 25.5 °C en la primavera austral (septiembre a noviembre 1998). Por otro lado, la salinidad del agua fue muy variable a lo largo del período de estudio (fig. 2), con picos en febrero, abril, junio, agosto y octubre que estuvieron relacionados con la apertura de la barra de arena.
Fueron analizados los estómagos de 2915 individuos que midieron entre 15.6 y 42.0 cm LT. Entre los individuos muestreados, 56.47% (n = 1646) presentaron contenidos en sus estómagos. La disponibilidad de los individuos en el punto de muestreo fue diferente a lo largo del período de estudio. Se encontraron diferencias significativas (P < 0.05) entre la proporción de estómagos con y sin alimento desde febrero a agosto de 1998, mientras que los individuos con estómagos vacíos mostraron diferencias significativas (P <0.05) para septiembre y noviembre-diciembre de 1998. El grado de estómagos llenos mostró un patrón regular con altos números de estómagos llenos desde abril hasta agosto (tabla 1). Los FI variaron entre 0.83 (abril 1998) y 0.27 (noviembre 1998) (tabla 1), con valores más altos entre febrero y agosto 1998 y una tendencia decreciente entre septiembre y noviembre de 1998 (fig. 2).
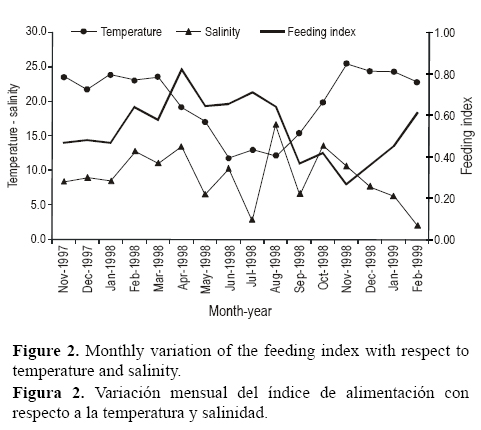
Un total de seis categorías de alimento fueron identificadas, generalmente en condiciones frescas o al comienzo de la digestión (tabla 2). La dieta estuvo compuesta principalmente de crustáceos, poliquetos y restos vegetales, mientras que otras categorías de alimento (moluscos, peces juveniles, e ítems sin identificar) representaron menos que el 5% del contenido estomacal muestreado (tabla 2). Los crustáceos fueron dominantes en la dieta desde noviembre de 1997 hasta marzo de 1998 y en noviembre y diciembre de 1998, mientras que los poliquetos fueron dominantes desde abril hasta octubre de 1998 y en enero y febrero de 1999 (fig. 3).
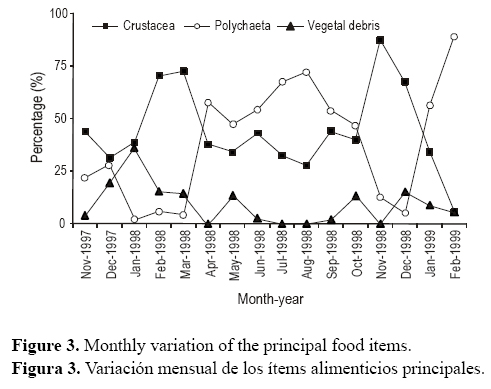
Los peces mostraron IG bajos y FI altos entre abril y agosto (fig. 4). En la primavera (septiembre a noviembre de 1998) las gónadas maduran gradualmente (IG aumenta), con valores de FI entre 0.39 (septiembre) y 0.27 (noviembre) (fig. 4). Las relaciones inversas entre IG y FI para machos y hembras fueron significativas (rs = –0.54, P = 0.03 y rs = -0.59, P = 0.015, respectivamente) y entre la temperatura del agua y FI (rs = -0.67, P = 0.004), mientras que las relaciones entre salinidad y FI no fueron significativas (rs = 0.073, P = 0.78 > 0.05).
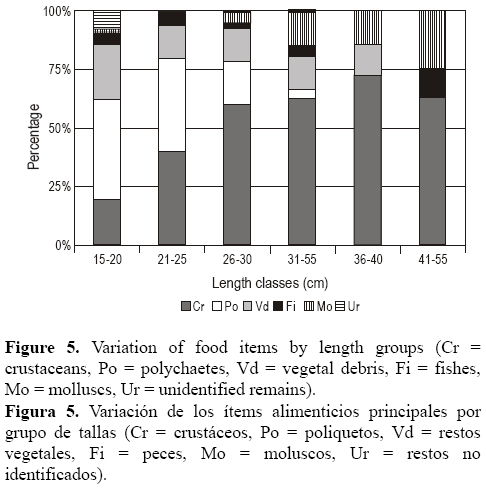
Se rechazó la hipótesis nula (P < 0.05) de que la frecuencia de la ingesta de alimento es independiente de las clases de talla (prueba de G = 379.46; χ225; 0.05 = 37.65). En general, los individuos menores que 25 cm se alimentaron principalmente de poliquetos y crustáceos, mientras que los individuos mayores que 30 cm depredaron sobre crustáceos y moluscos. Los peces y los restos vegetales fueron encontrados en todas las clases de talla, excepto en las clases 5 (36-40 cm) y 6 (41-45 cm) (fig. 5). El índice de Morisita mostró 12 valores mayores que 0.6, indicando altas superposiciones entre clases de talla (tabla 3). Los valores menores fueron entre las clases de talla 1 (15 - 20 cm) y las de individuos mayores que 30 cm (tabla 3).
Los primeros dos ejes de CA para las matrices M1 y M2 explicaron un 76.36% y un 53.13% de la varianza total, respectivamente (tabla 4). Los moluscos, los peces y los poliquetos contribuyeron con mayores factores de carga al primer factor en la M1, y las mismas variables más los estómagos vacíos en la M2. Los restos no identificados contribuyeron con los mayores valores al segundo factor en ambas matrices. Los crustáceos y los restos vegetales presentaron contribuciones menores (tabla 4). En M1, los valores negativos para el factor 1 estuvieron asociados con los meses de noviembre a diciembre de 1997 y de enero a marzo de 1998, y los valores positivos estuvieron asociados con el resto de los meses. El CA de la M2 mostró un cambio gradual de clases de talla entre valores positivos y negativos para el factor 1 (resultados no mostrados). Las ordenaciones de las dos matrices fueron significativamente concordantes (m12 = 0.1200, P = 0.0029).
DISCUSIÓN
Este estudio fue realizado en el área de la laguna con mayor influencia de agua marina costera y donde la disponibilidad y abundancia de la corvina blanca es mayor. Si bien el patrón de migración dentro de la laguna es poco conocido, al atardecer los peces se acercan a la costa y las redes utilizadas capturan la mayoría de los intervalos de talla de los individuos que viven en la laguna (Saona et al. 2003).
Nuestro estudio confirma la importancia de los crustáceos decápodos (principalmente Cyrtograpsus angulatus), poliquetos y restos vegetales en la dieta de M. furnieri en la laguna de Rocha. La importancia de los crustáceos y poliquetos en la dieta de M. furnieri es bien conocida (Puig 1986, Vazzoler 1991, Sánchez et al. 1991, Masello et al. 2002). La baja frecuencia de anfípodos e isópodos observada en la dieta se debe probablemente a la ausencia de especímenes de M. furnieri menores que 14 cm en las muestras (Mandali y Paes 1998, 2005; Hozbor y García de la Rosa 2000). También los peces juveniles fueron ocasionales en la dieta, y resultados similares fueron encontrados para la corvina blanca que habita en el estuario del Río de la Plata (Puig 1986, Sánchez et al. 1991, Masello et al. 2002). A pesar de la diferencia relativa entre la forma y la talla de las presas principales, hubo una fuerte selección a lo largo del año, en relación con otras presas bentónicas que estaban disponibles (i.e., moluscos). Los moluscos (Erodona mactroides y Heleobia australis) son abundantes en la comunidad bentónica de la laguna de Rocha durante todo el año (Jorcin 1996); sin embargo, esos ítems presa fueron ingeridos solo ocasionalmente por M. furnieri, como fue encontrado en la laguna de los Patos, Brasil (Mandali y Paes 1998). En este estudio, parecería que M. furnieri elige los organismos más grandes disponibles. Esto es consistente con la teoría de forrajeo óptimo que predice una mayor ganancia neta para peces que se alimentan de presas de tamaño óptimo (Stephens y Krebs 1986).
Los cambios temporales en la dieta de M. furnieri pueden ser vistos como cambios en la disponibilidad de organismos, a pesar de que los cangrejos (C. angulatus) y los poliquetos son especies permanentes y abundantes en el sistema (Jorcin 1996). Muchos autores definen a esta especie como un depredador bentónico oportunista (Sánchez et al. 1991, Mandali y Paes 1998, Hozbor y García de la Rosa 2000) que se alimenta de la presa más abundante presente en el sistema. Resultados similares fueron encontrados para Micropogonias undulatus (Chao y Musick 1977, Overstreet y Heard 1978). La corvina blanca se alimenta intensamente entre febrero (final del verano austral) y agosto (invierno austral), cuando la temperatura del agua disminuye y los peces entran en una fase de reposo, con bajos índices gonadosomáticos y con las gónadas inmaduras, en desarrollo o en reposo (Vizziano et al. 2002). Los poliquetos fueron el ítem presa predominante antes del período reproductivo (abril a octubre), y esos organismos contienen altos niveles de proteínas, lípidos y ácidos grasos altamente insaturados (HUFA) (Orlando y Passos 1995, Garcia-Alonso et al. 2008). Muchos autores encontraron que los lípidos en los ovarios de los peces contienen altas proporciones de HUFA (Singh y Singh 1979, 1984; Mourente et al. 2001; Sorbera et al. 2001), implicando que la disponibilidad de poliquetos podría jugar un rol importante en la reproducción de la corvina blanca. La talla de primera madurez para ambos sexos en la laguna de Rocha es de 20 cm (Vizziano et al. 2002), y los poliquetos fueron predominantes en los peces menores que 25 cm. Tales hábitos de alimentación coinciden más con un depredador de comportamiento selectivo que con un depredador generalista-oportunista (Delbeek y Williams 1988).
El desove de esta especie ocurre hacia fines de la primavera y verano austral, cuando los peces presentan altos índices gonadosomáticos y estados de desarrollo gonadales maduros y grávidos (Vizziano et al. 2002). Así la gran inversión de energía en el desarrollo gonadal sugiere que la corvina blanca adopta una estrategia de alimentación selectiva que maximiza la calidad de la presa. Tal estrategia podría proveer a la corvina con recursos adecuados para satisfacer las demandas energéticas cuando las presas son numerosas, particularmente durante periodos de alimentación intensiva en la estación de desove (cuando 50% de los individuos presentaron estómagos con alimento), como ha sido descrito para las aguas costeras del Río de la Plata en verano (Puig 1986, Masello et al. 2002). En el estuario de la laguna de los Patos, un número alto de estómagos llenos y la presencia de ítems de alimentación no digeridos totalmente sugieren una estrategia de ingestión de alimento continua (Mandali y Paes 1998, 2005).
La importancia de los diferentes ítems alimenticios varía con la talla del pez y con la época del año (Puig 1986, Sánchez et al. 1991, Masello et al. 2002, este trabajo), con grandes superposiciones entre clases de longitud. Esto puede resultar en un aumento de la competencia intraespecífica que conduzca al establecimiento de una segregación espacial entre grupos de talla.
La presión de depredación y la competencia intraespecífica, junto con la variación de la disponibilidad de presas y las características físicas de la laguna de Rocha, pueden jugar un rol importante en determinar la distribución de los peces. Sin embargo, la ocurrencia simultanea de diferentes grupos de talla durante las actividades de desove (Vizziano et al. 2002) y la segregación espacial de los grupos de talla dentro de la laguna (Saona et al. 2003) sugieren una baja competencia intraespecífica, pero se requieren más estudios para verificar esta hipótesis.
En general, los peces que habitan los estuarios no tienen dietas altamente especializadas (Edgar y Shaw 1995, Chaves y Umbria 2003). De todas formas, los hábitos temporales de alimentación de M. furnieri en la laguna de Rocha mostraron un uso selectivo y apropiado de las presas, de acuerdo con el ciclo reproductivo de la especie y la variabilidad de la temperatura del agua a lo largo del año. El ecosistema de la laguna costera de Rocha es altamente productivo (Bonilla et al. 2006) y posee áreas relevantes para la conservación (Díaz et al. 1999). El análisis de los procesos dominantes (resuspensión de sedimentos e intercambio hidrológico con el océano) determina la dinámica temporal y espacial de la biota a lo largo de diversas escalas temporales y revela la importancia del compartimiento bentónico (microfitobentos y zoobentos) en la laguna (Bonilla et al. 2006). Los cambios recientes en el uso del suelo en la cuenca, la eutrofización y la modificación artificial de la frecuencia de conexión con el océano podrían afectar la sinergia del funcionamiento ecológico de esta laguna (Bonilla et al. 2006) y, como consecuencia, la disponibilidad de presas para los peces bentónicos como M. furnieri.
AGRADECIMIENTOS
Los autores agradecen los fondos proporcionados por PROBIDES (URU/97/G31 proyecto PNUD-GEF-MVTOMA) y la Facultad de Ciencias (Universidad de la República, Uruguay). Agradecemos a Denise Vizziano su asistencia en la tarea de muestreo y a los pescadores artesanales de la laguna de Rocha (Vicente, José, Jorge y Santiago Ballesteros; Fabián Huelmo, Angel Alvarez; y Walter Fernández) su valiosa ayuda y colaboración en los muestreos. También agradecemos a Fabricio Scarabino (DINARA y Museo Nacional de Historia Natural, Uruguay) por la revisión de la nomenclatura del bentos.
REFERENCIAS
Araujo FG. 1984. Feeding habits of three marine catfishes (Ariidae) in Lagoa dos Patos estuary (RS), Brasil. Atlantica 7: 47-63. [ Links ]
Arena G. 1990. Maximum sustainable yield of the white croaker (Micropogonias furnieri) in the operating area of the Uruguayan fleet, through surplus production models. Frente Marit. 7: 25-36. [ Links ]
Bonilla S, Conde D, Aubriot L, Rodríguez-Gallego L, Piccini C, Meeroff E, Rodríguez-Graña L, Calliari D, Gómez P, Machado I, Britos A. 2006. Structured process of biological communities in coastal lagoons of Uruguay. In: Menafra R, Rodríguez-Gallego L, Scarabino F, Conde D (eds.), Bases para la Conservación y el Manejo de la Costa Uruguaya. Vida Silvestre Uruguay, Montevideo, pp. 611-630. [ Links ]
Bozec YM, Gascuel D, Kulbicki M. 2004. Trophic model of lagoonal communities in a large open atoll (Uvea, Loyalty islands, New Caledonia). Aquat. Living Resour. 17: 151-162. http://dx.doi.org/10.1051/alr:2004024 [ Links ]
Castello JP. 1985. La ecología de los consumidores del estuario de la Laguna dos Patos, Brasil. In: Yáñez-Arancibia A (ed.), Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. Universidad Nacional Autónoma de México, México, pp. 383-406. [ Links ]
Conde D, Aubriot L, Sommaruga R. 2000. Changes in UV penetration associated with marine intrusions and freshwater discharge in a shallow coastal lagoon of the Southern Atlantic Ocean. Mar. Ecol. Prog. Ser. 207: 19-31. http://dx.doi.org/10.3354/meps207019 [ Links ]
Chao L, Musick JA. 1977. Life history, feeding habits, and functional morphology of juvenile sciaenid fishes in the York River estuary, Virginia. Fish. Bull. 75: 567-702. [ Links ]
Chaves PTC, Umbria SC. 2003. Changes in the diet composition of transitory fishes in coastal systems, estuary and continental shelf. Braz. Arch. Biol. Technol. 46: 41-46. http://dx.doi.org/10.1590/S1516-89132003000100007 [ Links ]
Delbeek JC, Williams DD. 1988. Feeding selectivity of four species of sympatric stickleback in brackish water habitats in eastern Canada. J. Fish Biol. 32: 41-62. http://dx.doi.org/10.1111/j.1095-8649.1988.tb05334.x [ Links ]
Díaz A, Porzecansky I, Rilla F, Casciani M, Hernández J, Acosta J, Iglesias A, Sciandro J, Azpiroz A, Baez F, Molina B, Prigioni C, Rodríguez R, Bazzani S, Fagetti C, Pérez J, Torres A, Guarino P, Castillo A, Fernández S, Jaurena M, Norbis W, Vitancurt J. 1999. Management Plan. Biosphere Reserve Bañados del Este, Uruguay. Editorial Mosca Hnos., Montevideo, Uruguay, 159 pp. [ Links ]
Edgar G, Shaw C. 1995. The production and trophic ecology of shallow water fish assemblages in southern Australia. II. Diets of fishes and trophic relationships between fishes and benthos at Western Port, Victoria. J. Exp. Mar. Biol. Ecol. 194: 83-106. http://dx.doi.org/10.1016/0022-0981(95)00084-4 [ Links ]
García-Alonso J, Müller CT, Hardege JD. 2008. Influence of food regimes and seasonality on fatty acid composition in the ragworm. Aquat. Biol. 4: 7-13. http://dx.doi.org/10.3354/ab00090 [ Links ]
Goncalves AA, Feijò JA, Paes J. 1999. Trophic description of first life stages of Micropogonias furnieri (Sciaenidae) in Lagoa dos Patos estuary, RS, Brazil. Atlantica 21: 93-103. [ Links ]
Hozbor NM, García de la Rosa MB. 2000. Food of juvenile croaker (Micropogonias furnieri) in the Mar Chiquita coastal lagoon (Buenos Aires, Argentina). Frente Marit. 18: 59-70. [ Links ]
Hureau J. 1970. Biologie comparée de quelques poissons antarctiques (Nototheniidae). Bull. Inst. Oceanogr. Monaco 68:1-244. [ Links ]
Hyslop EJ. 1980. Stomach content analysis: A review of methods and their application. J. Fish Biol. 17: 411-429. http://dx.doi.org/10.1111/j.1095-8649.1980.tb02775.x [ Links ]
Isaac VJ. 1988. Synopsis of biological data on the whitemouth croaker Micropogonias furnieri (Desmarest, 1823). FAO Fish. Synop. No. 150: 35 pp. [ Links ]
Jackson DA. 1993. Multivariate analysis of benthic invertebrate communities: The implication of choosing particular data standardizations, measures of association, and ordination methods. Hydrobiologia 268: 9-26. http://dx.doi.org/10.1007/BF00005737 [ Links ]
Jackson DA. 1995. PROTEST: A Procrustean Randomization Test of community environment concordance. Ecoscience 2:297-303. [ Links ]
Jackson DA. 1997. Compositional data in community ecology: The paradigm or peril of proportions? Ecology 78: 929-940. http://dx.doi.org/10.1890/0012-9658(1997)078[0929:CDICET]2.0.CO;2 [ Links ]
Jorcin A. 1996. Distribution, abundance and biomass of Erodona mactroides (Mollusca, Bivalvia, Daudin, 1801) in Rocha Lagoon (Rocha, Uruguay). Revista Brasil. Biol. 56: 155-162. [ Links ]
Langton RW. 1982. Diet overlap between the Atlantic cod Gadus morhua, silver hake Merluccius bilinearis and fifteen other northwest Atlantic finfish. Fish. Bull. 80: 745-759. [ Links ]
Mandali G, Paes J. 1998. Feeding chronology and diet of corvina, Micropogonias furnieri, in Lagoa dos Patos estuary, Rs, Brazil. Atlantica 20: 55-72. [ Links ]
Mandali G, Paes J. 2005. Diel feeding, daily food consumption and the predatory impact of whitemouth croaker (Micropogonias furnieri) in an estuarine environment. Mar. Ecol. 26: 130-139. [ Links ]
Marshall S, Elliott M. 1997. A comparison of univariate and multivariate numerical and graphical techniques for determining inter- and intraspecific feeding relationships in estuarine fish. J. Fish Biol. 51: 526-545.http://dx.doi.org/10.1111/j.1095-8649.1997.tb01510.x [ Links ]
Masello A, Scarabino F, Gamarra M, Menafra R. 2002. Study of feeding habits and stomach contents of Micropogonias furnieri. In: Vizziano D, Puig P, Mesones C, Nagy G (eds.), Río de la Plata research to manage the environment, fish resources and the fishery in the saline front. Ecoplata Program, Montevideo, Uruguay, pp. 147-161. [ Links ]
Mendoza-Carranza M, Vieira J. 2008. Whitemouth croaker Micropogonias furnieri (Desmarest 1823) feeding strategies across four southern Brazilian estuaries. Aquat. Ecol. 42: 83-93. http://dx.doi.org/10.1007/s10452-007-9084-4 [ Links ]
Mourente G, Megina C, Díaz-Salvago E. 2001. Lipids in female northern bluefin tuna (Thunnus thynnus thynnus L.) during sexual maturation. Fish Physiol. Biochem. 24: 351-363. http://dx.doi.org/10.1023/A:1015011609017 [ Links ]
Norbis W. 1995. Influence of wind, behavior and characteristics of the croacker (Micropogonias furnieri) artisanal fishery in the Río de la Plata (Uruguay). Fish. Res. 22: 43-58. http://dx.doi.org/10.1016/0165-7836(94)00310-S [ Links ]
Norbis W, Galli O. 2004. Feeding habits of the flounder Paralichthys orbignyanus (Valenciennes 1839) in a shallow coastal lagoon of the southern Atlantic Ocean: Rocha, Uruguay. Cienc. Mar. 30: 619-625. [ Links ]
Orlando J, Passos A. 1995. Seasonal changes in lipid content and composition of the polychaete Nereis (Hediste) diversicolor. Comp. Biochem. Physiol. B: Biochem. Mol. Biol. 111: 579-586. [ Links ]
Overstreet R, Heard R. 1978. Food of the Atlantic croaker, Micropogonias undulatus, from Mississippi Sound and the Gulf Mexico. Gulf Res. Rep. 6: 145-152. [ Links ]
Palomares MLD, Pauly D. 1999. Predicting the food consumption of fish populations as functions of mortality, food type, morphometrics, temperature and salinity. Mar. Freshwat. Res. 49: 447-453. [ Links ]
Peres-Neto PR, Jackson DA. 2001. How well do multivariate data sets match? The advantages of a Procrustean superimposition approach over the Mantel test. Oecologia 129: 169-178. http://dx.doi.org/10.1007/s004420100720 [ Links ]
Pintos W, Conde D, De León R, Cardezo MJ, Jorcín A, Sommaruga R. 1991. Some limnological characteristics of Laguna de Rocha (Uruguay). Rev. Bras. Biol. 51: 79-84. [ Links ]
Puig P. 1986. Stomach content analysis of white croaker (Micropogon opercularis) (Sciaenidae, Perciformes), summer 1984. Publ. Com. Téc. Mix. Frente Marit. 1: 333-340. [ Links ]
Rodríguez-Graña L, Calliari D, Conde D, Sellanes J, Urrutia R 2008. Food web of a SW Atlantic shallow coastal lagoon: Spatial environmental variability does not impose substantial changes in the trophic structure. Mar. Ecol. Prog. Ser. 362: 69-83. http://dx.doi.org/10.3354/meps07401 [ Links ]
Sánchez F, Mari N, Lasta C, Giangiobbe A. 1991. Feeding of the croaker (Micropogonias furnieri) in Samborombon Bay. Frente Marit. 8: 43-50. [ Links ]
Saona G, Forni F, Vizziano D, Norbis W. 2003. Structure by size, sex, and maturity stage of the white croaker (Micropogonias furnieri, Desmarest 1823; Teleostei: Sciaenidae) in the bycatch of the artisanal fishery at Rocha Lagoon, Uruguay. Cienc. Mar. 29: 315-324. [ Links ]
Singh A, Singh T. 1979. Seasonal fluctuation in lipid and cholesterol content of ovary, liver and blood serum in relation to annual sexual cycle in Heteropneustes fossilis (Bloch). Endocrinology 73: 47-54. [ Links ]
Singh I, Singh T. 1984. Changes in gonadotrophin, lipid and cholesterol levels during annual reproductive cycle in the freshwater teleost, Cirrhinus mrigala (Ham.). Ann. Endocrinol. 45: 131-136. [ Links ]
Smith P, Zaret MT. 1982. Bias in estimating niche overlap. Ecology 63: 1248-1253. http://dx.doi.org/10.2307/1938851 [ Links ]
Sorbera L, Asturiano JF, Carrillo M, Zanuy S. 2001. Effects of polyunsaturated fatty acids and prostaglandins on oocyte maturation in a marine teleost, the European sea bass (Dicentrarchus labrax). Biol. Reprod. 64: 382-389. [ Links ]
Sokal RR, Rohlf FJ. 1995. Biometry: The Principles and Practice of Statistics in Biological Research. 3rd ed. WH Freeman and Company, New York, 887 pp. [ Links ]
Stephens DW, Krebs LR. 1986. Foraging Theory. Princeton University Press, Princeton, 153 pp. [ Links ]
Teixeira RL, Falcao GAF, Melo SC. 1992. Occurrency and feeding of Sciaenidae juveniles (Pisces: Perciformes) from surf zone beaches of Maceio, Brazil. Atlantica 4: 29-42. [ Links ]
ter Braak CJF, Smilauer P. 1998. CANOCO Reference Manual and User's Guide to Canoco for Windows. Ver. 4. Ithaca, New York, 352 pp. [ Links ]
Vazzoler AE. 1991. Síntese de conhecimentos sobre a biología da corvina Micropogonias furnieri (Desmarest, 1823), da costa do Brasil. Atlántica 13: 55-74. [ Links ]
Vizziano D. 2002. Reproductive cycle of the white croaker Micropogonias furnieri in the frontal zone of the Río de la Plata. In: Vizziano D, Puig P, Mesones C, Nagy G (eds.), Río de la Plata research to manage the environment, fish resources and the fishery in the saline front. Ecoplata Program, Montevideo, Uruguay, pp. 103-111. [ Links ]
Vizziano D, Forni F, Saona G, Norbis W. 2002. Reproduction of the white croaker Micropogonias furnieri (Pisces: Sciaenidae) in a shallow temperate coastal lagoon of the Southern Atlantic Ocean (Uruguay). J. Fish Biol. 61: 196-206. http://dx.doi.org/10.1111/j.1095-8649.2002.tb01771.x [ Links ]














