Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.39 no.3 Ensenada sep. 2013
Artículos
Estructura de la comunidad bentónica en los bosques de macroalgas de la cuenca del Sur de California
Benthic community structure in kelp forests from the Southern California Bight
Guillermo Torres-Moye1,2*, Matthew S Edwards2, Cira Gabriela Montaño-Moctezuma3
1 Facultad de Ciencias Marinas, Universidad Autónoma de Baja California, Carretera Transpeninsular Ensenada-Tijuana No. 3917, Fraccionamiento Playitas, Ensenada 22800, Baja California, México.
2 Department of Biology, San Diego State University, San Diego, California 92182, USA.
3 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Carretera Transpeninsular Ensenada-Tijuana No. 3917, Fraccionamiento Playitas, Ensenada 22800, Baja California, México.
* Corresponding author.
E-mail: gtorres@uabc.edu.mx
Received October 2012
Received in revised form March 2013
Accepted April 2013
RESUMEN
Los Estados Unidos y México comparten el ecosistema de la cuenca del Sur de California (CSC) en el noreste del océano Pacífico donde la vida silvestre y los hábitats han sido históricamente perturbados por actividades humanas. En este ecosistema, los bosques del sargazo gigante Macrocystis pyrifera son hábitats críticos que mantienen conjuntos biológicos diversos y especies pesqueras importantes. Estudiamos patrones de variabilidad espacial y temporal entre las comunidades bentónicas de cinco bosques de macroalgas transfronterizos en California (EUA) y Baja California (México) durante un periodo de cuatro años que incluyó un evento moderado de El Niño. Aunque las comunidades marinas bentónicas compartieron algunas especies, variaron significativamente en la estructura de sus comunidades y el grado de disimilitud no estuvo relacionado con las distancias geográficas entre los hábitats estudiados. Más bien, la riqueza de especies se relacionó significativamente con la rugosidad del sustrato local, lo cual sugiere que podría ser usada como un indicador de la diversidad biológica bentónica. Los cambios temporales en los conjuntos bentónicos no fueron consistentes para todos los bosques y contrariamente a las observaciones realizadas durante eventos previos de El Niño en la CSC, las comunidades bentónicas no cambiaron significativamente después de El Niño 2009-2010. Esta respuesta imprevista podría explicarse debido a que El Niño 2009-2010 estuvo relacionado con el fenómeno Modoki, en el cual la temperatura superficial cálida del mar se ubica en el Pacífico central ecuatorial y no en el océano Pacífico oriental. Proponemos que los esfuerzos para la conservación a largo plazo deberían incorporar este conocimiento ecológico para apoyar las decisiones basadas en ciencia, la coordinación de políticas binacionales y prácticas de manejo coherentes incluyendo el diseño de redes de conservación transfronteriza como herramientas de manejo espacial para la conservación y/o restauración del ecosistema de la CSC.
Palabras clave: bosques de macroalgas, estructura de la comunidad, heterogeneidad de hábitat, bentos, región de la cuenca del Sur de California.
ABSTRACT
The United States and Mexico share the Southern California Bight (SCB) ecosystem in the Northeast Pacific Ocean where marine wildlife and habitats historically have been disturbed by human activities. Within this ecosystem, forests of the giant kelp Macrocystis pyrifera are critical habitats that sustain diverse biological assemblages and important fishery species. We studied patterns of temporal and spatial variability within the benthic communities of five transboundary kelp forests in California (USA) and Baja California (Mexico) over a four-year period that included a moderate El Niño event. While the benthic marine communities shared some species, they varied significantly in community structure from each other, and the degree of dissimilarity was not related to the geographic distances among the studied habitats. Rather, species richness was significantly related to local substratum rugosity, suggesting it could be used as a proxy of relative benthic biological diversity. Temporal changes in the benthic assemblages were not consistent across all forests, and contrary to observations made during previous El Niño events in the SCB, the benthic communities did not change significantly following the 2009-2010 El Niño. Such an unexpected community response may be explained by the fact that the 2009-2010 El Niño was linked to the Modoki phenomenon, where warm sea surface temperature is focused in the central equatorial Pacific and not in the eastern Pacific Ocean. We propose that long-term conservation efforts should incorporate this ecological knowledge to support science-based decisions, binational coordination of policies, and coherent management practices including the design of transboundary conservation networks as spatial management tools for the protection, conservation, and/or restoration of the SCB ecosystem.
Key words: kelp forests, community structure, habitat complexity, benthos, Southern California Bight region.
INTRODUCCIÓN
Los Estados Unidos y México comparten ecosistemas marinos y terrestres (e.g., Broyles et al. 2005, Wolf et al. 2006, Blanchette et al. 2008) donde el hábitat y la vida silvestre son comúnmente perturbados por actividades humanas que afectan su viabilidad a largo plazo. Entre éstos, la cuenca del Sur de California (CSC) es un ecosistema marino altamente productivo del océano Pacífico nororiental (Steneck et al. 2002) (fig. 1), cuyos límites norte y sur se ubican en Point Conception, California, EUA (34°26'53" N, 120°28'17" W), y Punta Colonet, Baja California, México (30°57'29" N, 116°19'42" W), respectivamente (Dailey et al. 1993). La región de la CSC tiene una larga historia de explotación humana (e.g., Erlandson y Torben 2010). La sobre-pesca y caza excesiva han llevado a la eliminación de nutrias, a la extinción ecológica de varias especies de abulón y peces, y a la disminución de la abundancia de especies comerciales y recreativas (Dayton et al. 1998, Tegner y Dayton 2000). En consecuencia, la protección de las especies que permanecen es de suma importancia para la conservación y el manejo adecuado de este ecosistema valioso.

A lo largo de la CSC, el sargazo gigante Macrocystis pyrifera crece en densos bosques submareales y proporciona hábitats biogénicos que sostienen diversas comunidades biológicas e importantes especies pesqueras (Foster y Schiel 1985, Hernández-Carmona et al. 1989, Graham 2004, Parnell et al. 2010). La biomasa algal que se produce en estos bosques representa una importante fuente de alimento para muchas especies bentónicas y pelágicas locales, tanto dentro de los bosques como en los ambientes adyacentes (Bradley y Bradley 1993, Graham et al. 2007). Macrocystis pyrifera es frecuentemente considerada una especie fundadora y/o ingeniero de ecosistemas con una estructura tridimensional que impide parcialmente o totalmente que la luz llegue al sustrato, reduce corrientes e incrementa la sedimentación (Dayton 1971, Jones et al. 1994, Gaylord et al. 2007). Estos bosques crecen en sustratos rocosos y someros (<30 m), donde presentan una distribución desigual (en parches) (Parnell et al. 2006) y se ven afectados por estresores ambientales como agua cálida pobre en nutrientes, fuerzas hidrodinámicas fuertes (e.g., oleaje) durante tormentas, una mayor sedimentación y cambios en la calidad del agua y el pastoreo por herbívoros (Ebeling et al. 1985; Tegner y Dayton 1987, 2000; Ladah et al. 1999; Edwards 2004; Foster y Schiel 2010). Por lo tanto, la distribución y abundancia de estos bosques pueden variar a diferentes escalas espaciales y temporales (e.g., Edwards 2004), lo cual dificulta las generalizaciones regionales.
Varios investigadores han proporcionado información sobre las comunidades de los bosques de macroalgas de California (e.g., Dayton 1985, Foster y Schiel 1985, Foster y Vanblaricom 2001), y tal información ha sido muy valiosa para el diseño de áreas marinas protegidas (AMPs) (e.g., Parnell et al. 2006; Pondella et al. 2011a, 2011b). En contraste, hay escasa información relevante de los patrones espaciotemporales de la estructura de la comunidad de los bosques de macroalgas de México. La mayor parte de la información disponible sobre los habitantes de estos bosques consiste de estudios aislados de grupos de algas (e.g., Hernández-Carmona et al. 1989, Ladah et al. 1999, Edwards y Hernández-Carmona 2005, Edwards y Estes 2006), especies ícticas (e.g., Hammann y Rosales-Casián 1990, Pondella et al. 2005), y poblaciones de especies comerciales importantes como el erizo de mar (Palleiro-Nayar et al. 1996, Salgado-Rogel y Palleiro-Nayar 2008), el abulón y la langosta (Guzmán del Próo et al. 2000, Arteaga-Ríos et al. 2007).
La riqueza de especies se utiliza con frecuencia como un objetivo de conservación para mantener la biodiversidad, y se pueden priorizar los hábitats con mayor riqueza como zonas de conservación potenciales (e.g., Pressey et al. 1993). Además, considerando que los ambientes morfológicamente heterogéneos mantienen comunidades biológicas más diversas (McClain y Barry 2010, Kovalenko et al. 2012), la evaluación de la relación entre la heterogeneidad y la biodiversidad tiene ventajas prácticas para el diseño de las AMPs o redes de reservas (Roberts et al. 2003). En el caso de los ambientes bentónicos submareales, la mayoría de los trabajos de tal relación se han enfocado en comunidades ícticas de arrecifes coralinos (e.g., Wilson et al. 2007). En los sistemas de bosques de macroalgas, se han estudiado las relaciones entre el manto algal, la luz y la sedimentación con los conjuntos algales del sotobosque (e.g., Connell 2003, Clark et al. 2004), entre las macroalgas y el reclutamiento de invertebrados bentónicos (Duggins et al. 1990), y entre la complejidad topográfica (rugosidad) y la estructura de la comunidad de algas (e.g., Fowler-Walker y Connell 2007, Toohey et al. 2007). Así, ampliar los estudios de la estructura de la comunidad de los bosques de macroalgas de la CSC y de la relación entre la heterogeneidad y la diversidad proporcionará información de un factor regulador potencial de la diversidad biológica que pudiera usarse en el futuro como un criterio adicional para el diseño de las AMPs. Por lo tanto, el objetivo de este trabajo fue caracterizar la variabilidad espacial y temporal de las comunidades bentónicas marinas dentro de un grupo de bosques de macroalgas que se distribuyen a lo largo de la región fronteriza de la CSC que comparten México y los Estados Unidos, así como examinar la relación entre un índice de heterogeneidad de hábitat y la diversidad biológica de estos hábitats.
MATERIALES Y MÉTODOS
Se escogieron cinco bosques de macroalgas cubriendo una distancia geográfica de ca 195 km dentro de la CSC y a lo largo de las costas de California (EUA) y Baja California (México) para representar un grupo transfronterizo de sitios y comparar los patrones espaciales y temporales de la estructura de la comunidad. Tres de los bosques se localizaron en la costa de México y dos en la costa de los Estados Unidos. Uno de estos dos sitios se localizó en la Reserva Ecológica de San Diego-La Jolla establecida en 1971 (fig. 1). Los bosques de macroalgas se seleccionaron con base en tres criterios: (1) que tuvieran mantos de macroalgas persistentes, (2) que estuvieran por debajo del límite de la "zona somera" de 9 m (sensu Foster y Vanblaricom 2001), y (3) que estuvieran en la Provincia Biogeográfica Sudensenadense (Blanchette et al. 2008), para que las diferencias causadas por sustituciones de especies latitudinales pudieran considerarse insignificantes.
Dentro de cada bosque de macroalgas se estimó la variabilidad temporal de la composición de la comunidad bentónica mediante campañas de buceo no destructivo en junio y julio de 2007, 2008 y 2010, con el apoyo de pescadores locales. No se realizaron muestreos en 2009 porque iniciaba un evento El Niño y olas grandes limitaron el acceso a los sitios. Específicamente, dentro de cada bosque, cada año se recorrieron tres transectos de 10 m en el fondo, comenzando en el centro del bosque y procediendo hacia fuera en tres rumbos aleatorios marcados por la brújula. El centro del sitio se determinó mediante GPS para que pudiera ser relocalizado y remuestreado en años subsecuentes. Para estimar la abundancia de toda la macrofauna y macroflora, se tomaron fotografías de los conjuntos bentónicos en cada metro y en cada lado del transecto usando un cuadrante de 0.25 m2. El esfuerzo de muestreo necesario para obtener estimaciones confiables de la riqueza de especies se determinó usando la curva de acumulación de especies definida por el número promedio de especies bajo todas las permutaciones de las muestras (Ugland et al. 2003, Bakus 2007). Se obtuvieron datos preliminares de los cinco sitios en 2007, y se determinó que era necesario un tamaño de muestreo mínimo de 23 cuadrantes; sin embargo, considerando que el patrón de acumulación de especies puede variar de año a año, escogimos un esfuerzo más conservador (30 muestras) para cada campaña.
En el laboratorio, se examinaron las fotografías y se determinó la densidad y/o el porcentaje de cobertura de cada especie o nivel taxonómico mayor. Para reducir la influencia de usar diferentes tipos de mediciones (i.e., porcentaje de cobertura vs conteos individuales), los datos fueron estandarizados y transformados con raíz cuadrada (Clarke y Gorley 2006). Para mostrar la variabilidad espacial y temporal de las similitudes de la comunidad bentónica, se generaron gráficas de escalamiento multidimensional no métrico para cada año con base en índices de similitud de Bray-Curtis entre transectos. Posteriormente, se realizó un análisis de varianza multivariado con base en permutaciones (PERMANOVA) de dos vías para evaluar la variación de la estructura de la comunidad entre años y sitios. Para determinar la cantidad de variación de la composición de la comunidad atribuida a las diferencias entre sitios, años y transectos, se calculó la magnitud del efecto asociado con cada factor (Graham y Edwards 2001). Se usó la rutina BVSTEP para identificar el subconjunto más pequeño de especies capaces de reproducir las diferencias observadas en la similitud de la comunidad (rho = 0.95 y 100 permutaciones). Para examinar más a fondo la importancia relativa de las especies individuales en relación con las diferencias observadas en la estructura de la comunidad, se realizó un análisis de porcentajes de similitud (SIMPER) de dos vías. Para comprobar si las diferencias en la composición de la comunidad entre sitios estaban relacionadas con la distancia geográfica entre ellos, se usaron correlaciones independientes entre la distancia geográfica y la disimilitud de Bray-Curtis de pares de sitios para cada año.
Para evaluar la relación entre la heterogeneidad de hábitat y la diversidad biológica, se calculó un índice de rugosidad (IR) del sustrato modificado (Luckhurst y Luckhurst 1978) para cada sitio durante la campaña de 2010. En cada sitio se registró la profundidad a cada metro a lo largo del transecto con un ordenador de buceo Suunto Vyper. Los perfiles fueron graficados y el IR del sustrato fue calculado dividiendo la longitud total del perfil por la distancia fija del transecto de 10 m. Para determinar la relación general entre la rugosidad del sustrato y la riqueza de especies, y suponiendo que la geomorfología del sustrato (i.e., IR de cada sitio) no cambiaría significativamente durante el marco temporal del estudio, se usó un análisis de regresión entre ambas variables para los tres años de estudio. Los análisis multivariados se realizaron con el programa PRIMER 6.1.11 (Clarke y Gorley 2006) y los análisis univariados con SYSTAT ver. 13 (SYSTAT 2009).
RESULTADOS
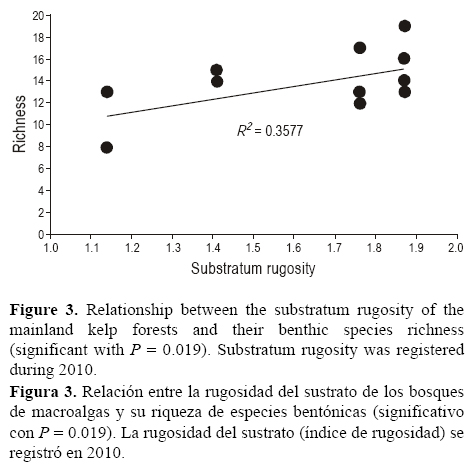
Más del 50% de todos los taxones encontrados durante los tres años de estudio aparecieron en al menos cuatro de los cinco sitios y no se observaron patrones latitudinales identificables de la sustitución de especies (tabla 1). La composición de la comunidad varió significativamente entre los cinco bosques de macroalgas (PERMANOVA: P = 0.0026), pero no entre los tres años (P = 0.2568, tabla 2). Asimismo, las diferencias relativas entre los cinco bosques variaron entre los tres años (interacción sitio x año P < 0.001), lo que sugiere que además de las diferencias entre los bosques de macroalgas, los cambios temporales en las abundancias relativas de las diferentes especies no fueron consistentes entre los bosques. A pesar de que tales efectos de interacción son difíciles de visualizar, las gráficas de escalamiento multidimensional no métrico (fig. 2) muestran que las diferencias entre sitios (según el método de clasificación jerárquica) no fueron iguales en años diferentes. La figura 2 también muestra menor variación dentro de los sitios registrada a partir de los transectos en comparación con mayores diferencias observadas entre los sitios durante cada año de estudio. De hecho, la variabilidad entre sitios explicó 40% de la variación total de la composición de la comunidad, mientras que la variabilidad entre transectos dentro de cada sitio explicó 16% de la variación total. La variabilidad entre los años de estudio representó sólo ~3% de la variación total, y la variabilidad debida a la interacción entre años y sitios representó 41% de la variación (tabla 2). En conjunto, esto indica que la mayor parte de la variabilidad (81%) se debió a diferencias entre los bosques de macroalgas o a diferencias en cómo los cinco bosques variaron a través del tiempo. La rutina BVSTEP mostró que un subconjunto de cinco taxones, incluyendo algas rojas foliáceas, algas coralinas geniculadas y no geniculadas (Corallina sp. y Lithothamnion sp.), el coral Balanophyllia elegans y el erizo morado Strongylocentrotus purpuratus, podría explicar el 95% de la variación de la composición de la comunidad (correlación = 0.95). El análisis SIMPER de dos vías identificó el mismo subconjunto de especies como los taxones más relevantes que discriminaron entre años (tabla 3). Entre ellos, la abundancia de algas rojas foliosas disminuyó y la abundancia de S. purpuratus aumentó en la mayoría de los sitios durante el estudio. Raramente se observaron abulones y las densidades más bajas de algunas especies capturadas por pesquerías comerciales (S. franciscanus, Lithopoma undosa, Parastichopus parvimensis y Megathura crenulata) se registraron en los sitios mexicanos. No se observó una relación significativa entre la distancia geográfica y la disimilitud en la estructura de la comunidad entre los bosques de macroalgas (P = 0.377); sin embargo, se observó una relación significativa entre la riqueza de especies y la rugosidad del sustrato en cada sitio (R2 = 0.357, P = 0.019; fig. 3). Los valores de la riqueza de especies y rugosidad del sustrato fueron menores en Eréndira e incrementaron hacia El Retiro, Campo López, La Jolla y Point Loma.

DISCUSIÓN
La variación espacial y temporal de la estructura de la comunidad de bosques de macroalgas es comúnmente regida por estresores ambientales tales como disturbios naturales, contaminación antropogénica, explotación humana, y variaciones de temperatura, nutrientes e irradiación, y/o por interacciones biológicas como competencia, depredación y pastoreo (Dayton et al. 1984, 1998; Ebeling et al. 1985; Foster y Vanblaricom 2001; Foster y Schiel 2010; Parnell et al. 2010; Watson et al. 2011). No obstante, los bosques de macroalgas son hábitats resilientes, continuamente expuestos a perturbaciones de alta frecuencia como tormentas invernales y a perturbaciones de baja frecuencia como El Niño/ Oscilación del Sur, que operan a diferentes escalas espaciales y temporales; esto sugiere que los patrones de variabilidad también pueden operar a diversas escalas espaciales y temporales (e.g., Edwards 2004). Por ende, para evaluar plenamente los patrones de variabilidad en los bosques de macroalgas de la región de la CSC, es necesario estudiar varios bosques durante un periodo de tiempo suficientemente largo para capturar sus trayectorias temporales.
En este trabajo hemos mostrado que a pesar de que las comunidades marinas bentónicas que se encuentran en cinco bosques de macroalgas a lo largo de la región transfronteriza de la CSC comparten algunas especies, son significativamente diferentes entre ellas y los cambios temporales no fueron consistentes en todos los bosques. La presencia de especies compartidas y la ausencia de sustituciones de especies latitudinales pueden explicarse por el hecho de que estas comunidades pertenecen a la misma región biogeográfica (Provincia Biogeográfica Sudensenadense) y, por lo tanto, probablemente experimentan condiciones ambientales similares. Otros autores han documentado sustituciones de especies latitudinales entre sitios en algunas regiones del norte de California de la CSC con distancias geográficas similares a las de este estudio pero con una gran variación de temperatura (e.g., Watson et al. 2011). En contraste, los sitios muestreados en la región transfronteriza de la CSC comparten temperaturas estacionales promedio del mar similares (Durazo et al. 2010) y corrientes de mesoescala cambiantes hacia el norte o el sur (Di Lorenzo 2003), que pueden controlar la mezcla histórica transfronteriza de larvas pelágicas y el reclutamiento de especies bentónicas que habitan en los bosques de macroalgas.
Aunque diferentes bosques de macroalgas comparten especies a escala regional, la distancia geográfica entre ellos o la variabilidad de la calidad del hábitat pueden explicar los cambios espaciales en su estructura de la comunidad. Se analizó si la distancia geográfica entre sitios o los cambios en la rugosidad del sustrato estaban relacionados con las diferencias espaciales observadas en la similitud de la comunidad o la riqueza de especies, respectivamente. La distancia geográfica ha sido usada para explicar cambios latitudinales de comunidades del intermareal rocoso en una comparación latitudinal más extensa que incluyó la CSC (Blanchette et al. 2008); sin embargo, nuestros resultados no mostraron una relación significativa entre la distancia geográfica y la similitud de la comunidad en los sitios estudiados. En contraste, la variación local de la rugosidad del sustrato se relacionó positivamente y significativamente con la riqueza de las especies bentónicas de los bosques de macroalgas. La "hipótesis de la heterogeneidad del hábitat" sustenta la idea que los ambientes espacialmente heterogéneos mantienen una mayor riqueza de especies y la explicación prevaleciente supone que hay una mayor disponibilidad de nichos en ambientes estructuralmente complejos (Tews et al. 2004, Kovalenko et al. 2012). La importancia de la heterogeneidad como un precursor de la diversidad biológica ha llevado a algunos autores a sugerir que la protección y el aumento de la heterogeneidad debería ser una base importante para la conservación y el manejo de comunidades ecológicas (Fuhlendorf et al. 2006). Nuestros resultados concuerdan con esta idea para las comunidades bentónicas de los bosques de macroalgas y recalcan la importancia de seguir estudiando este y otros enfoques de la complejidad del hábitat en otros ambientes de bosques macroalgales y con las comunidades ícticas demersales y pelágicas.
Las actividades pesqueras también pueden impactar directamente los cambios espaciales y temporales en la abundancia de especies comerciales. En los sitios estudiados, la sobrepesca ha reducido significativamente las densidades de abulón. Además, las menores abundancias de las especies objetivo Strongylocentrotus franciscanus, Lithopoma undosa y Megathura crenulata en los sitios mexicanos podrían deberse a una menor vigilancia y mayor esfuerzo de pesca en comparación con la Reserva de La Jolla y Point Loma.
Los eventos de El Niño pueden generar cambios importantes en los bosques de macroalgas de la CSC (Tegner y Dayton 1987, Edwards y Estes 2006). Específicamente, se ha documentado que la dinámica de los bosques cambia de un control local a regional durante un evento de El Niño y que la recuperación al finalizar el evento regresa estos ecosistemas a un control local (Edwards 2004); sin embargo, la mayoría de los análisis de similitudes de la comunidad se restrigen a casos espacialmente estáticos que no contemplan cambios temporales, incluyendo la dinámica de un evento de El Niño (Watson et al. 2011), y raramente consideran las respuestas de toda la comunidad bentónica. En el presente estudio, no se observaron cambios temporales significativos en la comunidad bentónica de los bosques de macroalgas. Así que contrariamente a lo observado durante eventos previos de El Niño (e.g., Edwards y Estes 2006), con excepción de algunas cuantas especies, las comunidades bentónicas no cambiaron significativamente después de El Niño 2009-2010. Esta respuesta imprevista puede atribuirse a que El Niño 2009-2010 no presentó las anomalías térmicas altas que prevalecen durante los eventos típicos. Más bien, este evento se relacionó con el fenómeno Modoki, en el cual la temperatura superficial cálida del mar se ubica en el Pacífico central ecuatorial y no en el Pacífico oriental (Barnard et al. 2011). No obstante, el oleaje en el invierno durante El Niño 2009-2010 fue anómalamente fuerte y similar al del último El Niño importante en 1997-1998 (Barnard et al. 2011). Tal forzamiento ambiental desprendió muchas de las macroalgas, incrementó la abrasión de la arena en el fondo y pudo haber contribuido en parte a la disminución de las algas rojas foliosas, obligando a las poblaciones de S. purpuratus a salir de las grietas en busca de alimento, como ha sido observado en otras zonas de California (e.g., Breda y Foster 1985, Ebeling et al. 1985).
La rugosidad del sustrato local aparentemente jugó un papel importante en la variación espacial de la diversidad biológica, uno de los criterios biológicos más importantes usados para priorizar sitios de conservación (Roberts et al. 2003). Dado el costo de muestreos y observaciones directas submareales, proponemos que la rugosidad del sustrato puede usarse como un indicador para futuras estimaciones de la diversidad biológica bentónica en estos hábitats. Los bosques de macroalgas se comportaron como ecosistemas complejos con cambios temporales a corto plazo que no fueron consistentes en todos los sitios incluso después de estar expuestos a un evento moderado de El Niño (2009-2010). Tal complejidad requiere de la constante generación de conocimiento de los patrones temporales de los ambientes de bosques algales y sus respuestas esperadas ante perturbaciones. Si queremos predecir cambios en estos hábitats críticos, es necesario implementar actividades de monitoreo para apoyar futuros programas de manejo adaptativo. Los bosques de macroalgas de la costa de Baja California considerados en este estudio son los representantes más al sur de la CSC, donde el intercambio de agua por corrientes los une como una red compartida entre México y los Estados Unidos. No obstante, se requieren estudios adicionales para incluir los cambios locales de la fauna íctica, para estudiar el nivel de conectividad de estos hábitats críticos y para identificar los límites geográficos de la zona de intercambio transfronterizo usando muchas especies de interés. Proponemos que los esfuerzos de conservación regional a largo plazo deberían incorporar este conocimiento ecológico para apoyar las decisiones basadas en la ciencia, la coordinación de políticas binacionales y las prácticas de manejo coherentes incluyendo el diseño de redes de conservación transfronteriza como herramientas de manejo espacial para la protección, conservación y/o restauración del ecosistema de la CSC.
AGRADECIMIENTOS
Agradecemos el apoyo brindado por el Consejo Nacional de Ciencia y Tecnología (CONACYT, México) y UCMEXUS mediante una beca doctoral a GTM, así como el apoyo brindado por el Programa Conjunto de Doctorado en Ecología de la Universidad Estatal de San Diego y la Universidad de California en Davis. También agradecemos a Todd Anderson y Rick Grosberg su revisión y comentarios al manuscrito.
REFERENCIAS
Arteaga-Ríos LD, Carrillo-Laguna J, Belmar-Perez J, Guzmán del Próo SD. 2007. Postlarval settlement of California spiny lobster Panulirus interruptus in Bahia Tortugas, Baja California and its relationship to the commercial catch. Fish. Res. 88: 51-55. [ Links ]
Bakus GJ. 2007. Quantitative Analysis of Marine Biological Communities: Field Biology and Environment. Wiley-Interscience, New Jersey, 435 pp. http://dx.doi.org/10.1002/0470099186 [ Links ]
Barnard PL, Allan J, Hansen JE, Kaminsky GM, Ruggiero P, Doria A. 2011. The impact of the 2009-10 El Niño Modoki on west coast beaches. Geophys. Res. Lett. 38, L13604. http://dx.doi.org/10.1029/2011GL047707 [ Links ]
Blanchette CA, Miner CM, Raimondi PT, Lohse D, Heady KEK, Broitman BR. 2008. Biogeographical patterns of rocky intertidal communities along the Pacific coast of North America. J. Biogeogr. 35: 1593-1607. http://dx.doi.org/10.1111/j.1365-2699.2008.01913.x [ Links ]
Bradley RA, Bradley DW. 1993. Wintering shorebirds increase after kelp (Macrocystis) recovery. Condor 95: 372-376. http://dx.doi.org/10.2307/1369359 [ Links ]
Breda VA, Foster MS. 1985. Composition, abundance and phenology of foliose red algae associated with two central California kelp forests. J. Exp. Mar. Biol. Ecol. 94: 115-130. http://dx.doi.org/10.1016/0022-0981(85)90053-X [ Links ]
Broyles B, Felger R, Ezcurra E. 2005. Dry borders: Linking nature reserves across the Sonora-Arizona border. In: Mittermeier RA, Kormos CF, Mittermeier CG, Sandwith T, Besançon C (eds.), Transboundary Conservation: A New Vision for Protected Areas, pp. 128-137. [ Links ]
Clark RP, Edwards MS, Foster MS. 2004. Effects of shade from multiple kelp canopies on an understorey algal assemblage. Mar. Ecol. Prog. Ser. 267: 107-119. http://dx.doi.org/10.3354/meps267107 [ Links ]
Clarke KR, Gorley RN. 2006. PRIMER v6: User Manual/Tutorial. PRIMER-E, Plymouth. [ Links ]
Connell SD. 2003. The monopolization of understorey habitat by subtidal encrusting coralline algae: A test of the combined effects of canopy-mediated light and sedimentation. Mar. Biol. 142: 1065-1071. [ Links ]
Dailey MD, Reish DJ, Anderson JW. 1993. Ecology of the Southern California Bight: A Synthesis and Interpretation. University of California Press, Berkeley, 926 pp. [ Links ]
Dayton PK. 1971. Competition, disturbance and community organization: The provision of subsequent utilization of space in a rocky intertidal community. Ecol. Monogr. 41: 351-389. http://dx.doi.org/10.2307/1948498 [ Links ]
Dayton PK. 1985. Ecology of kelp communities. Annu. Rev. Ecol. Syst. 16: 215-245. http://dx.doi.org/10.1146/annurev.ecolsys.16.L215 [ Links ]
Dayton PK, Currie V, Gerrodette T, Keller BD, Rosenthal RJ, Tresca DV. 1984. Patch dynamics and stability of some California kelp communities. Ecol. Monogr. 54: 253-289. http://dx.doi.org/10.2307/1942498 [ Links ]
Dayton PK, Tegner MJ, Edwards PB, Riser KL. 1998. Sliding baselines, ghosts, and reduced expectations in kelp forest communities. Ecol. Appl. 8: 309-322. http://dx.doi.org/10.1890/1051-0761(1998)008[0309:SBGARE]2.0.CO;2 [ Links ]
Di Lorenzo E. 2003. Seasonal dynamics of the surface circulation in the Southern California Current System. Deep-Sea Res. 50: 2371-2388. http://dx.doi.org/10.1016/S0967-0645(03)00125-5 [ Links ]
Duggins DO, Eckman JE, Sewell AT. 1990. Ecology of understory kelp environments. II. Effects of kelps on recruitment of benthic invertebrates. J. Exp. Mar. Biol. Ecol. 143: 27-45. http://dx.doi.org/10.1016/0022-0981(90)90109-P [ Links ]
Durazo R, Ramírez-Manguilar AM, Miranda LE, Soto-Mardones LA. 2010. Climatología de variables hidrográficas. In: Gaxiola-Castro G, Durazo R (eds.), Dinámica del Ecosistema Pelágico frente a Baja California 1997-2007. Insituto Nacional de Ecología, Centro de Investigación Científica y Educación Superior de Ensenada, Universidad Autónoma de Baja California, pp. 25-57. [ Links ]
Ebeling AW, Laur DR, Rowley RJ. 1985. Severe storm disturbances and reversal of community structure in a southern California kelp forest. Mar. Biol. 84: 287-294. http://dx.doi.org/10.1007/BF00392498 [ Links ]
Edwards MS. 2004. Estimating scale-dependency in disturbance impacts: El Niños and giant kelp forests in the northeast Pacific. Oecologia 138: 436-447. http://dx.doi.org/10.1007/s00442-003-1452-8 [ Links ]
Edwards MS, Hernández-Carmona G. 2005. Delayed recovery of giant kelp near its southern range limit in the North Pacific Ocean following El Niño. Mar. Biol. 147: 273-279. http://dx.doi.org/10.1007/s00227-004-1548-7 [ Links ]
Edwards MS, Estes JA. 2006. Catastrophe, recovery, and range limitation in NE Pacific kelp forests: A large-scale perspective. Mar. Ecol. Prog. Ser. 320: 79-87. http://dx.doi.org/10.3354/meps320079 [ Links ]
Erlandson JM, Torben CR. 2010. Archaeology meets marine Ecology: The antiquity of maritime cultures and human impacts on marine fisheries and ecosystems. Annu. Rev. Mar. Sci. 2: 231-251. http://dx.doi.org/10.1146/annurev.marine.010908.163749 [ Links ]
Foster MS, Schiel DR. 1985. The ecology of giant kelp forests in California, USA: A community profile. US Fish and Wildlife Service Biological Rep. I-XV: 1-152. [ Links ]
Foster MS, Vanblaricom GR. 2001. Spatial variation in kelp forest communities along the Big Sur coast of central California, USA. Cryptogamie Algol. 22: 173-186. http://dx.doi.org/10.1016/S0181-1568(01)01054-6 [ Links ]
Foster MS, Schiel DR. 2010. Loss of predators and the collapse of southern California kelp forests: Alternatives, explanations and generalizations. J. Exp. Mar. Biol. Ecol. 393: 59-70. http://dx.doi.org/10.1016/j.jembe.2010.07.002 [ Links ]
Fowler-Walker MJ, Connell SD. 2007. Habitat heterogeneity as a consequence of substratum-orientation and kelp-canopy: Relating interdependent responses to common patterns. J. Exp. Mar. Biol. Ecol. 343: 127-137. http://dx.doi.org/10.1016/j.jembe.2006.12.004 [ Links ]
Fuhlendorf SD, Harrell WC, Engle DM, Hamilton RG, Davis CA. 2006. Should heterogeneity be the basis for conservation? Grassland bird response to fire and grazing. Ecol. Appl. 16: 1706-1716. http://dx.doi.org/10.1890/1051-0761(2006)016[1706:SHBTBF]2.0.CO;2 [ Links ]
Gaylord B, Rosman JH, Reed DC, Koseff JR, Fram J, MacIntyre S, Arkema K, McDonald C, Brzezinski MA, Largier JL, Monismith SG, Raimondi PT, Mardian B. 2007. Spatial patterns of flow and their modification within and around a giant kelp forest. Limnol. Oceanogr. 52: 1838-1852. http://dx.doi.org/10.4319/lo.2007.52.5.1838 [ Links ]
Graham MH. 2004. Effects of local deforestation on the diversity and structure of southern California giant kelp forest food webs. Ecosystems 7: 341-357. http://dx.doi.org/10.1007/s10021-003-0245-6 [ Links ]
Graham MH, Edwards MS. 2001. Statistical significance versus factor fit: Estimating the importance of individual factor in ecological analysis of variance. Oikos 93: 505-513. http://dx.doi.org/10.1034/j.1600-0706.2001.930317.x [ Links ]
Graham MH, Vasquez JA, Bushmann AH. 2007. Global ecology of the giant kelp Macrocystis: From ecotypes to ecosystems. Oceanogr. Mar. Biol. 45: 39-88. [ Links ]
Guzmán del Próo SA, Salinas F, Saitzev O, Belmar J, Carrillo J. 2000. Potential dispersion of reproductive products and larval stages of Haliotis spp as a function of the hydrodynamics of Bahía Tortugas, Mexico. J. Shellfish Res. 19: 869-882. [ Links ]
Hammann MG, Rosales-Casián JA. 1990. Taxonomía y estructura de la comunidad de peces del Estero de Punta Banda y Bahía de Todos Santos, Baja California, México. In: de la Rosa-Vélez J, González-Farías F (eds.), Temas de Oceanografía Biológica en México. Universidad Autónoma de Baja California, Ensenada, pp. 153-192. [ Links ]
Hernández-Carmona G, Rodríguez-Montesinos YE, Torres-Villegas JR, Sánchez-Rodríguez I, Vilchis MA. 1989. Evaluation of Macrocystis pyrifera (Phaeophyta, Laminariales) kelp beds in Baja California, Mexico. I. Winter 1985-1986. Cienc. Mar. 15(2): 1-27. [ Links ]
Jones CG, Lawton JH, Shachak M. 1994. Organisms as ecosystem engineers. Oikos 69: 373-386. http://dx.doi.org/10.2307/3545850 [ Links ]
Kovalenko KE, Thomaz SM, Warfe DM. 2012. Habitat complexity: Approaches and future directions. Hydrobiologia 685: 1-17. http://dx.doi.org/10.1007/s10750-011-0974-z [ Links ]
Ladah LB, Zertuche-González JA, Hernández-Carmona G. 1999. Giant kelp (Macrocystis pyrifera, Phaeophyceae) recruitment near its southern limit in Baja California after mass disappearance during ENSO 1997-1998. J. Phycol. 35: 1106-1112. http://dx.doi.org/10.1046/j.1529-8817.1999.3561106.x [ Links ]
Luckhurst BE, Luckhurst K. 1978. Analysis of the influence of substrate variables on coral reef fish communities. Mar. Biol. 49:317-323. http://dx.doi.org/10.1007/BF00455026 [ Links ]
McClain CR, Barry JP. 2010. Habitat heterogeneity, disturbance, and productivity work in concert to regulate diversity in deep submarine canyons. Ecology 91: 964-976. [ Links ]
Palleiro-Nayar JS, Aguilar-Montero D, Romero-Martínez JM. 1996. La pesquería del erizo de mar en Baja California, México. Las Pesquerías Relevantes de México. XXX Aniversario del Instituto Nacional de la Pesca, SEMARNAP, pp. 313-335. [ Links ]
Parnell PE, Dayton PK, Lennert-Cody CE, Rasmussen LL, Leichter JJ. 2006. Marine reserve design: Optimal habitats, species affinities, diversity, and ocean microclimate. Ecol. Appl. 16:945-962. http://dx.doi.org/10.1890/1051-0761(2006)016[0945:MRDOSH]2.0.CO;2 [ Links ]
Parnell PE, Dayton PK, Fisher RA, Loarie CC, Darrow RD. 2010. Spatial patterns of fishing effort off San Diego: Implications for zonal management and ecosystem function. Ecol. Appl. 20:2203-2222. http://dx.doi.org/10.1890/09-1543.1 [ Links ]
Pondella D, Gintert BE, Cobb JR, Allen LG. 2005. Biogeography of the nearshore rocky-reef fishes at the southern and Baja California islands. J. Biogeogr. 32: 187-201. http://dx.doi.org/10.1111/j.1365-2699.2004.01180.x [ Links ]
Pondella D, Williams J, Claisse J, Schaffer B, Ritter K, et al. 2011a. A preliminary investigation into the status of nearshore rocky reefs in areas of special biological significance in the Southern California Bight. SCCWRP Technical Report, 38 pp. [ Links ]
Pondella D, Williams J, Claisse J, Schaffer B, Ritter K, et al. 2011b. Physical and biological characteristics of nearshore rocky reefs in the Southern California Bight SCCWRP Technical Report, 29 pp. [ Links ]
Pressey RL, Humphries CJ, Margules CR, Vane-Wright RI, Williams PH. 1993. Beyond opportunism: Key principles for systematic reserve selection. Trends Ecol. Evol. 8: 124-128. http://dx.doi.org/10.1016/0169-5347(93)90023-I [ Links ]
Roberts CM, Andelman S, Branch G, Bustamante RG, Castilla JC, Dugan J, Halpern BS, Lafferty KD, Leslie HM, Lubchenco J, McArdle D, Possingham HP, Ruckelshaus M, Warner RR. 2003. Ecological criteria for evaluating candidate sites for marine reserves. Ecol. Appl. 13: 199-214. http://dx.doi.org/10.1890/1051-0761(2003)013[0199:ECFECS]2.0.CO;2 [ Links ]
Salgado-Rogel ML, Palleiro-Nayar JS. 2008. Disminución de la abundancia de erizo rojo y propuesta para su manejo en Baja California, México. INAPESCA Cienc. Pesq. 16: 37-45. [ Links ]
Steneck RS, Graham MH, Bourque BJ, Corbett D, Erlandson JM, Estes JA, Tegner MJ. 2002. Kelp forest ecosystems: Biodiversity, stability, resilience and future. Environ. Conserv. 29: 436-459. http://dx.doi.org/10.1017/S0376892902000322 [ Links ]
SYSTAT. 2009. SYSTAT for Windows. Version 13. SYSTAT Software Inc., Richmond, California. [ Links ]
Tegner MJ, Dayton PK. 1987. El Niño effects on southern California kelp forest communities. Adv. Ecol. Res. 17: 243-279. http://dx.doi.org/10.1016/S0065-2504(08)60247-0 [ Links ]
Tegner MJ, Dayton PK. 2000. Ecosystem effects of fishing in kelp forest communities. ICES J. Mar. Sci. 57: 579-589. http://dx.doi.org/10.1006/jmsc.2000.0715 [ Links ]
Tews J, Brose U, Grimm V, Tielbörger K, Wichmann MC, Schwager M, Jeltsch F. 2004. Animal species diversity driven by habitat heterogeneity/diversity: The importance of keystone structures. J. Biogeogr. 31: 79-92. http://dx.doi.org/10.1046/j.0305-0270.2003.00994.x [ Links ]
Toohey BD, Kendrick GA, Harvey ES. 2007. Disturbance and reef topography maintain high local diversity in Ecklonia radiata kelp forests. Oikos 116: 1618-1630. http://dx.doi.org/10.1111/j.0030-1299.2007.15689.x [ Links ]
Ugland KI, Gray JS, Ellingsen KE. 2003. The species accumulation curve and estimation of species richness. J. Anim. Ecol. 72:888-897. http://dx.doi.org/10.1046/j.1365-2656.2003.00748.x [ Links ]
Watson JR, Hays CG, Raimondi PT, Mitarai S, Dong C, McWilliams JC, Blanchette CA, Caselle JE, Siegel DA. 2011. Currents connecting communities: Nearshore community similarity and ocean circulation. Ecology 92: 1193-1200. http://dx.doi.org/10.1890/10-1436.1 [ Links ]
Wilson SK, Graham NAJ, Polunin NVC. 2007. Appraisal of visual assessments of habitat complexity and benthic composition on coral reefs. Mar. Biol. 151: 1069-1076. http://dx.doi.org/10.1007/s00227-006-0538-3 [ Links ]
Wolf S, Keitt B, Aguirre-Muñoz A, Tershy B, Palacios E. Croll D. 2006. Transboundary seabird conservation in an important North American marine ecoregion. Environ. Conserv. 33:294-305. http://dx.doi.org/10.1017/S0376892906003353 [ Links ]
Nota
Traducido al español por Christine Harris.














