Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.39 no.1 Ensenada Mar. 2013
https://doi.org/dx.doi.org/10.7773/cm.v39i1.2146
Artículos
Proporción de sexos, reproducción y crecimiento de la dorada, Sparus aurata (Pisces: Sparidae), en el golfo de Gabes, Túnez
Sex ratio, reproduction, and growth of the gilthead sea bream, Sparus aurata (Pisces: Sparidae), in the Gulf of Gabes, Tunisia
Aymen Hadj-Taieb*, Mohamed Ghorbel, Nader Ben Hadj-Hamida, Othman Jarboui
Institut National des Sciences et Technologies de la Mer (INSTM), BP 1035, 3018 Sfax, Tunisia.
* Corresponding author. E-mail: aymen.haj.82@gmail.com
Received April 2012,
received in revised form December 2012,
accepted January 2013.
RESUMEN
Se recolectaron muestras (N = 1065) de la dorada, Sparus aurata, en el golfo de Gabes (Túnez) de marzo de 2008 a febrero de 2010. Esta especie es una hermafrodita protándrica. La longitud total (LT) varió de 10.10 a 35.00 cm y el número de machos por cada hembra fue de 1.18:1. La temporada reproductiva se extendió de octubre a febrero y la máxima actividad reproductiva se presentó de diciembre a enero. La talla a la cual el 50% de los machos alcanzó la madurez sexual fue de 17.63 ± 0.28 cm LT y el tamaño al cual el 50% de los machos se transformó en hembras fue de 18.75 ± 0.19 cm LT. La relación longitud-peso para todos los individuos fue descrita por los siguientes parámetros: a = 0.0107 y b = 3.0797. Se encontraron peces de 0 a 8 años de edad. Las estimaciones de los parámetros de crecimiento de von Bertalanffy para toda la muestra fueron: L∞ = 38.28 cm, k = 0.202 año–1 y t0 = –1.888 años.
Palabras clave: Sparus aurata, parámetros reproductivos, edad, crecimiento, golfo de Gabes.
ABSTRACT
Samples (N = 1065) of the gilthead seabream, Sparus aurata, were collected in the Gulf of Gabes (Tunisia) from March 2008 to February 2010. This species is a protandric hermaphrodite. Total length (TL) ranged from 10.10 to 35.00 cm and the number of males to each female was 1.18:1. The reproductive season extended from October to February and maximum spawning activity occurred from December to January. The size at which 50% of the males reached maturity was 17.63 ± 0.28 cm TL and the size at which 50% of males transformed into females was 18.75 ± 0.19 cm TL. The length-weight relationship for all individuals was described by the following parameters: a = 0.0107 and b = 3.0797. Age of fish ranged from 0 to 8 years. Estimates of the von Bertalanffy growth parameters for the whole sample were: L∞ = 38.28 cm, k = 0.202 year–1, and t0 = –1.888 years.
Key words: Sparus aurata, reproductive parameters, age, growth, Gulf of Gabes.
INTRODUCCIÓN
La dorada, Sparus aurata (Linnaeus 1758), se encuentra comúnmente en el mar Mediterráneo pero con poca frecuencia en el mar Negro (Bânârescu 1964). También se encuentra en el océano Atlántico nororiental, desde las islas Británicas hasta las islas Canarias y Cabo Verde (Bauchot y Hureau 1986). Se han realizado varios estudios sobre las poblaciones silvestres en el océano Atlántico (Arias 1980, Pita et al. 2002) y el mar Mediterráneo (Arnal et al. 1976, Lasserre 1976, Suau y López 1976, Ferrari y Chieregato 1981, Wassef y Eisawy 1985, Rosecchi 1987, Kraljević y Dulĉić 1997, Mehanna 2007). Asimismo, se han dedicado considerables esfuerzos de investigación a su acuicultura en Europa (Chatain 1997, Shields 2001).
En Túnez, donde S. aurata es de gran interés comercial tanto para las pesquerías tradicionales como para la acuicultura marina, se han estudiado algunos aspectos biológicos (Chauvet 1979, Ksouri 1981). Esta especie representa más del 15% de los peces espáridos capturados en la región (la oficina de estadística de la Dirección General de Pesca y Acuicultura de Túnez proporcionó una estimación media anual de captura de 291 t para 2010, 2011 y 2012).
A pesar de su importancia comercial, poco se sabe acerca de los parámetros de historia de vida de S. aurata en Túnez en general y en el golfo de Gabes en particular. Por lo tanto, es importante determinar la estrategia reproductiva y el crecimiento de esta especie espárida para obtener un mejor conocimiento de su biología y dinámica poblacional y mejorar la gestión pesquera. Este trabajo proporciona datos sobre la biología reproductiva, estructura de edades y tasa de crecimiento de S. aurata en el golfo de Gabes.
MATERIALES Y MÉTODOS
Se obtuvieron 1065 especímenes de S. aurata mediante un muestreo aleatorio estratificado de capturas comerciales en diferentes puertos del golfo de Gabes entre marzo de 2008 y febrero de 2010. El golfo de Gabes se localiza en la costa sur de Túnez y cubre un área grande de unos 750 km desde cabo Kapoudia (paralelo 35 Norte) hasta la frontera de Túnez con Libya (fig. 1). En esta zona la especie actualmente se captura con palangres, trasmallos y trampas tradicionales conocidas localmente como cherfias. Estas trampas son empleadas en la parte sur del país, especialmente alrededor de las islas Kerkennah donde las aguas son someras y el intervalo de marea es importante. Estas estructuras en forma de V (con la punta hacia el mar) consisten de particiones construidas con hojas de palma. Una entrada en el ápice de la V lleva a unos compartimientos donde quedan atrapados los peces durante la marea baja. Para cada ejemplar, la longitud total (LT) se midió al milímetro más cercano, y el peso total (PT) y peso eviscerado (PE) se midieron con precisión de 0.1 g. El sexo se determinó mediante observación macroscópica de las gónadas. Los ejemplares se consideraron machos (M) si sólo presentaban testículos, hembras (H) si sólo tenían ovarios, e individuos transicionales cuando presentaron componentes masculinos y femeninos en proporciones iguales o diferentes (MH = igual proporción de tejidos masculinos y femeninos, Mh = predominio de tejido masculino y Hm = predominio de tejido femenino).
Las etapas de madurez se determinaron macroscópicamente y el peso de las gónadas (PG) se registró con presición de 0.01 g. Se clasificaron cinco etapas de madurez: I, inmaduro; II, en reposo; III¸ maduro; IV, maduro y fluyente; y V, evacuado (Holden y Raitt 1975).
La proporción de sexos (M:H) se analizó mediante clases de talla. El periodo de desove se determinó siguiendo los cambios mensuales en el índice gonadosomático (IGS), el cual se calculó como sigue (Anderson y Gutreuter 1983):
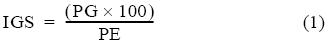
Para la estimación de las longitudes promedio a 50% de madurez sexual, se ajustó una función logística a la proporción de individuos maduros por clase de talla mediante una regresión no lineal. Se usó la siguiente función (Pauly 1980):
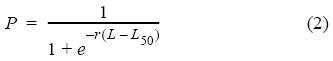
donde P es la proporción de individuos maduros en cada intervalo de talla (L), L50 es la longitud a la cual el 50% de los individuos alcanza la madurez sexual y r es la constante.
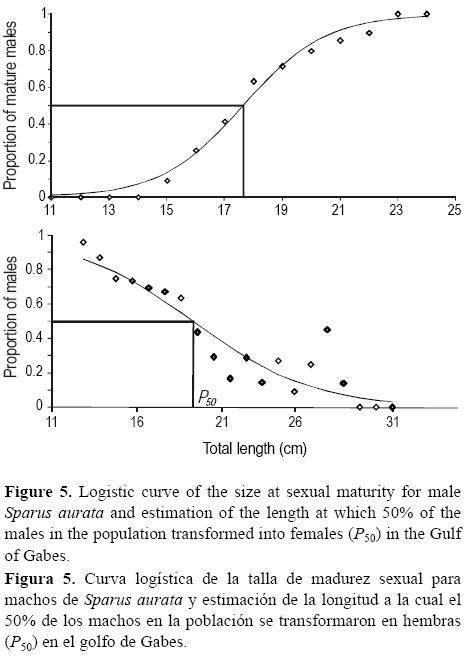
Se ajustó una función similar al porcentaje de hembras en la población para estimar la longitud a la cual el 50% de los machos de la población se transforman en hembras (P50). Para esto se utilizó el método de Shapiro (1984), el cual consiste en agregar la distribución de frecuencia de tallas donde las hembras y machos se traslapan y luego calcular el valor medio de la distribución.
Con la finalidad de detectar si existían signos de inversión sexual, se realizó un examen histológico de las gónadas de siete individuos transicionales de S. aurata escogidos aleatoriamente del intervalo completo de tallas (17.8 a 27 cm) y de cada etapa de madurez (maduro, maduro y fluyente, y evacuado). Submuestras de los tejidos gonádicos fueron fijadas en solución de Bouin durante dos o tres días y luego deshidratadas y embebidas en parafina. Se cortaron secciones transversales de 5 μm de grosor y se tiñieron con hematoxilina y eosina. Las fases reproductivas y de desarrollo de los gametos se determinaron según Matsuyama et al. (1990) y Brown-Peterson et al. (2011).
La relación entre el peso total o eviscerado y la longitud total de los peces se calculó usando la ecuación de regresión exponencial (Ricker 1973):

donde a y b son los parámetros a estimar.
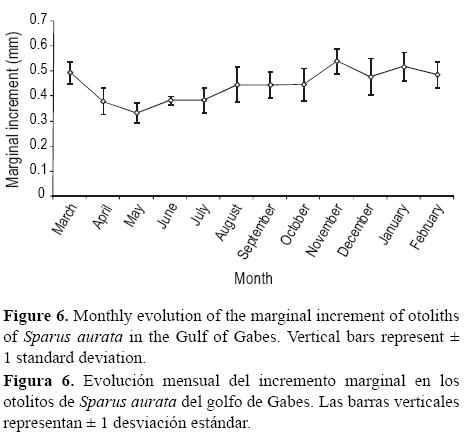
Se extrajeron los otolitos (sagitas) de 955 individuos y se limpiaron y almacenaron para su posterior análisis. La edad se determinó leyendo el otolito entero (inmerso en una solución de glicerina y alcohol) usando un microscopio binocular con una magnificación de 20× y luz reflejada. Las estimaciones de edad se obtuvieron contando el número de bandas opacas del núcleo al margen. Los otolitos fueron leidos tres veces por el investigador principal y sólo se aceptaron las lecturas cuando dos coincidían. La periodicidad de formación de los anillos se determinó mediante el método de incremento marginal. Este método se basa en las estimaciones del incremento marginal del otolito de cada individuo por clase de edad y en las estimaciones del incremento marginal promedio mensual. El incremento marginal (0.1 mm) se midió como la distancia entre el margen interior del anillo translúcido más externo y la periferia del otolito. Las mediciones siempre se realizaron a lo largo del eje mayor del otolito. En vista del amplio intervalo de edades encontrado, fue necesario combinar las edades en grupos para representar individuos con crecimiento rápido, moderado y lento.
La curva de crecimiento de von Bertalanffy se ajustó a la longitud observada a cada edad de la clave de edad-longitud resultante mediante el algoritmo de Marquardt para la estimación por mínimos cuadrados de parámetros no lineales (Saila et al. 1988). La ecuación de la curva de crecimiento es (Beverton y Holt 1957):
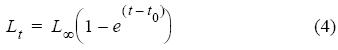
donde Lt es la longitud del individuo en un tiempo t (año), L∞ es la longitud asintótica que el individuo puede alcanzar, k es el coeficiente de crecimiento y t0 es el tiempo hipotético cuando la longitud es cero.
Se estimó, mediante un método de cálculo directo (Jabeur 1999), la edad para cada longitud al momento de captura. Para este cálculo se consideró el periodo de desove, la deposición de anillos de crecimiento anuales y la fecha de captura del individuo examinado.
RESULTADOS
De los 1065 individuos capturados, 520 fueron machos, 442 fueron hembras y 76 fueron transicionales; no fue posible determinar macroscópicamente el sexo de los 27 restantes. Los machos variaron de 10 a 30 cm LT (11–200 g PT), las hembras de 12 a 35 cm LT (20–350 g PT) y los individuos transicionales de 17 a 27 cm TL (50–300 g PT).
La proporción de sexos estuvo sesgada hacia los machos (M:H = 1.176:1); el análisis de X2 mostró que el número de machos por cada hembra difirió significativamente de una proporción balanceada de 1:1 (X2 = 6.33, P < 0.05). Los machos predominaron en las clases de talla menores y las hembras en las mayores (fig. 2). Los individuos transicionales (en las clases de talla medianas) representaron el 7.10% de los especímenes examinados.
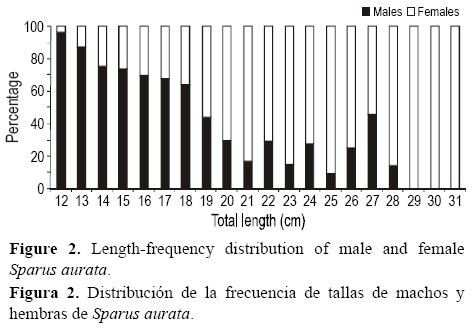
La observación de las gónadas a simple vista mostró un número pequeño de gónadas bisexuales (7.10%), lo que sugiere que S. aurata es una especie hermafrodita. Los individuos transicionales se observaron principalmente entre octubre y febrero, durante el periodo reproductivo. La mayoría de las veces las gónadas mostraron un mayor desarrollo de un sexo que del otro, la longitud total promedio siendo mayor para los individuos con un ovario más desarrollado (19 Mh: LT = 18.21 ± 1.4 cm; 21 MH: LT = 20.32 ± 0.7 cm; 36 Hm: LT = 23.86 ± 3.5 cm). La longitud total promedio de los individuos transicionales en conjunto fue de 21.47 ± 0.6 cm. La inversión sexual sucedió a aproximadamente 18 cm LT, ésta siendo la distribución media de 1058 individuos variando de 10 a 30 cm LT.
El estudio histológico de las submuestras aleatorias de gónadas mostró que todos los individuos presentaron gónadas bisexuales; sin embargo, nos permitió identificar unas gónadas en proceso de inversión sexual (fig. 3), las cuales fueron un indicador experimental real del cambio de sexo. Consistieron de una porción ovárica desarrollada con ovocitos previtelogénicos y una porción testicular en regresión con algunos espermatozoides residuales mostrando evidencia de un testículo funcional anterior. La presencia de individuos con ovarios bien desarrollados y residuos de testículos degenerados confirma que S. aurata es una especie hermafrodita protándrica. La inversión sexual estuvo acompañada por la reabsorción y reestructuración del tejido testicular y posterior resurgimiento del tejido ovárico.
Los valores medios del IGS generalmente fueron mayores para las hembras que para los machos (fig. 4), pero mostraron el mismo patrón estacional, siendo mayores de octubre a febrero, con un máximo entre noviembre y diciembre. La etapa de maduración de los gametos se observó entre septiembre y noviembre. El valor máximo del IGS se observó en noviembre, después del cual los valores empezaron a decrecer, lo que refleja el fenómeno de desove.
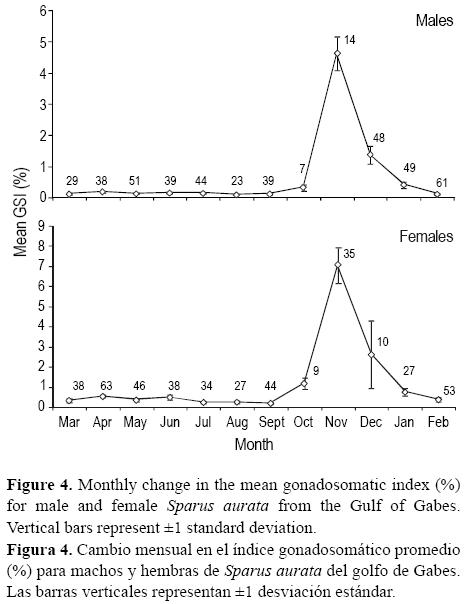
Para los machos, L50 = 17.6 ± 0.21 cm LT y P50 = 18.75 ± 0.19 cm LT (tabla 1, fig. 5).

Los parámetros de la relación longitud-peso para los machos, las hembras y los dos sexos en conjunto se presentan en la tabla 2. Se encontró una diferencia significativa en los coeficientes alométricos para machos y hembras (t = 5, P < 0.05). Se observó un crecimiento alométrico positivo para las hembras y los dos sexos combinados, mientras que para los machos el peso aumentó isométricamente con la longitud (tabla 2).
Los anillos de crecimiento de los otolitos cubiertos de glicerina fueron visibles, pudiéndose leer el 82%. El análisis del incremento marginal mostró que un solo anillo se formó durante mayo de cada año (fig. 6).
La longitud empleada en la clave de edad-longitud (fig. 7, tabla 3) correspondió a los promedios de la longitud estimada para los individuos de la misma edad en meses que subsecuentemente se conviertieron en años. La edad de los machos varió de 0+ a 5+ años y la de las hembras de 0+ a 7+ años (tabla 3, fig. 7). Los parámetros de la ecuación de crecimiento de von Bertalanffy fueron: L∞ = 38.28 ± 4.19 cm, k = 0.202 año–1 ± 0.07 y t0 = –1.888 ± 0.61 años (tabla 4).


DISCUSIÓN
Sparus aurata es una especie hermafrodita (Bruslé-Sicard y Fourcault 1997). Esta característica, común entre espáridos (Alekseev 1982, Buxton y Garratt 1990), ha sido documentada para esta especie de otras zonas de la ribera sur del Mediterráneo (Chaoui et al. 2006, Mehanna 2007) y es reforzada en este estudio.
En el golfo de Gabes, la inversión sexual sucedió principalmente a 18 cm LT. Según Sadovy de Mitcheson y Liu (2008), la inversión sexual es acompañada por la reabsorción y reestructuración de las espermatogonias y el posterior resurgimiento del tejido ovárico.
La estructura sexual de la población, con predominancia de machos sobre hembras, se determina principalmente por la naturaleza de la inversión sexual. Smale (1988) indicó que las proporciones de sexos de espáridos protándricos pueden favorecer a los machos, como ha sido observado en muestras de otros lados del Mediterráneo (Chaoui et al. 2006). La explotación y expresión de este tipo de hermafroditismo parecen ser una respuesta a varios factores ambientales y biológicos (Sadovy de Mitcheson y Liu 2008). Tal inversión sexual (i.e., el cambio de un sexo a otro en el mismo individuo) es un fenómeno común en la familia Sparidae (Buxton y Garratt 1990, Micale y Perdichizzi 1994, Vitale et al. 2011).
En el Atlántico, el desove se realiza en otoño y a veces se extiende hasta principios de invierno (Suau y López 1976). En el Mediterráneo, S. aurata desova de noviembre a febrero (Lasserre y Labourg 1974, Chaoui et al. 2006) y esto último es apoyado por lo observado en este estudio en el golfo de Gabes. Un periodo de desove tan extenso podría indicar que las condiciones ambientales para la eclosión y el desarrollo larval son favorables durante un mayor periodo de tiempo (Tsikliras et al. 2010). Un periodo de desove prolongado también ha sido documentado para otras especies de espáridos como Pagellus erythrinus (Ghorbel 1996) y Diplodus vulgaris (Hadj Taieb 2007).
Asimismo, el peso aumenta isométricamente con la longitud para ambos sexos. Se han obtenido resultados similares en otras zonas (Wassef 1978).
El uso del modelo de von Bertalanffy para decribir el crecimiento ha sido criticado por varias razones (Booth 1997). No obstante, este modelo proporciona una descripción simple del crecimiento que permite comparaciones entre especies y grupos de especies. Se escogió la forma original de la ecuación de von Bertalanffy para este estudio porque contiene menos parámetros que el modelo de crecimiento de Schnute.
El individuo de mayor edad encontrado en el golfo de Gabes fue de 8 años, mientras que en Algeria fue de 7 años (Chaoui et al. 2006) y en Egipto de 4 años (Mehanna 2007).
Una diferencia en longitud entre machos y hembras de la misma edad no puede considerarse evidencia de una diferencia intersexual de la tasa de crecimiento ya que las hembras y los machos son los mismos individuos en diferentes fases de sucesión sexual y, posiblemente, los machos de mayor tamaño de un grupo de edad son los primeros en cambiar de sexo.
El valor de longitud máxima teórica (L = 38.28 cm) fue similar al tamaño del pez más grande examinado, y el valor del coeficiente de crecimiento (k = 0.202 año–1) indicó una relativamente baja obtención de la talla máxima. Estos parámetros son similares a los obtenidos por Ameran (1992) y Tharwat et al. (1998) en Egipto (tabla 4; figs. 8, 9), pero difieren de los obtenidos por Lasserre y Labourg (1974) en Francia, Suau y López (1976) en el este de España, Kraljević y Dulĉić (1997) en el Adriático norte y Chaoui et al. (2006) en Algeria (tabla 4, fig. 8). La diferencia en crecimiento entre las regiones puede atribuirse a las diferencias en el tamaño del individuo más grande examinado en cada lugar, los métodos usados para evaluar la ecuación de crecimiento y las diferentes condiciones ambientales. Los especímenes más grandes se han encontrado en los estudios realizados por Lasserre (1976), Wassef (1978) y Chaoui et al. (2006). La ausencia de individuos grandes en nuestro estudio podría atribuirse al fenómeno de migración.
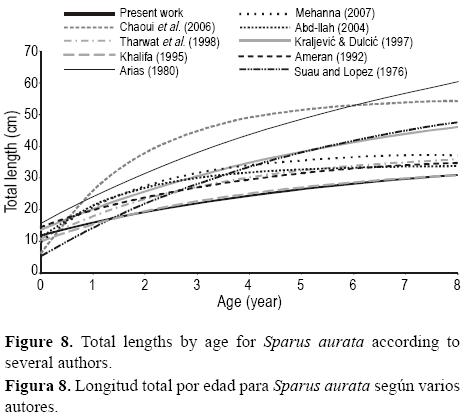
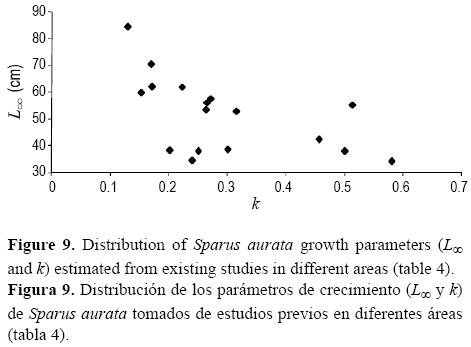
En el golfo de Gabes, S. aurata crece más lento que en el Mediterráneo oriental (Arnal et al. 1976, Suau y López 1976) y occidental (Khalifa 1995, Abd-Allah 2004). Este fenómeno ha sido documentado para otras especies como Scorpaena porcus (Bradai y Bouain 1988) y Pagellus erythrinus (Ghorbel y Bouain 1990).
Los parámetros de crecimiento obtenidos en el presente estudio son razonables ya que la longitud máxima teórica es mayor que el tamaño del pez más grande examinado y el valor del coeficiente de crecimiento indica una obtención relativamente lenta del tamaño máximo, lo cual es característico de especies que presentan ciclos de vida largos. Los individuos crecen rápidamente durante su primer año de inmadurez, alcanzando aproximadamente el 40% de su talla máxima; después del primer año, la tasa de crecimiento anual decrece rápidamente.
AGRADECIMIENTOS
Se agradece al cuerpo técnico y de apoyo del INSTM (Sfax) su asistencia en el laboratorio y a Nabil Kallel (Facultad de Ciencias, Sfax) su revisión del manuscrito. Las sugerencias y comentarios de los revisores anónimos ayudaron a mejorar el manuscrito.
Traducido al español por Christine Harris.
REFERENCES
Abd-Allah SM. 2004. Biological studies for the fishery regulations and management of the Bardawil Lagoon. PhD thesis, Suez Canal University, Egypt, 282 pp. [ Links ]
Alekseev FE. 1982. Hermaphroditism in sparid fishes (Perciformes: Sparidae). I. Protogyny in porgies, Pagrus pagrus, P. orphus, P. ehrenbergi and P. auriga, from West Africa. J. Ichthyol. 22: 85–94. [ Links ]
Ameran MA. 1992. Studies on fish production of Bardawil Lagoon. MSc thesis, Suez Canal University, Egypt, 158 pp. [ Links ]
Anderson RO, Gutreuter SJ. 1983. Length, weight, and associated structural indices. In: Nielsen LA, Jonhnson DL (eds.), Fisheries Techniques. American Fisheries Society, Bethesda, pp. 283–300. [ Links ]
Arias A. 1980. Crecimento, régimen alimentario y reproducción de la dorada (Sparus aurata L.) y del róbalo (Dicentrarchus labrax L.) en los esteros de Cádiz. Inv. Pesq. 44: 59–83. [ Links ]
Arnal JI, García-Alcazar A, Ortega A. 1976. Observaciones sobre el crecimento de la dorada (Sparus aurata L.) en el Mar Menor (Murcia). Bol. Inst. Esp. Oceanogr. 221: 1–17. [ Links ]
Bânârescu P. 1964. Fauna republicii populare romine (Pises-Osteichthyes). Editura Academiei Republicii Populare Romine, Bucharest, 960 pp. [ Links ]
Bauchot ML, Hureau JC. 1986. Sparidae. In: Whitehead PJP, Bauchot ML, Hureau JC, Nielsen J, Tortenese E (eds.), Fishes of the North-Eastern Atlantic and Mediterranean. UNESCO, Paris, pp. 883–907. [ Links ]
Beverton RJH, Holt SJ. 1957. On the dynamics of exploited fish populations. Fishery Investigations Series II, XIX. HMSO, London, 533 pp. [ Links ]
Booth AJ. 1997. On the life history of lesser gurnard (Scorpaeniformes: Triglidae) inhabiting the Agulhas Bank, South Africa. J. Fish. Biol. 51: 1155–1173. [ Links ]
Bradai MN, Bouain A. 1988. Age et croissance de Scorpaena porcus et Scorpaena scorfa du golfe de Gabès. Bull. Inst. Nat. Scient. Tech. Océanogr, Pêche Salammbô 15: 13–38. [ Links ]
Brown-Peterson NJ, Wyansky DM, Saborido-Rey F, Macewicz BJ, Lowerre-Barbieri SK. 2011. A standardized terminology for describing reproductive development in fishes. Mar. Coast. Fish. 3: 52–70. [ Links ]
Bruslé-Sicard S, Fourcault B. 1997. Recognition of sex-inverting protandric Sparus aurata: Ultrastructural aspects. J. Fish Biol. 50: 1094–1103. [ Links ]
Buxton CD, Garratt PA. 1990. Alternative reproductive styles in seabreams (Pisces: Sparidae). Environ. Biol. Fish. 28: 113–124. [ Links ]
Chaoui L, Kara MH, Faure E, Quignard JP. 2006. Growth and reproduction of the gilthead seabream Sparus aurata in Mellah Lagoon (north-eastern Algeria). Scien. Mar. 70: 545–552. [ Links ]
Chatain B. 1997. Development and achievements of marine fish-rearing technology in France over the last 15 years. Hydrobiologia 358: 7–11. [ Links ]
Chauvet C. 1979. Préliminaire à l'étude de la biologie et de la dynamique du stock tunisien de Sparus aurata (L. 1758). Synopsis de la croissance groupes 0, 1, 2. Bull. Off. Nat. Pêches 3(2): 241–253. [ Links ]
Ferrari I, Chieregato AJ. 1981. Feeding habits of juvenile stages of Sparus auratus L., Dicentrarchus labrax L. and Mugilidae in a brackish embayment of the Po River delta. Aquaculture 25: 243–257. [ Links ]
Ghorbel M. 1996. Le pageot commun Pagellus erythrinus (Poissons, Sparidae): Ecobiologie et état d'exploitation dans le golfe de Gabès. PhD thesis, University of Sfax, Tunisia, 170 pp. [ Links ]
Ghorbel M, Bouain A. 1990. Age et croissance et croissance du pageot commun Pagellus erythrinus du golfe de Gabès, Tunisie. Bull. Inst. Nat. Scient. Tech. Océanogr. Pêche Salammbô 17: 17–32. [ Links ]
Hadj Taieb A. 2007. Contribution a l'etude ecobiologique du sar à tête noire Diplodus vulgaris (Téleosteens, Sparidae) du golfe de Gabès. MSc thesis, University of Sfax, Tunisia, 96 pp. [ Links ]
Holden MJ, Raitt DFS. 1975. Manual de ciencia pesquera. Parte 2. Métodos para investigar los recursos y su aplicación. FAO Documentos Técnicos de Pesca 115, 211 pp. [ Links ]
Jabeur C. 1999. La pêche dans le golfe de Gabès: Interactions techniques entres les métiers et exploitation partagée du rouget rouge (Mullus surmuletus L., 1758). PhD thesis, Université de Bretagne Occidentale, France, 168 pp. [ Links ]
Khalifa U. 1995. Biological studies on gilthead bream, Sparus aurata in Lake Bardwil. MSc thesis, Cairo University, Egypt, 361 pp. [ Links ]
Kraljević M, Dulĉić J. 1997. Age and growth of gilt-head seabream (Sparus aurata L.) in the Mirna Estuary, northern Adriatic. Fish. Res. 31: 249–255. [ Links ]
Ksouri J. 1981. Contribution à l'étude de la biologie de S. aurata du golfe de Tunis et de son élevage dans les stations de Ghar EL Melh et Lakarit. MSc thesis, University of Tunis, Tunisia, 108 pp. [ Links ]
Lasserre G. 1976. Dynamique des populations ichthyologiques lagunaires. Application à Sparus aurata. PhD thesis, Université Montpellier II, France, 306 pp. [ Links ]
Lasserre G, Labourg PJ. 1974. Etude comparée de la croissance de ladaurade Sparus aurata L. des régions d'Arcachon et de Sète. Vie Milieu 24: 155–170. [ Links ]
Matsuyama M, Adachi S, Nagahama Y, Maruyama K, Matsura S. 1990. Diurnal rhythm of serum steroid hormone levels in the Japanese whiting, Sillago japonica, a daily-spawning teleost. Fish Physiol. Biochem. 8: 329–338. [ Links ]
Mehanna SF. 2007. A preliminary assessment and management of gilthead bream Sparus aurata in the Port Said fishery, the southeastern Mediterranean, Egypt. Turkish J. Fish. Aquat. Sci. 7: 123–130. [ Links ]
Micale V, Perdichizzi F. 1994. Further studies on the sexuality of the hermaphroditic teleost Diplodus sargus (L.). J. Fish Biol. 31: 435–440. [ Links ]
Pauly D. 1980. On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fish stocks. J. Cons. Int. Exp. Mer 39:175–192. [ Links ]
Pita C, Gamito S, Erzini K. 2002. Feeding habits of the gilthead seabream (Sparus aurata) from the Ria Formosa (southern Portugal) as compared to the black seabream (Spondyliosoma cantharus) and the annular seabream (Diplodus annularis). J. Appl. Ichthyol. 18: 81–86. [ Links ]
Ricker WE. 1973. Linear regressions in fishery research. J. Fish. Res. Bd. Canada 30: 409–434. [ Links ]
Rosecchi E. 1987. L'alimentation de Diplodus annularis, Diplodus sargus, Diplodus vulgaris et Sparus aurata (Pisces, Sparidae) dans le golfe du Lion et les lagunes littorales. Rev. Trav. Inst. Pêches Marit. 49: 125–141. [ Links ]
Sadovy de Mitcheson Y, Liu M. 2008. Functional hermaphroditism in teleosts. Fish Fish. 9:1–43. [ Links ]
Saila SB, Recksiek CW, Prager MH. 1988. Basic fishery scienceprograms. A compendium of microcomputer programs and manual of operation. Dev. Aquacult. Fish. Sci. 18: 1–230. [ Links ]
Shapiro DY. 1984. Sex reversal and sociodemographic processes incoral reef fishes. In: Potts GW, Wootton RJ (eds.), Fish Reproduction: Strategies and Tactics. 3rd ed. Academic Press,London, pp. 103–118. [ Links ]
Shields RJ. 2001. Larviculture of marine finfish in Europe. Aquaculture 200: 55–88. [ Links ]
Smale MJ. 1988. Distribution and reproduction of the reef fish Petrus rupestris (Pisces: Sparidae) off the coast of South Africa. J. Zool. S. Afr. 23: 272–287. [ Links ]
Suau P, López J. 1976. Contribución al studio de la dorada, Sparus aurta L. Inv. Pesq. 40: 169–199. [ Links ]
Tharwat AA, Emam WM, Ameran MA. 1998. Stock assessment of the gilthead seabream Sparus aurata from Bardawil Lagoon, North Sinai, Egypt. J. Aquat. Biol. Fish. 2: 483–504. [ Links ]
Tsikliras AC, Antonopoulou E, Stergiou KI. 2010. Spawning period of Mediterranean marine fishes. Rev. Fish Biol. Fish. 20: 499–538. [ Links ]
Vitale S, Arkhipkin A, Cannizzaro L, Scalisi M. 2011. Life history traits of the striped seabream Lithognathus mormyrus (Pisces, Sparidae) from two coastal fishing grounds in the Strait of Sicily. J. Appl. Ichthyol. 27: 1086–1094. [ Links ]
Wassef E. 1978. Biological and physiological studies on marine and acclimatized fish Chrysophrys auratus. PhD thesis, Cairo University, Egypt, 225 pp. [ Links ]
Wassef EA, Eisawy A. 1985. Food and feeding habits of wild and reared gilthead bream Sparus aurata L. Cybium 9: 233–242. [ Links ]














