Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.39 no.1 Ensenada mar. 2013
https://doi.org/dx.doi.org/10.7773/cm.v39i1.2136
Artículos
La importancia de los machos del bagre bandera, Bagre marinus (Pisces: Ariidae), en el proceso reproductivo
Importance of male gafftopsail catfish, Bagre marinus (Pisces: Ariidae), in the reproductive process
Elsy Consuelo Segura-Berttolini1, 2, Manuel Mendoza-Carranza1*
1 El Colegio de la Frontera Sur (ECOSUR), Unidad Villahermosa, Sistemas de Producción Alternativos: Pesquerías Artesanales, Km 15.5 carretera a Reforma A. Guineo 2ª sección s/n, Villahermosa 86280, Tabasco, México. * Corresponding author. E-mail: mcarranza@ecosur.mx
2 Instituto Tecnológico Superior de los Ríos. Departamento Académico de Ingeniería Ambiental Km. 3 Carretera Balancán-Villahermosa, Balancán, Tabasco, México.
Received March 2012,
received in revised form December 2012,
accepted December 2012.
RESUMEN
El objetivo de este trabajo fue analizar el papel que juegan los machos de bagre bandera, Bagre marinus, en el proceso reproductivo. Los machos de B. marinus analizados provinieron de 12 muestreos mensuales obtenidos de la flota palangrera de pequeña escala del puerto de San Pedro, Tabasco (México), y de un muestreo puntual de la pesca clandestina con redes de cerco sobre cardúmenes reproductivos en la desembocadura del río Grijalva. El pico del proceso reproductivo de B. marinus (de julio a agosto) estuvo indicado por los altos valores del índice gonadosomático en junio (0.16 ± 0.04, IC 95%), julio (0.31 ± 0.03) y agosto (0.19 ± 0.02), por las altas frecuencias del estadio de madurez gonádica avanzado en julio (48%) y agosto (45%) y por la presencia de cardúmenes de machos incubadores en la desembocadura del río Grijalva de junio a agosto. Los huevos incubados por los machos de B. marinus midieron de 1.4 a 1.9 cm de diámetro, siendo 1.9 cm el tamaño más frecuente (64.8%). Los machos incubadores capturados midieron entre 36.2 y 44.0 cm de longitud total y pudieron acarrear entre 17 y 40 huevos de 1.9 cm de diámetro. La táctica reproductiva de incubación oral en esta especie incrementa la supervivencia de los pequeños juveniles en el medio marino-estuarino; sin embargo, esta táctica ha hecho que los machos incubadores sean más susceptible a los efectos de la pesca, especialmente a la pesca con redes de cerco que se extiende durante todo el periodo reproductivo, produciendo una elevada mortandad de machos incubadores y la consecuente muerte de huevos y juveniles.
Palabras clave: estrategia reproductiva, incubación oral, estuario, pesca artesanal.
ABSTRACT
The objective of this research was to analyze the role of male gafftopsail catfish, Bagre marinus, in the reproductive process. Twelve monthly samples of male B. marinus were obtained from the small-scale longline fleet operating out of the port of San Pedro in Tabasco, Mexico. Mouthbrooding males were also obtained from the illegal purse seine fishery targeting shoals of B. marinus at the mouth of the Grijalva River. Maximum reproductive activity in B. marinus (July to August) was evinced by the high gonadosomatic index values in June (0.16 ± 0.04, CI 95%), July (0.31 ± 0.03), and August (0.19 ± 0.02), by the high frequency of mature males (more than 40%) caught by the bottom-longline fleet between June and August, and by the presence of shoals of mouthbrooding males at the mouth of the Grijalva River from June to August. The eggs incubated by male B. marinus ranged from 1.4 to 1.9 cm in diameter, 1.9 cm being the most frequent (64.8%). Mouthbrooding males ranged from 36.2 to 44.0 cm total length and could carry from 17 to 40 eggs of 1.9 cm diameter. The reproductive strategy of mouthbrooding gives B. marinus survival advantages in a marine-estuarine environment; however, this strategy also represents a severe risk because shoals of mouthbrooding males are traceable by fishermen, resulting in high mortalities and, consequently, a high loss of eggs and embryos.
Key words: reproductive strategy, mouthbrooding, estuary, artisanal fisheries.
INTRODUCCIÓN
La zona sur del golfo de México alberga zonas estuarinas importantes. Estas zonas, junto con el banco de Campeche, proporcionan características idóneas para el sostenimiento de una alta diversidad biológica y son importantes zonas de crecimiento, alimentación y reproducción de una alta diversidad de especies de importancia comercial (Lara-Lara et al. 2008). En particular, la zona costera de Tabasco (México), dominada por el sistema deltaico Grijalva-Usumacinta, presenta características que permiten una alta abundancia de recursos pesqueros, dentro de los cuales destaca por su abundancia el bagre bandera, Bagre marinus (Mitchill 1815). Esta especie es el objetivo de dos pesquerías importantes: la pesca costera multiespecífica a pequeña escala realizada con palangre de fondo, durante todo el año, y la pesca clandestina con redes de cerco durante su época reproductiva (junio a agosto). Bagre marinus es pieza clave de la economía pesquera del estado de Tabasco, pues aporta el 44% de la producción total estatal; por tanto, es necesario proporcionar los conocimientos biológicos y ecológicos para su uso sustentable (Mendoza-Carranza y Hernández-Franyutti 2005, CONAPESCA 2010). La mayoría de estudios y estrategias de conservación pesquera se centran en el aporte que tienen las hembras, pues usualmente juegan el rol principal en el proceso reproductivo (Trippel 2003). Sin embargo, dentro de la familia Ariidae, los machos juegan un rol fundamental dentro del proceso reproductivo, pues se encargan del cuidado de huevos fecundados y crías hasta la absorción completa del saco vitelino a través de la incubación oral (Gomes y Araújo 2004). Es por esto que resulta de gran importancia incluirlos en los estudios del potencial reproductivo de la especie, así como en los esquemas de conservación (Mendoza-Carranza y Hernández-Franyutti 2005).
En las últimas dos décadas, B. marinus ha sido la especie más abundante en las capturas de la flota pesquera de pequeña escala de Tabasco y es capturada durante todo el año (Mendoza-Carranza et al. 2012). Además, los machos incubadores son capturados con redes de cerco entre junio y septiembre, durante el periodo de incubación orofaríngea (Palazón et al. 1994, Mendoza-Carranza 2003, Acero et al. 2005). A pesar de la elevada importancia económica de B. marinus y del sobresaliente rol que juegan los machos en el sostenimiento de la especie, no hay estudios específicos. El objetivo de este trabajo fue evaluar la importancia que tienen los machos de B. marinus en el proceso reproductivo. Se analizaron los individuos provenientes de dos tipos de pesca (palangre de fondo en la zona marina y redes de cerco en la zona estuarina) y se discuten los posibles efectos de la pesca sobre el rol de los machos en el proceso reproductivo.
MATERIALES Y MÉTODOS
El área de pesca se delimitó con un GPS durante un recorrido por el perímetro del área cubierta por los pescadores. El área de pesca de la flota palangrera de pequeña escala de los puertos de San Pedro y Frontera se extiende aproximadamente 70 km a lo largo de la costa de los municipios de Centla (Tabasco) y Carmen (Campeche) (polígono, fig. 1). La parte sur del polígono se encuentra delimitada por la isobata de los 10 m y la parte norte por la isobata de los 38 m aproximadamente a 48 km de la costa. El área total de pesca comprende 3058 km2 sobre el banco de Campeche (fig. 1). En esta área la especie es capturada durante todo el año con palangre de fondo.
Se recolectaron datos biológicos y morfométricos de 537 individuos de B. marinus, de los cuales 193 fueron machos, provenientes de muestreos mensuales (enero a diciembre de 2004) de la flota marina de pequeña escala del puerto de San Pedro, Centla, Tabasco. Para cada individuo, se determinó el sexo, peso total (PT, g) y longitud total (LT, cm). Las etapas macroscópicas de madurez gonádica de los machos de
B. marinus se clasificaron según la escala de madurez para desovantes totales propuesta por Vazzoler (1996) y se identificaron con base en las siguientes características de la gónada: color, longitud (cm), peso (g), turgencia, vascularización, presencia de crestas en la periferia y líquido seminal.
Se analizó la distribución de frecuencias de tallas (LT) de los machos capturados por la flota palangrera. Se calculó la relación entre LT y PT mediante la ecuación potencial

donde a es el intercepto y b es el coeficiente de crecimiento. La regresión y el intervalo de confianza de la regresión se calcularon por medio del análisis interactivo de regresión líneal basado en el algoritmo de Levenberg-Marquardt. Para probar si b era diferente de 3, se realizó la prueba t de Student (Sokal y Rohlf, 1995). El índice gonadosomático (IGS) mensual se calculó con la fórmula

donde PG es el peso del testículo. El factor de condición (K) mensual se calculó con la fórmula

donde b es el coeficiente obtenido de la regresión LT-PT (Froese 2006).
Para el cálculo de la capacidad de incubación oral, se recolectaron 13 bagres machos incubadores durante un muestreo de un día en septiembre de 2007 en la desembocadura del río Grijalva (18º36'52'' N, 92º41'35'' W y 18º36'10'' N 92º41'55'' W). Debido a que la pesca de estos individuos es clandestina, no fue posible obtener una muestra de mayor tamaño. Se contó el número total de huevos encontrados en la cavidad oral de cada macho. Adicionalmente, se midieron el diámetro (cm) de cada huevo y la LT de cada macho. Se determinó la madurez gonádica; las gónadas se pesaron con una balanza electrónica (0.01 g de precisión). La transparencia, la temperatura, la salinidad, el oxígeno disuelto, la conductividad y el pH del agua se obtuvieron al inicio y al final del muestreo.
El estrés generado en los machos por el proceso de captura los induce a liberar parte o todos los huevos que incuban; por tanto, el conteo directo de los huevos es poco confiable para estimar la capacidad de carga de huevos que pueden incubar. Para estimar la capacidad de carga de huevos con relación a la talla de los machos, se supusó que la elipse tridimensional (volumen = 4/3 πabc) es el cuerpo geométrico que más se acerca a la forma de la cavidad orofaríngea de B. marinus (fig. 2). La profundidad (a), la altura (b) y el ancho (c) de la cavidad orofaríngea se midieron con un vernier para obtener el volumen (VCO, cm3) (fig. 2). Cabe mencionar que durante el proceso de incubación, la región hioidea se distiende para dar una mayor capacidad de acarreo (Burns y Ramírez 1990, Palazón et al. 1994). Se calculó el volumen (V, cm3) de cada huevo:

donde R es el radio del huevo (cm).

La relación morfométrica entre el tamaño de los machos incubadores y el volumen de la cavidad orofaríngea (LTVCO) se determinó mediante una regresión lineal. El número teórico de huevos de determinado tamaño que un macho puede acarrear se determinó por el producto de VCO entre V. Para determinar la temporada de avistamiento de cardúmenes de machos incubadores de B. marinus, se realizaron encuestas informales a 3 permisionarios y 15 pescadores de la Barra Bosque.
RESULTADOS
La longitud mínima de los machos de B. marinus capturados por la flota palangrera fue de 31 cm LT y la máxima fue de 60 cm LT. La distribución de frecuencias de tallas de los machos fue polimodal, con dos modas aisladas a los 35 y 49 cm LT (4.1% y 3.9%, respectivamente), y el intervalo de tallas con la mayor frecuencia fue de 37 a 43 cm LT (63.70%, fig. 3). El promedio de tallas capturadas fue 43.58 ± 0.73 cm, intervalo de confianza (IC) de 95%. El valor del exponente b (3.22 ± 0.90, IC 95%) de la regresión LT-PT indicó que los machos de B. marinus tienen un crecimiento alométrico positivo (fig. 4), siendo este valor significativamente diferente de 3 (t = 61.37, P < 0.001).


Con base en los datos morfométricos de los testículos de los machos de B. marinus obtenidos de las capturas de la flota palangrera de pequeña escala, se clasificaron tres estadios de madurez. En el estadio I (en maduración), los testículos son filiformes, de coloración rosácea blanquecina y traslúcidos; la longitud de los testículos varió de 4.8 a 9.2 cm y el peso de 0.1 a 2.7 g. El estadio I se presentó en todos los meses de muestreo; las mayores frecuencias de ocurrencia se presentaron en enero (83%), abril (67%), agosto (60%) y septiembre (62%), y el resto de los meses oscilaron entre 10% (octubre) y 43% (julio) (fig. 5). En el estadio II (maduro), los testículos son delgados, de coloración blanquecina, tienen crestas en su periferia y presentan expulsión de semen a una ligera presión; la longitud de los testículos varió de 2.9 a 9.8 cm y el peso de 0.1 a 3.4 g. Las mayores frecuencias de ocurrencia se observaron en febrero (44%) y de mayo a agosto (valores mayores que 34%) (fig. 5). En el estadio III (en recuperación), los testículos están reducidos a dos filamentos, su vascularización es abundante, dándoles una coloración roja intensa, y las crestas han desaparecido. El estadio III fue observado con mayor frecuencia de octubre (81%) a diciembre (61%) (fig. 5).

El IGS mostró un aumento pronunciado en junio (0.16 ± 0.04, IC 95%), julio (0.31 ± 0.03, IC 95%) y agosto (0.19 ± 0.02, CI 95%), lo que indica el periodo reproductivo de la especie (fig. 6). El factor de condición (K) mostró una tendencia aproximadamente inversa, con valores bajos de mayo a octubre y los valores más altos en marzo (0.031 ± 0.003) y diciembre (0.029 ± 0.002) (fig. 6).

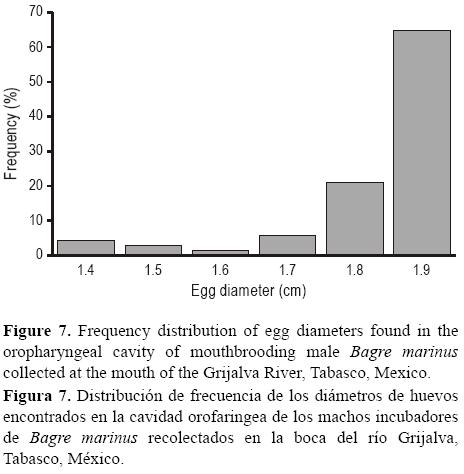
El intervalo de tallas de los machos incubadores fue de 36 a 45 cm LT, con un promedio de 39.9 ± 1.54 cm LT (IC 95%). Los machos recolectados estaban en estadio de madurez sexual II (peso medio de las gónadas = 0.83 ± 0.15 g, IC 95%). De los 13 machos incubadores, diez ejemplares tuvieron de 1 a 15 huevos en la cavidad oral (72 huevos en total), un ejemplar acarreaba dos juveniles pequeños (8.0 y 8.1 cm LT) y dos ejemplares no contenían ni huevos ni juveniles. El diámetro de los huevos que estaban siendo incubados osciló de 1.4 cm (V = 1.43 cm3) a 1.9 cm (V = 3.59 cm3). El diámetro más frecuente fue de 1.9 cm (64.8% del total) seguido del de 1.8 cm (21.1%, fig. 7). El 97% de los huevos presentaron embriones en estadios tempranos de desarrollo.
La relación LT-VCO de los individuos analizados fue la siguiente: VCO = (10.80 × LT) – 330.11 (r2 = 0.90, n = 13; fig. 8). Las rectas que explican la relación entre la LT y el número de huevos de determinado tamaño que un macho puede acarrear fueron generadas usando las siguientes ecuaciones: número de huevos(1.9 cm) = (3.00 × LT) – 91.91, número de huevos(1.8 cm) = (3.53 × LT) – 108.10 y número de huevos(1.4 cm) = (7.52 × LT) – 229.76 (fig. 9). El VCO (incluyendo la distensión de la región hioidea) mínimo fue de 48.3 cm3 y correspondió a un individuo de 36.2 cm LT, pudiendo acarrear hasta 17 huevos de 1.9 cm de diámetro; el VCO máximo fue de 154.19 cm3 y correspondió a un individuo de 44 cm LT, pudiendo acarrear hasta 40 huevos de 1.9 cm de diámetro (fig. 9).


Durante el muestreo de los machos incubadores, los parametros del agua presentaron las siguientes mediciones: temperatura, 29 °C; oxígeno disuelto, 4.33 ± 0.94 mg L–1; pH, 8.43 ± 0.04; conductividad, 48.69 ± 0.35 mS cm–1; salinidad, 32; y transparencia, 10.7 ± 1.2 cm. Los 3 permisionarios y 14 pescadores entrevistados coincidieron en que la temporada de avistamiento de los cardúmenes de machos incubadores inicia entre a fines de junio e inicios de julio y termina entre agosto y septiembre, y que esto ha sido constante desde al menos 1995.
DISCUSIÓN
Una de las principales características de B. marinus que se observó en este estudio es la constancia y persistencia temporal y espacial de sus procesos reproductivos. Esta constancia en las fechas del evento reproductivo también ha sido registrada para otras especies de áridos del Atlántico centro occidental como Ariopsis felis (Gunter 1947, Yáñez-Arancibia y Lara-Domínguez 1988), Cathorops spixii (Fávaro et al. 2005), C. melanopus (Yáñez-Arancibia y Lara-Domínguez 1988), Ariopsis guatemalensis (Burns y Ramírez 1990), Genidens barbus (Reis 1986), G. genidens (Gomes y Araújo 2004), Pseudoplatystoma fasciatum (Reyes y Fazlul 1990), Aspitor luniscutis (Gomes y Araújo 2004), Sciades herzbergii (Chacón et al. 1994). En general, la época de reproducción de casi todas estas especies coincide con el periodo de altas temperaturas y la temporada de lluvias, y se extiende por periodos de dos hasta seis meses.
El proceso reproductivo de los individuos de B. marinus capturados por la flota marina de pequeña escala está reflejado por la disminución de machos durante septiembre y octubre, y los machos que son capturados tienen muy poco alimento en el estómago o su estómago está vacío; a partir de octubre, el incremento progresivo en el índice de llenado estomacal puede atribuirse al reclutamiento de los machos que han finalizado el periodo de incubación oral (Mendoza-Carranza 2003). El desarrollo gonadal de los machos de B. marinus es paralelo al documentado para las hembras, las cuales tienen sus picos máximos de IGS de junio a agosto (Mendoza-Carranza 2003, Mendoza-Carranza y Hernández-Franyutti 2005). La coincidencia en los resultados del IGS del presente estudio y de aquellos previamente registrados indica una alta estabilidad en espacio y tiempo en el ciclo reproductivo de esta especie. La descripción de los estadios de madurez gonádica de los machos presentada en nuestro estudio complementa la información hasta ahora conocida para la especie. El desarrollo de los estadios de madurez a lo largo del año y el IGS de los machos capturados en la pesca con palangre de fondo en el oeste del banco de Campeche reflejan de forma clara la evolución anual del proceso reproductivo y su periodo de máxima actividad.
Esta especie se captura durante todo el año en el oeste de Campeche. Además, los cardúmenes de machos incubadores comienzan a ser avistados en las inmediaciones de la boca del río Grijalva durante y después de los picos de actividad reproductiva (junio–agosto) registrados para los organismos provenientes de la pesca con palagre de fondo. Estos cardúmenes tienen la particularidad de nadar en la superficie del agua, lo que los hace muy visibles y, por tanto, susceptibles a la pesca con redes de cerco.
Durante el periodo de incubación los huevos ocupan la cavidad orofaríngea de los machos y, como resultado, se presentan algunas modificaciones adaptativas antes de y durante este periodo, tales como la distención de la región hioidea para dar mayor capacidad de acarreo, el encogimiento del estómago y la acumulación de grasa en los mesenterios, que junto con los ovocitos no viables proporcionan las reservas alimenticias necesarias para sobrevivir (Palazón et al. 1994, Mendoza-Carranza 2003). Después de la eclosión, los embriones son acarreados durante varias semanas hasta la absorción completa del saco vitelino, y este proceso puede durar de dos a tres meses (Palazón et al. 1994, Mendoza-Carranza y Hernández-Franyutti 2005).
El cuidado parental está más desarrollado en peces tropicales pequeños tanto de agua dulce (e.g., cíclidos) como marinos (e.g., signatidos, góbidos), y la incubación es una táctica muy elaborada (Winemiller y Dailey 2002, Ortega-Salas y Reyes-Bustamante 2006). Sin embargo, por su talla corporal y el tamaño de sus huevos, B. marinus presenta una forma extrema de esta táctica (Winemiller y Rose 1992); de hecho, B. marinus y el bagre boca chica, Ariopsis felis, son las únicas dos especies marino-estuarinas de talla media que emplean esta táctica en la zona costera de Tabasco.
De acuerdo con la teoría triangular del ciclo de vida, B. marinus es una especie con una estrategia de vida que tiende al equilibrio. Se caracteriza por alcanzar un tamaño intermedio, producir un número reducido de huevos grandes, invertir una importante cantidad de energía en la incubación oral y presentar una alta supervivencia de su progenie (Winemiller y Rose 1992). Esta táctica ha permitido que esta especie aproveche de forma exitosa los cambios estacionales que se dan en la zona estuarina, la cual es fuertemente influida por los afluentes de la cuenca más importante del país, la Grijalva-Usumacinta (Mendoza-Carranza y Hernández-Franyutti 2005).
La ventaja que le proporciona esta táctica reproductiva a B. marinus le ha permitido sostener los mayores volúmenes de captura en la pesca de pequeña escala de la costa de Tabasco desde hace al menos dos décadas (SAGARPA 2010). A mediano y largo plazo, es posible que esta táctica sea insuficiente para compensar la alta mortalidad poblacional producto de la pesca que año tras año se realiza sobre los cardúmenes de machos incubadores y de la pesca con palangre realizada en toda la costa de Tabasco (Mendoza-Carranza et al. 2012). Esta práctica actúa sobre los individuos machos de mayores tallas y mayor potencial reproductivo (Coates 1988, Barbieri et al. 1992). Esto activa los mecanismos denso-dependientes generando presión sobre individuos de menores tallas para que maduren y cubran esta función (Venturelli et al. 2010). Con la perdida de machos reproductores, se pierden también grandes cantidades de huevos, lo cual representa un riesgo para que la especie mantenga sus niveles poblacionales óptimos (Chaves 1994, Lowerre-Barbieri et al. 2003).
A pesar del pequeño tamaño de muestra obtenido para estimar la relación entre LT y el número teórico de huevos que un macho podría incubar, nuestros resultados coinciden con otros trabajos previos. Con relación al tamaño de los huevos, Rimmer y Merrick (1982) documentaron que los huevos incubados por machos de B. marinus medían entre 1.5 y 2.5 cm de diámetro y que un macho usualmente podía portar entre 10 y 30 huevos. Kunz-Ramsay (2004) registró diámetros de entre 1.5 y 2.2 cm para los huevos de esta especie. Estos datos son muy cercanos a los diámetros registrados en el presente trabajo (1.4–1.9 cm). Asimismo, el intervalo de diámetros de huevos observados en machos incubadores es muy similar al intervalo (0.7–1.9 cm) observado para el lote de huevos de mayor tamaño y próximo a ser desovado en hembras maduras de B. marinus (Mendoza-Carranza y Hernández-Franyutti 2005). Tanto Mendoza-Carranza y Hernández Franyutti (2005) como Pinheiro et al. (2006) observaron una relación lineal positiva entre la talla de la hembra y el número de huevos próximos al desove. Los primeros autores registraron un mínimo de 28 huevos en una hembra de 35 cm LT y un máximo de 60 huevos en una hembra de 57 cm LT, y los últimos registraron un mínimo de 10 huevos en una hembra de 31 cm LT y un máximo de 33 huevos en una hembra de 45 cm LT.
Las bajas fecundidades y la estrategia del cuidado de las crías sugieren que el reclutamiento de las especies de bagre con cuidado parental es dependiente de la densidad y, por tanto, estas especies son muy vulnerables a la mortalidad por pesca (Coates 1988). Sin embargo, no fue posible observar este efecto para B. marinus debido al pequeño tamaño de muestra. Para poder hacer una estimación precisa del efecto de la pesca sobre la dinámica poblacional de B. marinus, es necesaria una cuantificación más precisa de los volúmenes de captura de machos durante el proceso de incubación oral y una estimación del tamaño de la población.
A pesar de la importancia de B. marinus, la Carta Nacional Pesquera (CONAPESCA 2010) sólo enuncia un periodo de veda de junio a agosto, pero no precisa el tipo de pesca (palangre o cerco), y recomienda no incrementar el esfuerzo pesquero.
Como conclusión, B. marinus presenta una táctica específicamente beneficiosa para incrementar la supervivencia de sus crías; la participación activa de los machos, por medio de la incubación oral, es fundamental en la protección de los huevos y las crías. El éxito de su estrategia reproductiva ha permitido que a lo largo del tiempo esta especie sea la más abundante en las capturas de la flota marina costera de pequeña escala de Tabasco (Mendoza-Carranza et al. 2012). Sin embargo, esta misma estrategia ha hecho que los cardúmenes de machos incubadores sean altamente susceptibles a la captura, lo cual es probable que a lo largo del tiempo haya incidido en las actuales caídas de sus tasas de captura (Mendoza-Carranza et al. 2012). Las medidas de manejo son urgentes, especialmente la prohibición absoluta de la pesca de cerco sobre los cardúmenes de machos incubadores.
AGRADECIMIENTOS
Agradecemos al Gobierno del Estado de Tabasco (SEDAFOP) por el apoyo financiero para la realización del proyecto, al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca otorgada al primer autor y a Juan Juárez y a los pescadores de San Pedro y la Barra Bosque (Centla, Tabasco) por su apoyo en la obtención de las muestras y experiencias compartidas.
REFERENCES
Acero PA, Betancur RR, Polanco AF, Chaparro N. 2005. Diferenciación sexual temprana a nivel óseo en dos géneros de bagres marinos (Pisces: Ariidae) del Caribe. Memoria de la Fundación La Salle de Ciencias Naturales 163: 19–25. [ Links ]
Barbieri RL, dos Santos PR, Andreata VJ. 1992. Reproductive biology of the marine catfish, Genidens genidens (Siluriformes, Ariidae), in the Jacarepaguá Lagoon system, Rio de Janeiro, Brazil. Environ. Biol. Fish. 35: 23–35. [ Links ]
Burns RJ, Ramirez AM. 1990. Annual pattern of reproduction of the bagre, Arius guatemalensis (Pisces: Ariidae), in El Salvador. Rev. Biol. Trop. 38: 487–490. [ Links ]
Chacón JO, Alves MIM, de Mesquita MSC. 1994. Alguns aspectos da reprodução do bagre branco, Selenaspsis herzbergii (Bloch 1794), Pisces: Ostariophysi, Siluriformes, Ariidae. Bol. Tec. DNOCS 47: 43–78. [ Links ]
Chaves P de TC. 1994. A incubação de ovos e larvas em Genidens genidens (Valenciennes) (Siluriformes, Ariidae) da baía de Guaratuba, Paraná, Brasil. Rev. Bras. Zool. 11: 641–648. [ Links ]
Coates D. 1988. Length-dependent changes in egg size in fecundity in females, and brooded embryo size in males of fork-tailed catfishes (Pisces: Ariidae) from the Sepik River, Papua New Guinea with some implications for stock assessments. J. Fish Biol. 33: 455–464. [ Links ]
CONAPESCA. 2010. Carta Nacional Pesquera, 2010. Comisión Nacional de Acuacultura y Pesca: http://www.inapesca.gob.mx/portal/documentos/cartaNacionalPesquera2010.pdf. Accessed June 2011. [ Links ]
Fávaro FL, Frehse AF, de Oliveira NR Jr., Swuarz R. 2005. Reprodução do bagre amarelo, Cathorops spixii (Agassiz) (Siluriformes, Ariidae), da Baía Pinheiros, região estuarina do litoral do Paraná, Brasil. Rev. Bras. Zool. 22: 1022–1029. [ Links ]
Froese R. 2006. Cube law, condition factor and weight-length relationships: History, meta-analysis and recommendations. J. Appl. Ichthyol. 22: 241–253. [ Links ]
Gomes ID, Araújo FG. 2004. Reproductive biology of two marine catfishes (Siluriformes, Ariidae) in the Sepetiba Bay, Brazil. Rev. Biol. Trop. 52: 143–156. [ Links ]
Gunter G. 1947. Observations on Breeding of the Marine Catfish, Galeichthys felis (Linnaeus). Copeia 4: 217–223. [ Links ]
Kunz-Ramsay Y. 2004. Developmental Biology of Teleost Fishes. Springer, 636 pp. [ Links ]
Lara-Lara JR, Arenas FV, Bazán GC, Díaz CV, Escobar BE, García AM de la C, Gaxiola CG, Robles JG, Sosa AR, Soto GLA, Tapia GM, Valdez-Holguín JE. 2008. Los ecosistemas marinos. In: CONABIO (eds.), Capital Natural de México. Vol. I: Conocimiento actual de la biodiversidad. México, pp. 135–159. [ Links ]
Lowerre-Barbieri SK, Vose FE, Whittington JA. 2003. Catch-and release fishing on a spawning aggregation of common snook: Does it affect reproductive output. Trans. Am. Fish. Soc. 132: 940–952. [ Links ]
Mendoza-Carranza M. 2003. The feeding habits of gafftopsail catfish Bagre marinus (Ariidae) in Paraiso Coast, Tabasco, Mexico. Hidrobiológica 13: 119–126. [ Links ]
Mendoza-Carranza M, Hernández-Franyutti A. 2005. Annual reproductive cycle of gafftopsail catfish, Bagre marinus (Ariidae), in a tropical coastal environment in the Gulf of Mexico. Hidrobiológica 15: 275–282. [ Links ]
Mendoza-Carranza M, Romero-Rodríguez A, Segura-Berttolini E, Ramírez-Mosqueda E, Arévalo-Frías W. 2012. El bagre bandera Bagre marinus como especie clave de la pesca marina de pequeña escala en la costa de Tabasco. In: Sánchez AJ, Chiappa-Carrara X, Pérez B (eds.), Recursos Acuáticos Costeros del Sureste: Tendencias actuales en investigación y estado del arte. RECORECOS, CONCYTEY, UNACAR, UJAT, ECOSUR, UNAM., pp. 527–547. [ Links ]
Ortega-Salas AA, Reyes-Bustamante H. 2006. Fecundity, survival,and growth of the seahorse Hippocampus ingens (Pisces: Syngathidae) under semi-controlled conditions. Rev. Biol. Trop. 54: 1099–1102. [ Links ]
Palazón FJL, León RJ, Gómez FE, Bolaños J. 1994. Reproducción del bagre cacumo, Bagre marinus (Mitchil 1815) (Pices:Ariidae), de la costa sur de Margarita, Venezuela. Bol. Inst. Oceanogr. Venezuela 33: 19–27. [ Links ]
Pinheiro P, Broadhurst MK, Hazin FHV, Bezerra T, Hamilton S. 2006. Reproduction in Bagre marinus (Ariidae) off Pernambuco, northeastern Brazil. J. Appl. Ichthyol. 22: 189–192. [ Links ]
Reis EG. 1986. Reproduction and feeding habits of the marine catfish Netuma barba (Siluriformes, Ariidae) in the estuary of Lagoa dos Patos, Brazil. Atlântica 8: 35–55. [ Links ]
Reyes AO, Fazlul MH. 1990. Algunos aspectos reproductivos delbagre rayado, Pseudoplatystoma fasciatum Linnaeus, 1776 (Pisces: Pimelodidae) en la Laguna Grande, Maturin, Venezuela. Bol. Inst. Oceanogr. Venezuela 29: 133–140. [ Links ]
Rimmer MA. Merrick. 1982. A review of reproduction anddevelopment in the fork-tailed catfishes (Ariidae). Proc. Linn.Soc. N.S.W. 107: 41–50. [ Links ]
SAGARPA. 2010. Anuario Estadístico de Acuacultura y Pesca 2010. Secretaría de Agricultura, Ganadería y Desarrollo Rural, Pesca y Alimentación, Comisión Nacional de Acuacultura y Pesca, Mazatlán, 285 pp., www.conapesca.sagarpa.gob.mx/wb/cona/cona_anuario_estadistico_de_pesca. Accessed June 2011. [ Links ]
Sokal RR, Rohlf FJ. 1995. Biometry: The principles and practice ofstatistics in biological research. WH Freeman, New York, 887 pp. [ Links ]
Trippel EA. 2003. Estimation of male reproductive success of marine fishes. J. Northwest Atl. Fish. Soc. 33: 81–113. [ Links ]
Vazzoler AEA de M. 1996. Biologia da Reprodução de Peixes Teleósteos: Teoria e prática. EDUEM, São Paulo, SBI, 169 pp. [ Links ]
Venturelli PA, Murphy CA, Shuter BJ, Johnson TA, van Coeverdende Groot PA, Boag PT, Casselman JM, Montgomerie RM, Weigand MD, Leggett WC. 2010. Maternal influences onpopulation dynamics: Evidence from an exploited freshwaterfish. Ecology 91: 2003–2012. [ Links ]
Winemiller KO, Rose KA. 1992. Patterns of life-history diversification in North American fishes: Implications for population regulation. Can. J. Fish. Aquat. Sci. 49: 2196–2218. http://dx.doi.org/10.1139/f92-242. [ Links ]
Winemiller KO, Dailey WH. 2002. Life history strategies and population regulation: Theory predicts consequences for supplemental stocking of tarpon. Contrib. Mar. Sci. 35: 81–94. [ Links ]
Yáñez-Arancibia A, Lara-Domínguez AL. 1988. Ecology of three sea catfishes (Ariidae) in a tropical coastal ecosystem-southern Gulf of Mexico. Mar. Ecol. Prog. Ser. 49: 215–230. [ Links ]














