Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.4 Ensenada dic. 2012
https://doi.org/10.7773/cm.v38i4.2077
Diferencias en la diversidad, estructura y variabilidad de la comunidad meiofaunal entre el medio intermareal y el submareal
Differences in diversity, structure, and variability between intertidal and subtidal meiofaunal assemblages
R Riera1*, J Núñez2, MC Brito2, F Tuya3
1 Centro de Investigaciones Medioambientales del Atlántico (CIMA SL), Arzobispo Elías Yanes 44, 38206 La Laguna, Tenerife, Islas Canarias, España. * Corresponding author. E-mail: rodrigo@cimacanarias.com
2 Laboratorio de Bentos, Departamento de Biología Animal, Universidad de La Laguna, 38206 La Laguna, Tenerife, Islas Canarias, España.
3 BIOGES, Universidad de Las Palmas de Gran Canaria, 35017 Las Palmas, Islas Canarias, España.
Received October 2010,
received in revised form October 2011,
accepted November 2012.
RESUMEN
Se estudiaron las comunidades meiofaunales que habitan el medio intermareal y submareal somero adyacente en dos sitios (uno dominado por arenas terrígenas de origen volcánico y otro por arenas organógenas) de la isla de Tenerife (islas Canarias, NE del océano Atlántico) a lo largo de un año (mayo de 2000-abril de 2001). Específicamente, nos propusimos (i) evaluar las diferencias en la diversidad, estructura y estabilidad de la comunidad meiofaunal entre los estratos inter y submareales, y (ii) determinar si las diferencias en la estructura de la comunidad meiofaunal pueden ser explicadas por factores ambientales (composición granulométrica, disponibilidad de materia orgánica y contenido en carbonatos del sedimento). Se recolectó un total de 103,763 individuos meiofaunales pertenecientes a 203 especies y 19 grandes grupos taxonómicos (Acari, Amphipoda, Cnidaria, Copepoda, Echinodermata, Gastrotricha, Isopoda, Insecta, Kinorrhyncha, Misidacea, Nematoda, Nemertini, Oligochaeta, Ostracoda, Polychaeta, Priapulida, Sipuncula, Tanaidacea y Turbellaria). Los nematodos fueron el grupo más abundante. La diversidad de especies fue mayor en el medio submareal en relación con el intermareal para ambos sitios, como resultado de la dominancia de unas pocas especies en el estrato intermareal. La estructura de la comunidad meiofaunal fue distinta entre sitios y estratos, presentando el medio intermareal una mayor variabilidad temporal (dispersión multivariante) en la estructura de la comunidad meiofaunal en comparación con el medio submareal. La granulometría del sedimento, tipificado por las cantidades de las distintas fracciones granulométricas, contribuyó significativamente a explicar la variabilidad en la estructura meiofaunal, por encima del contenido en carbonatos de los sedimentos, variable ligada a la distinta naturaleza de cada sitio. En conclusión, este estudio ha mostrado diferencias en la diversidad, estructura y variabilidad de la comunidad meiofaunal entre los sistemas inter y submareales.
Palabras clave: meiofauna, intermareal, submareal, granulometría, islas Canarias.
ABSTRACT
Meiofaunal assemblages from intertidal and shallow subtidal seabeds were studied at two sites (one dominated by volcanic sands and the other by organogenic sands) at Tenerife (Canary Islands, NE Atlantic Ocean) throughout an entire year (May 2000-April 2001). Specifically, we aimed (i) to test for differences in diversity, structure, and stability between intertidal and subtidal meiofaunal assemblages, and (ii) to determine if differences in the meiofaunal assemblage structure may be explained by environmental factors (granulometric composition, availability of organic matter, and carbonate content in sediments). A total of 103,763 meiofaunal individuals were collected, including 203 species from 19 taxonomic groups (Acari, Amphipoda, Cnidaria, Copepoda, Echinodermata, Gastrotricha, Isopoda, Insecta, Kinorrhyncha, Misidacea, Nematoda, Nemertini, Oligochaeta, Ostracoda, Polychaeta, Priapulida, Sipuncula, Tanaidacea, and Turbellaria). Nematodes were the most abundant taxonomic group. Species diversity was higher in the subtidal than in the intertidal zone at both sites, as a result of the larger dominance of a few species in the intertidal zone. The meiofaunal assemblage structure was different between tidal levels at both sites, the intertidal presenting greater temporal variability (multivariate dispersion) in the meiofaunal assemblage structure than the subtidal. Sediment grain size, here quantified by the different granulometric fractions, explained the variability in meiofaunal assemblage structure to a greater extent than the percentage of carbonates, a variable linked to sediment origin. This study revealed differences in diversity, assemblage structure, and variability between intertidal and subtidal meiofauna.
Key words: meiofauna, intertidal, subtidal, granulometric composition, Canary Islands.
Introducción
Los sustratos arenosos marinos se caracterizan por la presencia, a primera vista, de pocos seres vivos macroscópicos, la mayoría de los organismos habitando en los espacios que existen entre los granos de sedimento. Estas comunidades infaunales están integradas por dos componentes, macrofaunal y meiofaunal, que se encuentran relacionados mediante redes tróficas complejas. Por ejemplo, la meiofauna constituye una fuente de alimento para muchas especies de la macrofauna bentónica, como los peces (Gee 1989). Los organismos meiofaunales se caracterizan por presentar tallas pequeñas, distribución espacial de tipo contagiosa, abundancias y diversidades altas, ciclos de vida cortos y desarrollo larvario directo sin fase pelágica (Higgins y Thiel 1988).
El hábitat intermareal es, por regla general, sometido a grandes fluctuaciones ambientales (Raffaelli y Hawkins 1996). Por ejemplo, perturbaciones asociadas a eventos naturales como el oleaje y la escorrentía pueden tener máxima intensidad en el medio intermareal en relación con el medio submareal adyacente, donde el incremento de la profundidad suaviza la intensidad y variabilidad de estas perturbaciones (Short 1999). Los factores hidrodinámicos que más afectan a las comunidades submareales son las corrientes y el oleaje (Gray y Elliott 2009). Este hecho permite que las comunidades biológicas sean hipotéticamente más diversas y estables al aumentar la profundidad (Garrabou et al. 2002). Si bien existe suficiente evidencia que demuestra un incremento en biodiversidad al aumentar la profundidad para comunidades macrofaunales de fondos duros (Andres y Witman 1995, Witman y Grange 1998), existen pocos estudios realizados en fondos arenosos sobre los patrones de zonación de las comunidades infaunales, incluyendo sus componentes macro y meiofaunales, desde el medio intermareal hasta el submareal (McLachlan y Brown 2006). La diversidad y abundancia macrofaunal aumentan desde el eulitoral superior hacia el submareal, con una discontinuidad puntual en el rompiente de la ola, donde prácticamente desaparecen (Reise 1985, Brown y McLachlan 1990, Veloso y Cardoso 2001). No obstante, varios autores han observado que la meiofauna presenta un patrón diferente, con una disminución en la riqueza y abundancia en el medio submareal en comparación con el intermareal (McIntyre y Murison 1973, McLachlan 1977, Reise 1985, Brown y McLachlan 1990). El mayor efecto de la fuerza hidrodinámica es sobre la composición granulométrica del sedimento porque provoca suspensión y desplazamiento del mismo, y esto afecta directamente a la composición de la comunidad meiofaunal porque el grado de estabilidad sedimentaria determina que se asienten unas especies intersticiales u otras (Gray y Elliott 2009).
Otros factores ambientales determinantes para la supervivencia de la meiofauna en los intersticios son el porcentaje de saturación del oxígeno intersticial y el grado de deshidratación del sedimento (McLachlan y Jaramillo 1995). Aquellos organismos expuestos a hipoxia y deshidratación tienen que recurrir al metabolismo anaeróbico, que es ineficiente en la producción de energía y, por tanto, sólo destina recursos para el mantenimiento energético y no para el crecimiento celular (Shin et al. 2005). Factores como el oleaje afectan en menor grado a la estructura de la comunidad meiofaunal (Mann 2000), debido a que estos organismos suelen vivir en las capas inferiores a la superficie del sedimento (Armonies y Reise 2000).
En este trabajo se comparan las comunidades meiofauna-les entre dos estratos diferentes (intermareal y submareal somero) en localidades de la isla de Tenerife (Canarias, océano Atlántico) caracterizadas por presentar fracciones granulométricas (arenas finas y arenas medias) y orígenes (organógeno y volcánico) diferentes. Específicamente, nos propusimos evaluar las diferencias en la diversidad, estructura y estabilidad de la comunidad meiofaunal entre los estratos inter y submareales. Nuestra hipótesis es que el medio submareal presenta una mayor estabilidad y diversidad para la comunidad meiofaunal. Adicionalmente, determinamos si las diferencias en la estructura de la comunidad meiofaunal entre estratos se pueden explicar mediante diferencias en la granulometría y composición del sedimento.
Materiales y métodos
Área de estudio
Este estudio se desarrolló en las playas de Los Abrigos (SE de Tenerife) y Los Cristianos (SO de Tenerife) (fig. 1), ambas con un origen sedimentario diferente. Los Abrigos se encuentra situada en el interior de una pequeña bahía, protegida de las corrientes dominantes, y está conformada por arenas de origen volcánico. En este lugar no existen desembocaduras de barrancos que afecten directamente a la zona de estudio. Esta playa tiene una longitud de unos 150 m y una anchura máxima de 30 m. Los Cristianos se encuentra en el interior de una bahía, en la cual desemboca el barranco de Aquilino. Esta playa se caracteriza por arenas organógenas de origen sedimentario, y tiene una longitud de 400 m y una anchura máxima de 200 m.
Trabajo de campo
En los dos sitios (playas) se recogieron muestras de sedimento. Se introdujo en el sustrato un cilindro de PVC (4.5 cm de diámetro interno y 40 cm de longitud) hasta los 30 cm de profundidad. Se recogieron seis muestras, cinco destinadas al estudio faunístico y una al análisis del sedimento, en cada uno de los dos estratos (intermareal y submareal) de cada sitio. Este tamaño muestral (meiofauna y factores sedimentarios) se ha utilizado con éxito para caracterizar las comunidades meiofaunales del medio intermareal (Riera et al. 2011) y el submareal del archipiélago Canario (Brito et al. 2005). En el estrato intermareal, las muestras fueron recolectadas durante el periodo de bajamar al nivel del eulitoral inferior, que se considera la zona más rica a nivel de abundancia de especies en las playas arenosas (Gheskiere et al. 2005), mientras que en el submareal, las muestras se obtuvieron a 3 m de profundidad. Las muestras fueron recolectadas de forma aleatoria con una distancia de separación entre ellas de aproximadamente 1 m. Una vez en tierra, las muestras se almacenaron en frascos herméticos y se fijaron con formaldehido al 4% neutralizado con agua de mar. Este protocolo se repitió de forma mensual a lo largo de 12 meses (mayo de 2000 a abril de 2001).
Análisis de las variables del sedimento
Los análisis granulométricos se realizaron a partir de muestras de aproximadamente 100 g. Estas muestras se secaron a temperatura ambiente y luego se pasaron de forma manual por una columna de seis tamices metálicos, cuya luz de malla sigue la escala de Wentworth (Buchanan 1984), para obtener gravimétricamente las siguientes fracciones sedimentarias: gravas (> 2 mm), arenas muy gruesas (1-2 mm), arenas gruesas (0.50-1.0 mm), arenas medias (0.50-0.25 mm), arenas finas (0.250-0.125 mm), arenas muy finas (0.125-0.062 mm) y fangos (< 0.062 mm). El contenido de la materia orgánica en el sedimento se determinó por valoración del carbono orgánico oxidable (Walkley y Black 1934), que consiste en la oxidación de todos los compuestos orgánicos con dicromato potásico en presencia de ácido sulfúrico. La determinación de carbonatos en el sedimento se realizó con ácido en un dispositivo cerrado (calcímetro de Bernard), a presión y temperatura constante. El incremento de volumen de la muestra se mide directamente a partir del CO2 desprendido (Allison y Moodie 1965). La concentración de nitrógeno total se determinó por el método de Kjeldahl (Bradstreet 1965).
Análisis de meiofauna (0.063-0.500 mm)
El proceso de lavado y triado del sedimento se realizó utilizando cubetas de plástico. Se vertió agua corriente sobre la muestra hasta dos tercios de la capacidad de la cubeta y, a continuación, se agitó para poner en suspensión las partículas más ligeras del sedimento y la fauna. Este proceso de lavado se repitió cinco veces para cada una de las muestras, considerado suficiente para obtener el 90-95% de los ejemplares (Ólafsson 1991). Posteriormente, el líquido resultante se pasó por un tamiz de filtrado (63 de luz de malla), utilizado en estudios de fauna intersticial (Somerfield y Warwick 1996). El contenido se transfirió a placas de Petri para su observación bajo una lupa binocular, separando con pinzas los ejemplares de los diferentes grupos faunísticos. Para la identificación de la meiofauna se utilizó un microscopio, dotado con un sistema interferencial tipo Nomarski, que permite una óptima observación de detalles. Todos los individuos fueron identificados hasta el nivel taxonómico más bajo posible con la ayuda de bibliografía científica actual de cada uno de los grupos taxonómicos. De cada muestra se obtuvo una submuestra de 200 nematodos (Somerfield y Warwick 1996) para su determinación específica. Las abundancias meiofaunales fueron expresadas como número de individuos por 10 cm2.
Tratamiento estadístico
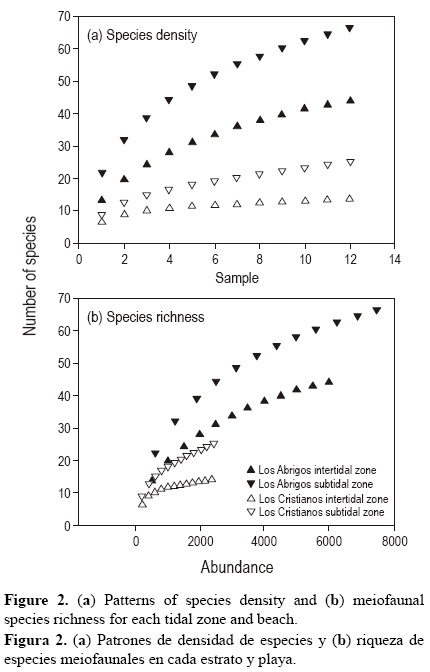
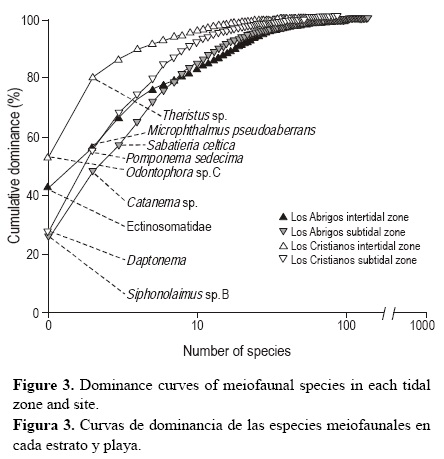
Se obtuvieron curvas de dominancia para cada estrato y sitio, de cara a describir el número de especies dominantes y su grado de influencia sobre la composición de la comunidad meiofaunal (Lambshead et al. 1983). Se utilizaron curvas de rarefacción para comparar los patrones de densidad y riqueza de especies, elementos cuya interpretación complementaria permite explicar patrones de diversidad (Gotelli y Colwell 2001) entre los estratos y sitios, usando la totalidad de las muestras recolectadas a lo largo del periodo de estudio (mayo de 2000 a abril de 2001); esto se realizó con el programa EstimateS 7.5 (Colwell 2006).
Se empleó un análisis de escalamiento multidimensional no métrico (nm-MDS, por sus siglas en inglés) para visualizar las similitudes en la estructura de la comunidad meiofau-nal entre los dos estratos y sitios a lo largo del periodo de estudio. El análisis de similitudes (ANOSIM) no paramétrico se utilizó para contrastar las diferencias en la estructura de la comunidad meiofaunal entre sitios y estratos, agrupando todos los datos a lo largo del estudio. Se empleó un análisis permutacional de dispersión multivariante (PERMDISP, Anderson 2006) para conocer las diferencias en la variabilidad (dispersión) multivariante en la estructura de la comunidad meiofaunal, por una parte, y en las condiciones ambientales, por otra parte, entre los estratos y sitios de estudio. Con el fin de conocer la influencia de las variables ambientales del sedimento sobre la estructura de la comunidad meiofaunal, se ejecutó un análisis de redundancia (RDA) basado en distancia, que se acompañó de un análisis de regresión multivariante múltiple (DISTLM, Anderson 2006) para determinar las variables ambientales que mejor explicaron la variabilidad encontrada. Se utilizó la rutina del criterio de información de Akaike (AIC) como criterio de selección debido a la colinealidad entre variables predictoras (Legendre y Anderson 1999). Todos los análisis multivariantes se basaron en disimilitudes de Bray-Curtis sobre datos trasformados a raíz cuadrada para disminuir la influencia de las especies más abundantes, excepto aquellos ejecutados sobre la matriz de datos ambientales, para los que se emplearon datos normalizados y distancia euclidiana. Los análisis estadísticos multivariantes fueron realizados mediante PRIMER y PERMANOVA 6.0 (Clarke y Gorley 2006).
Resultados
Variables del sedimento
En Los Abrigos, las arenas medias dominaron durante todo el estudio, tanto en el estrato intermareal (60.75 ± 9.42%, media ± error estándar) como en el submareal (48.70 ± 10.35%), seguidas por arenas finas en el submareal (38.74 ± 11.13%) y arenas gruesas en el intermareal (17.89 ± 6.37%) (tabla 1). Los contenidos medios de nitrógeno (<0.03%) y de carbonatos (<6%) fueron bajos, mientras que la materia orgánica fluctuó entre 0.9% y 1.0% (tabla 1). En Los Cristianos, las arenas finas dominaron los dos estratos (intermareal: 61.91 ± 15.46%; submareal: 69.67 ± 8.67%), seguidas por las arenas medias (intermareal: 24.87 ± 13.80%; submareal: 20.47 ± 7.07%). El contenido de nitrógeno fue muy bajo durante todo el estudio (<0.02%), mientras que los carbonatos oscilaron entre el 19% y el 25% (intermareal: 19.60 ± 2.71%; submareal: 24.32 ± 2.26%) (tabla 1). La materia orgánica mostró contenidos <1% (intermareal: 0.67 ± 0.28%; submareal: 0.54 ± 0.33%) (tabla 1).
Comunidad meiofaunal
A lo largo de todo el estudio, se recolectó un total de 103,763 individuos meiofaunales pertenecientes a 19 grupos taxonómicos (Acari, Amphipoda, Cnidaria, Copepoda, Echi-nodermata, Gastrotricha, Isopoda, Insecta, Kinorrhyncha, Misidacea, Nematoda, Nemertini, Oligochaeta, Ostracoda, Polychaeta, Priapulida, Sipuncula, Tanaidacea y Turbellaria). Los nematodos fueron el grupo taxonómico más abundante (91,659 individuos, 88.25% de la abundancia total), seguidos por los copépodos (6195 individuos, 5.94% de la abundancia) y los turbelarios (2402 individuos, 2.31% de la abundancia) (tabla 2). Los sipuncúlidos, insectos y cnidarios fueron minoritarios y estuvieron representados por un único individuo (tabla 2). Se identificaron un total de 203 especies meiofaunales a lo largo del período de estudio. Los nematodos Odontophora sp. C (12,710 individuos) y Daptonema hirsutum (12,191 individuos) fueron las especies más abundantes, seguidas por los nematodos Siphonolaimus sp. B (10,959 individuos) y Catanema sp. (9509 individuos) (apéndice).
La densidad (fig. 2a) y la riqueza de especies (fig. 2b) fueron superiores en el estrato submareal en relación con el intermareal para ambos sitios, registrándose valores más altos en Los Abrigos que en Los Cristianos. La comunidad meiofaunal estuvo dominada por varias especies en el medio intermareal, principalmente por los nematodos Odontophora sp. C y Theristus sp. en Los Cristianos y el copépodo Ectino-somatidae y el poliqueto Microphthalmus pseudoaberrans en Los Abrigos (fig. 3) (apéndice). Esta dominancia fue menos acusada en el submareal, caracterizado por presentar varias especies con densidades intermedias, principalmente los nematodos Siphonolaimus sp. B, Catanema sp., Oncholaimus campylocercoides, Paramesonchium belgicum y Sabatieria aff. longisetosa en Los Abrigos y los nematodos Daptonema hirsutum, Pomponema sedecima, Oncholaimellus calvadosicus y Odontophora sp. C y el copépodo Canuella aff. perplexa en Los Cristianos (fig. 3, apéndice).
La estructura de la comunidad meiofaunal fue distinta entre sitios (ANOSIM, R estadístico = 0.952, P = 0.02; fig. 4) y estratos (ANOSIM, R estadístico = 0.926, P = 0.02; fig. 4). El estrato intermareal presentó una mayor variabilidad temporal en la estructura de la comunidad meiofaunal en comparación con el submareal. Se observó una mayor dispersión de los centroides mensuales a lo largo del año de estudio (fig. 4), corroborado por valores de dispersión multivariante significativamente más altos (PERMDISP) en el medio intermareal con respecto al medio submareal en ambas playas: F = 2.71, P = 0.002 para Los Abrigos y F = 3.09, P = 0.003 para Los Cristianos. Similarmente, a lo largo del periodo de estudio, las condiciones ambientales del medio intermareal fueron más variables que en el medio submareal: F = 8.55, P = 0.001 para Los Abrigos y F = 2.67, P = 0.06 para Los Cristianos.

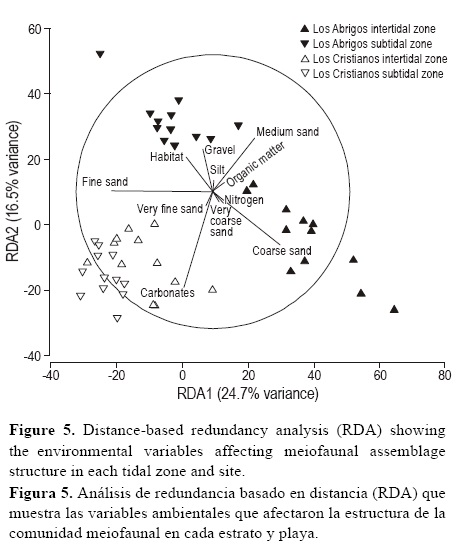
Los dos primeros ejes del RDA explicaron el 41.2% de la variabilidad de la estructura de la comunidad meiofaunal (fig. 5). Las arenas medias y gruesas estuvieron correlacionadas positivamente con el primer eje, que explicó el 24.7% de la varianza total. En cambio, las arenas finas estuvieron negativamente correlacionadas con este eje. Los carbonatos obtuvieron una correlación negativa con el segundo eje, responsable del 16.5% de la variabilidad de la comunidad meiofaunal. Las arenas gruesas y los carbonatos fueron las variables que más contribuyeron a explicar la variabilidad en la estructura meiofaunal (prueba secuencial de regresión multivariante múltiple, tabla 3).
Discusión
El ambiente intersticial se encuentra sujeto a cambios cíclicos (las estaciones, día y noche, mareas y períodos temporales), lo que genera cambios importantes, entre otros, en la microtopografía del sedimento, así como en la disponibilidad de alimento y sustrato (Ólafsson 1991, Coull 1999, Covazzi et al. 2000, Gheskiere et al. 2002). Estos cambios determinan, en gran medida, la distribución vertical y horizontal de la comunidad meiofaunal en el estrato intermareal (Giere 1993), que trata de evitar el estrés hídrico (desecación), térmico (altas temperaturas) y de oxígeno (capa de discontinuidad del potencial redox, RPD) típico de este estrato (Armonies y Reise 2000). Por esta razón, se ha observado con anterioridad que la abundancia y la riqueza meiofaunal son inferiores en el estrato intermareal en comparación con el submareal (Gheskiere et al. 2002, Bick y Arlt 2005), tal y como se registró en el presente estudio. Esta gran fluctuación en las condiciones ambientales del medio intermareal, como nuestros resultados han mostrado, se traduce en cambios drásticos en la estructura de la comunidad meiofaunal a lo largo del tiempo; el medio submareal, por el contrario, presentó una comunidad meiofaunal temporalmente más estable. No obstante, algunas especies meiofaunales restringidas al estrato intermareal se han adaptado a estas condiciones de elevado estrés (Reise 1985, Brown y McLachlan 1990), presentando altas densidades y dominando claramente la comunidad (McIntyre y Murison 1973, McLachlan 1977). Así, el presente estudio mostró que la comunidad meiofaunal estuvo dominada por unas pocas especies en el medio intermareal, mientras que en el medio submareal, esta dominancia correspondió a varias especies.
A nivel de abundancias, se observaron densidades que se pueden considerar intermedias en comparación con otros trabajos llevados a cabo en otras latitudes, e incluso con los realizados en playas del Mediterráneo (Fabiano et al. 2002, Moreno et al. 2006), caracterizadas como altamente oligotróficas debido a su bajo contenido de proteínas y carbohidratos (Dell'Anno et al. 2002). La concentración de materia orgánica explica parcialmente las abundancias meiofaunales en las playas de estudio, tal y como se ha comprobado en otros trabajos (e.g., Rudnick et al. 1985), aunque es necesario un análisis exhaustivo de las concentraciones de bacterias presentes en el sedimento para determinar el grado de disponibilidad de la materia orgánica para los organismos meiofaunales (Montagna et al. 1983, Moreno et al. 2006).
La granulometría del sedimento, tipificado por las cantidades de las distintas fracciones granulométricas, contribuyó significativamente a explicar la variabilidad en la estructura de la comunidad meiofaunal, tal y como se apreció en el análisis de ordenación basada en distancia RDA. El contenido en carbonatos del sedimento, variable ligada a la distinta naturaleza de cada sitio (Los Abrigos, de origen volcánico y Los Cristianos, de origen organógeno), fue un factor menos relevante que la granulometría. Las diferencias encontradas en la estructura de la comunidad meiofaunal entre los dos sitios de estudio (Los Abrigos y Los Cristianos) se correlacionan, principalmente, con la fracción sedimentaria dominante (arenas medias en el intermareal de Los Abrigos y arenas finas en el submareal de Los Abrigos y en el intermareal y submareal de Los Cristianos). En el intermareal de Los Abrigos, que estuvo dominado por arenas medias, los copépodos fueron el grupo más abundante, destacando la especie Ectinosomatidae sp. 1. Estos resultados se encuentran en consonancia con los observados por Ólafsson (1991) en las costas de Islandia y por Covazzi et al. (2000) en playas del mar de Liguria (Mediterráneo), que estuvieron caracterizadas por una fracción importante de gravas y arenas gruesas, en las cuales dominan los copépodos harpacticoides (Heip et al. 1982) debido al mayor tamaño de los intersticios y a una oxigenación alta. Por otro lado, los nematodos se encuentran bien adaptados a vivir en intersticios pequeños; gracias a su musculatura pueden desplazarse a través de intersticios de poco diámetro (Forster 1998). Por esta razón, las playas de arenas finas se caracterizan por presentar abundancias elevadas de nematodos (McLachlan 1977, Gheskiere et al. 2002). En el presente estudio, se observó esta tendencia en el submareal de Los Abrigos y en los estratos intermareal y submareal de Los Cristianos, ambientes dominados por arenas finas.
En conclusión, este estudio ha mostrado diferencias en la estructura de la comunidad meiofaunal de los dos estratos analizados (inter y submareal) debido principalmente a diferencias en la composición granulométrica y a la naturaleza del sedimento (organógeno vs volcánico) en las localidades de estudio.
Agradecimientos
Los autores expresan su agradecimiento a PJ Somerfield (Laboratorio Marino de Plymouth, Reino Unido) por introducirnos en el campo de la ecología de la meiofauna marina. También queremos agradecer a T Gheskiere y a M Vincx (Departamento de Biología Marina, Universidad de Gante, Bélgica) por la facilidad prestada en su laboratorio y ayuda en la adquisición de bibliografía.
References
Allison LE, Moodie CD. 1965. Methods of soil analysis. Part 2. American Society of Agronomy: 1389-1392. [ Links ]
Anderson MJ. 2006. Distance-based tests for homogeneity of multivariate dispersions. Biometrics 62: 245-253. [ Links ]
Andres NG, Witman JD. 1995. Trends in community structure on a Jamaican reef. Mar. Ecol. Prog. Ser. 118: 305-310. [ Links ]
Armonies W, Reise K. 2000. Faunal diversity across a sandy shore. Mar. Ecol. Prog. Ser. 196: 49-57. [ Links ]
Bick A, Arlt G. 2005. Intertidal and subtidal soft-bottom macro- and meiofauna of the Kongsfjord (Spitsbergen). Polar Biol. 28: 550-557. [ Links ]
Bradstreet RB. 1965. The Kjeldahl Method for Organic Nitrogen. Academic Press, New York, 239 pp. [ Links ]
Brito MC, Núñez J, Martín D. 2005. Polychaetes associated to a Cymodocea nodosa meadow in the Canary Islands: assemblage structure, temporal variability and vertical distribution compared to other Mediterranean seagrass meadows. Mar. Biol. 146: 467-481. [ Links ]
Brown AC, McLachlan A. 1990. Ecology of Sandy Shores. Elsevier, Amsterdam, 327 pp. [ Links ]
Buchanan JB. 1984. Sediment analisis. In: NA Holme, AD McIntyre (eds.), Methods for the study of marine benthos, Blackell Scientific Publications, Oxford, pp 41-65. [ Links ]
Clarke KR, Gorley RN. 2006. Primer v6: User Manual/Tutorial. PRIMER-E, Plymouth, UK, 193 pp. [ Links ]
Colwell RK. 2006. EstimateS: Statistical estimation of species richness and shared species from samples. Version 7.5. User's guide and application published at http://purl.oclc.org/estimates. Accessed on 17 November 2011. [ Links ]
Coull BC. 1999. Role of meiofauna in estuarine soft-bottom habitats. Aust. J. Ecol. 24: 327-343. [ Links ]
Covazzi A, Pusceddu A, Della Croce N, Danovaro R. 2000. Spatial and temporal changes in beach meiofaunal communities of the Ligurian Sea (NW Mediterranean). Rev. Biol. Mar. Ocean. 35: 57-64. [ Links ]
Dell'Anno A, Mei ML, Pusceddu A, Danovaro R. 20002. Assessing the trophic state and eutrophication of coastal marine systems: A new approach based on the biochemical composition of sediment organic matter. Mar. Pollut. Bull. 44: 611-622. [ Links ]
Fabiano M, Misic C, Moreno M, Salvo VS, Covazzi A. 2002. Ecological features of Ligurian beaches exposed to different hydrodynamic forcing. In: Proceedings of the International MEDCOAST Workshop on Beaches of the Mediterranean and Black Sea: Dynamics, Regeneration, Ecology and Management. Middle East Technical University, Ankara, Turkey, pp. 201-203. [ Links ]
Forster SJ. 1998. Osmotic stress tolerance and osmoregulation of intertidal and subtidal nematodes. J. Exp. Mar. Biol. Ecol. 224: 109-125. [ Links ]
Garrabou J, Ballesteros E, Zabala M. 2002. Structure and dynamics of north-western Mediterranean rocky benthic communities along a depth gradient. Estuar. Coast. Shelf Sci. 55: 493-508. [ Links ]
Gee JM. 1989. An ecological and economic review of meiofauna as food for fish. Zool. J. Linn. Soc. 96: 243-261. [ Links ]
Gheskiere T, Hoste E, Kotwicki L, Degraer S, Vanaverbeke J, Vincx M. 2002. The sandy beach meiofauna and free-living nematodes from De Panne (Belgium). Bull. Inst. Roy. Sci. Nat. Bel. 72(S): 43-49. [ Links ]
Gheskiere T, Vincx M, Weslawski JM, Scapini F, Degraer S. 2005. Meiofauna as descriptor of tourism-induced changes at sandy beaches. Mar. Environ. Res. 60: 245-265. [ Links ]
Giere O. 1993. Meiobenthology: The Microscopic Fauna in Aquatic Sediments. Springer, Berlin, 328 pp. [ Links ]
Gotelli N, Colwell RK. 2001. Quantifying biodiversity: Procedures and pitfalls in the measurement and comparison of species richness. Ecol. Lett. 4: 379-391. [ Links ]
Gray JS, Elliott M. 2009. Ecology of Marine Sediments, from Science to Management. 2nd ed. Oxford University Press, New York, 213 pp. [ Links ]
Heip C, Vincx M, Smol N, Vranken G. 1982. The systematics and ecology of marine nematodes. Helminth. Abs. 51: 1-31. [ Links ]
Higgins RP, Thiel H. 1988. Introduction to the Study of Meiofauna. Smithsonian Institution Press, London, 488 pp. [ Links ]
Lambshead PJD, Platt HM, Shaw KM. 1983. The detection of differences among assemblages of marine benthic species based on an assessent of dominance and diversity. J. Nat. Hist. 17: 859-974. [ Links ]
Legendre P, Anderson MJ. 1999. Distance-based redundancy analysis: testing multispecies responses in multifactorial ecological experiments. Ecol. Monogr. 69:1-24. [ Links ]
Mann KH. 2000. Ecology of Coastal Waters: With Implications for Management. Blackwell Science, Massachusetts, 432 pp. [ Links ]
McIntyre AD, Murison DJ. 1973. The meiofauna of a flatfish nursery ground. J. Mar. Biol. Assoc. UK 53: 93-118. [ Links ]
McLachlan A. 1977. Composition, distribution, abundance and biomass of the macrofauna and meiofauna of four sandy beaches. Zool. Afr. 12. 279-306. [ Links ]
McLachlan A, Brown AC. 2006. The Ecology of Sandy Shores. 2nd ed. Academic Press, New York, 373 pp. [ Links ]
McLachlan A, Jaramillo E. 1995. Zonation on sandy beaches. Ocean. Mar. Biol. 33: 305-335. [ Links ]
Montagna PA, Coull BC, Herring TL, Dudley BW. 1983. The relationship between abundances of meiofauna and their suspected microbial food (diatoms and bacteria). Estuar. Coast. Shelf Sci. 17: 381-394. [ Links ]
Moreno M, Ferrero TJ, Granelli V, Marin V, Albertelli G, Fabiano M. 2006. Across-shore variability and trophodynamic features of meiofauna in a microtidal beach of the NW Mediterranean. Estuar. Coast. Shelf Sci. 66: 357-367. [ Links ]
Ólafsson E. 1991. Intertidal meiofauna of four sandy beaches in Iceland. Ophelia 33: 55-65. [ Links ]
Raffaelli D, Hawkins S. 1996. Intertidal Ecology. Chapman and Hall, London, 356 pp. [ Links ]
Reise K. 1985. Tidal Flat Ecology. An experimental approach to species interactions. Springer-Verlag, Berlin, 191 pp. [ Links ]
Riera R, Núñez J, Brito MC. 2011. Short-term variability in sedimentary and compositional properties of two beaches in Tenerife (Canary Islands, NE Atlantic Ocean). Rev. Soc. Geol. Esp. 23(3-4): 81-87. [ Links ]
Riera R, Núñez J, Brito MC, Tuya F. 2011. Temporal variability of a subtropical intertidal meiofaunal assemblage: Contrasting effects at the species and assemblage level. Vie Milieu 61: 1-4. [ Links ]
Rudnick DT, Elmgren R, Frithsen JB. 1985. Meiofaunal prominence and benthic seasonality in a coastal marine system. Oecologia 67: 157-168. [ Links ]
Shin P, Cheung P, Yang F, Cheung S. 2005. Intermittent exposure to reduced oxygen levels affects prey-size selection and consumption in swimming crab Thalamita danae Stimpson. Mar. Pollut. Bull. 51: 1003-1009. [ Links ]
Short A. 1999. Handbook of Beach and Shoreface Morphodynamics. Wiley, West Sussex, UK, 379 pp. [ Links ]
Somerfield P, Warwick RM. 1996. Meiofauna in marine pollution programmes. A laboratory manual. Ministry of Agriculture, Fisheries and Food, Directorate of Fisheries Research, Lowestoft, 71 pp. [ Links ]
Veloso V, Cardoso R. 2001. Effect of morphodynamics on the spatial and temporal variation of macrofauna on three sandy beaches, Rio de Janeiro State, Brazil. J. Mar. Biol. Assoc. UK 81: 369-375. [ Links ]
Walkley A, Black JA. 1934. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the choromic acid nitration method. Soil Sci. 37: 29-38. [ Links ]
Witman JD, Grange KR. 1998. Links between rain, salinity and predation in a rocky subtidal community. Ecology 79: 2429-2447. [ Links ]














