Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.4 Ensenada dic. 2012
https://doi.org/10.7773/cm.v38i4.2108
Análisis del comportamiento alimentario y de la tasa de consumo de alimento de Atlantorchestoidea brasiliensis (Crustacea: Talitridae)
Analysis of feeding behavior and food consumption rate of Atlantorchestoidea brasiliensis (Crustacea: Talitridae)
V Gomes Veloso1, I Azevedo Sallorenzo2*, WK Andrade Barros1, G Neves de Souza3
1 Laboratório de Ecología Bêcntica, Departamento de Ciências Naturais, Universidade Federal do Estado do Rio de Janeiro, Avenida Pasteur 458, Urca, Rio de Janeiro, CEP 22290-240, RJ, Brazil.
2 Instituto de Biologia, Departamento de Biologia Marinha, Universidade Federal Fluminense, Outeiro de São João Batista s/n, Campus do Valonguinho, Centro, Niterói, CEP 24020-140, RJ, Brazil. * Corresponding author. E-mail: isallorenzo@gmail.com
3 Laboratório de Ecologia de Sedimentos, Instituto de Biologia, Departamento de Biologia Marinha, Universidade Federal Fluminense, Outeiro de São João Batista s/n, Campus do Valonguinho, Centro, Niterói, CEP 24020-140, RJ, Brazil.
Received January 2012,
received in revised form August 2012,
accepted, October 2012.
RESUMEN
Los anfípodos talítridos son considerados los principales consumidores de residuos orgánicos en la zona intermareal de playas arenosas ya que retiran grandes cantidades de macrófitos. La cantidad y composición de los macrófitos depositados pueden influir en el consumo y la tasa demográfica de las especies de talítridos. Sin embargo, en las costas con baja contribución de macrófitos, donde la materia orgánica consiste de detrito, fragmentos de algas y plantas vasculares, el comportamiento alimentario de los talítridos es escasamente conocido. En la costa sur de Brasil, el anfípodo Atlantorchestoidea brasiliensis es la especie más abundante de la macrofauna en playas expuestas con escasos restos de algas. Para entender el comportamiento alimentario de esta especie, se realizaron experimentos sobre la preferencia de alimento y las tasas de consumo. La capacidad de alimentarse en la superficie y dentro del sustrato también se examinó. El alimento ofrecido incluyó el cangrejo de arena Emerita brasiliensis, el berberecho Donax hanleyanus, el pez Mugil sp. y el alga Ulva sp., especies que comúnmente comprenden el detrito varado. Los anfípodos adultos consumieron una amplia gama de alimentos. Las especies más consumidas fueron E. brasiliensis y D. hanleyanus, las cuales se consumieron más durante la noche, mientras que Mugil sp. fue el alimento menos consumido durante tanto el día como la noche. En el ensayo de preferencia de alimento, el consumo de algas fue insignificante por lo que se sugiere que los restos de animales son más importantes para la alimentación de esta especie. Los anfípodos prefirieron algas frescas más que algas secas cuando se ofrecieron simultáneamente. Nuestros resultados indican que los talítridos tienen diferente estrategia y comportamiento alimentario según el tipo de material orgánico depositado en la playa.
Palabras clave: Atlantorchestoidea brasiliensis, tasa de consumo, playas arenosas, comportamiento alimentario, materia orgánica varada.
ABSTRACT
Talitrid amphipods are considered one of the most important wrack-deposit consumers in the intertidal zone of sandy beaches due to their ability to remove extensive amounts of macrophytes. The quantity and composition of drift macrophytes can influence the consumption and demographic rates of talitrid species. However, on coasts with a low contribution of macrophytes, where organic material is typically composed of debris, algal fragments, and vascular plants, the feeding behavior of talitrids is poorly understood. Along the south coast of Brazil, the amphipod Atlantorchestoidea brasiliensis is the most abundant species of macrofauna on exposed sandy beaches that do not have a high abundance of macroalgal wrack. In order to understand the feeding behavior of this species, experiments on food preference and consumption rates were carried out, and the ability to feed on the surface or buried within the substrate was also tested. Food items offered included the sand crab Emérita brasiliensis, the wedge clam Donax hanleyanus, the mullet fish Mugil sp., and the alga Ulva sp., species that commonly comprise debris on the drift line. Adult amphipods showed a broad feeding range. The most commonly consumed food items were E. brasiliensis and D. hanleyanus, which were consumed more during the night, while Mugil sp. was the least consumed item during both the day and night. In the food preference trials, algal consumption was negligible, suggesting that feeding on debris is more important for this species. Amphipods preferred fresh algae rather than dried algae when simultaneously offered both food items. Our results indicate that talitrids have different feeding strategies and behavior according to the type of organic material deposited on the beach.
Key words: Atlantorchestoidea brasiliensis, consumption rate, sandy beaches, feeding behavior, strandline.
Introducción
Las cadenas tróficas de playas arenosas expuestas se ven beneficiadas por los restos de macroalgas, pastos marinos y animales de ecosistemas adyacentes que quedan varados ahí (Olabarria et al. 2009). Este material alóctono representa una de las principales fuentes alimenticias de la macrofauna y los animales terrestres que habitan en los niveles superiores de la zona intermareal (Colombini y Chelazzi 2003, Dugan et al. 2003, Hyndes y Lavery 2005). En algunas zonas costeras se ha estimado la cantidad de material orgánico alóctono (subsidio trófico), y la biomasa depositada en playas expuestas es considerable, con aportes anuales de más de 2000 kg peso fresco m-2 (Stenton-Dozey y Griffiths 1983, Orr et al. 2005, Lastra et al. 2008). Una vez depositado en la costa, este material pasa por procesos de fragmentación, descomposición y remineralización. La macrofauna herbívora, la meiofauna y las bacterias son responsables de dichos procesos (Colombini y Chelazzi 2003). Los fragmentos y componentes mineralizados pueden ser utilizados dentro del mismo ecosistema playero o transportados a otras zonas de la costa (Griffiths y Stenton-Dozey 1980, Colombini y Chelazzi 2003). Macroinvertebrados como los anfípodos, isópodos e insectos pueden usar estos recursos durante las diferentes etapas de descomposición como refugio y alimento (Koop y Field 1980; Griffiths et al. 1983; Marsden 1991a, 1991b; Crawley y Hyndes 2007; Olabarria et al. 2009). Entre éstos, los anfípodos de la familia Talitridae han recibido especial atención como pioneros de la colonización de macroalgas varadas y son responsables de las tasas de consumo más altas (Griffiths y Stenton-Dozey 1980, Inglis 1989, Colombini et al. 1998, Adin y Riera 2003). Estos animales tienen la capacidad de consumir algas, acelerando el proceso de descomposición y retirando grandes cantidades (más del 50%) de los macrófitos depositados en las playas (Griffiths et al. 1983, Colombini et al. 2000, Dugan et al. 2003, Lastra et al. 2008, Olabarria et al. 2009). Los anfípodos usan las macroal-gas sin mediación trófica y esto juega un papel importante en la transferencia de energía a niveles tróficos superiores (Duarte et al. 2010).
El anfípodo talítrido Atlantorchestoidea brasiliensis (Dana 1853) se encuentra comúnmente a través del espectro morfodinámico de playas expuestas de Uruguay y Brasil, con mayor abundancia en playas reflectivas. Esta especie, junto con el cangrejo de arena (tatucito) Emerita brasiliensis y el isópodo cirolánido Excirolana brasiliensis, comprende el 95% de la abundancia total de la macrofauna en la zona supralitoral y el medio litoral de playas expuestas (Defeo et al. 1992, Cardoso y Veloso 1996, Veloso et al. 1997, Veloso y Cardoso 2001, Defeo y Gómez 2005). La mayoría de los trabajos sobre A. brasiliensis han examinado la biología, la zonación y las respuestas poblacionales a variables físicas (Gómez y Defeo 1999, Cardoso y Veloso 2001, Defeo y Gómez 2005), pero poco se sabe de su comportamiento alimentario. Tal información es indispensable para un mejor conocimiento de las cadenas tróficas y del papel de los subsidios tróficos en diferentes tipos de playas arenosas. En este contexto, el objetivo principal de este estudio fue investigar la influencia de A. brasiliensis en el procesado y la tasa de consumo del material orgánico alóctono depositado en playas que reciben pocas cantidades de tales residuos. El comportamiento alimentario de esta especie se estudió en el laboratorio, donde se evaluó lo siguiente: (1) tasa de consumo y periodo de actividad alimentaria, (2) preferencia de alimento (varios tipos de animales y materia orgánica algal), (3) preferencia por algas frescas o secas y (4) lugar preferencial para alimentarse (en la superficie o dentro del sustrato).
Materiales y métodos
Sitio de estudio
Las muestras se recolectaron en la playa Grumari (23°2'59'' S, 43°31'35'' W), localizada en una zona de protección ambiental, al oeste de la ciudad de Río de Janeiro (Brasil). Esta playa reflectiva (Veloso et al. 2003a) recibe restos de conchas; invertebrados muertos tales como crustáceos, moluscos e insectos; cantidades pequeñas de algas verdes y pardas, incluyendo Ulva sp. y Sargassum sp.; y basura inorgánica dejada por bañistas. Los anfípodos talítridos son muy abundantes durante todo el año (Veloso et al. 2003a).
Trabajo de campo
Los muestreos se realizaron de enero a febrero de 2011 durante la marea baja. Los anfípodos talítridos se capturaron por arriba de la línea de resaca con trampas de caída de 17 cm de diámetro y se colocaron en contenedores de plástico. También se recolectaron el cangrejo Emerita brasiliensis Schmitt 1935, el berberecho Donax hanleyanus Philippi 1847, el pez Mugil sp. y la macroalga Ulva sp., los cuales fueron ofrecidos como alimento en los tratamientos posteriores.
Trabajo de laboratorio
Para la medición de las tasas de consumo, los anfípodos se colocaron en contenedores de plástico (15 cm de diámetro y 10 cm de profundidad) que contenían 6 cm de arena húmeda de la playa Grumari. Los contenedores fueron cubiertos con una malla de nilón de 500 μm. La arena de Grumari primero se esterilizó con peróxido de hidrógeno durante 12 h y luego se lavó con agua corriente y se secó en un horno a 60 °C durante 24 h antes de utilizarse como sustrato en los experimentos. El proceso se realizó dos veces para eliminar la materia orgánica y los microorganismos.
Tasas de consumo y periodo de actividad alimentaria
Para estimar las tasas de consumo y el periodo de actividad alimentaria, los anfípodos recibieron un solo tipo de alimento (ensayo sin opción de alimento). Se comparó la tasa de consumo de cuatro diferentes especies por A. brasiliensis. Como ya se mencionó, se recolectaron las especies que comúnmente componen el detrito varado (E. brasiliensis, D. hanleyanus, Mugil sp. y Ulva sp.). Se seleccionaron juveniles de D. hanleyanus y E. brasiliensis a fin de estandarizar el peso del alimento ofrecido (0.5 a 0.7 g); el primero se ofreció sin su concha. Se utilizó un pedazo pequeño (0.5 a 0.7 g) de músculo de Mugil sp. Para medir las tasas de consumo algal, todas las porciones macrofíticas comprendieron material cosechado en el campo, el cual se secó con papel secante para eliminar el exceso de agua y se pesó al 0.001 g más cercano antes de colocarlo en los contenedores. Se usó material cosechado para simular restos recién depositados en la playa (Lastra et al. 2008).
Para todos los experimentos se utilizaron 10 réplicas de 10 animales experimentales y un pedazo de cada tipo de alimento. El alimento previamente pesado se adicionó directamente a cada contenedor experimental. Para controlar cualquier posible cambio de peso en las porciones de alimento no relacionado con la alimentación de los anfípodos (e.g., por desecación, degradación microbial), para cada ensayo experimental también se prepararon 5 controles consistentes de contenedores con arena y porciones previamente pesadas de cada tipo de alimento, pero sin anfípodos. Así, para cada tratamiento (cada tipo de alimento) se contó con 10 réplicas experimentales y 5 controles. Para evitar la influencia de la dieta anterior en el comportamiento alimentario y para reducir el estrés de los animales generado por su manipulación (Duarte et al. 2010), todos los individuos se mantuvieron en inanición durante 24 h antes de los ensayos experimentales. Los contenedores de plástico (réplicas y controles) se colocaron aleatoreamente en dos cámaras climáticas a 20 °C. El periodo durante el cual los anfípodos se alimentan preferentemente se estudió ofreciendo alimento durante condiciones de día y de noche en las cámaras climáticas. En el primer ensayo se usó luz blanca fluorescente para iluminar la cámara durante 12 h (simulando el día). El ensayo se repitió con individuos nuevos para cada tratamiento sin luz (simulando la noche). Al terminar los ensayos, el alimento remanente se retiró, se cepilló ligeramente para quitar la arena y se pesó.
Preferencia de alimento
Para evaluar la preferencia de alimento de A. brasiliensis, se colocaron pedazos pequeños, previamente pesados, de cuatro tipos de alimento (E. brasiliensis, D. hanleyanus, Mugil sp. y Ulva sp.) en el mismo contenedor de forma simultánea. Para este experimento se usaron 10 réplicas y 5 controles.
Macroalgas frescas y secas
Para comparar la tasa de consumo de algas frescas y secas (Ulva sp.), se colocaron porciones previamente pesadas (al 0.001 g más cercano) de las hojas de algas frescas y secas en la superficie de cada contenedor experimental. Las hojas se secaron a 40 °C durante 24 h antes del ensayo. Al igual que en los ensayos anteriores, se usaron 10 réplicas y 5 controles.
Tasa de consumo de alimento en la superficie y enterrado
Para evaluar la tasa de consumo de alimento en la superficie y enterrado en la arena, se recolectaron anfípodos adicionales y alimento (D. hanleyanus) de la playa como se describió anteriormente. Antes de los ensayos, los moluscos se separaron de su concha y se pesaron al 0.001 g más cercano. El alimento se proporcionó en la superficie y 5 cm por debajo de la superficie dentro de valvas abiertas (para minimizar la adhesión de arena al alimento). En un ambiente natural, D. hanleyanus típicamente se encuentra con valvas abiertas después de morir, dentro de las cuales se observa A. brasiliensis. Al final de cada ensayo, se pesaron tanto los componentes alimenticios como los anfípodos para calcular el peso posterior por gramo de cada individuo. Se usaron 10 réplicas y 5 controles.
Análisis de datos
Las tasas de consumo se calcularon por individuo: (Hi x Cf / Ci) - Hf, donde Hi y Hf son el peso preensayo y peso posensayo del alimento (secado con papel secante) ofrecido a los anfípodos, y Ci y Cf son el peso preensayo y peso posensayo de los controles emparejados (secados) para determinar los cambios autogénicos en el peso (Taylor y Brown 2006). Los resultados obtenidos de la ecuación se dividieron por el número de anfípodos en cada tratamiento para calcular las tasas de consumo por individuo (consumo promedio ind-1 12 h-1). El resultado fue dividido por el peso del anfípodo para calcular la tasa de consumo por gramo de individuo.
Para comparar el consumo de los alimentos ofrecidos en los ensayos sin opción, se empleó la prueba no paramétrica de Kruskal-Wallis para los periodos de día y noche de forma separada. Las comparaciones por pares del consumo durante los periodos de día y noche se evaluaron con la prueba paramétrica t de Student para muestras independientes (Zar 1999). Los ensayos de preferencia de alimento (con opción) se evaluaron con la prueba no paramétrica de Friedman seguida por comparaciones por pares (Zar 1999). La prueba t de Student se volvió a usar para comparar el consumo de los diferentes alimentos ofrecidos individualmente (sin opción) y simultáneamente (con opción), así como para analizar la ingesta de D. hanleyanus en la superficie o enterrada en la arena y el consumo de algas frescas y secas. Todos los análisis estadísticos se realizaron con el programa Statistica 7.0.
Resultados
Tasas de consumo y periodo de actividad alimentaria
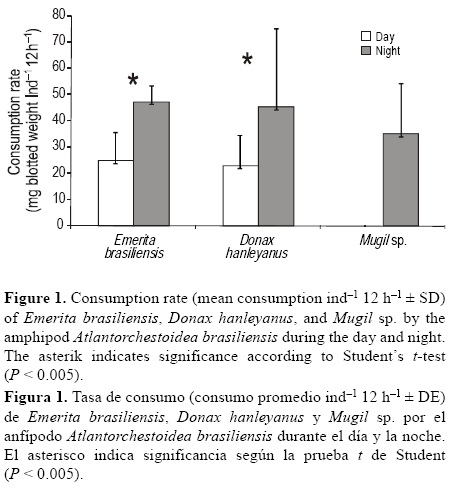
Durante el día los anfípodos consumieron tres de los cuatro tipos de alimento ofrecidos, con tasas de consumo promedio en el intervalo de 4.7 a 24.9 mg peso seco ind-1 12 h-1. Los anfípodos no consumieron Mugil sp. durante este periodo. Las tasas de consumo de E. brasiliensis y D. hanleyanus fueron muy similares y no difirieron estadísticamente. La tasa de consumo de E. brasiliensis fue de 24.9 mg peso seco ind-1 12 h-1 (±10 DE) y el de D. hanleyanus de 23.0 mg peso seco ind-1 12 h-1 (±11 DE), representando 21.8% y 20.4%, respectivamente, del total de alimento ofrecido. La tasa de consumo de Ulva sp. durante el día fue de 4.7 mg peso seco ind-1 12 h-1 (±3 DE), lo que representa sólo el 11% del total de alimento ofrecido y difiere significativamente de las cantidades de E. brasiliensis (Kruskal-Wallis: P = 0.002) y D. hanleyanus (Kruskal-Wallis: P = 0.001) consumidas por los anfípodos durante el día.
Durante la noche los anfípodos consumieron los cuatro tipos de alimento ofrecidos, con tasas de consumo promedio en el intervalo de 5.0 a 47.4 mg peso seco ind-1 12 h-1. El consumo de E. brasiliensis (47 mg peso seco ind-1 12 h-1, ±6 DE) y D. hanleyanus (45 mg peso seco ind-1 12 h-1, ±29 DE) representó 34.7% y 29.7%, respectivamente, del total de alimento ofrecido, mientras que el de Mugil sp., que fue menor (35 mg peso seco ind-1 12 h-1, ±18 DE), representó 23.3% del total. El consumo de Ulva sp. fue mucho menor, 5 mg peso seco ind-1 12 h-1 (±3 DE), lo que representa sólo 12.1% del total de alimento ofrecido. No obstante, no se encontraron diferencias estadísticamente significativas entre los tratamientos nocturnos.
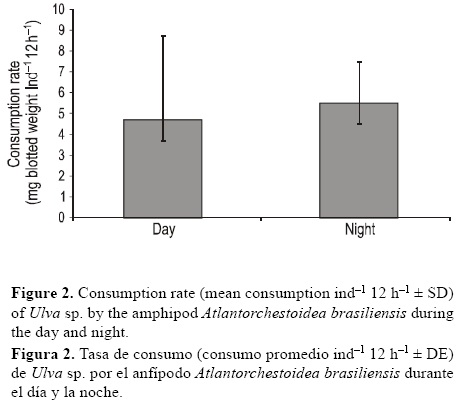
En la figura 1 se comparan las tasas de consumo de E. brasiliensis, D. hanleyanus y Mugil sp. durante el día y la noche. Se observa un aumento significativo en la tasa de consumo de E. brasiliensis (prueba t de Student: t = -2.12, P = 0.045) y D. hanleyanus (prueba t de Student: t = -2.22, P = 0.039) durante la noche. En la figura 2 se muestra la tasa de consumo de Ulva sp. durante el día y la noche y no se observa una diferencia significativa (prueba t de Student: t = -0.27, P = 0.783). Este resultado se presenta de forma separada debido a la diferencia en el peso de las algas y de los animales ofrecidos como alimento.
Preferencia de alimento y comparación de las tasas de consumo con y sin opción de alimento
Tras observar un mayor consumo de alimentos durante la noche, los ensayos subsecuentes se realizaron en ausencia de luz.
Al evaluar las tasas de consumo en el ensayo con opción de alimento, no se observaron diferencias significativas en las tasas de consumo de E. brasiliensis, D. hanleyanus y Mugil sp. (prueba de Friedman: P = 0.122); la tasa de consumo de los primeros dos (22.06 mg peso seco ind-1 12 h-1, ±7 DE, y 18.31 mg peso seco ind-1 12 h-1, ±10 DE, respectivamente) fue mayor que el de Mugil sp. (14.45 mg peso seco ind-1 12 h-1, ±6 DE). Los anfípodos no consumieron Ulva sp. (fig. 3).
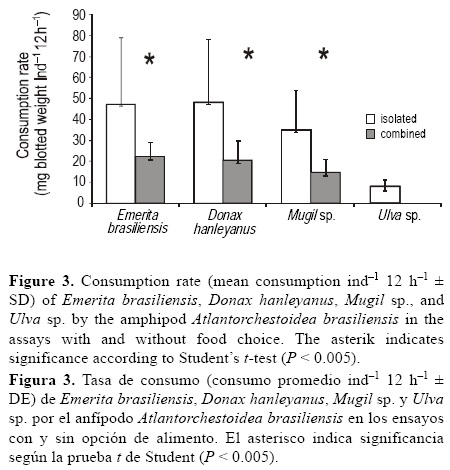
Cuando los anfípodos fueron ofrecidos sólo un tipo de alimento (ensayo sin opción), la tasa de consumo siempre fue mayor que cuando los alimentos fueron ofrecidos simultáneamente (con opción). Se observó una diferencia significativa en las tasas de consumo de E. brasiliensis y D. hanleyanus entre los tratamientos (prueba t de Student: t = 2.47, P = 0.023, y t = 2.82, P = 0.011, respectivamente). La tasa de consumo de Mugil sp. fue dos veces más alta cuando este alimento se ofreció como única opción que cuando se ofreció de forma simultánea con otros alimentos (prueba t de Student: t = 3.25, P = 0.004) (fig. 3).
Macroalgas frescas y secas
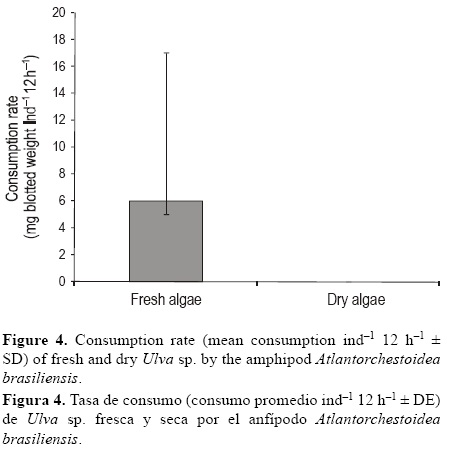
Cuando A. brasiliensis recibió macroalgas frescas y secas de forma simultánea, sólo se consumieron las algas frescas (6 mg peso seco ind-1 12 h-1, ±11 DE) (fig. 4).
Tasa de consumo de alimento en la superficie y enterrado
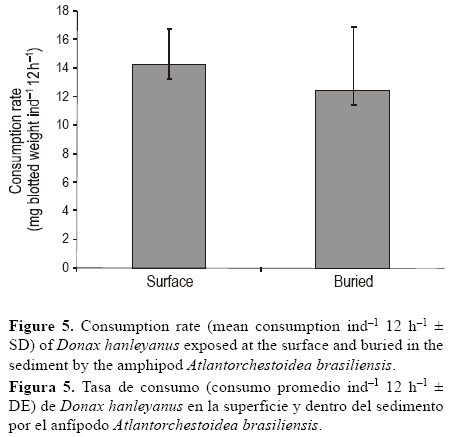
No se observaron diferencias significativas en la tasa de consumo de D. hanleyanus cuando se colocó en la superficie o se enterró en la arena (prueba t de Student: t = 1.11, P = 0.280) (fig. 5). La tasa de consumo de D. hanleyanus en la superficie fue de 14.27 mg peso seco ind-1 12 h-1 (±2 DE) y enterrado fue de 12.47 mg peso seco ind-1 12 h-1 (±2 DE).
Discusión
En el presente estudio, A. brasiliensis consumió una variedad de alimentos, incluyendo tanto plantas como animales. Es interesante notar que otras especies de anfípodos, como Orchestia gammarellus y Platorchestia platensis, también han sido clasificados como omnívoros, aunque consumen más materia orgánica vegetal (Behbehani y Croker 1982, Moore y Francis 1985). Éste es el primer trabajo que ha estimado la tasa de consumo de materia orgánica animal por anfípodos talítridos. El cangrejo E. brasiliensis y el molusco D. hanleyanus fueron los alimentos más consumidos por A. brasiliensis. Emerita brasiliensis es una de las especies más abundantes en la zona de saca y resaca de playas arenosas expuestas en la costa de Río de Janeiro, y contribuye a la alta disponibilidad de individuos muertos y fragmentos alóctonos despositados (Cardoso y Veloso 1996, Defeo y Gómez 2005). Donax hanleyanus muestra la misma distribución que E. brasiliensis pero es menos abundante en las playas (Veloso et al. 2003b). En el campo, también se observó A. brasiliensis consumiendo una variedad de insectos, tales como moscas, avispas y escarabajos. La escasa presencia de macroalgas en esta playa podría explicar el alto nivel de consumo de animales por A. brasiliensis. Es necesario estudiar las diferencias en la morfología bucal de especies omnívoras y herbívoras para entender mejor cómo las especies se han adaptado a las distintas dinámicas de alimentación observadas en los diferentes tipos de playa.
Durante el día, es común observar individuos de A. brasiliensis consumiendo detrito fresco cerca de la zona de resaca (Cardoso y Veloso 1996, Cardoso 2002, Veloso et al. 2009). Nuestros resultados indican que esta especie puede alimentarse durante el día y que la actividad nocturna está relacionada más con un ambiente de bajo estrés (e.g., temperatura de la arena y el aire, humedad, depredación). A medio día, en el verano, la temperatura de la arena en las playas de Río de Janeiro puede rebasar los 40 °C y la diferencia de temperatura entre el día y la noche puede ser de hasta 20 °C (obs. pers.). Durante el día se observó muy poca actividad y la mayoría de los animales permanecieron enterrados en la arena. No obstante, se ha observado más de un pico de actividad para A. brasiliensis durante un periodo de 24 h: al amanecer, al atardecer y a medianoche (Cardoso 2002), coincidiendo con los periodos cuando la temperatura no es muy alta. Otras especies, como Orchestoidea corniculata, Orchestoidea tuberculata y Talorchestia brito, también muestran actividad durante el día (Craig 1973, Kennedy et al. 2000, Lastra et al. 2010), mientras que Megalorchestia corni-culata y Talitrus saltator son principalmente nocturnos (Scapini et al. 1992, Nardi et al. 2003). Se han observado diferencias en rasgos de comportamiento en respuesta a la dinámica del hábitat local, imprevisibilidad de la disponibilidad de alimento y otros factores ambientales (Lastra et al. 2010).
En el presente estudio, fue poca la cantidad de Ulva sp. consumida por A. brasiliensis cuando fue el único alimento ofrecido, y cuando se ofreció simultáneamente con otros alimentos, su consumo fue insignificante. Se ha observado un menor consumo de Ulva sp. por otras especies de anfípodos, como Talitrus, y un mayor consumo de macroalgas pardas por anfípodos (Adin y Riera 2003, Lastra et al. 2008, Duarte et al. 2010). Las especies del orden Ulvales son ricas en nutrientes (Cruz-Rivera y Hay 2000, Taylor y Steinberg 2005) y en general se consideran libres de defensas químicas (Borowsky y Borowsky 1990, Van Alstyne et al. 2001). El bajo contenido fenólico y la dureza estructural de estas algas en comparación con otras hace difícil entender la preferencia de alimento de Talitrus (Adin y Riera 2003). También se ha documentado que O. tuberculata selecciona su alimento (Duarte et al. 2010). Esta especie selecciona activamente las macroalgas disponibles y la selección parece basarse en la calidad nutricional. En el presente trabajo, la selección presentada por los anfípodos podría estar relacionada con alimentos de mejor calidad. Una dieta herbívora indica un menor contenido de proteína en comparación con la dieta de un cañonero, pero aún falta estudiar este aspecto. La disponibilidad de alimento en la playa es otro factor importante a consider. Una estrategia que podrían usar los carroneros en playas reflectivas es depender de una mejor calidad de nutrientes para compensar la menor disponibilidad y frecuencia de alimento.
A pesar de enterrarse bajo macroalgas desecantes, varios estudios han sugerido que los anfípodos talítridos prefieren consumir algas frescas en vez de algas secas o en descomposición (Colombini et al. 2000, Lastra et al. 2008, Duarte et al. 2010). Nuestros resultados concuerdan con esto ya que A. brasiliensis se alimentó preferentemente de algas frescas que de algas secas cuando ambas se ofrecieron simultáneamente. Sin embargo, es muy difícil evaluar el tiempo entre el desprendimiento de los macrófitos y su desecación al quedar varados. Nuestro experimento no evaluó el consumo por los anfípodos de macroalgas en otras etapas de descomposición y este aspecto requiere de mayor investigación.
Aparentemente no existen otros reportes del consumo de alimento por anfípodos dentro del sedimento. Nuestros resultados indican que A. brasiliensis puede alimentarse tanto en la superficie como enterrado en la arena y, sorprendentemente, no se observaron diferencias significativas en las tasas de consumo entre las dos posiciones. Esta observación es muy interesante ya que el detrito constantemente se mezcla con la arena de playas reflectivas y la cantidad de alimento disponible en la superficie disminuye. Similarmente, Vilas (1986) encontró que T. saltator puede enterrarse y moverse horizontalmente en el sedimento.
Como se ha demostrado en otros estudios, los anfípodos talítridos son los principales consumidores de residuos orgánicos y representan un eslabón importante en la cadena trófica entre la materia orgánica y niveles superiores (Griffiths et al. 1983, Dugan et al. 2003). Ciertas acciones que pueden afectar el procesado y la disponibilidad de la materia orgánica, como limpiar la playa de residuos, pueden tener consecuencias negativas para la cadena trófica.
El presente trabajo aporta información adicional sobre el comportamiento alimentario de especies de talítridos y su capacidad para procesar material depositado en las playas. El material alóctono que arriba a las playas juega un papel importante en el sustento de una gama de invertebrados, y su consumo por herbívoros y carroneros afecta la transformación de la materia orgánica (Lercari et al. 2010, Bergamino et al. 2011). El conocimiento de las relaciones tróficas es esencial para entender el papel ecológico de las especies en la operación y los procesos del ecosistema, así como las consecuencias de la pérdida de biodiversidad. Actividades humanas, tales como la remoción de detrito y la sobreexplotación de especies, pueden alterar las vías naturales de los procesos de descomposición y la circulación de materia. Se necesitan mayores estudios de la influencia de la calidad de los alimentos y de las preferencias alimentarias de A. brasiliensis para un mejor entendimiento de las estrategias utilizadas por esta especie y para evaluar su respuesta si desaparece su fuente de alimento.
Agradecimientos
Este trabajo fue apoyado por el Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasil). Agradecemos a CAPES el finaciamiento para los experimentos. También agradecemos a todos los participantes en el trabajo de campo sus valiosos esfuerzos, así como al Departamento de Carcinología de la Universidad de Santa Úrsula, especialmente a E Figueiredo Albuquerque y J Braga, quienes amablemente permitieron el uso de sus instalaciones y equipo. El texto en inglés fue revisado por JW Reid y el resumen en espanol por F García García.
References
Adin R, Riera PR. 2003. Preferential food source utilization among stranded macroalgae by Talitrus saltator (Amphipod, Talitridae): A stable isotope study on the northern coast of Brittany (France). Estuar. Coast. Shelf Sci. 56: 91-98. [ Links ]
Behbehani ML, Croker RA. 1982. Ecology of beach wrack in northern New Eng1and with specia1 reference to Orchestia platensis. Estuar. Coast. Shelf Sci. 15: 611-620. [ Links ]
Bergamino L, Lercari D, Defeo O. 2011. Food web structure of sandy beaches: Temporal and spatial variation using stable isotope analysis. Estuar. Coast. Shelf Sci. 91: 536-543. [ Links ]
Borowsky R, Borowsky D. 1990. Feeding inhibition of the salt marsh amphipod Gammarus palustris Bousfield, 1969 by heatlabile substances in Ulva lactuca. Crustaceana 59: 299-301. [ Links ]
Cardoso RS. 2002. Behavioural strategies and surface activity of the sandhopper Pseudorchestoidea brasiliensis (Amphipod, Talitridae) on a Brazilian beach. Mar. Biol. 141: 167-173. [ Links ]
Cardoso RS, Veloso VG. 1996. Population biology and secondary production of the sandhopper Pseudorchestoidea brasiliensis (Amphipoda: Talitridae) at Prainha Beach, Brazil. Mar. Ecol. Prog. Ser. 142: 111-119. [ Links ]
Cardoso RS, Veloso VG. 2001. Embryonic development and reproductive strategy of Pseudorchestoidea brasiliensis (Amphipoda: Talitridae) at Prainha Beach, Brazil. J. Nat. Hist. 35: 201-211. [ Links ]
Colombini I, Chelazzi L. 2003. Influence of marine allochthonous input of sandy beach communities. In: Gibson RN, Atkinson RJA (eds.), Oceanography and Marine Biology: An Annual Review, 41. CRC Press, pp. 115-159. [ Links ]
Colombini I, Aloia A, Fallaci M, Pezzoli G, Chelazzi L. 1998. Spatial use of an equatorial coastal system (East Africa) by an arthropod community in relation to periodically varying environmental conditions. Estuar. Coast. Shelf Sci. 47: 633-647. [ Links ]
Colombini I, Aloia A, Fallaci M, Pezzoli G, Chelazzi L. 2000. Temporal and spatial use of stranded wrack by the macrofauna of a tropical sand beach. Mar. Biol. 136: 531-541. [ Links ]
Craig PC. 1973. Behaviour and distribution of the sand beach amphipod Orchestoidea corniculata. Mar. Biol. 23: 101-109. [ Links ]
Crawley KR, Hyndes GA. 2007. The role of different types of detached macrophytes in the food and habitat choice of a surf-zone inhabiting amphipod. Mar. Biol. 151: 1433-1443. [ Links ]
Cruz-Rivera E, Hay ME. 2000. Can quantity replace quality? Food choice, compensatory feeding, and fitness of marine mesograzers. Ecology 81: 201-219. [ Links ]
Defeo O, Gómez J. 2005. Morphodynamics and habitat safety in sandy beaches: Life history adaptations in a supralittoral amphipod. Mar. Ecol. Prog. Ser. 293: 143-153. [ Links ]
Defeo O, Jaramillo E, Lyonnet A. 1992. Community structure and intertidal zonation of the macroinfauna on the Atlantic coasts of Uruguay. J. Coast. Res. 8: 830-839. [ Links ]
Duarte C, Navarro JM, Acuna K, Gómez I. 2010. Feeding preferences of the sandhopper Orchestoidea tuberculata: The importance of algal traits. Hydrobiologia 651: 291-30. [ Links ]
Dugan JE, Hubbard DM, McCrary MD, Pierson, MO. 2003. The response of macrofauna communities and shorebirds to macrophyte wrack subsidies on exposed sandy beaches of southern California. Estuar. Coast. Shelf Sci. 588: 25-40. [ Links ]
Gómez J, Defeo O. 1999. Life history of the sandhopper Pseudorchestoidea brasiliensis (Amphipoda) in sandy beaches with contrasting morphodynamics. Mar. Ecol. Prog. Ser. 182: 209-220. [ Links ]
Griffiths CL, Stenton-Dozey JM. 1980. The fauna and rate of degradation of stranded kelp. Estuar. Coast. Shelf Sci. 12: 645-653. [ Links ]
Griffiths CL, Stenton-Dozey JM, Koop K. 1983. Kelp wrack and the flow of energy through a sandy beach ecosystem. In: McLachlan A, Erasmus T (eds.), Sandy Beaches as Ecosystems. Junk, The Hague, pp. 547-556. [ Links ]
Hyndes GA, Lavery PS. 2005. Does transported seagrass provide an important trophic link in unvegetated, nearshore areas? Estuar. Coast. Shelf Sci. 63: 633-643. [ Links ]
Inglis G. 1989. The colonization and degradation of stranded Macrocystis pyrifera (L.) C. Ag. by the macrofauna of a New Zealand sandy beach. J. Exp. Mar. Biol. Ecol. 125: 203-217. [ Links ]
Kennedy F, Naylor E, Jaramillo E. 2000. Ontogenetic differences in the circadian locomotor activity rhythm of the talitrid amphipod crustacean Orchestoidea tuberculata. Mar. Biol. 137: 511-517. [ Links ]
Koop K, Field JG. 1980. The influence of food availability on population dynamics of a supralittoral isopod, Ligia dilatata. J. Exp. Mar. Biol. Ecol. 48: 61-72. [ Links ]
Lastra M, Page HM, Dugan JE, Hubbard DM, Rodil IF. 2008. Processing of allochthonous macrophyte subsidies by sandy beach consumers: Estimates of feeding rates and impacts on food resources. Mar. Biol. 154: 163-174. [ Links ]
Lastra M, Schlacher TA, Olabarria C. 2010. Niche segregation in sandy beach animals: An analysis with surface-active peracarid crustaceans on the Atlantic coast of Spain. Mar. Biol. 157: 613-625. [ Links ]
Lercari D, Bergamino L, Defeo O. 2010. Trophic models in sandy beaches with contrasting morphodynamics: Comparing ecosystem structure and biomass flow. Ecol. Model. 221: 2751-2759. [ Links ]
Marsden ID. 1991a. Kelp-sandhopper interactions on a sandy beach in New Zealand. I. Drift composition and distribution. J. Exp. Mar. Biol. Ecol. 152: 61-74. [ Links ]
Marsden ID. 1991b. Kelp-sandhopper interactions on a sandy beach in New Zealand. II. Population dynamics of Talorchestia quoyana (Milne-Edwards). J. Exp. Mar. Biol. Ecol. 152: 75-90. [ Links ]
Moore PG, Francis CH. 1985. Some observations on food and feeding of the supralittoral beach hopper Orchestia gammarellus (Pallas) (Crustacea: Amphipoda). Ophelia 24: 183-197. [ Links ]
Nardi M, Morgan E, Scapini F. 2003. Seasonal variation in the free running period in two Talitrus saltator populations from Italian beaches differing in morphodynamics and human disturbance. Estuar. Coast. Shelf Sci. 58:199-206. [ Links ]
Olabarria C, Incera M, Garrido J, Rodil IF, Rossi F. 2009. Intraspecific diet shift in Talitrus saltator inhabiting exposed sandy beaches. Estuar. Coast. Shelf Sci. 84: 282-288. [ Links ]
Orr M, Zimmer R, Jelinski DE, Mews M. 2005. Wrack deposition on different beach types: Spatial and temporal variation in the pattern of subsidy. Ecology 86: 1496-1507. [ Links ]
Scapini F, Chelazzi L, Colombini I, Fallaci M. 1992. Surface activity, zonation and migrations of Talitrus saltator on a Mediterranean beach. Mar. Biol. 112: 573-581. [ Links ]
Stenton-Dozey J, Griffiths CL. 1983. The fauna associated with kelp stranded on a sandy beach. In: McLachlan A, Erasmus T (eds.), Sandy Beaches as Ecosystems. Junk, The Hague, pp. 557-568. [ Links ]
Taylor RB, Steinberg PD. 2005. Host use by Australasian seaweed mesograzers in relation to feeding preferences of larger grazers. Ecology 86: 2955-2967. [ Links ]
Taylor RB, Brown PJ. 2006. Herbivory in the gammarid amphipod Aora typica: Relationships between consumption rates, performance and abundance across ten seaweed species. Mar. Biol. 149: 455-463. [ Links ]
Van Alstyne KL, Wolfe GV, Freidenburg TL, Neill A, Hicken C. 2001. Activated defense systems in marine macroalgae: vidence for an ecological role for DMSP cleavage. Mar. Ecol. Prog. Ser. 213: 53-65. [ Links ]
Veloso VG, Cardoso RS. 2001. Effect of morphodynamic on the spatial and temporal variation of macrofauna on three sandy beaches, Rio de Janeiro State, Brazil. J. Mar. Biol. Assoc. UK 81: 369-375. [ Links ]
Veloso VG, Cardoso RS, Fonseca DB. 1997. Spatiotemporal characterization of an intertidal macrofauna community at Prainha Beach (recreio dos Bandeirantes), State of Rio de Janeiro, Brazil. In: Absalao RS, Esteves RS (Org.), Oecol. Bras. Rio de Janeiro, Ed. UFRJ 3, pp. 213-225. [ Links ]
Veloso VG, Caetano CHS, Cardoso RS. 2003a. Composition, structure and zonation of intertidal macroinfauna in relation to physical factors in microtidal sandy beaches in Rio de Janeiro State, Brazil. Sci. Mar. 67: 393-402. [ Links ]
Veloso VG, Cardoso RS, Petracco M. 2003b. Secondary production of the intertidal macrofauna of Prainha Beach, Brazil. J. Coast. Res. Spec. Issue 35: 385-391. [ Links ]
Veloso VG, Sallorenzo IA, Ferreira BCA, Souza GN. 2009. Atlantorchestoidea brasiliensis (Crustacea: Amphipoda) as an indicator of disturbance caused by urbanization of a beach ecosystem. Braz. J. Oceanogr. 58: 13-21. [ Links ]
Vilas F. 1986. Activity of amphipods in beach sediments and nearshore environments; Playa Ladeira, NW Spain. J. Coast. Res. 2: 285-295. [ Links ]
Zar JH. 1999. Biostatistical Analysis. 4th ed. Prentice Hall, New Jersey, 662 pp. [ Links ]
Nota
Traducido al español por Christine Harris.














