Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.38 no.4 Ensenada Dez. 2012
https://doi.org/10.7773/cm.v38i4.2034
Efecto de la concentración del sulfuro, pH y anoxia sobre la fotosíntesis y respiración de Zostera marina
Effects of sulfide concentration, pH, and anoxia on photosynthesis and respiration of Zostera marina
LK Korhonen1, V Macías-Carranza1, R Abdala2, FL Figueroa2, A Cabello-Pasini1*
1 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, apartado postal 453, Ensenada 22800, Baja California, México. * Corresponding author. E-mail: acabello@uabc.edu.mx
2 Departamento de Ecología, Facultad de Ciencias, Universidad de Málaga, E-29071, Málaga, Spain.
Received July 2011,
received in revisedform July 2012,
RESUMEN
El sulfuro producido en los sedimentos a consecuencia de la reducción del sulfato es tóxico para algunas macrófitas. De la misma manera, altas concentraciones de sulfuro en el sedimento han sido asociadas con eventos de mortalidad en pastos marinos. Se ha observado que la presencia de sulfuro reduce el crecimiento en algunos pastos marinos; sin embargo, el efecto sobre el metabolismo fotosintético y respiratorio es poco conocido. En consecuencia, el objetivo de esta investigación fue evaluar el efecto de sulfuro sobre la fotosíntesis y la respiración de la fanerógama marina Zostera marina. La evolución del oxígeno fotosintético y la respiración fueron determinados polarográficamente, en tanto que el rendimiento cuántico óptimo fue utilizado como una medida del desempeño fotosintético del fotosistema II en las hojas de Z. marina. Los resultados mostraron que las concentraciones de sulfuro cercanas a 1000 μM pueden ser consideradas como el límite superior para la supervivencia de Z. marina en las lagunas costeras de Baja California (México) consideradas en este estudio. La respiración no presentó inhibición cuando las plantas fueron expuestas a concentraciones de sulfuro de 1000 μM durante incubaciones de 48 h, mientras que el desempeño fotosintético disminuyó al ser expuestas a concentraciones de 25 μM por cortos periodos de tiempo, pero también a exposiciones prolongadas en concentraciones de tan solo 50 μM. Este es el primer estudio que muestra que la capacidad fotosintética de Z. marina no se recupera una vez que las condiciones libres de sulfuro son restablecidas.
Palabras clave: respiración aeróbica, rendimiento cuántico óptimo, sulfuro, fotosíntesis, Zostera marina.
ABSTRACT
Sulfide produced in marine sediments by sulfate reduction is toxic for several macrophytes, and high sediment sulfide concentrations have been associated with seagrass die-off events. Sulfide has been shown to reduce growth in a number of seagrasses, but little is known about its effect on the photosynthetic and respiratory metabolism. Consequently, the aim of this research was to evaluate the effect of sulfide on photosynthesis and respiration of the seagrass Zostera marina. Photosynthetic oxygen evolution and respiration were determined polarographically, while the optimum quantum yield was used as a measure of the photosynthetic performance of photosystem II in the leaves of Z. marina. The results showed that sulfide concentrations of approximately 1000 μM could be considered an upper threshold limit for the survival of Z. marina in the coastal lagoons of Baja California (Mexico) studied. Respiration was not inhibited by sulfide concentrations up to 1000 μM during 48-h incubations, while photosynthetic performance was reduced by short exposure to sulfide concentrations of 25 μM but also by long exposure to concentrations as low as 50 μM. This is the first study that shows that the photosynthetic capacity of Z. marina is not recovered once the sulfide-free conditions have been re-established.
Key words: aerobic respiration, optimum quantum yield, sulfide, photosynthesis, Zostera marina.
Introducción
La reducción del sulfato es la principal fuente de remineralización de carbono en los sedimentos marinos (Jorgensen y Revsbech 1983, Canfield et al. 1993). La reducción del sulfato por bacterias genera sulfuro como producto final, el cual se disocia y mantiene un equilibrio químico entre S2-, HS- y H2S, controlados principalmente por el pH. A pH 6, el 90% del sulfuro estará presente como H2S, mientras que a pH 8, el 80% del sulfuro estará presente como HS- y sólo el 20% como H2S. Se ha encontrado que el sulfuro producido por estas bacterias en el sedimento impactan las funciones fisiológicas de otros organismos acuáticos (Bagarinao 1992).
Por ejemplo, concentraciones de sulfuro entre 1 y 10 en células eucariotas inhiben el citocromo c oxidasa (Fenchel y Finlay 1995). Por otra parte, se ha encontrado que concentraciones en el sedimento menores que 5000 μM limitan el crecimiento de las macrófitas en los humedales (Koch y Mendelssohn 1989, Koch et al. 1990, Erskine y Koch 2000) y también, al unirse a las métalo-enzimas en las raíces del arroz, reducen su capacidad respiratoria aeróbica (Allam y Hollis 1972).
Se ha sugerido que el aumento repentino de los niveles de sulfuro en el sedimento o el agua pueden afectar negativamente la fotosíntesis de los pastos marinos (Holmer y Bondgaard 2001). Por ejemplo, se ha demostrado que concentraciones entre 50 y 100 μM de sulfuro en el agua, reduce tres veces las tasas fotosintéticas en Zostera marina (Holmer y Bondgaard 2001). Por otra parte, este estudio demostró que las concentraciones de sulfuro por arriba de 100 μM detienen toda la actividad fotosintética en este pasto marino. También se observó que en condiciones de hipoxia y presencia de sulfuro en la columna de agua existe una reducción de las tasas de crecimiento en los pastos marinos (Holmer y Bondgaard 2001). Por otra parte, numerosos estudios relacionan las altas concentraciones de sulfuro en el sedimento con eventos de muerte y, por consecuencia, la disminución en la distribución de pastos marinos (Carlson et al. 1994). Estos estudios sugieren que el sulfuro no inicia el evento de muerte en los pastos, sino que actúa sinérgicamente con otros factores de estrés tales como la reducción de la luz, la anoxia, hipersalinidad o las altas temperaturas (Carlson et al. 1994).
Las lagunas costeras están expuestas a periodos de aumento de la temperatura, la anoxia, la salinidad y/o reducción de la luz causada por la resuspensión de sedimentos o el crecimiento del fitoplancton en los sistemas eutróficos. Estas condiciones pueden producir una disminución del oxígeno interno de Z. marina, permitiendo la intrusión de sulfuro (Pedersen et al. 2004). De este modo, las praderas de Z. marina en las lagunas costeras de poca profundidad son más vulnerables a la intrusión de sulfuro y a los posibles eventos de muerte. Zostera marina es la vegetación acuática sumergida dominante en las lagunas costeras de Baja California (México) donde se ha encontrado la presencia de anoxia y altos niveles de sulfuro. Si bien una reducción de las praderas de Z. marina en las lagunas costeras de Baja California se ha asociado a la disminución de los niveles de luz (Cabello-Pasini et al. 2002, 2003), también es posible que los altos niveles de sulfuro en el sedimento y agua de mar podrían regular la disminución en el metabolismo fotosintético y respiratorio de los pastos marinos en estas lagunas; sin embargo, esto aún se desconoce. En consecuencia, el objetivo de este estudio fue evaluar el efecto de sulfuro en la fotosíntesis y la respiración de la fanerógama marina Z. marina. Este estudio describe el mecanismo básico de la tolerancia fotosintética de Z. marina al sulfuro en una laguna costera fuertemente impactada por la acuicultura de ostión.
Materiales y métodos
Haces de Z. marina fueron recolectados en Bahía San Quintín (30°30' N, 116°01' O) y transportados en hieleras con agua de mar a las instalaciones del laboratorio en Ensenada, Baja California, México. Los haces se trasplantaron en contenedores de 2 L y se colocaron en tanques de 1.2 m3 con un flujo de agua de mar (aproximadamente 1 vol d-1). La temperatura del agua fluctuó entre 19 y 2 °C y la salinidad se mantuvo constante a 35 durante todo el periodo experimental. Los niveles de irradiancia y el fotoperiodo también se determinaron durante el estudio.
Fotosíntesis y respiración
Las tasas máximas de fotosíntesis en las hojas de Z. marina fueron evaluadas mediante la evolución de oxígeno determinada polarograficamente. Aproximadamente 0.1 g de tejido (n = 6) de la hoja #2 (hoja más joven = # 1) se incubó en agua de mar filtrada (0.45 |am, 2.1 μM DIC) a 20 °C en cámaras de 5 mL con doble pared conectadas a un termocirculador. Las tasas máximas de fotosíntesis (Pmax) se determinaron después de irradiar las muestra con luz para llegar a la saturación fotosintética (300 mol quanta m-2 s-1, Ek = 96 ± 12 |amol quanta m-2 s-1). Lámparas halógenas de cuarzo (300 W) fueron utilizadas como fuente de luz.
El rendimiento cuántico óptimo (Fv/Fm) del aparato fotosintético se determinó mediante la medición de la fluorescencia de la clorofila in vivo con un fluorómetro de pulso de amplitud modulada (PAM-210, Walz, Effeltrich, Alemania). La fluorescencia intrínseca (Fo) se determinó en la hoja #2 después de mantener el tejido (aproximadamente 3 cm) en la oscuridad durante 1-2 h al pH experimental. Un pulso de saturación de luz actínica (3000 μmol fotones m-2 s-1, 800 ms) se aplicó para obtener la fluorescencia máxima (Fm) en las muestras aclimatadas a la obscuridad. La fluorescencia variable (Fv) se determinó como la diferencia entre Fm y Fo, y el desempeño óptimo cuántico fue calculado como la razón de Fv/Fm (Schreiber et al. 1994).
Diseño experimental
El efecto del pH y la concentración de sulfuro en la razón fotosintética Fv/Fm se evaluó incubando tejido de la hoja de Z. marina en agua de mar filtrada con sulfuro (en un intervalo de 0 (control) a 1000 μM) a pH 6 y pH 8 en oscuridad. El rendimiento cuántico óptimo fue evaluado como se describió anteriormente cada 20 min por 135 min (n = 3). Después del periodo de incubación, el tejido foliar se lavó varias veces en agua de mar libre de sulfuro y en la oscuridad. Después del tratamiento de sulfuro, se evaluó la recuperación de Fv/Fm incubando el tejido en agua de mar libre de sulfuro, en la oscuridad y al mismo pH del tratamiento durante 24 h.
El efecto de la anoxia y de la concentración de sulfuro (25 μM de sulfuro) en la fotosíntesis se evaluó mediante la incubación de tejido de la parte media de la hoja #2 en agua de mar libre de oxígeno a pH 6 y pH 8 en la oscuridad. Como se demostró polarograficamente en experimentos anteriores, el agua de mar libre de oxígeno se obtuvo por burbujeo con nitrógeno durante 10 min. El rendimiento óptico cuántico en el tejido de la hoja (n = 7) se evaluó cada hora durante 3 h como se ha descrito anteriormente. La recuperación de Fv/Fm después del tratamiento de sulfuro se evaluó incubando el tejido en agua de mar libre de sulfuro al mismo pH del tratamiento en condiciones anóxicas y en la oscuridad. La recuperación de Fv/Fm se evaluó durante 24 h.
El efecto de la concentración de sulfuro sobre la evolución máxima de oxígeno (Pmax) y la respiración se evaluó mediante la incubación de los haces de pasto marino (n = 5) en agua de mar filtrada con sulfuro (0 [control] a 1000 μM) durante 24 h en agua de mar a pH 6 y pH 8. Los haces se incubaron a 20 °C, con una irradiancia de 100 μmol photon m-2 s-1 y con burbujeo ligero para mantener la circulación del agua. Después del periodo de incubación, la fotosíntesis máxima y la respiración se determinaron a partir de aproximadamente 0.1 g de tejido tomado de la mitad de la segunda hoja como se describió anteriormente.
Análisis estadístico
La diferencia en Fv/Fm, Pmax y la respiración de las hojas en función de la concentración de sulfuro fueron evaluados mediante un análisis de la varianza después de la prueba de normalidad y homocedasticidad de los datos (Sokal y Rohlf 1995). Todas las comparaciones múltiples por pares se llevaron a cabo con la prueba de Tukey. Los niveles mínimos de significancia se establecieron en P < 0.05.
Resultados
Se observaron diferencias significativas en Fv/Fm cuando los haces se incubaron a diferentes concentraciones de sulfato y entre los tratamientos de pH (fig. 1). En haces incubados a pH 6, el rendimiento cuántico óptimo se redujo linealmente (P < 0.05) a valores inferiores a 0.3 en 90 min, y cuando los haces se incubaron a concentraciones de 1000 μM de sulfuro, los valores disminuyeron (P < 0.05) a 0.196 en 15 min. Los haces incubados con sulfuro a pH 6 no mostraron ninguna recuperación después de incubarse durante 24 h en agua de mar libre de sulfuro. Por el contrario, los haces incubados a pH 8 y 50 μM de sulfuro no mostraron una disminución significativa en los valores de Fv/Fm(P > 0.05). A pH 8, se produjo una disminución del 25% (P < 0.05) en los valores de Fv/Fm cuando los haces se incubaron a concentraciones mayores que 50 μM de sulfuro. No se presentó recuperación de los valores de Fv/Fm cuando los haces se incubaron a pH 8 y a concentraciones de sulfuro de 250 mM o más.

Los haces que se incubaron a pH 6 y 10 μM de sulfuro no mostraron una disminución en los valores de Fv/Fm (P > 0.05) con respecto al control; sin embargo, se presentó una reducción del 22% (P < 0.05) en los valores de Fv/Fm, en relación con los controles, cuando los haces se incubaron a 25 μM (fig. 2). No hubo recuperación en los valores de Fv/Fm después de que los haces fueron incubados durante 24 h en agua de mar libre de sulfuro. En contraste con los haces incubados a pH 6, los haces incubados a pH 8 no mostraron una disminución significativa (P > 0.05) en los valores de Fv/Fm relativo a los observados en los controles cuando se incubaron a 10 ó 25 μM de sulfuro.
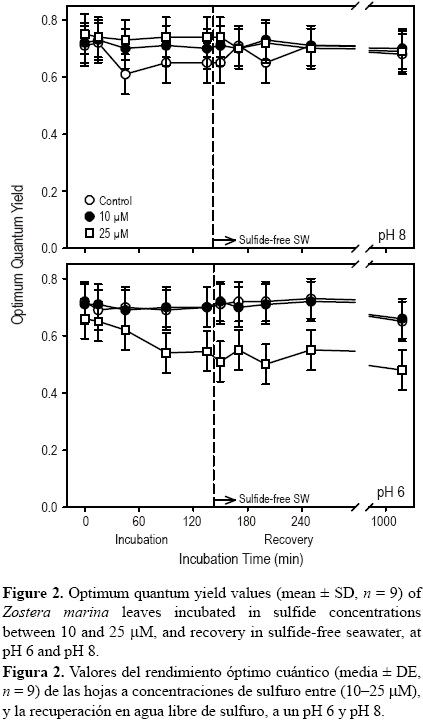
Los valores del rendimiento cuántico óptimo en los haces de Z. marina incubados a 25 μM de sulfuro varió con respecto a la concentración de oxígeno en el medio (fig. 3). A pH 6 y 8, hubo una disminución significativa (P < 0.05) en los valores de Fv/Fm en las hojas de Z. marina después de que los haces se incubaron en condiciones de anoxia a una concentración de 25 μM de sulfuro. En contraste, los haces incubados en condiciones óxicas (control) no mostraron ninguna disminución en los valores de Fv/Fm. Algunos valores del rendimiento cuántico óptimo no se recuperaron en los haces que se incubaron durante 20 h a un pH de 6. En contraste, hubo una recuperación del 60% en los valores de Fv/Fm cuando los haces se incubaron a pH 8.

La máxima evolución de oxígeno a luz de saturación (Pmax) y la respiración en las hojas de Z. marina mostraron una respuesta diferencial como resultado del pH y la concentración de sulfuro del agua de mar (fig. 4). A un pH de 6, los valores de Pmax en las hojas disminuyeron de tres veces (P < 0.05) durante el aumento en la concentración de sulfuro de 0 a 250 μM. Por el contrario, a un pH de 8, los valores de Pmax se mantuvieron constantes (P > 0.05) en todas las concentraciones de sulfuro. La respiración en las hojas de Z. marina no fluctuó (P > 0.05) como función del aumento en las concentraciones de sulfuro o en función del pH del agua de mar.

Discusión
El efecto de la alta concentración de sulfuro del agua de poro en el crecimiento y supervivencia de algas marinas ha sido documentado en numerosos de estudios (Carlson et al. 1994, Borum et al. 2005, Calleja et al. 2007). Las praderas marinas por lo general crecen en ambientes con alta reducción en los sedimentos. Bajo condiciones de anoxia, sulfuro de hidrógeno (ácido sulfhídrico) puede acumularse como un producto final de la respiración anaerobia a niveles que pueden ser tóxicos para halófitas. En este estudio demostramos que Fv/Fm en Z. marina se vió afectado negativamente por las altas concentraciones sulfúricas y los bajos niveles de oxígeno. Además, se demuestra que el pH del agua de mar desempeña un papel crítico que controla la especiación de los sulfuros y que finalmente impacta el metabolismo foto-sintético y respiratorio en las hojas de Z. marina.
Se ha demostrado que el sulfuro es fitotóxico y en consecuencia puede afectar los procesos metabólicos que pueden reducir el crecimiento y la supervivencia de autótrofos marinos. Las fuentes de sulfuro están determinas por el pH del agua de mar, donde la mayoría se encuentra como H2S (pK1 = 6.9) y HS (pK2 = 11.9). Esto indica que la relación de H2S: HS es de aproximadamente 50% a pH 7; sin embargo, a pH 6 los niveles de sulfuro se incrementan a aproximadamente 90%, mientras que a pH 8 se reduce a aproximadamente 10%. El pH del agua de mar en las lagunas costeras de Baja California oscila entre 7 y 8 (Álvarez-Borrego et al. 1975); sin embargo, los niveles de pH podrían caer por debajo de 7 en la interfaz sedimento-agua por la liberación del agua de poro fuera del sedimento. Bajo estas circunstancias, la concentración de sulfuro puede fluctuar ampliamente y afectar la fisiología de las plantas.
Las praderas marinas suelen mostrar valores de Fm/Fm de alrededor de 0.7 (Durako y Kunzelman 2002), y una reducción de estos valores suele indicar algún tipo de estrés foto-químico. En este estudio, los haces de Z. marina que se incubaron a niveles de sulfuro por encima de 25 y pH 6 mostraron una reducción en los valores de Fv/Fm. A este pH la especie dominante es el sulfuro y probablemente es responsable de reducir el potencial fotosintético. La fotosíntesis oxigénica se basa en el flujo de electrones a través de la luz mediado por el fotosistema II (PSII) y PSI. La repoblación de los electrones en los centros de reacción PSII se reduce en presencia de sulfuro, que finalmente inhibe la fotosíntesis oxigénica en el sitio donante de PSII (Miller y Bebout 2004). Estudios anteriores también han encontrado una reducción de Fv/Fm en Thalassia testudinum cuando se incubaron en presencia de sulfuro (Goodman et al. 1995, Koch et al. 2007). El aumento en las temperaturas y los niveles bajos de oxígeno en la columna de agua parecen agravar los efectos de sulfuro sobre el metabolismo fotosintético. Por ejemplo, los valores de Pmax se redujeron 40% después de que los haces de pasto marino se incubaron en concentraciones de sulfuro de entre 50 y 100 |j.M (Holmer y Bondgaard 2001). El mismo tejido mostró una reducción del 80% cuando la concentración de sulfuro se presentó en un intervalo de 100 a 1000 μM en condiciones de hipoxia.
La vida media de la reacción espontánea entre el sulfuro y el oxígeno es del orden de 1 h (Almgren y Hagstróm 1974). Así, aunque el tejido se enjuagó varias veces después de la incubación en sulfuro, la mayor captación de oxígeno observado en el experimento a pH 8 podría estar relacionada con los procesos de oxidación de sulfuro que tienen lugar dentro de las hojas. A pH 6, el consumo de oxígeno se redujo en todos los tratamientos, incluyendo el control, lo que indica un factor distinto al sulfuro que afectó las tasas de consumo de oxígeno. La razón por la cual el incremento en el consumo de oxígeno que se presentó en el tratamiento a pH 8 no se observó en el de pH 6 podría ser la tasa inicial específica de la oxidación de los sulfuros, la cual es dependiente del pH. En soluciones ácidas (pH < 6) la tasa es muy lenta, lo que aumenta a un máximo en torno a un pH 8 (Chen y Morris 1972).
Nuestros experimentos muestran un efecto perjudicial del sulfuro en la capacidad fotosintética de las hojas de Z. marina. Noventa minutos de exposición a concentraciones de sulfuro de 250 y 1000 μM (a pH 8) redujo la razón Fv/Fm en un 32% y 35%, respectivamente. Cuando las incubaciones a las mismas concentraciones de sulfuro se ensayaron a un pH 6, la reducción de Fv/Fm fue mayor y más rápida, ya que la proporción de sulfuro como H2S total es nueve veces mayor. La reducción en los valores de Pmax como resultado de altos niveles de sulfuro, finalmente se refleja en una reducción de las tasas de crecimiento de los haces.
Zostera marina es el autótrofo más importante en la bahía de San Quintín, donde cubre aproximadamente el 40% de la superficie de la bahía (Ward et al. 2004). Por otro lado, el cultivo de moluscos es una de las actividades más importantes en la bahía de San Quintín, donde se cultivan los ostiones con los sistemas de bastidores (Aguirre-Muñoz et al. 2001). Praderas de pastos marinos por debajo de estos bastidores se han reducido significativamente (obs. pers.) y se ha atribuido a una disminución de la luz debido a la sombra de los bastidores o un aumento de materia orgánica producida por las heces de ostras. Por otro lado, el aumento de materia orgánica directamente debajo de bastidores de ostras es responsable del aumento en la concentración de sulfuro debido a la reducción de la materia orgánica (Ito e Imai 1955). Así, es posible que la disminución de Z. marina bajo los bastidores podría ser el resultado de niveles crecientes de sulfuro que a su vez disminuyen la fotosíntesis de los pastos marinos, y esto eventualmente resulta en su descenso.
Los resultados de este estudio muestran por primera vez cómo la capacidad fotosintética no se recupera a los valores iniciales de Fv/Fm una vez que las condiciones libres de sulfuro han sido restablecidas. Noventa minutos de exposición a una concentración de sulfuro de 250 μM redujo en un 32% la capacidad fotosintética de pastos marinos a un pH 8, cuando el H2S es un 10% de la concentración del sulfuro. Concentraciones de hasta 325 μM se han medido en el interior del tejido meristemático de pastos marinos (Pedersen et al. 2004). Este hallazgo pone de relieve los posibles efectos a largo plazo de eventos de intrusión de sulfuro en Z. marina, eventos en que, por diferentes combinaciones de factores de estrés, el sulfuro de hidrógeno llega al tejido fotosintético y puede causar daño permanente a la actividad fotosintética de la planta. Los bajos niveles de fotosíntesis podrían reducir la capacidad de oxidación de la planta, por lo que es propensa a nuevos eventos de intrusión de sulfuro. Esta hipótesis está de acuerdo con las observaciones que sugieren que el sulfuro juega un papel en los eventos de mortandad de T. testudinum (Borum et al. 2005, Koch et al. 2007).
Agradecimientos
La primera autora fue apoyada en México por una beca Erasmus Mundus.
References
Aguirre-Muñoz A, Buddemeir R, Camacho-Ibar VF, Carriquiry JD, Ibarra Obando SE, Massey B, Smith S, Wulff F. 2001. Sustainability of coastal resource use in San Quintín, Mexico. Amibo 30: 142-149. [ Links ]
Allam AI, Hollis JP. 1972. Sulfide inhibition of oxidases in riceroots. Phytopathology 62: 634-639. [ Links ]
Almgren T, Hagstróm I. 1974. The oxidation rate of sulphide in sea water. Water Res. 8: 395-400. [ Links ]
Álvarez-Borrego S, Ballesteros-Grijalva G, Chee-Barragán A. 1975. Estudio de algunas variables fisicoquímicas superficiales en Bahía San Quintín, en verano, otoño e invierno. Cienc. Mar. 2: 1-9. [ Links ]
Bagarinao T. 1992. Sulfide as an environmental factor and toxicant: Tolerance and adaptation in aquatic organisms. Aquat. Toxicol. 24: 21-62. [ Links ]
Borum J, Pedersen O, Greve TM, Frankovich TA, Zieman JC, Fourqurean JW, Madden CJ. 2005. The potential role of plant oxygen and sulphide dynamics in die-off events of the tropical seagrass, Thalassia testudinum. J. Ecol. 93:148-158. [ Links ]
Cabello-Pasini A, Lara-Turrent C, Zimmerman RC. 2002. Effect of storms on photosynthesis, carbohydrate content and survival of eelgrass populations in a coastal lagoon and the adjacent open ocean. Aquat. Bot. 74: 149-164. [ Links ]
Cabello-Pasini A, Muñiz-Salazar R, Ward DH. 2003. Annual variations of biomass and photosynthesis in Zostera marina L. along the Pacific coast of Baja California, Mexico. Aquat. Bot. 76: 31-47. [ Links ]
Calleja ML, Marbá N, Duarte CM. 2007. The relationship between seagrass (Posidonia oceanica) decline and sulfide porewater concentration in carbonate sediments. Estuar. Coast. Shelf Sci. 73: 583-588. [ Links ]
Canfield DE, Thamdrup B, Hansen JW. 1993. The anaerobic degradation of organic matter in Danish coastal sediments: Iron reduction, manganese reduction, and sulfate reduction. Geochim. Cosmochim. Acta 57: 3867-3883. [ Links ]
Carlson PR, Yarbro L, Barber T. 1994. Relationship of sediment sulfide to mortality of Thalassia testudinum in Florida Bay. Bull. Mar. Sci. 54: 733-746. [ Links ]
Chen KY, Morris J. 1972. Kinetics of oxidation of aqueous sulfide by O2. Environ. Sci. Technol. 6: 529-537. [ Links ]
Durako M, Kunzelman J. 2002. Photosynthetic characteristics of Thalassia testudinum measured in situ by pulse-amplitude modulated (PAM) fluorometry: Methodological and scale-based considerations. Aquat. Bot. 73: 173-185. [ Links ]
Erskine JM, Koch M. 2000. Sulfide effects on Thalassia testudinum carbon balance and adenylate energy charge. Aquat. Bot. 67: 275-285. [ Links ]
Fenchel T, Finlay B. 1995. Ecology and Evolution in Anoxic Worlds. Oxford University Press, Oxford, UK, 288pp. [ Links ]
Goodman JL, Moore K, Dennison W. 1995. Photosynthetic responses of eelgrass (Zostera marina L.) to light and sediment sulphide in a shallow barrier island lagoon. Aquat. Bot. 50: 37-47. [ Links ]
Holmer M, Bondgaard E. 2001. Photosynthetic and growth response of eelgrass to low oxygen and high sulfide concentrations during hypoxic events. Aquat. Bot. 70: 29-38. [ Links ]
Ito S, Imai T. 1955. Ecology of oyster bed. I. On the decline of productivity due to repeated culture. Tohoku J. Agric. Res. 5: 251-268. [ Links ]
Jorgensen BB, Revsbech NP. 1983. Colorless sulfur bacteria, Beggiatoa spp. and Thiovulum spp., in O2 and H2S microgradients. Appl. Environ. Microbiol. 45: 1261-1270. [ Links ]
Koch MS, Mendelssohn IA. 1989. Sulfide as a soil phytotoxin: Differential responses in two marsh species. J. Ecol. 77: 565-578. [ Links ]
Koch MS, Mendelssohn I, McKee K. 1990. Mechanism for the hydrogen sulfide-induced growth limitation in wetland macrophytes. Limnol. Oceanogr. 35: 399-408. [ Links ]
Koch MS, Schopmeyer SA, Kyhn-Hansen C, Madden CJ. 2007. Synergistic effects of high temperature and sulfide on tropical seagrass. J. Exp. Mar. Biol. Ecol. 341: 91-101. [ Links ]
Miller SR, Bebout BM. 2004. Variation in sulfide tolerance of photosystem II in phylogenetically diverse cyanobacteria from sulfidic habitats. Appl. Environ. Microbiol. 70: 736-744. [ Links ]
Pedersen O, Binzer T, Borum J. 2004. Sulphide intrusion in eelgrass (Zostera marina L.). Plant Cell Environ. 27: 595-602. [ Links ]
Schreiber U, Bilger W, Neubauer C. 1994. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis. In: Schulze E, Caldwell M (eds.), Ecophysiology of Photosynthesis. Springer, Berlin, pp. 49-70. [ Links ]
Sokal RR, Rohlf FJ. 1995. Biometry. WH Freeman, New York, 887 pp. [ Links ]
Ward DH, Tibbitts T, Morton A, Carrera-González E, Kempka R. 2004. Use of airborne remote sensing techniques to assess seagrass distribution in San Quintín Bay, Baja California, Mexico. Cienc. Mar. 30: 47-60. [ Links ]














