Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.4 Ensenada dic. 2012
https://doi.org/10.7773/cm.v38i4.2079
Estudio a largo plazo del ciclo de vida y crecimiento de Heleobia australis (Caenogastropoda, Cochliopidae) en el estuario de Bahía Blanca, Argentina
Long-term study of the life cycle and growth of Heleobia australis (Caenogastropoda, Cochliopidae) in the Bahía Blanca estuary, Argentina
MC Carcedo1*, SM Fiori1,2
1 Instituto Argentino de Oceanografía, PO Box 804, Florida 8000 CCT-BB(El) (8000) Bahía Blanca, Argentina. * Corresponding author. E-mail: ccarcedo@iado-conicet.gob.ar
2 Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur, San Juan 670, Primer Piso (8000) Bahía Blanca, Argentina.
Received November 2011,
received in revised form July 2012,
accepted July 2012.
RESUMEN
El crecimiento y ciclo de vida del caracol Heleobia australis fue estudiado en el estuario de Bahía Blanca (39° S, Argentina) de abril de 2008 a abril de 2010. Cuatro clases de edad fueron identificadas. Esta especie recluta una vez al año, durante el verano. En general, los reclutas (< 2.5 mm) representan un pequeño porcentaje de la población total. La tasa de crecimiento de H. australis declinó con el incremento del tamaño del animal y mostró un marcado patrón estacional: baja tasa de crecimiento durante el invierno y alta tasa de crecimiento durante el verano. Se estimó un ciclo de vida de aproximadamente 30 meses (~2.5 años) para la población de H. australis en el estuario de Bahía Blanca. Esta población mostró variaciones en las tasas de crecimiento, la abundancia de reclutas y el tamaño de la conchilla en relación con las poblaciones localizadas al norte. Varios factores como parasitismo, depredación, características ambientales y la acción antropogénica pueden estar interactuando para producir las diferencias observadas. Este trabajo constituye el primer estudio a largo plazo del ciclo de vida de cocliópidos. Heleobia australis parece ser una especie longeva y muestra variaciones en su ciclo de vida que parecen estar influenciadas por variables físicas y biológicas. Estudios a largo plazo que incluyan interacciones biológicas y características espaciales de los microhábitats son necesarios para dilucidar patrones en la historia de vida de H. australis a lo largo de su inervalo de distribución.
Palabras clave: estuario de Bahía Blanca, Cochliopidae, crecimiento, tamaño de la conchilla.
ABSTRACT
The life cycle and growth of the mud-snail Heleobia australis was studied in the Bahía Blanca estuary (Argentina) from April 2008 to April 2010. Four age classes were identified. This species recruits once a year, during summer. In general, the recruits (<2.5 mm) represented a small percentage of the total population. The growth rate of H. australis declined with increasing animal size and showed a marked seasonal pattern for the population under study: lower rate during winter and higher rate in summer. A life cycle of approximately 30 months (~2.5 years) was estimated for the population of H. australis in the Bahía Blanca estuary. This population shows variations in growth rate, abundance of recruits, and shell size in relation to more northerly populations. Several factors like parasitism, predation, environmental features, and anthropogenic action may be interacting to produce these differences. This work constitutes the first long-term study of the life cycle of cochliopids. Heleobia australis appears to be a long-lived species and exhibits variations in its life cycle that seem to be influenced by biological and physical variables. Long-term studies that include biological interactions and spatial features of the microhabitats are needed to elucidate patterns in life-history traits of H. australis along its distribution range.
Key words: Bahía Blanca estuary, Cochliopidae, growth, shell size.
Introducción
Heleobia australis (d'Orbigny 1835) es un gasterópodo intermareal característico de los ambientes protegidos de la acción directa del mar, como estuarios y lagunas costeras. Esta especie tiene una amplia distribución que se extiende desde el sureste de Brasil hasta el noreste de la Patagonia, Argentina (22°-64° S) (Gaillard y Castellanos 1976, Aguirre y Farinati 2000). Se encuentra asociada con condiciones hiperhalinas y mixohalinas (Aguirre y Farinati 2000, Aguirre y Urrutia 2002, De Francesco e Isla 2003, Canepuccia et al. 2007) y domina, en términos de abundancia y biomasa, la comunidad macrobentónica de estuarios y lagunas costeras (Gongalves et al. 1998, Carcedo y Fiori 2011). Esta especie constituye un eslabon importante en las redes tróficas costeras, ya que constituye un ítem alimenticio de peces y crustáceos de interés comercial (Figueiredo-Barros et al. 2006).
Varios autores han estudiado a los caracoles hidróbidos. Tanto en áreas templadas como tropicales, han demostrado alteraciones en la estructura y dinámica poblacional, ciclo de vida, producción, morfología, reproducción y crecimiento en respuesta a cambios en los factores bióticos y abióticos en los ecosistemas acuáticos costeros (Fenchel 1975, Britton 1985, Coosen et al. 1994, Gongalves et al. 1998, Grudemo y Bohlin 2000, Cardoso et al. 2002). Recientemente, H. australis ha generado un gran interés debido a su uso potencial como bioindicador o especie centinela.
Heleobia australis es el único caracol hidróbido que habita el estuario de Bahía Blanca (Elías et al. 2004) y representa una de las especies más abundantes de las planicies y marismas intermareales en este ecosistema (Carcedo y Fiori 2011), altamente impactado por el desarrollo de diversas y complejas actividades humanas (descarga de aguas residuales, actividades de dragado, circulación de grandes naves comerciales, etc.). Sin embargo, pocos estudios se han focalizado en esta especie en el estuario de Bahía Blanca. El trabajo de Canepuccia et al. (2007) aborda ciertos aspectos ecológicos de H. australis y constituye una importante referencia para el mismo sitio. No hay trabajos publicados sobre la dinámica poblacional o los rasgos de la historia de vida de esta especie para el área de estudio. El objetivo del presente estudio es estimar el número de temporadas de reproducción, el ciclo de vida y los parámetros de crecimiento de la población de H. australis en el estuario de Bahía Blanca y compararlos con parámetros de otras poblaciones situadas a lo largo de su distribución.
Materiales y métodos
El estudio se llevó a cabo en el estuario de Bahía Blanca, un amplio complejo de humedales costeros en la zona templada de América del Sur, que comprende una superficie de 2300 km2 que incluye aproximadamente 410 km2 de marismas y más de 1150 km2 de planicies de marea (Perillo et al. 2001, Isacch et al. 2006). El extremo norte del estuario es estrecho y la boca es más ancha y abre a la costa sur-occidental del Atlántico. El muestreo se llevó a cabo en Villa del Mar (38°51'25'' S, 62°06'59'' O), una marisma costera dominada por Spartina alterniflora dentro de la porción media del estuario de Bahía Blanca (fig. 1). En este ambiente costero, el intervalo medio de mareas varía de 2.0 a 2.5 m y la altura media de las olas es 5-30 cm. La concentración de salinidad fluctúa a lo largo del año, desde un mínimo de 22.8 a un máximo de 41.0 en verano (Piccolo y Perillo 1990, Perillo et al. 2001). La temperatura media del aire oscila entre 5.2 y 28.4 °C. La media anual de la temperatura de la superficie del agua es de 15.3 °C, y varía de 23.6 °C en verano a 7.6 °C en invierno (Vitale 2010).
El muestreo se llevó a cabo desde abril de 2008 hasta abril de 2010. Un sitio de muestreo de 1 ha con planicies de marea, marismas y afloramientos rocosos fue seleccionado por su accesibilidad desde la costa. En esta área, cada dos meses, doce muestras fueron recolectadas al azar con un núcleo de PVC (10 cm de diámetro, 5 cm de profundidad) en la franja intermareal durante marea baja. Cada muestra fue guardada en una bolsa plástica y llevada al laboratorio, donde fue lavada y tamizada a través de una malla de 0.5 mm. Posteriormente, los especímenes de H. australis fueron preservados en etanol al 70%. Los caracoles fueron medidos bajo un microscopio estereoscópico (N = 9606). La longitud total de la conchilla (la distancia desde el ápex hasta el margen anterior de la apertura) fue usado como un estimador de la talla. Los datos obtenidos fueron utilizados para construir gráficos de distribución de frecuencia de tallas (DFT). Para reconocer grupos de edad dominantes, los DFT fueron analizados con el método de Bhattacharya (software FISAT II), que separa distribuciones normales en una mezcla de distribuciones de frecuencia de tallas. Este método permite estimar las tallas medias, desviaciones estándar y los tamaños poblacionales para cada grupo de edad identificado (Gayanilo et al. 1995). Los resultados se emplearon para separar cohortes y seguir el crecimiento de cada cohorte en específico. El patrón de crecimiento se determinó por análisis gráfico de la progresión de los componentes detectados en las sucesivas distribuciones de frecuencia de tallas. Los parámetros de crecimiento fueron descritos mediante la forma estacional del modelo de von Bertalanffy (Hoenig y Hanumara 1982, Somers 1988):
Lt = LINF (1 - e - k [(t - t0) + T1 - T2]).
T1 = C sin (2π (t - ts))/2π
T2 = C sin (2π (t0 - ts))/2π
donde LINF es el tamaño asintótico (mm), k es la constante de crecimiento anual, t es la edad (años), t0 es la edad a tamaño cero, C es un parámetro que refleja la intensidad de la oscilación del crecimiento estacional yts es el momento de inicio de la oscilación sinusoidal del crecimiento. El punto invernal o, del inglés, Winter Point (WP = ts + 0.5) indica el periodo del año donde el crecimiento es más lento. Los modelos de crecimiento se ajustaron a los datos utilizando el método de máxima verosimilitud.
Resultados
Las distribuciones de frecuencia de tallas de H. australis se ajustaron a una distribución polimodal (fig. 2). Cuatro clases de edad fueron identificadas a lo largo de dos años de estudio: cohortes I (2007), II (2008), III (2009) y IV (2010) (fig. 3). Las cohortes II y III fueron seguidas desde su reclutamiento hasta el final del periodo de estudio (24 y 14 meses, respectivamente), y alcanzaron una talla promedio de 5.01 ± 0.48 y 3.57 ± 0.49 mm, respectivamente. A su vez, en 2010, fue posible identificar el reclutamiento de la cohorte IV.

Con base en estas observaciones, se puede deducir que H. australis recluta una vez al año y se supone que la clase modal detectada en abril de 2008 (4.42 ± 0.48 mm) pertenece a un reclutamiento ocurrido en 2007. En general, los reclutas (< 2.5 mm) representan un pequeño porcentaje de la abundancia total (2-12%). El tamaño máximo de la conchilla fue de 7.39 mm, mientras que el mínimo fue de 1.25 mm. El tamaño de caracoles jóvenes de entre 1.25 y 3.5 mm correspondió a ejemplares de entre 3 y 4 espiras. El tamaño de caracoles adultos de entre 3.5 y 7.39 mm correspondió a ejemplares de entre 5 y 6 espiras.
Durante el otoño tardío-invierno (abril a agosto de 2008), las tasas de crecimiento de las cohortes I y II fueron en promedio de 0.03 y 0.07 mm mes-1, respectivamente. Durante primavera-verano (octubre a diciembre de 2008), las tasas de crecimiento de las cohortes I y II aumentaron a 0.09 y 0.16 mm mes-1, respectivamente. Durante el verano tardío (febrero a abril de 2009), las cohortes I y II crecieron a una tasa similar al periodo previo, y los reclutas de la cohorte III crecieron a 0.34 mm mes-1. En invierno (junio a agosto de 2009), las tasas de crecimiento decrecen para las tres cohortes: 0.06 mm mes-1 para la cohorte I, 0.10 mm mes-1 para la cohorte II y 0.03 mm mes-1 para la cohorte III. Finalmente, durante primavera-otoño (octubre de 2009 a abril de 2010), el crecimiento cesa en la cohorte I debido a la mortalidad y la tasa de crecimiento incrementó para las otras cohortes: 0.08 mm mes-1 para la cohorte II y 0.06 mm mes-1 para la cohorte III. En abril de 2010 una nueva cohorte se encontró creciendo a una tasa de 0.22 mm mes-1.
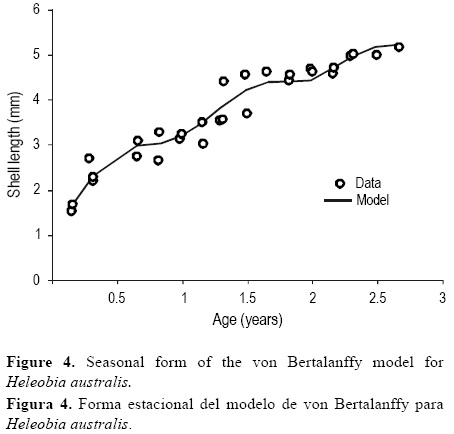
Los parámetros de crecimiento estimados a partir del modelo de von Bertalanffy fueron los siguientes: L1NP = 7.7 mm y k = 0.41 año-1. El parámetro de intensidad de oscilación en el crecimiento fue C = 0.86, que indica que el crecimiento incrementó hasta un 86% durante el verano. El momento del año cuando el crecimiento fue más lento fue a mediados de septiembre (WP = 0.77). Esta información nos permite estimar un ciclo de vida de al menos 30 meses (~2.5 años) para la población de H. australis en el estuario de Bahía Blanca (fig. 4).
Discusión
La población de H. australis muestra un marcado patrón estacional en el crecimiento: baja tasa de crecimiento durante la temporada fría (crecimiento mínimo en septiembre) y alta tasa de crecimiento durante la temporada cálida. Esto es similar al patrón estacional descrito por De Francesco e Isla (2004) para la población de H. australis en Mar Chiquita. Las altas variaciones intra-anuales de la temperatura, comúnmente observadas en las costas templadas del Atlántico, podrían explicar esta estacionalidad en el crecimiento.
El ciclo de vida de H. australis en el estuario de Bahía Blanca (39° S) fue de al menos 30 meses; la tasa de crecimiento declinó con el incremento del tamaño del animal. Los reclutas crecieron rápidamente durante los primeros meses de vida, y después del primer, segundo y tercer año de vida alcanzaron un tamaño promedio de la conchilla de 3, 5 y 7 mm, respectivamente. En la laguna Mar Chiquita (37° S), los reclutas alcanzaron tallas de 3 mm en alrededor de seis meses (De Francesco e Isla 2004), y en la laguna Imboassica (22° S), H. australis alcanzó tallas de 4 a 5 mm en menos de un año (Figueiredo-Barros et al. 2006). El máximo tamaño de conchilla (LINF) derivado del modelo de crecimiento de H. australis en el estuario de Bahía Blanca fue de 7.07 mm, coincidiendo con el máximo tamaño medido (7.39 mm). Este tamaño de conchilla es similar al registrado para la especie en la laguna Mar Chiquita (7.50 mm) y mayor que el registrado para la laguna Imboassica (6.5 mm). Varios factores podrían estar interactuando para producir las variaciones en la tasa de crecimiento y el tamaño de la conchilla entre diferentes poblaciones. Se ha planteado la hipótesis de que los organismos en las costas templadas alcanzan mayores tamaños, retrasando la madurez y, por lo tanto, asignando más recursos para el crecimiento somático que en las costas tropicales. Esto probablemente se deba a una disminución de la tasa metabólica, determinada por un menor consumo de oxígeno en aguas templadas (Moreau 1987, Munch y Salinas 2009). Por otra parte, Alda et al. (2010), al examinar los efectos del parasitismo y el ambiente en el tamaño de la conchilla de H. australis en el estuario de Bahía Blanca, señalaron que el tamaño de la conchilla es afectado por la prevalencia de parásitos, la presencia de depredadores, el grado de exposición a las olas y la acción antropogénica. Ellos postulan que estos factores podrían incrementar el estrés fisiológico, causando un retraso en el crecimiento somático.
La población de H. australis en el estuario de Bahía Blanca mostró un único periodo de reclutamiento, registrado durante la época estival. Esto concuerda con lo registrado para otros sitios (De Francesco e Isla 2004, Figueiredo-Barros et al. 2006), pero la abundancia de reclutas encontrada en el presente estudio fue significativamente menor. El parasitismo podría explicar estos resultados; H. australis actúa como hospedador intermediario de varias especies de digeneos, en su mayoría Microphallus simillimus (Micropha-llidae, Trematoda) (Etchegoin 1997), que pueden causar castración de los caracoles infectados (Lafferty 1993). La prevalencia total de digeneos larvarios en Villa del Mar (70.2%, Alda et al. 2010) es mayor que la registrada para Mar Chiquita (10.4%, Etchegoin 1997). La dinámica de las comunidades de digeneos y su prevalencia de infección está relacionada con la ocurrencia de aves costeras, sus hos-pedadores definitivos (Etchegoin 1997; Alda et al. 2010, 2011; Alda 2011; Etchegoin y Merlo 2011). Villa del Mar es un área muy usada por las aves costeras para alimentación, probablemente debido a la gran extensión de las planicies del intermareal y a la baja presencia humana en el área (Delhey y Petracci 2004), mientras que en Mar Chiquita, el turismo y la pesca dificultan el uso del área como sitio de alimentación y descaso para la aves costeras (Etchegoin 1997, Etchegoin y Merlo 2011). El estrés de deshidratación y la depredación podrían también regular la distribución y supervivencia de H. australis (Canepuccia et al. 2007). Carcedo y Fiori (2011) indicaron que, en Villa del Mar, los reclutas de H. australis son encontrados solo en sitios protegidas (marismas). La mayor abundancia de reclutas registrada en Mar Chiquita por De Francesco e Isla (2004) podría estar relacionada con el tipo de muestreo, ya que los caracoles fueron recolectados sólo de arrecifes del ampliamente distribuido serpúlido Picopomatus enigmaticus. La complejidad topográfica de estas estructuras biogénicas podría reducir el estrés de deshidratación y otorgar refugio ante los depredadores (Schwindt e Iribarne 2000). En este sentido, Mar Chiquita podría ser considerado como un ambiente menos estresante que Villa del Mar.
Este trabajo constituye el primer estudio a largo plazo del ciclo de vida y crecimiento de H. australis. Estudios previos fueron llevados a cabo en Argentina y Brasil durante un año; consecuentemente, no es posible saber en estos ambientes la duración de sus ciclos de vida. Heleobia australis parece ser una especie longeva que exhibe variaciones en su ciclo de vida que parecen estar influenciadas por variables biológicas y físicas. Estudios a largo plazo que incluyan las interacciones biológicas y las características espaciales de los micro-ambientes son necesarios para dilucidar patrones en la historia de vida de H. australis a lo largo de su distribución.
Agradecimientos
Los autores agradecen el soporte de la Secretaría de Ciencia y Técnica de la Universidad Nacional del Sur (PGI 24/ZB40).
References
Aguirre ML, Farinati EA. 2000. Aspectos sistemáticos, de distribución y paleoambientales de Littoridina australis (D'Orbigny 1835) (Mesogastropoda) en el Cuaternario marino de Argentina (Sudamérica). Geobios 33: 569-597. [ Links ]
Aguirre ML, Urrutia MI. 2002. Morphological variability of Littoridina australis (d'Orbigny 1835) (Hydrobiidae) in the Bonaerensian marine Holocene (Argentina). Palaeogeogr. Palaeoclimatol. Palaeoecol. 183: 1-23. [ Links ]}
Alda P. 2011. Estadios larvales de digeneos parásitos de Heleobia australis (d'Orbigny 1835) en el estuario de Bahía Blanca. PhD thesis, Universidad Nacional de La Plata, Argentina, 216 pp. [ Links ]
Alda P, Bonel N, Cazzaniga N, Martorelli S. 2010. Effects of parasitism and environment on shell size of the South American intertidal mud snail Heleobia australis (Gastropoda). Estuar. Coast. Shelf Sci. 87: 305-310. [ Links ]
Alda P, Bonel N, Cazzaniga NJ, Martorelli SR. 2011. Variación morfométrica en Heleobia australis causada por parásitos trematodes y factores ambientales. In: Cazzaniga NJ (ed.), El Género Heleobia (Caenogastropoda: Cochliopidae) en América del Sur. Amici Molluscarum (Núm. Esp.), pp. 30-32. [ Links ]
Britton RH. 1985. Life cycle and production of Hydrobia acuta Drap. (Gastropoda: Prosobranchia) in a hypersaline coastal lagoon. Hydrobiologia 122: 219-230. [ Links ]
Canepuccia AD, Escapa M, Daleo P, Alberti J, Botto F, Iribarne OO. 2007. Positive interactions of the smooth cordgrass Spartina alterniflora on the mud snail Heleobia australis, in south-western Atlantic salt marshes. J. Exp. Mar. Biol. Ecol. 353:180-190. [ Links ]
Carcedo MC, Fiori SM. 2011. Patrones de distribución y abundancia de Heleobia australis (Caenogastropoda: Cochliopidae) en el estuario de Bahía Blanca, Argentina In: Cazzaniga NJ (ed.), El Género Heleobia (Caenogastropoda: Cochliopidae) en América del Sur. Amici Molluscarum (Núm. Esp.), pp. 33-35. [ Links ]
Cardoso PG, Lillebo AI, Pardal MA, Ferreira SM, Marques JC. 2002. The effect of different primary producers on Hydrobia ulvae population dynamics: A case study in a temperate intertidal estuary. J. Exp. Mar. Biol. Ecol. 277: 173-195. [ Links ]
Coosen J, Seys J, Meire PM, Craeymeersch JAM. 1994. Effect of sedimentological and hydrodynamical changes in the intertidal areas of the Oosterscheld estuary (SW Netherlands) on distribution, density and biomass of five common macrobenthic species: Spio martinensis (Mesnil), Hydrobia ulvae (Pennant), Arenicola marina (L.), Scoloplos armiger (Muller) and Bathyporeia sp. Hydrobiologia 282/283: 235-249. [ Links ]
De Francesco CG, Isla FI. 2003. Distribution and abundance of hydrobiid snails in a mixed estuary and a coastal lagoon, Argentina. Estuaries 26: 790-797. [ Links ]
De Francesco CG, Isla FI. 2004. The life cycle and growth of Heleobia australis (d'Orbigny 1835) and H. conexa (Gaillard, 1974) (Gastropoda: Rissooidea) in Mar Chiquita coastal lagoon (Argentina). J. Molluscan Stud. 70: 173-178. [ Links ]
Delhey K, Petracci P. 2004. Aves marinas y costeras. In: Piccolo MC, Hoffmeyer MS (eds.), Ecosistema del Estuario de Bahía Blanca. Instituto Argentino de Oceanografía, Bahía Blanca, Argentina, pp. 203-220. [ Links ]
Elías R, Iribarne O, Bremec CS, Martínez DE. 2004. Comunidades bentónicas de fondos blandos. In: Piccolo MC, Hoffmeyer MS (eds.), Ecosistema del Estuario de Bahía Blanca. Instituto Argentino de Oceanografía, Bahía Blanca, Argentina, pp. 179-190. [ Links ]
Etchegoin JA. 1997. Sistemas parasitarios presentes en la albufera Mar Chiquita. PhD thesis, Universidad Nacional de Mar del Plata, Argentina, 244 pp. [ Links ]
Etchegoin JA, Merlo MJ. 2011. Heleobia conexa y H. australis como bioindicadores de fauna y de fluctuaciones ambientales en la laguna Mar Chiquita (Buenos Aires, Argentina). In: Cazzaniga NJ (ed.), El Género Heleobia (Caenogastropoda: Cochliopidae) en América del Sur. Amici Molluscarum (Núm. Esp.), pp. 33-35. [ Links ]
Fenchel T. 1975. Factors determining the distribution patterns of mudsnails (Hydrobiidae). Oecologia 20: 1-18. [ Links ]
Figueiredo-Barros MP, Leal JJF, Esteves F De A, Rocha A De M, Bozelli RL. 2006. Life cycle, secondary production and nutrient stock in Heleobia australis (d'Orbigny 1835) (Gastropoda: Hydrobiidae) in a tropical coastal lagoon. Estuar. Coast. Shelf Sci. 69: 87-95. [ Links ]
Gaillard MC, Castellanos ZA. 1976. Mollusca Gasteropoda Hydrobiidae. In: Ringuelet RA (ed.), Fauna de Agua Dulce de la República Argentina. FECIC, Buenos Aires, 15: 1-10. [ Links ]
Gayanilo Jr. FC, Sparre P, Pauly D. 1995. The FAO-ICLARM Stocks Assessment Tools (FiSAT). User's Guide. FAO Computerized Information Series (Fisheries) 8, Rome, 186 pp. [ Links ]
Goncalves Jr. JF, Fonseca JJL, Callisto MFP. 1998. Population dynamic of Heleobia australis (Gastropoda) in a coastal lagoon (Rio de Janeiro, Brazil). Verh. Int. Ver. Limnol. 26: 2056-2057. [ Links ]
Grudemo J, Bohlin T. 2000. Effects of sediment type and intra and interspecific competition on growth rate of the marine snails Hydrobia ulvae and Hydrobia ventrosa. J. Exp. Mar. Biol. Ecol. 253: 115-127. [ Links ]
Hoenig N, Hanumara RC. 1982. A statistical study of a seasonal growth model for fishes. Technical Reports, Department of Computer Science and Statistics, University of Rhode Island, 91 pp. [ Links ]
Isacch JP, Costa CSB, Rodríguez-Gallego L, Conde D, Escapa M, Gagliardini DA, Iribarne OO. 2006. Distribution of saltmarsh plant communities associated with environmental factors along a latitudinal gradient on the south-west Atlantic coast. J. Biogeogr. 33: 888-900. [ Links ]
Lafferty KD. 1993. The marine snail, Cerithidea californica, matures at smaller sizes where parasitism is high. Oikos 68: 3-11. [ Links ]
Moreau J. 1987. Mathematical and biological expression of growth in fishes: Recent trends and further developments. In: Summer-Felt RC, Hall GE. (eds.), Age and Growth of Fish. Iowa State University Press, Ames, Iowa, pp. 81-113. [ Links ]
Munch SB, Salinas S. 2009. Latitudinal variation in lifespan within species is explained by the metabolic theory of ecology. Proc. Natl. Acad. Sci. 106: 13860-13864. [ Links ]
Perillo GME, Piccolo MC, Parodi E, Freije RH. 2001. The Bahía Blanca estuary, Argentina. In: Seeliger U, Kjerfve B (eds.), Coastal Marine Ecosystems of Latin America. Ecological Studies 144. Springer-Verlag, Berlin, pp. 205-217. [ Links ]
Piccolo MC, Perillo GM. 1990. Physical characteristics of the Bahía Blanca estuary (Argentina). Estuar. Coast. Shelf Sci. 31: 303-317. [ Links ]
Schwindt E, Iribarne OO. 2000. Settlement sites, survival and effects on benthos of an introduced reef-building polychaete in a SW Atlantic coastal lagoon. Bull. Mar. Sci. 67: 73-82. [ Links ]
Somers IF. 1988. On a seasonally-oscillating growth function. Fishbyte 6: 8-11. [ Links ]
Vitale AJ. 2010. Modelado y simulación del balance energético en marismas. PhD thesis, Universidad Nacional del Sur, Bahía Blanca, Argentina, 341 pp. [ Links ]














