Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.3 Ensenada sep. 2012
https://doi.org/10.7773/cm.v38i3.2066
Variabilidad de la abundancia relativa y talla promedio del pez vela Istiophorus platypterus capturado por la flota artesanal en el golfo de Tehuantepec, México
Variation in relative abundance and mean size of the sailfish Istiophorus platypterus caught by the artisanal fleet in the Gulf of Tehuantepec, Mexico
G Cerdenares-Ladrón de Guevara1, E Morales-Bojórquez2*, S Ramos-Carrillo1, G González-Medina1
1 Universidad del Mar, Cd. Universitaria s/n, Puerto Ángel, Municipio de San Pedro Pochutla, CP 70902, Oaxaca, México.
2 Centro de Investigaciones Biológicas del Noroeste SC, Instituto Politécnico Nacional 195, Col. Playa Palo de Santa Rita, CP 23090, La Paz, Baja California Sur, México. * Corresponding author. E-mail: emorales@cibnor.mx
Received September 2011
Received in revised form June 2012
Accepted June 2012.
RESUMEN
El pez vela Istiophorus platypterus es abundante en zonas costeras tropicales del océano Pacífico. Además de ser atractiva para la pesca deportiva, también sostiene pesquerías artesanales en México, Guatemala, Costa Rica y Panamá. El golfo de Tehuantepec se reconoce como una de las áreas de mayor abundancia de I. platypterus y en la cual se llevan a cabo capturas incidentales en la pesca comercial de pequeña escala. El objetivo del presente trabajo fue determinar la estructura de tallas y la tendencia de la captura por unidad de esfuerzo (CPUE) del pez vela capturado por la flota artesanal en el golfo de Tehuantepec durante 2000 hasta 2008. Se estimó la estructura de tallas con base en el registro de la longitud ojo-furca (LOF) y la CPUE con base en el número de organismos capturados por viaje de pesca. Los individuos presentaron un intervalo de tallas de 55 a 240 cm de LOF y un peso total de 1.6 a 69.7 kg. La estructura de tallas fue unimodal, con una variación anual en la talla promedio de 2000 a 2008, y mostró una tendencia a disminuir en la serie de tiempo (F(0.05(1),8,4967) = 6.8E + 8; P < 0.05). La CPUE de I. platypterus presentó cambios estacionales: los valores más bajos se observaron durante el periodo de enero a abril, luego incrementaron durante el verano y volvieron a decaer hacia diciembre.
Palabras clave: pesca artesanal, golfo de Tehuantepec, estructura de tallas, CPUE, Istiophorus platypterus.
ABSTRACT
The sailfish Istiophorus platypterus is abundant in tropical coastal areas of the Pacific Ocean. It is targeted by both sport-fishing and commercial (artisanal) fleets in Mexico, Guatemala, Costa Rica, and Panama. The Gulf of Tehuantepec is one of the main areas of abundance of I. platypterus, where it is caught incidentally by artisanal vessels. The objective of this study was to analyze the size structure and the variability in the catch-per-unit-effort (CPUE) of sailfish caught in the Gulf of Tehuantepec from 2000 to 2008. The size structure was analyzed using eye-fork length (EFL) and CPUE was estimated as the number of individuals per fishing trip. Individuals ranged in size from 55 to 240 cm EFL and varied in total weight from 1.6 to 69.7 kg. The size structure was unimodal, and the variability over time showed a negative tendency (F(0.05(1),8,4967) = 6.8E + 8; P < 0.05). The CPUE of I. platypterus showed seasonal changes: values were lower from January to April and higher during the summer, and then decreased again in early winter.
Key words: artisanal fishing, Gulf of Tehuantepec, size structure, CPUE, Istiophorus platypterus.
INTRODUCCIÓN
La especie Istiophorus platypterus (Shaw y Nodder 1792) es un pez vela abundante y económicamente importante en las zonas costeras ecuatoriales de los océanos Pacífico e Índico (Hoolihan 2003, Chiang et al. 2009). En el océano Pacífico Oriental Tropical sobresalió su explotación por parte de las flotas palangreras comerciales de Japón, Corea y Taiwán (Sosa-Nishizaki 1998), y en el margen occidental de América tropical se concentra su explotación por parte de las flotas deportivas que salen de las grandes ciudades costeras o los destinos turísticos. Esta especie también sostiene pesquerías artesanales de México, Guatemala, Costa Rica y Panamá (Prince et al. 2006). A pesar de su amplia distribución geográfica y su gran movilidad, se ha dificultado la obtención de información sobre sus movimientos, sus patrones de distribución y su historia de vida (Prince y Brown 1991, Uozumi 2003).
En el Atlántico, las evaluaciones de peces de pico de diversas especies se han realizado utilizando modelos de producción excedente, con base en la estandarización de la captura por unidad de esfuerzo (CPUE) y las capturas comerciales. De esta forma se encontró que todas las especies de peces de pico en el Atlántico han sido sobreexplotadas (Uozumi 2003, Die 2006). Algunos autores consideran que el pez vela está constituido por dos especies, el pez vela del Atlántico (Istiophorus albicans) y el pez vela del Indo-Pacífico (I. platypterus), pero datos genéticos son consistentes con la existencia de una sola especie con distribución pantropical (Graves 1998, Collette et al. 2006). Tomando en cuenta esto, se continuará citando a la especie como originalmente se mencionó en cada trabajo referido. Recientemente en la evaluación del pez vela del Atlántico (I. albicans), se documentó que las flotas artesanales de la costa de África (población del este) y las de la costa Atlántica de América (población del oeste) obtienen las mayores capturas de esta especie en el Atlántico (ICCAT 2010). La única información disponible relacionada con la evaluación del recurso en el Pacífico Oriental Tropical son estadísticas referentes al esfuerzo de pesca nominal y capturas de la flota palangrera de altura (Macías-Zamora et al. 2001). De esta manera se ha descrito la tendencia de índices de abundancia relativa de la CPUE nominal y la forma en que este índice de abundancia se relaciona con las condiciones oceanográficas prevalecientes (Santana-Hernández 2001).
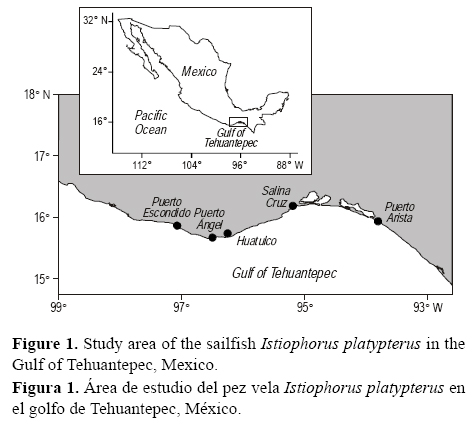
En el golfo de Tehuantepec, México (fig. 1), las actividades de la pesca deportiva son escasas, limitándose a unos cuantos torneos anuales, por lo que la información que se obtiene a partir de esta actividad no es suficiente para conocer el estado de I. platypterus. Sin embargo, existe una captura artesanal que ha permitido dar un seguimiento del recurso en esta región, permitiendo actualizar el conocimiento sobre el estado del mismo en la zona. En el presente estudio, por primera vez, se presenta una descripción de la tendencia de la CPUE así como de la estructura de tallas del pez vela capturado por la flota artesanal en el golfo de Tehuantepec.
MATERIALES Y MÉTODOS
Información de campo
La información analizada para la obtención del índice de abundancia relativa proviene exclusivamente de las capturas de la flota artesanal con base en Puerto Ángel, Oaxaca (fig. 1). Desde 2000, la Universidad del Mar inició un programa de seguimiento de la actividad pesquera a pequeña escala de Puerto Ángel. En un principio, sólo se recolectó información de la estructura de tallas de la captura, pero de junio de 2005 a diciembre de 2008 se registraron las capturas y el esfuerzo de la flota artesanal de Puerto Ángel. En número de organismos, las capturas pelágicas de la pesca ribereña las compusieron principalmente Euthinnus lineatus (69%); Sarda orientalis, Tunnus albacares y Corhyphaena hippurus (8% cada uno); I. platypterus (4%); y Carcharhynus falciformis (3%). En biomasa I. platypterus tiene el segundo lugar, con casi el 20% de las capturas. La pesca artesanal de pelágicos mayores en Puerto Ángel está conformada por 228 embarcaciones menores de fibra de vidrio de 7.61 a 10.33 m (25 a 33 pies) de eslora, con una capacidad de carga de entre 1200 y 3000 kg y con motores fuera de borda de entre 40 y 75 HP (rara vez de mayor potencia). Las operaciones de pesca se realizan con equipos armados de manera artesanal y sin ayudas mecánicas, excepto los motores fuera de borda empleados para la propulsión. En estas embarcaciones participan de dos a cuatro pescadores. Las operaciones de pesca son diarias, inician entre 6:00 y 7:00, y tienen una duración de 3 a 4 h.
Los equipos de pesca activos que se utilizan son los curricanes (rápalas), para la captura de barrilete negro (E. lineatus) y atún aleta amarilla (T. albacares), y las boyas (palangre modificado), para la captura de atún aleta amarilla, pez vela (I. platypterus) y dorado (Coryphaena hippurus). Los equipos pasivos son los palangres (llamados localmente "cimbras") y las redes de enmalle, que son utilizados para la pesca de tiburón (Carcharynus falciformis). El trabajo en campo se realizó durante dos días a la semana, y en esos días se registró el total de viajes de pesca de pelágicos mayores.
Índice de abundancia relativa
Para estimar la CPUE, se consideró como unidad de esfuerzo un viaje de pesca. En la pesca artesanal de la costa de Oaxaca, el tiempo para dirigirse al área de pesca es relativamente corto, ya que los viajes son diarios y de poca duración. Según Arocha et al. (2009), se supone que las prácticas de pesca de este tipo son suficientemente homogéneas, lo que permite considerar al viaje de pesca como unidad de esfuerzo. Es así que la CPUE fue definida como sigue:

donde CPUE es el número de organismos capturados por viaje de pesca, c es el número de organismos, f es el número de viajes y η es el número de operaciones de pesca durante los días de muestreo.
Para describir la CPUE, se consideró que ésta presenta una distribución Δ (i.e., contiene una proporción de valores cero y diferentes de cero con una distribución log normal; Pennington 1996), por lo que no se supone que la CPUE esté normalmente distribuida. Para lograr una estimación del valor promedio de la CPUE bajo esta distribución estadística, se usó el modelo general de Pennington (1996), el cual incluye en su aplicación la solución a modelos con distribución Δ (distribuciones desviadas por la presencia de ceros) y distribución log normal (distribuciones desviadas por la presencia de valores bajos distintos de cero). Dadas las propiedades de la distribución log normal, los estimadores insesgados con mínima varianza de la media (ω) y la varianza (ς) de la distribución A están dados por (Pennington 1996):

and
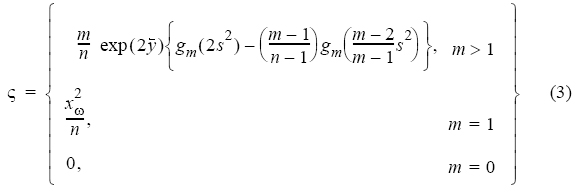
donde n es el número de observaciones, m es el número de valores diferentes de cero, y es ln(x), 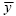 y s2 son la media y la varianza de la muestra de datos diferentes de cero, xω representa a un valor único sin transformar cuando m es igual a uno y gm(t), es una función de m y de t, definida por:
y s2 son la media y la varianza de la muestra de datos diferentes de cero, xω representa a un valor único sin transformar cuando m es igual a uno y gm(t), es una función de m y de t, definida por:

donde t es una variable que toma los valores de t1 = (s2/2), t2 =(2s2) y t3 = ((m -2/m - 1)s2). El estimador insesgado de mínima varianza de la varianza de ω está dado por (Pennington 1996):

Estructura de tallas
Las longitudes ojo-furca (LOF) de los organismos de I. platyperus capturados por la pesca artesanal del golfo de Tehuantepec se representaron en histogramas de frecuencias de longitud con intervalos de 5 cm. La descripción y el análisis estadístico de las modas observadas se realizó a partir de la función de densidad multinomial (Haddon 2001):
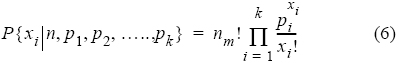
donde xi es el número de veces que un evento tipo i ocurre en n número de muestras y pi son las probabilidades o proporciones separadas de cada uno de los k eventos posibles. Para evitar problemas de cálculo y dado que el término factorial es constante, éste puede ser omitido al trasformar la ecuación (6) en una expresión de verosimilitud (Haddon 2001):

Para generar las proporciones relativas esperadas de cada categoría de longitud (pi), se supuso que cada longitud promedio o moda puede ser analizada como una distribución normal; por lo tanto, cada categoría de longitud (pi) se describió a partir de la siguiente función de densidad:

En esta expresión los parámetros μLOF, σn y λLOF (parámetros a estimar) corresponden a las medias y las desviaciones estándar de la LOF de las n medias presentes en la distribución de longitudes de cada año analizado, mientras que λ es un valor de penalización a la función de distribución multinomial que obliga a la función objetivo a predecir el número de observaciones de la distribución de frecuencias observada. Los valores iniciales μLOF, σn y λLOF de la función de densidad (8) se asignaron bajo dos criterios: (1) inspección visual de la distribución de frecuencias de LOF y (2) comparación con la estructura de modas de años previos (Montgomery et al. 2010). Posteriormente, los parámetros del modelo fueron estimados cuando la función negativa del logaritmo de verosimilitud fue minimizada con el algoritmo de búsqueda directa de Newton (Neter et al. 1996). La función objetivo a minimizar fue expresada como sigue (Haddon 2001, Aguirre-Villaseñor et al. 2006):
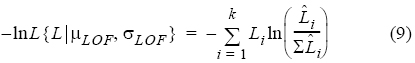
La variación de la talla promedio de la LOF durante todo el periodo de estudio (2000-2008) se analizó mediante una prueba de varianza de una vía (P < 0.05) para la comparación de medias, y en el caso de encontrar diferencias significativas, se llevó a cabo la prueba de comparaciones múltiples de Tukey (P < 0.05) (Zar 1999).
RESULTADOS
Índice de abundancia relativa
Durante 2005 hasta 2008 se recopiló información mensual de captura (número de individuos y número de viajes) para la estimación de la CPUE de la flota artesanal de Puerto Ángel, Oaxaca. La serie de tiempo del índice de abundancia relativa estimado de I. platypterus se muestra en la figura 2. La CPUE promedio más alta se registró en julio de 2007 (2.7 ind viaje-1) y la más baja en diciembre de 2008 (0.01 ind viaje-1). Se observó una tendencia estacional de la abundancia relativa de I. platypterus: los valores más bajos se observaron durante los primeros meses del año, luego fueron incrementando hacia los meses de verano y volvieron a decaer hacia el principio del invierno (diciembre).
Estructura de tallas
La distribución de frecuencias de la LOF de I. platypterus capturado por la flota artesanal del golfo de Tehuantepec durante el periodo de 2000 a 2008 estuvo basada en 4976 mediciones de LOF dentro del intervalo de 55 a 240 cm (promedio = 159.9 cm, desviación estándar (s) = 13.6 cm). La distribución de frecuencias de pesos se basó en 4985 individuos que pesaron entre 1.6 y 69.6 kg (promedio = 27.9 kg, s = 6 kg).
La distribución de la LOF por año mostró una estructura unimodal a lo largo del periodo de estudio (fig. 3). Sin embargo, durante 2000 se identificaron dos modas; se estimó una talla promedio ( μLOF) de 172.2 cm de LOF (σLOF = 7.9 cm) para la primera y una talla de 189.9 cm de LOF (σLOF= 5.4 cm) para la segunda. En 2005, también se registraron dos modas, una en las tallas de 155.3 cm de LOF (σLOF = 0.6 cm) y otra en 161.9 cm de LOF (σLOF = 12.2 cm). Al ordenar las tallas promedio con respecto al tiempo, se observó una disminución; la tendencia fue negativa con dos periodos de estabilidad (fig. 4) y se determinaron diferencias estadísticas significativas de la LOF (F(0.05(1),8,4967) = 6.8E + 8, P < 0.05). Durante 2000, las dos modas estimadas fueron las más altas del periodo de estudio y presentaron una diferencia con respecto al resto del periodo (q(0.05,4967,8)> 19.3, P < 0.05). El primer periodo homogéneo lo formaron los años 2001 a 2004. En 2001, la talla promedio disminuyó hasta 167.8 cm de LOF (σLOF = 9.5 cm). Durante 2002 y 2003, las tallas medias promedio estimadas fueron 169.4 cm de LOF (σLOF = 11.3 cm) y 169.9 cm de LOF (σLOF = 12.4 cm). En 2004, volvió a disminuir la talla promedio estimada (165.1 cm de LOF,σLOF= 9.9 cm). Sin embargo, durante este periodo, no se encontraron diferencias estadísticas significativas (F(0.05(1),3,671) = 0.33, P < 0.05). Finalmente, durante los últimos cuatro años las tallas promedio fueron las más pequeñas estimadas. La talla promedio estimada para 2005 fue 161.9 de LOF (σLOF = 12.1), para 2006 fue 161.7 cm de LOF (σLOF= 11.6 cm), para 2007 fue 160.2 cm de LOF (σLOF = 12.4 cm) y para 2008 fue 160.3 cm de LOF (σLOF = 10.1 cm). No se observaron diferencias significativas (F(0.05(1),3,4184) = 0.33, P < 0.05) dentro de este segundo periodo.

DISCUSIÓN
Índice de abundancia relativa
Entre 2005 y 2008, se observó una marcada estacionalidad en las tendencias de la captura por unidad de esfuerzo, principalmente en los meses de verano (de julio a septiembre); esta situación sugiere que el aumento del índice de abundancia relativa en este periodo se relaciona con el reclutamiento al área de pesca. Las estimaciones mostraron que durante el verano es cuando se espera un aumento en la abundancia de I. platypterus.
En el golfo de Tehuantepec, la temporalidad de las capturas ha sido relacionada con los meses de mayor temperatura y de mayor precipitación pluvial (Cerdenares-Ladrón de Guevara 2005). Considerando la dinámica oceánica de la región, el golfo de Tehuantepec está influenciado por la corriente costera de Costa Rica (CCCR) durante la mayor parte del año. Esta corriente se caracteriza por un núcleo de alta temperatura (> 20 °C) y baja salinidad (< 33.8). De enero a marzo, la CCCR no penetra en el golfo de Tehuantepec y se registra una fuerte salida de agua (Wyrtki 1965). En esta época, la zona se encuentra bajo la influencia de los vientos nortes, denominados Tehuanos, que provocan el surgimiento de aguas frías (Blackburn 1962) y descensos en la temperatura de hasta 10 °C (Barton et al. 1993). Las corrientes de agua fría que emergen frente a la costa eventualmente desarrollan giros anticiclónicos de mesoescala (100-500 km) que se propagan hacia el oeste. El forzamiento producido por el viento Tehuano aparentemente interrumpe el flujo costero de la CCCR (Reyes-Hernández y Murad 2005). Es así que la disponibilidad de I. platypterus a la flota artesanal en el golfo de Tehuantepec podría estar relacionada con la presencia de la CCCR, y la interrupción de la misma en los primeros meses del año por la presencia de Tehuanos podría tener un impacto en el cambio del índice de abundancia relativa de la especie.
Otro sitio donde sucede una periodicidad similar es en La Guaira, Venezuela, donde existe una flota de 35 embarcaciones que pesca durante todo el año y captura picudos con redes de enmalle (Marcano et al. 2001). En esta región se ha dado seguimiento a las especies de pico desde 1991, donde I. albicans es la especie más representativa en las capturas (Arocha et al. 2009, Marcano et al. 2010), y se ha documentado una fuerte estacionalidad en las capturas de pez vela; las mayores capturas se registraron para los meses de abril a octubre (Arocha et al. 2009). En comparación con el golfo de Tehuantepec, en Venezuela el periodo de alta abundancia es más largo, iniciando en primavera y continuando en el verano.
Otro patrón estacional de la abundancia relativa de I. albicans se ha documentado para aguas de Senegal, donde la época de mayores capturas es de junio a noviembre, periodo en el que la especie está disponible a flotas artesanales para su captura con redes de enmalle, curricán y línea de mano (Diatta et al. 2010). Diatta et al. 2010 también comentan que la variabilidad en la abundancia relativa es causada por la migración hacia el norte de Senegal asociada con cambios en la temperatura superficial del mar. Estos autores sugieren que las migraciones estacionales del pez vela están asociadas con el periodo y extensión de la migración de Sardinella aurita (principal presa del pez vela), que a su vez fue relacionada con la fuerza de la surgencia estacional en la zona. Joanny et al. (1995) observaron en Costa de Marfil que el pez vela desaparece completamente de las capturas durante la época de surgencia. Las observaciones y cambios en abundancia registrados para I. albicans en África relacionan su variabilidad con cambios en su ambiente, principalmente surgencias y alimentación.
Estructura de tallas
La estructura de tallas de los organismos capturados por la flota artesanal que opera en el golfo de Tehuantepec es unimodal (excepto en 2000 y 2005). Las capturas de organismos de menos de 130 cm de LOF no son comunes, por lo que se podrían consideran dos explicaciones posibles: una alta selectividad del arte de pesca o la existencia de una segregación por tallas o sexos. Resultados similares se han observado en la estructura de tallas de I. platypterus en las costas del Pacífico mexicano (Alvarado-Castillo y Félix-Uraga 1998, Macías-Zamora et al. 2001, Ramírez-Pérez et al. 2011). Por otra parte, se ha observado una bimodalidad de tallas en los registros obtenidos de la flota palangrera japonesa que opera en aguas oceánicas internacionales del océano Pacífico oriental (Uosaki y Bayliff 1999). La moda de los peces más pequeños (120 cm de LOF) estuvo formada por las capturas realizadas entre los 0° y 40° N y los 120° y 150° O. Esta información sugiere que el pez vela presenta una distribución segregada por tallas, donde los organismos adultos se distribuyen en aguas costeras; este grupo de organismos es el que está accesible a la flota artesanal del golfo de Tehuantepec.
Se ha documentado que existen diferencias significativas en la proporción de sexos en las capturas del pez vela del golfo de Tehuantepec durante el periodo de 2005 a 2008 (Cerdenares-Ladrón de Guevara 2011), lo que podría estar influenciando la estructura de tallas. Se considera que existe un dimorfismo sexual en el que las hembras presentan mayores tallas que los machos (Cerdenares-Ladrón de Guevara 2011, Ramírez-Pérez et al. 2011). Con base en las capturas comerciales de la flota de Hawaii, Strasburg (1970) registró una distribución bimodal para el peso del marlín blanco (Tetrapturus albidus), mencionando que, al igual que ocurre con el marlín azul (Makaira nigricans), las modas podrían estar relacionadas con la abundancia temporal de uno de los sexos. Por consiguiente, se acepta que la proporción de sexos influye en la composición de tallas (Goodyear y Arocha 2001).
En cuanto a la talla promedio de I. platypterus capturado por la flota artesanal en el golfo de Tehuantepec, la serie de tiempo de nueve años analizada mostró una tendencia negativa, observándose una reducción de 30 cm durante el periodo de estudio. Un efecto inmediato de la pesca es la reducción de la talla promedio de captura, y un cambio en la estructura de tallas puede ser un indicador de pesca excesiva (Shin et al. 2005). Al revisar la información registrada de 1990 a 2009 por el programa de observadores de la Comisión Interamericana del Atún Tropical (http://www.iattc.org/Catchbygear/IATTC-Catch-by-species1.htm), se observó que existen cambios anuales significativos, sobre todo en 1990 y 1991; durante el resto del periodo, se observó una variación en las tallas registradas sin una tendencia específica que indique una disminución en la talla promedio de los organismos capturados. Es posible que los cambios en la talla promedio de I. platypterus sean un efecto de la fuerza de una clase anual, considerando que los cambios en las frecuencias de tallas de las capturas han sido utilizados como un indicador de cambios en la estructura de edades de la población (Goodyear y Arocha 2001). De acuerdo con Cerdenares-Ladrón de Guevara et al. (2011), en el golfo de Tehuantepec se encuentran hasta 11 grupos de edad de los cuales el más representativo es el grupo de edad cinco. Según la clave talla-edad de los organismos que presentan estos autores, se observa un amplio traslape de tallas en cada grupo de edad, lo que impide observar con claridad cambios en los grupos de edad, particularmente en los de edad avanzada. Aunado a lo anterior, es posible una segregación de tallas en la que los organismos adultos se distribuyen en áreas costeras (Uosaki y Bayliff 1999).
En otras especies de picudos también se han observado cambios en la talla y peso promedio. Para las especies M. nigricans y T. albidus que se distribuyen frente a las costas de Venezuela, Marcano et al. (2001) documentaron cambios sin variaciones significativas. En el caso del marlín rayado (Tetrapturus audax) capturado por la flota deportiva de Nueva Zelanda de 1925 a 2003, Kopf et al. (2005) documentó que el peso promedio de esta especie declinó progresivamente de 6 a 9 kg por cada 20 años; no obstante, en 2003 estos autores observaron una inusual presencia de organismos adultos, incrementando significativamente la talla promedio de las capturas. Sin embargo, estas fluctuaciones no se consideraron relevantes dado que la talla promedio no decayó por debajo de la longitud de primera madurez (Baum y Myers 2004, Kopf et al. 2005). En este sentido, la reducción de la talla promedio del pez vela en el golfo de Tehuantepec (160 cm de LOF, talla promedio mínima estimada) tampoco es menor que la longitud de primera madurez, que fue estimada en 150.2 cm de LOF (Cerdenares-Ladrón de Guevara 2011). En consecuencia, la falta de tendencias claras que muestren cambios en la talla promedio de las especies de pico hace que la talla no se considere de utilidad como un indicador de la presión de pesca (ICCAT 2010).
La tasa de crecimiento que presentan estas especies es alta, y esto ocasiona que en los primeros años de vida alcancen más del 50% de su longitud media asintótica (L∞). Para el caso de I. platypterus en el golfo de Tehuantepec, la L∞ estimada es de 180.6 cm de LOP, lo que indica que alcanza más del 80% de su L∞ en los primeros tres años de vida (Cerdenares-Ladrón de Guevara et al. 2011); estos grupos de edad representaron solamente 4.7% de las capturas (Cerdenares-Ladrón de Guevara 2011). Antes de los dos años de vida, los machos y las hembras de M. nigricans alcanzan 90% y 67% de su L∞ , respectivamente (Prince y Brown 1991). Tetrapturus audax alcanza más del 75% de su L∞ en sus primeros tres años de vida; estos grupos de edad (1, 2 y 3) en conjunto sólo representaron 1.6% de las capturas (Melo-Barrera et al. 2003, Melo-Barrera y Félix-Uraga 2004).
No es posible asociar una relación entre el esfuerzo pesquero y los cambios en la talla promedio para tener una evidencia directa de la causa (esfuerzo pesquero) y efecto (talla promedio) (Neuheimer y Taggart 2010). Las poblaciones sujetas a la pesca comercial, principalmente la pesca selectiva, han sufrido disminuciones en su talla promedio, y se han propuesto tres hipótesis que explican estos cambios: (a) la pesca induce evolución que modifica la estructura de tallas de la población (impacto genético poblacional), (b) es solo una expresión fenotípica que no afecta la estructura de edades de la población y (c) es un efecto de alguna causa ambiental. Estás tres hipótesis tienen particular relevancia si la disminución en la talla promedio de la población cae por debajo de la talla de primera madurez (Law 2007). El ICCAT (2010) documentó que, desde 1990, las distribuciones de tallas y talla promedio del pez vela del océano Atlántico no han tenido grandes variaciones; esto reduce el valor de usar la longitud como un indicador de la presión de pesca. En nuestro estudio observamos un cambio en la talla promedio de pesca, pero no tenemos elementos que nos permitan mostrar evidencia del esfuerzo de pesca sobre la disminución en la talla. En conclusión, la pesquería artesanal de pez vela en el golfo de Tehuantepec mostró una estructura de tallas unimodal de 2000 a 2009, y la variación anual en la talla promedio mostró una tendencia negativa. La CPUE de I. platypterus presentó un cambio estacional: los valores más bajos se presentaron durante el periodo de enero a abril, luego incrementaron durante los meses de verano y nuevamente decayeron hacia diciembre.
Agradecimientos
El presente estudio fue financiado por CONACYT y CONAPESCA (México). Agradecemos a los alumnos del Laboratorio de Ictiología y Biología Pesquera de la Universidad del Mar por su colaboración en el trabajo de campo y a los tres árbitros que revisaron el manuscrito inicial por sus valiosas aportaciones.
REFERENCIAS
Aguirre-Villaseñor H, Morales-Bojórquez E, Morán-Angulo ER, Madrid-Vera J, Valdez-Pineda MC. 2006. Biological indicators for the Pacific sierra (Scomberomorus sierra) fishery in the southern Gulf of California, Mexico. Cienc. Mar. 32: 471—484. [ Links ]
Alvarado-Castillo R, Félix-Uraga R. 1998. Growth of Istiophorus platypterus (Pices: Istiophoridae) from the mouth of the Gulf of California. Rev. Biol. Trop. 46: 115-118. [ Links ]
Arocha F, Ortiz M, Barrios A, Debrot D, Marcano LA. 2009. Catch rates for sailfish (Istiophorus albicans) from small scale fishery off La Guaira, Venezuela: period 1991-2007. Collect. Vol. Sci. Pap. ICCAT 64: 1844-1853. [ Links ]
Barton ED, Argote ML, Brown J, Kosro PM, Lavín M, Robles JM, Smith RL, Trasviña A, Vélez HS. 1993. Supersquirt: Dynamics of the Gulf of Tehuantepec, Mexico. Oceanography 6: 23-30. [ Links ]
Baum JK, Myers RA. 2004. Shifting baselines and the decline of pelagic sharks in the Gulf of Mexico. Ecol. Lett. 7: 135-145. [ Links ]
Blackburn M. 1962. An oceanographic study of the Gulf of Tehuantepec. US Fish Wildl. Serv. Spec. Sci. Rep. Fish. 404: 28. [ Links ]
Cerdenares-Ladrón de Guevara G. 2005. Caracterización biológica del pez vela Istiophorus platypterus (Shaw y Nodder, 1972) capturado en la costa de Oaxaca. MSc thesis, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, México, 42 pp. [ Links ]
Cerdenares-Ladrón de Guevara G. 2011. Biología del pez vela Istiophorus platypterus (Shaw y Nodder 1792) en el Golfo de Tehuantepec. PhD thesis, IPN-CICIMAR, México, 142 pp. [ Links ]
Cerdenares-Ladrón de Guevara G, Morales-Bojórquez E, Rodríguez-Sánchez R. 2011. Age and growth of the sailfish Istiophorus platypterus (Istiophoridae) in the Gulf of Tehuantepec, Mexico. Mar. Biol. Res. 7: 488-499. [ Links ]
Chiang WC, Chen Y, Sun CL, Su WC, Wang SP, Liu DC, Yeh SZ, Chen WY. 2009. Analysis of sex-specific spawning biomass per recruit of the sailfish (Istiophorus platypterus) in the waters off eastern Taiwan. Fish. Bull. 107: 265-277. [ Links ]
Collette BB, McDowell JR, Graves JE. 2006. Phylogeny of recent billfishes (Xiphioidei). Bull. Mar. Sci. 79: 45 5-468. [ Links ]
Diatta Y, Die DJ, Fitchett M. 2010. Relative abundance indices for sailfish from the artisanal fleet from Senegal. Collect. Vol. Sci. Pap. ICCAT 65: 1725-1739. [ Links ]
Die DJ. 2006. Are Atlantic marlins overfished or endangered?. Some reasons why we may not be able to tell. Bull. Mar. Sci. 79:529-544. [ Links ]
Goodyear CP, Arocha F. 2001. Size composition of blue and white marlins taken in selected fisheries in the Western North Atlantic. Collect. Vol. Sci. Pap. ICCAT 53: 249-257. [ Links ]
Graves JE. 1998. Molecular insights into the population structures of cosmopolitan marine fishes. J. Hered. 89: 427-437. [ Links ]
Haddon M. 2001. Modelling and Quantitative Methods in Fisheries. Chapman and Hall/CRC, Boca Raton, Florida, 406 pp. [ Links ]
Hoolihan J. 2003. Sailfish movement in the Arabian Gulf: A summary of tagging efforts. Mar. Freshwat. Res. 54: 509-513. [ Links ]
ICCAT. 2010. Report of the 2009 Sailfish Stock Assessment. Collect. Vol. Sci. Pap. ICCAT 65: 1507-1632. [ Links ]
Joanny T, Amon-Kothias JB, Bard FX. 1995. Standardized indices of abundance 1988-1994 for billfish (sailfish, blue marlin) and swordfish (Xiphias gladius) off Cote d'Ivoire. Collect. Vol. Sci. Pap. ICCAT 44: 32-33. [ Links ]
Kopf RK, Davie PS, Holdsworth JC. 2005. Size trends and population characteristics of striped marlin, Tetrapturus audax, caught in the New Zealand recreational fishery. N. Z. J. Mar. Freshwat. Res. 39: 1145-1156. [ Links ]
Law R. 2007. Fisheries-induced evolution: Present status and future directions. Mar. Ecol. Prog. Ser. 335: 271-27.7. [ Links ]
Macías-Zamora R, Vidaurri-Sotelo AL, Santana-Hernández H, Valdez-Flores JJ, Beltrán-Pimienta R. 2001. Pez vela. In: SAGARPA (ed.), Sustentabilidad y Pesca Responsable en México: Evaluación y Manejo. INAPESCA, México, pp. 389-410. [ Links ]
Marcano L, Alió JJ, Arocha F, Gutiérrez X. 2001. Tendencia de la pesquería artesanal de peces de pico en la costa central de Venezuela. Periodo 1988-1999. Collect. Vol. Sci. Pap. ICCAT 53: 291-297. [ Links ]
Marcano L, Arocha F, Alió J, Marcano J, Larez A. 2010. Actividades desarrolladas en el programa de investigación intensiva sobre marlines en Venezuela: periodo 2007-2008. Collect. Vol. Sci. Pap. ICCAT 65: 1824-1832. [ Links ]
Melo-Barrera FN, Félix-Uraga R. 2004. Estructura de tallas y edad del marlin rayado Tetrapturus audax (Pisces: Xiphidae), en Cabo San Lucas, Baja California Sur, México. Rev. Biol. Trop. 52: 981-989. [ Links ]
Melo-Barrera FN, Félix-Uraga R, Quiñónez-Velázquez C. 2003. Growth and length-weight relationship of the striped marlin, Tetrapturus audax (Pisces: Istiophoridae), in Cabo San Lucas, Baja California Sur, Mexico. Cienc. Mar. 29: 305-313. [ Links ]
Montgomery SS, Walsh CT, Haddon M, Kesby CL, Johnson D. 2010. Using length data in the Schnute model to describe growth in a metapeneid from waters off Australia. Mar. Freshwat. Res. 61: 1435-1445. [ Links ]
Neter J, Kutner MH, Nachtsheim CJ, Wasserman W. 1996. Applied Linear Statistical Models. McGraw-Hill, new York,1408 pp. [ Links ]
Neuheimer AB, Taggart CT. 2010. Can changes in length-at-age and maturation timing in Scotian Shelf haddock (Melanogrammus aeglefinus) be explained by fishing?. Can. J. Fish. Aquat. Sci. 67: 854-865. [ Links ]
Pennington M. 1996. Estimating the mean and variance from highly skewed marine data. Fish. Bull. 94: 98-505. [ Links ]
Prince ED, Brown BB. 1991. Coordination of the ICCAT enhanced research program for billfish. In: Creel and Angler Surveys in Fisheries Management. Am. Fish. Soc. Symp. 12: 13-17. [ Links ]
Prince ED, Holts DB, Snodgrass D, Orbesen ES, Luo J, Domeier ML, Serafy JE. 2006. Transboundary movement of sailfish, Istiophorus platypterus, off the Pacific coast of central America. Bull. Mar. Sci. 79: 827-838. [ Links ]
Ramírez-Pérez JS, Quiñónez-Velázquez C, Abitia-Cárdenas AL, Melo-Barrera FN. 2011. Age and growth of sailfish Istiophorus platypterus (Shaw in Shaw and Nodder, 1792) from Mazatlan, Sinaloa, Mexico. Environ. Biol. Fish. 92: 187-196. [ Links ]
Reyes-Hernández CA, Murad P. 2005. Estructura hidrográfica del Golfo de Tehuantepec en septiembre de 2004: Crucero TEHMAL04. GEOS 25: 246. [ Links ]
Santana-Hernández H. 2001. Estructura de la comunidad de pelágicos mayores capturados con palangre en el Pacífico mexicano (1983-1996) y su relación con la temperatura superficial del mar. PhD thesis, Universidad de Colima, México, 123 pp. [ Links ]
Shin YJ, Rochet MJ, Jennings S, Field JG, Gislason H. 2005. Using size-based indicators to evaluate the ecosystem effects of fishing. ICES J. Mar. Sci. 62: 384-396. [ Links ]
Sosa-Nishizaki O. 1998. Historical review of the billfish management in the Mexican Pacific. Cienc. Mar. 24(1): 95-111. [ Links ]
Strasburg DW. 1970. A report on the billfishes of the central Pacific Ocean. Bull. Mar. Sci. 20: 575-604. [ Links ]
Uosaki K, Bayliff WH. 1999. A review of the Japanese longline fishery for tunas and billfishes in the eastern Pacific Ocean, 1988-1992. Inter-Am. Trop. Tuna Comm. Bull. 21: 273-488. [ Links ]
Uozumi Y. 2003. Historical perspective of global billfish assessment. Mar. Freshwat. Res. 54: 555-566. [ Links ]
Wyrtki K. 1965. Surface currents of the eastern tropical Pacific ocean. Inter-Am. Trop. Tuna Comm. Bull. 9: 271-304. [ Links ]
Zar JH. 1999. Biostatistical Analysis. 4th ed. Prentice Hall, New Jersey, 663 pp. [ Links ]














