Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.3 Ensenada sep. 2012
https://doi.org/10.7773/cm.v38i3.2147
Biología reproductiva del gobio de roca, Gobius paganellus (Actinopterygii: Perciformes: Gobiidae), en la costa del sur de Túnez (golfo de Gabes)
Reproductive biology of the rock goby, Gobius paganellus (Actinopterygii: Perciformes: Gobiidae), on the southern Tunisian coast (Gulf of Gabes)
F Hajji*, A Ouannes-Ghorbel, M Ghorbel, O Jarboui
Institut National des Sciences et Technologies de la Mer (INSTM), BP 1035, 3018 Sfax, Tunisia. *Corresponding author. E-mail: ferid.hajji@yahoo.fr
Received January 2012,
Received in revised form April 2012,
Accepted May 2012.
RESUMEN
El gobio de roca Gobius paganellus es uno de los góbidos más comunes en la costa del sur de Túnez y este estudio proporciona la primera información detallada de su biología reproductiva en el golfo de Gabes. Se analizaron un total de 365 machos (8.9-14 cm de longitud total, LT) y 273 hembras (9.1-14.3 cm LT). Los peces fueron disecados y se retiraron las gónadas y el hígado. Se estimó la talla media de madurez sexual (LT50; i.e., la longitud a la cual el 50% de los individuos han alcanzado la madurez sexual) para machos y hembras mediante el ajuste de la función logística de Gompertz a la proporción de peces maduros en cada clase de talla. Se calcularon el índice gonadosomático, el índice somático de las vesículas seminales (SVSI), el índice hepatosomático y el índice de condición sobre una base mensual. En toda la población, la proporción de sexos fue desequilibrada, los machos dominando en las tallas mayores. El periodo de reproducción comenzó en octubre y duró hasta marzo y la temporada de desove fue de enero a marzo. Las variaciones mensuales del SVSI mostraron que tienen una fase de proliferación durante el periodo de predesove y una fase regresiva durante el periodo de posdesove. La utilización de reservas lipídicas, almacenadas principalmente en el hígado así como en los músculos, fue considerable durante la temporada de reproducción. La talla de madurez sexual se estimó en 11.44 ± 0.25 cm para los machos y en 10.37 ± 0.23 cm para las hembras. La fecundidad total varió de 5280 a 14,320 huevos por individuo, con un promedio de 8565 ± 608 huevos por individuo.
Palabras clave : Gobius paganellus, reproducción, índice gonadosomático, madurez sexual, fertilidad.
ABSTRACT
The rock goby Gobius paganellus is one of the most common gobiid fish on the southern Tunisian coast and this study provides the first detailed information on its reproductive biology in the Gulf of Gabes. A total of 356 males (8.9-14 cm total length, TL) and 273 females (9.1-14.3 cm TL) were analyzed. Specimens were dissected and their gonads and livers were removed. Mean size at sexual maturity (TL50; i.e., length at which 50% of the fish are mature) was estimated for males and females by fitting the logistic Gompertz function to the proportion of mature fish per centimeter size class. The gonadosomatic index, the seminal vesicle-somatic index (SVSI), the hepatosomatic index, and the condition index were calculated on a monthly basis. In the entire population, the sex ratio was unbalanced, males dominating among larger size classes. The reproductive period started in October and lasted until March, and the spawning season was between January and March. Monthly changes in the SVSI showed that during the pre-spawning period they have a proliferation phase, followed by a regressive phase during the post-spawning period. The use of lipid reserves, stored predominantly in the liver as well as in muscles, was important during the reproductive season. The estimated length at sexual maturity was 11.44 ± 0.25 cm for males and 10.37 ± 0.23 cm for females. Total fecundity ranged from 5280 to 14,320 eggs per fish, with an average of 8565 ± 608 eggs per fish.
Key words: Gobius paganellus, reproduction, gonadosomatic index, size at maturity, fecundity.
INTRODUCCIÓN
El gobio de roca Gobius paganellus es un góbido relativamente grande que habita en las costas rocosas del mar Mediterráneo, el mar Negro y el Atlántico noroccidental, de Escocia a Senegal (Miller 1986, Engin et al. 2007, Fricke et al. 2007). Es una especie intermareal común que se encuentra debajo de rocas y en pozos en zonas rocosas protegidas con mucha cobertura algal (Miller 1986). Esta especie se encuentra a lo largo de la costa tunecina, así como en algunas lagunas (Ghar El Melh, Bizerte, Ichkeul, El Bibéne) y el lago de Túnez (Menif 2000). En el golfo de Gabes fue registrado por primera vez por Ben Othman (1973).
Su biología ha sido estudiada en algunas zonas del Mediterráneo (Gibson 1972, Maze 2004) y el Atlántico (Miller 1961, Dunne 1978, Azevedo y Simas 2000, Engin y Seyhan 2009). La evaluación de la biología reproductiva de una especie es importante para entender su ecología y para desarrollar medidas de conservación efectivas. Ante la falta de información actual de la biología de G. paganellus en la costa de Túnez, el objetivo de este trabajo fue generar información básica de su biología reproductiva en el golfo de Gabes mediante el análisis de la proporción de sexos, el ciclo anual de desarrollo gonádico, el índice somático de las vesículas seminales, la talla de primera madurez sexual y la fecundidad. También se analizaron el índice hepatosomático (Fouda et al. 1993) y el índice de condición (Kartas y Quignard 1984) para evaluar el estado fisiológico general de los animales.
MATERIALES Y MÉTODOS
Se usó una muestra de 629 individuos de 8.9 a 14.3 cm de longitud total (LT) para estudiar la reproducción. Los especímenes fueron recolectados semanalmente entre agosto de 2009 y julio de 2010 de varias artes de pesca artesanal en la costa del sur de Túnez (fig. 1). En el laboratorio, se midió la LT de cada individuo al 0.01 cm más cercano. Se midieron la masa total y la masa eviscerada (ME) con una balanza electrónica al 0.01 g más cercano. Se retiraron el hígado y las gónadas. Los peces se sexaron con base en la forma de la papila genital (Gandolfi et al. 1991). La disección permitió confirmar el sexo, así como determinar el grado de madurez sexual. Las gónadas fueron analizadas macroscópicamente según la escala de cinco estadios de madurez gonádica para góbidos (Miller 1961):

• Estadio I: inmaduro, inicio de la gametogénesis; gónadas aún no desarrolladas y el sexo es distinguible sólo por la forma de la papila genital.
• Estadio II: desarrollo; virgen y recuperación para un próximo desove.
• Estadio III: en maduración; gónadas desarrolladas, consistentes de tejido compacto, línea alargada de color blanco en machos y de aspecto granuloso y color amarillo en hembras.
• Estadio IV: madurez, etapa reproductiva; gónadas infladas y maduras, para hembras y machos.
• Estadio V: desove; ovarios y testículos vacíos, flácidos y de color rojo. Pocos remanentes de huevos en proceso de resorción.
La masa de las gónadas (MG) y la masa del hígado (MH) se registraron al 0.001 g más cercano. Para los machos, la masa testicular (MG) y la masa de vesículas seminales (MVS) se pesaron por separado. Los cambios en la proporción de sexos se analizaron según la talla y el mes; ésta se calculó con la siguiente fórmula:
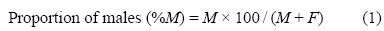
donde M es el número de machos, H es el número de hembras y M + H es el número total de machos y hembras.
El ciclo reproductivo anual se analizó considerando las etapas de madurez y calculando el índice gonadosomático (IGS, donde IGS = 100 MG ME-1) y el índice somático de las vesículas seminales (ISVS, donde ISVS = 100 MVS ME-1) (Patzner et al. 1991) para muestras mensuales.
La acumulación y el agotamiento de las reservas en el hígado y los músculos de G. paganellus del golfo de Gabes se estudió mediante el análisis de cambios mensuales en el índice hepatosomático (IHS, donde IHS = 100 MH ME-1; Fouda et al. 1993) y el índice de condición (K, donde K = 100 x (ME/(LT)3); Kartas y Quignard 1984).
Se evaluaron las desviaciones estadísticamente significativas de una proporción sexual balanceada de 1:1 mediante una prueba χ2, con un nivel de significancia de P < 0.05 (Zar 1996). Se aplicó un análisis de varianza, seguido de la prueba post hoc de Tukey (Zar 1996), para determinar las diferencias críticas mensuales en los índices (IGS, IHS y K). Los resultados se presentan como la media (± intervalo de confianza) y se usó un nivel de significancia de P = 0.05.
Para estimar la fecundidad, se analizaron 39 hembras maduras; se pesaron pequeños trozos de cada par de ovarios al 0.1 mg más cercano y se preservaron en una solución de formalina al 7%. Después de aproximadamente tres meses, los ovarios fueron enjuagadas cuidadosamente bajo agua corriente para separar los ovocitos del tejido. La fecundidad fue estimada con el método volumétrico. Los ovarios se colocaron en un vaso de precipitado con un volumen conocido de agua y el contenido se mezcló con un agitador magnético. Se obtuvieron cinco submuestras de los ovarios de cada hembra con una pipeta Stempel de 2 mL y se verificó la homogeneidad de varianzas. Se midió el diámetro de los ovocitos con un microscopio de disección provisto de un micrómetro ocular. Para establecer la relación entre la fecundidad y la LT, ME y MG, se utilizó el modelo de multiplicación regresiva (y = axb).
La talla de primera madurez se estimó para machos y hembras con base en la proporción de especímenes maduros (estadios II a V, Miller 1961). La talla de primera madurez, definida como la longitud a la cual el 50% de los individuos han alcanzado la madurez sexual, se estimó mediante una función logística ajustada para la proporción de individuos maduros agrupados en clases de 1 cm LT. Se aplicó el algoritmo cuasi-Newton para la estimación no lineal por mínimos cuadrados de parámetros funcionales a los datos según la siguiente ecuación:

donde P es la proporción de individuos maduros, a es el parámetro estimado (pendiente de la curva), LT es la longitud total correspondiente a P y LT50 es la longitud total de 50% de los individuos maduros.
Los resultados se analizaron con la prueba χ2 (Scherrer 1984):

donde Mi es el número de individuos maduros observados en la talla i y nPi es el número de individuos maduros estimados en la talla i.
RESULTADOS
Sexualidad
Se examinaron un total de 629 especímenes, de los cuales 356 fueron machos y 273 hembras. La proporción de sexos (machos: hembras) fue 1.30:1, la cual difiere significativamente de la proporción 1:1 (χ2 = 33.57, P < 0.001). En la tabla 1 se muestran las variaciones mensuales de la proporción de sexos, que fue balanceada (igual a 50%) en agosto, septiembre, enero, febrero, marzo, abril, mayo, junio y julio, pero favoreció a los machos en octubre, noviembre y diciembre. El valor de la prueba χ2 indica diferencias significativas entre los meses cuando predominaron los machos. La proporción de sexos fue balanceada (igual a 50%) para los individuos más pequeños (LT < 12 cm). Para los individuos mayores de 12 cm, la proporción de machos aumentó progresivamente y mostró una abundancia significativa en comparación con las hembras (tabla 2).
Cambios gonádicos estacionales
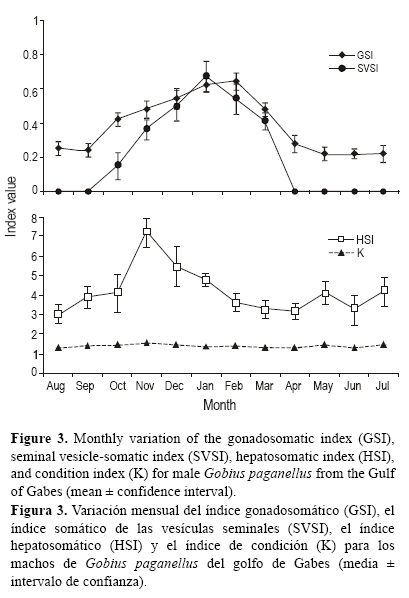
En la figura 2 se muestran los cambios mensuales en el IGS para las hembras de G. paganellus. No se presentaron cambios significativos de agosto a octubre y de abril a julio (P > 0.05), pero hubo un incremento gradual de octubre (1.10) a noviembre (3.56) (P < 0.05), seguido de un aumento notable de diciembre (4.71) a enero (7.60) (P < 0.05) y luego un decremento significativo hasta marzo (P < 0.05).

Los cambios mensuales en el IGS para los machos de G. paganellus (fig. 3) mostraron un aumento gradual de octubre (0.42) a febrero (0.64) (P < 0.05), seguido de una fuerte disminución de febrero a marzo (0.48) (P < 0.05); no se observaron diferencias significativas (P > 0.05) de agosto a septiembre y de abril a julio. Las vesículas seminales presentaron sus máximas extensiones en enero (ISVS = 0.67 ± 0.09) (fig. 3). De agosto a octubre y de abril a julio, la MSV fue mínima y no se observaron diferencias significativas (P > 0.05) en el ISVS durante estos periodos. El periodo de noviembre a enero se caracterizó por un incremento notable en MVS (P < 0.05). El ISVS decreció significativamente (P < 0.05) hasta alcanzar un valor de 0.41 ± 0.05 en marzo (fig. 3).
El IGS decreció según aumentó la talla de los machos (fig. 4: r de Pearson = -0.41, P < 0.001, N = 197); esta correlación negativa aparentemente se debe a la fuerte disminución del IGS, de 8.9 a 14 cm. El ISVS presentó un patrón opuesto e incrementó junto con la talla (fig. 5: r de Pearson = +0.63, P < 0.001, N = 356).


Índice hepatosomático e índice de condición
El IHS y K incrementaron gradualmente de agosto a noviembre. En diciembre, unas cuantas semanas antes de iniciar el desove, ambos índices mostraron una disminución. Los valores máximos del IHS para hembras y machos (7.29 y 7.20, respectivamente) se registraron en noviembre y los mínimos (3.54 y 3.04, respectivamente) en agosto (P < 0.05) (figs. 2, 3). Los cambios mensuales en K mostraron una disminución gradual, pero no significativa (P > 0.05), de noviembre (1.55) a abril (1.35) para las hembras y de noviembre (1.58) a junio (1.32) para los machos (figs. 2, 3).
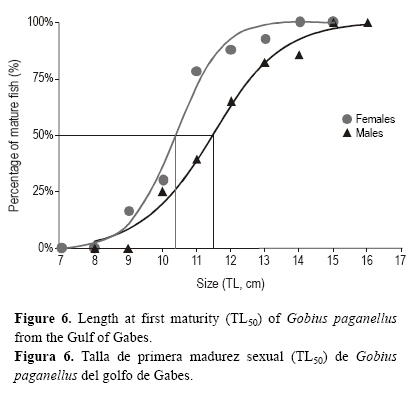
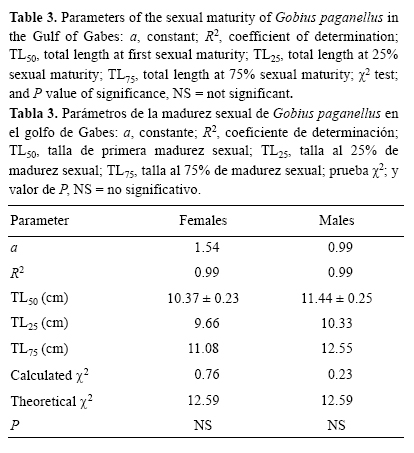
Talla de primera madurez sexual
Los cambios en la proporción de individuos maduros indicaron que los individuos < 9 cm LT eran inmaduros y los > 14 cm LT eran maduros. Según el modelo logístico, la talla de primera madurez sexual (LT50) fue de 10.37 ± 0.23 cm para las hembras y de 11.44 ± 0.25 cm para los machos (fig. 6). La prueba χ2 no mostró diferencias significativas entre los valores teoréticos y los observados (tabla 3).
Fecundidad
Las 39 hembras maduras examinadas presentaron un intervalo de talla de 9.8 a 13.20 cm LT, mientras que la masa total varió de 14.50 a 35.34 g. La fecundidad absoluta osciló entre 5280 y 14,320 huevos por individuo. Las gráficas de fecundidad vs LT (fig. 7), fecundidad vs ME (fig. 8) y fecundidad vs MG (fig. 9) indicaron un modelo de regresión.
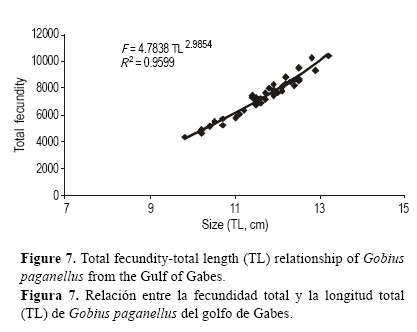

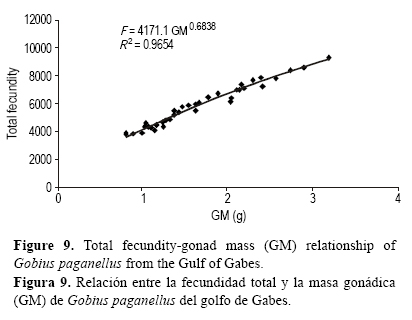
La fecundidad media obtenida para G. paganellus con el procedimiento de suma directa fue de 8565 ± 608 huevos por individuo. El diámetro de los ovocitos en los ovarios varió de 0.36 a 0.87 mm, con un promedio de 0.58 ± 0.04 mm.
DISCUSIÓN
La talla máxima de los especímenes registrada en este estudio fue similar a la documentada para las poblaciones del Atlántico (Azevedo y Simas 2000, Engin y Seyhan 2009). El análisis de la proporción de sexos mostró diferencias significativas entre las proporciones de machos y las de hembras de la muestra total, según el mes y la talla. En la población de G. paganellus del golfo de Gabes, los cambios mensuales de las proporciones numéricas y la predominancia de machos podrían deberse al uso temporal de determinadas artes de pesca y a la formación de cardúmenes en las zonas de alimentación y desove. Para G. paganellus de Sao Miguel (islas Azores), Azevedo y Simas (2000) también registraron una dominancia estadísticamente significativa de machos en las clases de talla mayores. La proporción de sexos fue similar a la encontrada para otros góbidos, como G. niger del mar Adriático (Fabi y Giannetti 1985), la laguna de Mauguio (Joyeux et al. 1992) y el mar Egeo (Filiz y Togula 2009), y Zosterisessor ophiocephalus del golfo de Gabes (Hajji et al. 2011). Por otro lado, Miller (1961) y Dunne (1978) no encontraron diferencias sexuales en la tasa de crecimiento de G. paganellus; sin embargo, el primer autor documentó la desaparición de los individuos más grandes de cada grupo de edad y sugirió que la mortalidad selectiva o migración a la zona submareal podría explicar esto. Esta desaparación podría enmascarar los efectos de las diferencias en la tasa de crecimiento entre sexos (Azevedo y Simas 2000).
Los cambios mensuales en el IGS indicaron que el ciclo sexual de las hembras se correlaciona con el de los machos de G. paganellus en el golfo de Gabes. De hecho, el periodo de maduración gonadal se extiende de octubre a enero y el periodo de desove de enero a marzo, mientras que la fase de inactividad sexual dura de agosto a septiembre y de abril a julio. Esta especie muestra un cambio en el tamaño relativo de la gónadas así como en el tamaño de la vesícula seminal en relación con el tamaño corporal de los machos. Los machos pequeños tienen gónadas relativamente grandes, lo que indica una producción de grandes cantidades de espermatozoides. En machos maduros de talla pequeña (LT < 10 cm), la principal función de las vesículas seminales es el almacenamiento de espermatozoides y la producción de mucina es mínima. Por otro lado, los machos de mayor tamaño (LT > 12 cm) tienen gónadas relativamente pequeñas, lo que indica una menor producción relativa de espermatozoides y que las vesículas seminales producen y se llenan de grandes cantidades de mucinas que causan su ensanchamiento conspicuo. Los machos de talla intermedia tienen vesículas seminales con una mezcla variable de espermatozoides y mucinas. La liberación intermitente de los espermatozoides le permite a los machos paternales pasar parte del periodo de apareamiento resguardando las entradas a los nidos de incursiones por predadores o machos furtivos buscando penetrar en su territorio y fecundar los huevos (Mazzoldi 1999). En especies con tacticas alternativas de apareamiento, los machos furtivos que se disfrazan de hembras depositan una mayor densidad de esperma, pero más pobre en mucinas y de menor duración que los machos paternales (Mazzoldi et al. 2000, Rasotto y Mazzoldi 2002). Estas características dan diferentes cualidades a las eyaculaciones, los machos paternales garantizando un suministro bajo pero constante de esperma durante horas, mientras que los machos furtivos liberan un gran número de espermatozoides que durante un tiempo corto son más numerosos que los de los machos paternales (Scaggiante et al. 1999, Mazzoldi et al. 2000, Rasotto y Mazzoldi 2002, Mazzoldi et al. 2005).
Gobius paganellus almacena algunas reservas lipídicas en el hígado así como en los músculos. Por lo tanto, los cambios en el IHS y K parecen estar asociados con el ciclo sexual. Nuestros resultados coinciden con lo encontrado por Azevedo y Simas (2000) en Sao Miguel (islas Azores), quienes mencionan que G. paganellus comienza a desovar en enero; estos datos son consistentes con un desarrollo larval más rápido en las islas Azores. Esta historia de vida acelerada de los individuos de las islas Azores puede significar una duración de vida más corta. Engin y Seyhan (2009) informaron que el periodo de desove de G. paganellus se extiende desde marzo hasta junio en el mar Negro. En la isla de Man, el periodo de desove comienza a mediados de abril y termina a mediados de junio (Miller 1961). Las principales especies de góbidos del Atlántico nororiental y el mar Mediterráneo desovan entre marzo y junio (Gibson 1970; Vaas et al. 1975; Dunne 1978; Nash 1984; Vesey y Langford 1985; Joyeux etal. 1991; Arruda et al. 1993; Silva y Gordo 1997; Kovacic 2001, 2007).
Para G. paganellus del golfo de Gabes, los valores del IGS fueron menores para los machos que para las hembras; esto es común para la mayoría de los góbidos (Miller 1984). Por ende, para la mayoría de los peces que protegen sus nidos, la pérdida de espermatozoides es relativamente insignificante (Ota et al. 1996). Las vesículas seminales de G. paganellus presentaron cambios temporales según el ciclo sexual; sin embargo, el cambio mensual en el ISVS mostró que durante el periodo de desove, las vesículas seminales alcanzan sus máximas extensiones en enero. Esto probablemente se deba al papel que juegan las vesículas seminales durante la construcción del nido (Ota et al. 1996). La variación anual del IHS mostró que el almacenamiento energético disminuyó durante la época de desove e incrementó posteriormente. Se ha observado una reducción notable de MH al principio o durante la época de apareamiento (Joyeux et al. 1992, Fouda et al. 1993, Kovacic 2007). La cantidad de lípidos somáticos puede depender en gran parte de los diferentes niveles de inversión reproductiva que muestran los individuos (Malavasi et al. 2004). En el presente trabajo, las hembras y los machos de G. paganellus alcanzaron la madurez sexual a los 10.37 ± 0.23 y 11.44 ± 0.25 cm, respectivamente. Azevedo y Simas (2000) informaron que en Sao Miguel (islas Azores), la talla de primera madurez sexual para G. paganellus fue de 6 a 7 cm para ambos sexos. En el mar Negro sudoriental, Engin y Seyhan (2009) encontraron que la talla de madurez sexual (LT50) fue de 5.20 ± 0.19 cm para machos y de 5.50 ± 0.05 cm para hembras. Hay una gran diferencia entre la talla de primera madurez sexual encontrada en el presente estudio y los valores registrados por otros autores. Esta diferencia se debe a que la madurez sexual se relaciona con el tamaño y puede ser influenciada por la abundancia y disponbilidad de alimento, temperatura, fotoperiodo y otros factores ambientales en diferentes localidades.
La fecundidad de G. paganellus fue mayor en el golfo de Gabes que en el mar Negro sudoriental (Engin y Seyhan 2009). La eficiencia reproductiva de G. paganellus parece ser similar a la observada en el Atlántico nororiental (Miller 1961). Se encontró una relación positiva y significativa entre la fecundidad y la longitud corporal; este resultado coincide con lo encontrado por Miller (1961).
En resumen, este trabajo proporciona, por primera vez, información básica sobre la reproducción e historia de vida de G. paganellus en aguas del sur de Túnez. Esta especie mostró un ciclo reproductivo en invierno. Se requieren estudios adicionales para obtener más detalles de la función bio-ecológica de este pequeño pez en hábitats costeros y rocosos.
AGRADECIMIENTOS
Se agradece al personal técnico y de apoyo del INSTM (Sfax) su asistencia durante los muestreos y análisis de laboratorio, así como a los revisores anónimos cuyos comentarios mejoraron el manuscrito.
REFERENCIAS
Arruda L, Azevedo JN, Neto AI. 1993. Abundance, age structure and growth, and reproduction of gobies (Pisces; Gobiidae) in the Ria de Aveiro Lagoon (Portugal). Estuar. Coast. Shelf Sci. 37: 509-523. [ Links ]
Azevedo JMN, Simas AMV. 2000. Age and growth, reproduction and diet of a sublittoral population of the rock goby Gobius paganellus (Teleostei, Gobiidae). Hydrobiologia 440: 129-135. [ Links ]
Ben Othman S. 1973. Le sud tunisien (golfe de Gabés), hydrologie, sédimentologie, flore et faune. PhD thesis, University of Tunis, Tunisia, 166 pp. [ Links ]
Dunne J. 1978. Littoral and benthic investigations on the west coast of Ireland. IX (Section A: Faunistic and ecological studies). The biology of the rock goby, Gobius paganellus L., at Carna. Proc. R. Irish Acad. 12: 179-191. [ Links ]
Engin S, Seyhan K. 2009. Biological characteristics of rock goby, Gobius paganellus (Actinopterygii: Perciformes: Gobiidae), in the south-eastern Black Sea. Acta Ichthyol. Pisc. 39: 111-118. [ Links ]
Engin S, Turan D, Kovacic M. 2007. First record of the red-mouthed goby, Gobius cruentatus (Pisces: Gobiidae), in the Black Sea. Cybium 31: 87-88. [ Links ]
Fabi G, Giannetti G. 1985. Growth parameters of the black goby (Gobius niger L.) in the Adriatic Sea, based on otoliths reading. Rapp. Comm. Int. Mer Médit. 29: 87-90. [ Links ]
Filiz H, Togula M. 2009. Age and growth, reproduction and diet of the black goby (Gobius niger) from the Aegean Sea, Turkey. J. Fish. Sci. 3: 243-265. [ Links ]
Fouda MM, Hanna MY, Fouda FM. 1993. Reproductive biology of the Red Sea goby, Silhouettea aegyptia, and a Mediterranean goby, Pomatoschistus marmoratus, in Lake Timsah, Suez Canal. J. Fish Biol. 43:139-151. [ Links ]
Fricke R, Bilecenoglu M, Sari HM. 2007. Annotated checklist of fish and lamprey species of Turkey, including a Red List of threatened and declining species. Stuttgarter Beitr. Naturk. A 706: 1-169. [ Links ]
Gandolfi G, Zerunian S, Torricelli P, Marconato A. 1991. I Pesci delle Acque Interne Italiane. Istituto Poligrafico e Zecca dello Stato, Rome, 617 pp. [ Links ]
Gibson RN. 1970. Observations on the biology of the giant goby Gobius cobitis Pallas. J. Fish Biol. 3: 281-288. [ Links ]
Gibson RN. 1972. The vertical distribution and feeding relationships of intertidal fish on the Atlantic coast of France. J. Anim. Ecol. 41: 187-207. [ Links ]
Hajji F, Ouannes-Ghorbel A, Ghorbel M, Jarboui O. 2011. Reproductive cycle and life history traits of the grass goby, Zosterisessor ophiocephalus (Gobiidae), in the Gulf of Gabes (central Mediterranean). Cah. Biol. Mar. 52: 79-88. [ Links ]
Joyeux JC, Bouchereau JL, Tomasini JA. 1991. La reproduction de Gobius niger (Pisces, Gobiidae) dans la lagune de Mauguio, France. Rapports gonadosomatiques, fécondités, ponte, oeufs et larves. Vie milieu 41: 97-106. [ Links ]
Joyeux JC, Tomasini JA, Bouchereau JL. 1992. Modalités de la reproduction de Gobius niger (Teleostei, Gobiidae) dans une lagune méditerranéenne. Vie Milieu 42: 1-13. [ Links ]
Kartas F, Quignard JP. 1984. La fécondité des poissons téléostéens. Collection de Biologie des Milieux Marins. Ed. Masson, 121 pp. [ Links ]
Kovačić M. 2001. The biology of Roule's goby in the Kvarner area, northern Adriatic Sea. J. Fish Biol. 59: 795-809. [ Links ]
Kovačić M. 2007. Reproductive biology of the striped goby, Gobius vittatus (Gobiidae), in the northern Adriatic Sea. Sci. Mar. 71:145-151. [ Links ]
Malavasi S, Fiorin R, Franco A, Torricelli P. 2004. Somatic energy storage and reproductive investment in the grass goby Zosterisessor ophiocephalus. J. Mar. Biol. Assoc. UK 84: 455-459. [ Links ]
Maze RA. 2004. Seasonal and ontogenetic diet shifts in an intertidal population of Gobius paganellus (Teleostei, Gobiidae) from the Cantabrian coast. Vie Milieu 54: 1-6. [ Links ]
Mazzoldi C. 1999. Studio comparativo della dinamica di accoppiamento e fecondazione in Teleostei ad uova demerse [A comparative study on mating behavior and fertilization dynamics in demersal spawner teleosts]. PhD Thesis, University of Padua, Italy. [ Links ]
Mazzoldi C, Scaggiante M, Ambrosin E, Rasotto MB. 2000. Mating system and alternative male mating tactics in the grass goby, Zosterisessor ophiocephalus (Teleostei: Gobiidae). Mar. Biol. 137: 1041-1048. [ Links ]
Mazzoldi C, Petersen CW, Rasotto MB. 2005. The influence of mating system on seminal vesicle variability among gobies (Teleostei, Gobiidae). J. Zool. Sys. 43: 307-314. [ Links ]
Menif D. 2000. Les Gobiidae des cotes tunisiennes: Morphologie et biologie de Zosterisessor ophiocephalus (Pallas 1811) et Gobius niger (Linnaeus 1758). PhD thesis, University of Tunis, Tunisia. [ Links ]
Miller PJ. 1961. Age, growth, and reproduction of the rock goby, Gobius paganellus L., in the Isle of Man. J. Mar. Biol. Assoc. UK 41: 737-769. [ Links ]
Miller PJ. 1984. The tokology of Gobioid fishes. In: Potts GW, Wootton RJ (eds.), Fish Reproduction: Strategies and Tactics. Academic Press, London, pp. 119-153. [ Links ]
Miller PJ. 1986. Gobiidae. In: Whitehead PJP, Bauchot ML, Hureau JC, Nielsen J, Tortonese E (eds.), Fishes of the Northern Eastern Atlantic and the Mediterranean. Unesco, Paris, pp. 1019-1085. [ Links ]
Nash RDM. 1984. Aspects of biology of the black goby, Gobius niger L., in Oslofjorden, Norway. Sarsia 69: 55-61. [ Links ]
Ota D, Marchesan M, Ferrero EA. 1996. Sperm release behaviour and fertilization in the grass goby. J. Fish Biol. 49: 246-256. [ Links ]
Patzner RA, Seiwald M, Angerer S, Ferrero EA, Giulianini PG. 1991. Genital system and reproductive cycle of the male grass goby, Zosterisessor ophiocephalus (Teleostei, Gobiidae), in the northern Adriatic Sea. Zool. Anz. 226: 205-219. [ Links ]
Rasotto MB, Mazzoldi C. 2002. Male traits associated with alternative reproductive tactics in Gobius niger. J. Fish Biol. 61: 173-184. [ Links ]
Scaggiante M, Mazzoldi C, Petersen CW, Rasotto MB. 1999. Sperm competition and mode of fertilization in the grass goby Zosterisessor ophiocephalus (Teleostei: Gobiidae). J. Exp. Zool. 283: 81-90. [ Links ]
Scherrer B. 1984. Biostatistique. Gaetan Morin Editeur, Montreal, Paris, Casablanca, 850 pp. [ Links ]
Silva MN, Gordo LS. 1997. Age, growth and reproduction of the black goby, Gobius niger, from Óbidos Lagoon, Portugal. Cah. Biol. Mar. 38: 175-180. [ Links ]
Vaas KF, Vlasblom AG, Koeijer P. 1975. Studies on the black goby (Gobius niger, Gobiidae, Pisces) in the Veerse Meer, SW Netherlands. Neth. J. Sea Res. 9: 56-68. [ Links ]
Vesey G, Langford TE. 1985. The biology of the black goby, Gobius niger L., in an English south-coast bay. J. Fish Biol. 27: 417429. [ Links ]
Zar JH. 1996. Biostatistical Analysis. 3rd ed. Prentice-Hall, New Jersey, 662 pp. [ Links ]
Nota
Traducido al español por Christine Harris.














