Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.38 no.3 Ensenada Set. 2012
https://doi.org/10.7773/cm.v38i3.1989
Viabilidad del cultivo del misidáceo Gastrosaccus roscoffensis (Peracarida, Mysida): Crecimiento, supervivencia, capacidad depredadora y composición lipídica
A general survey of the feasibility of culturing the mysid Gastrosaccus roscoffensis (Peracarida, Mysida): Growth, survival, predatory skills, and lipid composition
A Escánez1,5, R Riera2, L Márquez3, A Skalli1,4, BC Felipe1, I García-Herrero1,5, D Reis1,5,6, C Rodríguez5, E Almansa1*
1 Instituto Español de Oceanografía, Centro Oceanográfico de Canarias, Avenida 3 de Mayo 73, Apdo. 1373, 38005, Santa Cruz de Tenerife, Canary Islands, Spain. *Corresponding author. E-mail: eduardo.almansa@oceanografia.es
2 Centro de Investigaciones Medioambientales del Atlántico (CIMA SL), Arzobispo Elías Yanes 44, 38206 La Laguna, Santa Cruz de Tenerife, Canary Islands, Spain.
3 Departamento de Biología Aplicada, Universidad de Almería, Ctra. Sacramento s/n, La Cañada de San Urbano, 04120, Almería, Spain.
4 Unitat de Cultius Aquatics, Institut de Recerca i Tecnología Agroalimentárias (IRTA), Crta. Poble Nou km 5.5, Sant Carles de la Rápita, 43540 Tarragona, Spain.
5 Departamento de Biología Animal, Universidad de La Laguna, Avenida Astrofísico Francisco Sánchez, 38206 La Laguna, Santa Cruz de Tenerife, Canary Islands, Spain.
6 CCMar, Campus de Gambelas, Faculdade de Ciências e Tecnologia, Universidade do Algarve, 8005-139, Faro, Portugal.
Received April 2011,
Received in revised form April 2012,
Accepted May 2012.
RESUMEN
En el presente estudio se analizaron los efectos de las condiciones de cultivo sobre el crecimiento, la supervivencia, la depredación y la composición nutricional del misidáceo Gastrosaccus roscoffensis. La luminosidad afectó de forma negativa a las tasas de predación de G. roscoffensis y la talla del depredador fue importante cuando depredaba sobre nauplios de Artemia y rotíferos (Brachionus plicatilis). El crecimiento fue superior en las primeras tres semanas; los individuos aumentaron en 7 mm su longitud en seis semanas. La tasa de mortalidad no fue constante, con dos picos de mortalidad a los 10 días y a los 40 días de cultivo. La composición de clases lipídicas de los misidáceos juveniles cultivados difirió de los misidáceos salvajes y de otras especies de misidáceos, con una alta proporción de lípidos neutros (72.04% lípido total), en los cuales predominaron los triglicéridos (41.74%). La composición de ácidos grasos se caracterizó por altos niveles de 18:3n-3 (23.16% lípido total) y monoenos en individuos cultivados de G roscoffensis. Los experimentos realizados demuestran la viabilidad de las condiciones ensayadas para el cultivo de G. roscoffensis, aunque en el futuro son necesarios más experimentos para probar la efectividad de este misidáceo como presa alternativa en la alimentación de nuevas especies de interés comercial, incluyendo peces y cefalópodos.
Palabras clave: Gastrosaccus roscoffensis, cultivo, depredación, composición nutricional.
ABSTRACT
The effects of culture conditions on growth, survival, predation, and nutritional composition of the mysid Gastrosaccus roscoffensis were studied. Light had a negative effect on the predation rates of G. roscoffensis and predator size was important to prey on Artemia nauplii and rotifers (Brachionus plicatilis). Growth rates were higher in the first three weeks and measured individuals increased almost 7 mm in length in six weeks. Mortality rate was not constant, but it peaked during the first 10 days and after the 40th day of culture. Lipid class composition of cultured G. roscoffensis juveniles showed differences compared to wild G. roscoffensis and other mysid species, with a high proportion of neutral lipids (72.04% total lipids) mainly triacylglycerol (41.74%). Fatty acid composition was characterized by high levels of 18:3n-3 (23.16% total lipids) and monoenes in cultured G. roscoffensis. The experiments demonstrated the feasibility of the culturing conditions assayed for G. roscoffensis, although further experiments should be carried out to test this mysid as a prey for new species of commercial interest, including fish and cephalopods.
Key words: Gastrosaccus roscoffensis, culture, predation, nutritional composition.
INTRODUCCIÓN
El género de misidáceos Gastrosaccus constituye un grupo de especies típicamente neríticas, una de las cuales, Gastrosaccus roscoffensis, es parcialmente epibentónica (McQuart-Moulin y Ribera-Maycas 1995). Esta especie se entierra en los primeros centímetros del fondo, en las playas arenosas intermareales cerca del límite superior de la zona de rompiente de las olas (Bacescu 1970). Observaciones preliminares realizadas por Fischelson y Loya (1968) sobre especies del género Gastrosaccus (G. sanctus) en las playas arenosas de Israel mostraron que en ocasiones estos crustáceos abandonaban la arena y avanzaban con las olas volviéndose a enterrar en la arena cuando la ola se retraía.
En general, la mayoría de los misidáceos son considerados omnívoros que se alimentan de detritus y pequeños organismos por filtración (Johnston y Lasenby 1982). Los misidáceos trituran completamente los alimentos (Mauchline 1980), pero en contenidos estomacales de Gastrosaccus psammodytes alimentados con Anaulus birostratus se encontraron fragmentos reconocibles de esta diatomea junto con detritos amorfos.
Hasta ahora, no existen estudios detallados sobre la ecología de la especie G. roscoffensis, un habitante común de la zona intermareal de las playas arenosas del archipiélago Canario (Witman et al. 2010), así como de las costas atlánticas de Europa (Bacescu 1970). Durante el día, los individuos de Gastrosaccus permanecen enterrados en las capas superiores del sedimento y durante la noche nadan en la columna de agua para alimentarse de fitoplancton, zooplancton y detritus (Suau y Vives 1957).
La nutrición de los organismos marinos es una de las áreas de investigación más importantes en acuicultura, debido a que representa uno de los aspectos más significativos en los costes y es esencial para el éxito de la producción de organismos acuáticos. El principal cuello de botella de la acuicultura intensiva se presenta en las etapas larvarias, principalmente de peces, crustáceos y moluscos. La alta mortalidad larvaria hace que muchos cultivos no sean rentables o produzcan un bajo beneficio económico en la industria acuícola (Le Francois et al. 2009). Los macroinvertebrados más extensamente utilizados como presas vivas en acuicultura son los rotíferos (e.g., Brachionus plicatillis) y Artemia sp. (Stottrup y McEvoy 2003). Sin embargo, estas presas no proporcionan todos los requerimientos nutricionales de las etapas larvarias y se necesita enriquecer a los rotíferos y a la Artemia, especialmente con ácidos grasos poliinsaturados de cadena larga (LC-PUFA, por sus siglas en inglés). Numerosas técnicas han sido desarrolladas para resolver este problema; se ha enriquecido a las presas con lípidos ricos en estos ácidos grasos y proteínas, usando microalgas y emulsiones de aceite. Otros factores a tener en cuenta a la hora de utilizar presas alternativas, como el misidáceo G. roscoffensis, son su tamaño, movilidad y palatabilidad, entre otros.
En los últimos años los investigadores han buscado presas alternativas para sustituir a las utilizadas tradicionalmente en acuicultura. Los misidáceos han sido considerados previamente como presas alternativas para algunas especies de interés comercial (principalmente cefalópodos) (Domingues et al. 2001a) y pueden ser una importante fuente de alimento para muchas especies de peces y crustáceos. (Kuhn et al. 1991). Con este objetivo varios autores han utilizado diferentes especies de misidáceos, como Mysidopsis almira (Domingues et al. 1998, 1999, 2001b), Mysis mixta (Gorokhova y Hansson 2000), Mysis relicta (Viherluoto et al. 2000) y Neomysis integer (Gorokhova 2002).
El objetivo principal de este trabajo fue estudiar la viabilidad del cultivo del misidáceo G. roscoffensis en instalaciones acuícolas, mediante el análisis de su crecimiento, supervivencia, capacidad depredadora y composición nutricional (fundamentalmente, composición lipídica) para evaluar su idoneidad como presa alternativa en el cultivo de especies comerciales. Además, se analizaron ejemplares salvajes para comparar su composición con la de los ejemplares cultivados.
MATERIALES Y MÉTODOS
Los ejemplares de G. roscoffensis empleados en el presente estudio fueron recogidos en la playa de Las Gaviotas (noroeste de Tenerife, islas Canarias; 28°30'47" N, 16°10'31" O) mediante redes de arrastre de fondo. Los individuos recolectados fueron transportados al laboratorio, donde se muestrearon en frío, separándolos en tubos Eppendorf, previamente etiquetados, para posteriormente colocarlos en hielo seco hasta su almacenamiento a -80 °C. De esta manera se conservaron para futuros análisis. El cultivo de G. roscoffensis se realizó en tanques de 100 L, en oscuridad, conectados a un sistema de flujo (con renovación 200% por día) y con una densidad de 5 ind L-1. La alimentación se llevó a cabo ad libitum con 100 artemias por misidáceo por día, 200 rotíferos por misidáceo por día y 105 células mL-1 de fitoplancton (Chorella sp.). Los experimentos se efectuaron en las instalaciones del Instituto Español de Oceanografía (IEO de Canarias).
CRECIMIENTO Y SUPERVIVENCIA
El cultivo experimental de misidáceos se llevó a cabo en tanques de 4 L en oscuridad o bajo iluminación (fotoperiodo natural, 100-200 lux), con aireación continua y renovación de agua cada 5 días. La densidad inicial de juveniles de misidáceos fue de 5 ind L-1 y la alimentación se realizó ad libitum con 100 nauplios de Artemia por misidáceo por día, 200 rotíferos por misidáceo por día y 4 x 105 células mL-1 de fitoplancton (Chorella sp.). Los experimentos se realizaron por duplicado.
Durante el experimento, se observaron diferencias con relación al tamaño de los individuos, por lo que se estableció un umbral para distinguir entre los ejemplares pequeños (juveniles) y grandes (adultos). El umbral fue de 9 mm. De este modo, los individuos de entre 2 mm (0 días) y 9 mm se consideraron juveniles, ya que eran notables las diferencias anatómicas con respecto a los especímenes más grandes (9-10.2 mm).
El porcentaje de supervivencia se determinó contabilizando los adultos, los juveniles y los ejemplares recién eclosionados cada nueve días. Todos los misidáceos fueron trasvasados cuidadosamente del tanque a una jarra y fueron contados. El porcentaje de supervivencia se expresó como el porcentaje de misidáceos iniciales, según la siguiente fórmula:

En los días 29, 39 y 46, los individuos fueron tabulados de acuerdo con las variables "iluminación" (dos niveles: luz, oscuridad) y "supervivencia" (dos niveles: muertos, vivos). Las tablas de contingencia 2 x 2 obtenidas se analizaron por la prueba exacta de Fisher (2 colas).
Los valores de crecimiento se basaron en la longitud del cuerpo (desde el rostro hasta el final del último segmento abdominal) de los ejemplares de misidáceos medidos bajo lupa (Nikon SMZ-10A), a cinco aumentos. Las medidas de longitud se tomaron los días 0, 6, 13, 20, 42, 49 y 57. Se midieron cinco misidáceos al día. Las observaciones longitud-edad se describieron mediante la función de crecimiento de von Bertalanffy, de acuerdo con la ecuación

donde Lt es la longitud del cuerpo (en mm) para una determinada edad t (en días), L es la longitud máxima del cuerpo (en mm), k es la constante de crecimiento y t0 es un parámetro relacionado con la longitud en la edad cero (en días) (von Bertalanffy 1938).
CULTIVO DE PRESAS VIVAS
Los nauplios de Artemia sp. empleados como presa viva se obtuvieron por eclosión de los quistes de la empresa INVE Aquaculture (Dendermonde, Bélgica), después de un proceso de descapsulación e incubación. Los rotíferos (B. plicatilis) se cultivaron en tanques de 1000 L y se alimentaron con levadura (Saccharomyces cerevisiae), bajo condiciones de luz continua, agua con temperatura de 21-22 °C y salinidad de 28. El fitoplancton (Chlorella sp.) se cultivó en agua de mar fertilizada con el medio de cultivo F2 Prolina (Aquatic EcoSystems) en tanques de 40 L continuamente iluminados, con temperatura del agua a 19 °C y salinidad de 25.
DISEÑO Y ANÁLISIS DE LOS ENSAYOS DE DEPREDACIÓN
Se diseñaron dos experimentos para investigar la eficiencia de G. roscoffensis como depredador: (1) un experimento multifactorial (4 factores) de baja replicación (x 3)y (2) un experimento bifactorial con mayor número de réplicas (x 7). En ambos experimentos, la variable dependiente fue el número de presas consumidas. El montaje experimental general implicó el ensayo de depredadores individuales en cajas de Petri que contenían 30 mL de agua de mar a 25 °C y tenían el fondo transparente.
Los factores probados en el experimento multifactorial fueron la iluminación (120 lx vs 0 lx), la especie de presa (nauplios de Artemia sp. vs Brachionus sp.), el tamaño del depredador (juveniles vs adultos) y el número inicial de presas (de 9 a 21 por caja de Petri) como co-variable; el tiempo de ensayo fue de 2 h. Los factores probados en el experimento bifactorial fueron la iluminación (120 1x vs 0 1x) y el tamaño del depredador (juveniles vs adultos); el número inicial de presas se fijó en 10 nauplios de Artemia por caja de Petri y el tiempo de ensayo en 4 h.
Ambos experimentos fueron analizados mediante modelos lineales generalizados (GLM) (Agresti 2007). En una primera aproximación, se eligió un GLM con distribución de Poisson y función de enlace logarítmica y se revisó el cociente (verosimilitud)/(grados de libertad) para detectar la posibilidad de sobredispersión; en tal caso, los datos fueron reanalizados mediante un GLM con binomial negativa y función de enlace logarítmica con diferentes parámetros de escala dentro del intervalo 0.25-2.0. El modelo con mayor verosimilitud fue seleccionado.
El algoritmo estadístico utilizado mostró un mensaje de matriz hessiana singular durante el análisis de los datos del experimento bifactorial. Dado que la razón probable para este mensaje era la nula tasa de consumo de todos los misidáceos juveniles que depredaban nauplios de Artemia bajo iluminación (lo que implicaba una varianza nula), se decidió modificar mínimamente los datos mediante el reemplazo de uno de los ceros por un uno. Cuando los datos así modificados fueron reanalizados no se produjeron más mensajes de error.
La variable independiente "numero inicial de presas" en el ensayo multifactorial no estaba fijada, por lo tanto fue incluida como una variable de normalización para estandarizar el número de eventos de depredación con respecto al número de presas expuestas al riesgo de depredación; en este caso, hay que resaltar que la variable dependiente bajo análisis fue el consumo proporcional.
ANÁLISIS BIOQUÍMICOS
Recolección de muestras y conservación
Las muestras de juveniles de misidáceos, alimentados con la mezcla anteriormente mencionada de fitoplancton (Chlorella sp.), nauplios de Artemia, y Brachionus, se obtuvieron mediante el filtrado del flujo de agua saliente de los tanques de puesta de 100 L a través de un filtro de 100 µm. Los ejemplares salvajes se recogieron en la playa de Las Gaviotas directamente con redes de arrastre de fondo. Las muestras se lavaron con agua corriente para retirar el agua salada y posteriormente se secaron con papel secante. A continuación, las muestras se colocaron en hielo seco y, por último, se conservaron a -80° C hasta su utilización para los análisis bioquímicos.
Análisis bioquímicos
El número de réplicas empleado en los análisis bioquímicos fue de tres. El contenido de humedad se determinó manteniendo las muestras a 110° C hasta obtener un peso constante, de acuerdo con el Método Oficial de Análisis de la Asociación Oficial de Química Analítica (AOAC 2006), que es una adaptación del método de Horwirtz (1980).
El lípido total se obtuvo siguiendo el protocolo descrito por Christie (1982). El contenido de lípido total se determinó gravimétricamente, usando cloroformo: metanol (2:1) como solvente para la extracción y butilhidroxitolueno como antioxidante.
Las clases lipídicas se separaron por cromatografía en capa fina de alta resolución y se determinaron por densitometría (dual-wavelength flying spot scanner CS-9001PC, Shimadzu), según el método de Olsen y Henderson (1989).
Los ácidos grasos se obtuvieron a partir del lípido total por transesterificación metílica y posterior purificación, conforme al método de Christie (1982). Una vez purificados, los ésteres metílicos de ácidos grasos (FAME) se separaron y cuantificaron mediante el cromatógrafo de gases TRACE GC Ultra (Thermo Scientific), con un detector de ionización a la llama a 240° C y una columna de sílice Supelcowax 10 (30 m longitud, 0.32 mm diámetro y 0.25 μm anchura). El gas portador fue helio. La temperatura inicial del horno fue de 50° C, seguida de un incremento de temperatura a diferentes tasas: de 40 °C min-1 hasta alcanzar 150 °C, 2 °C min-1 hasta 200 °C, 1 °C min-1 hasta 214 °C y, por último, de 40 °C min-1 hasta 230 °C. Finalmente, el horno permaneció a 230° C durante 5 min. El tiempo total transcurrido fue de 46.90 min. Para confirmar la identidad de los FAME individualmente, se empleó un espectómetro de masas cuadrupolo (Thermo Scientific) con ionización electrónica (fuente iónica a 250 °C). Los intervalos de incremento de temperatura del horno fueron los mismos que los usados en la cromatografía de gases. De nuevo, el gas portador fue helio, con un flujo constante de 1.5 mL min-1.
La determinación del contenido de proteína total se llevó a cabo mediante una modificación del método de Kjeldahl (AOAC 2006). El contenido proteico se calculó a partir del contenido de nitrógeno total de las muestras.
Análisis estadístico
Los resultados de composición bioquímica se presentan como la media ± desviación estándar. Se comprobó la normalidad de los datos con la prueba de Kolmogorov-Smirrnov para una muestra, así como la homogeneidad de las varianzas con la prueba de Levene. Cuando fue necesario, se realizó la transformación de los datos a arcoseno. Para aquellos datos expresados como porcentaje, se aplicó directamente la transformación a arcoseno (Fowler et al. 2002). La comparación entre ejemplares de misidáceos salvajes y cultivados se llevó a cabo mediante la prueba t de Student (Zar 1984). En todas las pruebas estadísticas se consideró diferencia significativa para P < 0.05. Todos los análisis se realizaron mediante el paquete estadístico SPSS (versión 13.0).
RESULTADOS
Ensayos de depredación
El efecto general de la luz fue negativo; el consumo proporcional medio se redujo aproximadamente a la mitad bajo iluminación cuando los misidáceos (los dos tamaños agrupados) depredaban nauplios de Artemia y hasta en tres cuartas partes cuando depredaban Brachionus plicatilis (tabla 1). Contrariamente, el efecto general del tamaño del predador fue positivo en los experimentos con luz, más claramente cuando los misidáceos depredaban nauplios de Artemia (tabla 1). En cualquier caso, la interpretación de estos dos factores se vio oscurecida por el término de interacción triple, que pareció deberse a un debilitamiento del efecto inhibidor de la luz en adultos que deprendan Artemia.
Los efectos de la luz en la tasa de depredación de G. roscoffensis fueron significativos en ambos experimentos (experimento multifactorial, Wald = 13.65, P = 0.000; experimento bifactorial, Wald = 4.164, P = 0.041), particularmente en el experimento multifactorial; el tamaño del misidáceo sólo fue significativo en el experimento bifactorial (Wald = 4.764, P = 0.029), en condiciones de alta replicación. Finalmente, el término de triple interacción (presa x tamaño x luz) mostró significación estadística en el experimento multifactorial (Wald = 6.215, P = 0.013) (tabla 2).
Supervivencia y crecimiento
La supervivencia de los ejemplares de G. roscoffensis mostró dos importantes descensos durante el periodo de cultivo. El primero ocurrió durante los días 9-10, con una tasa de mortalidad de entre 20% y 60%. El segundo episodio de mortalidad tuvo lugar el día 28 en experimentos sin supervivientes en el día 55, o durante los días 40-43 en experiencias con población viable después del día 50. En relación al efecto de la iluminación en la supervivencia, pareció registrarse una posible asociación positiva entre oscuridad y supervivencia en los días 29, 39 y 46 (tabla 3).
El crecimiento de los misidáceos se muestra en la figura 1. La longitud inicial del cuerpo de los misidáceos fue de 2.7 ± 0.2 mm. Se observó un pico importante de crecimiento durante las tres primeras semanas, mientras que en la cuarta semana no hubo incremento de tamaño. Los ejemplares de misidáceos alcanzaron los 9.6 ± 0.7 mm de longitud en la sexta semana, aumentando 7 ± 0.8 mm a lo largo de todo el experimento (65 días). Las tasas de crecimiento fueron similares a las observadas en otras especies de misidáceos (tabla 4). Los parámetros estimados tras ajustar los datos de longitud a una función de crecimiento de von Bertalanffy (R = 0.967) fueron los siguientes: L∞ = 12.1 mm, k = 0.03 día-1 y t0 = -7.2 día.
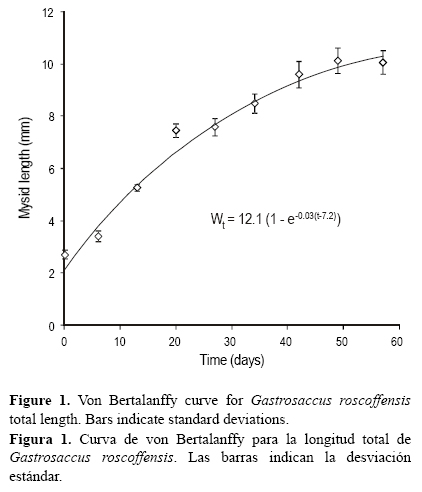
En el presente experimento, se completó el ciclo de vida de G. roscoffensis y se obtuvieron individuos adultos a partir de los juveniles cultivados. Se realizaron observaciones sobre la fecundidad de las hembras en un solo tanque: cuatro adultos produjeron un total de 40 juveniles después de 54-66 días, obteniéndose el mayor número de juveniles tras 61 días de cultivo. La inspección visual de hembras ovígeras de G. roscoffensis indicó la presencia de 10-14 juveniles por hembra durante el periodo de estudio (obs. pers. A Escánez y E Almansa), pero no se llevó a cabo un estudio sistemático de los parámetros de fecundidad.
COMPOSICIÓN NUTRICIONAL
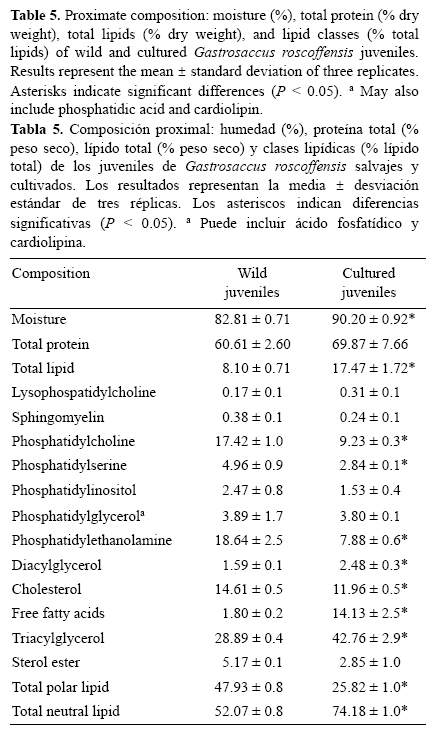
Se analizó tanto la composición nutricional de los ejemplares salvajes como la de los juveniles nacidos en cautividad y alimentados con la mezcla de Artemia, Brachionus y fitoplancton. Los datos de humedad, proteína total, lípido total (LT) y clases lipídicas de ambos grupos de G. roscoffensis (cultivados y salvajes) se muestran en la tabla 5. La proteína total (porcentaje en peso seco, incluyendo nitrógeno no protéico) representó el 60.61 ± 2.60 y 69.87 ± 7.66 en misidáceos salvajes y cultivados, respectivamente. El porcentaje de LT fue menor en individuos salvajes (8.10 ± 0.71) que en los cultivados (17.47 ± 1.72). La composición de clases lipídicas (expresada como porcentaje de LT) de ambos grupos presentó diferencias con relación a los lípidos polares y neutros. Entre los lípidos polares, las diferencias más notables se observaron en la fosfatidilcolina (PC) y fosfatidiletanolamina (PE), que mostraron valores de 17.42 ± 1.00 y 18.64 ± 2.50, respectivamente, en individuos salvajes y 9.23 ± 0.23 y 7.88 ± 0.60, respectivamente, en individuos cultivados. Con relación a los lípidos neutros, los misidáceos cultivados revelaron un mayor contenido respecto a los animales salvajes en ácidos grasos libres (14.13 ± 2.5 vs 1.80 ± 0.2) y triglicéridos (TG) (42.76 ± 2.90 vs 28.89 ± 0.40).
La tabla 6 muestra la composición de ácidos grasos de LT (expresados como porcentaje del total de ácidos grasos) de G. roscoffensis. Se detectaron diferencias entre misidáceos salvajes y cultivados para la mayoría de ácidos grasos analizados. Los ácidos grasos poliinsaturados (PUFA) y los ácidos grasos monoinsaturados (MUFA) fueron los grupos mayoritarios de ácidos grasos en los misidáceos cultivados, con 44.21 ± 1.84 y 31.77 ± 1.38 de LT, respectivamente; mientras que los PUFA, con 50.39 ± 0.6, y los ácidos grasos saturados (SFA), con 32.45 ± 0.49, predominan en los animales salvajes. Los ácidos grasos altamente insaturados de la serie n-3 (n-3 HUFA) fueron claramente más abundantes en los ejemplares salvajes que en los cultivados (39.28 ± 0.91 vs 11.21 ± 0.88), debido principalmente al 20:5n-3 (ácido eicosapentaenoico, EPA; 20.43 ± 0.35 vs 5.51 ± 0.90) y 22:6n-3 (ácido docosahexanoico, DHA; 17.30 ± 1.12 vs 3.48 ± 0.27). La relación DHA:EPA, aunque menor que 1 en ambos casos, fue ligeramente mayor en los individuos salvajes (0.85 vs 0.64). Finalmente, el porcentaje de 20:4n-6 (ácido araquidonico, ARA) representó sólo 2.31 ± 0.05 y 1.14 ± 0.24 del porcentaje de LT en los animales salvajes y cultivados, respectivamente. Las relaciones DHA:ARA y EPA:ARA fueron aproximadamente el doble en ejemplares cultivados que en salvajes.

DISCUSIÓN
La gestión del cultivo es el factor más importante para conseguir cultivos altamente productivos de misidáceos (Lussier et al. 1988). En el presente estudio se utilizó un sistema abierto de renovación, al contrario que en experimentos previos con misidáceos (Domingues et al. 1998, 1999). Este sistema de cultivo tenía como objetivo mejorar la calidad del agua, ya que se ha observado que las altas concentraciones de amonio, nitratos y nitritos, junto con niveles bajos de oxígeno disuelto, incrementan la mortalidad de los misidáceos (Brandt et al. 1993).
Se ha documentado que la luz inhibe las tasas de alimentación en misidáceos pelágicos con migración vertical como consecuencia de la necesidad de evitar los predadores visuales, pero no en misidáceos litorales que pueden ocultarse en la vegetación de macroalgas, siendo el efecto mayor en animales juveniles (Viherluoto y Viitasalo 2001a). Estos resultados previos no pueden aplicarse directamente a los datos aquí presentados, ya que G. roscoffensis muestra inhibición por luz a pesar de ser una especie litoral; de todas formas, esta especie efectúa una migración diaria entre los fondos arenosos y la columna del agua, donde puede ser encontrada durante la noche, como ocurre en otras especies de Gastrosaccus (Suau y Vives 1957). Por lo tanto, todavía es viable hipotetizar una solución de compromiso entre la evitación de los predadores visuales y la necesidad de alimentación. Sea como fuere, el efecto de la luz aquí presentado es de gran importancia en el diseño de protocolos de alimentación para esta especie.
Un segundo hecho de interés es la homogeneidad en las tasas de alimentación entre juveniles y adultos cuando depredaron rotíferos, lo que sugiere diferentes mecanismos de captura de acuerdo con las características de la presa. A este respecto, los rotíferos del género Brachionus, nadadores menos poderosos y más transparentes que los nauplios de Artemia, podrían ser más propensos a ser capturados mediante mecanismos de filtración mientras que los nauplios de Artemia lo serían mediante un mecanismo de presa (Viherluoto y Viitasalo 2001b); ambos mecanismos están presentes en otras especies de misidáceos, tales como Neomysis integer (Fockedey 2005) y Praunus flexuosus (Viitasalo y Rautio 1998).
Finalmente, las tasas de depredación de nauplios de Artemia más pequeñas que se registraron en el experimento bifactorial pueden ser parcialmente explicadas por la conocida bajada de las tasas de consumo a lo largo del tiempo, lo que implica menores tasas para los ensayos más largos (Gorokhova y Hansson 1997), sin que se pueda excluir un efecto de las diferencias en el grado de repleción digestiva.
En el presente estudio, se utilizó una densidad inicial de misidáceos de 5 ind L-1, ya que los misidáceos depredan con mayor probabilidad sobre sus juveniles si la comida es limitante (Reistema y Neff 1980, Lussier et al. 1988, Domingues et al. 1998). La subalimentación, causante del canibalismo, y la sobrealimentación, causante de baja calidad del agua, pueden ocurrir con frecuencia. Además, la densidad de población puede afectar al comportamiento reproductivo; una población muy densa muestra una mayor proporción de hembras con sacos ovígeros vacíos (Lussier et al. 1988).
Los experimentos de supervivencia llevados a cabo en el presente estudio duraron 55 días, un periodo más largo comparado con los experimentos realizados con Leptomysis sp. (Domingues et al. 2000). Las tasas de supervivencia de los juveniles fueron bajas (40-80%) en los 10 primeros días de cultivo, en consonancia con experiencias anteriores (Domingues et al. 2000, 2001b). Sin embargo, dos eventos de importante mortalidad fueron observados más tarde (día 28 y días 40-43), hecho no recogido por otros autores con otras especies de misidáceos. La asociación aparente entre oscuridad y supervivencia coincide con el también efecto positivo de la oscuridad en la tasa de predación, lo que sugiere una relación causal entre ingestión y tasa de supervivencia.
En términos de tasa de crecimiento, G. roscoffensis manifestó valores similares a los ya obtenidos para otras especies (Leptomysis sp., Mysidopsis almira y Neomysis intermedia) (Domingues et al. 1999, 2000, 2001b). La especie estudiada creció 6.8 mm en 42 días, un periodo más largo comparado con el de estudios previos (15-34 días) (Domingues et al. 1999, 2000, 2001b), probablemente debido a la temperatura del cultivo (22-27 °C vs 20 °C en experimentos con G. roscoffensis). Finalmente, Toda et al. (1984) registró una alta variación en las tasas de crecimiento de N. intermedia dependiendo de la dieta, 0.03 mm día-1 cuando la alimentación constaba de nauplios de Artemia enriquecida, rotíferos y Daphnia, y 0.32 mm día-1 cuando la alimentación se basaba en rotíferos y Daphnia (tabla 3).
En relación a la composición bioquímica, los porcentajes (porcentaje en peso seco) de proteína total de los ejemplares salvajes y cultivados de G. roscoffensis (60.61 ± 2.60 y 69.87 ± 7.66, respectivamente) fueron similares a los valores obtenidos en otras especies de misidáceos (salvajes y/o cultivados), tales como Metamysidopsis insularis (Guevara etal. 2005), Mesopodopsis orientalis (Eusebio et al. 2010), Paramysis nouveli y Leptomysis lingvura (Herrera et al. 2009). De la misma manera, el porcentaje de LT de los individuos de G. roscoffensis cultivados fue similar a los valores de las especies anteriormente mencionadas. En cambio, el LT de los ejemplares salvajes de G. roscoffensis (8.10 ± 0.71) fue aproximadamente la mitad de los valores presentados en los artículos ya mencionados; únicamente los ejemplares salvajes de M. orientalis muestran un valor semejante de LT (10.60 ± 0.10).
La composición de clases lipídicas reflejó diferencias significativas cuando se compararon los datos con los obtenidos para ejemplares cultivados de N. intermedia (Ando y Nozaki 2007). En los misidáceos cultivados de G. roscoffensis, los lípidos neutros representaron la fracción principal (74.18% de LT), con un alto porcentaje de TG (42.76%), pero en N. intermedia los lípidos polares (principalmente PE, PC y fosfatidilinositol (PI)) fueron claramente predominantes (63.8 %), representando los TG únicamente el 6.8% de LT (Ando y Nozaki 2007). Otro dato relevante es el porcentaje de ácidos grasos libres encontrado en ejemplares de G. roscoffensis cultivados (14.13% de LT). Este valor tan elevado de esta clase lipídica no es usual en los organismos marinos, pero el dato concuerda con los valores de ácidos grasos libres observados en N. intermedia (Ando y Nozaki 2007).
La composición de ácidos grasos de los ejemplares salvajes recolectados en el presente estudio reflejó la composición de ácidos grasos de otras especies de misidáceos previamente estudiadas, como Amblyops kempy (Woods y Valentino 2003) y M. orientalis (Eusebio et al. 2010), así como de otras especies marinas componentes del zooplancton (Brett et al. 2009), en las cuales los ácidos grasos más importantes fueron 16:0, 20:5n-3 y 22:6n-3. Por otro lado, la especie M. insularis salvaje presentó bajos niveles de estos dos últimos ácidos grasos (Guevara et al. 2005). Tras el periodo de cultivo, G. roscoffensis mostró diferencias con los ejemplares salvajes. Los niveles de DHA y EPA descendieron significativamente y la composición de ácidos grasos de G. roscoffensis cultivado pasó a ser caracterizada por una predominancia de 18C-PUFA y monoenos, siendo el 18:3n-3 (ácido linoleico) el ácido graso principal de LT (22.34% de LT), seguido por el 18:1n-9 (ácido oleico).
Es llamativo el hecho de que la composición lipídica de los ejemplares cultivados de G. roscoffensis obtenida en este estudio refleja la composición lipídica de la Artemia comercial (Coutteau y Mourente 1997) empleada como presa, en especial los altos niveles de TG y 18:3n-3, así como los bajos niveles de n-3 HUFA. No obstante, la relación DHA:EPA se ve disminuida en sólo un 25% (de 0.85 a 0.63), a pesar de la relación DHA:EPA cercana a cero detectada en la Artemia recién eclosionada, sin enriquecer (Coutteau y Mourente 1997). Una posible explicación a esta semejanza con el perfil de ácidos grasos de Artemia podría ser la alta ingestión de esta presa por parte de los misidáceos, como fue ya descrito por Domingues et al. (2001b). Las diferencias en la composición nutricional entre especies de misidáceos pueden estar ocasionadas por las diferencias entre ejemplares salvajes y cultivados, e incluso por los diferentes hábitats de alimentación entre especies epibénticas y planctónicas (i.e., Leptomysis spp. y Mysidium spp.). De hecho, las especies de agua dulce se caracterizan por altos niveles de 18:3n-3, y una especie de Gastrosaccus (G. sanctus) se ha descrito asimismo en el río Ebro, lo cual podría explicar la composición de ácidos grasos descrita en estas especies. Tomados en su conjunto, estos datos nutricionales sugieren que la composición lipídica de G. roscoffensis cultivado podría ser pobre en términos de calidad lipídica. Sin embargo, las altas tasas de predación hacia la Artemia indican que los protocolos habituales de enriquecimiento de Artemia con n-3 HUFA podrían emplearse para transferir estos nutrientes a G. roscoffensis y convertirlo en un tipo de presa alternativa y/o complementaria. Otra posibilidad de mejorar el perfil de ácidos grasos del misidáceo es enriquecer a los ejemplares con emulsiones lipídicas, tal y como fue estudiado anteriormente por Ando y Nozaki (2007) para el misidáceo N. intermedia. Tras el periodo de cultivo, los niveles de DHA oscilaron entre 23.3 y 14.3 (porcentaje del total de ácidos grasos).
Por otro lado, convendría tener en consideración otros nutrientes, como aminoácidos, carbohidratos, oligoelementos, vitaminas y carotenoides. Igualmente, para profundizar en todos los aspectos mencionados, son necesarias más investigaciones y estudios acerca de la calidad nutricional de G. roscoffensis bajo diferentes protocolos de cultivo, incluyendo diversas presas o dieta inerte.
En general, los misidáceos han demostrado ser una buena presa por su accesibilidad en el mar, pudiendo ser capturados con medios sencillos y económicos. De hecho, algunas especies han sido masivamente producidas y vendidas como presas. La especie del presente estudio, G. roscoffensis, podría ser una buena candidata como presa complementaria para estadios larvarios de especies con interés comercial. Aunque G. roscoffensis no puede sustituir todavía a los nauplios de Artemia en los protocolos de cultivo y, por tanto, no puede ser considerada estrictamente como presa alternativa, nos gustaría llamar la atención en el hecho de que los misidáceos pueden mejorar la ingestión y las tasas de supervivencia en aquellas especies que requieren de presas de mayor tamaño en los primeros estadios, tales como los cefalópodos. Las zoeas de ciertos decápodos han sido empleadas como presa complementaria, pero también necesaria, para mejorar la supervivencia de las paralarvas de Octopus vulgaris, y muchos autores han apoyado la investigación con misidáceos en dicho contexto (Iglesias et al. 2007). De manera similar, los juveniles de Sepia officinalis no crecen de forma adecuada con una dieta que incluya solo Artemia adulta (Domingues et al. 2001a). Las condiciones de alimentación y el cultivo de ambas especies, O. vulgaris y S. officinalis, están siendo ampliamente investigadas con fines productivos en la actualidad tanto en España como en Portugal. El tamaño, la palatabilidad, la tasas de crecimiento y supervivencia, y la reproducción en cautividad deberían ser tomadas en cuenta para futuras experiencias de cultivo con G. roscoffensis.
Con el objetivo de considerar al misidáceo G. roscoffensis como una presa viva en acuicultura, sugerimos el uso de tanques aireados en oscuridad con densidades de 5 ind L-1y la alimentación ad libitum con una mezcla de fitoplancton (Chlorella sp.), Brachionus, y nauplios de Artemia enriquecida con n-3 HUFA.
AGRADECIMIENTOS
Este trabajo ha sido en parte desarrollado por el proyecto de investigación PRESAPUL ("Uso de presas alternativas para el crecimiento de paralarvas de pulpo común (Octopus vulgaris) (2009-2011) referencia, PI SolsubC200801000162"), financiado por el Gobierno de Canarias (ACIISI), así como el proyecto de investigación NUTRIPULPO, financiado por JACUMAR (Gobierno de España). Los autores agradecen a G Guerao (Institut de Recerca i Tenología Agroalimentarias, España) y C San Vicente (Universidad Autónoma de Barcelona, España) la confirmación taxonómica de G. roscoffensis, y a V Martín (Instituto Español de Oceanografía, Canarias) por sus comentarios constructivos en la versión preliminar del manuscrito.
REFERENCIAS
Agresti A. 2007. An Introduction to Categorical Data Analysis. 2nd ed. Wiley, Hoboken, New Jersey, 372 pp. [ Links ]
Ando Y, Nozaki M. 2007. Lipid profile of mysid Neomysis intermedia and its changes by feeding DHA-rich marine lipids. J. Oleo Sci. 56: 471-478. [ Links ]
AOAC. 2006. Analysis of the Association of Official Analytical Chemistry. Official method 942.05. 2590 pp. [ Links ]
Bacescu M. 1970. Contributions á l'étude morphoécologique des Gastrosaccinae (Crustacea, Mysidacea) du versant est de l'Atlantique et de la Méditerranée. Description de G. mediterraneus n.sp., G. olivae n.sp. et G. roscoffensis n.sp. Rev. Roum. Biol. Zool. 15: 217-234. [ Links ]
Brandt OM, Fujimura RW, Finlayson B. 1993. Use of Neomysis mercedis (Crustacea: Mysidacea) for estuarine toxicity test. Trans. Am. Fish Soc. 122: 279-288. [ Links ]
Brett MT, Müller-Navarra DC, Persson J. 2009. Crustacean zooplankton fatty acid composition. In: Arts MT, Brett MT, Kainz MJ. (eds.), Lipids in Aquatic Ecosystems. Springer, New York, 377 pp. [ Links ]
Christie W. 1982. Lipid Analysis. Isolation, Separation, Identification, and Structural Analysis of Lipids. 2nd ed. Pergamon Press, New York, 207 pp. [ Links ]
Coutteau P, Mourente G. 1997. Lipid classes and their contents of n3 highly unsaturated fatty acids (HUFA) in Artemia franciscana after hatching, HUFA-enrichment and subsequent starvation. Mar. Biol. 130: 81-91. [ Links ]
Domingues P, Turk PE, Andrade JP, Lee PG. 1998. Pilot-scale production of mysid shrimp in a static water system. Aquacult. Int. 6 : 3 87-402. [ Links ]
Domingues PM, Turk PE, Andrade JP, Lee PG. 1999. Culture of the mysid, Mysidopsis almyra (Bowman) (Crustacea: Mysidacea), in a static water system: Effects of density and temperature on production, survival and growth. Aquacult. Res. 30: 135-143. [ Links ]
Domingues PM, Fores F, Turk PE, Lee PG, Andrade JP. 2000. Mysid culture: Lowering costs with alternative diets. Aquacult. Res. 31: 719-728. [ Links ]
Domingues PM, Sykes AV, Andrade JP. 2001a. The use of Artemia sp. or mysids as food source for hatchlings of the cuttlefish (Sepia officinalis L.); effects on growth and survival throughout the life cycle. Aquacult. Int. 4: 319-331. [ Links ]
Domingues PM, Turk PE, Andrade JP, Lee PG. 2001b. Effects of different food items on the culture of the mysid shrimp Mysidopsis almyra (Crustacea: Pericaridea) in a static water system. Aquacult. Int. 9: 393-400. [ Links ]
Eusebio PS, Coloso RM, Gapasin RSJ. 2010. Nutritional evaluation of mysids Mesopodopsis orientalis (Crustacea: Mysida) as live food for grouper Epinephelus fuscoguttatus larvae. Aquaculture 306(1/4): 289-294. [ Links ]
Fischelson L, Loya Y. 1968. Preliminary observations on a population of Gastrosaccus sanctus (Van Beneden) (Mysidacea, Gastrosaccinae) on a Mediterranean sand beach of Israel. Crustaceana 15: 149-152. [ Links ]
Fockedey N. 2005. Diet and growth of Neomysis integer (Leach 1814) (Crustacea, Mysidacea). PhD thesis, University of Ghent. [ Links ]
Fowler J, Cohen L, Jarvis P. 2002. Practical Statistics for Field Biology. 2nd ed. Wiley and Sons, West Sussex, UK, 259 pp. [ Links ]
Gorokhova E. 2002. Moult cycle and its chronology in Mysis mixta and Neomysis integer (Crustacea: Mysidacea): Implications for growth assessment. J. Exp. Mar. Biol. Ecol. 278: 179-194. [ Links ]
Gorokhova E, Hansson S. 1997. Effects of experimental conditions on the feeding rates of Mysis mixta (Crustacea, Mysidacea). Hydrobiologia 355: 167-172. [ Links ]
Gorokhova E, Hansson S. 2000. Elemental composition of Mysis mixta (Crustacea: Mysidacea) and energy costs of reproduction and embryogenesis under laboratory conditions. J. Exp. Mar. Biol. Ecol. 246: 103-123. [ Links ]
Guevara M, Lodeiros C, Donato MD, Graciani C, Freites L. 2005. Nutritional quality of Metamysidopsis insularis Brattegard (Crustacea: Mysidacea). Aquacult. Nutr. 11: 315-319. [ Links ]
Herrera A, Gómez M, Molina L, Otero F, Packard T. 2009. Advances in rearing techniques and analysis of nutritional quality of two mysid species present in Gran Canaria. Eur. Aquacult. Soc. Spec. Publ. 38: 171-174. [ Links ]
Horwitz W. 1980. Methods of Analysis. 13th ed. Association of Official Analytical Chemists, Washington, DC, 1038 pp. [ Links ]
Iglesias J, Sánchez JL, Bersano JGF, Carrasco JF, Dhont J, Fuentes L, Linares L, Muñoz JL, Okumura S, Roo J, van der Meeren T, Vidal EAG, Villanueva R. 2007. Rearing of Octopus vulgaris paralarvae: Present status, bottlenecks and trends. Aquaculture 266: 1-15. [ Links ]
Johnston NT, Lasenby DC. 1982. Diet and feeding of Neomysis mercedis Holmes (Crustacea, Mysidacea) from the Fraser River Estuary, British Columbia. Can. J. Zool. 60: 813-824. [ Links ]
Kuhn AH, Bengtson DD, Simpson KL. 1991. Increased reproduction by mysids (Mysidopsis bahia) fed with enriched Artemia sp. nauplii. Am. Fish. Soc. Symp. 9: 192-199. [ Links ]
Le Francois N, Jobling M, Carter C, Blier P. 2009. Finfish aquaculture: Species selection for diversification. CABI International, Oxforshire, UK, 640 pp. [ Links ]
Lussier SM, Kuhn A, Chammas MJ, Sewall J. 1988. Techniques for the laboratory culture of Mysidopsis species (Crustacea: Mysidacea). Environ. Toxicol. Chem. 7: 969-977. [ Links ]
Mauchline J. 1980. The biology of mysids and euphausiids. Adv. Mar. Biol. 18: 1-681. [ Links ]
McQuart-Moulin C, Ribera-Maycas E. 1995. Inshore and offshore diel migrations in European benthopelagic mysids, genera Gastrosaccus, Anchialina and Haplostylus (Crustacea, Mysidacea). J. Plankton Res. 17: 531-555. [ Links ]
Olsen RE, Henderson RJ. 1989. The rapid analysis on neutral and polar marine lipids using double development HPTLC and scanning densitometry. J. Exp. Mar. Biol. Ecol. 129: 189-197. [ Links ]
Reistema L, Neff JM. 1980. A recirculating artificial seawater system for the laboratory culture of Mysidopsis almyra (Crustacea: Pericaridea). Estuaries 3: 321-323. [ Links ]
Stottrup J, McEvoy LA. 2003. Live Feeds in Marine Aquaculture. Blackwell, Oxford, 318 pp. [ Links ]
Suau P, Vives F. 1957. Sobre la presencia de Gastrosaccus sanctus (van Beneden) en la desembocadura del río Ebro. Invest. Pesq. 8: 121-126. [ Links ]
Toda H, Takahashi M, Ichumura S. 1984. The effect of temperature on the post-embryonic growth of Neomysis intermedia Czerniawsky (Crustacea, Mysidacea) under laboratory conditions. J. Plankton Res. 6: 647-662. [ Links ]
Viherluoto M, Viitasalo M. 2001a. Effect of light in the feeding rates of pelagic and littoral mysid shrimps: A trade-off between feeding success and predation avoidance. J. Exp. Mar. Biol. Ecol. 261: 237-241. [ Links ]
Viherluoto M, Viitasalo M. 2001b. Temporal variability in functional responses and prey selectivity of the pelagic mysid, Mysis mixta, in natural prey assemblages. Mar. Biol. 138:575-583. [ Links ]
Viherluoto M, Kuosa H, Flinkman J, Viitasalo M. 2000. Food utilisation of pelagic mysids, Mysis mixta and M. relicta, during their growing season in the northen Baltic Sea. Mar. Biol. 136:553-559. [ Links ]
Viitasalo M, Rautio M. 1998. Zooplanktivory by Praunus flexuosus (Crustacea: Mysidacea): Functional responses and prey selection in relation to prey escape responses. Mar. Ecol. Prog. Ser. 174: 77-87. [ Links ]
Von Bertalanffy L. 1938. A quantitave theory of organic growth (inquiries on growth laws). Hum. Biol. 10: 181-213. [ Links ]
Wittmann K, Moro L, Riera R. 2010. Sobre la distribución de Gastrosaccus roscoffensis (Crustacea: Mysida) en el Atlántico nororiental y primer registro para las islas canarias. Rev. Acad. Canar. Cienc. XXII(4): 91-101. [ Links ]
Woods CMC, Valentino F. 2003. Frozen mysids as an alternative to live Artemia in culturing seahorses Hippocampus abdominalis. Aquacult. Res. 34: 757-763. [ Links ]
Zar JH. 1984. Biostatistical Analysis. Prentice-Hall, Englewood Cliffs, New Jersey, 619 pp. [ Links ]














