Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.38 no.2 Ensenada Jun. 2012
Artículos
Índice gonadal y desarrollo larvario de la galleta de mar Dendraster excentricus (Echinodermata; Echinoidea) en Baja California, México
Gonad index and larval development of the sand dollar Dendraster excentricus (Echinodermata; Echinoidea) in Baja California, Mexico
T Olivares-Bañuelos, S Figueroa-Flores, E Carpizo-Ituarte*
Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Apartado postal 453, Ensenada 22800, Baja California, México. * Corresponding author. E-mail: ecarpizo@uabc.edu.mx, ecarpizo@gmail.com
Received December 2010,
received in revised form March 2012,
accepted March 2012.
RESUMEN
La galleta de mar Dendraster excentricus ha sido extensivamente utilizada en diversos estudios en Baja California (México). El presente trabajo muestra la variación anual del índice gonadal y describe el desarrollo larvario de D. excentricus en condiciones de laboratorio. Durante un periodo de un año, se recolectaron mensualmente galletas adultas (6.73 ± 0.56 cm de diámetro, 23.22 ± 6.90 g). El análisis mensual del índice gonadal (hembras y machos) y la determinación del tamaño de los huevos fueron considerados para estimar el periodo reproductivo de esta especie en el estero de Punta Banda (Baja California). Los resultados sugieren que D. excentricus presenta dos picos reproductivos máximos, uno durante el inicio de la primavera y otro en el verano, aunque se observaron gametos viables todo el año. El desarrollo larvario tuvo una duración de 21-23 días desde la fertilización hasta la metamorfosis en condiciones de laboratorio (19 ± 2 °C, 33.5 de salinidad). La formación de la blástula se observó a las 5 h postfertilización. Las larvas equinopluteus de cuatro brazos, con un tamaño de 387.00 ± 23.25 μm desde el brazo aboral al dorsal, se observaron a los dos días de la fertilización. Se desarrolló un estadio larval diferente aproximadamente cada dos días. Las larvas equinopluteus de ocho brazos alcanzaron un tamaño promedio de 744.60 ± 69.45 μm. El rudimento juvenil completamente desarrollado se detectó al día 18 postfertilización y las larvas metamorfoseadas se observaron 72 h después de la inducción. Los resultados aquí presentados, si bien no son nuevos para la especie, muestran el comportamiento reproductivo y la duración del periodo larvario para las poblaciones de D. excentricus asociada a un estero en la parte sur de su distribución y resultan de utilidad para documentar la variabilidad de la respuesta de especies de amplia distribución geográfica en escenarios de cambio global.
Palabras clave: Dendraster excentricus, desarrollo larvario, índice gonadal, Pacífico de México.
ABSTRACT
The sand dollar Dendraster excentricus has been extensively used in diverse studies in Baja California (Mexico). This study shows annual variations in the gonad index and describes larval development under laboratory conditions of D. excentricus. Over a period of one year, adult sand dollars (6.73 ± 0.56 cm diameter and 23.22 ± 6.90 g) were collected monthly. Both the monthly analysis of the gonad index (male and female) and the measure of mature eggs were considered to estimate the reproductive period of the sand dollar in Punta Banda Estuary (Baja California). Our results suggest that D. excentricus has two maximum reproductive peaks, one during the early spring and another during the summer, although viable gametes were obtained in the laboratory year round. Larval development took 21-23 days from fertilization to metamorphosis under laboratory conditions (19 ± 2 °C, salinity 33.5). The blastula stage was observed 5 h postfertilization, while four-armed echinopluteus larvae, with an average size of 387.00 ± 23.25 μm (from aboral to dorsal arms), were observed two days after fertilization. A different larval stage was attained approximately every two days. Eight-armed echinopluteus larvae were 744.60 ± 69.45 μm in size. The completely developed juvenile rudiment was detected 18 days after fertilization and metamorphosed larvae were observed 72 h after induction. These results, while not new for the species, show the reproductive behavior and larval period for the D. excentricus populations associated with an estuary at the southern limit of its distribution, and will be useful to document variation in the response of species of ample geographic distribution in global change scenarios.
Key words: Dendraster excentricus, larval development, gonad index, Mexican Pacific.
Introducción
La galleta de mar Dendraster excentricus (Eschscholtz 1831) es un equinodermo común en las costas del océano Pacífico. Se distribuye desde el suroeste de Alaska hasta la costa oeste de Baja California Sur (Merrill y Hobson 1970, Mooi 1997). En costas expuestas, habita el intermareal y el submareal arenoso, y en el estero de Punta Banda, a 13 km al sur de Ensenada (Baja California, México), se le encuentra asociada a los canales cercanos a la boca.
El género Dendraster ha sido ampliamente utilizado en diversos estudios, entre los que se incluyen estudios de ciclo de vida (Merrill y Hobson 1970, Niesen 1977, Emlet 1986), biología del desarrollo (Burke 1983, Highsmith y Emlet 1986, Boidron-Metairon 1988), distribución (Beadle 1989, Mooi 1997, Smith et al. 2008) y alimentación (Timko 1976, Francisco y Herzka 2010), entre otros. Durante la época reproductiva, los huevos y espermatozoides de la galleta de mar son liberados en la columna de agua, donde ocurre la fertilización y el subsecuente desarrollo embrionario y larvario (Kozloff 1983). Este desarrollo, se sabe, es modificado por factores como la alimentación y la temperatura (O'Connor et al. 2007). Una vez que alcanzan el estadio competente, las larvas se metamorfosean y se transforman en postlarvas, que generalmente se establecen en sitios con presencia de congéneres adultos (Burke 1984, Highsmith y Emlet 1986). El desarrollo larvario de D. excentricus comparte elementos básicos con el descrito para el erizo morado Strongylocentrotus purpuratus. Para esta especie de erizo, Smith et al. (2008) han presentado uno de los desarrollos larvarios más detallados descritos a la fecha para equinodermos. Dicho estudio aporta información clave para entender cada uno de los estadios de éste y otros géneros de equinoideos que comparten desarrollos larvarios similares. Estudios sobre Scaphechinus mirabilis y Clypeaster subdepressus (Dautov y Kashenko 2008, Vellutini y Migotto 2010) también han proporcionado datos que contribuyen a elucidar el desarrollo en larvas de equinodermos.
A pesar de que el desarrollo larvario ha sido ampliamente documentado para D. excentricus, el periodo reproductivo y la duración del desarrollo larvario para las poblaciones localizadas en el estero de Punta Banda, que representan la porción más al sur de su distribución geográfica, no han sido estudiados. Estudios recientes para esta localidad han estado enfocados al entendimiento de los mecanismos de alimentación en sitios poco profundos (Francisco y Herzka 2010). Registros iniciales de las poblaciones de D. excentricus en el estero de Punta Banda indicaron densidades de hasta 45 ind m-2 (Merrill y Hobson 1970), pero en algunos casos las poblaciones han llegado a desaparecer temporalmente del intermareal del estero, posiblemente por un efecto local asociado a la precipitación pluvial. El objetivo del presente trabajo consistió en documentar el índice gonadal y el desarrollo larvario de la galleta de mar D. excentricus de poblaciones localizadas en el estero de Punta Banda. Tomando en consideración que el desarrollo larvario de D. excentricus ha sido ampliamente documentado (Tyler 1936, Hart y Strathmann 1994, Collin 1997, Heyland y Hodin 2004), los resultados que se presentan en el presente estudio resultan de utilidad para entender el comportamiento reproductivo y la duración del periodo larvario de las poblaciones que habitan la porción más al sur de su distribución geográfica, donde la temperatura y las condiciones del hábitat difieren de sus contrapartes más norteñas (e.g., California, Washington y Alaska). Lo anterior resulta de interés para entender el comportamiento de estas poblaciones estuarinas de amplia distribución geográfica en las condiciones actuales de cambio global y acidificación del océano.
Materiales y métodos
Recolección y mantenimiento de organismos adultos
Galletas de mar (D. excentricus) adultas fueron recolectadas mensualmente durante la marea baja de mayo de 2009 a mayo de 2010 en el estero de Punta Banda en la Bahía de Todos Santos, Baja California, México (31°42'-31°47' N, 116°37'-116°39' W) (fig. 1). Este estero comprende un área aproximada de 20 km2 (~10 km de longitud por 2 km de ancho) (Buenrostro et al. 1999). Cada mes se recolectaron 30 organismos adultos con un tamaño de 6.73 ± 0.56 cm de diámetro y un peso de 23.22 ± 6.90 g (media ± desviación estándar). En febrero y marzo de 2010 no se recolectaron galletas de mar debido a que no se encontraron en las orillas de los canales durante las mareas bajas. Este hecho fue atribuido a la época de lluvias, la cual modificó la distribución del sedimento fino en el estero y posiblemente afectó las poblaciones de galleta de mar. Los organismos se transportaron al laboratorio del Instituto de Investigaciones Oceanológicas (Ensenada) en cubetas con agua de mar y se colocaron en acuarios con temperatura promedio de 19 ± 2°C. Los acuarios utilizados fueron habilitados con una cama de arena del estero (5 cm de espesor) y se mantuvieron con aireación y flujo de agua de mar constante (1 L min-1). Veinte de las galletas recolectadas mensualmente fueron utilizadas para determinar el índice gonadal y 10 para llevar a cabo los cultivos de larvas.

Determinación del índice gonadal
El índice gonadal se determinó en un periodo de 24 h posteriores a la llegada de las galletas de mar al laboratorio. Los organismos fueron pesados en una balanza granataria (0.01 g de precisión), medidos por su parte más ancha con un calibrador vernier (0.1 cm de precisión) y, posteriormente, diseccionados para obtener las gónadas. Para determinar el sexo de cada organismo, las gónadas se pesaron y observaron al microscopio estereoscópico. El índice gonadal se calculó en 10 hembras y en 10 machos de acuerdo con Phillips et al. (1998): índice gonadal = peso gónada x 100/peso total de la galleta.
Una vez pesadas las gónadas, se tomaron muestras representativas de los óvulos y se colocaron en una caja de Petri. Veinte huevos de cada hembra diseccionada, que presentaban la cubierta gelatinosa pigmentada característica de la especie, se fotografiaron con ayuda del microscopio compuesto Axioskop2 Zeiss motorizado para su posterior análisis.
Cultivo de larvas
El desove fue inducido mediante la inyección de aproximadamente 800 μL de cloruro de potasio (KCl) 0.55 M en la parte oral de la galleta (Strathmann 1987, Salas-Garza et al. 2005). Posterior a la inyección, los organismos se colocaron con la parte oral hacia arriba en recipientes con agua de mar filtrada hasta 1 μm (filtros Cuno) e irradiada con luz UV. Una vez que los organismos expulsaron sus gametos (aproximadamente 5 min después de la inyección con KCl), se seleccionó una hembra y un macho para realizar la fertilización. Al término del desove los organismos se colocaron en acuarios con aireación y flujo constante de agua de mar, hasta su recuperación. Una vez recuperados del desove, los organismos se regresaron al sitio del estero donde fueron recolectados.
Para llevar a cabo la fertilización, los gametos de una hembra y un macho se mezclaron suavemente durante un minuto en un recipiente con 5 L de agua de mar filtrada. El contenido del recipiente se tamizó a través de una malla de 90 μm de luz para remover el exceso de espermatozoides y prevenir la poliespermia. Los huevos fertilizados se colocaron en recipientes con 15 L de agua de mar filtrada, se cubrieron y se dejaron a una temperatura de 19 ± 2 °C. Después de 24 h, las larvas (en estadio de prisma) se pasaron a tanques cónicos de fibra de vidrio de 45 L con aireación y agua de mar filtrada hasta 1 μm. La densidad del cultivo fue de 3-4 larvas mL-1. Durante el desarrollo larvario se realizaron recambios de agua diariamente, al 50% y 100%, y se registró la temperatura del agua. Durante los primeros seis días de cultivo, las larvas se alimentaron con Rhodomonas sp. a una concentración de 10,000 cél mL-1; a partir del día siete, se incrementó la concentración a 15,000 cél mL-1. Se realizaron al menos 12 cultivos de larvas de galleta de mar durante el periodo de estudio.
Desarrollo larvario
La documentación del desarrollo embrionario y larvario se hizo a partir de la fertilización de los gametos. El tiempo de fertilización se consideró como tiempo cero, y a partir de ahí se fotografiaron las larvas cada 30 minutos mediante un microscopio compuesto Axioskop2 Zeiss motorizado. Se tomaron microfotografías hasta que los embriones alcanzaron el estadio de gástrula. Posterior a este estadio de desarrollo, se realizaron observaciones diarias con un microscopio estereoscópico. Cuando se observaron como larvas pluteus de cuatro, seis u ocho brazos, larvas competentes o postlarvas recién metamorfoseadas, se tomaron microfotografías con el microscopio compuesto para su posterior análisis.
Medición de gametos y larvas
Todas las mediciones se realizaron a partir de microfotografías tomadas con el microscopio compuesto Axioskop2 Zeiss, y las microfotografías fueron analizadas con el programa AxioVision Zeiss (AxioVs40 V4.8.0.0). El tamaño de los huevos se determinó considerando su diámetro máximo. El tamaño de las blástulas y gástrulas se obtuvo midiendo 20 embriones que se encontraban en cada uno de estos estadios de desarrollo; las blástulas se midieron diametralmente y las gástrulas longitudinalmente del polo animal al vegetal. En el caso de larvas pluteus de cuatro, seis y ocho brazos y larvas competentes, se obtuvo el tamaño de cada estadio considerando las medidas obtenidas de 20 larvas; el tamaño de cada larva corresponde al promedio de cuatro mediciones realizadas desde la parte aboral de la larva hasta los brazos dorsales (dos mediciones en brazos anterolaterales y dos en brazos posterodorsales). El tamaño de las postlarvas se calculó midiendo longitudinalmente 20 postlarvas por su parte más ancha.
Análisis de datos
Los análisis estadísticos se realizaron utilizando el programa GraphPad Prism v4.00 para Windows (GraphPad Software, San Diego, California, USA). Los datos se analizaron con la prueba de normalidad de D'Agostino-Pearson (omnibus K2) considerando un límite de confianza del 95%. En organismos adultos, la determinación de la media ± desviación estándar (DE) de la talla (n = 20), el peso (n = 20) y el índice gonadal (n = 10) consistió en una prueba no para-métrica de Kruskal-Wallis y una postprueba de Dunns (α = 0.05). Para los huevos, se realizó esta misma prueba y se graficaron los máximos y mínimos obtenidos de 20 mediciones ± DE. Las mediciones durante el desarrollo larval representan la media de 20 repeticiones (M ± DE). Para todas las fuentes de variación, se consideró significativa una P <0.05.
Resultados
El análisis de la media (± DE) de la talla (en centímetros) de organismos adultos de D. excentricus mostró que no hubo diferencias estadísticamente significativas entre los machos (N = 110, M = 6.78 ± 0.26, Kruskal-Wallis = 7.306, P = 0.1206) o entre las hembras (N = 110, M = 6.64 ± 0.19, Kruskal-Wallis = 10.19, P = 0.0374). La media del peso de los machos fue de 23.38 ± 5.94 g (N = 110, P = 0.1015) y la de las hembras fue de 23.35 ± 4.89 g (N = 110, P = 0.0356), lo que demuestra que este factor tampoco fue estadísticamente significativo entre los organismos de estudio.
El diámetro de los huevos fue significativamente diferente en los primeros meses del año de muestreo (mayo-julio de 2009). El menor tamaño (M ± DE) de los huevos se registró en mayo de 2009, con un valor de 88.63 ± 5.70 μm, y presentó una diferencia altamente significativa con respecto a la media máxima registrada en noviembre de 2009, que fue de 187.60 ± 24.54 μm (<0.001, Kruskal-Wallis = 183.9, P < 0.0001) (fig. 2a). La media del tamaño de los huevos en mayo de 2009 (n = 20, M = 88.63 ± 5.70 μm) presentó diferencias altamente significativas (<0.001, Kruskal-Wallis = 122.4) con respecto a la media de septiembre-noviembre de 2009 (n = 60, M = 145.50 ± 34.66 μm), diciembre de 2009-enero de 2010 (n = 40, M = 144.90 ± 9.41 μm) y abril-mayo de 2010 (n = 40, M = 145.80 ± 20.53 μm). También se observaron diferencias altamente significativas (<0.001, Kruskal-Wallis = 122.4) cuando se comparó la media de septiembre-noviembre de 2009 (145.50 ± 34.66 μm), diciembre de 2009-enero de 2010 (144.90 ± 9.41 μm) y abril-mayo de 2010 (145.80 ± 20.53 μm) contra la media de junio-agosto 2009 (n = 60, 102.80 ± 18.83 μm).
El índice gonadal de los machos presentó una mayor variabilidad que en las hembras (fig. 2b). La media mensual del índice gonadal de hembras tuvo un valor máximo de 6.45% (± 2.81) en enero de 2010 y un mínimo de 3.10% (± 1.59) en octubre de 2009, sin diferencias estadísticamente significativas entre ellas (Kruskal-Wallis = 101.7, P < 0.0001). El periodo con valores mayores del índice gonadal para las hembras se presentó durante diciembre-enero de 2010 (n = 20, M = 4.87 ± 2.67) y el periodo con valores menores se presentaron en abril-mayo de 2010 (n = 20, M = 3.22 ± 0.96), sin diferencias estadísticamente significativas entre ambos periodos; sin embargo, los valores de junio-agosto de 2009 (n = 30, M = 4.02 ± 1.36) tuvieron una diferencia significativa con respecto a la registrada en abril-mayo de 2010 (0.01-0.05, Kruskal-Wallis = 12.30, P =0.0153).
Para los machos, se registró el valor máximo mensual de índice gonadal durante junio de 2009 (n = 10, M = 5.54 ± 1.52) y el valor mínimo durante octubre de 2009 (n = 10, M =2.13 ± 0.91); se encontró una diferencia altamente significativa entre ambas medias (<0.001, Kruskal-Wallis = 101.7). En estos organismos, el índice gonadal registró diferencias significativas (<0.05, Kruskal-Wallis = 27.51, P < 0.0001) entre mayo de 2009 (n = 10, M = 4.43 ± 0.34) y abril-mayo de 2010 (n = 20, M = 2.41 ± 0.70), entre junio-agosto de 2009 (n = 30, M = 4.43 ± 1.96) y septiembre-noviembre de 2009 (n = 30, M = 2.79 ± 1.42) y entre septiembre-noviembre de 2009 y abril-mayo de 2010.
Los espermatozoides de D. excentricus presentaron un color blanco lechoso y un tamaño de 5.20 ± 0.29 μm (fig. 3a). La concentración de espermatozoides varió entre 2.00 x 1010 y 2.00 x 1012 espermas mL-1. En las hembras, los gametos presentaron un color rosa pálido, una cubierta gelatinosa con pequeños gránulos periféricos de color púrpura (fig. 3b) y un diámetro medio de 138.70 ± 27.82 μm. La concentración de huevos por hembra desovada osciló entre 250,000 y 550,000 huevos por individuo.
La fertilización de los huevos se confirmó con la presencia de la membrana de fertilización (fig. 3c). La primera división celular se detectó 50 min después (fig. 3d), y, en intervalos de aproximadamente 40 min, se presentaron las subsecuentes divisiones celulares (fig. 3e-j) hasta que a los 220 min se formó la blástula temprana (fig. 3k).
Transcurridas 5 h postfertilización, se observó la formación de blástulas tardías a punto de eclosionar (fig. 3l), seguidas por blástulas mesenquimales (fig. 3m) en las que fue posible observar la acumulación de células primarias mesenquimales migrando al blastocele del embrión. La formación incipiente del arquenteron fue claramente visible en bástulas en proceso de gastrulación (fig. 3n, o) y el blastoporo formado se convirtió en el ano, mientras que las células primarias mesenquimales dieron origen a las espículas tri-radiales que formaron el esqueleto de la larva. El arquenterón completamente formado dio origen al intestino primitivo y, en su parte superior, se formó la boca de la larva. Veinticuatro horas después de la fertilización, la gástrula adquirió la forma de prisma. Como prisma continuó por 24 h adicionales, durante las cuales se formaron las espículas extendidas que se convertirían en el esqueleto que da soporte a los brazos de la larva equinopluteus.
Tras 24 h, las larvas desarrollaron los brazos anterolaterales y, posteriormente, los brazos postorales (tabla 1). A las 48 h postfertilización, las larvas alcanzaron el estadio equinopluteus de cuatro brazos (fig. 4a) y se observó, a través del epitelio translúcido, un sistema digestivo completamente formado. Durante este estadio las larvas alcanzaron un tamaño de 387.00 ± 23.25 μm (tabla 1) y comenzaron a alimentarse de microalgas, con las bandas ciliadas presentes en ambos pares de brazos. En este estadio, se observó que los brazos anterolaterales se alargaron hasta un tercio de la longitud corporal, mientras que los brazos postorales se alejaron del cuerpo larval. En las horas siguientes, los brazos postorales de las larvas se volvieron más gruesos que los anterolaterales y, después de tres días, el esqueleto se desarrolló gradualmente hasta formar los brazos posterodorsales. Las larvas alcanzaron el estadio equinopluteus de seis brazos cinco días después de la fertilización (fig. 4b) y la media de su tamaño fue de 525.50 ± 63.21 μm. A los ocho días, se formaron los dos últimos pares de brazos preorales y las larvas pasaron al estadio equinopluteus de ocho brazos (fig. 4c). Las larvas midieron 744.60 ± 69.45 y se observó la presencia del rudimento juvenil desarrollado. En los días siguientes, las larvas comenzaron a ensancharse por su extremo posterior y presentaron una forma más redondeada (fig. 4d). Consecutivamente, se alargó el estomago significativamente y los brazos se extendieron anteriormente; los brazos postorales y posterodorsales se proyectaron más profundamente en el cuerpo de la larva. A los 18 días de cultivo las larvas midieron 639.00 ± 30.72 μm. La circunferencia del rudimento se incrementó y se presentó una invaginación del ectodermo hacia el estómago; continuó el crecimiento del rudimento, de los primordios de los pies ambulacrales y de las espinas juveniles. Conforme el tamaño del rudimento incrementó, se abrió el poro vestibular (larvas en estadio competente listas para metamorfosearse).
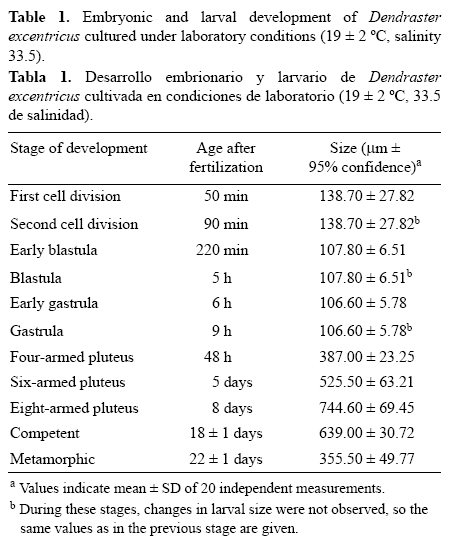
La metamorfosis en D. excentricus inició con una disminución en el tamaño y grosor de los brazos. El epitelio que recubre los brazos, junto con las bandas ciliadas en el cuerpo de la larva, se unió a su parte dorsal. Las larvas comenzaron a asentarse en el fondo del tanque de cultivo, probablemente por el incremento en el peso corporal y por la pérdida de bandas ciliares que le permitían nadar en la columna de agua (fig. 4e). Los pies ambulacrales emergieron del cuerpo larval por el poro vestibular, y el rudimento se evertió por ese mismo poro. Las espículas que soportaban los brazos rasgaron la epidermis de la larva y ésta comenzó a colapsar. Después de algunas horas, se completó la metamorfosis con la eversión del rudimento y fue posible observar espinas adultas y juveniles, y pies ambulacrales con una forma puntiaguda en su extremo distal (fig. 4f). A los 22 (±1) días de cultivo, a una temperatura de 17-21 °C y una salinidad de 33.5, las postlarvas se encontraban metamorfoseadas y tenían un tamaño promedio de 355.50 ± 49.77 μm.
Discusión
La variación en el índice gonadal con dos picos máximos, uno en verano y otro en invierno, hace suponer que posiblemente estos periodos indican que la máxima actividad reproductiva para D. excentricus sucede en septiembre y después en diciembre en el estero de Punta Banda. Cabe mencionar que en el laboratorio fue posible obtener gametos viables la mayor parte del año, mediante inducción al desove de organismos adultos con KCl. Lane y Lawrence (1979) expusieron que en equinodermos se presenta un incremento en el índice gonadal justo antes del desove. Este hecho fue corroborado en el erizo de mar Strongylocentrotus purpuratus (Phillips et al. 1998) y la galleta de mar Mellita quinquiesperforata (Lane y Lawrence 1980), lo que concuerda con las observaciones para D. excentricus en el presente estudio.
La producción de gametos viables en el laboratorio durante casi todo al año indica que la reproducción puede estar relacionada con las variaciones de temperatura en el estero. Se infiere que hay una maduración de gametos durante el verano (junio-agosto), cuando las temperaturas del estero oscilan entre 22 y 25 °C (López-Rasgado y Herzka 2009), tal como sucede en algunas especies tropicales de equinodermos como el erizo Centrostephanus coronatus (Pearse 1972) y la galleta de mar M. quinquiesperforata (Lane y Lawrence 1980), a temperaturas entre 18 y 22 °C. Aparentemente, durante el invierno (diciembre-febrero), a 14-18 °C, D. excentricus responde a temperaturas cercanas a las más bajas registradas en su hábitat. Eso mismo ha sido documentado para las galletas de mar Echinarachnius parma (Cocanour y Allen 1967) y Arachnoides placenta (Hines y Kenny 1967), y para el erizo Evechinus chlorotilus (Brewin et al. 2000), especies en las que se especula ocurre una game-togénesis más lenta. En el caso de D. excentricus, a temperaturas bajas, la disponibilidad de alimento en el estero de Punta Banda quizá permita continuar produciendo gametos maduros.
En equinodermos, conforme la gametogénesis procede, los ovocitos jóvenes incrementan su tamaño y son liberados al medio. En algunas especies como la galleta M. quinquiesperforata, las hembras jóvenes que alcanzan su madurez sexual durante el primer año de vida liberan gametos viables de tamaño pequeño durante el otoño, mientras que las hembras maduras (de al menos 4 años de edad) liberan los ovocitos de mayor tamaño durante la primavera (Lane y Lawrence 1979). Las variaciones estacionales entre ambas especies de galleta de mar se explican porque a pesar de que el desarrollo de gametos en equinodermos es muy similar, los factores que inducen la gametogénesis, el índice de desarrollo de gametos y la sincronía de los tiempos de desove, varían entre especies y entre poblaciones de la misma especie localizadas en diferentes sitios (Holland y Giese 1965).
El grado en el que los diversos factores ambientales determinan las épocas de desove y desarrollo gonadal en equinodermos aún no se conoce por completo, pero se sabe que es cíclico (asociado a las estaciones) en zonas templadas y con mayor continuidad durante el año en el trópico. Los ciclos reproductivos se caracterizan por patrones periódicos de reproducción y se dan en forma flexible, dado que pueden ser modificados por claves externas como las variaciones estacionales en alimentación (Giese 1959, Gonor 1973, Pearse y Cameron 1991) o eventos de mayor periodicidad como El Niño. Posiblemente, en el caso de las poblaciones de galleta de mar del estero de Punta Banda, el ciclo reproductivo se ajusta al patrón observado en otras especies de zonas templadas (estacional), con variaciones particulares asociadas a la dinámica de esta laguna costera.
Las observaciones en D. excentricus del estero de Punta Banda mostraron que el desarrollo de la larva comprende un periodo de 21-23 días, desde el momento de la fertilización hasta la postlarva, en condiciones de laboratorio (17-21 °C, 33.5 de salinidad). El tiempo de desarrollo en esta especie hasta la metamorfosis corresponde a los periodos más cortos registrados a esas temperaturas y resulta menor que lo que se ha registrado para su desarrollo a temperaturas menores que la del presente estudio (Strathmann 1987). El tiempo de desarrollo fue similar al documentado para otros géneros de galletas de mar, aunque en algunos casos se trata de especies tropicales cuyo desarrollo larvario ocurre a mayores temperaturas. Para la galleta de mar Scapechinus mirabilis, localizada en el mar de Japón, el periodo de desarrollo fue de 28.5-29 días en condiciones de temperatura y salinidad similares (20-21 °C, 32.2 de salinidad) (Dautov y Kashenko 2008). Para Clypeaster subdepressus, localizada en las costas de Brasil, dicho desarrollo duró 23 días a 26 °C (Vellutini y Migotto 2010), mientras que para Arachnoides placenta, localizada en Australia, duró aproximadamente siete días, independientemente de la temperatura (28-34 °C) a la que se sometieron las larvas (Chen y Chen 1992).
En D. excentricus, las divisiones celulares postfertilización fueron similares a las de otros equinodermos con larvas planctotróficas (Smith et al. 2008, Vellutini y Migotto 2010). El tiempo registrado para la formación de la blástula (5 h a 17-21 °C) fue similar al registrado para Heliocidaris erythrogramma (6 h a 25 °C) (Henry et al. 1991), Ophiodaphne formataressus (6.2 h a 26 °C) (Tominaga et al. 2004) y C. subdepressus (7 h a 26 °C) (Vellutini y Migotto 2010); sin embargo, es importante mencionar que en estos últimos casos, la temperatura a la que se documentó el desarrollo embrionario es mucho mayor a la del presente estudio. Por otro lado, nuestros resultados difieren considerablemente de otros registrados para equinodermos como S. mirabilis, S. griseus y E. parma, en los cuales la blástula se forma entre las 13 y 16 h posteriores a la fertilización a 20-21 °C (Kasyanov et al. 1983, Dautov y Kashenko 2008). Estos resultados sugieren que durante las primeras divisiones celulares en D. excentricus hasta la formación de la blástula, los factores que regulan el proceso deben estar más relacionados con los mecanismos de la regulación genética propia del organismo y no con las condiciones ambientales a las que se realizan los experimentos. Aparentemente, la temperatura no es el único determinante en el tiempo que se requiere para la formación de la blástula, dado que nuestros tiempos a 17-21 °C coinciden con los registrados para una especie que habita en aguas cálidas (27 °C) y difieren de aquellas que se encuentran a temperaturas similares. Los resultados indican que, para las especies arriba mencionadas, las mayores diferencias en los tiempos de desarrollo se presentan durante los primeros estadios de desarrollo, antes de la formación del estadio de prisma.
El periodo transcurrido durante cada uno de los subsecuentes estadios larvales (dos días entre estadio y estadio) de D. excentricus no difirió con respecto a los documentados para otras galletas de mar (Dautov y Kashenko 2008, Vellutini y Migotto 2010) e incluso fue similar al de algunas especies de erizo (Kasyanov et al. 1983). El tamaño de las larvas de D. excentricus en cada uno de estos estadios fue similar al reportado por Hart y Strathmann (1994) para la misma especie recolectada en Washington (EUA) y por Dautov y Kashenko (2008) para S. mirabilis; en ambos casos, los cultivos de larvas equinopluteus se mantuvieron en condiciones de temperatura y salinidad similares al presente trabajo (19-22 °C, 32.2-33.5 de salinidad). La morfometría y el tiempo de desarrollo de las poblaciones de D. excentricus en el estero de Punta Banda presenta algunas diferencias con respecto a la población que se localiza en la isla Orcas, Washington, donde las larvas alcanzaron su estadio equinopluteus de seis brazos a los tres días postfertilización y de ocho brazos a los cinco días, en condiciones similares de temperatura y salinidad (Reitzel et al. 2004). La longitud de los brazos anterodorsales en larvas equinopluteus de D. excentricus de ocho brazos en las poblaciones de Baja California es mayor que la que se documenta para la misma especie en Washington (Reitzel et al. 2004), 220-310 μm vs 744.60 ± 69.45 μm, pero menor que la registrada para S. mirabilis, con la cual presenta diferencias de hasta 300 en los estadios de larva equinopluteus (Dautov y Kashenko 2008). Por su parte, las postlarvas alcanzaron un tamaño muy similar al registrado para distintas poblaciones de D. excentricus (Emlet 1986, Strathmann 1987, Hart y Strathmann 1994, Heyland y Hodin 2004) y S. mirabilis (Dautov y Kas-henko 2008).
Las similitudes en el tamaño de las larvas equinopluteus y postlarvas deben estar relacionadas con el género de las galletas de mar y con el aporte energético proporcionado por los ovocitos hasta que la larva comienza a alimentarse, como ha sido mencionado por Bertram y Strathmann (1998) para otros equinodermos. Las diferencias observadas en el tiempo para alcanzar los distintos estadios larvales pudieran estar relacionadas con el régimen alimenticio de los cultivos. En el present estudio, D. excentricus fue alimentada con Rhodomonas sp., mientras que las larvas de la isla Orcas fueron alimentadas con la microalga Dunaliella tertiolecta. Diferencias nutricionales entre las especies de microalgas utilizadas pudieran explicar las diferencias en el desarrollo larvario en ambas localidades. En los equinodermos, las dietas de microalgas simples o compuestas modifican la variabilidad de ácidos grasos en diferentes puntos del desarrollo y específicamente en distintas especies de Dendraster, incrementan la supervivencia y aceleran la metamorfosis (Schiopu et al. 2006, George et al. 2008).
En conjunto, los resultados del presente estudio demuestran que en el estero de Punta Banda D. excentricus presenta incrementos puntuales en el índice gonadal, que pueden estar directamente relacionados con su época reproductiva, tal y como ha sido documentado para otros equinodermos. Es un hecho que existen similitudes entre D. excentricus y otros equinoideos con relación al tamaño de los huevos y el tiempo de fertilización de los mismos, el tiempo en el que ocurren las primeras divisiones celulares hasta alcanzar la etapa de blástula y el tamaño que alcanzan las postlarvas. Se destaca que existen diferencias en cuanto a las horas necesarias para que los organismos pasen de la etapa de blástula a gástrula y en el número de días transcurridos en cada uno de los estadios de larvas equinopluteus. Se infiere que estos rasgos distintivos están directamente relacionados con la regulación genética durante el desarrollo, propia del organismo y las condiciones de su hábitat. Los resultados para D. excentricus, localizadas en el estero de Punta Banda, en la región sur de su distribución geográfica, pueden tomarse como punto de partida para valorar la respuesta de invertebrados marinos de amplia distribución ante las presentes condiciones del cambio global.
Agradecimientos
El presente trabajo recibió apoyo financiero de la Universidad Autónoma de Baja California (proyecto interno IIO-UABC No. 533 a cargo de ECI). El primer autor recibió una beca de apoyo posdoctoral del Consejo Nacional de Ciencia y Tecnología (CONACYT No. 119311) para la realización del presente estudio. Los autores agradecen a R Escobar-Fernández y J Guzmán-Calderón su colaboración en la recolección de los organismos adultos, y a E Valenzuela-Espinoza y el personal de su laboratorio por facilitar las microalgas utilizadas para la alimentación de los cultivos de larvas.
Referencias
Beadle SC. 1989. Ontogenetic regulatory mechanisms, heterochrony, and eccentricity in dendrasterid sand dollars. Paleobiology 15: 205-222. [ Links ]
Bertram DF, Strathmann RR. 1998. Effects of maternal and larval nutrition on growth and form of planktotrophic larvae. Ecology 79: 315-327. [ Links ]
Boidron-Metairon IF. 1988. Morphological plasticity in laboratory-reared echinoplutei of Dendraster excentricus (Eschscholtz) and Lytechinus variegatus (Lamarck) in response to food conditions. J. Exp. Mar. Biol. Ecol. 119: 31-41. [ Links ]
Brewin PE, Lamare MD, Keogh JA, Mladenov PV. 2000. Reproductive variability over a four-year period in the sea urchin Evechinus chloroticus (Echinoidea: Echinodermata) from differing habitats in New Zealand. Mar. Biol. 137: 543-557. [ Links ]
Buenrostro MA, Warnock N, Cueva H. 1999. Wintering Western Sandpipers Calidris mauri at Estero de Punta Banda, Baja California, México. Wader Study Group Bull. 88: 59-63. [ Links ]
Burke RD. 1983. Development of the larval nervous system of the sand dollar, Dendraster excentricus. Cell Tissue Res. 229: 145-154. [ Links ]
Burke RD. 1984. Pheromonal control of metamorphosis in the Pacific sand dollar, Dendraster excentricus. Science 225: 442-443. [ Links ]
Chen C-P, Chen B-Y. 1992. Effects of high temperature on larval development and metamorphosis of Arachnoides placenta (Echinodermata: Echinoidea). Mar. Biol. 112: 445-449. [ Links ]
Cocanour B, Allen K. 1967. The breeding cycles of a sand dollar and a sea urchin Comp. Biochem. Physiol. 20: 327-331. [ Links ]
Collin R. 1997. Ontogeny of subtle skeletal asymmetries in individual larvae of the sand dollar Dendraster excentricus. Evolution 51: 999-1005. [ Links ]
Dautov SS, Kashenko SD. 2008. Development of the sand dollar Scaphechinus mirabilis. Russ. J. Mar. Biol. 34: 415-420. [ Links ]
Emlet RB. 1986. Larval production, dispersal, and growth in a fjord: A case study on larvae of the sand dollar Dendraster excentricus. Mar. Ecol. Prog. Ser. 31: 245-254. [ Links ]
Francisco V, Herzka SZ. 2010. Regulation of feeding mode by the sand dollar Dendraster excentricus in a shallow estuarine habitat. J. Exp. Mar. Biol. Ecol. 383: 146-155. [ Links ]
George SB, Fox C, Wakeham S. 2008. Fatty acid composition of larvae of the sand dollar Dendraster excentricus (Echinodermata) might reflect FA composition of the diets. Aquaculture 285: 167-173. [ Links ]
Giese AC. 1959. Comparative physiology: Annual reproductive cycles of marine invertebrates. Annu. Rev. Physiol. 21: 547-576. [ Links ]
Gonor JJ. 1973. Reproductive cycles in Oregon populations of the echinoid, Strongylocentrotus purpurutus (Stimpson). II. Seasonal changes in oocyte growth and in abundance of gametogenic stages in the ovary. J. Exp. Mar. Biol. Ecol. 12: 65-78. [ Links ]
Hart MW, Strathmann RR. 1994. Functional consequences of phenotypic plasticity in echinoid larvae. Biol. Bull. 186:291-299. [ Links ]
Henry JJ, Wray GA, Raff RA. 1991. Mechanism of an alternate type of echinoderm blastula formation: The wrinkled blastula of the sea urchin Heliocidaris erythrogramma. Develop. Growth Differ. 33: 317-328. [ Links ]
Heyland A, Hodin J. 2004. Heterochronic developmental shift caused by thyroid hormone in larval sand dollars and its implications for phenotypic plasticity and the evolution of nonfeeding development. Evolution 58: 524-538. [ Links ]
Highsmith RC, Emlet RB. 1986. Delayed metamorphosis: Effect on growth and survival of juvenile sand dollars (Equinoidea: Clypeasteroida). Bull. Mar. Sci. 39: 347-361. [ Links ]
Hines J, Kenny R. 1967. The growth of Arachnoides placenta (L.) (Echinoidea). Pac. Sci. XXI: 230-235. [ Links ]
Holland ND, Giese AC. 1965. An autoradiographic investigation of the gonads of the purple sea urchin (Strongylocentrotus Purpuratus). Biol. Bull. Mar. Biol. Lab. Woods Hole 128:241-258. [ Links ]
Kasyanov VL, Kryuchkova GA, Kulikova VA, Medvedeva LA. 1983. Larvae of Marine Bivalves and Echinoderms. Nauka, Moscow, 82 pp. [ Links ]
Kozloff EN. 1983. Seashore Life of the Northern Pacific Coast. University of Washington Press, Seattle, 370 pp. [ Links ]
Lane JM, Lawrence JM. 1979. Gonadal growth and gametogenesis in the sand dollar Mellita quinoquiesperforata (Leske 1778). J. Exp. Mar. Biol. Ecol. 38: 271-285. [ Links ]
Lane JM, Lawrence JM. 1980. Seasonal variation in body growth, density and distribution of a population of sand dollar Mellita quinquiesperforata (Leske). Estuar. Coast. Mar. Sci. 14:421-431. [ Links ]
López-Rasgado FJ, Herzka SZ. 2009. Assessment of habitat quality for juvenile California halibut (Paralichthys californicus) in a seasonally arid estuary. Fish. Bull. 107: 343-358. [ Links ]
Merrill RJ, Hobson ES. 1970. Field observations of Dendraster excentricus, a sand dollar of western North America. Am. Midl. Nat. 83: 595-624. [ Links ]
Mooi R. 1997. Sand dollars of the genus Dendraster (Echinoidea: Clypeasteroida): Phylogenetic systematics, heterochrony and distribution of extant species. Bull. Mar. Sci. 61: 343-375. [ Links ]
Niesen TM. 1977. Reproductive cycles of two populations of the Pacific sand dollar Dendraster excentricus. Mar. Biol. 42:365-373. [ Links ]
O'Connor MI, Bruno JF, Gaines SD, Halpern BS, Lester SE, Kinlan BP, Weiss JM. 2007. Temperature control of larval dispersal and the implications for marine ecology, evolution, and conservation. Proc. Natl. Acad. Sci. USA 104: 1266-1271. [ Links ]
Pearse JS. 1972. A monthly reproductive rhythm in the diadematid sea urchin Centrostephanus coronatus Verrill. J. Exp. Mar. Biol. Ecol. 8: 167-186. [ Links ]
Pearse JS, Cameron RA. 1991. Reproduction of marine invertebrates. In: Giese AC, Pearse JS, Pears VB (eds.), Echinodermata: Echinoidea. Boxwood, Pacific Grove, California, pp. 513-622. [ Links ]
Phillips BM, Anderson BS, Hunt JW. 1998. Spatial and temporal variation in results of purple urchin (Strongylocentrotus purpuratus) toxicity tests with zinc. Environ. Toxicol. Chem. 17: 453-459. [ Links ]
Reitzel AM, Webb J, Arellano S. 2004. Growth, development and condition of Dendraster excentricus (Eschscholtz) larvae reared on natural and laboratory diets. J. Plankton Res. 26: 901-908. [ Links ]
Salas-Garza A, Carpizo-Ituarte E, Parés-Sierra G, Martínez-López R, Quintana-Rodríguez R. 2005. Juvenile production of the red sea urchin Strongylocentrotus franciscanus (Echinodermata: Echinoidea) in Baja California, Mexico. Rev. Biol. Trop. 53 (Suppl. 3): 345-355. [ Links ]
Schiopu D, George SB, Castell J. 2006. Ingestion rates and dietary lipids affect growth and fatty acid composition of Dendraster excentricus larvae. J. Exp. Mar. Biol. Ecol. 328: 47-75. [ Links ]
Smith MM, Cruz Smith L, Cameron R, Urry L. 2008. The larval stages of the sea urchin, Strongylocentrotus purpuratus. J. Morphol. 269: 713-733. [ Links ]
Strathmann MF. 1987. Reproduction and Development of Marine Invertebrates of the Northern Pacific Coast. University of Washington Press, Seattle, 670 pp. [ Links ]
Timko PL. 1976. Sand dollars as suspension feeders: A new description of feeding in Dendraster excentricus. Biol. Bull. 151: 247-259. [ Links ]
Tominaga H, Nakamura S, Komatsu M. 2004. Reproduction and development of the conspicuously dimorphic brittle star Ophiodaphne formata (Ophiuroidea). Biol. Bull. 206: 25-34. [ Links ]
Tyler A. 1936. On the energetics of differentiation. III. Comparison of the temperature coefficients for cleaveage and later stages in the development of the eggs of some marine animals. Biol. Bull. 71: 59-81. [ Links ]
Vellutini BC, Migotto EE. 2010. Embryonic, larval, and juvenile development of the sea biscuit Clypeaster subdepressus (Echinodermata: Clypeasteroida). PLoS ONE 5: e9654. [ Links ]














