Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.2 Ensenada jun. 2012
Artículos
Fenología y alginatos de dos especies de Sargassum de la costa caribe de Colombia
Phenology and alginates of two Sargassum species from the Caribbean coast of Colombia
O Camacho1,2*, G Hernández-Carmona3
1 Department of Biology, University of Louisiana at Lafayette, LA 70504-2451, USA. * Corresponding author. E-mail: omc1833@louisiana.edu
2 Vicerrectoría de Investigación e Instituto de Investigaciones Tropicales (INTROPIC), Universidad del Magdalena, Cra. 32 No. 22-08, Santa Marta, Colombia.
3 Centro Interdisciplinario de Ciencias Marinas, Av. Instituto Politécnico Nacional s/n, Col. Playa Palo de Santa Rita, 23096 La Paz, Baja California Sur, México.
Received March 2011,
received in revised form November 2011,
accepted January 2012.
RESUMEN
El género Sargassum (Phaeophyceae) forma grandes mantos en las costas rocosas del Caribe colombiano y presenta importantes fluctuaciones estacionales de biomasa que están relacionadas con los eventos de surgencia en la zona. Este estudio describe la fenología de dos especies bentónicas de Sargassum de la costa caribe de Colombia, y presenta una evaluación preliminar de la concentración de alginato y las propiedades de viscosidad y fuerza de gel para evaluar su potencial como un recurso explotable. Las muestras fueron recolectadas en el área de Santa Marta en 2007. La primera especie fue identificada a nivel de género como Sargassum sp. Ésta alcanzó sus valores máximos de biomasa y abundancia de receptáculos en abril y los más bajos entre junio y febrero. La otra especie fue Sargassum cymosum. Ésta presentó mayor biomasa y persistió durante más tiempo que Sargassum sp. A pesar de esto, la biomasa y el periodo reproductivo de ambas especies fueron marcadamente estacionales y bajos durante la mayor parte del año. El rendimiento de alginato fue relativamente alto en ambas especies, en comparación con lo documentado para otras especies de Sargassum. La viscosidad del alginato fue muy baja y por lo tanto sólo puede tener algunas aplicaciones en la industria; sin embargo, la fuerza de gel del alginato en ambas especies fue competitiva, en comparación con otros productos comerciales. Este estudio sugiere que, si bien estas dos especies de Sargassum en Colombia son candidatas potenciales para la producción comercial de alginatos con relación a algunas aplicaciones, la marcada estacionalidad de ambas especies aconseja tener precaución para una explotación sostenible.
Palabras clave: Sargassum, fenología, alginatos, Caribe, Colombia.
ABSTRACT
The genus Sargassum (Phaeophyceae) forms large beds on rocky shores of the Colombian Caribbean, showing large seasonal fluctuations in biomass that are related to upwelling events in the area. This study describes the phenology of two benthic species of Sargassum from the Caribbean coast of Colombia, and presents a preliminary assessment of the alginate concentration and properties of viscosity and gel strength to determine their potential as an exploitable resource. Samples were collected during 2007 in the Santa Marta area. The first species was identified at genus level as Sargassum sp. The highest values of biomass and abundance of receptacles were recorded in April and the lowest between June and February. The other species was Sargassum cymosum. It showed higher biomass and persisted a longer time than Sargassum sp. In spite of this, the biomass and reproductive period of both species were markedly seasonal and low during most of the year. Alginate yield was relatively high in both species, compared to that reported for other Sargassum species. The viscosity of the alginates was very low and may thus have only few applications in the industry; however, the gel strength of the alginates of both species was competitive, compared with other commercial algal products. This study suggests that while these two species of Sargassum in Colombia are potential candidates for the commercial production of alginates in regard to some applications, the marked seasonality of the species advises caution for a sustainable exploitation.
Key words: Sargassum, phenology, alginates, Caribbean, Colombia.
Introducción
Las especies bentónicas de Sargassum constituyen un habitat ecológico importante en muchas regiones costeras tropicales y templadas (Nizamuddin 1970). Este género usualmente constituye grandes praderas en areas rocosas intermareales y submareales, donde juega un papel fundamental en el ciclo de vida de la fauna asociada y otras alga (Kilar et al. 1992, Martin-Smith 1992, Tanaka y Leite 2003). Las fluctuaciones de los factores abióticos afectan significativamente la dinámica de las poblaciones de Sargassum en términos de sus ciclos de crecimiento, maduración y senescencia (DeWreede 1976, McCourt 1984, Núñez-López y Casas-Valdez 1997, Gillespie y Critchley 1999, Stiger y Payri 1999, Ang 2006). Tanto en áreas tropicales como templadas, la temperatura del agua (McCourt 1984, Glenn et al. 1990, Sánchez-Rodríguez y Hernández-Carmona 1998, Ang 2006), las mareas (Ang 1985), la temperatura del aire (Gillespie y Critchley 1999) y los factores fisicoquímicos (Trono y Lluisma 1990) han sido relacionados como factores que juegan un papel crítico en la estructura de las poblaciones de Sargassum y sus patrones fenológicos.
Sargassum tiene importantes aplicaciones comerciales como fuente de alginatos. Este hidrocoloide es usado como agente gelificante, espesante o estabilizante y agente emulsificante en la industria alimenticia, farmacéutica, cosmetológica y biotecnológica (McHugh 1987, Istini et al. 1994). El alginato es un glucourunano lineal con uniones (1, 4) de residuos de α-L guluronato y β-D manuronato, arreglados de manera irregular en un patrón de bloques a lo largo de la cadena (Grasdalen et al. 1981). Las diferentes especies de Sargassum tienen diferente calidad, concentración y propiedades de su alginato (Calumpong et al. 1999, Ragaza y Hurtado 1999), lo que hace su evaluación muy necesaria dada las diversas aplicaciones que cada especie puede tener en la industria.
El genero Sargassum forma grandes praderas en las costas rocosas del Caribe colombiano, particularmente a lo largo de la costa de Santa Marta y el Parque Nacional Natural de Tayrona. Estas praderas presentan una gran variación anual en su biomasa, la cual se ha relacionado con las fluctuaciones oceanográficas producidas por el evento de surgencia que ocurre en el área (Bula-Meyer 1990a, 1992; Camacho-Hadad y Díaz-Pulido 2008). Este evento se caracteriza por presentar baja temperatura del agua y altos niveles de salinidad. Incluso, se ha relacionado con la marcada estacionalidad de macroalgas en el área de Santa Marta (Bula-Meyer 1977, 1985, Díaz-Pulido y Garzón-Ferreira 2002). A pesar de la abundancia de las poblaciones de Sargassum en la región, se conoce muy poco acerca de su fenología y el potencial de aplicaciones comerciales de este género en la producción de alginatos.
Este estudio describe la fenología de Sargassum cymosum C. Agardh y Sargassum sp., consideradas como unas de las macroalgas más abundantes en la zona intermareal y sub-mareal del área de Santa Marta en el Caribe colombiano (Camacho 2003). Se documenta la variación estacional de su biomasa y sus estructuras reproductivas, y se discuten con relación a la variabilidad oceanográfica (temperatura y salinidad) en la región durante 2007. Se presenta también una evaluación preliminar de la producción de alginatos para las dos especies, en términos de concentración, viscosidad y propiedad gelificante.
Materiales y métodos
Área de estudio
Las muestras se recolectaron en el área de Santa Marta, específicamente en la bahía de Granate (11°17'36.4" N, 74°U'24.6" O), localizada dentro del Parque Tayrona en la costa caribe de Colombia (fig. 1). Las características oceanográficas y climáticas de esta área están determinadas por la morfología de la costa y la incidencia de los vientos alisios del NE. Se presentan dos estaciones principales en esta área: la estación o época seca (diciembre-abril), cuando se presenta un evento de surgencia con aguas más frías (22-25 °C) y alta salinidad (≥36), y la época de lluvias (mayo-noviembre), cuando no hay surgencia y prevalecen una temperatura más alta (27-30 °C) y bajas salinidades (<36) (Ramírez 1990, Díaz-Pulido y Garzón-Ferreira 2002, Rodríguez-Ramírez y Garzón-Ferreira 2003). Sargassum cymosum se encuentra en la zona intermareal y Sargassum sp. crece en la submareal (3-4 m de profundidad) de la zona rocosa del área de estudio. Esta última especie se encuentra actualmente en revisión taxonómica y molecular.
Fenología de Sargassum
Para estudiar la dinámica estacional de la abundancia y reproducción de ambas especies de Sargassum, se llevaron a cabo muestreos bimensuales o trimensuales de enero a diciembre de 2007. Para cada especie, se seleccionaron al azar cinco cuadrantes de 0.25 m2. En cada fecha de muestreo, los cuadrantes se colocaron sobre el fondo de cada hábitat donde se encuentran las especies (intermareal o submareal) y se recolectaron todos los talos de Sargassum desde el disco basal. Para analizar la dinámica de los estados reproductivos, se seleccionaron al azar 20 talos de cada especie por cuadrante y se registró la abundancia relativa (%) de receptáculos; este porcentaje se estimó como el número de ramas con receptáculos con relación al número total de ramas. Para estimar la biomasa, todo el Sargassum recolectado en cada cuadrante se secó separadamente al sol (a temperatura ambiente de 25-40 °C) y luego fue pesado. La biomasa de las algas por unidad de área se calculó con base en el peso seco.
Para evaluar las diferencias significativas de la biomasa y la abundancia de receptáculos entre fechas de muestreo, se realizó un análisis de varianza de una vía y una prueba aposteriori de Tukey de manera independiente para cada especie con el programa InfoStat 2008. Los supuestos para-métricos se encontraron después de hacer una transformación de los datos a log10 para la biomasa en ambas especies y una transformación a raíz cuadrada para los receptáculos de Sargassum sp. Para relacionar los factores bióticos con abióticos, se registró la temperatura superficial del agua y la salinidad durante cada muestreo. No se obtuvieron datos de nutrientes durante el periodo de estudio.
Extracción de alginatos
Las muestras de algas para la extracción de alginatos se recolectaron durante el periodo de máxima abundancia (abril-mayo) y se secaron al sol (temperatura ambiente de 30-40 °C) hasta obtener un peso constante (aproximadamente 4 h, 12% humedad). El material seco de cada especie, de las fechas de muestreo entre abril y mayo, se mezcló previo a la extracción. Se analizaron por separado tres replicas de cada especie. Las algas se molieron a un tamaño de 30 mallas con un molino de martillos. Para la extracción del alginato, se rehidrataron 30 g de alga seca durante una noche con 180 mL de agua destilada y 0.18 mL de formaldehido. La solución se filtró y el líquido fue descartado. Las algas fueron tratadas con 200 mL de solución de HCl a pH 4 durante 15 min y con agitación constante (Arvizu-Higuera et al. 1995). Después de la filtración, las algas fueron tratadas con 200 mL de solución de Na2CO3 a pH 10 y 80 °C durante 2 h en baño María, con agitación constante a 800 rpm usando un agitador externo (Caframo) y propela. El alginato extraído se filtró al vacío para separar el alga residual (principalmente celulosa), y el alginato en solución se precipitó con un volumen igual de etanol, agitando lentamente con una varilla de vidrio. Las fibras precipitadas de alginato se enrollaron a la varilla. Las fibras se removieron, se desenredaron, se lavaron con alcohol y se secaron a 50 °C durante 24 h (Arvizu-Higuera et al. 1996). El alginato se pesó y el porcentaje de alginato se calculó con base en el peso inicial del alga.
La viscosidad de las muestras se obtuvo preparando una solución de alginato al 1% y midiéndola con un viscosímetro Brookfield LVT, a 60 rpm, con la aguja apropiada, antes y después de añadir hexametafosfato de sodio, el cual secuestra el calcio residual (Hernández-Carmona et al. 1999). La propiedad gelificante del alginato de cada especie se obtuvo preparando una solución de alginato al 1% en agua destilada y llenando un tubo de membrana de diálisis (5 cm de diámetro x 2.5 cm de altura). Los tubos se sumergieron en una solución de cloruro de calcio (10%) durante una noche para formar los geles. Al siguiente día se separó la membrana, se recortaron cuidadosamente las puntas redondeadas y, posteriormente, se volvió a cortar el gel a la mitad para obtener dos cilindros. La fuerza de gel se midió con un analizador de textura TA.XT Plus, programado para llevar a cabo una penetración de 2 cm a una velocidad de penetración de 5 segundos. El programa esquematiza una curva con el máximo valor al punto de rompimiento. El valor en la cima de la curva fue registrado en gramos por centímetro cuadrado (modificado de Armisen y Galatas 1987). Se calculó el promedio de las mediciones de dos geles por muestra.
Resultados
Fenología de Sargassum
Ambas especies mostraron un marcado patrón estacional en el área de Santa Marta. Las plantas comenzaron a crecer (tanto sexualmente a partir de nuevos reclutas como vegetativamente a partir de discos basales viejos) en enero, cuando la temperatura del agua en el área fue baja (24 °C) y la salinidad alta (38) (fig. 2), coincidiendo con el inicio del periodo de surgencia más fuerte en el área.
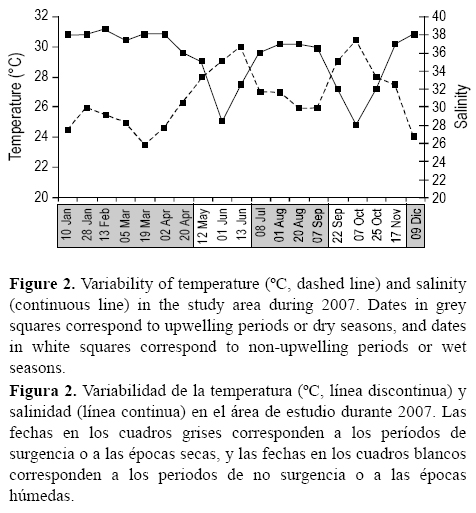
La biomasa de S. cymosum presentó una variación temporal significativa (F = 42.05, P < 0.0001, tabla 1). La biomasa de esta especie aumentó gradualmente y alcanzó un pico máximo de 595 (±211.7) g m-2 en abril, cuando la temperatura empezó a incrementar y la salinidad empezó a disminuir (fig. 2). Luego, su biomasa disminuyó drásticamente a 4.7 (±3.6) g m-2 en agosto y a 0.4 (±0.1) g m-2 en noviembre (fig. 3a). Los receptáculos en S. cymosum mostraron también diferencias significativas entre las fechas de muestreo (F = 12.64, P < 0.0001, tabla 1). Esta especie presentó la mayor abundancia de receptáculos (53.4%) en mayo, coincidiendo con un valor de temperatura de 28 °C y una salinidad de 35 (fig. 2). En junio se presentó un periodo corto de lluvias con alta temperatura (30 °C) y baja salinidad (28). Durante julio, agosto e inicios de septiembre, la temperatura y la salinidad cambiaron nuevamente (fig. 2) debido a un periodo corto de surgencia que comúnmente ocurre cada año en la región. Durante este periodo corto de surgencia, los talos de S. cymosum estaban senescentes pero se registraron algunos talos reproductivos (fig. 3a).
La biomasa de Sargassum sp. fue más baja y no persistió tanto tiempo como la de S. cymosum. La biomasa y la abundancia de receptáculos de Sargassum sp. mostraron diferencias temporales significativas (F = 25.68, P < 0.0001 y F = 13.94, P < 0.0001, respectivamente, tabla 1). Esta especie alcanzó la máxima biomasa (410.6 ± 108.8 g m-2) y abundancia de receptáculos (44.5%) en abril (fig. 3b), cuando la temperatura fue de 26-27 °C y la salinidad de 36-38 (fig. 2). En mayo los talos comenzaron a ser senescentes, y entre junio y febrero se registró la biomasa más baja, con valores entre 0 y 14.85 g m-2, además de una ausencia total de estructuras reproductivas (fig. 3b).
Contenido de alginato
La concentración, viscosidad y propiedad gelificante del alginato de las dos especies recolectadas en abril-mayo se muestran en la tabla 2. El rendimiento del alginato fue menor en S. cymosum (15.9%) que en Sargassum sp. (20.9%). La viscosidad del alginato de ambas especies sin la adición de hexametafosfato de sodio fue muy baja (12.3-21.6 mPa·s), especialmente en S. cymosum. Después de la adición de hexametafosfato de sodio, la viscosidad en ambas especies fue aún menor (7.0-14.2 mPa·s). La fuerza de gel del alginato fue alta y similar entre las dos especies, con valores de 709-866 g cm-2 (tabla 2).
Discusión
Fenología de Sargassum
Este estudio muestra una marcada dinámica estacional de dos macroalgas pardas tropicales. A pesar de que las dos especies de Sargassum investigadas mostraron diferencias fenológicas importantes, la biomasa poblacional y la dinámica reproductiva están en alguna medida relacionadas con la surgencia estacional que ocurre en el área. Los eventos de surgencia anuales en el Caribe colombiano han sido bastante documentados (Fajardo 1979, Bula-Meyer 1990b, Ramírez 1990, Cabrera y Donoso 1993, Rodríguez-Ramírez y Garzón-Ferreira 2003), con valores más bajos de temperatura y más altos de salinidad que en los periodos sin surgencia. Las variables abióticas registradas durante el año de muestreo corresponden al patrón estacional descrito para la región (fig. 2), con dos épocas principales (seca, con surgencia de diciembre a abril; lluviosa, sin surgencia de mayo a noviembre) y un periodo intermedio o corta surgencia de julio a agosto. En este corto periodo, la temperatura no es tan baja y la salinidad no es tan alta como ocurre durante la temporada principal de surgencia de diciembre a abril (Rodríguez-Ramírez y Garzón-Ferreira 2003) (fig. 2). De manera interesante, durante el año de este estudio (2007), el periodo de corta surgencia fue más prolongado de lo normal, de julio a principios de septiembre (fig. 2). A pesar de esto, la fenología de Sargassum en 2007 presentó un patrón similar que en años anteriores (obs. pers.).
Los valores de nutrientes también pueden variar a lo largo del año. De acuerdo con Rodríguez-Ramírez y Garzón-Ferreira (2003), quienes llevaron a cabo mediciones cerca del área de estudio entre 1993 y 1999 en la bahía Chengue (Parque Tayrona), el silicato fue el único nutriente que mostró una fuerte correlación con las épocas climáticas. Este nutriente presentó los niveles más altos durante los periodos de lluvia (con un promedio mensual máximo de hasta 14.19 ± 6.47 μ.M en octubre) y los niveles más bajos en la épocas de surgencia (con un promedio mensual máximo de 0.12 ± 0.07 μM en marzo). Por el contrario, el amonio, el fosforo y los nitritos fueron altamente variables y no mostraron un patrón estacional claro en ese estudio (con valores anuales promedio de 0.80, 0.10 y 0.07 μM, respectivamente). Estos autores incluso mencionan que los altos niveles de fósforo y nitritos pueden estar más influenciados por la descarga de los ríos que por los eventos de surgencia. Respecto a esto, Ramírez (1987) mencionó que en la bahía Neguanje (Parque Tayrona), la descarga de los ríos puede traer más nutrientes que los eventos de surgencia. Recientemente, Arévalo-Martínez y Franco-Herrera (2008) sugirieron un incremento en los valores promedio de nitratos (9.48 ± 0.49 μM) en bahía Gaira (a 15 km de distancia del Parque Tayrona), los cuales son suministrados por aguas profundas durante los eventos de surgencia. No encontraron diferencias entre los periodos de surgencia y de lluvias en cuanto a las concentraciones de nitritos, amonio y fosfato (valores promedio de 0.35 ± 0.02, 1.08 ± 1.11 y 0.29 ± 0.01 μM, respectivamente). Estos autores clasifican los eventos de surgencia como mesotróficos, señalando que los niveles costeros de nutrientes en el área son muy variables y pueden estar siendo suministrados por la descarga de los ríos, principalmente durante las temporadas de lluvias. En este estudio, S. cymosum y Sargassum sp. alcanzaron su máxima biomasa y abundancia de receptáculos en abril-mayo, lo que sugiere que los nutrientes no son el único factor que conduce a los picos de abundancia. Sin embargo, sería relevante que en futuros estudios se compararan cuidadosamente los cambios temporales de la biomasa y la reproducción de Sargassum de Colombia con los niveles de nutrientes en la columna de agua y con los tejidos del alga, incluso con isotopos.
Se ha observado una marcada variación estacional en poblaciones de diferentes especies de Sargassum alrededor del mundo. Esta variabilidad ha sido atribuida generalmente a las variaciones de la temperatura del agua. Algunas poblaciones presentan mayor biomasa y reproducción durante los meses fríos, e.g., en Hawai (De Wreede 1976), el golfo de California (McCourt 1984, Espinoza y Rodríguez 1987) y el noreste de Filipinas (Hurtado y Ragaza 1999). Otras poblaciones de Sargassum forman praderas densas durante los periodos cálidos, e.g., en la parte media-noreste de Filipinas (Ang 1985); La Gran Barrera de Coral, Australia (Vuki y Price 1994); Brasil (Paula y Oliveira 1980, Mafra y Cunha 2006); y el golfo de California (Rivera y Scrosati 2006). Incluso, hay patrones estacionales contrastantes entre especies en una misma región (Prince y O'Neal 1979, Prince 1980, Sánchez-Rodríguez y Hernández-Carmona 1998, Calumpong et al. 1999) y en una misma localidad (Martin-Smith 1992, Gillespie y Critchley 1999, Ang 2006).
A pesar de observarse un patrón estacional similar de S. cymosum en el sur de Brasil (Santa Catarina), el cual coincide con picos bajos de biomasa y reproducción en los últimos meses del año (invierno-primavera) y con picos altos en abril (finales de verano) (Mafra y Cunha 2006), se encontraron valores de biomasa mucho más bajos en Brasil (327.1 ± 84.3 g m-2) que en este estudio. En otro estudio llevado a cabo en Brasil (Sao Paulo), Paula y Oliveira (1980) también observaron una alta variabilidad en la dinámica estacional de S. cymosum, pero con un patrón anual diferente y mayores biomasas que las que mencionan Mafra y Cunha (2006) y las de este estudio. Paula y Oliveira (1980) registraron una bio-masa de 800.8 g m-2 en diciembre (finales de primavera), que disminuyó a 400 g m-2 en abril (otoño). Las poblaciones de las dos especies estudiadas en Colombia presentaron diferentes valores de biomasa y esfuerzo reproductivo; sin embargo, ambas mostraron un marcado patrón estacional relacionado con las variaciones anuales de las condiciones oceanográficas en el área y con el ciclo de vida natural de estas poblaciones.
Contenido de alginato
Aunque el contenido de alginato fue más bajo en S. cymosum que en Sargassum sp. (tabla 2), los valores fueron más altos comparados con otros previamente publicados para especies de Sargassum (Casas-Valdez 1982, Gillespie y Critchley 1999, Ragaza y Hurtado 1999, Brito 2001, Yabur et al. 2007, Rodríguez-Montesinos et al. 2008). A pesar de esto, también se han registrado valores de alginato más altos para el género: 35% por Hernández-Carmona (1985) y Omar et al. (1988), y 41% por Ragaza y Hurtado (1999). Particularmente, para S. cymosum, Carrasquero y Palma (1984) documentaron valores similares de alginato de sodio (17.9%) en Venezuela, comparado con el 15.9% obtenido en este estudio. En el sur de Brasil, Andreazza et al. (2009) determinaron un intervalo entre 12.4% y 25.5% para S. cymosum dependiendo de la estación climática, y Mafra y Cunha (2006) registraron valores de 22.9% en abril (finales del verano) a 28.9 % en noviembre (primavera).
En este estudio, el contenido de alginato se evaluó sólo en las muestras obtenidas en abril-mayo, periodo que corresponde a los meses de mayor abundancia y reproducción, considerando el uso práctico de las especies (ya que ambas muestran baja biomasa durante el resto del año). Sin embargo, los valores de alginato para S. cymosum y Sargassum sp. en el área de estudio podrían variar durante las diferentes etapas de desarrollo de los talos en la población. Por ejemplo, Gillespie y Critchley (1999) observaron que el patrón de contenido de alginato en poblaciones mezcladas de Sargassum en la costa de Sudáfrica presentó un pico en los meses fríos de invierno, pero no coincide con la mayor biomasa. Igualmente, Calumpong et al. (1999) encontraron que cuatro especies en la parte central de Filipinas presentaron patrones diferentes en su contenido de alginato y su viscosidad en relación con sus estados de desarrollo. Aunque la biomasa de las dos especies de Colombia es muy baja la mayor parte del año para sostener una explotación continua de este recurso, sería apropiado, para futuras aplicaciones potenciales, evaluar su posible variación temporal en su alginato y sus propiedades en relación con las condiciones ambientales del área y el desarrollo de los talos.
La baja viscosidad del alginato en los dos especies estudiadas, especialmente en S. cymosum, indica que el alginato obtenido puede tener pocas aplicaciones como espesante en la industria, ya que la mayoría de las aplicaciones (e.g., en salsas, jarabes y cubiertas para helados) requieren una mayor viscosidad (400-800 mPa·s) (McHugh 1987). Andreazza et al. (2009) observaron una gran variación en la viscosidad de esta especie (S. cymosum), con intervalos entre 18.3 mPa·s en otoño y 62.6 mPa·s en primavera. También, en otras especies de Sargassum, como S. sinicola, Rodríguez-Montesinos et al. (2008) registraron valores de viscosidad mucho más altos (191.7 mPa·s en invierno) que en este estudio. Ragaza y Hurtado (1999) observaron diferencias en la viscosidad del alginato entre estaciones y estados reproductivos, con el valor más alto de 178 mPa·s para S. ilicifolium y el más bajo de 50 mPa·s para S. carpophyllum. La viscosidad de las dos especies estudiadas fue baja; sin embargo, la fuerza de gel del alginato de los dos taxa fue alta y podría encontrar usos en productos comerciales, ya que muchas industrias emplean polisacáridos (alginatos, agar, carragenano) que comúnmente tienen una fuerza de gel de 750 g cm-2 (Armisen y Galatas 1987). Esta mayor fuerza de gel se explica por la alta proporción de ácido gulurónico (G) en relación con el ácido manu-rónico (M). Los bloques G permiten que se unan los iones de calcio entre dos cadenas, creando una estructura más fuerte que los bloques M (McHugh 1987). Actualmente se sabe que la fuerza de gel es independiente del peso molecular del alginato (Martinsen et al. 1989). Se ha demostrado que en el género Sargassum los bloques G son dominantes en la molécula del alginato (Murillo-Álvarez y Hernández-Carmona 2007) y por lo tanto producen geles más fuertes. Esta propiedad física provee la oportunidad de usar el alginato obtenido de Sargassum en aplicaciones novedosas donde se requiera una alta fuerza de gel, pero que se mantenga aún su porosidad (Merc 2008). Por ejemplo, el alginato de Sargassum ha sido utilizado exitosamente para producir microencapsulados de bacterias benéficas, para la liberación lenta de productos y para mejorar el crecimiento de plantas terrestres (Yabur et al. 2007).
A pesar de que la propiedad gelificante (fuerza de gel) obtenida del alginato de las especies estudiadas sugiere que éstas pueden ser consideradas como una buena opción para algunas aplicaciones comerciales, la industria debe estar consciente de la gran estacionalidad de su abundancia. Se encontró baja biomasa durante la mayor parte del año; i.e, la biomasa de S. cymosum y Sargassum sp. fue extremadamente baja durante seis y nueve meses, respectivamente. También es importante resaltar el reducido periodo reproductivo (particularmente para Sargassum sp.), por lo que la industria debería cosechar el alga después de la reproducción para asegurar su persistencia en el medio. El conocimiento de los periodos reproductivos y las variaciones estacionales de la biomasa en las poblaciones son de necesidad imperativa para conocer el óptimo periodo de cosecha y asegurar una explotación sustentable. Adicionalmente, a pesar de que las praderas de Sargassum son frecuentes a lo largo de la costa de Santa Marta, éstas están distribuidas en parches locales. Por ejemplo, las praderas de Sargassum sp. se encuentran sólo en unas cuantas localidades con un intervalo discreto y reducido (decenas de metros cuadrados). Aunque se carece de datos estimados de la biomasa de Sargassum para la costa caribe de Colombia, el presente estudio contribuye sustancialmente con la evaluación de este recurso. Se espera que en futuros estudios sea posible la estimación de la biomasa de Sargassum en la costa colombiana. De cualquier forma, si las especies son explotadas comercialmente, la mejor época para cosechar S. cymosum, que tiene una distribución más amplia y mayor biomasa que Sargassum sp. en el área de Santa Marta, sería en junio-julio, justo después de su pico máximo de reproducción y antes de la senescencia del talo, cuando la biomasa aún está disponible. Se recomienda también no cosechar las plantas desde el disco basal en estas poblaciones pseudoperennes; sólo se deben recolectar las ramas erectas para permitir la regeneración del talo desde el disco. Se observaron, en el área de estudio, a individuos de S. cymosum creciendo nuevamente a partir de los discos basales perennes cuando las condiciones fueron nuevamente favorables (obs. pers.).
Debido a que las dos poblaciones estudiadas podrían no ser suficientes para mantener una producción comercial, se debe considerar una fuente adicional de material prima.
Otras localidades de la costa caribe de Colombia deben ser evaluadas. Alternativamente, se puede comprar materia prima adicional con posibles propiedades similares de la industria de ficocoloides en países vecinos, como Perú y Chile, que explotan grandes cantidades de este recurso.
Agradecimientos
Este estudio hace parte de la tesis de maestría de OC (Universidad del Magdalena, Colombia). GHC agradece a los siguientes programas por la beca de exclusividad otorgada: "Comisión de Operación y Fomento de Actividades Académicas del IPN (COFAA)" y "Estímulo al Desempeño de los Investigadores del IPN (EDI)". Agradecemos a S Fredericq, T Sauvage y G Díaz-Pulido sus comentarios al manuscrito original, y a MG Amador-Martínez su ayuda en el proceso de extracción de alginatos.
Referencias
Andreazza F, Maas MM, Pessatti ML, Bellé Bresolin TM. 2009. Release of theophylline from hydrophilic matrices containing sodium alginate from seasonal Sargassum cymosum (Phaeophyta). Rev. Cubana Farm. 43: 1-8. [ Links ]
Ang PO. 1985. Phenology of Sargassum siliquosum J. Ag. and S. paniculatum J. Ag. (Sargassacea, Phaeophyta) in the Reef Flat of Balibago (Calatagan, Philippines). Proc. 5th Int. Coral Reef Congress, Tahiti 2: 10 pp. [ Links ]
Ang PO. 2006. Phenology of Sargassum spp. in Tung Ping Chau Marine Park, Hong Kong, SAR, China. J. Appl. Phycol. 1S: 629-636. [ Links ]
Arévalo-Martínez DL, Franco-Herrera A. 2008. Características oceanográficas de la surgencia frente a la ensenada de Gaira, departamento del Magdalena, época seca menor de 2006. An. Inst. Invest. Mar. Punta Betín 37: 131-162. [ Links ]
Armisen R, Galatas F. 1987. Production properties and uses of agar. In: McHugh DJ (Ed), Production and Utilization of Products from Commercial Seaweeds. FAO Fish. Tech. Pap. 2SS, Rome, pp. 1-57. [ Links ]
Arvizu-Higuera DL, Hernández-Carmona G, Rodríguez-Montesinos YE. 1995. Sistemas de carga y flujo continuo durante la etapa de preextracción ácida en el proceso de extracción de alginatos. Cienc. Mar. 21: 25-37. [ Links ]
Arvizu-Higuera DL, Hernández-Carmona G, Rodríguez-Montesinos YE. 1996. Efecto de la temperatura y el tiempo de extracción en el proceso de extracción de alginato de sodio a partir de Macrocystis pyrifera. Cienc. Mar. 22: 511-521. [ Links ]
Brito L. 2001. Extracción de alginato de sodio a partir de Sargassum vulgare (Fucales, Phaeophyta). IX Congreso Latinoamericano de Ciencias del Mar (COLACMAR), San Andrés Isla, Colombia. Resumen ampliado, pp. 1-5. [ Links ]
Bula-Meyer G. 1977. Algas marinas bénticas indicadoras de un área afectada por aguas de surgencia en la costa Caribe de Colombia. An. Inst. Invest. Mar. Punta Betín 9: 45-71. [ Links ]
Bula-Meyer G. 1985. Un núcleo nuevo de surgencia en el Caribe colombiano detectado en correlación con las macroalgas. Bol. Ecotróp. 14: 3-20. [ Links ]
Bula-Meyer G. 1990a. Altas temperaturas estacionales del agua como condición disturbadora de las macroalgas del Parque Nacional Natural Tayrona, Caribe colombiano: Una hipótesis. An. Inst. Invest. Mar. Punta Betín 19-20: 9-21. [ Links ]
Bula-Meyer G. 1990b. Oceanografía. In: Jimeno MC (ed.), Caribe Colombia. FEN, Colombia, pp. 135-153. [ Links ]
Bula-Meyer G. 1992. El Parque Nacional Tayrona, costa Caribe de Colombia: Importancia ecológica y económica de la macroflora marina y condiciones oceanográficas. Rev. Ing. Pesq. 12: 31-44. [ Links ]
Cabrera E, Donoso M. 1993. Estudio de las características oceanográficas del Caribe colombiano, Región III, Zona 1, PDCTM. Bol. Cient. CIOH 13: 19-32. [ Links ]
Calumpong HP, Maypa AP, Magbanua M. 1999. Population and alginate yield and quality assessment of four Sargassum species in Negros Island, central Philippines. Hydrobiologia 398/399: 211-215. [ Links ]
Camacho O. 2003. El género Sargassum C. Agardh 1820 (Phaeophyta-Fucales) del Parque Nacional Natural Tayrona, Caribe colombiano. BSs dissertation, Universidad Jorge Tadeo Lozano, Santa Marta, Colombia, 107 pp. [ Links ]
Camacho-Hadad O, Díaz-Pulido G. 2008. Fenología del alga parda Sargassum en el Parque Tayrona, Caribe colombiano. Seminario Nacional de Ciencia y Tecnología del Mar (SENALMAR), San Andrés Isla, Colombia. Resumen, p. 37. [ Links ]
Carrasquero G, Palma H. 1984. Contenido de alginato en dos especies de algas Phaeophyta: Padina gymnospora (Kutzing) Vickers y Sargassum filipendula C.A. Agardh de las costas de la Isla de Margarita, Venezuela. Acta Cient. Venez. 35: 456-473. [ Links ]
Casas-Valdez MM. 1982. Avance para la industrialización de los alginates en México. Ser. Téc. CICIMAR 1: 1-20. [ Links ]
DeWreede RE. 1976. The phenology of three species of Sargassum (Sargassaceae, Phaeophyta) in Hawaii. Phycologia 15: 175-183. [ Links ]
Díaz-Pulido G, Garzón-Ferreira J. 2002. Seasonality in algal assemblages on upwelling-influenced coral reefs in the Colombian Caribbean. Bot. Mar. 45: 284-292. [ Links ]
Espinoza J, Rodríguez H. 1987. Seasonal phenology and reciprocal transplantation of Sargassum sinicola Setchell et Gardner in the southern Gulf of California. J. Exp. Mar. Biol. Ecol. 110: 183-195. [ Links ]
Fajardo G. 1979. Surgencia costera en las proximidades de la Península colombiana de la Guajira. Bol. Cient. (Centro de Investigaciones Oceanográficas e Hidrográficas) 2: 7-19. [ Links ]
Gillespie RD, Critchley AT. 1999. Phenology of Sargassum spp. (Sargassaceae, Phaeophyta) from Reunion Rocks, KwaZulu-Natal, South Africa. Hydrobiologia 398/399: 201-210. [ Links ]
Glenn EP, Smith CM, Doty MS. 1990. Influence of antecedent water temperatures on standing crop of Sargassum spp. dominated reef flat in Hawaii. Mar. Biol. 105: 323-328. [ Links ]
Grasdalen H, Larsen B, Smidsrod O. 1981. C.N.M.R. studies of monomeric composition and sequence in alginate. Carbohydr. Res. 89: 179-191. [ Links ]
Hernández-Carmona G. 1985. Variación estacional del contenido de alginatos en tres especies de feofitas de Baja California Sur, México. Invest. Mar. CICIMAR 2: 29-45. [ Links ]
Hernández-Carmona G, McHugh DJ, Arvizu-Higuera DL, Rodríguez-Montesinos YE. 1999. Pilot plant scale extraction of alginate from Macrocystis pyrifera. Part 1. The effect of pre-extraction treatments on the yield and quality of alginate. J. Appl. Phycol. 10: 507-513. [ Links ]
Hurtado AQ, Ragaza AR. 1999. Sargassum studies in Currimao, Ilocos Norte, Northern Philippines. I. Seasonal variations in the biomass of Sargassum carpophyllum J. Agardh, Sargassum ilicifolium (Turner) C. Agardh and Sargassum siliquosum J. Agardh (Phaeophyta, Sargassaceae). Bot. Mar. 42: 321-32. [ Links ]
Istini S, Ohno M, Kusunose H. 1994. Methods of analysis for agar, carrageenan and alginate in seaweed. Bull. Mar. Sci. Fish. Kochi Univ. 14: 49-55. [ Links ]
Kilar JA, Hanisak MD, Yoshida T. 1992. On the expression of phenotypic variability: Why is Sargassum so taxonomically difficult? In: Abbott IA (ed.), Taxonomy of Economic Seaweeds with Reference to Some Pacific and Caribbean Species. III. California Sea Grant College, La Jolla, California, pp. 95-117. [ Links ]
Mafra LL Jr, Cunha SR. 2006. Sargassum cymosum (Phaeophyceae) in southern Brazil: Seasonality of biomass, recovery after harvest and alginate yield. J. Coast. Res. 39: 1861-1866. [ Links ]
Martin-Smith KM. 1992. Seasonal variation in tropical benthic Sargassum and associated motile epifauna. Proc. 7th Coral Reef Symposium, Guam, Vol. 2, pp. 881-886. [ Links ]
Martinsen A, SkjBk-Braek G, Smidsrsd O. 1989. Alginate as immobilization material:. I. Correlation between chemical and physical properties of alginate gel beads. Biotech. Bioeng. 33:79-89. [ Links ]
McCourt R. 1984. Seasonal patterns of abundance, distributions and phenology in relation to growth strategies of three Sargassum species. J. Exp. Mar. Biol. Ecol. 74: 141-156. [ Links ]
McHugh DJ. 1987. Production, properties and uses of alginates. In: McHugh DJ (ed.), Production and Utilization of Products from Seaweeds. FAO, Rome, pp. 58-115. [ Links ]
Mørc YA. 2008. Novel alginate microcapsules for cell therapy. PhD thesis, Norwegian University of Science and Technology. ISBN 978-82-471-6891-2, 74 pp. [ Links ]
Murillo-Álvarez JI, Hernández-Carmona G. 2007. Monomer composition and sequence of sodium alginate extracted at pilot plant scales from three commercially important seaweeds from Mexico. J. Appl. Phycol. 19: 545-548. [ Links ]
Nizamudin M. 1970. Phytogeography of the Fucales and their seasonal growth. Bot. Mar. 13: 131-139. [ Links ]
Núñez-López RA, Casas-Valdez MM. 1997. Variación estacional de la biomasa y talla de Sargassum spp. (Sargassaceae, Phaeophyta) en la Bahía de Concepción, BCS, México. Hidrobiológica 7: 19-25. [ Links ]
Omar S, Ahmad N, Ahmad F. 1988. Composition of alginates from brown seaweeds, Sargassum and Padina spp. Pertanika 11: 79-78. [ Links ]
Paula EJ, Oliveira FC. 1980. Aspectos fenológicos de duas populacöes de Sargassum cymosum (Phaeophyta-Fucales) do litoral de Säo Paulo, Brasil. Bol. Bot. Univ. S. Paulo 8: 21-39. [ Links ]
Prince JS, O'Neal SW. 1979. The ecology of Sargassum pteropleuron Grunow (Phaeophyceae, Fucales) in the waters off south Florida. I. Growth, reproduction and population structure. Phycologia 18: 109-114. [ Links ]
Prince JS. 1980. The ecology of Sargassum pteropleuron Grunow (Phaeophyceae, Fucales) in the waters off south Florida. II. Seasonal photosynthesis and reproduction of S. pteropleuron and its comparation with that of S. polyceratium Mont. Phycologia 19: 190-193. [ Links ]
Ragaza AR, Hurtado AQ. 1999. Sargassum studies in Currimao, Ilocos Norte, northern Philippines. II. Seasonal variations in alginate yield and viscosity of Sargassum carpophyllum J. Agardh, S. ilicifolium (Turner) C. Agardh and S. siliquosum J. Agardh (Phaeophyta, Sargassaceae). Bot. Mar. 42: 327-331. [ Links ]
Ramírez G. 1987. Características hidrodinámicas y composición química de los sedimentos de la bahía de Neguanje, Caribe colombiano. An. Inst. Invest. Mar. Punta Betín 17: 15-26. [ Links ]
Ramírez G. 1990. Evaluación de parámetros fisicoquímicos y su relación con la surgencia costera. In: Díaz JM (ed.), Estudio Ecológico Integrado de la Zona Costera de Santa Marta y el Parque Nacional Natural Tayrona, Santa Marta. INVEMAR, pp. 55-71. [ Links ]
Rivera M, Scrosati R. 2006. Population dynamics of Sargassum lapazeanum (Fucales, Phaeophyta) from the Gulf of California, Mexico. Phycologia 45: 178-189. [ Links ]
Rodríguez-Montesinos YE, Arvizu-Higuera DL, Hernández-Carmona G. 2008. Seasonal variation on size and chemical constituents of Sargassum sinicola Setchell et Gardner from Bahía de La Paz, Baja California Sur, Mexico. Phycol. Res. 56:33-38. [ Links ]
Rodríguez-Ramírez A, Garzón-Ferreira J. 2003. Monitoreo de arrecifes coralinos, pastos marinos y manglares en la bahía de Chengue (Caribe colombiano) 1993-1999. INVEMAR Santa Marta 8, 170 pp. [ Links ]
Sánchez-Rodríguez I, Hernández-Carmona G. 1998. Factores biológicos que afectan el crecimiento del alga café Sargassum sinicola (Fucales, Phaeophyta) en Bahía Magdalena, BCS, México. In: Anales del IV Congreso Latino-americano, II Reunión Ibero-americano y VII Reunión Brasileña de Ficología. II, pp. 299-308. [ Links ]
Stiger V, Payri CE. 1999. Spatial and seasonal variations in the biological characteristics of two invasive brown algae, Turbinaria ornata (Turner) J. Agardh and Sargassum mangarevense (Grunow) Setchell (Sargassaceae, Fucales) spreading on the reefs of Tahiti (French Polynesia). Bot. Mar. 42: 295-306. [ Links ]
Tanaka MO, Leite FP. 2003. Spatial scaling in the distribution of macrofauna associated with Sargassum stenophyllum (Martens) Martius: Analysis of faunal group, gammarid life habits, and assemblage structure. J. Exp. Mar. Biol. Ecol. 293: 1-22. [ Links ]
Trono GC Jr, Lluisma AO. 1990. Seasonality of standing crop of a Sargassum (Fucales, Phaeophyta) bed in Bolinao, Pangasinan, Philippines. Hydrobiologia 204/205: 331-338. [ Links ]
Vuki VC, Price IR. 1994. Seasonal changes in the Sargassum populations on a fringing coral reef, Magnetic Island, Great Barrier Reef region, Australia. Aquat. Bot. 8: 153-166. [ Links ]
Yabur R, Bashan Y, Hernández-Carmona G. 2007. Alginate from the macroalgae Sargassum sinicola as a novel source for microbial immobilization material in wastewater treatment and plant growth promotion. J. Appl. Phycol. 19: 43-53. [ Links ]














