Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.38 no.1b Ensenada Abr. 2012
Efecto de los exudados orgánicos de Phaeodactylum tricornutum en la constante de velocidad de oxidación del Fe(II)
Effect of organic exudates of Phaeodactylum tricornutum on the Fe(II) oxidation rate constant
AG González, JM Santana-Casiano*, M González-Dávila, N Pérez
Universidad de Las Palmas de Gran Canaria, Departamento de Química, Facultad de Ciencias del Mar, Campus de Tafira, 35017 Las Palmas, Spain. * Corresponding author. E-mail: jmsantana@dqui.ulpgc.es
Received June 2010
Received in revised form May 2011
Accepted May 2011.
RESUMEN
Se estudió la cinética de oxidación del Fe(II) en agua de mar y en agua de mar enriquecida con exudados excretados por Phaeodactylum tricornutum como modelo de ligando orgánico. Se seleccionaron los exudados producidos después de 2, 4 y 8 días de cultivo, correspondientes a 6.21 x 107, 2.29 x 108 y 4.98 x 108 células L-1. Se estudió el efecto del pH (7.2-8.2), la temperatura (5-35 °C) y la salinidad (10-36.72) en la velocidad de oxidación del Fe(II). Todos los datos se compararon con los resultados obtenidos en agua de mar sin exudados (control). La constante de velocidad de oxidación del Fe(II) disminuyó en función del tiempo de cultivo y la concentración de células a diferentes valores de pH, temperatura y salinidad. Todos los datos experimentales obtenidos en este estudio se ajustaron a una función polinómica con el objetivo de cuantificar la contribución parcial de los exudados orgánicos de diatomeas a la velocidad de oxidación del Fe(II) en agua de mar. Los resultados experimentales mostraron que los exudados orgánicos excretados por P. tricornutum afectan a la oxidación del Fe(II) incrementando su tiempo de vida media en agua de mar. Se aplicó un modelo cinético para calcular la especiación de Fe(II) y la contribución de cada especie a la velocidad total del proceso de oxidación.
Palabras clave: Fe(II), oxidación, exudados orgánicos, diatomeas, oxígeno.
ABSTRACT
Fe(II) oxidation kinetics were studied in seawater and in seawater enriched with exudates excreted by Phaeodactylum tricornutum as an organic ligand model. The exudates produced after 2, 4, and 8 days of culture at 6.21 x 107, 2.29 x 108, and 4.98 x 108 cell L-1 were selected. The effects of pH (7.2-8.2), temperature (5-35 °C), and salinity (10-36.72) on the Fe(II) oxidation rate were studied. All the data were compared with the results for seawater without exudates (control). The Fe(II) rate constant decreased as a function of culture time and cell concentration in the culture at different pH, temperature, and salinity. All the experimental data obtained in this study were fitted to a polynomial function in order to quantify the fractional contribution of the organic exudates from the diatoms to the Fe(II) oxidation rate in natural seawater. Experimental results showed that the organic exudates excreted by P. tricornutum affect Fe(II) oxidation, increasing the lifetime of Fe(II) in seawater. A kinetic model approach was carried out to account for the speciation of each Fe(II) type together with its contribution to the overall rate.
Key words: Fe(II), oxidation, organic exudates, diatom, oxygen.
INTRODUCCIÓN
El hierro es un elemento esencial en las aguas naturales debido a su utilización como micronutriente por los microorganismos y al papel fundamental que desempeña en la asimilación del nitrógeno (Sunda y Huntsman 1997). El ciclo biogeoquímico del hierro aún no se ha definido totalmente, especialmente en el caso del Fe(II). El Fe(II) puede llegar al océano desde diferentes fuentes: deposición húmeda (Faust y Zeep 1993, Millero et al. 1995, Kieber et al. 2001), reducción fotoquímica (Wells et al. 1991, Johnson et al. 1994) y producción biológica directa (Maldonado y Price 2001, Kustka et al. 2005, Rose et al. 2005). Una vez que se encuentra en aguas superficiales, el Fe(II) debería oxidarse rápida-mente a Fe(III). Trabajos previos han estudiado la oxidación del Fe(II) (Stumm y Lee 1961; Ghost 1974; Kester et al. 1975; Tamura et al. 1976; Sung y Morgan 1980; Davison y Seed 1983; Millero et al. 1987; Millero y Sotolongo 1989; King et al. 1995; Emennegger et al. 1998; Santana-Casiano et al. 2000, 2004, 2005; Gunnars et al. 2002; Rose y Waite 2002; González-Dávila et al. 2005, 2006; Roy et al. 2008) para caracterizar la química del Fe(II) en aguas naturales. El mecanismo de oxidación del Fe(II) más aceptado en aguas naturales es el de Haber-Weiss:

donde las especies de Fe(II), FeOH+ y Fe(OH)2 son las que más contribuyen al proceso de oxidación del Fe(II) en función del pH (Millero et al. 1987). Además, los carbonatos presentes en el agua de mar reaccionan con el Fe(II) formando FeCO3, FeHCO3+, Fe(CO3)22- (Millero e Izaguirre 1989). La velocidad de oxidación del Fe(II) está fuertemente afectada por la formación de Fe(CO3)22- (King 1998). También se ha estudiado el efecto del H2O2 en la constante de velocidad de oxidación del Fe(II) a concentraciones micro-molares (Millero y Sotolongo 1989, Millero et al. 1991) y nanomolares (González-Dávila et al. 2005, 2006).
La presencia de material orgánico afecta a la cinética de oxidación del Fe(II), acelerando o retardando la velocidad de oxidación (Theis y Singer 1974; Santana-Casiano et al. 2000, 2004; Rose y Waite 2003). Existen evidencias de la presencia de complejos orgánicos de Fe(II) en aguas oceánicas (Rue y Bruland 1997, Croot et al. 2001). Monitoreando concentraciones nanomolares de Fe(II) en aguas superficiales, se han medido concentraciones persistentes de esta especie en aguas superficiales (Croot et al. 2001, 2005) varios días después de experimentos de enriquecimiento con hierro en el océano del Sur (SOIREX y EisenEX). Roy et al. (2008), en el Pacífico subártico, midieron un máximo superficial de Fe(II) de 40 pM. En estos estudios la presencia de Fe(II) se atribuyó a las reacciones con ligandos orgánicos, posiblemente originados por microalgas. En este sentido, la especiación de los metales traza, como el hierro, en el agua de mar está controlada por la presencia de ligandos orgánicos (Gledhill y van den Berg 1994, Rue y Bruland 1995, van den Berg 1995, Santana-Casiano et al. 2000, Vasconcelos et al. 2002).
La mayoría de los trabajos relacionados con la complejación de hierro en el océano se han llevado a cabo para el Fe(III) (Rue y Bruland 1995, Kuma et al. 1996, Witter y Luther 1998, Vasconcelos et al. 2002, Chen et al. 2003, Gerringa et al. 2007, Hirose 2007, Laglera y van den Berg 2007, Fujii et al. 2008, Rijkenberg et al. 2008). Sin embargo, pocos trabajos han considerado el efecto de los exudados en la oxidación del Fe(II) (Steigenberger et al. 2010).
En aguas naturales existe una mezcla de compuestos orgánicos producidos por microorganismos y diferentes microalgas. Para elucidar la influencia de los diferentes ligandos orgánicos excretados por estos organismos se requieren estudios con especies individuales de microalgas. En este trabajo se estudió el efecto de los exudados producidos por una especie en particular, la diatomea Phaeodactylum tricornutum, en la velocidad de oxidación del Fe(II), en función del pH (7.2-8.2), la temperatura (5-35 °C) y la salinidad (10-36.72). Los experimentos se llevaron a cabo para distintas fases de crecimiento. Se ha seleccionado esta especie de diatomea debido a su amplia variedad de hábitats y porque es considerada uno de los organismos fotosintéticos más abundantes en el medio marino.
MATERIALES Y MÉTODOS
Reactivos
El agua de mar utilizada en este estudio procede de una zona frente a la costa de Gran Canaria (septiembre de 2009). La disolución patrón de Fe(II) (4 x 10-4 M) se preparó a partir de sulfato de Fe(II) amónico hexahidratado (Sigma), acidificado a pH 2 con HCl Suprapuro (Sigma) en NaCl (0.7 M). La concentración inicial de Fe(II) en los estudios fue 25 nM. Todas las disoluciones fueron preparadas con agua Milli-Q (18 MQ) y filtradas por 0.1 μm. Los reactivos empleados para la determinación de Fe(II) eran de grado analítico traza. Los nutrientes del medio de cultivo f/2 se prepararon de acuerdo con Guillard (1975). Las disoluciones estándares de nutrientes se prepararon a partir de nitrato de sodio (Sigma) (0.88 M), hidrógeno fosfato de potasio (Sigma) (0.03 M) y silicato de sodio (Sigma) (0.14 M). Para las diversas condiciones fisicoquímicas de este estudio, la concentración de NO3-, HPO42- y SiO32- se mantuvo constante en 8.83 x 10-4, 2.93 x 10-5 y 1.42 x 10-4 M, respectivamente.
Medidas de pH
El pH se midió en escala libre de ión hidrógeno, pHF = -log[H+], haciendo uso de un potenciómetro Orion y calibrando el electrodo combinado (ROSS Combination, glass body) con la disolución tampón Tris-(hidroximetil)aminometano(Tris)-agua de mar artificial (Millero 1986). La disolución tampón se preparó en 0.005 mol kg-1 Tris y Tris-HCl en agua de mar artificial. En este estudio se consideró el efecto de la temperatura y la salinidad en el pK* del Tris de agua de mar.
Cultivos de algas
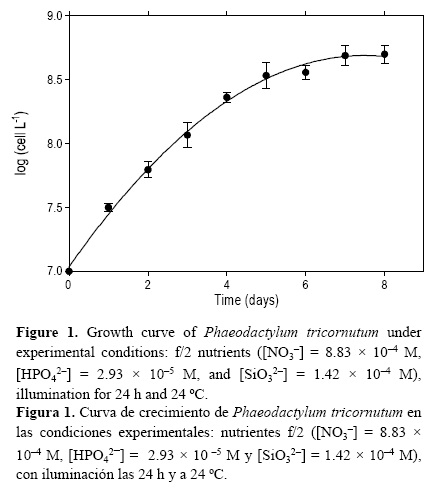
Se seleccionó P. tricornutum como la especie de fitoplancton para estudiar el efecto de los exudados en la constante de velocidad de oxidación del Fe(II). Esta diatomea fue suministrada por el Banco Español de Algas (BEA) de Taliarte (Gran Canaria). Los cultivos axénicos se mantuvieron con el medio f/2 (Guillard 1975) en una cámara de cultivo (Friocell, FC111). Las células fueron contadas diariamente haciendo uso de un microscopio (MicroBioTests Inc.) con un hemocitómetro y midiendo la absorbancia (640 nm) con un espectrofotómetro (USB4000).
Las algas se cultivaron en agua de mar (filtrada por 0.45 µm) enriquecida con los nutrientes del medio de cultivo f/2. La concentración de células inicial siempre fue 107 cél L-1. La temperatura se mantuvo constante a 24 °C, bajo iluminación permanente (24 h). Los cultivos alcanzaron la fase estacionaria a una densidad de 4.98 x 108 cél L-1, después de 8 días de crecimiento (fig. 1). Antes de cada experimento, los cultivos se filtraron en dos etapas, la primera por gravedad, con un filtro de 1.2 µm, y la segunda al vacío, utilizando un filtro de 0.1 µm para evitar la ruptura de células. Todos los filtros utilizados en este estudio fueron previamente lavados con HCl (10% en agua Milli-Q). El agua de mar control se preparó a partir de agua de mar con la misma concentración de nutrientes f/2, también filtrada por 0.1 |am. El método se resume en la figura 2.
Experimentos de oxidación
Los estudios de oxidación del Fe(II) se llevaron a cabo en un matraz de reacción de vidrio de doble camisa, termostatizado (250 mL) usando un baño AG-2 (±0.02 °C), para un rango de temperatura entre 5 y 35 °C. Las muestras fueron agitadas con un agitador magnético recubierto de teflón. La velocidad de oxidación del Fe(II) se estudió en el agua de mar control y en el agua de mar enriquecida con exudados orgánicos en condiciones de saturación de aire, burbujeando la disolución con aire puro durante una hora, antes del estudio y durante el mismo. El pH se ajustó al valor deseado (±0.01) con pequeñas adiciones de HCl suprapuro 0.1 M, a través de un sistema valorador automático (Titrino 719S, Methrom). La adición de Fe(II) (25 nM) a la muestra correspondió con el tiempo cero de reacción. La salinidad del agua de mar, 36.72, se determinó con un salinómetro (Portasal 8410A). El efecto de la salinidad se estudió diluyendo la muestra original con agua Milli-Q y el efecto del bicarbonato se corrigió de acuerdo con Santana-Casiano et al. (2005).
Análisis del Fe(II)
La concentración del Fe(II) se determinó espectrofotomé-tricamente con el método de la ferrozina (Violler et al. 2000). La ferrozina y el Fe(II) muestran un máximo de absorción a 562 nm. Cada 30 segundos se añadieron 10 mL de muestra a un matraz de vidrio de 25 mL que contenía ferrozina (50 µL de 0.01 M), disolución tampón de acetato (2 mL, pH 5.5) y NaF (50 µL de 7.1 x 10-4 M). Cuando el NaF se emplea con una disolución tampón de acetato y ferrozina, la absorbancia permanece estable después de 30 min (González-Dávila et al. 2005).
Se utilizó una columna capilar de 5 m de paso de luz (World Precision Instruments) conectada a un detector UV-Vis USB2000 (Ocean Optics) que permite medir concentraciones nanomolares de Fe(II). La luz empleada fue de una fuente halógena (HL-2000-FHSA de Mikropack). La cubeta de flujo y el detector UV-Vis estaban conectados con fibra óptica. El espectro se registró directamente a través del programa OOIBase32 de Ocean Optics. La muestra se introdujo en la cubeta con una bomba peristáltica (EXPETEC Perimax 12) a un flujo de 1 mL min-1. La constante aparente de velocidad de oxidación, kapp (kg mol-1 min-1), se determinó considerando

donde, en condiciones saturadas de aire, kapp = k' /[O2]. Los valores de [O2] se determinaron a partir de la ecuación de solubilidad (Benson y Krause 1984). La constante de velocidad de pseudo-primer orden, k', se determinó a partir de la regresión lineal del ln[Fe(II)] frente al tiempo, para tiempos superiores al tiempo de vida medio (t1/2), y el coeficiente de regresión R2 siempre fue > 0.98. A concentraciones micromo-lares de Fe(II) se consideró una estequiometría de oxídación de 4:1 para esta especie por el oxígeno, pero a niveles nano-molares ésta proporción ya no es valida (Santana-Casiano et el. 2005).
RESULTADOS Y DISCUSIÓN
Efecto de la concentración de células
La figura 1 muestra que en el agua de mar donde sólo se añadieron nutrientes del medio de cultivo f/2, P. tricornutum creció con una fase exponencial (2° día = 6.21 x 107 cél L-1, 4° día = 2.29 x 108 cél L-1) y una estacionaria (8° día = 4.98 x 108 cél L-1), de manera similar a resultados obtenidos previamente (Vasconcelos et al. 2002, Vasconcelos y Leal 2008).
Se estudió el efecto de los exudados orgánicos excretados por P. tricornutum cultivada en diferentes fases de crecimiento y diversas concentraciones de células (107 - 4.98 x 108 cél L-1) (fig. 3). La constante aparente de oxidación del Fe(II) disminuyó en el medio con exudados al aumentar la concentración de células productoras o el tiempo de crecimiento (fig. 3). Las mayores diferencias se observaron en los casos de exudados correspondientes a 4.98 x 108 cél L-1. El log kapp para 4.98 x 108 cél L-1 fue 2.82 ± 0.02 kg mol-1 min-1, 0.22 unidades menor que en agua de mar enriquecida con nutrientes del medio f/2 (log kapp = 3.04 ± 0.01 kg mol-1 min-1), una diferencia total de 436 kg mol-1 min-1 en kapp. Por lo tanto, la diferencia máxima en términos de kapp entre el agua de mar control y el agua de mar con exudados orgánicos añadidos de cultivos de P. tricornutum, a pH = 8.0 y T = 25 °C, fue un 60% menor. Los resultados experimentales se ajustaron a una ecuación polinómica (ecuación 6) en función de la concentración de células ([cél L-1]), donde R2 = 0.99.
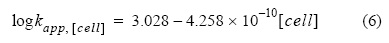
La disminución de la velocidad de oxidación del Fe(II) en presencia de exudados orgánicos de P. tricornutum incrementó el tiempo de vida media (t1/2) de 3.0 min (agua de mar) a 3.4 min (6.21 x 107 cél L-1), 4.0 min (2.29 x 108 cél L-1) y 5.1 min (4.98 x 108 cél L-1), a pH 8.0 y T = 25 °C (tabla 1). El hecho de que t1/2 fuese casi el doble cuando el agua de mar se enriqueció con exudados orgánicos excretados por 4.98 x 108 cél L-1 de P. tricornutum, permite que el Fe(II) permanezca en disolución por más tiempo. El decrecimiento lineal de log kapp en función de la concentración de células del cultivo indicó que el tipo de ligandos orgánicos que interactúan con Fe(II), o bien no cambiaron en el tiempo, o si cambiaron, se comportaron de la misma manera.
El efecto observado y presentado en este trabajo es debido al amplio espectro de exudados excretados por P. tricornutum. Algunos trabajos recientes han estudiado los exudados producidos por P. tricornutum en agua de mar enriquecida con nutrientes (Vasconcelos et al. 2002, Vasconcelos y Leal 2008) bajo condiciones similares de crecimiento. Así, se estableció que los compuestos tiólicos eran los mayores contribuyentes a los ligandos orgánicos liberados por algas eucariotas como P. tricornutum. La concentración de cisteína y glutatión (como compuestos tiólicos) incrementa con la concentración celular en los cultivos. Se encontró que la cisteína es el ligando excretado más importante. Por otra parte, también se ha demostrado la regeneración de Fe(II) en presencia de cisteína (Santana-Casiano et al. 2000). Además, en agua de mar natural se han encontrado cisteína libre y compuestos identificados como glutatión (c-glutamilcisteinil-glicina) (van den Berg et al. 1988, Le Gall y van den Berg 1993). Por lo tanto, considerando la mezcla de exudados excretados por P. tricornutum, los compuestos tiólicos podrían ser responsables de la oxidación del Fe(II). Se han planificado más estudios para conocer este comportamiento.
Efecto del pH, la temperatura y la salinidad
Se estudió el efecto del pH, en un rango entre 7.2 y 8.2, en la constante de oxidación del Fe(II) (fig. 4) en agua de mar enriquecida con exudados de cultivos de P. tricornutum, considerando las tres fases de crecimiento que se muestran en la figura 1. El log kapp depende del pH y de la densidad celular en los cultivos. Las diferencias entre el log kapp obtenido en agua de mar enriquecida con nutrientes y agua de mar enriquecida con exudados orgánicos fueron más significativas a pHs bajos. Además, estas diferencias fueron más pronunciadas cuando los cultivos se encontraban en la fase estacionaria (4.98 x 108 cél L-1). Aquí, Δlog k resultó igual a 0.41 kg mol-1 min-1 a pH = 7.2; de hecho, la velocidad de oxidación del Fe(II) a este pH (7.2) fue 60.2% menor en presencia de exudados, siendo despreciable a un pH de 8.2.

La disminución de log kapp en función del pH, para las distintas fases de crecimiento, mostró que el t1/2 del Fe(II) aumentó de 19.9 min (agua de mar enriquecida con nutrientes) a 50.6 min (4.98 x 108 cél L-1) a pH 7.2, confirmando el importante papel que juegan los exudados orgánicos de P. tricornutum en la velocidad de oxidación del Fe(II) en agua de mar en función del pH.
La constante de velocidad de oxidación del Fe(II) en función del pH (fig. 4) se ajustó a una ecuación polinómica de segundo orden (ecuación 7), como se ha hecho en trabajos previos (Santana-Casiano et al. 2004, 2005; González-Dávila et al. 2006):

donde R2 fue 0.99 y el error estándar de determinación en log kapp fue 0.08. Además, el efecto de los exudados orgánicos de P. tricornutum se estimó sustrayendo la dependencia del pH en agua de mar control y el agua de mar enriquecida con exudados (ecuación 8), donde R2 fue 0.98 y el error estándar de determinación en log kapp fue 0.12.
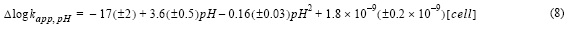
El efecto del pH en la oxidación del Fe(II) es significativo debido a que puede controlar la contribución de cada especie a la constante global de oxidación del Fe(II) en aguas naturales (Santana-Casiano et al. 2005) y la especiación de ambos, Fe(II) y ligandos orgánicos presentes en la solución.
El efecto de la temperatura en la constante de velocidad de oxidación del Fe(II) se estudió entre 5 y 35 °C (fig. 5) en presencia de exudados orgánicos. La constante de velocidad de oxidación del Fe(II) aumentó con la temperatura y disminuyó con el incremento en la concentración de células. Los resultados experimentales se ajustaron a una ecuación lineal:
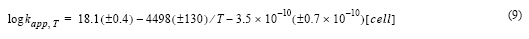
donde R2 fue 0.99, el error estándar de determinación en log kapp fue 0.059 y T la temperatura en grados Kelvin. El efecto debido sólo a los exudados también fue estimado en función de la temperatura, sustrayendo el efecto en el agua de mar control (ecuación 10), dando como resultado un R2 de 0.99 y un error estándar de determinación de 0.12 en log kapp.
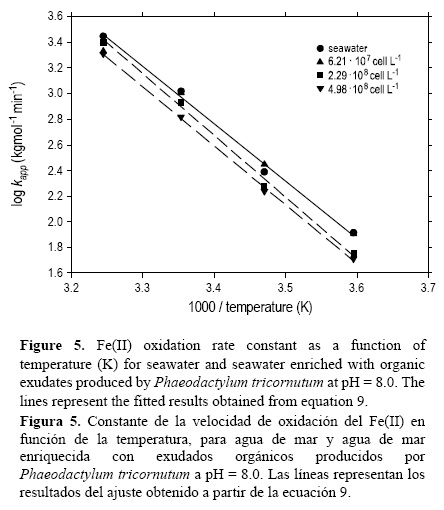

La energía de activación (Ea) fue 79 kJ mol-1 (6.21 x 107 cél L-1), 92 kJ mol-1 (2.29 x 108 cél L-1) y 88 kJ mol-1 (4.98 x 108 cél L-1). La Ea para agua de mar, con nutrientes del medio f/2, fue 86 kJ mol-1. Estos valores son comparables con resultados previos en agua de mar de la corriente del Golfo (104 kJ mol-1, Santana-Casiano et al. 2005) y del Pacífico subártico (97 y 109 kJ mol-1, Roy et al. 2008). Las diferencias en log kapp entre el agua de mar de control y el agua de mar enriquecida con exudados procedentes de la fase estacionaria (4.98 x 108 cél L-1) permanecieron constantes a 58 ± 6%, en kapp, en el rango de temperatura considerado. De acuerdo con los resultados experimentales, el Fe(II) puede persistir en aguas superficiales entre 27.6 min (agua de mar control) y 44.2 min (4.98 x 108 cél L-1) a 5 °C (tabla 1), lo cual podría explicar la presencia de Fe(II) en aguas frías (e.g., océano Sur, aguas del Pacífico subártico) (Roy et al. 2008).
El efecto de la salinidad (10.0-36.72) en la constante de oxidación del Fe(II) (fig. 6) se estudió en presencia de exudados orgánicos procedentes de cultivos de P. tricornutum, donde la concentración de bicarbonato se consideró constante a 2 mM. La constante de velocidad de oxidación del Fe(II) disminuyó al aumentar la salinidad (S), obedeciendo a una ecuación polinómica de segundo orden:
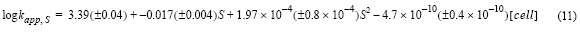
donde R2 fue 0.98 y el error estándar de determinación en log kapp fue 0.02; S corresponde a la salinidad. El efecto de los exudados en función de la salinidad también se estimó sustrayendo su efecto en el agua de mar control (ecuación 12), donde R2 fue 0.96 y el error estándar de determinación fue 0.13.
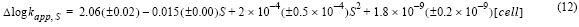
El efecto de la salinidad en la velocidad de oxidación del Fe(II) fue menos significativo en presencia de exudados orgánicos que en su ausencia (agua de mar con nutrientes f/2). La diferencia en log kapp entre S = 10 y S = 36.72 fue 0.30 kg mol-1 min-1 en agua de mar control. En presencia de exudados, la diferencia en log kapp para el rango de S estudiado se redujo a 0.17 ± 0.05 kg mol-1 min-1. No obstante, los ligandos orgánicos juegan un rol crucial en la oxidación del Fe(II) si se compara con agua de mar sin ellos, con mayor control de la oxidación por las especies iónicas mayoritarias. La variación de la velocidad de oxidación respecto al agua de mar sin exudados es mayor a bajas salinidades, lo que está relacionado con el efecto de los iones mayoritarios del agua de mar tanto en capacidad como en fuerza complejante de los ligandos.
Todos los resultados experimentales obtenidos en este estudio fueron ajustados a una función polinómica (ecuación 13) (k en kg mol-1 min-1) en función del pH (escala de ión libre), la temperatura (K), la salinidad y la concentración de células (cél L-1):
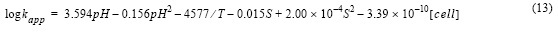
donde R2 fue 0.98 y el error estándar de determinación 0.08.
El efecto de los ligandos orgánicos de P. tricornutum en la velocidad de oxidación del Fe(II) se puede determinar a partir de la diferencia entre la velocidad de oxidación del Fe(II) en agua de mar control (log kapp,SWcontrol) y en presencia de exudados orgánicos (log kapp, células ):
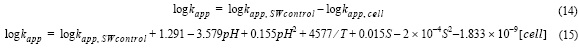
donde R2 fue 0.99 y el error estándar de determinación 0.001.
Estos resultados indican que existe un retardo en la velocidad de oxidación del Fe(II) debido al conjunto total de compuestos que componen los exudados de P. tricornutum, entre los que algunos pueden acelerar y otros ralentizar la velocidad de oxidación del Fe(II). Debido a la compleja mezcla de compuestos encontrados en el océano, cualquier extrapolación debe realizarse con precaución. Si el comportamiento observado en este estudio en los exudados orgánicos de P. tricornutum se considera como modelo para otros cultivos de diatomeas, la ecuación 15 permitirá calcular la constante de velocidad aparente de oxidación del Fe(II) en diversas condiciones experimentales. La ecuación 15 permite cuantificar la cantidad equivalente de células de P. tricornutum que producen un efecto similar.
Se deben llevar a cabo más estudios para acrecentar nuestro conocimiento sobre los exudados y su especiación. Dichos estudios nos permitirán identificar el tipo de exudados orgánicos que aceleran o retardan la velocidad de oxidación del Fe(II).
Especiación y contribución parcial a la constante de oxidación global
Para estimar los efectos de los ligandos orgánicos producidos por P. tricornutum (fig. 7) y la contribución parcial de cada especie de Fe(II) a la constante de oxidación global (fig. 8) se aplicó un modelo cinético para agua de mar y agua de mar con altas concentraciones de nutrientes (Santana-Casiano et al. 2005, González-Dávila et al. 2006, González et al. 2010). El efecto de los nutrientes se consideró ya que el agua de mar control estaba compuesta por agua de mar y nutrientes f/2. Además, el modelo consideró el efecto de los exudados orgánicos en solución, suponiendo que los complejos de Fe(II)-exudados y el Fe(II) libre se oxidan a distintas velocidades. Se ha considerado que los exudados orgánicos son un ligando simple (L + H = LH; Ka = 104 - 105, resultado del ajuste). La contribución individual de cada especie de Fe(II) a la constante cinética global se estimó a partir de los resultados del modelo cinético y la especiación de Fe(II).
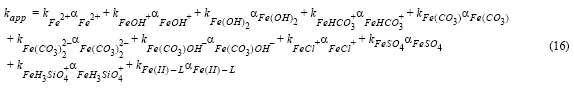
donde αi = [FeXi]/[Fe(II)]T es la fracción molar de cada especie de Fe(II) presente en la solución, kapp es la constante global de oxidación (kg mol-1 min-1), y ki son las constantes de velocidad individuales para cada especie de Fe(II). Fe(II)-L representa los complejos Fe(II)-exudados.
Los ligandos orgánicos presentes en aguas naturales pueden acelerar o desacelerar la oxidación del Fe(II), dependiendo de su estructura (Santana-Casiano et al. 2000, Rose y Waite 2003). El modelo cinético permite calcular la concentración de exudados en disolución, sus constantes de equilibrio y la constante de velocidad de oxidación de los complejos Fe(II)-exudados. El mejor ajuste para todos los experimentos que se llevaron a cabo indicó que KFe(II)-L =107 y log kFe(II)-L= 1.08 ± 0.43 kg mol-1 min-1. La concentración total de exudados calculada fue de 11 ± 1 nM (6.21 x 107 cél L-1), 113 ± 4 nM (2.29 x 108 cél L-1) y 170 ± 10 nM (4.98 x 108 cél L-1). La concentración total de ligan-dos fue similar a la medida por otros autores para el octavo día de cultivo (4.98 x 108 cél L-1) (Vasconcelos et al. 2002, Vasconcelos y Leal 2008).
En la figura 7 se muestra la especiación de todas las variedades de Fe(II) presentes en estos cultivos. Cuando la concentración de exudados aumentó en la disolución, el Fe(II)-L llegó a ser la especie más importante. La especie Fe(II)-L fue despreciable a 6.21 x 107 cél L-1 (5%) y fue la especie más abundante a 4.98 x 108 cél L-1 (50%), mientras que el Fe2+ varió desde 58% en el agua de mar de referencia hasta 29% en el agua de mar con exudados producidos por 4.98 x 108 cél L-1 de P. tricornutum, a pH 7.2. A pH 8.5, el Fe(II)-L abarca del 2% (6.21 x 107 cél L-1) al 20% (4.98 x 108 cél L-1). La especiación del Fe(II) para 6.21 x 107 cél L-1 a pH 8.0 siguió la secuencia: Fe2+ > FeCO3 > Fe(H3SiO4)+ > FeCl+ > Fe(SO4) > Fe(II)-L > Fe(CO3)(OH)-. A 4.98 x 108 cél L-1, las especies de Fe(II) siguen la siguiente secuencia: Fe(II)-L > Fe2+ > FeCO3 > Fe(H3SiO4)+ > FeCl+ > Fe(SO4) > Fe(CO3)(OH)-.
La contribución de cada especie a la constante global de oxidación (fig. 8) resultante del modelo cinético mostró que la contribución de Fe(II)-L fue más importante a bajos pHs. La contribución de Fe(II)-L fue despreciable para el segundo día de cultivo (6.21 x 107 cél L-1) (1%) pero fue el segundo mayor contribuyente en presencia de exudados producidos por 4.98 x 108 cél L-1 (16%), a pH 6. A pH 8.0 la contribución de la especie Fe(II)-L a la constante global del proceso fue inferior al 0.3% en cada caso. Mientras que los complejos de Fe(II) disminuyen la velocidad de oxidación, la relación entre las constantes de velocidad del resto de especies era prácticamente constante en el agua de mar de referencia y el agua de mar enriquecida con exudados a pH > 8.0.
CONCLUSIONES
La constante de velocidad de oxidación del Fe(II) fue siempre menor en presencia de exudados orgánicos de P. tricornutum que en agua de mar sin ligandos. La velocidad de oxidación del Fe(II) se relacionó linealmente con la concentración de células y el tiempo de cultivo. La constante de velocidad disminuyó en función de las fases de cultivo, al igual que con el tiempo de cultivo, en función del pH, la temperatura y la salinidad. El efecto de la salinidad en log kapp para agua de mar enriquecida con exudados orgánicos fue menos importante que para el agua de mar sin ellos. Sin embargo, a bajas fuerzas iónicas los ligandos orgánicos inter-accionan con el Fe(II) de forma más efectiva, permitiendo que esta especie sea estable por más tiempo. Los resultados confirman que el Fe(II) puede estar más tiempo presente en aguas superficiales naturales en presencia de ligandos producidos por células fitoplanctónicas. La ecuación global (ecuación 15) permite calcular la fracción de la constante de velocidad de oxidación del Fe(II) que corresponde a los exudados orgánicos excretados por diatomeas en aguas naturales. El modelo cinético confirma que los exudados de P. tricornutum interaccionan significativamente con el Fe(II), afectando tanto a la especiación como a la contribución de cada especie de Fe(II) a la constante global de este proceso en el agua de mar.
AGRADECIMIENTOS
Este estudio fue realizado con fondos de los proyectos CTM2006-09857, EFECO2 CTM2009-12526 y ECOFEMA CTM2010-19517-MAR, del Ministerio de Ciencia e Innovación de España. La participación de AGG fue apoyada por la beca BES-2007-15776 del Ministerio de Ciencia e Innovación. Se agradece a Margaret Hart por la revisión del manuscrito en inglés.
REFERENCIAS
Benson B, Krause D. 1984. The concentration and isotopic fractionation of oxygen dissolved in fresh water and seawater in equilibrium with the atmosphere. Limnol. Oceanogr. 29: 620-632. [ Links ]
Chen M, Dei RCH, Wang WX, Guo L. 2003. Marine diatom uptake of iron bound with natural colloids of different origins. Mar. Chem. 81: 177-189. [ Links ]
Croot PL, Bowie AR, Frew RD, Maldonado MT, Hall JA, Safi KA, La Roche J, Boyd PW, Law CS. 2001. Retention of dissolved iron and Fe(II) in an iron induced Southern Ocean phytoplankton bloom. Geophys. Res. Lett. 28: 3425-3428. [ Links ]
Croot PL, Laan P, Nishioka J, Strass V, Cisewski B, Boye M, Timmermans KR, Bellerby RG, Goldson L, Nightingale P, Baar HJW de. 2005. Spatial and temporal distribution of Fe(II) and H2O2 during EisenEx, an open ocean mesoscale iron enrichment. Mar. Chem. 95: 65-88. [ Links ]
Davison W, Seed G. 1983. The kinetics of the oxidation of ferrous iron in synthetic and natural waters. Geochim. Cosmochim. Acta 47: 67-79. [ Links ]
Emennegger L, King DW, Sigg L, Sulzberger B. 1998. Oxidation kinetics of Fe(II) in a eutrophic Swiss lake. Environ. Sci. Technol. 32: 2990-2996. [ Links ]
Faust BC, Zeep RG. 1993. Photochemistry of aqueous iron(III)-polycarboxylate complexes: Roles in the chemistry of atmospheric and surface waters. Environ. Sci. Technol. 27: 2517-2522. [ Links ]
Fujii M, Rose AL, Waite TD, Omura T. 2008. Effect of divalent cations on the kinetics of Fe(III) complexation by organic ligands in natural waters. Geochim. Cosmochim. Acta 72: 1335-1349. [ Links ]
Gerringa LJA, Rijkenberg MJA, Wolterbeek HT, Verburg TG, Boye M, Baar HJW de. 2007. Kinetic study reveals weak Fe-binding ligand, which affects the solubility of Fe in the Scheldt estuary. Mar. Chem. 103: 30-45. [ Links ]
Ghost MM. 1974. Oxygenation of ferrous iron(II) in highly buffered waters. In: Rubin AJ (ed.), Aqueous Environmental Chemistry of Metals. Ann Arbor Science, Ann Arbor, MI, pp. 193-217. [ Links ]
Gledhill M, van den Berg CMG. 1994. Determination of complexation of iron(III) with natural organic complexing ligands in seawater using cathodic stripping voltammetry. Mar. Chem. 47: 41-54. [ Links ]
González AG, Santana-Casiano JM, Pérez N, González-Dávila M. 2010. Oxidation of Fe(II) in natural waters at high nutrient concentrations. Environ. Sci. Technol. 44: 8095-8101. [ Links ]
González-Dávila M, Santana-Casiano JM, Millero FJ. 2005. Oxidation of nanomolar levels of iron(II) with H2O2 in Seawater. Geochim. Cosmochim. Acta 69: 83-93. [ Links ]
González-Dávila M, Santana-Casiano JM, Millero FJ. 2006. Competition between O2 and H2O2 in the oxidation of Fe(II) in natural waters. J. Solution Chem. 35: 95-111. [ Links ]
Guillard RRL. 1975. Culture of phytoplankton for feeding marine invertebrates. In: Smith WL, Chanley MH (eds.), Culture of Marine Invertebrate Animals. Plenum Press, New York, pp. 29-60. [ Links ]
Gunnars A, Blomqvist S, Johansson P, Andersson C. 2002. Formation of Fe(III) oxyhydroxide colloids in freshwater and brackish seawater, with incorporation of phosphate and calcium. Geochim. Cosmochim. Acta 66: 746-758. [ Links ]
Hirose K. 2007. Metal-organic matter interaction: Ecological roles of ligands in oceanic DOM. Appl. Geochem. 22: 1636-1645. [ Links ]
Johnson KS, Coale KH, Elrod VA, Tindale NW. 1994. Iron photochemistry in seawater from equatorial Pacific. Mar. Chem. 46: 319-334. [ Links ]
Kester DR, Byrne RH Jr, Liang Y. 1975. Redox reactions and solution complexes of iron in marine systems. In: Chuch IM (ed.), Marine Chemistry of the Coastal Environment. ACS Symposium Series 18, American Chemical Society, Washington, DC, pp. 56-79. [ Links ]
Kieber RJ, Williams K, Willey JD, Skrabal S, Avery GB. 2001. Iron speciation in coastal rainwater: Concentration and deposition to seawater. Mar. Chem. 73: 83-95. [ Links ]
King DW. 1998. Role of carbonate speciation on the oxidation rate of Fe(II) in aquatic systems. Environ. Sci. Technol. 32: 2997-3003. [ Links ]
King DW, Lounsbury HA, Millero, FJ. 1995. Rates and mechanism of Fe(II) oxidation at nanomolar total iron concentration. Environ. Sci. Technol. 29: 818-824. [ Links ]
Kuma K, Nishioka J, Matsunaga K. 1996. Controls on iron(III) hydroxide solubility in seawater: The influence of pH and natural organic chelators. Limnol. Oceanogr. 41: 396-407. [ Links ]
Kustka AB, Shaked Y, Milligan AJ, King DW, Morel FMM. 2005. Extracellular production of superoxide by marine diatoms: Contrasting effects on iron redox chemistry and bioavailability. Limnol. Oceanogr. 50: 1172-1180. [ Links ]
Laglera LM, van den Berg CMG. 2007. Wavelength dependence of the photochemical reduction of iron in Arctic seawater. Environ. Sci. Tech. 41: 2296-2302. [ Links ]
Le Gall A, van den Berg CMG. 1993. Cathodic stripping voltammetry of glutathione in natural waters. Analyst 118: 1411-1415. [ Links ]
Maldonado MT, Price NM. 2001. Reduction and transport of organically bound iron by Thalassiosira oceanica (Bacillariophyceae). J. Phycol. 37: 298-309. [ Links ]
Millero FJ. 1986. The pH of estuarine waters. Limnol. Oceanogr. 31: 839-847. [ Links ]
Millero FJ, Izaguirre M. 1989. Effect of ionic strength and ionic interactions on the oxidation of Fe(II). J. Solution Chem. 18: 585-599. [ Links ]
Millero FJ, Sotolongo S. 1989. The oxidation of Fe(II) with H2O2 in seawater. Mar. Chem. 53: 1867-1873. [ Links ]
Millero FJ, Sotolongo S, Izaguirre M. 1987. The oxidation kinetics of Fe(II) in seawater. Geochim. Cosmochim. Acta 51: 793-801. [ Links ]
Millero FJ, Sotolongo S, Stade DJ, Vega CA. 1991. Effect of ionic interactions on the oxidation of Fe(II) with H2O2 in aqueous solutions. J. Solution Chem. 20: 1079-1092. [ Links ]
Millero FJ, González-Dávila M, Santana-Casiano JM. 1995. Reduction of Fe(III) with sulfite in natural waters. J. Geophys. Res. 100: 7235-7244. [ Links ]
Rijkenberg MJA, Gerringa LJA, Timmermans KR, Fischer AC, Kroon KJ, Buma AGJ, Wolterbeek BT, Baar HJW de. 2008. Enhancement of the reactive pool by marine diatoms. Mar. Chem.109: 29-44. [ Links ]
Rose AL, Waite TD. 2002. Kinetic model for Fe(II) oxidation in seawater in the absence and presence of natural organic matter. Environ. Sci. Technol. 36: 433-444. [ Links ]
Rose AL, Waite TD. 2003. Effect of dissolved natural organic matter on the kinetics of ferrous iron oxygenation in seawater. Environ. Sci. Technol. 37: 4877-4886. [ Links ]
Rose AL, Salmon TP, Lukondeh T, Neilan BA, Waite TD. 2005. Use of superoxide as an electron shuttle for iron acquisition by the marine cyanobaterium Lyngbya majuscule. Environ. Sci. Technol. 39: 3708-3715. [ Links ]
Roy EG, Wells ML, King W. 2008. Persistence of iron(II) in surface waters of the western subarctic Pacific. Limnol. Oceanogr. 53: 89-98. [ Links ]
Rue EL, Bruland KW. 1995. Complexation of iron(III) by natural organic ligands in the central North Pacific as determined by a new competitive ligand equilibration adsorptive cathodic stripping voltammetric method. Mar. Chem. 50: 117-138. [ Links ]
Rue EL, Bruland KW. 1997. The role of organic complexation on ambient iron chemistry in the equatorial Pacific Ocean and the response of a mesoscale iron addition experiment. Limnol. Oceanogr. 42: 901-910. [ Links ]
Santana-Casiano JM, González-Dávila M, Rodríguez MJ, Millero FJ. 2000. The effect of organic compounds on the oxidation kinetics of Fe(II). Mar. Chem. 70: 211-222. [ Links ]
Santana-Casiano JM, González-Dávila M, Millero FJ. 2004. The oxidation of Fe(II) in NaCl-HCO3- and seawater solutions in the presence of phthalate and salicylate ions: A kinetic model. Mar. Chem. 85: 27-40. [ Links ]
Santana-Casiano JM, González-Dávila M, Millero FJ. 2005. Oxidation of nanomolar levels of Fe(II) with oxygen in natural waters. Environ. Sci. Technol. 39: 2073-2079. [ Links ]
Steigenberger S, Stathman PJ, Volker C, Passow U. 2010. The role of polysaccharides and diatom exudates in the redox cycling of Fe and the photoreduction of hydrogen peroxide in coastal seawaters. Biogeosciences 7: 109-119. [ Links ]
Stumm W, Lee GF. 1961. Kinetic product of ferrous iron. Ind. Eng. Chem. 53: 143-146. [ Links ]
Sunda WG, Huntsman SA. 1997. Interrelated influence of iron, light and cell size on marine phytoplankton growth. Nature 390: 389-392. [ Links ]
Sung W, Morgan JJ. 1980. Kinetics and product of ferrous iron oxygenation in aqueous solutions. Environ. Sci. Technol. 14: 561-568. [ Links ]
Tamura H, Goto K, Nagayama M. 1976. Effects of anions of the oxygenation of ferrous iron in neutral solutions. J. Inorg. Nucl. Chem. 38: 113-117. [ Links ]
Theis TL, Singer PC. 1974. Complexation of iron(II) by organic matter and its effect on iron(II) oxygenation. Environ. Sci. Technol. 8: 569-573. [ Links ]
Van den Berg CMG. 1995. Evidence for organic complexation of iron in seawater. Mar. Chem. 50: 139-157. [ Links ]
Van den Berg CMG, Househam BC, Riley JP. 1988. Determination of cystine and cysteine in seawater using cathodic stripping voltammetry in the presence of Cu(I). J. Electroanal. Chem. 239: 137- 148. [ Links ]
Vasconcelos MTSD, Leal MFC. 2008. Exudates of different marine algae promote growth and mediate trace metal binding in P. tricornutum. Mar. Environ. Res. 66: 499-507. [ Links ]
Vasconcelos MTSD, Leal MFC, van den Berg CMG. 2002. Influence of the nature of the exudates released by different marine algae on the growth, trace metal uptake and exudation of Emiliania huxleyi in natural seawater. Mar. Chem. 77: 187-210. [ Links ]
Violler E, Inglett PW, Hunter K, Roychuodhury AN, Cappellen P. 2000. The ferrozine method revisited: Fe(II)/Fe(III) determination in natural waters. Appl. Geochem. 15: 785-790. [ Links ]
Wells ML, Mayer LM, Donard OFX, De Souza Sierra MM, Ackelson SG. 1991. The photolysis of colloidal iron in the oceans. Nature 353: 248-250. [ Links ]
Witter AE, Luther GW. 1998. Variation in Fe-organic complexation with depth in the northwestern Atlantic Ocean as determined using a kinetic approach. Mar. Chem. 62: 241-258. [ Links ]
NOTA
* Descargar versión bilingüe (Inglés-Español) en formato PDF.














