Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.38 no.1a Ensenada Mar. 2012
Diversidad ambiental de las historias migratorias de los mugílidos Mugil cephalus y M. curema en aguas costeras mexicanas analizadas mediante la proporción de Sr:Ca en los otolitos*
Diversity of migratory environmental history of the mullets Mugil cephalus and M. curema in Mexican coastal waters as indicated by otolith Sr:Ca ratios
AL Ibáñez1*, CW Chang2, CC Hsu3, CH Wang4, Y Iizuka5, WN Tzeng4,6**
1 Universidad Autónoma Metropolitana–Iztapalapa, Departamento de Hidrobiología, México DF, México. Corresponding authors. E–mail: *ana@xanum.uam.mx,**wnt@ntu.edu.tw
2 National Museum of Marine Biology and Aquarium, and Institute of Marine Biodiversity and Evolutionary Biology, National Donghwa University, Taiwan, ROC.
3 Earth Dynamic System Research Center, National Chengkung University, Taiwan, ROC.
4 Department of Environmental Biology and Fisheries Science, National Taiwan Ocean University, Taiwan, ROC.
5 Institute of Earth Sciences, Academia Sinica, Taiwan, ROC.
6 Institute of Fisheries Science, National Taiwan University, Taiwan, ROC.
Received November 2010
Received in revised form November 2011
Accepted November 2011
RESUMEN
Con el objeto de entender la historia migratoria y el uso del hábitat de dos mugílidos de importancia comercial en México, se recolectaron 31 ejemplares de la lisa Mugil cephalus y 40 de la lebrancha M. curema de tres zonas geográficas distintas (la laguna de Tamiahua y los estuarios de Cazones y Tecolutla, Veracruz) del oeste del golfo de México. Se midió la proporción de Sr:Ca en los otolitos sagita desde el primordio hasta el margen del otolito con un microanalizador de electrones. La edad de los ejemplares fue determinada contando los anillos de crecimiento en el otolito. Los patrones de Sr:Ca fueron diferentes entre zonas geográficas y especies, lo que indica que el uso del hábitat y el comportamiento migratorio es distinto entre las dos especies. La variabilidad de la proporción de Sr:Ca en los otolitos fue consistente con el ambiente en el que habitan estas especies. Estos mugílidos muestran una preferencia eurihalina más que simplemente un comportamiento catádromo. La proporción de Sr:Ca en el núcleo de los otolitos indicó que estos mugílidos pueden desovar tanto en aguas marinas como en ambientes salobres o que posiblemente desoven en ambientes marinos y los huevos sean transportados a ambientes costeros salobres. Los valores máximos de la proporción de Sr:Ca correspondieron a la depositación del anillo anual, lo que valida las diferencias en la migración reproductiva al mar que realiza M. cephalus en invierno y M. curema en primavera.
Palabras clave: Mugil cephalus, Mugil curema, otolitos, proporción Sr:Ca, historia migratoria ambiental.
ABSTRACT
To understand their migratory environmental history and habitat use in Mexican waters, 31 striped mullet Mugil cephalus and 40 white mullet M. curema (family Mugilidae) were collected from three habitats (Tamiahua Lagoon, and Cazones and Tecolutla estuaries, Veracruz) in the western Gulf of Mexico. Sr:Ca ratios in otoliths of mullets were measured from the primordium to the otolith edge with an electron probe microanalyzer. Mullets were aged by counting the otolith annuli. The patterns in mullet otolith Sr:Ca ratio differed among habitats and between species, indicating that habitat use and migratory behavior differed between species. Variability in otolith Sr:Ca ratios was consistent with that of the environment inhabited by the mullets. They showed a more diverse euryhaline preference than the simple catadromous behavior expected. The Sr:Ca ratios in the core region of the otolith indicated that mullets can spawn in both offshore waters and nearshore brackish waters, or that spawning may occur in offshore waters and that onshore currents/winds carry the fertilized eggs into onshore waters where salinities are lower. Peak Sr:Ca ratios corresponded to otolith annulus deposition, which validated the difference in timing of seaward spawning migration between striped mullet (winter) and white mullet (spring).
Key words: Mugil cephalus, Mugil curema, otolith, Sr:Ca ratios, migratory environmental history.
INTRODUCCIÓN
La lisa cabezona Mugil cephalus Linnaeus 1758 se distribuye ampliamente en aguas costeras, lagunas y estuarios entre 42° N y 42° S (De Silva y Silva 1979), mientras que la lisa blanca o lebrancha M. curema (Valenciennes 1836) es esencialmente una especie americana que se distribuye desde Nueva Escocia (Canadá) hasta Brasil en la costa oriental y desde California hasta Chile en la costa occidental de América (Nirchio et al. 2005, Bonner 2007), con unas cuantas poblaciones en aguas africanas (Alvarez–Lajonchere 1976). México es uno de los diez países más productivos de mugílidos en el mundo (FAO 2009), con una producción anual promedio de aproximadamente 12,0001 año–1 (SAGARPA 2009), y es una fuente muy valiosa de hueva. Alrededor del 99% de la producción de mugílidos se captura en las lagunas Madre y Tamiahua en la región occidental del golfo de México.
Mugil cephalus desova anualmente en el golfo de México entre noviembre y febrero, coincidiendo con el monzón estacional impulsado por vientos del norte (Ibáñez y Gallardo–Cabello 2004, Ibáñez y Gutiérrez–Benítez 2004). Mugil curema también desova en el golfo de México pero entre febrero y mayo, con máxima actividad en abril (Anderson 1958, Arnold y Thompson 1958, Moore 1974, Finucane et al. 1978, Render et al. 1995). La diferencia de la temporada de desove entre las especies produce una diferencia de tres meses en el tiempo de reclutamiento (Ibáñez 1993, Ibáñez y Gallardo–Cabello 2004). Se supone que los mugílidos son especies catádromas y que migran de aguas estuarinas al mar para desovar (De Silva 1980, Torricelli et al. 1982). Los individuos jóvenes aparentemente ingresan a las lagunas Madre y Tamiahua donde permanecen hasta que maduran e inician su migración de desove (Ibáñez y Gallardo–Cabello 2004, Ibáñez y Gutiérrez–Benítez 2004). Sin embargo, estudios recientes indican que los patrones migratorios de M. cephalus en Taiwán difieren de los previamente conocidos (Chang et al. 2004a). La historia migratoria de las lisas M. cephalus y M. curema en el golfo de México, especialmente entre sistemas fluvio–estuarinos, lagunas costeras y zonas de desove mar adentro, no es bien conocida.
Los otolitos de peces teleósteos están compuestos de carbonato de calcio depositado regularmente como cristales de aragonita en una matriz proteica (Degens et al. 1969, Pannella 1971). Se han utilizado elementos del otolito como la proporción de estroncio (Sr) y calcio (Ca) como una etiqueta natural para reconstruir la historia migratoria de peces ya que el Sr incorporado en los otolitos se correlaciona positivamente con la salinidad ambiental (Secor et al. 1995, Tzeng 1996, Campana 1999, Zimmerman 2005). Existen dos métodos para validar la proporción de Sr:Ca en relación con la salinidad ambiental. El primero consiste en experimentos de laboratorio controlados en los que se crían peces en diferentes regímenes de salinidad para ver si los elementos constituyentes del otolito cambian con la concentración del elemento en el agua (Tzeng 1996, Secor et al. 1998, Elsdon y Gillanders 2006). El segundo método evalúa la proporción de Sr:Ca en el margen del otolito de peces recolectados en hábitats de salinidad diferente (Tzeng et al. 1997, 2002, 2003; Chang et al. 2004b). Se han empleado cambios cronológicos en la proporción de Sr:Ca en otolitos para establecer las historias migratorias de varios peces diádromos, tales como la lubina estriada Morone saxatilis (Secor 1992, Secor y Piccoli 1996); las anguilas de agua dulce Anguilla japonica, A. anguilla y A. rostrata (e.g., Tzeng et al. 1997, 2002, 2003; Jessop et al. 2002) que migran entre agua dulce y ambientes marinos; y la lisa M. cephalus (Chang et al. 2004a, 2004b).
El objetivo del presente estudio fue evaluar los cambios cronológicos en la proporción de Sr:Ca en los otolitos para entender el uso de hábitat y el comportamiento migratorio de M. cephalus and M. curema entre zonas geográficas de aguas mexicanas. Asimismo, se analizó la proporción de Sr:Ca en el núcleo de los otolitos para entender los hábitats de desove, y se examinaron las máximas proporciones de Sr:Ca en relación con las marcas de crecimiento en los otolitos para entender la migración hacia la costa y hacia el mar de estos mugílidos.
MATERIALES Y MÉTODOS
Diseño de muestreo y medición biológica
Se recolectaron especímenes de M. cephalus y M. curema de la captura comercial de la laguna de Tamiahua (21°06'–22°06' N y 97°23'–97°46' W) en noviembre de 2006, y de los estuarios de Cazones (20°43' N y 97°11' W) y Tecolutla (20°29' N y 97°00' W), en el estado de Veracruz (México), en marzo de 2007 (fig. 1). El área de la laguna de Tamiahua (de aquí en adelante TaL) es de alrededor de 88,000 ha. La laguna es principalmente salobre pero su salinidad es muy influenciada por las corrientes mareales, la precipitación y las descargas fluviales (Camacho–Barrera et al. 1983). Básicamente, las bocas de la laguna (Tampachiche al norte y Corazones al sur) son euhalinas con salinidad mayor que 30 , mientras que el resto de la laguna es polihalina con salinidad entre 16 y 30 (Camacho–Barrera et al. 1983). La salinidad en la laguna oscila estacionalmente entre 32.5 y 34.7 durante la época seca en primavera y alrededor de 4 durante la época de lluvias en octubre (Alaves 1978). La salinidad en el estuario de Tecolutla (TeE) varió de 3.68 en diciembre a 0.46 en junio (Delon 1984). Existe poca información sobre la salinidad del estuario de Cazones (CaE), pero muestras recolectadas del río y de la boca del río en marzo de 2010 mostraron una estratificación de la salinidad, con agua dulce en la superficie y una salinidad entre 4 y 6 a 2 m de profundidad. La temperatura del agua varió entre 25.3 °C en la superficie y 21.3 °C a 2 m de profundidad.

En cada muestreo se seleccionaron 10 lisas aleatoriamente de la captura, excepto en TeE donde sólo se recolectó un ejemplar de M. cephalus, y se les extrajo el otolito sagita derecho para analizar la proporción de Sr:Ca. Se analizaron un total de 31 ejemplares de M. cephalus y 40 de M. curema (tabla 1). Se midió la longitud total (LT, mm) con precisión de ±1 mm y el peso total (PT, g) con precisión de ±1 g. El sexo y la maduración gonadal se determinaron in situ. Se determinaron las etapas de maduración sexual de ambas especies según lo propuesto por Díaz–Pardo y Hernández–Vázquez (1980): la etapa I corresponde a la etapa juvenil; en la etapa II, las gónadas ocupan 1/3 de la cavidad abdominal del pez; en la etapa III, las gónadas ocupan de 1/2 a 3/4 de la cavidad abdominal y los ovocitos individuales aún no son visibles; en la etapa IV, la etapa de predesove, las gónadas ocupan de 3/4 al total de la cavidad abdominal y los ovocitos son visibles; en la etapa V, la etapa de desove, las gónadas ocupan toda la cavidad abdominal y se pueden liberar los ovocitos y el esperma al oprimir el cuerpo; y la etapa VI corresponde a la etapa de posdesove.
Preparación del otolito para el análisis microquímico y la determinación de la edad
Los otolitos se limpiaron, se secaron al aire, se incluyeron en resina epoxi, se seccionaron transversalmente para obtener una lámina delgada de ca. 300 µm de espesor, se pulieron hasta quedar expuesto el primordio y se cubrieron con carbono. Se midieron las concentraciones de Sr y Ca del otolito pulido desde el primordio hasta el margen del otolito, con un intervalo de 10 µm, mediante un microanalizador de sonda de electrones (JEOL JXA–8900R) equipado con espectrómetros de rayos × de dispersión de longitud de onda. Los análisis fueron realizados con un voltaje de aceleración de 15 kV, una corriente del haz de 3 nA y un haz de barrido rectangular de 5 × 4 µm. La máxima intensidad de rayos × de Sr La fue contada durante 80 segundos con mediciones de fondo durante 20 segundos a cada lado superior e inferior. La máxima intensidad de rayos × de Ca Ka se contó durante 20 segundos y cada medición de fondo durante 10 segundos. Se usaron una aragonita sintetizada (CaCO3) y una estroncianita nativa ([Sr095Ca005]CO3: NMNH R10065) como estándares para calibrar la concentración de Ca y Sr en los otolitos mediante el método de corrección de PRZ. El límite de detección, que se basa en el límite de control de 3 sigma, es aproximadamente 400 ppm para Sr. Los datos de conteo de Sr y Ca en otolitos se expresan como proporciones de la concentración de Sr:Ca (ppmppm–1).
Después del microanálisis de electrones, los otolitos fueron ligeramente repulidos para quitar la capa de carbono y se sumergieron en una solución de HCl al 5% durante 10 segundos para mejorar la definición de los anillos de crecimiento anual. La edad se determinó contando los anillos de crecimiento (zonas opacas) en una fotografía del otolito tomada bajo luz reflejada. Se evaluaron los valores máximos de la proporción de Sr:Ca correspondiendo al anillo anual para validar el desove en el mar y/o las migraciones de invierno con el suavizador robusto no lineal 4253H–doble (Tukey 1977). La identificación de un anillo de crecimiento anual por zona opaca se realizó siguiendo los criterios de Ibáñez y Gallardo–Cabello (1996) y Hsu y Tzeng (2009).
Análisis de datos
Los valores medios de la proporción de Sr:Ca en los otolitos se calcularon desde el primordio hasta el margen dorsal del otolito para cada individuo. Se probaron las diferencias significativas de los valores medios entre especies, sitios de muestreo, grupos de edad y meses mediante el método no paramétrico de Kruskal–Wallis ya que los datos no cumplieron con el requisito de homogeneidad de varianza y los tamaños de muestra eran diferentes. Cuando se encontraron diferencias, se realizaron comparaciones de los valores medios de la proporción de Sr:Ca entre pares con la prueba de Mann–Whitney. Se utilizó la distribución de frecuencia de las proporciones de Sr:Ca construidas por sitio de muestreo y por edad para examinar la diferencia en el uso del hábitat entre especies. Además, se utilizaron diagramas de cajas para analizar la variabilidad de las proporciones de Sr:Ca por especie, sitio y mes. La diferencia de las proporciones de Sr:Ca en el núcleo de los otolitos entre especies, sitios y meses se evaluó mediante un análisis de varianza univariado. Se evaluaron la homogeneidad de varianza y la normalidad con la prueba de Levene y la prueba de Shapiro–Wilk, respectivamente, con un nivel de significación de α = 0.05.
Los mugílidos se clasificaron en residentes de agua dulce, de agua salobre y de agua marina con base en los criterios de Chang et al. (2004b), donde los valores medios de la proporción de Sr:Ca entre 3 × 10–3 y 7 × 10–3 correspondieron a residentes de agua salobre, mientras que los valores por debajo y arriba de este intervalo correspondieron a residentes de agua dulce y agua marina, respectivamente. Aunque no se ha realizado un experimento de la relación entre la proporción de Sr:Ca en otolitos y la salinidad para especies de mugílidos en aguas mexicanas, consideramos que tal relación debería ser similar a la documentada para M. cephalus de Taiwán (Chang et al. 2004a, 2004b; Wang et al. 2010, 2011) y para otras especies catádromas como las anguilas americanas, europeas y japonesas (Daverat et al. 2006).
RESULTADOS
Migración estacional según los valores máximos de la proporción de Sr:Ca en relación con la marca de edad en los otolitos
El cambio cronológico de la proporción de Sr:Ca y las marcas de edad (bandas opacas) en los otolitos de ambos mugílidos, M. cephalus y M. curema, mostraron que los valores máximos de la proporción de Sr:Ca correspondieron al periodo en que se depositaron las marcas de edad (bandas opacas) (figs. 2a, b; 3a, b). Las marcas de edad en los otolitos generalmente se depositaron en el periodo de crecimiento lento del pez durante el invierno o el desove, y el valor máximo podría indicar su migración hacia el mar. Los primeros dos máximos de la proporción de Sr:Ca de los ejemplares de M. cephalus de tres años de edad fueron de 5 × 10–3 y 6 × 10–3 y el tercer máximo fue mayor que 7 × 10–3. Esto indica que esta especie permaneció en agua salobre durante los primeros dos inviernos y migró a agua marina en el tercer invierno (fig. 2a, b). De forma similar, los individuos de M. curema de dos años de edad migraron a agua salobre en el primer invierno y a agua marina en el segundo (fig. 3a, b). El porcentaje de coincidencias en ocurrencia entre las marcas de edad y los valores máximos de la proporción de Sr:Ca fue mayor para M. cephalus (74.2%) y menor para M. curema (45%) (fig. 4a, b). Las edades estimadas mediante el número de bandas opacas y la frecuencia de las proporciones máximas de Sr:Ca no difirieron significativamente entre especies (M. cephalus: t (30) = –0.70, P = 0.49; M. curema: t (39) = 0.76, P = 0.45), lo que indica que las proporciones máximas en los otolitos se depositan anualmente y que la migración hacia y fuera de la costa es bastante regular.



Diferencia entre especies de la selección de hábitat según la proporción de Sr:Ca en los otolitos
Las distribuciones de frecuencia con curva normal de la proporción de Sr:Ca en los otolitos (fig. 5) indicó que los ejemplares de M. cephalus de CaE provenían de un hábitat marino y los de TaL de aguas salobres, mientras que el único espécimen de TeE mostró un hábitat marino. Los ejemplares de M. curema de TeE mostraron una mayor frecuencia de ocurrencia en aguas salobres, mientras que los de TaL y CaE mostraron mayor frecuencia de ocurrencia en aguas marinas. La mayoría de los individuos recolectados en los tres hábitats se clasificaron como residentes de agua marina y salobre independientemente de la época, y pocos fueron residentes de agua dulce. El porcentaje de residentes de agua marina y agua salobre difirió ligeramente entre especies, el porcentaje de residentes marinos de M. cephalus (59.3–88.5%) siendo mayor que el de M. curema (44.7–64.1%). Esto sugiere una diferencia en la selección de hábitat entre especies, la primera mostrando una tendencia a ser residentes de agua marina y la segunda, residentes de agua salobre. Los valores medios de la proporción de Sr:Ca en los otolitos difirieron significativamente entre especies (χ2(1) = 294.4, P ≤ 0.0001).
Para cada especie, los valores medios de la proporción de Sr:Ca en los otolitos difirieron significativamente entre sitios (χ2(2) = 566.9, P < 0.0001) y entre meses de muestreo (χ2(1) = 439.9, P < 0.0001), pero no entre grupos de edad (χ2(3) = 1.6, P = 0.645). La proporción media de Sr:Ca para M. cephalus capturada en TaL fue 6.3 × 10–3, constando de 6.2 × 10–3 en noviembre y 6.5 × 10–3 en marzo (tabla 2). En CaE, la proporción media de Sr:Ca en los otolitos de M. cephalus fue 7.5 × 10–3, mayor que en TaL, excluyendo TeE debido al tamaño de muestra pequeño (tabla 2). El gran valor medio de la proporción de Sr:Ca en los otolitos de M. curema capturada en TaL fue 6.9 × 10–3, constando de una media de 6.3 × 10–3 en noviembre y de 7.3 × 10–3 en marzo, y fue 6.3 × 10–3 para CaE y 5.6 × 10–3 para TeE (tabla 2). Las proporciones de Sr:Ca de M. cephalus difirieron significativamente entre TaL y ambos estuarios pero no entre estuarios (tabla 3a). Los valores medios de la proporción de Sr:Ca de M. curema difirieron significativamente entre los tres sitios (χ2(2) = 175.8, P < 0.0001), aunque no entre TaL y CaE (tabla 3b), pero no difirieron significativamente entre meses (χ2(1) = 0.023, P = 0.88) o grupos de edad (χ2(3) = 7.9, P = 0.21).

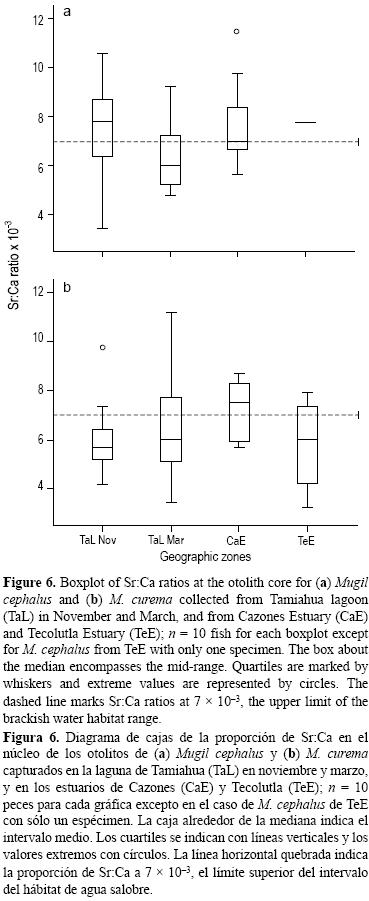
Uso de hábitat en las etapas tempranas según la proporción de Sr:Ca en el núcleo del otolito
Los valores medios de la proporción de Sr:Ca en el núcleo del otolito no difirieron significativamente entre especies(F (1,63) = 3.75, P = 0.057), meses F (1,63) = 0.34, P = 0.56) o sitios F (1,63) = 1.58, P = 0.21). Las interacciones entre especies y meses (F(1,63) = 1.42, P = 0.24) y entre especies y sitios F (2.63) = 0.47, P = 0.63) tampoco fueron significativamente diferentes.
Si la proporción de Sr:Ca en el núcleo del otolito refleja la salinidad del hábitat durante el periodo de desove y la etapa larval, entonces 60% de los especímenes de M. cephalus recolectados en TaL en noviembre fueron eclosionados y criados en ambientes marinos y 60% de los recolectados en marzo fueron eclosionados y criados en agua salobre, mientras que los de CaE fueron eclosionados y criados igualmente en agua salobre y marina (fig. 6a, tabla 4). En cuanto a M. curema, 80% de los especímenes recolectados en TaL en noviembre y 70% en marzo, así como los de TeE, fueron eclosionados y criados en agua salobre, mientras que 60% de los de CaE fueron eclosionados y criados en agua de mar (fig. 6b, tabla 4).
DISCUSIÓN
La proporción de Sr:Ca en los otolitos incrementó con el aumento de la salinidad ambiental (Tzeng 1996) y con el decremento de la tasa de crecimiento de los peces (Sadovy y Severin 1994). Se encontró que la proporción de Sr:Ca aumentó drásticamente en correspondencia con la deposición de las zonas opacas (anillos de crecimiento) en los otolitos de tanto M. cephalus como M. curema. El anillo de crecimiento anual en los otolitos de M. cephalus se depositó durante el periodo de crecimiento lento en invierno, durante la migración de desove de aguas costeras o estuarinas de baja salinidad a aguas marinas de alta salindad. El periodo de bandas de crecimiento lento en los otolitos de M. curema fue más largo, de invierno a primavera (diciembre a mayo) (Ibáñez y Gallardo–Cabello 1996). Ambos mugílidos regresaron a TaL en la etapa VI (etapa de posdesove) y se observaron evidentemente exhaustos y delgados (Ibáñez y Gallardo–Cabello 2004). Esto validó que se depositó una marca anual en los otolitos durante el periodo de crecimiento somático reducido durante la migración de desove, cuando se utilizó la energía metabólica para la reproducción, y proporciona un método alternativo para la validación de la edad. La edad de primera madurez es tres años y un año para M. cephalus y M. curema, respectivamente. Por lo tanto, los valores máximos de la proporción de Sr:Ca que aparecen antes de la edad de primera madurez podrían indicar una migración al mar en invierno de los mugílidos.
El análisis de vida de la proporción de Sr:Cr en los otolitos indicó que tanto M. cephalus como M. curema permanecen la mayor parte de sus vidas en aguas salobres de salinidad variable y un periodo de tiempo más corto en aguas marinas durante su migración de la costa al mar para desovar. Los valores máximos de la proporción de Sr:Ca, indicativos de alta salinidad, proporcionan evidencia de una migración mar adentro; alternativamente, éstos podrían atribuirse a la entrada de agua marina de alta salinidad a las zonas de alimentación costeras o a la alta salinidad en el estuario como resultado de la disminución en la descarga de agua dulce durante la época de secas si los mugílidos no migran entre el estuario y el mar abierto. Sin embargo, ningún estudio ha mostrado que los mugílidos no migran al mar para desovar, aunque se han relacionado algunas variables climáticas con las migraciones de desove en el golfo de México (Ibáñez y Gutiérrez–Benítez 2004). La hueva de M. cephalus y M. curema es de importancia económica (Ibáñez y Gallardo–Cabello 2004) y constituye una pesquería importante en las lagunas y estuarios de la costa noroccidental del golfo de México (Diario Oficial de la Federación, 25 de agosto de 2006). Esto sugiere que los mugílidos permanecen en zonas lagunares o estuarinas donde su comportamiento eurihalino les permite buscar el mejor ambiente para sobrevivir, crecer y reproducir.
Nuestros resultados muestran que los mugílidos no actúan como peces catádromos, pasando la mayor parte de sus vidas en agua dulce antes de migrar al mar para desovar, como afirman De Silva (1980) y Torricelli et al. (1982). Son peces eurihalinos posiblemente porque su productividad es mayor en los estuarios que mar adentro y pueden tolerar una amplia gama de salinidades. Por lo tanto, el diferente comportamiento migratorio de los mugílidos podría ser básicamente un resultado de su intento de encontrar la mejor aptitud evolutiva para alimentarse (Gross 1987).
Por otro lado, la proporción de Sr:Ca en el núcleo de los otolitos varió ampliamente de 3.2 × 10–3 a 11.4 × 10–3, con una media de 6.7 × 10–3 ± 1.8 × 10–3 y una mediana a 6.6 × 10–3. Esto podría indicar que el desove se realizó en aguas salobres o marinas. Este comportamiento es similar al de M. cephalus de Taiwán (Hsu 2009; Wang et al. 2010, 2011), pero difiere a lo observado en varios estudios que indican que M. cephalus desova en aguas marinas de alta salinidad y que las crías se dispersan del mar al estuario (Tung 1981, Chang et al. 2000). La distribución larval de mugílidos tanto en el golfo de México (Ditty y Shaw 1996, Flores–Coto et al. 2009) como en las costas de Carolina del Norte y Florida (Powles 1981) es nerítica, lo que proporciona evidencia de que los mugílidos desovan en aguas de poca salinidad en zonas marinas, cerca de las bocas de ríos o en lagunas. Arnold y Thompson (1958) mencionan que M. cephalus desova en aguas marinas del golfo de México a profundidades entre 40 y 1650 m, más allá de la plataforma continental a unos 50–100 km de la costa. Además, la diferencia de la proporción de Sr:Ca en los otolitos entre hábitats podría reflejar la diferencia en salinidad cuando la salinidad es mayor en la laguna que en los estuarios, aun durante los cambios estacionales de salinidad entre las épocas de lluvias y secas. La amplia gama de salinidad, profundidad y distancia de la costa en que se encuentran los mugílidos podría explicar la variación de la proporción de Sr:Ca en los otolitos. Asimismo, es posible que los mugílidos desoven en ambientes marinos y que los huveos fertilizados sean transportados por corrientes/vientos a aguas costeras de menor salinidad. De esta forma, las larvas podrían iniciar su desarrollo en un lugar diferente a donde se realizó el desove y sus otolitos reflejarían el régimen de salinidad costero más que el marino.
Mugil cephalus y M. curema son especies congéneres y simpátricas ya que ocupan la misma zona geográfica, lo que permite recolectar ejemplares del mismo sitio de muestreo, como en este estudio; sin embargo, la diferencia en la proporción de Sr:Ca en los otolitos y el desfase de tres meses en el periodo de desove de estas especies en la parte noroccidental del golfo de México (Ibáñez 1993) indica que el uso del hábitat a escalas espaciales y temporales puede diferir entre estas dos especies congéneres. Diferencias en el uso del hábitat en el tiempo y espacio puede reducir la competencia interespecífica por la comida y el espacio. El desfasamiento en el tiempo de desove distingue la química de los otolitos debido a la exposición a múltiples y diversas variables ambientales (Elsdon y Gillanders 2004). En otras palabras, estos dos mugílidos aparentemente habitan los mismos estuarios y lagunas costeras pero están algo separadas por la diferencia en el uso del hábitat en el tiempo y espacio y por el aislamiento reproductivo. Las diferencias en la proporción de Sr:Ca se pueden explicar de forma similar y por esta razón se ha utilizado la química de los otolitos para la evaluación de poblaciones ícticas y la discriminación de localidades (Patterson et al. 1999, Berg et al. 2005, Husebe et al. 2005, Clarke et al. 2009). Wang et al. (2010) encontraron dos ecotipos de juveniles de M. cephalus habitando diversos ambientes del río Tanshui en el norte de Taiwán. Se observó un fenómeno similar para M. cephalus en TaL, donde los ejemplares capturados en noviembre eclosionaron en agua marina mientras que los capturados en marzo eclosionaron en agua salobre. Esto indica que diferentes especies de mugílidos y sus contingentes migratorios pueden habitar el mismo hábitat pero que tienen diferentes hábitats migratorios durante el desove. No obstante, se requiere mayor investigación para entender si existen diferentes poblaciones de cada especie de mugílido en aguas mexicanas y la conectividad entre las poblaciones.
CONCLUSIONES
La microquímica de los otolitos mostró que tanto M. cephalus como M. curema permanecen la mayor parte de sus vidas en aguas salobres de salinidad variable y que pasan un periodo corto en aguas marinas. La proporción de Sr:Ca en el núcleo del otolito indicó que ambas especies de mugílidos pueden desovar en aguas salobres y marinas. Los valores máximos de la proporción de Sr:Ca coincidieron con la depositación del anillo de crecimiento anual, lo que valida la determinación de la edad. La variabilidad de los patrones migratorios entre especies indicó que su comportamiento migratorio parece ser más facultativo que simplemente catádromo.
AGRADECIMIENTOS
Este trabajo fue parcialmente apoyado por el Consejo Nacional de Ciencias de Taiwán (NSC95–2915–I–002–108 a WNT, NSC97–2116–M–001–008 a YI, y NSC98–2621–B–006–001 a CHW y CWC) y por la Universidad Autónoma Metropolitana (México). Los autores agradecen a NT Yeh su asistencia en el laboratorio y a B Jessop sus comentarios valiosos que ayudaron a mejorar el manuscrito.
REFERENCIAS
Alaves Y. 1978. Contribución al conocimiento de la biología de Palaemonetes intermedius Holthuis (Crustacea: Decapoda) en la laguna de Tamiahua, Veracruz. BSc dissertation, Universidad Veracruzana, Xalapa, México. [ Links ]
Alvarez–Lajonchere LS. 1976. Contribución al ciclo de vida de Mugil curema Valenciennes in Cuvier et Valenciennes, 1836 (Pisces, Mugilidae). Rev. Invest. Mar. 28: 1–130. [ Links ]
Anderson WW. 1958. Larval development, growth and spawning of striped mullet (Mugil cephalus) along the South Atlantic coast of the United States. Fish. Bull. 58: 500–519. [ Links ]
Arnold EL Jr., Thompson JR. 1958. Offshore spawning of the striped mullet, Mugil cephalus, in the Gulf of Mexico. Copeia 158: 130–132. [ Links ]
Berg E, Sarvas TH, Harbitz A, Fevolden SE, Salberg AB. 2005. Accuracy and precision in stock separation of northeast Arctic and Norwegian coastal cod by otoliths – comparing readings, image analyses and a genetic method. Mar. Freshwat. Res. 56: 753–762, doi:10.1071/MF04172. [ Links ]
Bonner T. 2007. Identification and information for Texas fish. Available at: http://www.bio.txstate.edu/~tbonner/txfishes/mugil%20curema.htm (accessed 3 November 2010). [ Links ]
Camacho–Barrera M, Cisneros JL, Cosío P. 1983. Estudio de la comunidad zooplanctónica de la laguna de Tamiahua, Veracruz. BSc dissertation, Universidad Nacional Autónoma de México. [ Links ]
Campana SE. 1999. Chemistry and composition of fish otoliths: Pathways, mechanisms and applications. Mar. Ecol. Prog. Ser. 188: 263–297. [ Links ]
Chang CW, Tzeng WN, Lee YC. 2000. Recruitment and hatching dates of grey mullet (Mugil cephalus L.) juveniles in the Tanshui estuary of northwest Taiwan. Zool. Stud. 39: 99–106. [ Links ]
Chang CW, Iizuka Y, Tzeng WN. 2004a. Migratory environmental history of the grey mullet Mugil cephalus as revealed by otolith Sr:Ca ratios. Mar. Ecol. Prog. Ser. 269: 277–288. [ Links ]
Chang CW, Lin SH, Iizuka Y, Tzeng WN. 2004b. Relationship between Sr:Ca ratios in otoliths of grey mullet Mugil cephalus and ambient salinity: Validation, mechanisms, and applications. Zool. Stud. 43: 74–85. [ Links ]
Clarke LM, Walther BD, Munch SB, Thorrold SR, Conover DO. 2009. Chemical signatures in the otoliths of a coastal marine fish, Menidia menidia, from the northeastern United States: Spatial and temporal difference. Mar. Ecol. Prog. Ser. 384: 261–271. [ Links ]
Daverat F, Limburg KE, Thibault I, Shiao JC, Dodson JJ, Caron F, Tzeng WN, Iizuka Y, Wickstrõm H. 2006. Phenotypic plasticity of habitat use by three temperate eel species Anguilla anguilla, A. japonica and A. rostrata. Mar. Ecol. Prog. Ser. 308: 231–241. [ Links ]
Degens ET, Deuser WG, Haedrich RL. 1969. Molecular structure and composition of fish otoliths. Mar. Biol. 2: 105–113. [ Links ]
Delon CA. 1984. Variación estacional del plancton en los esteros Boca de Lima y Lagartos, Municipio de Tecolutla, Veracruz. BSc dissertation, Universidad Veracruzana, Xalapa, México. [ Links ]
De Silva SS. 1980. Biology of juvenile grey mullet: A short review. Aquaculture 19: 21–36. [ Links ]
De Silva SS, Silva EIL. 1979. Biology of young grey mullet, Mugil cephalus L., populations in a coastal lagoon in Sri Lanka. J. Fish Biol. 15: 9–20. [ Links ]
Díaz–Pardo E, Hernández–Vázquez S. 1980. Crecimiento, reproducción y hábitos alimenticios de la lisa Mugil cephalus en la Laguna de San Andrés, Tamps. An. Esc. Nac. Cienc. Biol. 23: 109–127. [ Links ]
Ditty JG, Shaw RF. 1996. Spatial and temporal distribution of larval striped mullet (Mugil cephalus) and white mullet (M. curema, family Mugilidae) in the northern Gulf of Mexico, with notes on mountain mullet, Agonostomus monticola. Bull. Mar. Sci. 59: 271–288. [ Links ]
Elsdon TS, Gillanders BM. 2004. Fish otolith chemistry influenced by exposure to multiple environmental variables. J. Exp. Mar. Biol. Ecol. 313: 269–284. [ Links ]
Elsdon TS, Gillanders BM. 2006. Identifying migratory contingents of fish by combining otolith Sr:Ca with temporal collections of ambient Sr:Ca concentrations. J. Fish Biol. 69: 643–657. [ Links ]
FAO. 2009. Cultured Aquatic Species Information Programme. Mugil cephalus. Cultured Aquatic Species Fact Sheets. Text by Saleh MA. In: FAO Fisheries and Aquaculture Department (online). Rome. Updated 7 April 2006 (accessed 8 December 2009), http://www.fao.org/fishery/culturedspecies/Mugil_cephalus/es. [ Links ]
Finucane JH, Collins LA, Barger LE. 1978. Spawning of the striped mullet, Mugil cephalus, in the northwestern Gulf of Mexico. Northeast Gulf Sci. 2: 148–150. [ Links ]
Flores–Coto C, Espinosa–Fuentes ML, Zavala–García F, Sanvicente–Añorve L. 2009. Ichthyoplankton of the southern Gulf of Mexico. A compendium. Hidrobiologica 19: 49–76. [ Links ]
Gross M. 1987. The evolution of diadromy in fishes. Am. Fish. Soc. Symp. 1:14–25. [ Links ]
Hsu CC. 2009. Use of natural markers to study population structure and migratory environmental history of Mugil cephalus L. in the coastal waters of Taiwan. PhD thesis, National Taiwan University. [ Links ]
Hsu CC, Tzeng WN. 2009. Validation of annular deposition in scales and otoliths of flathead mullet Mugil cephalus. Zool. Stud. 48: 640–648. [ Links ]
Husebø Å, Slotte A, Clausen LAW, Mosegaard H. 2005. Mixing of populations or year class twinning in Norwegian spring spawning herring? Mar. Freshwat. Res. 56: 763–772, doi:10.1071/MF04170. [ Links ]
Ibáñez AL. 1993. Coexistence of Mugil cephalus and M. curema in a coastal lagoon in the Gulf of Mexico. J. Fish Biol. 42: 959–961. [ Links ]
Ibáñez AL, Gallardo–Cabello M. 1996. Age determination of the grey mullet Mugil cephalus L. and the white mullet M. curema V. (Pisces: Mugilidae) in Tamiahua Lagoon, Veracruz. Cienc. Mar. 22: 329–345. [ Links ]
Ibáñez AL, Gallardo–Cabello M. 2004. Reproduction of Mugil cephalus and M. curema (Pises: Mugilidae) from a coastal lagoon to the northwest of the Gulf of Mexico. Bull. Mar. Sci. 75: 37–49. [ Links ]
Ibáñez AL, Gutiérrez–Benítez O. 2004. Climate variables and spawning migrations of the striped mullet and white mullet in the northwestern area of the Gulf of Mexico. J. Fish Biol. 65: 822–831. [ Links ]
Jessop BM, Shiao JC, Iizuka Y, Tzeng WN. 2002. Migratory behaviour and habitat use by American eels Anguilla rostrata as revealed by otolith microchemistry. Mar. Ecol. Prog. Ser. 233: 217–229. [ Links ]
Moore RH. 1974. General ecology, distribution and relative abundance of Mugil cephalus and Mugil curema on the south Texas coast. Contrib. Mar. Sci. 18: 241–245. [ Links ]
Nirchio M, Cipriano R, Cestari M, Fenocchio A. 2005. Cytogenetical amd morphological features reveal significant differences among Venazuelan and Brazilian samples of Mugil curema. Neotrop. Ichthyol. 3: 107–110. [ Links ]
Pannella G. 1971. Fish otolith: Daily growth layers and periodical patterns. Science 173: 1124–1127. [ Links ]
Patterson HM, Thorrold SR, Shenker JM. 1999. Analysis of otolith chemistry in Nassau grouper (Epinephelus striatus) from the Bahamas and Belize using solution–based ICP–MS. Coral Reefs 18: 171–178. [ Links ]
Powles H. 1981. Distribution and movements of neustonic young of estuarine dependent (Mugil spp., Pomatomus saltatrix) and estuarine independent (Coryphaena spp.) fishes off the southeastern United States. Rapp. P–V Reun. Cons. Int Explor. Mer 178: 207–209. [ Links ]
Render JH, Thompson BA, Allen RL. 1995. Reproductive development of striped mullet in Louisiana estuarine waters with notes on the applicability of reproductive assessment methods for isochronal species. Trans. Am. Fish. Soc. 124: 26–36. [ Links ]
Sadovy Y, Severin KP. 1994. Elemental patterns in red hind (Epinephelus guttatus) otoliths from Bermuda and Puerto Rico reflect growth rate, not temperature. Can. J. Fish. Aquat. Sci. 51: 133–141. [ Links ]
SAGARPA. 2009. Anuario Estadístico Pesquero. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación, México. Available at http://www.conapesca.sagarpa.gob.mx/wb/cona/cona_produccion_pesquera_y_acuicola_2005. [ Links ]
Secor DH. 1992. Application of otolith microchemistry analysis to investigate anadromy in Chesapeake Bay striped bass Morone saxatilis. Fish. Bull. 90: 798–80. [ Links ]
Secor DH, Piccoli PM. 1996. Age– and sex–dependent migrations of striped bass in the Hudson River as determined by chemical microanalysis of otoliths. Estuaries 19: 778–793. [ Links ]
Secor DH, Henderson–Arzapalo A, Piccoli PM. 1995. Can otolith microchemistry chart patterns of migration and habitat utilization in anadromous fishes? J. Exp. Mar. Biol. Ecol. 192: 15–33. [ Links ]
Secor DH, Ota T, Tanaka M. 1998. Use of otolith microanalysis to determine estuarine migrations of Ariake Sea Japanese sea bass Lateolabrax japonicus. Fish. Sci. 64: 740–743. [ Links ]
Torricelli P, Tongiorgi P, Almansi P. 1982. Migration of grey mullet fry into the Arno River: Seasonal appearance, daily activity and feeding rhythms. Fish. Res. 1: 219–234. [ Links ]
Tukey JW. 1977. Exploratory Data Analysis. Addison–Wesley, Reading, MA, 688 pp. [ Links ]
Tung IH. 1981. On the fishery biology of gray mullet, Mugil cephalus L., in Taiwan. Report of the Institute of Fishery Biology of the Ministry of Economic Affairs and National Taiwan University 3: 38–102. [ Links ]
Tzeng WN. 1996. Effects of salinity and ontogenetic movements on strontium:calcium ratios in the otoliths of the Japanese eel, Anguilla japonica Temminck and Schlegel. J. Exp. Mar. Biol. Ecol. 199: 111–122. [ Links ]
Tzeng WN, Severin KP, Wickstrõm H. 1997. Use of otolith micro–chemistry to investigate the environmental history of European eel Anguilla anguilla. Mar. Ecol. Prog. Ser. 149: 73–81. [ Links ]
Tzeng WN, Shiao JC, Iizuka Y. 2002. Use of otolith Sr:Ca ratios to study the riverine migratory behaviours of Japanese eel Anguilla japonica. Mar. Ecol. Prog. Ser. 245: 213–221. [ Links ]
Tzeng WN, Iizuka Y, Shiao JC, Yamada Y, Oka HP. 2003. Identification and growth rates comparison of divergent migratory contingents of Japanese eel (Anguilla japonica). Aquaculture 216: 77–86. [ Links ]
Wang CH, Hsu CC, Chang CW, You CF, Tzeng WN. 2010. The migratory environmental history of freshwater resident flathead mullet Mugil cephalus L. in the Tanshui River, northern Taiwan. Zool. Stud. 49: 504–514. [ Links ]
Wang CH, Hsu CC, Tzeng WN, You CF, Chang CW. 2011. Origin of the mass mortal flathead grey mullet (Mugil cephalus) in Tanshui River, northern Taiwan, as indicated by otolith elemental signature. Mar. Pollut. Bull. 62: 1809–1813. [ Links ]
Zimmerman CE. 2005. Relationship of otolith strontium–to–calcium ratios to salinity: Experimental variation for juvenile salmonids. Can. J. Fish. Aquat. Sci. 62: 88–97. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.
Traducido al español por Christine Harris.














