Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.38 n.1a Ensenada Mar. 2012
Abundancia y distribución del calamar dedal, Lolliguncula panamensis (Teuthida: Loliginidae), en el golfo de California*
Abundance and distribution of the Panama brief squid, Lolliguncula panamensis (Teuthida: Loliginidae), in the Gulf of California
DI Arizmendi–Rodríguez1*, CA Salinas–Zavala2, C Quiñónez–Velázquez1, A Mejía–Rebollo2
1 Centro Interdisciplinario de Ciencias Marinas–Instituto Politécnico Nacional, Av. Instituto Politécnico Nacional s/n, Col. Playa Palo de Santa Rita, La Paz 23096, Baja California Sur, México.* Corresponding author. E–mail: adanaisela@gmail.com
2 Centro de Investigaciones Biológicas del Noroeste, S.C., Mar Bermejo 195, Col. Playa Palo de Santa Rita, La Paz 23090, Baja California Sur, México.
Received October 2010
Received in revisedform June 2011
Accepted September 2011
RESUMEN
Se analizó la abundancia y la distribución del calamar dedal (Lolliguncula panamensis) capturado en 15 cruceros de pesca exploratoria en el golfo de California, durante 2003–2006 y 2008. Se registraron 66 lances positivos de calamar, en los que se capturó un total de 2460 individuos. Con base en el patrón estacional de la temperatura superficial del mar, los individuos capturados se agruparon en dos periodos: frío (<22 °C: diciembre, enero, febrero, marzo y abril de 2003–2006 y 2008) y cálido (> 22 °C: mayo, junio, julio, agosto, septiembre, octubre y noviembre de 2003–2006 y 2008). En el periodo frío se recolectaron 1579 organismos, mientras que en el cálido, 881 individuos. Al analizar la abundancia por sexos, en ambos periodos las hembras fueron más abundantes (62% frío, 57% cálido) en comparación con los machos (17% frío, 12% cálido). En ambos periodos, tanto las hembras (99.6% frío, 91.0% cálido) como los machos (99.3% frío, 95.3% cálido) presentaron actividad reproductiva (etapa en desarrollo y madura), y fueron capturados entre 7 y 40 m de profundidad. Las mayores abundancias se registraron en lances realizados durante el día, a una profundidad promedio de 40 m en el periodo frío y de 24 m en el cálido.
Palabras clave: distribución, abundancia, calamar dedal, Lolliguncula panamensis, golfo de California.
ABSTRACT
This study examines the abundance and distribution of Panama brief squid (Lolliguncula panamensis) caught during 15 fishery surveys in the Gulf of California in 2003–2006 and 2008. A total of 2460 individuals were captured in 66 positive squid trawls. Based on the seasonal sea surface temperature pattern, captured individuals were grouped into two periods: cold (<22 °C: December, January, February, March, and April 2003–2006 and 2008) and warm (≥ 22 °C: May, June, July, August, September, October, and November 2003–2006 and 2008). During the cold period, 1579 organisms were sampled, and during the warm period, 881. Abundance by sex showed that females were more abundant during both periods (62% cold, 57% warm) than males (17% cold, 12% warm). During both periods, females (99.6% cold, 91.0% warm) as well as males (99.3% cold, 95.3% warm) presented reproductive activity (maturing and mature stages), and they were captured at depths between 7 and 40 m. The highest abundances occurred in diurnal trawls at an average depth of 40 m during the cold period and 24 m during the warm period.
Key words: distribution, abundance, Panama brief squid, Lolliguncula panamensis, Gulf of California.
INTRODUCCIÓN
El calamar dedal (Lolliguncula panamensis Berry 1911) se distribuye en el Pacífico oriental, desde el golfo de California hasta Perú. Se encuentra entre 1 y 70 m de profundidad, aunque es más abundante entre los 5 y 30 m de profundidad, a temperaturas entre 21 y 27 °C y salinidades entre 15 y 23 (Fisher et al. 1995).
En el Pacífico mexicano, L. panamensis se captura de manera incidental en la pesca de camarón (Alejo–Plata et al. 2001). Sánchez (2003) menciona que en las costas mexicanas el calamar dedal se localiza a profundidades entre 16 y 65 m. Para las costas de Colombia, Squires y Barragán (1979) observaron que los machos y las hembras de L. panamensis alcanzan hasta 74 y 110 mm de longitud dorsal del manto, respectivamente, y que el dimorfismo sexual se presenta antes de alcanzar la madurez sexual. Barragán (1977a, 1977b) registró que las hembras son más grandes que los machos y que esta especie se alimenta principalmente de peces y crustáceos.
Los loliginidos son organismos sujetos a explotación pesquera de manera directa o incidental (Staudinger 2006). Sus capturas alcanzaron 275,024 t en 2002, que representan el 9% de la captura mundial de calamar (Rodhouse 2005). Estos organismos también son un elemento importante en las tramas tróficas (Rosas–Luis et al. 2008). Sin embargo, el conocimiento sobre su biología es escaso, y es necesario establecer líneas de investigación que aborden de manera detallada los aspectos biológicos básicos de las especies consideradas recursos potenciales, como lo establecido para el calamar dedal por Hernández–Vázquez (1987). El presente trabajo tiene como objetivo analizar la abundancia y distribución de L. panamensis en el golfo de California (México).
MATERIALES Y MÉTODOS
El material biológico se recolectó en 15 cruceros de pesca exploratoria en el golfo de California, durante 2003–2006 y 2008, que fueron parte del programa "Evaluación de las poblaciones de camarón en aguas marinas del Pacifico mexicano durante el periodo de veda y el efecto de la captura incidental de la fauna acompañante de camarón en el ecosistema". Los cruceros se desarrollaron a bordo de los barcos de exploración pesquera BIP–XI y BIP–XII, equipados con red de arrastre (90 pies en relinga superior con luz de malla de 2 a 2 ¼" en el cuerpo y de 1 ½ a 1 ¾" en el copo, tablas de madera de 10' × 60"). El plan de muestreo incluyó 96 estaciones a lo largo de la costa, desde los 25° N hasta los 31° N de latitud (fig. 1), a profundidades entre 7.3 y 165 m. Los arrastres tuvieron una duración de una hora a una velocidad aproximada de 2.5 nudos.
La captura de cada arrastre se colocó sobre la cubierta del barco y se recolectó una muestra al azar de 40–45 kg. Los individuos de esta muestra se separaron en grupos taxonómicos (cefalópodos, crustáceos y peces), que se colocaron por separado en bolsas de plástico debidamente etiquetadas y se mantuvieron congelados hasta su procesamiento.
En el laboratorio, los cefalópodos se identificaron hasta nivel de especie empleando los caracteres diagnósticos descritos por Fisher et al. (1995). A todos los ejemplares de L. panamensis se les midió la longitud dorsal del manto (LDM, ± 0.1 cm) con un vernier y el peso total (PT, ± 0.1 g) con una báscula Ohaus. Cada organismo fue eviscerado por la parte ventral para identificar macroscópicamente el sexo y evaluar su condición reproductiva de acuerdo con los cuatro estadios de maduración (inmaduro, en desarrollo, maduro y desovado) incuidos en la escala morfocrómatica propuesta por Barragán (1977b).
Con el propósito de agrupar la información biológica en un ciclo anual, se estimó el promedio mensual de la temperatura superficial del mar (TSM) en cada estación positiva durante 2003–2008. La TSM se estimó a partir de imágenes satelitales del sensor Advanced Very High Resolution Radiometer (AVHRR) Pathfinder 5, con una resolución espacial de 4 × 4 km (http://poet.jpl.nasa.gov). De acuerdo con los valores de TSM se definió un periodo frío (diciembre, enero, febrero, marzo y abril) y un periodo cálido (mayo, junio, julio, agosto, septiembre, octubre y noviembre). Los resultados se presentan con respecto a estos periodos. Los datos de TSM pueden corresponder a los valores de temperatura del fondo en aguas someras, a causa de los efectos de mezcla ocasionada por vientos y mareas (Villaseñor–Casales 1979, Lluch–Cota y Arias–Aréchiga 2000).
La estructura de tallas y pesos de L. panamensis se analizó por sexo, agrupando la LDM en intervalos de 10 mm y el PT en intervalos de 5 g. Se evaluó la normalidad de las distribuciones de ambas variables con una prueba Shapiro–Wilk, y las diferencias en talla y peso se evaluaron con la prueba Kolmogorov–Smirnov. Para describir la condición reproductiva de los ejemplares, se analizaron los datos de madurez gonádica por sexo.
Con las hembras y los machos en estadio en desarrollo y maduro, se calculó la frecuencia relativa acumulada por intervalo de longitud y se estimó la talla promedio de primera madurez (LDM50), definida como la LDM a la cual el 50% de la población reproductora presenta actividad reproductiva.
Los datos de abundancia (organismo por hora de lance), distribución, madurez gonadal, profundidad (1–20, 21–40, 41–60, 61–80, 141–160, 161–180 m) y hora de los arrastres diurnos (08:00 a 19:59) y nocturnos (20:00 a 07:59) se agruparon en función de la TSM para su análisis. Para evaluar las diferencias en la distribución y abundancia por sexo y periodo, y a cada intervalo de profundidad, se aplicó una prueba de χ2 (Sokal y Rohlf 1981).
RESULTADOS
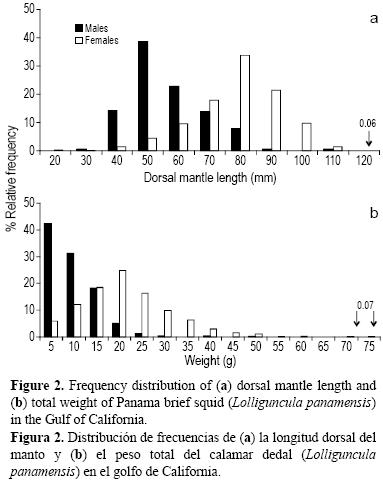
Se obtuvieron 66 lances positivos de calamar (14% del total de lances durante el periodo de estudio) y se capturaron 2460 individuos, de los cuales 1490 (61%) fueron hembras, 376 (15%) machos y 594 (24%) indeterminados (aparato reproductor en mal estado). La talla de las hembras varió de 30 a 115 mm LDM, con una moda de 80 mm LDM, y la de los machos varió de 27 a 110 mm LDM, con una moda de 50 mm LDM (fig. 2a). El peso varió entre 1.46 y 72.4 g PT (moda = 20 g PT) para las hembras y entre 1.33 y 49.1 g PT (moda = 5 g PT) para los machos (fig. 2b). Las diferencias en LDM y PT entre machos y hembras fueron significativas (K–S, P < 0.05). Se registraron organismos de ambos sexos en todo el intervalo de tallas; sin embargo, las hembras dominaron en tallas >70 mm LDM y los machos en tallas <70 mm LDM. En lo que corresponde a peso, las hembras presentaron una distribución normal en su estructura, a diferencia de los machos, cuyos valores tendieron a agruparse en los pesos <15 g PT.
Durante el periodo de estudio, 2003–2008, la TSM presentó un patrón anual similar (ANOVA, P > 0.05), con un promedio de 22 °C. Los valores de TSM >22 °C se presentaron de mayo a noviembre y los valores <22 °C se presentaron el resto del año, de diciembre a abril (fig. 3).

En la tabla 1, se presentan de manera resumida los datos de LDM y PT de los organismos recolectados. Durante el periodo frío (<22 °C) se capturaron 1579 calamares, de los cuales a 323 (21%) no se les asignó sexo (indeterminados). Durante el periodo cálido (>22 °C) se capturaron 881 calamares y 271 (31%) fueron indeterminados. Al evaluar las diferencias en talla y peso entre periodos para ambos sexos, éstas fueron significativas (K–S, P < 0.05). Las hembras fueron más grandes y pesadas en los meses cálidos que en los meses fríos, y los machos fueron más grandes en el periodo frío y más pesados en el periodo cálido.
El intervalo de tallas de organismos maduros por sexo fue similar en ambos periodos (K–S, P > 0.05): para las hembras, la talla varió de 32 a 105 mm LDM en el periodo frío y de 30 a 115 mm LDM en el periodo cálido; mientras que para los machos, la talla varió de 33 a 110 mm LDM en el periodo frío y de 30 a 105 mm LDM en el periodo cálido. En ambos periodos, la LDM50 fue de 80 mm LDM para las hembras y 50 mm LDM para los machos.
Distribución por sexo
Durante el periodo frío, se registraron 30 lances positivos de calamar (6% del total); las hembras estuvieron presentes en 28 estaciones y los machos en 24 estaciones. En los meses cálidos se registraron 33 lances positivos (7% del total); las hembras estuvieron presentes en 31 lances y los machos sólo en 18 lances. Las hembras se presentaron en más del 90% de los lances positivos, mientras que los machos en el 67% de los lances. El número de lances en los que se localizaron hembras y machos en ambos periodos no fue estadísticamente significativo de acuerdo con el valor de χ2 cuadrada (frío, χ2 = 0.07, P > 0.05; cálido χ2 = 0.06, P > 0.05).
Durante el periodo frío, la mayor abundancia de hembras se registró en la parte alta del golfo, frente a San Luis Gonzaga (Baja California [BC]), mientras que las menores abundancias se registraron al sur de la zona de muestreo, frente a Santa María (Sinaloa) (fig. 4a). Un patrón relativamente distinto se observó en el periodo cálido, cuando la mayor abundancia de hembras se presentó en la parte central del golfo, frente a Bahía Kino (Sonora), y la menor abundancia se presentó en el norte del golfo, frente a Puertecitos (BC), y en el sur del golfo, frente a Bacochibampo (Sonora) y Topolobampo (Sinaloa) (fig. 4b).
Respecto a la distribución de la abundancia de los machos de calamar dedal durante el periodo frío, las mayores concentraciones se localizaron en la parte central del golfo, frente a Bahía Kino, y la menor abundancia al norte y sur de la zona de estudio (Puertecitos, Yavaros [Sonora] y Agiabampo [Sonora]) (fig. 4c). Durante los meses cálidos, la mayor abundancia se presentó en la parte sur del golfo, frente a Santa María, y la menor abundancia en el norte del golfo (Puertecitos, La Soledad [Sonora], Bahía Kino y Yavaros) (fig. 4d). Considerando ambos sexos, la mayor abundancia fue en el periodo frío, y el número de organismos por lance disminuyó en 50% durante los meses cálidos.
Condición reproductiva
Del total de hembras de calamar dedal capturadas durante el periodo frío, >85% fueron maduras y <1% inmaduras (tabla 2). La mayor abundancia de hembras en estadio maduro se localizó frente a San Luis Gonzaga, en estadio en desarrollo frente a El Cardonal (Sonora) y en estadio inmaduro frente a Puertecitos (fig. 5a). En el periodo cálido, el 60% de hembras fueron maduras, 30% estuvieron en desarrollo y 10% fueron inmaduras. La mayor abundancia de hembras en estadio maduro se presentó en Bahía Kino (fig. 5b), en estadio en desarrollo frente a Las Guasimas (Sonora) y en estadio inmaduro en Bahía Kino.
Respecto a los machos de calamar dedal, durante el periodo frío >70% estuvieron en estadio maduro (tabla 2) y la zona de mayor abundancia se localizó frente a Bahía Kino (fig. 6a). La mayor abundancia de machos en estadio en desarrollo se presentó frente a San Luis Gonzaga, y los organismos en estadio inmaduro se recolectaron frente a San Felipe (BC) y Yavaros. Durante los meses cálidos, la mayor abundancia de machos en estadio maduro se concentró frente a Las Guásimas y Agiabampo, en estadio en desarrollo frente a Puertecitos y en estadio inmaduro frente a Las Guásimas (fig. 6b).
Distribución y abundancia por profundidad
Al analizar los datos de abundancia y distribución de L. panamensis respecto a la profundidad, se observó un patrón similar en ambos periodos tanto en hembras como en machos (tabla 3). La mayor abundancia se registró entre 7 y 40 m de profundidad y la menor abundancia entre 60 y 180 m de profundidad.
Distribución y abundancia diurna y nocturna
Durante el periodo frío, en los lances positivos diurnos se capturaron 731 hembras y 220 machos entre 23.8 y 146.4 m de profundidad (tabla 4). En cambio, en los lances positivos diurnos del periodo cálido se capturaron 339 hembras y 60 machos entre 7.3 y 44.8 m. En los lances positivos nocturnos, durante el periodo frío se capturaron 260 hembras y 50 machos entre 13.0 y 45.8 m de profundidad; durante el periodo cálido se capturaron 165 hembras y 46 machos a profundidades entre 9.2 y 164.7 m. Para cada periodo, se comparó la abundancia entre el día y la noche por sexo y se encontraron diferencias significativas en el número de hembras (frío, día y noche, χ2 = 7.18, P < 0.05; cálido, día y noche, χ2 = 5.29, P < 0.05); sin embargo, en los machos no se encontraron diferencias significativas (frío, día y noche, χ2 = 0.80, P > 0.05; cálido, día y noche, χ2 = 0.78, P > 0.05). Las mayores abundancias se registraron durante el día.
DISCUSIÓN
El golfo de California se distingue por su alta productividad (Santamaría–del Ángel y Álvarez–Borrego 1994), por su riqueza y abundancia en recursos naturales, por sus características ecológicas y por los volúmenes de captura de sus pesquerías (Lluch–Cota et al. 2007). Actualmente, el golfo es una de las zonas sujetas a un gran esfuerzo pesquero mediante la pesca de camaron con redes de arrastre. Junto con esta especie objetivo, se capturan de manera incidental otros crustáceos, peces y moluscos como fauna de acompañamiento. El calamar dedal es una especie recurrente en la fauna de acompañamiento (Hernández–Vázquez 1987).
La presencia de L. panamensis en el golfo de California confirma lo registrado por Fisher et al. (1995) respecto a su área de distribución; sin embargo, el intervalo de temperatura (21–27 °C) que ellos registran para esta especie difiere de lo encontrado en el presente estudio (17–32 °C). La relación entre la TSM y la abundancia de L. panamensis coincide con lo documentado para otros loliginidos (Pierce et al. 1994). Durante el periodo de estudio (2003–2006 y 2008), el intervalo de temperatura fue amplio (17–32 °C); sin embargo, la mayor abundancia se registró durante los meses con menor TSM (diciembre, enero, febrero, marzo, abril), cuando osciló entre 17 y 22 °C. Las mayores abundancias en este periodo se localizaron en la zona más productiva del golfo (parte alta del golfo), donde el enriquecimiento es originado por los procesos de mezcla por marea (Lluch–Cota y Arias–Aréchiga 2000). La presencia del calamar dedal en esta zona posiblemente está asociada a una mayor fuente de alimento, razón por la cual sus mayores abundancias se hayan localizado en esta zona en los meses fríos.
Considerando que el calamar dedal habita zonas ricas en alimento, la presencia tanto de machos como de hembras en las mismas estaciones indica que cohabitan en espacio para alimentarse. Esta misma tendencia la documentó Arkhipkin et al. (2004), quienes mencionan que, en la Patagonia, Loligo gahi forma agregaciones al momento de alimentarse. De igual forma, Rodrigues y Gasalla (2008) afirman que, en el sureste de Brasil, Loligo plei es una especie que se agrupa para alimentarse, de manera similar que L. gahi en las islas Malvinas (Agnew et al. 1998).
La disponibilidad de alimento es un elemento que explica la presencia de L. panamensis de ambos sexos en los mismos sitios. También, la presencia de organismos maduros en el golfo de California, a lo largo del año (periodos frío y cálido), sugiere que la especie está en condiciones de reproducirse. Lo anterior ha sido documentado para las especies de la familia Loliginidae, y se han registrado dos grupos desovantes: uno en invierno–primavera y otro en verano–otoño (Costa y Fernandes 1993). Los resultados en el presente trabajo respecto a la mayor abundancia de L. panamensis en el periodo frío, en comparación con el cálido, sugieren que el grupo desovante más exitoso es el de verano–otoño, razón por la cual se da el mayor reclutamiento de individuos a la población adulta en la temporada fría.
Distribución y abundancia por sexo
Al analizar la abundancia por sexo, de manera general, las hembras fueron más abundantes que los machos a tallas >70 mm LDM, mientras que los machos dominaron a tallas menores. Esto podría ser considerado como parte de la estrategia reproductiva de L. panamensis, debido a que en calamares las hembras definen el éxito reproductivo al almacenar los espermatóforos desde el estadio inmaduro (Hanlon y Messenger 1996, Pineda et al. 1998, Boyle y Rodhouse 2005). Los resultados sugieren que los machos alcanzan la madurez sexual a tallas menores que las hembras y permanecerán durante más tiempo en estadio maduro, copulando con más de una hembra (Boyle y Rodhouse 2005). La mayor abundancia de hembras a tallas mayores podría ser consecuencia de una distribución diferencial por sexos después de la copula y de un desgaste fisiológico que les ocasionaría directamente la muerte, e indirectamente al ser presas fáciles de sus depredadores. Pineda et al. (1998) documentaron algo similar a lo encontrado en el presente estudio; ellos mencionan que los machos de Loligo sanpaulensis aumentan de talla a medida que avanzan en la maduración gonadal, mientras que en las hembras, el proceso de maduración es lento al principio y aproximadamente a los 60 mm LDM el proceso de maduración se dispara.
Barragán (1977b) registró que, para las costas colombianas, las hembras de L. panamensis maduran entre 76 y 79 mm LDM y los machos a 40 mm LDM; estas tallas son similares a las registradas en el presente estudio. Es común en loliginidos que las hembras maduren a menores tallas que los machos (Pineda et al. 1998, Perez et al. 2002, Jackson 2004).
Al comparar la estructura de tallas y pesos por sexo y periodo, se encontró que las hembras presentaron mayor peso por talla que los machos y que los individuos de ambos sexos con mayor peso estaban maduros. En esta etapa los organismos son más pesados debido a la presencia de ovocitos, en el caso de las hembras, y de paquetes de espermatóforos, en el caso de los machos. Pineda et al. (1998) mencionan que los calamares incrementan su peso durante la maduración de los órganos reproductores; en las hembras de Loligo gahi esto se hace evidente una vez que alcanzan los 40 g y en los machos este aumento es gradual con el crecimiento.
Condición reproductiva
Al clasificar a L. panamensis por estadio de madurez gonadal (Barragán 1977b), el estadio maduro siempre fue más frecuente (63% periodo frío y 79% periodo cálido), y esto sugiere que esta especie se encuentra apta para llevar a cabo su evento reproductivo a lo largo del año en el golfo de California. Durante los meses fríos la mayor abundancia de hembras maduras se localizó en la parte alta del golfo (San Luis Gonzaga), mientras que durante el periodo cálido la mayor abundancia de hembras se localizó en la parte central (Bahía Kino). Esto sugiere un desplazamiento de los centros de abundancia del calamar dedal en estadio maduro en relación a la disponibilidad de alimento (Arizmendi–Rodríguez et al. 2011), tal como se ha reportado para otras especies de calamar (Rodrigues y Gasalla 2008, Arkhipkin et al. 2004).
Lluch–Cota y Arias–Aréchiga (2000) mencionan que, en los meses fríos, en la parte alta del golfo de California las corrientes de marea y los procesos de mezcla vertical enriquecen la columna de agua, incrementándo la disponibilidad de alimento. En la temporada cálida, L. panamensis se distribuyó a lo largo de la costa este del golfo de California, con los centros de abundancia para ambos sexos frente a Bahía Kino, parte media del golfo, la cual corresponde a la segunda zona más productiva en este golfo (Mann y Lazier 1996, Lluch–Cota y Arias–Aréchiga 2000). El enriquecimiento en esta zona se debe a las surgencias costeras ocasionadas por el viento.
Distribución y abundancia por profundidad
El análisis de los datos por periodo, sexo y estadio de madurez mostró que en el periodo frío los organismos de ambos sexos y maduros se localizaron a profundidades de 21 a 40 m, mientras que en el periodo cálido se ubicaron en el intervalo de 1 a 20 m. Esto indica que la profundidad en la que realizan alguna etapa del evento reproductivo (cortejo, parchado y desove) difiere por temporada. O'Dor y Coelho (1993) comentan que los calamares habitan diferentes áreas en cada etapa de su ciclo de vida (paralarva, juvenil y adulto). Hatfield et al. (1990) documentaron que en las Islas Malvinas Loligo gahi se localiza en el límite de la plataforma continental en estadio juvenil y se desplaza a aguas poco profundas en estadio maduro. No obstante, Pineda et al. (1998) registraron individuos de L. gahi en estadio maduro entre 100 y 200 m de profundidad en la costa sudpatagónica, sugiriendo que esta especie desova a esa profundidad. Rodrigues y Gasalla (2008), en aguas brasileñas, y Barón y Re (2002), para la costa patagónica, registraron una mayor abundancia de juveniles de L. sanpaulensis en mar abierto y que al alcanzar la madurez sexual migran a la costa para desovar.
En el presente trabajo no se identificó un patrón batimétrico por fase de madurez y talla. La mayoría de los organismos en cada estrato presentaron actividad reproductiva. En lo que corresponde a la talla, en hembras se observó que la moda de 80 mm LDM se presentó en todos los intervalos de profundidad y en machos el intervalo de talla mejor representado fue 50 mm LDM. Es posible concluir que el calamar dedal en el golfo de California no presenta una distribución diferencial por fase de madurez (inmaduro, en desarrollo, maduro) y talla, o que los datos analizados no permitieron identificar tal patrón de distribución.
Distribución y abundancia diurna y nocturna
Se detectó que L. panamensis realiza movimientos diarios en la columna de agua, posiblemente para escapar de sus depredadores y alimentarse. Esta especie fue más abundante en los lances diurnos, entre 8:00 y 19:00, y menos abundante en los lances nocturnos, entre 20:00 a 07:00, en ambos periodos (frío y cálido). La migración vertical también se ha documentado para otros loliginidos como Loligo gahi (Hatfield et al. 1990), L. forbesi (Pierce et al. 1998) y L. pealei (Vecchione 1981). Summers (1983) observó que durante el día L. pealei se mantiene cerca del fondo y durante la noche se dispersa en la columna de agua, similar a los resultados de este trabajo. Se han confirmado migraciones verticales de Lolliguncula tydeus, que durante la noche migra a la superficie persiguiendo al zooplancton (Barrientos y García–Cubas 1997).
De manera general, la distribución de L. panamensis en el golfo de California presenta un ciclo estacional de los centros de abundancia. Los machos y las hembras se localizan principalmente en la parte norte del golfo durante el periodo frío y en la parte central durante el periodo cálido, coincidiendo con los periodos de enriquecimiento y mayor disponibilidad de alimento en la zona. El estadio maduro predominó en los centros de abundancia, lo que sugiere desplazamientos asociados con la alimentación y el desove. Las hembras maduran a tallas mayores que los machos y son más abundantes a tallas >70 mm LDM. Este trabajo constituye el primer reporte sobre la distribución de la abundancia del calamar dedal en el golfo de California.
AGRADECIMIENTOS
Agradecemos a la Comisión Nacional de Acuacultura y Pesca por el financiamiento al proyecto "Evaluación delas poblaciones de camarón en aguas marinas del Pacifico mexicano durante el periodo de veda y el efecto de la captura incidental de la fauna acompañante de camarón en el ecosistema". DIAR agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT, México) y al Instituto Politécnico Nacional (IPN) a través del Programa Institucional de Formación de Investigadores (PIFI). CQV es becario de EDI y COFAA del IPN. Se agradece la colaboración de J Padilla–Serrato durante la recolección y preservación del material biológico. Se agradece también la disposición y apoyo del capitán G Rivera–Velázquez y de la tripulación de los buques BIP XI y BIP XII durante las campañas de pesca exploratoria. El documento se benefició grandemente de los comentarios y sugerencias de un revisor anónimo.
REFERENCIAS
Agnew DJ, Baranowski R, Beddington JR, Desclers S, Nolan P. 1998. Approaches to assessing stocks of Loligo gahi around the Falkland Islands. Fish. Res. 35: 155–169. [ Links ]
Alejo–Plata MC, Cerdenares–Ladrón de Guevara G, Herrera–Galindo JE. 2001. Cefalópodos loliginidos en la fauna de acompañamiento del camarón. Cienc. Mar 5: 41–46. [ Links ]
Arizmendi–Rodríguez DI, Cruz–Escalona VH, Quiñónez–Velázquez C, Salinas–Zavala CA. 2011. Feeding habits of the Panama brief squid Lolliguncula panamensis in the Gulf of California, Mexico. J. Fish. Aquat. Sci. 6: 194–201. [ Links ]
Arkhipkin AI, Grzebielec R, Sirota AM, Remeslo AV, Polishchuk IA, Middleton DAJ. 2004. The influence of seasonal environ–mental changes on ontogenetic migrations of the squid Loligo gahi on the Falkland shelf. Fish. Oceanogr. 13: 1–9. [ Links ]
Barón PJ, Re ME. 2002. Reproductive cycle and population structure of Loligo sanpaulensis of the northeastern coast of Patagonia. Bull. Mar. Sci. 71: 175–186. [ Links ]
Barragán VJ. 1977a. Estudio de la nutrición del calamar del Pacífico colombiano, Lolliguncula panamensis, Berry (Cephalopoda: Myopsida). Div. Pesq. 10: 1–7. [ Links ]
Barragán VJ. 1977b. Estudio de la maduración sexual del calamar del Pacífico colombiano, Lolliguncula panamensis, Berry (Cephalopoda: Myopsida). Div. Pesq. 10: 8–14. [ Links ]
Barrientos G, García–Cubas A. 1997. Distribución y abundancia de la familia Loliginidae (Mollusca: Cephalopoda) en aguas mexicanas del Golfo de México. Rev. Soc. Mex. Hist. Nat. 47: 12–139. [ Links ]
Boyle P.R, Rodhouse P. 2005. Cephalopods: Ecology and fisheries. Blackwell, Oxford, 452 pp. [ Links ]
Costa PAS, Fernandes FC. 1993. Reproductive cycle of Loligo sanpaulensis (Cephalopoda: Loliginidae) in the Cabo Frío region, Brazil. Mar. Ecol. Prog. Ser. 101: 91–97. [ Links ]
Fischer W, Krupp F, Schneider W, Sommer C, Carpenter KE, Niem VH. 1995. Guia FAO para la identificación de especies para los fines de la pesca. FAO Pacífico centro–oriental. Rome, ISBN: 9253036753. [ Links ]
Hanlon R, Messenger J. 1996. Cephalopod Behavior. Cambridge University Press, Cambridge, UK. 248 pp. [ Links ]
Hatfield EMC, Rodhouse PG, Porebski J. 1990. Demography and distribution of the Patagonian squid (Loligo gahi d'Orbigny) during the austral winter. J. Cons. Int. Explor. Mer 46: 306–312. [ Links ]
Hernández–Vázquez S. 1987. Pesquerías pelágicas y neríticas de la costa occidental de Baja California, México. CalCOFI Rep. 38: 53–56. [ Links ]
Jackson GD. 2004. Advances in defining the life history of myopsid squids. J. Mar. Res. 55: 357–365. [ Links ]
Lluch–Cota SE, Arias–Aréchiga JP. 2000. Sobre la importancia de considerar la existencia de centros de actividad biológica para la regionalización del océano: El caso del Golfo de California. In: Lluch–Cota D, Elorduy–Garay J, Lluch–Cota SE, Ponce–Díaz G (eds.), Centros de Actividad Biológica del Pacífico Mexicano. CIBNOR, CICIMAR, CONACYT, La Paz, México, pp. 255–263. [ Links ]
Lluch–Cota SE, Aragón–Noriega EA, Arreguín–Sánchez F, Aurioles–Gamboa D, Bautista–Romero JJ, Brusca RC, Cervantes–Duarte R, Cortés–Altamirano R, Del Monte–Luna P, Esquivel–Herrera A, Fernández G, Hendrickx ME, Hernández–Vázquez S, Herrera–Cervantes H, Kahru M, Lavín M, Lluch–Belda D, Lluch–Cota DB, López–Martínez J, Marinone SG, Nevárez–Martínez MO, Ortega–García S, Palacios E, Parés–Sierra A, Ponce–Díaz G, Ramírez–Rodríguez M, Salinas–Zavala CA, Schwartzlose RA, Sierra–Beltrán AP. 2007. The Gulf of California: Review of ecosystem status and sustainability challenges. Prog. Oceanogr. 73: 1–26. [ Links ]
Mann KH, Lazier JRN. 1996. Dynamics of Marine Ecosystems: Biological–physical Interactions in the Oceans. 2nd ed. Blackwell Science, Oxford, 394 pp. [ Links ]
O'Dor RK, Coelho ML. 1993. Big squid, big currents and big fisheries. In: Okutani T, O'Dor R, Kubodera T (eds.), The Recent Advances in Cephalopod Fishery Biology. Tokai University Press, Tokyo, pp. 385–396. [ Links ]
Perez JAA, Aguiar DC, Oliveira UC. 2002. Biology and Population dynamics of the long–finned squid Loligo plei (Cephalopoda: Loliginidae) in southern Brazilian waters. Fish. Res. 58: 267–279. [ Links ]
Pierce GJ, Boyle PR, Hastie LC, Key L. 1994. The life history of Loligo forbesi (Cephalopoda, Loliginidae) in Scottish waters. Fish. Res. 21: 17–41. [ Links ]
Pierce GJ, Bailey N, Stratoudakis Y, Newton A. 1998. Distribution and abundance of the fished population of Loligo forbesi in Scottish waters: Analysis of research cruise data. ICES J. Mar. Sci. 55: 14–33. [ Links ]
Pineda SE, Brunetti NE, Scarlato NA. 1998. Calamares loligínidos (Cephalopoda, Loliginidae). In: Boschi EE (ed.), Los Moluscos de Interés Pesquero. Cultivos y Estrategias Reproductivas de Bivalvos y Equinodermos. Publicaciones Especiales INIDEP, Mar del Plata, pp. 13–36. [ Links ]
Rodhouse PG. 2005. Recursos mundiales de calamares. In: FAO Documento Técnico de Pesca No. 457, Roma, pp. 194–207. [ Links ]
Rodrigues AR, Gasalla MA. 2008. Spatial and temporal patterns in size and maturation of Loligo plei and Loligo sanpaulensis (Cephalopoda: Loliginidae) in southeastern Brazilian waters, between 23° S and 27° S. Sci. Mar. 72: 631–643. [ Links ]
Rosas–Luis R, Salinas–Zavala CA, Koch V, Del Monte–Luna P, Morales–Zárate MV. 2008. Importance of jumbo squid Dosidicus gigas (Orbigny 1835) in the pelagic ecosystem of the central Gulf of California. Ecol. Model. 218: 149–161. [ Links ]
Sánchez P. 2003. Cephalopods from off the Pacific coast of Mexico: Biological aspects of the most abundant species. Sci. Mar. 67: 81–90. [ Links ]
Santamaría–del Angel E, Álvarez–Borrego S. 1994. Gulf of California biogeographic regions based on coastal zone color scanner imagery. J. Geophys. Res. 99: 7411–7423. [ Links ]
Staudinger, MD. 2006. Seasonal and size–based predation on two species of squid by four fish predators on the northwest Atlantic continental shelf. Fish. Bull. 104: 605–615. [ Links ]
Sokal RR, Rohlf FJ. 1981. Biometry: the principles and practice of statistics in biological research, 2nd ed. Freeman, San Francisco, 859 pp. [ Links ]
Squires HJ, Barragán JH. 1979. Lolliguncula panamensis from the Pacific coast of Colombia. Veliger 22: 67–74. [ Links ]
Summers WC. 1983. Loligopealei. In: Boyle PR (ed.), Cephalopod Life Cycles. Vol. I. Species Accounts. Academic Press, London, pp. 115–142. [ Links ]
Vecchione M. 1981. Aspects of the early life history of Loligo pealei (Cephalopoda: Myopsida). J. Shellfish Res. 1: 171–180. [ Links ]
Villaseñor–Casales M. 1979. Distribución vertical de temperatura, salinidad, y oxígeno disuelto en la Bahía de La Paz, Baja California Sur, durante la primavera de 1976. CalCOFI Rep. 20: 146–149. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.
English translation by Christine Harris.














