Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.38 no.1a Ensenada Mar. 2012
Reclutamiento experimental del coral endémico de Brasil Mussismilia braziliensis y acondicionamiento de placas de asentamiento*
Experimental recruitment of the Brazilian endemic coral Mussismilia braziliensis and conditioning of settlement plates
B Segal1,2*, V Berenguer1, CB Castro1
1 Setor de Celenterologia, Departamento de Invertebrados, Museu Nacional/Universidade Federal do Rio de Janeiro, Quinta da Boa Vista s/n, São Cristóvão, Rio de Janeiro 20940–040, Brazil.
2 Present address: Departamento de Ecologia e Zoologia, Centro de Ciências Biológicas, Universidade Federal de Santa Catarina, Edifício Fritz Muller, Florianópolis, SC 88040–970, Brazil. * Corresponding author. E–mail: segal.barbara@gmail.com
Received September 2010
Received in revised form June 2011
Accepted October 2011
RESUMEN
En las últimas décadas se han propuesto iniciativas de restauración de arrecifes alrededor del mundo, algunas basadas en la reproducción sexual del coral. El objetivo del presente estudio fue definir el menor tiempo requerido para acondicionar sustratos artificiales a fin de incrementar el asentamiento de larvas del coral Mussismilia braziliensis. Se acondicionaron azulejos de cerámica en el arrecife durante diferentes periodos (0 [control], 6, 10, 20 y 30 semanas), y se analizó la comunidad incrustante. Los azulejos fueron dominados por algas cespitosas y algas coralinas crustosas (ACC) en los tratamientos de todas las edades; las placas de 20 y 30 semanas fueron estadísticamente diferentes comparadas con las de menor edad, con menos algas cespitosas y más ACC. Al ser expuestas a los distintos tratamientos, las larvas de M. braziliensis reclutaron poco en las placas de 6 semanas y no se encontraron reclutas en las placas control. Nuestros resultados destacan la importancia de un periodo adecuado de acondicionamiento para optimizar el asentamiento de corales. Aunque estamos lejos de comprender los procesos complejos que conducen el asentamiento de larvas, es muy importante establecer condiciones básicas para experimentos, aun para la conservación y actividades de manejo de arrecifes coralinos.
Palabras clave: coral, acondicionamiento de placas, asentamiento de larvas, Mussidae, Atlántico Sur.
ABSTRACT
Reef restoration initiatives have been proposed all over the world during the last decades, a few based on sexual coral reproduction. The present study aimed at defining the minimal time required to condition artificial substrates to enhance larval settlement of the coral Mussismilia braziliensis. Ceramic tiles were conditioned at the reef for different periods (0 [control], 6, 10, 20, and 30 weeks), and the fouling community was analyzed. The tiles were dominated by turf algae and crustose coralline algae (CCA) in all age treatments; plates 20 and 30 weeks old were statistically different than newer ones, having less turf algae and more CCA. When exposed to the different treatments, larvae of M. braziliensis recruited poorly on 6–week plates, and no spat were found on control plates. Our results highlight the importance of an adequate period of conditioning to optimize coral settlement. Although we are far from understanding the complex processes driving larval settlement, establishing baseline conditions for experiments is of foremost importance, even for conservation and management activities of coral reefs.
Key words: coral, plate conditioning, larval settlement, Mussidae, South Atlantic.
INTRODUCCIÓN
Los arrecifes coralinos han sido degradados en todo el mundo por actividades humanas, las cuales se han intensificado durante las últimas dos o tres décadas. Estas actividades afectan los arrecifes directamente a través de daños físicos provocados por anclajes, pesca con dinamita, encallamiento de embarcaciones y extracción de piedra caliza arrecifal. Los impactos indirectos humanos son causados por sobrepesca, contaminación, sedimentación, aumento de la temperatura superficial del mar y acidificación del océano (Buddemeier et al. 2004, Precht 2006). Las principales respuestas de los organismos constructures sujetos a estos impactos son el blanqueamiento, enfermedades, disminución de crecimiento y calcificación, y muerte (Buddemeier et al. 2004). En los arrecifes más importantes del Atlántico Sur, frente a la costa de Brasil, los impactos regionales parecen ser de mayor importancia que los de los fenómenos a gran escala como el calentamiento global. Según Rodríguez–Ramírez et al. (2008), los mayores riesgos que enfrentan los arrecifes brasileños son la proliferación de algas, la sedimentación, la deforestación y el desarrollo urbano de las zonas costeras. Aunque existen pocos datos, un estudio reciente que analizó las tendencias mundiales de la exposición de arrecifes coralinos a factores estresantes también mostró que los impactos locales (tales como la eutrofización y sedimentación) tienden a ser más importantes en los arrecifes brasileños (Maina et al. 2011).
Científicos y administradores alrededor del mundo se han enfocado en estudios e iniciativas de restauración con el fin de reparar arrecifes dañados. La mayoría de las técnicas consisten en realizar trasplantes de fragmentos de coral en zonas deterioradas (Oren y Benayahu 1997, Jaap 2000, Epstein et al. 2001). Este tipo de trasplante se emplea fácilmente a gran escala con especies ramificadas, como los acropóridos, que crecen rápidamente y producen varios fragmentos para trasplantar; sin embargo, se han realizado pocos estudios con especies masivas para propósitos de restauración (ver Gleason et al. 2001, Miller y Szmant 2006). Según Gleason et al. 2001, este tipo de trasplante puede lograr gran éxito al combinar la resistencia al trasplante con un alto potencial reproductivo y reclutamiento local. Por otro lado, las técnicas que usan semillas de coral producidas mediante fecundación cruzada in vitro también son importantes para el mantenimiento de la variabilidad genética. En los arrecifes brasileños del Atlántico Sur, los cuales son dominados por corales masivos de crecimiento lento, que tienen sólo unas cuantas especies ramificadas de milepóridos, el uso de semillas de coral generadas mediante técnicas de fecundación cruzada in vitro podría ser una buena alternativa para propósitos de resiembra.
Un proceso clave en el mantenimiento del crecimiento arrecifal y la restauración de arrecifes degradados es la tasa de llegada de nuevos corales (reclutas) al arrecife. Varios trabajos han estudiado la influencia de aspectos físicos del sustrato como la inclinación y la incidencia de luz en el asentamiento de corales (Harriott y Banks 1995, Maida y Ferreira 1995, Soong et al. 2003). Otros estudios han mostrado la influencia de un proceso químico que promueve el asentamiento de larvas. Estas señales químicas pueden ser proporcionadas por bacterias incrustantes (Johnson et al. 1991, Faimali et al. 2004), escombros coralinos (Heyward y Negri 1999, Carlon 2002, Lee et al. 2009) y algas coralinas crustosas (Morse et al. 1994, Heyward y Negri 1999, Baird y Morse 2004). Por ende, es bien sabido que los estudios de asentamiento coralino con placas experimentales deben cumplir un proceso de "maduración" de las unidades de asentamiento. Este proceso permite el desarrollo de una comunidad incrustante, que puede favorecer el asentamiento coralino, actuando como un inductor o potenciador de la fijación y metamorfosis larval (Baird et al. 2003, Faimali et al. 2004, Koehl y Hadfield 2004). Sin embargo, no se ha llegado a una conclusión precisa en cuanto al momento óptimo de maduración del sustrato para la colonización exitosa de arrecifes. Por ejemplo, algunos estudios mencionan un tiempo de preacondicionamiento de una semana (Gilmour 1999) o tres semanas (Mundy y Babcock 1998), mientras que otros mencionan tres meses (Petersen et al. 2005). Además, la mediación química de este proceso puede tener una respuesta específica según la especie (Dunstan y Johnson 1998). Por lo tanto, el objetivo de este trabajo fue analizar la influencia de los tiempos de maduración de placas, antes de la temporada de desove, para exitosamente obtener corales unos cuantos meses después de su asentamiento usando larvas del coral Mussismilia braziliensis (Verrill 1868) como un estudio de caso. Nuestro enfoque evaluó conjuntamente dos principales restricciones para obtener nuevos reclutas: éxito de asentamiento y tasa de mortalidad temprana.
Los corales del género Mussismilia son endémicos de la costa de Brasil, donde se encuentran tres especies: M. braziliensis, M. harttii y M. hispida. De éstas, M. braziliensis tiene la distribución más reducida, siendo exclusiva del estado de Bahía (12–18° S), pero es una de las principales constructoras de las zonas arrecifales más prolíficas del Atlántico Sur: los arrecifes de Abrolhos (Castro y Pires 2001). Esta especie libera sus gametos al medio durante el verano (enero a marzo; Pires et al. 1999). Francini–Filho et al. (2008) observaron que las enfermedades coralinas se han intensificado recientemente (2005–2007) en algunos de los arrecifes de Abrolhos, y pronosticaron que "M. braziliensis estará casi extinta en menos de un siglo si no se invierte la tasa de mortalidad actual debido a enfermedades". En este escenario, la investigación de los procesos de reproducción y asentamiento de M. braziliensis se vuelve muy relevante para los planes de conservación y manejo de arrecifes del Atlántico Sur.
Este trabajo representa el primer estudio experimental ex situ para definir el menor tiempo requerido para acondicionar placas de asentamiento a fin de aumentar el número de reclutas de un coral masivo, liberador de gametos y constructor de arrecifes.
MATERIALES Y MÉTODOS
Preparación experimental
Se colocaron azulejos de terracota (placas de asentamiento), de 15 × 15 cm, en diferentes fechas en el Parque Marino Municipal de Recife de Fora (16°24.802' S, 038°59.295' W), un arrecife cerca de la costa este (3.5 km) de Brasil. La cobertura coralina máxima de 22.7% se observa a 3 m de profundidad (Costa et al. 2000). Las placas fueron atadas a bloques de cemento, y colocadas verticalmente y aleatoriamente alrededor de los bloques, los cuales fueron colocados a una profundidad similar (3 m). Las placas se colocaron en julio de 2007 (48 placas, acondicionadas durante 213 días, ca. 30 semanas), octubre de 2007 (31 placas, acondicionadas durante 137 días, ca. 20 semanas), diciembre de 2007 (30 placas, acondicionadas durante 72 días, ca. 10 semanas) y enero de 2008 (51 placas, acondicionadas durante 43 días, ca. 6 semanas).
Justo antes del experimento, 10 placas de cada periodo de acondicionamiento fueron seleccionadas aleatoriamente y transportadas al laboratorio en contenedores de plástico con agua de mar (se utilizó un mayor número de placas para evitar que eventuales pérdidas afectaran el experimento). Estas placas se mantuvieron en un sistema semiabierto de agua de mar en la estación de investigación del proyecto Coral Vivo. El sistema consistió en varios tanques de 1000 L y un depósito de 5000 L. Se bombeó agua marina una vez por semana del mar cerca de un arrecife costero, y una bomba y un sistema de filtración circularon el agua entre el depósito y los tanques más pequeños. Las placas se fotografiaron con una cámara de 10 Mp (Canon EOS Rebel XTi) y se analizaron bajo un estereomicroscopio (Zeiss Stemi DV4) para la cuantificación y la remoción de reclutas que se asentaron naturalmente en ellas. Este procedimiento fue necesario para evitar el conteo de reclutas que se asentaron durante la inmersión de las placas en el mar y no durante el experimento. Se analizaron las imágenes para evaluar la cobertura béntica de los sustratos artificiales con el programa Coral Point Count with Excel Extensions 3.4 (Kohler y Gill 2006), muestreando 100 puntos aleatorios por placa. Se registraron dos categorías de algas: algas cespitosas (diferentes tipos de algas pequeñas que parecen arbustos y generalmente forman una capa gruesa) y algas coralinas crustosas (ACC). Además de estas placas para los tratamientos, se colocaron 10 placas control por un par de días en los tanques con agua de mar para eliminar cualquier residuo de la fabricación de terracota antes del experimento.
Las 50 placas seleccionadas se organizaron en estantes de PVC, en posición casi vertical (misma posición que en el campo), colocadas para que la superficie disponible para el asentamiento siempre estuviera enfrente de otra placa. Se dejó una distancia de 10 cm entre cada placa para minimizar los efectos de borde (Maida et al. 1994). Los estantes se colocaron dentro de contenedores de plástico de 80 L (10 réplicas) con agua de mar y aireación, con cinco placas (control, 6, 10, 20 y 30 semanas) en cada uno y un estante (soporte de PVC) por contenedor.
Cultivo de larvas
Se recolectaron colonias maduras de M. braziliensis (de 15 cm o más de diámetro) en febrero de 2008, justo antes de la temporada de desove (Pires et al. 1999), y se transportaron al laboratorio donde se mantuvieron en los tanques de 1000 L del sistema semiabierto. El 5 y 6 de marzo se recolectaron varios bultos de 10 colonias, que contenían óvulos y espermatozoides. Los gametos se introdujeron en contenedores de plástico de 41 L para su fertilización. Debido a una alta variabilidad del número de gametos por bulto y alta mortalidad larvaria, se realizaron cuantificaciones periódicas de las larvas viables en los contenedores. Se tomaron tres submuestras (20 mL) de cada contenedor y las larvas vivas se contaron bajo un estereomicroscopio. Posteriormente, se calculó el número de larvas para el volumen total. Las larvas fueron criadas durante cinco días después de su fertilización, con aireación y cambios de agua diarios. Las larvas se distribuyeron entre los contenedores antes del experimento manteniendo un balance de ca. 3000 larvas por contenedor. Las colonias madres se regresaron al arrecife después del evento de desove donde se fijaron con cemento epoxi.
Asentamiento
Las larvas de M. braziliensis están listas para iniciar la metamorfosis y el asentamiento cinco días después de su fertilización (Projeto Coral Vivo, datos no publicados). Nuestro experimento inició el 11 de marzo al poner los estantes de PVC en los contenedores. Siete días después, cuando ya no se observaron larvas en los contenedores, los estantes se transfirieron al sistema de tanques.
Cuatro meses después de ser trasladados a los tanques se contaron los pólipos vivos y esqueletos muertos de los reclutas con un estereomicroscopio. Después de la búsqueda de corales, las placas se fijaron en alcohol (92.8°) y se trasladaron al laboratorio.
Análisis estadístico
Las diferencias en la cobertura algal, el reclutamiento natural y el número experimental de reclutas entre los tratamientos se compararon con la prueba no paramétrica de Kruskal–Wallis, debido a la heterocedasticidad de varianzas entre los tratamientos. Los resultados significativos se evaluaron mediante comparaciones post hoc de rangos promedio de todos los pares de grupos. También se realizó un análisis de correlación parcial para evaluar cuál factor afectó el asentamiento experimental: el periodo de acondicionamiento de las placas, la cobertura de algas cespitosas, la cobertura de ACC y el número total de reclutas in situ (considerado un indicador indirecto a priori de condiciones buenas para el asentamiento de larvas). Los valores atípicos fueron indicados por el programa y eliminados al ser detectados. Todas las pruebas se realizaron con Statistica 7.0.
RESULTADOS
Las algas cespitosas y las ACC dominaron la comunidad incrustante de las placas experimentales. Se observaron briozoarios, esponjas y tunicados, pero no fueron detectados por el programa Coral Point Count ya que su cobertura fue muy baja. La cobertura de las algas cespitosas fue mayor en las placas de 6 y 10 semanas, y significativamente menor en las placas de 20 y 30 semanas (Kruskal–Wallis, H(3, n=39) = 19.98172, P = 0.0002; fig. 1). Las ACC mostraron una tendencia inversa; su cobertura fue incrementando en las placas de mayor edad, las de 20 y 30 semanas con una cobertura significativamente mayor (Kruskal–Wallis, H(3, n=39) = 19.26399, P = 0.0002; fig. 1). El reclutamiento coralino natural, compuesto de especies no identificadas que se asentaron durante su maduración, fue significativamente menor en las placas de 6 semanas que en las de 20 y 30 semanas. Tomando en cuenta que la temporada de desove de M. braziliensis es entre febrero y abril (Pires et al. 1999) y las primeras placas se colocaron en julio, estos reclutas se atribuyeron a otras especies de coral. Las placas de 10 semanas mostraron una situación transicional y no se observaron diferencias significativas con los otros periodos (Kruskal–Wallis, H(3, n=39) = 12.33097, P = 0.0063; fig. 2).
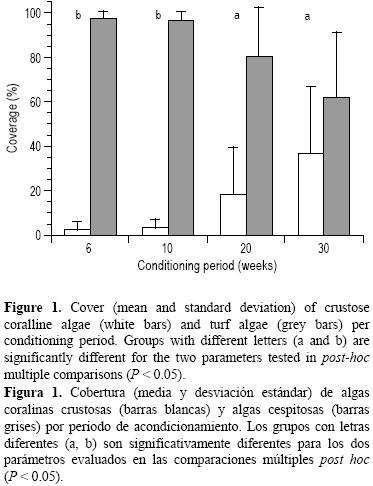
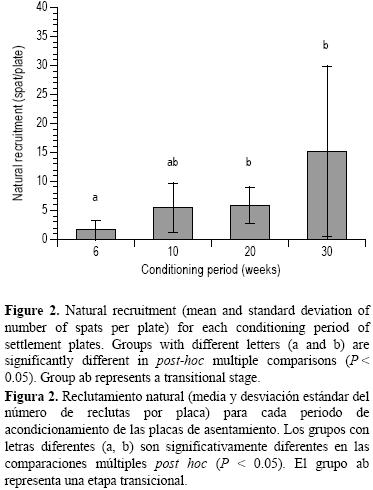
El experimento con las larvas de M. braziliensis produjo un total de 708 reclutas en las 50 placas experimentales después de cuatro meses. De este total, 343 corales provinieron de las placas inmersas durante 30 semanas, 206 de las placas inmersas durante 20 semanas y 133 de las placas inmersas durante 6 semanas; no se observaron reclutas en las placas control. Una de las placas de 30 semanas se eliminó de los análisis gráficos y estadísticos ya que presentó un número extremadamente alto de corales (117 reclutas), el cual fue un valor atípico. Los números de reclutas experimentales y naturales para cada tratamiento se expresan en corales por metro cuadrado (figs. 2, 3).

De todas las variables probadas en las correlaciones parciales, sólo el periodo de acondicionamiento mostró una probabilidad significativa de que las diferencias en el número experimental de reclutas podrían no ser aleatorias (tabla 1). El número total experimental de corales fue significativamente menor en las placas de 6 semanas (Kruskal–Wallis, H(3, n=39) = 17.60930, P = 0.0005). Considerando sólo los corales encontrados vivos, las placas de 6 semanas difirieron significativamente sólo de las de 30 semanas (Kruskal–Wallis, H(3, n=39)= 14.01209, P = 0.003). En cualquier caso, el número de corales obtenido experimentalmente incrementó en las placas de mayor tiempo de inmersión (fig. 3).
DISCUSIÓN
La fecundación in vitro de óvulos y espermatozoides de 10 colonias de M. braziliensis se realizó con éxito, proporcionando ca. 30,000 larvas cinco días después de su fertilización. Esto representa el primer experimento exitoso de asentamiento in vitro de uno de los principales constructores arrecifales endémico del Atlántico Sur. De mayor importancia, nuestros resultados muestran claramente la relevancia de considerar cuidadosamente el periodo de incubación antes de poder obtener estimaciones confiables de las tasas de reclutamiento de corales. Este enfoque es válido para cualquier especie que está siendo considerada para experimentos de reclutamiento ex situ o in situ.
Un aspecto importante para los esfuerzos de recuperación es la tasa de reclutas obtenidos: en este estudio, ca. 2.4% (n = 708) de 30,000 larvas inicialmente disponibles. Aún más relevante es la tasa de supervivencia después de los primeros meses cruciales. Miller y Szmant (2006) registraron una tasa de supervivencia de 1–2% para reclutas de Montastraea faveolata durante los primeros tres meses después de su asentamiento. En comparación, nosotros encontramos 39% de reclutas vivos después de cuatro meses de su asentamiento (fig. 3). Estos resultados sugieren que se podrían utilizar técnicas similares para la reposición, como larvas o reclutas, de los ambientes naturales degradados. Las bajas tasas de asentamiento pueden mejorarse significativamente, especialmente eliminando las pérdidas durante los cambios de agua; las larvas de M. braziliensis son extremadamente pequeñas, y casi todas (>95%) no fueron retenidas por mallas de plankton de 100 |am. Asimismo, se podría aumentar el número de las colonias semilleras (fuente de gametos) para alcanzar el número deseado de larvas.
Nuestros resultados sugieren que el tiempo mínimo de acondicionamiento de las placas de reclutamiento necesariamente debe ser más de 10 semanas en condiciones de campo. A pesar de que no fue posible distinguir estadísticamente entre las placas de 10 semanas y las de 20 y 30 semanas debido a la alta variación, el mayor reclutamiento promedio obtenido con las placas de mayor edad indica que periodos de inmersión más largos podrían incluso aumentar la eficiencia del reclutamiento. Un inconveniente de estos periodos tan largos en el mar es que es necesario examinar las placas y quitar los reclutas que se asentaron durante este periodo antes de iniciar los experimentos. Según nuestros resultados, las tasas registradas en varios estudios podrían haber subestimado el asentamiento potencial debido a un acondicionamiento inadecuado de los sustratos. Lundgren y Minton (2005), quienes acondicionaron las placas durante dos semanas antes del experimento de asentamiento, mencionan que el periodo de acondicionamiento podría haber sido responsable del bajo reclutamiento observado (sólo siete reclutas en 120 placas).
Hughes et al. (2002) realizaron un metaanálisis de varios estudios de reclutamiento en la Gran Barrera Arrecifal de Australia. Sus resultados mostraron que "el reclutamiento total se correlacionó significativamente con el mes y año de instalación, ya sea que la instalación incluyera el mes de desove masivo (desove), la profundidad, distancia de la costa, duración y hábitat, y latitud". Esto crea restricciones para la comparación de experimentos in situ. Además, con frecuencia los autores no especifican los tiempos precisos de acondicionamiento. Por ende, en este estudio no se compararon las tasas de acondicionamiento con diferentes estudios in situ; sin embargo, con base en nuestros resultados experimentales, se sugiere que el acondicionamiento de placas amerita especial atención en estudios de reclutamiento. Los autores deberían indicar los tiempos exactos de acondicionamiento y de la instalación y recuperación de las placas en sus trabajos.
La ausencia de M. braziliensis en las placas control concuerda con la suposición general en cuanto a la necesidad de señales o inductores biológicos para el asentamiento larval, como se ha documentado en varios trabajos. Diferentes enfoques han mostrado la importancia positiva o negativa de las ACC (Morse et al. 1994, Heyward y Negri 1999, Baird y Morse 2004, Szmant y Miller 2006), las algas cespitosas (Petersen et al. 2005), la biopelícula (Johnson et al. 1991, Faimali et al. 2004) y el agua arrecifal (Gleason et al. 2009). No hay consenso sobre una señal única o más importante. Una diferencia detectada entre las placas acondicionadas durante 20 y 30 semanas, en comparación con las de menos tiempo, fue una reducción de la cobertura de algas cespitosas (Kruskal–Wallis, P = 0.0002; fig. 1) y un incremento de las ACC (Kruskal–Wallis, P = 0.0002; fig. 1). Aunque las ACC presentaron mayor cobertura en las placas inmersas durante un periodo más largo, los resultados de la correlación no indicaron una relación entre las ACC y un mejor asentamiento (tabla 1). Tal falta de relación entre las ACC y los reclutas ya ha sido documentada (Petersen et al. 2005). Esto requiere de mayor investigación, tomando en cuenta el aislamiento de cada especie de ACC y probando cada especie como inductor de reclutamiento, ya que podría ser una relación específica según la especie.
El periodo de acondicionamiento mínimo para M. braziliensis debería ser por lo menos 10 semanas antes del experimento de reclutamiento, existiendo un beneficio potencial si se usan periodos más largos. El número de reclutas de cuatro meses de edad obtenido en este esfuerzo a pequeña escala sugiere que, con mejorías, esta especie podría ser apta para la producción ex situ de larvas y/o reclutas. La relación entre el tiempo de acondicionamiento de placas y el reclutamiento ex situ se evalúa por primera vez en este estudio. Se muestra la importancia de un acondicionamiento adecuado previo de las placas. Ya que las tasas de acondicionamiento pueden variar entre regiones, se les sugiere a los autores que determinen el periodo de acondicionamiento mínimo para la zona de su comunidad coralina.
AGRADECIMIENTOS
Se agradecen a las siguientes personas e instituciones que apoyaron este trabajo: J Creed realizó actividades iniciales relacionadas con el acondicionamiento de placas; A Baird y dos revisores anónimos aportaron comentarios útiles a una versión previa del manuscrito; el equipo del proyecto Coral Vivo proporcionó asistencia en el campo y laboratorio; el proyecto Coral Vivo, a través de su patrocinio del "Programa Petrobras Ambiental", proporcionó financiamiento para las actividades de campo y laboratorio y una beca a VB; El Eco Parque Arraial d'Ajuda proporcionó espacio y facilidades para la instalación de los sistemas de tanques; y la Secretaría de Medio Ambiente de Porto Seguro otorgó la licencia para trabajar en el Parque Municipal Marino de Recife de Fora.
REFERENCIAS
Baird AH, Morse ANC. 2004. Induction of metamorphosis in larvae of the brooding corals Acropora palifera and Stylophora pistillata. Mar. Freshwat. Res. 55: 469—472. [ Links ]
Baird AH, Babcock RC, Mundy CP. 2003. Habitat selection by larvae influences the depth distribution of six common coral species. Mar. Ecol. Prog. Ser. 252: 289–293. [ Links ]
Buddemeier RW, Kleypas JA, Aronson RB. 2004. Potential contributions of climate change to stresses on coral reef ecosystems. Coral reefs and global climate change. Pew Center on Global Climate Change, Virginia, USA, 56 pp. [ Links ]
Carlon DB. 2002. Production and supply of larvae as determinants of zonation in a brooding tropical coral. J. Exp. Mar. Biol. Ecol. 268: 33–46. [ Links ]
Castro CB, Pires DO. 2001. Brazilian coral reefs: What we already know and what is still missing. Bull. Mar. Sci. 69: 357–371. [ Links ]
Costa OS Jr, Attrill MJ, Pedrini AG, De–Paula JC. 2000. Benthic macroalgal distribution in coastal and offshore reefs at Porto Seguro Bay, Brazilian Discovery Coast. Proceedings of the 9th International Coral Reef Symposium, pp. 23–27. [ Links ]
Dunstan PK, Johnson CR. 1998. Spatio–temporal variation in coral recruitment at different scales on Heron Reef, southern Great Barrier Reef. Coral Reefs 17: 71–81. [ Links ]
Epstein N, Bak RPM, Rinkevich B. 2001. Strategies for gardening denuded coral reef areas: The applicability of using different types of coral material for reef restoration. Restor. Ecol. 9: 432–442. [ Links ]
Faimali M, Garaventa F, Terlizzi A, Chiantore M, Cattaneo–Vietti R. 2004. The interplay of substrate nature and biofilm formation in regulating Balanus amphitrite Darwin, 1854 larval settlement. J. Exp. Mar. Biol. Ecol. 306: 37–50. [ Links ]
Francini–Filho RB, Moura RL, Thompson FL, Reis RM, Kaufman L, Kikuchi RKP, Leão ZMAN. 2008. Diseases leading to accelerated decline of reef corals in the largest South Atlantic reef complex (Abrolhos Bank, eastern Brazil). Mar. Pollut. Bull. 56: 1008–1014. [ Links ]
Gilmour J. 1999. Experimental investigation into the effects of suspended sediment on fertilisation, larval survival and settlement in a scleractinian coral. Mar. Biol. 135: 451–462. [ Links ]
Gleason DF, Brazeau DA, Munfus D. 2001. Can self–fertilized coral species be used to enhance restoration of Caribbean reefs? Bull. Mar. Sci. 69: 933–943. [ Links ]
Gleason DF, Danilowicz BS, Nolan CJ. 2009. Reef waters stimulate substratum exploration in planulae from brooding Caribbean corals. Coral Reefs 28: 549–554. [ Links ]
Harriott VJ, Banks SA. 1995. Recruitment of scleractinian corals in the Solitary Island Marine Reserve, a high latitude coral–dominated community in eastern Australia. Mar. Ecol. Prog. Ser. 123: 155–161. [ Links ]
Heyward AJ, Negri AP. 1999. Natural inducers for coral larval metamorphosis. Coral Reefs 18: 273–279. [ Links ]
Hughes TP, Baird AH, Dinsdale EA, Harriott VJ, Moltschaniwskyj NA, Pratchett MS, Tanner JE, Willis BL. 2002. Detecting regional variation using meta–analysis and large–scale sampling: Latitudinal patterns in recruitment. Ecology 83: 436–451. [ Links ]
Jaap WC. 2000. Coral reef restoration. Ecol. Eng. 15: 345–364. [ Links ]
Johnson CR, Muir DG, Reysenbach AL. 1991. Characteristic bacteria associated with surfaces of coralline algae: A hypothesis for bacterial induction of marine invertebrate larvae. Mar. Ecol. Prog. Ser. 74: 281–294. [ Links ]
Koehl MAR, Hadfield MG. 2004. Soluble settlement cue in slowly moving water within coral reefs induces larval adhesion to surfaces. J. Mar. Syst. 49: 75–88. [ Links ]
Kohler KE, Gill SM. 2006. Coral Point Count with Excel extensions (CPCe): A Visual Basic program for the determination of coral and substrate coverage using random point count methodology. Comput. Geosci. 32: 1259–1269. [ Links ]
Lee CS, Walford J, Goh BPL. 2009. Adding coral rubble to substrata enhances settlement of Pocillopora damicornis larvae. Coral Reefs 28: 529–533. [ Links ]
Lundgren I, Minton D. 2005. Is coral recruitment limited by sedimentation at war in the Pacific National Historical Park? In: Harmon D (ed.), People, Places, and Parks. Proceedings of the 2005 George Wright Society Conference on Parks, Protected Areas, and Cultural Sites, Hancock, Michigan. The George Wright Society, pp. 379–384. [ Links ]
Maida M, Ferreira BP. 1995. Estudo preliminar sobre o assentamento de corais em um Recife na Baía de Tamandaré–PE. Bol. Téc. Cient. CEPENE 3: 23–37. [ Links ]
Maida M, Coll JC, Sammarco PW. 1994. Shedding new light on scleractinian coral recruitment. J. Exp. Mar. Biol. Ecol. 180: 189–202. [ Links ]
Maina J, McClanahan TR, Venus V, Ateweberhan M, Madin J. 2011. Global gradients of coral exposure to environmental stresses and implications for local management. PLoS ONE 6: e23064, doi:10.1371/journal.pone.0023064. [ Links ]
Miller MW, Szmant AM. 2006. Lessons learned from experimental key–species restoration. In: Precht W (ed.), Coral Reef Restoration Handbook. CRS Press, Boca Raton, pp. 219–233. [ Links ]
Morse DE, Morse ANC, Raimondi PT, Hooker N. 1994. Morphogen–based chemical flypaper for Agaricia humilis coral larvae. Biol. Bull. 186: 172–181. [ Links ]
Mundy CN, Babcock RC. 1998. Role of light intensity and spectral quality in coral settlement: Implications for depth–dependent settlement? J. Exp. Mar. Biol. Ecol. 223: 235–255. [ Links ]
Oren U, Benayahu Y. 1997. Transplantation of juvenile corals: A new approach for enhancing colonization of artificial reefs. Mar. Biol. 127: 499–505. [ Links ]
Petersen D, Laterveer M, Schuhmacher H. 2005. Spatial and temporal variation in larval settlement of reefbuilding corals in mariculture. Aquaculture 249: 317–327. [ Links ]
Pires DO, Castro CB, Ratto CC. 1999. Reef coral reproduction in the Abrolhos Reef Complex, Brazil: The endemic genus Mussismilia. Mar. Biol. 135: 463–171. [ Links ]
Precht W. 2006. Coral Reef Restoration Handbook. CRS Press, Boca Raton, 384 pp. [ Links ]
Rodríguez–Ramírez A, Bastidas C, Cortés J, Guzmán H, Leão Z, Garzón–Ferreira J, Kikuchi R, Ferreira BP, Alvarado JJ, Jiménez C, Fonseca AC, Salas E, Nivia J, Fernández C, Rodríguez S, Debrot D, Cróquer A, Gil D, Gómez DI, Navas–Camacho R, Reyes–Nivia MC, Acosta A, Alvarado E, Pizarro V, Sanjuan A, Herrón P, Zapata FA, Zea S, López–Victoria M, Sánchez JA. 2008. Status of coral reefs and associated ecosystems in Southern Tropical America: Brazil, Colombia, Costa Rica, Panama and Venezuela. In: Wilkinson C (ed.), Status of Coral Reefs of the World: 2008. Global Coral Reef Monitoring Network and Reef and Rainforest Research Center, Townsville, Australia, pp. 281–294. [ Links ]
Soong K, Chen MH, Chen CL, Dai CF, Fan TY, Li JJ, Fan H. 2003. Spatial and temporal variation of coral recruitment in Taiwan. Coral Reefs 22: 224–228. [ Links ]
Szmant AM, Miller MW. 2006. Settlement preferences and post–settlement mortality of laboratory cultured and settled larvae of the Caribbean hermatypic corals Montastraea faveolata and Acropora palmata in the Florida Keys, USA. Proceedings of the 10th International Coral Reef Symposium, pp. 43–49. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.
Traducido al español por Christine Harris.














