Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.4b Ensenada dic. 2011
Cambios espaciales y temporales en la fecundidad parcial de la sardina común y anchoveta frente al centro y sur de Chile (2002–2007)*
Spatial and temporal changes in batch fecundity of common sardine and anchovy off central and southern Chile (2002–2007)
LA Cubillos1*, C Alarcón1, C Castillo–Jordán1, G Claramunt2, C Oyarzún1, S Gacitúa3
1 Laboratorio de Evaluación de Poblaciones Marinas (EPOMAR), Departamento de Oceanografía, Universidad de Concepción, Casilla 160–C, Concepción, Chile.*Corresponding author. E–mail: lucubillos@udec.cl
2 Departamento de Ciencias del Mar, Universidad Arturo Prat, Casilla 121, Iquique, Chile.
3 ANAPESCA, Valparaíso, Chile.
Received April 2010
Accepted August 2011
RESUMEN
La anchoveta Engraulis ringens y la sardina común Strangomera benticki son dos peces pelágicos menores que concurren en el mismo hábitat reproductivo frente a las costas del centro y sur de Chile, con una estrategia reproductiva similar. Se analizaron los cambios interanuales y espaciales en la fecundidad parcial de ambas especies con el fin de detectar la variabilidad en sus parámetros e inferir diferentes tácticas reproductivas que pudieran afectar su potencial de reproducción. Se obtuvieron muestras de ejemplares adultos para estimar la biomasa desovante mediante el Método de Producción Diaria de Huevos, de 2002 a 2007, frente a la costa de Chile. El área de estudio fue dividida en dos zonas, central y sur. La fecundidad parcial estuvo linealmente relacionada cada año con el peso corporal (sin los ovarios) de las hembras. Para la anchoveta la pendiente no mostró diferencias interanuales, ni entre zonas, mientras para la sardina la ordenada al origen y las pendientes tuvieron cambios interanuales significativos, pero no entre zonas. El promedio de peso de las hembras maduras de ambas especies tendió a ser mayor en la zona sur, y el promedio de fecundidad parcial varió entre 4,283 y 8,903 huevos por hembra madura de anchoveta, y entre 5,901 y 10,414 de sardina. A pesar de la similitud entre las estrategias reproductivas de las especies estudiadas, las diferencias encontradas en su fecundidad parcial perecen constituir una diferencia primordial entre sardina y anchoveta en su zona de desove frente a Chile, lo cual puede tener implicaciones en su potencial reproductivo.
Palabras clave: fecundidad parcial, pelágicos menores, reproducción, desove.
ABSTRACT
Anchovy Engraulis ringens and common sardine Strangomera bentincki are two small pelagic fish that cooccur in the same reproductive habitat off central and southern Chile and have a similar reproductive strategy. Interannual and spatial changes in the batch fecundity of both fish were analyzed with the purpose of detecting variability in the parameters and inferring different reproductive tactics that could affect the reproductive potential. Samples were obtained from adult surveys carried out to estimate spawning biomass by the Daily Egg Production Method, from 2002 to 2007, off Chile. The study area was divided into two zones: central and south. The batch fecundity was linearly related to ovary–free female body weight for each year. For anchovy, the slope was not different across years and zones, while for sardine, changes in intercept and slopes varied significantly among years, but not between zones. The average weight of mature females tended to be higher in the south zone for both species, and average batch fecundity ranged from 4,283 to 8,903 eggs per mature female anchovy, and from 5,901 to 10,414 eggs per mature female sardine. Although the anchovy and sardine reproductive strategy is similar, differences in batch fecundity seemed to be the main distinction between the species in the central and southern spawning sites off Chile, with implications for the reproductive potential.
Key words: batch fecundity, small pelagic fish, reproduction, spawning.
INTRODUCCIÓN
Dentro de la ecología reproductiva de los peces pelágicos menores que habitan zonas de surgencias, como anchovetas y sardinas, es importante entender los cambios espaciales y temporales en la fecundidad parcial para explicar los cambios en su éxito reproductivo (Parrish et al. 1986, Mertz y Myers 1996) y el impacto de factores ambientales (Aoki y Murayama 1993, Kjesbu et al. 1998, Takasuka et al. 2005), para mejorar los modelos de evaluación poblacionales (Marshall et al. 2006, Lambert 2008), y para estimar la biomasa desovante mediante el Método de Producción Diaria de Huevos (MPDH) (Stratoudakis et al. 2006). La fecundidad es un componente importante de la producción total de huevos, y sus cambios tienen un impacto notable en el potencial reproductivo e implicaciones en el manejo de las pesquerías (Kjesbu et al. 1991, Solemdal 1997, Marteinsdottir y Begg 2002, Marshall et al. 2003, Murua y Saborido–Rey 2003).
Los peces pueden ser clasificados como de fecundidad determinada o indeterminada dependiendo de si su potencial anual de fecundidad se fija o no, respectivamente, al momento del desove. El potencial anual de fecundidad representa el número total de ovocitos en estado avanzado de vitelación madurados por cada hembra por año, sin corregir por pérdidas atrésicas (Murua y Saborido–Rey 2003), lo que está influenciado por el tamaño de la hembra, la estrategia de desove, y el patrón de desove de la especie (Lambert 2008). Por lo tanto, en las especies indeterminadas no es posible estimar el potencial de fecundidad, sino sólo la fecundidad anual real; es decir, el número total de huevos que en realidad fueron liberados durante la temporada de desove. Esto se puede estimar a partir del número de ovocitos hidratados liberados durante cada evento de desove (fecundidad parcial), la proporción de hembras desovantes por día y la duración de la temporada de desove (Hunter et al. 1985, Murua y Saborido–Rey 2003, Murua et al. 2006). Por ello en las especies indeterminadas la fecundidad parcial es un componente clave en la producción de huevos. La fecundidad parcial depende del tamaño, y usualmente es de esperar una relación exponencial al graficarla contra la talla de las hembras. En cambio, el número de ovocitos representa un volumen limitado por el tamaño del ovario y, por lo tanto, cabría esperar una relación lineal entre la fecundidad parcial y el peso corporal (Hunter et al. 1985, Lambert 2008). Aunque es posible establecer clara y fácilmente estas relaciones, usualmente se desconocen los cambios espaciales y temporales en la fecundidad parcial ya que la mayoría de los sistemas de monitoreo biológico de las pesquerías toman en cuenta sólo índices reproductivos como el gonadosomático, la madurez y la proporción de sexos.
En este artículo se seleccionó la fecundidad parcial para comparar las variaciones espaciales e interanuales en la anchoveta (Engraulis ringens) y la sardina común (Strangomera bentincki) frente a la costa centro y sur de Chile. Dichos clupéidos constituyen dos importantes recursos pesqueros desde el punto de vista comercial, con capturas que han fluctuado entre 424 mil toneladas y 1.091 millones toneladas en el periodo 2000–2007. Se pescan con redes de cerco, teniendo como puerto principal de desembarque Talcahuano (fig. 1). Al igual que otros pelágicos menores, la sardina común y la anchoveta son especies de crecimiento rápido, pero de vida relativamente corta («4 años, Aguayo y Soto 1978, Cubillos et al. 2001), maduración temprana al final de su primer año de vida (Cubillos et al. 1999), desovantes parciales de fecundidad indeterminada (Cubillos et al. 2007), y una mayor tasa de mortalidad natural (Cubillos et al. 2002).

Ambas especies viven en un ambiente altamente productivo (Daneri et al. 2000) donde ocurren surgencias estacionales de mediados de septiembre a marzo (primavera–verano austral) (Arcos y Navarro 1986, Sobarzo et al. 2007), y su estrategia reproductiva se basa en una estrategia de acopio de energía (Cubillos et al. 2001); esto es, en el capital reproductor. La biomasa del stock de reproductores de ambas especies ha sido evaluada por el MPDH desde 2002 (Cubillos et al. 2007), cuya correcta aplicación depende de parámetros reproductivos claves.
El principal objetivo de este artículo es detectar los cambios espaciales e interanuales en la fecundidad parcial, e inferir tácticas reproductivas que pudieran afectar el potencial reproductivo de anchovetas y sardinas. Para ello se analizaron datos de muestreos por el MPDH realizados durante el periodo 2002–2007. Al final se contrastaron las fecundidades relativas de la anchoveta y la sardina común con las de especies similares que habitan aguas de surgencia y oligotróficas alrededor del mundo.
MATERIAL Y MÉTODOS
Área de estudio y descripción de los muestreos
El área de estudio está localizada frente a la costa centro y sur de Chile, entre Constitución (35° S) y Punta Galera (40° S), dentro de una franja de 10 millas náuticas mar adentro (fig. 1). Los muestreos fueron realizados durante los máximos desoves de sardinas y anchovetas, entre agosto y septiembre (Cubillos et al. 2001), en muestreos de adultos de 2002 a 2005 y 2007. En 2006 no se realizó muestreo alguno. En cada muestreo se recolectaron especímenes a bordo a partir de capturas obtenidas por ocho barcos cerqueros (de 18 m de eslora), cuatro de los cuales operaban entre Constitución y el golfo de Arauco (zona centro, 35°S–37°10' S), y el resto entre 38°20' S y 40°S (zona sur, fig. 1).
Muestreo y procedimientos de laboratorio
En cada muestreo de adultos se utilizaron dos estrategias para obtener especímenes de anchoveta y sardina común: (1) en cada lance de pesca se seleccionaron hembras con ovarios hidratados, y (2) se muestrearon al azar hembras maduras de cada encierre. Fue necesario seleccionar hembras hidratadas porque usualmente los lances de pesca eran realizados durante el día, cuando las probabilidades de observar hembras hidratadas eran menores.
Para la fecundidad parcial se seleccionaron todos los especímenes con ovocitos macroscópica y visiblemente hidratados de cada lance de pesca. Cada hembra hidratada fue disectada mediante incisión en el vientre medio y preservada en una solución de formaldehido al 10% para su subsecuente análisis histológico. El número efectivo de hembras con ovarios hidratados (verificados histológicamente) para fecundidad parcial fue menor que el de hembras maduras (tabla 1). El número de especímenes hidratados por estrato geográfico se encontró desbalanceado para la sardina, en cuyo caso sólo en 2007 el número de especímenes fue suficiente para llevar a cabo una comparación espacial, mientras que el número de anchovetas hembras fue suficiente para tal comparación durante el período de estudio (tabla 1).
Para las hembras maduras se utilizó un muestreo de dos etapas en el que se estableció como primera etapa el número de lance de pesca, y como segunda etapa se consideró un número fijo de especímenes por lance de pesca. No obstante, debido a la generalmente corta duración de los cruceros y a que las especies se encontraban mezcladas en las capturas, el número efectivo de lances de pesca fluctuó entre 4 y 32 para la sardina común y entre 9 y39 para la anchoveta. El promedio de especímenes por lance fluctuó entre 19 y 43 en el caso de la sardina, y entre 24 y 40 para la anchoveta (tabla 1). Cada pez fue disectado por incisión ventral media y preservado en una solución amortiguada de formaldehido al 10%. En el laboratorio, a cada hembra preservada se midió la longitud total y se obtuvo peso total y peso sin gónadas; es decir, peso total menos el peso de los ovarios.
Los ovarios de hembras con huevos hidratados apropiados para la estimación de fecundidad parcial fueron pesados y preservados para su posterior análisis histológico para confirmar este estado en particular, de acuerdo a los criterios de Hunter et al. (1985) y Hunter y Macewicz (1985). Se obtuvo un factor de corrección para convertir el peso en formol a peso corporal en fresco con base en una muestra de 30 organismos de cada especie, de acuerdo a los procedimientos descritos por Hunter (1985). En promedio, la preservación en la solución de formaldehido causó un incremento de 5.2% en el peso de la anchoveta y uno de 3.91% en el de la sardina, en un periodo de 63 días. Este factor de corrección no se aplicó al peso de los ovarios debido a que se utilizó el método gravi–métrico (ver más abajo).
Fecundidad parcial
La fecundidad parcial, definida como el número de ovocitos hidratados en el ovario, se estimó mediante el método gravimétrico (Hunter et al. 1985). Sólo se utilizaron ovarios con ovocitos hidratados y sin folículos postovulatorios, ya que de lo contrario se puede subestimar la fecundidad parcial. De cada ovario se tomaron tres subsecciones (anterior, media y posterior), se pesaron (0.1 mg), y se contaron manualmente los ovocitos hidratados de cada subsección. La densidad ovárica media de ovocitos hidratados (número de ovocitos por gramo de tejido ovárico) de cada subsección no difirió significativamente (ANOVA, P > 0.05) ni para la sardina ni para la anchoveta en cada año. Por lo tanto, la fecundidad parcial fue calculada como el producto del promedio de ovocitos por gramo de sección ovárica, por el peso total del ovario.
La fecundidad parcial se encontró relacionada con el peso de las hembras sin ovarios por el modelo lineal:

donde Wj* es el peso sin ovarios de la j–ésima hembra, y a and b son parámetros a estimarse mediante regresión lineal. La fecundidad parcial también se relacionó con el peso total sin ovarios de acuerdo al modelo potencial:

donde a' y b' son parámetros estimados mediante regresión lineal por transformación logarítimica de la fecundidad parcial y el peso corporal. Además, la fecundidad parcial se relacionó con la longitud total de las hembras de acuerdo con el siguiente modelo potencial:

en el que Lj es la longitud total de la j–ésima hembra, y q y p son parámetros a estimarse por regresión lineal previa transformación logarítmica a fecundidad parcial y longitud total.
La fecundidad parcial media para las hembras maduras de cada lance se estimó mediante:

donde 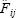 es la fecundidad parcial de la j–ésima hembra en el i–ésimo lance, estimada a partir de la ecuación (1), y m¡ es el número total de hembras maduras en el i–ésimo lance de pesca. El promedio global de fecundidad parcial
es la fecundidad parcial de la j–ésima hembra en el i–ésimo lance, estimada a partir de la ecuación (1), y m¡ es el número total de hembras maduras en el i–ésimo lance de pesca. El promedio global de fecundidad parcial  se obtuvo mediante el estimador de proporciones:
se obtuvo mediante el estimador de proporciones:
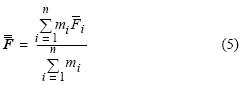
donde n es el número total de lances analizados. La varianza de la fecundidad parcial media se calculó de acuerdo con Hunter et al. (1985), i.e.

donde sh– es la varianza de la relación lineal fecundidad–peso (ecuación 1), nh el número de hembras hidratadas usado para ajustar la regresión,  el promedio de peso sin ovarios en el i–ésimo lance,
el promedio de peso sin ovarios en el i–ésimo lance,  el promedio de peso sin ovarios de las nhhembras hidratadas, y s2h la varianza de la pendiente de la regresión (ecuación 1).
el promedio de peso sin ovarios de las nhhembras hidratadas, y s2h la varianza de la pendiente de la regresión (ecuación 1).
El peso medio total de las hembras maduras se calculó mediante el estimador de proporciones (Picquelle y Stauffer 1985), y su varianza mediante

donde  es la estimación del peso medio, n el número de lance de pesca,
es la estimación del peso medio, n el número de lance de pesca, 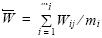 el peso medio del i–ésimo lance, mi el número de hembras maduras muestreadas en cada lance, y yij el valor calculado para la j–ésima hembra del i–ésimo lance de pesca. Una vez estimados los parámetros para los adultos, la fecundidad relativa se calculó dividiendo el promedio de fecundidad entre el promedio total de peso y también entre el peso corporal (fecundidad somática relativa). Finalmente se comparó la fecundidad relativa estimada en este estudio con la fecundidad de otros clupéidos que se distribuyen alrededor del mundo y cuyas estimaciones fueron obtenidas mediante una revisión bibliográfica.
el peso medio del i–ésimo lance, mi el número de hembras maduras muestreadas en cada lance, y yij el valor calculado para la j–ésima hembra del i–ésimo lance de pesca. Una vez estimados los parámetros para los adultos, la fecundidad relativa se calculó dividiendo el promedio de fecundidad entre el promedio total de peso y también entre el peso corporal (fecundidad somática relativa). Finalmente se comparó la fecundidad relativa estimada en este estudio con la fecundidad de otros clupéidos que se distribuyen alrededor del mundo y cuyas estimaciones fueron obtenidas mediante una revisión bibliográfica.
Análisis espacial y temporal
Se utilizó la técnica del modelo lineal generalizado (MLG) para detectar cambios espaciales y temporales en la fecundidad parcial de cada especie. El MLG se expresó mediante:
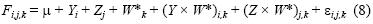
donde F¡jk es la fecundidad parcial en el i–ésimo año, la j–ésima zona, y la k–ésima hembra, \i es la ordenada al origen, Y¡ es el efecto anual, Zj es el efecto zonal, y Wk* es el peso sin ovarios de la k–ésima hembra, (Y × W*)i,k y (Z × W*)ik son las interacciones bidireccionales entre el peso de las hembras y el año o la zona, y εiJk es el factor de error distribuido de manera normal; es decir, N(0,σF2). En el MLG se usó la familia gaussiana y enlace identidad. Se usó la misma aproximación para estudiar la variación de la fecundidad parcial en relación con la longitud total de las hembras, y el análisis de devianza para buscar diferencias significativas en la fecundidad parcial entre años y zonas. Se usó la paquetería MASS de Venables y Ripley (2002) para el lenguaje y el software R (Ihaka y Gentleman 1986).
RESULTADOS
La fecundidad parcial de la anchoveta y la sardina común resultó significativa y positivamente relacionada con el peso corporal de las hembras para cada año y zona analizados (fig. 2, tabla 2). El desempeño estadístico entre los modelos lineal y potencial fue casi idéntico para la relación entre la fecundidad parcial y el peso corporal en términos del coeficiente de determinación (r2) (tabla 2). De manera similar, la fecundidad parcial incrementó significativamente con la longitud total de las hembras (tabla 2). En la mayoría de los casos los modelos mostraron un mayor coeficiente de determinación con la sardina que con la anchoveta (tabla 2).
El MLG desarrollado para analizar la variación espacial y temporal de la fecundidad parcial no mostró ningún efecto significativo del año o la zona en las relaciones fecundidad–peso, ni en la anchoveta ni en la sardina (tabla 3). En cambio, el año si mostró un efecto significativo en las relaciones fecundidad–longitud para ambas especies, así como la zona para la sardina (tabla 3); sin embargo, no se observó variación espacial (P = 0.963) en el caso de las relaciones fecundidad–longitud para la anchoveta.
Para la estimación de la fecundidad media de las hembras maduras, durante el periodo de estudio se obtuvieron 7966 anchovetas maduras de las cuales 54.7% fueron recolectadas en la zona central y 45.3% en la zona sur; en el caso de la sardina se obtuvieron 6545 hembras maduras, 62.2% en la zona central y 37.8% en la zona sur. El peso medio de las anchovetas maduras en la zona central varió entre 11.68 y 22.67 g, mientras que en la zona sur varió entre 19.20 y 22.82 g; para la sardina, el peso medio fluctuó entre 11.25 y 24.31 g en la zona central y entre 13.96 y 24.56 g en la zona sur. El peso medio de las hembras de ambas especies tendió a ser mayor en la zona sur (tabla 4).
El promedio de fecundidad parcial de la anchoveta fluctuó entre 4283 y 8837 ovocitos por hembra madura en la zona central. En la zona sur el promedio de fecundidad parcial fue menos variable en comparación con la zona central, y fluctuó entre 7260 y 8903 huevos por hembra madura. En el caso de la sardina el promedio de fecundidad parcial varió entre 5901 y 9267 huevos por hembra madura en la zona central, y entre 7069 y 10,414 en la zona sur. Los coeficientes de variación del promedio de fecundidad parcial estimados fueron en ambas especies menores a 12% (tabla 4).
La fecundidad parcial relativa de la anchoveta fluctuó entre 351 y 390 huevos g–1 de peso total de hembra madura, y entre 376 y 434 huevos g–1 cuando se consideró el peso corporal de las hembras maduras (tabla 4). La fecundidad relativa de la sardina fue mayor comparada con la anchoveta excepto en 2007, y fluctuó entre 381 y 539 huevos g–1 de peso total de las hembras maduras, y entre 406 y 583 huevos g–1 de peso corporal de las mismas (tabla 4).
DISCUSIÓN
En el desove parcial de los peces con fecundidad indeterminada los ovocitos hidratados representan el desove parcial separado de la diversa población de ovocitos restantes (Hunter et al. 1985). Aunque la duración del estadio correspondiente al ovario hidratado está limitada a unas cuantas horas de un día, y por tanto es difícil de ser muestreado, este particular estadio ha sido el más utilizado y confiable método para estimar la fecundidad parcial en casos de fecundidad anual indeterminada, aunque otros estadios de desarrollo ovocíticos pueden ser igualmente precisos (Ganias et al. 2004).
Según Hunter et al. (1985), el modelo lineal simple es preferible para modelar la fecundidad parcial como función del peso corporal en términos de la aplicación del MPDH, ya que la varianza puede fácilmente propagarse para calcular la fecundidad parcial media. No obstante, y desde un punto de vista biológico, el modelo potencial con un exponente mayor a 1 en la relación entre fecundidad parcial y peso corporal sugiere que aquella está relacionada alométricamente con éste, principalmente en la anchoveta. En el caso de la fecundidad parcial contra longitud total, usualmente es mejor un modelo potencial porque los ovocitos en un ovario determinado ocupan un volumen determinado. Para predecir la fecundidad potencial podría ser preferible usar la longitud total de las hembras debido a que el peso corporal puede variar estacionalmente, y porque la mayoría de los datos de las pesquerías están estructurados por tallas (Blanchard et al. 2003, Thorsen et al. 2006, Alonso–Fernández et al. 2008). Sin embargo, el factor de condición de las hembras puede ser una covariante significativa a considerar en la relación entre fecundidad y longitud (Thorsen et al. 2006).
Para la anchoveta, las pendientes asociadas con la interacción entre año y peso corporal no difirieron entre años ni entre zonas. Este es un resultado importante en términos de la aplicación del MPDH usado en el cómputo de la biomasa desovante (Cubillos et al. 2007). De hecho, si en un dado año no hay disponibles hembras de anchoveta con ovarios que contengan ovocitos hidratados (o en estadio de núcleo migratorio), entonces sería muy recomendable usar una ecuación general de regresión. En clupéidos no es tan inusual un modelo global de regresión para la fecundidad parcial; por ejemplo, Macewicz et al. (1996) y Lo et al. (2005) encontraron una relación bastante estable para la sardina del Pacífico (Sardinops sagax) frente a California.
En la anchoveta el tamaño del ovocito es independiente de la talla de la hembra (Leal et al. 2009); por lo tanto es de esperar que el número de ovocitos por peso de ovario sea constante. De esta manera la fecundidad parcial relativa podría ser suficiente para modelar la fecundidad parcial de la especie, dado que la pendiente interanual fecundidad parcial–peso corporal no es significativa. Llanos–Rivera y Castro (2004) reportaron un gradiente latitudinal en el tamaño de huevo de la anchoveta a lo largo de la costa chilena, localizando huevos planctónicos más grandes en la zona sur frente a Chile (37° S) y más chicos frente a la costa norte (21° S). Leal et al. (2009) compararon el tamaño de los ovocitos con la fecundidad parcial en esas dos contrastantes areas de desove de la anchoveta frente a Chile y sugirieron que el costo de producir ovocitos más grandes para la subpoblación del sur parece estar relacionado con una reducción en la fecundidad. Por ello, la menor fecundidad relativa de la anchoveta en su distribución más austral dentro del Sistema de la Corriente de Humboldt podría deberse a la influencia maternal en condiciones ambientales más adversas (Castro et al. 2009, Brochier et al. 2009).
Otro resultado para la anchoveta fue que las ordenadas al origen no fueron significativamente diferentes de cero y, por lo tanto, la fecundidad relativa podría ser utilizada para modelar la fecundidad parcial para un amplio rango de hembras maduras. Sin embargo, al compararla con la de la sardina, la fecundidad parcial de la anchoveta tiene mucha varianza alrededor de la regresión lineal, lo que implica una mayor plasticidad. De esta manera, las fluctuaciones de la producción de huevos de las hembras de anchoveta podrían ser más variables que las de sardina dependiendo del número de desoves, que a su vez también depende del tamaño (Claramunt et al. 2007). Cabe mencionar que todos los aspectos aquí mencionados sólo son válidos para la relación entre fecundidad parcial y peso corporal en el punto máximo de la temporada de desove, ya que todas las relaciones fueron obtenidas mediante el MPDH. De hecho, la fecundidad parcial puede variar por temporadas, tal y como lo han reportado para la merluza europea (Merluccius merluccius) Murua et al. (2006). Además, de acuerdo con Lambert (2008), la suposición de que la producción de huevos por unidad de biomasa no varía con el tiempo carece de fundamento, ya que la fecundidad varía en relación con la calidad parental (es decir, tiene efectos maternales, Solemdal 1997), la disponibilidad de recursos (es decir, abundancia y calidad del alimento), y factores ambientales (por ejemplo, temperatura, Takasuka et al. 2005) y evolutivos probablemente asociados a la presión pesquera (Marshall y Browman 2007).
En el caso de la sardina común, la relación entre fecundiad parcial y peso corporal mostró diferencias interanuales en la pendiente y ordenada al origen de los modelos lineales. Desde un punto de vista estadístico la varianza alrededor de las líneas de regresión fue baja comparada con la de la anchoveta. Por ello, pequeños cambios en la distribución de la fecundidad parcial, derivados de ovarios muestreados en un año dado, pueden generar diferencias interanuales. Además, los cambios en la fecundidad relativa parecen ser la causa de la variación en la fecundidad parcial ya que algunas relaciones lineales son mejor descritas por dos parámetros (ordenada al origen y pendiente), mientras que otras son mejor descritas tan sólo por la pendiente (sin una ordenada al origen significativa).
Desde un punto de vista biológico, probablemente los cambios en la fecundidad relativa podrían ser una fuente de variación en estas especies. Otros factores adicionales o covariantes tales como la temperatura, el factor de condición o el suministro de alimento podrían también afectar la fecundidad parcial (Takasuka et al. 2005). Aunque la pendiente no ha resultado significativamente diferente entre zonas, las diferencias interanuales sustentan la idea de que en esta especie la biomasa del stock de reproductores podría no ser un buen indicador del potencial reproductivo. Por ello, en el caso de la sardina deberían darse seguimiento a mediciones directas de la producción de huevos. Aunque la sardina almacena durante el verano energía que utilizará para su reproducción el invierno siguiente (Cubillos et al. 2001, Cubillos y Claramunt 2009), otra posible táctica reproductiva es que su producción de huevos sea soportada directamente por la ingesta alimenticia y las condiciones prevalecientes en su hábitat reproductivo, tal y como ha sido propuesto por Ganias (2009) para Sardina pilchardus.
A pesar de la variación interanual en la fecunidad relativa parcial de la sardina común, el rango de 406 a 583 huevos g–1 de peso corporal parece ser similar a las estimaciones disponibles para especies similares de los géneros Sardinops, Sardina, Sprattus y Sardinella (tabla 5). En contraste, el rango entre 376 y 434 huevos g–1 de peso corporal de la anchoveta parece se menor en comparación con otras especies del mismo género como E. japonica, E. anchoita, E. capensis, E. encrassicolus y E. mordax, y aún con la misma especie en aguas peruanas y en el norte de Chile (tabla 6).
De acuerdo con los criterios de Murua y Saborido–Rey (2003), las estrategias reproductivas de las hembras de la anchoveta y la sardina común pueden ser clasificadas como iteróparas, con desarrollo ovocítico asíncrono, fecundidad indeterminada, y desoves parciales. No es de sorprender esta idéntica estrategia reproductiva dado que ambas especies concurren y se mezclan en varios tipos de agregaciones (Gerlotto et al. 2004), y tienen características biológicas similares como distribución espacial, tasa de crecimiento, mortalidad natural, época roproductiva y zona de desove (Cubillos et al. 2001, Castillo–Jordán et al. 2007). Cubillos y Claramunt (2009) documentaron que el ciclo estacional reproductivo era afectado por el tamaño de las hembras. En la sardina, las hembras más grandes tienden a reproducirse antes que aquellas que lo hacen por primera vez, mientras que las hembras de las anchovetas son más síncronas, con una tendencia de las hembras más grandes a reproducirse después que las que se reproducen por primera vez. En este trabajo la principal diferencia encontrada entre las especies fue la relacionada con el promedio de la fecundidad parcial, mediada por diferencias en la estructura de tallas entre zonas, como lo reveló el peso medio de las hembras. En consecuencia, aunque las estrategias reproductivas de la anchoveta y la sardina común sean similares (Cubillos et al. 2001, Castillo–Jordán et al. 2007), la influencia de la longitud o estructura de tallas en el ciclo de desove (Cubillos y Claramunt 2009) y la fecundidad parcial parecieron constituir la principal diferencia entre especies en el hábitat de desove central y sur de ambas especies, con implicaciones para su potencial reproductivo.
AGRADECIMIENTOS
Esta investigación fue financiada por el Fondo de Investigación Pesquera (FIP) de Chile (http://www.fip.cl) mediante las becas FIP 2002–14, FIP 2003–06, FIP 2004–03, FIP 200502 y FIP 2007–06. Los autores agradecen a los técnicos y a la tripulación de los barcos de pesca su arduo trabajo a bordo, y a los colegas y amigos que participaron en el primer SIBECORP sus sugerencias y discusión de algunos tópicos aquí documentados. El trabajo experimental cumplió con las leyes chilenas en vigor.
REFERENCIAS
Aguayo HM, Soto SB. 1978. Edad y crecimiento de la sardina común (Clupea (Strangomera) bentincki) en Coquimbo y Talcahuano. Invest. Pesq. (Chile) 27: 1–55. [ Links ]
Andamari R, Milton DA. 1998. Reproductive biology of anchovies (Encrasicholina heterolobus and Encrasicholina devisi) from Bacan Island. Indon. Fish. Res. J. 4: 40–45. [ Links ]
Andamari R, Milton D, Zubaidi T. 2002. Reproductive biology of five species of anchovies (Engraulidae) from Bima Bay, Sumbawa, Nusa Tenggara. Indon. J. Agric. Sci. 3: 37–42. [ Links ]
Alheit J. 1989. Comparative spawning biology of anchovies, sardines, and sprats. Rapp. P.–V. Reun. Cons. Int. Explor. Mer 191: 7–14. [ Links ]
Alheit J. 1993. Use of the daily egg production method for estimating biomass of clupeoid fishes: A review and evaluation. Bull. Mar. Sci. 53: 750–767. [ Links ]
Alonso–Fernández A, Domínguez–Petit R, Bao M, Rivas C, Saborido–Rey F. 2008. Spawning pattern and reproductive strategy of female pouting Trisopterus luscus (Gadidae) on the Galician shelf of north–western Spain. Aquat. Living Resour. 21: 383–393. [ Links ]
Aoki I, Murayama T. 1993. Spawning pattern of the Japanese sardine Sardinops melanostictus off southern Kyushu and Shikoku, southwestern Japan. Mar. Ecol. Prog. Ser. 97: 127–134. [ Links ]
Arancibia H, Cubillos L, Remmaggi J, Alarcón R. 1994. Determinación de la talla de madurez sexual y fecundidad parcial en la sardina común, Strangomera bentinki (Norman, 1936), del área de Talcahuano, Chile. Biol. Pesq. 23: 11–17. [ Links ]
Arcos DF, Navarro N. 1986. Análisis de un índice de surgencia para la zona de Talcahuano, Chile (Lat. 37° S). Invest. Pesq. (Chile) 33: 91–98. [ Links ]
Blanchard JL, Frank KT, Simon JE. 2003. Effects of condition on fecundity and total egg production of eastern Scotian Shelf haddock (Melanogrammus aeglefinus). Can. J. Fish. Aquat. Sci. 60: 321–332. [ Links ]
Brochier T, Colas F, Lett C, Echevin V, Cubillos LA, Tam J, Chlaida M, Mullon C, Fréon P. 2009. Small pelagic fish reproductive strategies in upwelling systems: A natal homing evolutionary model to study environmental constraints. Prog. Oceanogr. 83: 261–269. [ Links ]
Buitrón B, Perea A. 2000. Aspectos reproductivos de la anchoveta peruana durante el periodo 1992– 2000. Bol. Inst. Mar Perú 19: 45–54. [ Links ]
Casavola N, Marano G, Rizzi E. 1996. Batch fecundity of Engraulis encrasicolus L. in the south–western Adriatic sea. Sci. Mar. 60: 369–377. [ Links ]
Castillo–Jordán C, Cubillos LA, Paramo J. 2007. The spawning spatial structure of two co–occurring small pelagic fish off central southern Chile in 2005. Aquat. Living Resour. 20: 77–84. [ Links ]
Castro LR, Claramunt G, Krautz MC, Llanos–Rivera A, Moreno P. 2009. Egg trait variation in anchoveta Engraulis ringens: A maternal response to changing environmental conditions in contrasting spawning habitats. Mar. Ecol. Prog. Ser. 381: 237–248. [ Links ]
Claramunt G, Roa R. 2001. An indirect approach of estimating spawning fraction as applied to Sardinops sagax from northern Chile. Sci. Mar. 65: 87–94. [ Links ]
Claramunt G, Herrera G, Pizarro P. 1993. Fluctuations of the partial fecundity in the Spanish sardine (Sardinops sagax) during the main spawning season in 1990, in the northern region of Chile. Sci. Mar. 57: 9–14. [ Links ]
Claramunt G, Serra R, Castro LR, Cubillos LA. 2007. Is the spawning frequency dependent on female size? Empirical evidence in Sardinops sagax and Engraulis ringens off northern Chile. Fish. Res. 85: 248–257. [ Links ]
Cubillos LA, Claramunt G. 2009. Length–structured analysis of the reproductive season of anchovy and common sardine off central southern Chile. Mar. Biol. 156: 1673–1680. [ Links ]
Cubillos L, Canales M, Bucarey D, Rojas A, Alarcón R. 1999. Época reproductiva y talla media de primera madurez sexual de Strangomera bentincki y Engraulis ringens en el periodo 1993–1997, zona centro–sur de Chile (1993–97). Invest. Mar. 28: 73–85. [ Links ]
Cubillos LA, Arcos DF, Bucarey DA, Canales MT. 2001. Seasonal growth of small pelagic fish off Talcahuano, Chile (37° S, 73° W): A consequence of their reproductive strategy to seasonal upwelling? Aquat. Living Resour. 14: 115–124. [ Links ]
Cubillos LA, Bucarey DA, Canales M. 2002. Monthly abundance estimation for common sardine Strangomera bentincki and anchovy Engraulis ringens in the central–southern area off Chile (34–40°S). Fish. Res. 57: 117–130. [ Links ]
Cubillos LA, Ruiz P, Claramunt G, Gacitúa S, Núñez S, Castro LR, Riquelme K, Alarcón C, Oyarzún C, Sepúlveda A. 2007. Spawning, daily egg production, and spawning stock biomass estimation for common sardine (Strangomera bentincki) and anchovy (Engraulis ringens) off central southern Chile in 2002. Fish. Res. 86: 228–240. [ Links ]
Daneri G, Dellarossa V, Quiñones R, Jacob B, Montero P, Ulloa O. 2000. Primary production and community respiration in the Humboldt Current System off Chile and associated oceanic areas. Mar. Ecol. Prog. Ser. 197: 41–19. [ Links ]
Ganias K. 2009. Linking sardine spawning dynamics to environ–mental variables. Estuar. Coast. Shelf Sci. 84: 402–208. [ Links ]
Ganias K, Somarakis S, Machias A, Theodorou A. 2004. Pattern of oocyte development and batch fecundity in the Mediterranean sardine. Fish. Res. 67: 13–23. [ Links ]
Gerlotto F, Castillo J, Saavedra A, Barbieri MA, Espejo M, Cotel P. 2004. Three–dimensional structure and avoidance behaviour of anchovy and common sardine schools in central southern Chile. ICES J. Mar. Sci. 61: 1120–1126. [ Links ]
Hunter JR. 1985. Preservation of northern anchovy in formaldehyde solution. In: Lasker R (ed.), An egg production method for estimating spawning biomass of pelagic fish: Application to the northern anchovy, Engraulis mordax. US Dep. Comm., NOAA Tech. Rep. NMFS 36: 63–66. [ Links ]
Hunter JR, Goldberg SR. 1980. Spawning incidence and batch fecundity in northern anchovy Engraulis mordax. Fish. Bull. 77: 641–652. [ Links ]
Hunter JR, Macewicz B. 1980. Sexual maturity, batch fecundity, spawning frequency, and temporal pattern of spawning for the northern anchovy, Engraulis mordax, during the 1979 spawning season. CalCOFI Rep. 21: 139–149. [ Links ]
Hunter JR, Macewicz B. 1985. Measurements of spawning frequency in multiple spawning fish. In: Lasker R (ed.), An egg production method for estimating spawning biomass of pelagic fish: application to the northern anchovy, Engraulis mordax. US Dept. Comm., NOAA Tech. Rep. NMFS 36: 79–94. [ Links ]
Hunter JR, Lo NCH, Leong RJH. 1985. Batch fecundity in multiple spawning fishes. In: Lasker R (ed.), An egg production method for estimating spawning biomass of pelagic fish: Application to the northern anchovy, Engraulis mordax. US Dept. Comm., NOAA Tech. Rep. NMFS 36: 67–77. [ Links ]
Ihaka R, Gentleman R. 1996. R: A language for data analysis and graphics. J. Comput. Graph. Stat. 5: 299–314. [ Links ]
Isaac–Nahum VJ, Cardoso R, Servo G, Rossi–Wongtshowski CLB. 1988. Aspects of the spawning biology of the Brazilian sardine Sardinella brasilensis (Steindachner, 1879) (Clupeidae). J. Fish Biol. 32: 383–396. [ Links ]
Kjesbu OS, Klungsoyr J, Kryvi H, Witthames PR, Greer Walker M. 1991. Fecundity, atresia, and egg size of captive Atlantic cod (Gadus morhua) in relation to proximate body composition. Can. J. Fish. Aquat. Sci. 48: 2333–2343. [ Links ]
Kjesbu OS, Witthames PR, Solemdal P, Walker MG. 1998. Temporal variations in the fecundity of Arcto–Norwegian cod (Gadus morhua) in response to natural changes in food and temperature. J. Sea Res. 40: 303–321. [ Links ]
Lambert Y. 2008. Why should we closely monitor fecundity in marine fish populations? J. Northwest Atl. Fish. Sci. 41: 93–106. [ Links ]
Leal EM, Castro LR, Claramunt G. 2009. Variability in oocyte size and batch fecundity in anchoveta (Engraulis ringens, Jenyns 1842) from two spawning areas off the Chilean coast. Sci. Mar. 73: 59–66. [ Links ]
Llanos–Rivera A, Castro LR. 2004. Latitudinal and seasonal egg–size variation of the anchoveta (Engraulis ringens) off the Chilean coast. Fish. Bull. 102: 207–212. [ Links ]
Lo NCH, Macewicz BJ, Griffith DA. 2005. Spawning biomass of Pacific sardine (Sardinops sagax), from 1994–2004 off California. CalCOFI Rep. 46: 93–112. [ Links ]
Maack G, George MR. 1999. Contribution to the reproductive biology of Encrasicholina punctifer (Engraulidae) from West Sumatra. Indon. Fish. Res. J. 44: 113–120. [ Links ]
Macewicz BJ, Castro–González JJ, Cotero–Altamirano CE, Hunter JR. 1996. Adult reproductive parameters of Pacific sardine (Sardinops sagax) during 1994. CalCOFI Rep. 37: 140–151. [ Links ]
MacGregor JS. 1957. Fecundity of Pacific sardine (Sardinops caerulea). Fish. Bull. 57: 427–449. [ Links ]
Marshall CT, Browman HI. 2007. Disentangling the causes of maturation trends in exploited fish populations. Mar. Ecol. Prog. Ser. 335: 249–251. [ Links ]
Marshall CT, O'Brien L, Tomkiewicz J, Kõster FW, Kraus G, Marteinsdottir G, Morgan MJ, Saborido–Rey F, Blanchard JL, Secor DH, Wright PJ, Mukhina NV, Bjornsson H. 2003. Developing alternative indices of reproductive potential for use in fisheries management, case studies for spawning stocks, and information gradient. J. Northwest Atl. Fish. Sci. 33: 161–190. [ Links ]
Marshall CT, Needle CL, Thorsen A, Kjesbu OS, Yaragina NA. 2006. Systematic bias in estimates of reproductive potential of an Atlantic cod (Gadus morhua) stock: Implications for stock– recruit theory and management. Can. J. Fish. Aquat. Sci. 63: 980–994. [ Links ]
Marteinsdottir G, Begg GA. 2002. Essential relationships incorpo–rating the influence of age, size and condition on variables required for estimation of reproductive potential in Atlantic cod Gadus morhua. Mar. Ecol. Prog. Ser. 235: 115–256. [ Links ]
Mertz G, Myers RA. 1996. Influence of fecundity on recruitment variability of marine fish. Can. J. Fish. Aquat. Sci. 53: 1618–1625. [ Links ]
Miñano J. 1968. Estudio de la fecundidad y ciclo sexual de la anchoveta (Engraulis ringens J.) en la zona de Chimbote. Bol. Inst. Mar Perú 1: 505–533. [ Links ]
Motos L. 1996. Reproductive biology and fecundity of the Bay of Biscay anchovy population (Engraulis encrasicolus L.). Sci. Mar. 60: 195–207. [ Links ]
Motos L, Santiago YJ. 1990. An egg production estimate of the biomass of Bay of Biscay anchovy (Engraulis encrasicolus, L.) in 1989. ICES Doc. CM 1990/H: 26. [ Links ]
Mujica A, Rojas O. 1984. Fecundidad y estructura poblacional de sardina común (Clupea bentincki Norman). Invest. Pesq. (Chile) 31: 59–69. [ Links ]
Murua H, Saborido–Rey F. 2003. Female reproductive strategies of marine fish species of the North Atlantic. J. Northwest Atl. Fish. Sci. 33: 23–31. [ Links ]
Murua H, Lucio P, Santurtún M, Motos L. 2006. Seasonal variation in egg production and batch fecundity of European hake Merluccius merluccius (L.) in the Bay of Biscay. J. Fish Biol. 69: 1304–1316. [ Links ]
Oliva J, Barañados J, Tirado M. 1989. Determinación de la fecundidad y frecuencia del desove de la sardina (Sardinops sagax), 1986. Memorias del Simposio Internacional de los Recursos Vivos y las Pesquerías en el Pacífico Sudeste, Viña del Mar, Chile, 9–13 mayo 1988. CPPS. Rev. Pacífico Sur (Núm. Esp.), pp. 341–348. [ Links ]
Pájaro M, Macchi GJ, Sánchez RP. 1997. Fecundidad y frecuencia reproductiva de las poblaciones bonaerense y patagónica de anchoita argentina (Engraulis anchoita). Rev. Invest. Desarr. Pesq. 11: 19–38. [ Links ]
Palomera I, Pertierra JP. 1993. Anchovy biomass estimate by the daily egg production method in 1990 in the western Mediterranean Sea. Sci. Mar. 5: 243–251. [ Links ]
Parrish RH, Mallicoate D, Klingbeil RA. 1986. Age dependent fecundity, number of spawnings per year, sex ratio, and maturation stages in northern anchovy, Engraulis mordax. Fish. Bull. 84: 503–517. [ Links ]
Pérez N, Figueiredo I, Lo NCH. 1992. Batch fecundity of Sardina pilchardus (Walb.) off the Atlantic Iberian coast. Bol. Inst. Esp. Oceanogr. 8: 155–162. [ Links ]
Picquelle SJ, Stauffer G. 1985. Parameter estimation for an egg production method of northern anchovy biomass assessment. In: Lasker R (ed.), An egg production method for estimating spawning biomass of pelagic fish: Application to the northern anchovy, Engraulis mordax. US Dept. Comm., NOAA Tech. Rep. NMFS 36: 7–15. [ Links ]
Ribeiro R, Reis J, Santos C, Gonçalves F, Soares A. 1996. Spawning of anchovy Engraulis encrasicolus in the Mondego Estuary, Portugal. Estuar. Coast. Shelf Sci. 42: 467–482. [ Links ]
Sobarzo M, Bravo L, Donoso D, Garcés–Vargas J, Schneider W. 2007. Coastal upwelling and seasonal cycles that influence the water column over the continental shelf off central Chile. Prog. Oceanogr. 75: 363–382. [ Links ]
Solemdal P. 1997. Maternal effects: A link between the past and the future. J. Sea Res. 37: 213–227. [ Links ]
Somarakis S, Palomera I, García A, Quintanilla L, Koutsikopoulos C, Uriarte A, Motos L. 2004. Daily egg production of anchovy in European waters. ICES J. Mar. Sci. 61: 944–958. [ Links ]
Stratoudakis Y, Bernal M, Ganias K, Uriarte A. 2006. The Daily Egg Production Method (DEPM): Tecent advances, current applications and future challenges. Fish Fish. 7: 35–57. [ Links ]
Takasuka A, Oozeki Y, Kubota H, Tsuruta Y, Funamoto T. 2005. Temperature impacts on reproductive parameters for Japanese anchovy: Comparison between inshore and offshore waters. Fish. Res. 76: 475–482. [ Links ]
Thorsen A, Marshall CT, Kjesbu OS. 2006. Comparison of various potential fecundity models for north–east Arctic cod Gadus morhua L. using oocyte diameter as a standardizing factor. J. Fish Biol. 69: 1709–1730. [ Links ]
Venables WN, Ripley BD. 2002. Modern Applied Statistics with S. 4th ed. Springer–Verlag, New York. [ Links ]
Wright PJ. 1992. Ovarian development, spawning frequency and batch fecundity in Encrasicholina heteroloba (Ruppell 1958). J. Fish Biol. 40: 833–844. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.
Traducido al español por Manuel Gardea–Ojeda.














