Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.37 no.3 Ensenada Set. 2011
Regionalización ecológica de las colonias reproductivas de Zalophus californianus, como herramienta para su conservación en el Golfo de California*
Ecological regionalization of Zalophus californianus rookeries, as a tool for conservation in the Gulf of California
D Szteren1*, D Aurioles–Gamboa2
1 Sección Zoología Vertebrados, Facultad de Ciencias, Iguá 4225, Montevideo, 11400, Uruguay.
2 Laboratorio de Ecología de Pinnipedos "Burney J Le Boeuf", Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional, Av. Instituto Politécnico Nacional s/n, Col. Playa Palo de Santa Rita, La Paz 23096, Baja California Sur, México.
*Corresponding author.
E–mail: diana@fcien.edu.uy
Received June 2010
Accepted March 2011
RESUMEN
Las colonias reproductivas del lobo marino de California (Zalophus californianus) en el Golfo de California están estructuradas genéticamente en diferentes grupos. A pesar de dicha evidencia de diferenciación regional, la población de lobo marino en el Golfo de California se maneja como una sola unidad; sin embargo, deberían considerarse las diferencias ecológicas entre las colonias a la hora de priorizar la asignación de recursos limitados y mejorar la eficiencia de las acciones de manejo. Esto es importante para poder definir y, posteriormente, manejar las colonias a nivel regional. El objetivo del presente estudio fue identificar patrones de similitud entre las colonias reproductivas del lobo marino de California en el Golfo de California con base en nueve bases de datos demográficas, biológicas, ecológicas y biogeoquímicas: censos poblacionales, contenido de metales traza en hueso, diversidad de dieta, presencia de serovariedades de Leptospira, isótopos estables, incidencia de osteoartritis, temperatura superficial del mar y concentración de clorofila a. Un segundo objetivo fue caracterizar cada región con base en dichas variables con el fin de focalizar los esfuerzos de manejo. Para examinar la estructura general de las colonias de lobo marino en el Golfo de California, se analizaron datos con diferentes combinaciones de variables y colonias mediante análisis multivariados. El escenario con el mayor poder explicativo resultó en la separación de las colonias en cuatro grupos: Golfo Norte, Ángel de la Guarda, Golfo Central y Golfo Sur. Las variables que más contribuyeron a la definición de los grupos fueron la diversidad de dieta y la temperatura superficial del mar. Las agrupaciones mostraron coherencia geográfica y fueron consistentes con las unidades genéticas previamente sugeridas y con las regiones oceanográficas del Golfo de California. El patrón multivariado resultante facilitará el manejo de las colonias del lobo marino de California, proveerá mejores herramientas de protección ante las contingencias ambientales y ayudará a guiar futuros planes de manejo.
Palabras clave: lobo marino de California, Golfo de California, agrupamiento, análisis multivariado, Zalophus californianus.
ABSTRACT
California sea lion (Zalophus californianus) rookeries in the Gulf of California are structured genetically in distinct groups. Despite this evidence for regional differentiation, the sea lion population of the Gulf of California is managed as a single unit. To prioritize the allocation of limited resources for conservation and to improve the effectiveness of management actions, ecological differences among rookeries should also be considered. This is important to be able to further define and subsequently manage the rookeries on a regional level. The aim of the present study was to identify patterns of similarity among California sea lion rookeries in the Gulf of California, using nine demographic, biological, ecological, and biogeochemical databases: population censuses, trace metal content in bone, diet diversity, presence of Leptospira serovarieties, stable isotopes, incidence of osteoarthritis, sea surface temperature, and chlorophyll a concentration. A second objective was to characterize each region on the basis of these variables in order to focus management efforts. To examine the overall structure of the sea lion rookeries in the Gulf of California, we analyzed data for different combinations of variables and rookeries using multivariate analysis. The scenario with the highest explanatory power resulted in the separation of the rookeries into four groups: Northern Gulf, Ángel de la Guarda, Central Gulf, and Southern Gulf. Diet and sea surface temperature were the variables that contributed most strongly to the definition of the groups. Groupings showed geographic coherence and were consistent with previously proposed genetic units and oceanographic regions of the Gulf of California. The resulting multivariate pattern should facilitate the management of California sea lion rookeries, provide better tools to protect against environmental contingencies, and help to guide future management plans.
Key words: California sea lion, Gulf of California, grouping, multivariate analysis, Zalophus californianus.
INTRODUCCIÓN
La distribución parchada de hábitats apropiados para la reproducción puede resultar en una estructura poblacional fragmentada a nivel regional de las colonias de pinnípedos. Esta subdivisión es probablemente una consecuencia de la fidelidad al sitio natal de las hembras, en una escala geográfica amplia (Campbell et al. 2008). Por otra parte, las condiciones oceanográficas regionales pueden sostener diferentes áreas de alimentación a las cuales se han adaptado las hembras, cuya dispersión está restringida por la necesidad de regresar a la colonia reproductiva a amamantar. La fidelidad al sitio y la filopatría tanto a los sitios reproductivos como a los de alimentación pueden promover procesos evolutivos al operar sobre la dinámica de metapoblaciones y la estructura genética, y también pueden tener un impacto en la estructura social (Pomeroy et al. 2000, Matthiopoulos et al. 2005, Wolf y Trillmich 2007). Es importante considerar las diferencias en las características ecológicas de las colonias reproductivas para mantener a los lobos marinos como partes funcionales del ecosistema, priorizar la distribución de los recursos escasos para la conservación y mejorar la efectividad de las acciones de manejo.
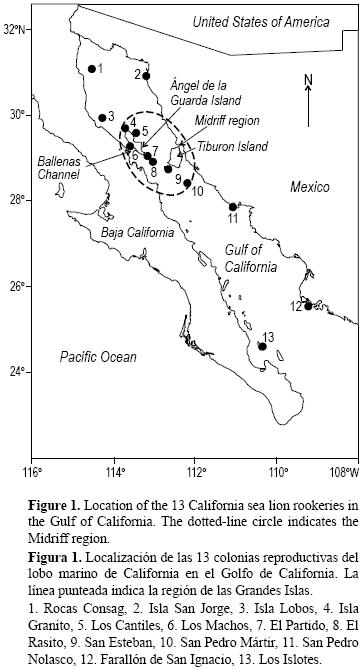
El lobo marino de California Zalophus californianus se distribuye ampliamente a lo largo de la costa del Pacífico de Norteamérica. Se encuentra desde la Columbia Británica, Canadá (51°N), hasta la costa sudoeste de México (19°N). La población global se estima en unos 355,000 individuos (Aurioles y Trillmich 2008). En México, el lobo marino se encuentra en ambas costas de la península de Baja California. La costa oeste de la península presenta una población estimada entre 75,000 y 87,000 individuos (Lowry y Maravilla–Chávez 2005), mientras que el Golfo de California tiene una población estimada entre 24,000 y 31,000 individuos (Szteren et al. 2006) distribuida en 13 colonias reproductivas (fig. 1). La población del Golfo de California declinó un 20% en la última década (Szteren et al. 2006); sin embargo, no se presentó un cuello de botella genético (González–Suárez et al. 2010). Hasta ahora, la población de lobo marino en el Golfo de California ha sido manejada como una única unidad. Las estrategias de manejo actuales se basan en la protección global de la especie por el gobierno mexicano (listada como "Protección Especial", NOM–059–ECOL–1994).
Estudios genéticos, basados en diferencias en el ADN mitocondrial heredado matrilinealmente, han mostrado que las colonias reproductivas en el Golfo de California se diferencian de las del Pacífico (Maldonado et al. 1995, Bowen et al. 2006) y que la población del golfo está estructurada en tres grupos genéticamente diferentes (norte, centro y sur) (Schramm et al. 2009). Usando ADN mitocondrial y loci de microsatélites, González–Suárez et al. (2009) sugirieron un patrón de aislamiento por distancia entre las colonias e identificaron tres unidades de manejo en México: alto Golfo de California, sur de la península de Baja California, y costa Pacífico superior de Baja California. La estructura poblacional se ha reflejado en varios estudios recientes que han examinado la diferenciación entre colonias según varios parámetros demográficos, biológicos y ecológicos. Por ejemplo, González–Suárez et al. (2006) sugirieron el agrupamiento de las colonias en cuatro grupos: Golfo Norte, Grandes Islas Norte, Grandes Islas Sur y Golfo Sur. Para ello, estos autores utilizaron datos de censos y distancia geográfica (desde la colonia más norteña hasta cada una de las restantes). Se encontraron los mismos grupos usando series de tiempo de abundancia para identificar subpoblaciones con modelos espacio–estado (Ward et al. 2010). Aunque los datos de censos contribuyeron a la definición de grupos de colonias reproductivas, esos datos por sí solos no son suficientes para describir cada región en relación con su salud, su ambiente y su posible susceptibilidad a perturbaciones ecosistémicas relacionadas con el ambiente o con las pesquerías. Aún faltan estudios que utilicen parámetros ecológicos u oceanográficos para caracterizar las colonias de cada región.
García–Rodríguez y Aurioles Gamboa (2004) encontraron diferencias en los hábitos alimentarios entre colonias como resultado de diferencias en las condiciones ambientales locales. Estos autores identificaron cuatro grupos de colonias con base en el análisis de la dieta. También se han detectado variaciones correspondientes en las firmas isotópicas de C y N, y diferencias de nivel trófico entre colonias (Porras–Peters et al. 2008); δ15N refleja el estatus trófico, mientras que el δ13C varía geográficamente indicando áreas de alimentación (e.g., costera vs oceánica, pelágica o bentónica). En este sentido, la señal isotópica refleja no sólo el alimento consumido y asimilado, sino también las condiciones oceanográficas del área de alimentación (Hobson et al. 1996). Por otro lado, la concentración de metales en tejidos de lobos marinos puede estar relacionada con la dieta y/o con las condiciones oceanográficas cerca de la colonia (Skoch 1990). La concentración en tejidos con baja tasa de renovación (como el hueso) representa la acumulación a lo largo de la vida de los individuos y, por lo tanto, puede ser una variable integradora importante en nuestro análisis, aunque aún no ha sido usada para investigar diferencias regionales.
Adicionalmente, se han identificado diferencias anatómicas en cráneos de machos adultos de tres zonas del Golfo de California (norte, centro, sur) y de la costa del Pacífico de California y Baja California (Zavaleta–Lizárraga 2003). En términos de salud, Pedernera (2004) informó que los patrones de prevalencia de serovariedades de Leptospira interrogans separaban las colonias de lobo marino en tres grupos. Estas bacterias, que entran a los organismos a través de mucosas o piel dañada, son transmitidas por contacto directo o indirecto a través de la orina, leche o fluidos infectados (Pedernera 2004). La presencia de anticuerpos contra diferentes serova–riedades está relacionada con la distancia geográfica entre las colonias, de manera que las que tengan mayor intercambio de animales compartirán más serovariedades. Por último, se han encontrado diferencias en los niveles de prevalencia de osteoartritis entre dos regiones del Golfo de California y una tercera región que incluye colonias de la costa del Pacífico (Díaz–Guzmán 2003). El origen de esta afección está ligado a una predisposición genética y su incidencia se correlacionó negativamente con el aislamiento geográfico.
Las características ambientales determinan el hábitat donde los lobos marinos mantienen sus colonias y se alimentan. La temperatura afecta principalmente la abundancia y distribución de las especies presa, mientras que la concentración de clorofila a es un indicador de la productividad primaria, que puede influenciar la abundancia de las presas de los lobos marinos a través de una cascada trófica ascendente (Soto et al. 2004, Le Boeuf y Crocker 2005). El Golfo de California es una cuenca de evaporación donde se presentan principalmente dos procesos de enriquecimiento: (1) una surgencia estacional a lo largo de las costas de los estados de Sonora y Baja California, México, y (2) una intensa mezcla de mareas producida en el golfo central (Santamaría–del–Ángel et al. 1994).
Se han propuesto varias regionalizaciones oceanográficas para el Golfo de California con base en diferentes variables y grados de detalle (e.g., Round 1967, Álvarez–Borrego 1983, Santamaría–del–Ángel et al. 1994, Lluch–Cota y Arias–Aréchiga 2000). En general, estos estudios definieron entre tres y cuatro zonas oceanográficas con un patrón norte–sur. En un estudio más reciente, Lluch–Cota (2004) describió cuatro zonas en el golfo con base en niveles de productividad primaria: el norte, el área de las Grandes Islas, la región central y la boca del Golfo de California.
Los estudios antes mencionados, basados en una sola variable, han mostrado diferencias entre las colonias de lobos marinos del Golfo de California y las aguas donde se alimentan. La existencia de tres grupos de lobos marinos genéticamente distintos en el Golfo de California (Schramm et al. 2009) implica que éstos deberían ser tratados por separado como diferentes unidades de manejo (González–Suárez et al. 2009, Schramm et al. 2009). Diversas variables ambientales y ecológicas afectan los sitios donde los lobos marinos se alimentan y mantienen colonias, ya sea directa o indirectamente, y esas variables deberían ser consideradas a la hora de establecer decisiones de manejo. Para ello, se propone un nuevo procedimiento de regionalización basado en un análisis multivariado de varios parámetros ecológicos y biológicos. Se generó un análisis completo para determinar el potencial de agrupamiento de las 13 colonias reproductivas de lobo marino en el Golfo de California. Se hipotetiza que diversas variables biológicas y ecológicas de la población de Z. californianus en el Golfo de California reflejarán una regionalización coherente que puede ser usada para identificar unidades ecológicas. Se espera que estas unidades se asocien con el arreglo genético propuesto por Schramm (2009) y con características oceanográficas locales.
El objetivo del presente trabajo fue agrupar las colonias de lobo marino en regiones de manejo y caracterizar cada región con base en las variables clasificadoras. Una regionalización ecológica facilitará las decisiones de manejo en respuesta a eventos que pueden amenazar las poblaciones locales, como enfermedades epizootias, contaminación, turismo, pesca, entre otras.
MATERIALES Y MÉTODOS
Colonias reproductivas del lobo marino de California
El presente estudio incluye las 13 colonias reproductivas del lobo marino de California en el Golfo de California (fig. 1). La distancia máxima entre Consag (la más norteña) y Los Islotes (la más sureña) es de 823 km, y las dos colonias más cercanas son El Partido y El Rasito, separadas por 7.6 km.
Bases de datos
Se analizaron los patrones geográficos de nueve series de datos (tabla 1). Cuatro de ellas (censos poblacionales, contenido de metales traza en cráneos, temperatura superficial del mar y concentración de clorofila a alrededor de cada colonia) fueron analizadas en este estudio, mientras que las otras cinco se derivaron de estudios previos (δ13C, δ15N, dieta, Leptospira y osteoartritis).
Censos poblacionales
Esta base de datos consta de conteos poblacionales directos realizados entre 1978 y 2004 durante la estación reproductiva (de junio a julio), cuando la mayor parte de la población se encuentra en tierra y se presenta el conteo máximo de nacimientos. Los análisis preliminares donde se estimaron las tendencias poblacionales y el riesgo de extinción fueron publicadas anteriormente (Szteren et al. 2006).
Para explorar el patrón regional, se utilizó el valor de la probabilidad de extinción de cada colonia porque éste incluye el estatus poblacional y su tendencia. La probabilidad de extinción se estimó usando el tamaño poblacional actual, un umbral de extinción poblacional, la tasa de cambio poblacional (µ) y un parámetro de varianza (Morris et al. 1999).
Concentraciones de metales
Se utilizó la concentración de Al, As, Cd, Cu, Co, Fe, Hg, Ni, Pb, Se y Zn medidos en la bula timpánica de cráneos de machos adultos de lobo marino recolectados en 10 colonias, entre 1978 y 1994 (tabla 1). El hueso, al ser un tejido compacto, presenta una tasa de renovación y remoción baja, y tiene la ventaja de representar la acumulación de metales a lo largo de la vida del animal. El trabajo de laboratorio se realizó previamente e incluyó el corte del hueso y la cuantificación de los metales usando espectrofotometría de absorción atómica, como fue descrito por Elorriaga y Aurioles–Gamboa (2008). El Hg se midió con el mismo equipo, usando técnicas de vapor frío sin llama. El Se fue medido por la generación de vapores calientes volátiles de hidruro de Se.
Para procesar los datos, se eliminó un dato extremo (outlier) antes de calcular las correlaciones entre los metales. Se seleccionaron el As, Co, Hg y Ni como los metales más representativos, ya que tuvieron las mayores correlaciones con el resto de los metales y mostraron diferencias significativas entre las colonias. Los datos fueron transformados logarítmicamente para minimizar las diferencias de escala entre los distintos metales. Para estudiar la regionalización general, se incorporó la contribución de cada metal al primer factor de un análisis de componentes principales (ACP) usando los metales más explicativos en una exploración preliminar.
Variables ambientales
Los datos de temperatura superficial del mar (TSM) y clorofila a se obtuvieron a partir de imágenes satelitales. Los datos de TSM se derivaron usando imágenes mensuales obtenidas por el satélite NOAA/NASA AVHRR Ocean Pathfinder (ftp://podaac.jpl.nasa.gov/pub/sea_surface_temperature/avhrr/pathfinder), y los datos de clorofila a de imágenes estacionales del satélite SeaStar (http://seawifs.gsfc.nasa.gov/cgi/level3.pl). Las imágenes tenían una resolución espacial de 9 km. Se obtuvieron los valores promedio dentro de cuadrados de 100 × 100 km centrados en cada una de las 13 colonias de manera que se incluyera el radio de alimentación promedio de los lobos marinos de 30 a 40 km (Durán–Lizarraga 1998, Kuhn 2006).
Las variables ambientales se estudiaron durante diciembre, enero y febrero, ya que estos meses representan un periodo crítico para las hembras que dan a luz en junio o julio y continúan amamantando a sus crías hasta entonces (Peterson y Bartholomew 1967, Newsome et al. 2006). El invierno también es importante para los machos subadultos que se dispersan durante este periodo en busca de alimento, y para las crías que comienzan a alimentarse independientemente (Aurioles–Gamboa et al. 1983).
Se obtuvieron los valores promedio, la desviación estándar, el error estándar y el número de datos (pixeles) dentro de cada cuadrado, utilizando el software WIM (Windows Image Manager). Se obtuvieron datos de TSM para diez años (ver tabla 1), y se seleccionaron los años más explicativos eligiendo aquéllos con mayor contribución a los factores 1 y 2 de un ACP preliminar. Para la regionalización general se utilizó la contribución de cada año al primer factor en el ACP preliminar. Por otro lado, se recolectaron datos de clorofila a de seis años usando los mismos criterios. Para la regionalización general se incorporó el valor promedio del periodo 1998–2003.
Isótopos estables
Esta base de datos consiste en las razones de isótopos estables de carbono y nitrógeno (expresados como δ13C y δ15N) medidas en muestras de pelo de 10 crías en cada colonia. Se muestrearon crías de aproximadamente dos meses de edad en 2000 y 2002 en 12 colonias (Porras–Peters et al. 2008), complementado con datos no publicados de 2004 de San Jorge (tabla 1). Para explorar el patrón regional se utilizó el valor promedio de cada isótopo estable para cada colonia.
Dieta
Se determinaron las especies presa mediante la identificación de restos duros en heces de lobos marinos recolectadas en julio de 2002 en 11 colonias (Porras–Peters et al. 2008), complementado con muestras de Isla Granito y Los Machos recolectadas en septiembre de 1995 (García–Rodríguez y Aurioles–Gamboa 2004) (tabla 1). Para explorar la regionalización se utilizó la diversidad de dieta, ya que incorpora la importancia de múltiples ítem presa. Además, la diversidad de dieta refleja la susceptibilidad potencial de las colonias ante variaciones en la disponibilidad de sus presas preferidas (Aurioles–Gamboa y Camacho–Ríos 2007). La diversidad se calculó usando el índice de diversidad de Shannon (H):

donde pi representa la proporción de presas i en todas las heces y s es el número total de presas. Los valores altos de H' equivalen a una mayor diversidad en la dieta. La diversidad de la dieta fue calculada previamente por García–Rodríguez y Aurioles–Gamboa (2004) y Porras–Peters et al. (2008). Para evaluar la regionalización general se incorporó el valor de H' de cada colonia.
Leptospira
Se examinó la presencia de serovariedades de L. interrogans en muestras de suero de crías recolectadas durante la estación reproductiva de 2002 (Pedernera 2004) (tabla 1). Se capturaron entre ocho y diez crías recién nacidas en 11 colonias, totalizando 106 crías. Para determinar y cuantificar la prevalencia de anticuerpos contra serovariedades de Leptospira, se usaron pruebas de aglutinación microscópica (MAT) (Pedernera 2004). Se identificaron 27 serovariedades; sin embargo, un ACP preliminar mostró que 13 fueron las más explicativas.
Para el presente análisis, se utilizó el mismo patrón regional descrito por Pedernera (2004) usando un análisis de clasificación con la unión completa y la distancia euclideana: (1) Consag, Isla Lobos, Granito, Los Cantiles, San Esteban, San Pedro Mártir y Nolasco; (2) El Partido y El Rasito; y (3) Farallón de San Ignacio y Los Islotes. Posteriormente, se analizó la significancia del agrupamiento usando un análisis discriminante. Para explorar la regionalización general, se incorporó la contribución de las 13 serovariedades (ACP) más explicativas.
Osteoartritis
Díaz–Guzmán (2003) analizó la incidencia de osteoartritis en 385 cráneos de adultos de lobo marino recolectados en 10 colonias entre 1978 y 2002 (tabla 1). Esta condición es un proceso degenerativo claramente observado en la articulación temporomandibular como un desgaste grave y reducción del hueso, que puede inducir deformaciones. Se calculó la prevalencia de esta afección como el número de cráneos con evidencias de osteoartritis sobre el número total de cráneos examinados en cada colonia. Para la regionalización general se usó la prevalencia de osteoartritis en cada colonia.
Análisis
Las bases de datos procesadas se incorporaron como se especificó anteriormente (tabla 2).
En primer lugar se exploró el patrón geográfico de las colonias usando el análisis de clasificación empleando el método de unión de Ward y la distancia euclideana. Debido a que no se contaba con toda la información de las 13 colonias para las bases de datos individuales, se realizaron tres ensayos diferentes con distintas combinaciones de colonias y variables (tabla 3). El ensayo a incluyó metales, osteoartritis y Leptospira, y abarcó ocho colonias, mientras que el ensayo b incluyó todas las variables y ocho colonias. Para incluir todas las colonias se realizó el ensayo c usando las siguientes variables: tendencia poblacional, TSM, clorofila a, diversidad trófica, δ15N y δ13C. Los grupos se definieron usando un valor de referencia umbral igual al promedio de la matriz de distancia euclideana (Arancibia 1988). Posteriormente, se realizó una prueba de Mantel entre todas las combinaciones de ensayos para compararlos entre sí y determinar la existencia de un patrón consistente.
A fin de explorar la afinidad regional de las colonias, se plantearon escenarios para identificar la mejor configuración de agrupamiento entre cuatro posibles, usando el análisis discriminante.
RESULTADOS
Patrones geográficos
La tabla 2 muestra el valor medio de cada variable de la base de datos de cada colonia. Cinco colonias están en aumento en cuanto a su población (Consag y San Jorge en el Golfo norte, San Esteban en la zona de las Grandes Islas, Nolasco en la zona central y Los Islotes en el sur). De las cinco colonias que están declinando, la mayoría se encuentra en la zona de las Grandes Islas (Szteren et al. 2006). La concentración media de As, Co y Ni fueron máximas en Nolasco. Se encontraron bajas concentraciones en Los Cantiles y en Los Machos para los dos primeros metales, mientras que Ni fue mínimo en San Pedro Mártir (tabla 2). El máximo promedio de Hg se encontró en Isla Lobos y el mínimo en San Pedro Mártir y Nolasco. Entre las variables ambientales, el máximo promedio de TSM invernal se registró en Los Islotes y Farallón de San Ignacio y el mínimo en San Esteban, mientras que la mayor concentración de clorofila a se encontró en Consag e Isla Lobos, y la menor en Los Islotes, Granito y Los Cantiles (tabla 2). El mayor δ13C se encontró en El Partido y el menor en Los Cantiles, mientras que el mayor δ15N se registró en Consag y el menor en Los Machos. La diversidad de dieta aumentó desde el norte del golfo hacia el sur. El porcentaje total de reacciones positivas a serovariedades de Leptospira fue máximo en El Rasito, Isla Lobos y Farallón de San Ignacio, y el mínimo en San Pedro Mártir y Granito (tabla 2). Las colonias se dividieron en tres grupos: un grupo en el sur, un segundo grupo compuesto por dos colonias situadas al sur de la Isla Ángel de la Guarda y un tercer grupo en el norte y centro del golfo (Pedernera 2004). La prevalencia de osteoartritis tendió a decrecer del norte al sur. El patrón geográfico indicó tres grupos de colonias: tres colonias con ausencia de osteoartritis, cuatro colonias con alta prevalencia al norte y en el área de la Isla Ángel de la Guarda (Isla Lobos, Los Machos, Granito y El Rasito) y un tercer grupo en el centro y sur del Golfo de California con prevalencia intermedia (San Esteban, Nolasco, Farallón de San Ignacio y Los Islotes) (tabla 2, fig. 1).
Ensayos de agrupamiento de las variables
En el ensayo a, al realizarse un corte en el árbol a una distancia de 1.6, se distinguieron tres grupos de colonias:
(1) Los Islotes y Farallón de San Ignacio (Golfo Sur); (2) Nolasco, San Pedro Mártir y San Esteban (Golfo Central); y (3) Granito, Los Cantiles e Isla Lobos (área de Ángel de la Guarda y Golfo Norte) (fig. 2a).
En el ensayo b emergieron tres grupos de colonias a una distancia de corte de 2.5: (1) Los Islotes y Farallón de San Ignacio (Golfo Sur); (2) Nolasco, San Pedro Mártir y San Esteban (Golfo Central); y (3) Granito, Los Cantiles e Isla Lobos (área de Ángel de la Guarda y Golfo Norte) (fig. 2b).
En el ensayo c se distinguieron cuatro grupos a una distancia de corte de 2.1: (1) Los Islotes y Farallón de San Ignacio (Golfo Sur); (2) Nolasco, San Pedro Mártir, San Esteban, El Partido y El Rasito (Golfo Central); (3) Los Machos, Los Cantiles y Granito (Ángel de la Guarda); y (4) Isla Lobos, San Jorge y Consag (Golfo Norte) (fig. 2c).
Las pruebas de Mantel resultaron significativas, lo que apoya la regionalización propuesta (tabla 4).

Agrupamiento de colonias con ausencia de datos
Sobre la base de la regionalización con datos completos, Consag y San Jorge formaron un grupo norte separado de las colonias situadas en Ángel de la Guarda, y Los Machos siempre estuvo asociada con las colonias situadas en Ángel de la Guarda (fig. 2c). Dos colonias presentaron dificultades al asignarles grupos, ya sea por la ausencia de datos para algunas variables o porque su clasificación variaba de acuerdo con la variable clasificadora: Isla Lobos, que según los ensayos a y b, se asoció con las colonias de Ángel de la Guarda y según el ensayo c, con colonias del norte; y El Partido, que podría pertenecer al grupo Ángel de la Guarda o al central dependiendo de la variable analizada.
Los resultados estadísticos para las cuatro configuraciones se muestran en la tabla 5. La mejor discriminación se logró agrupando Isla Lobos con el grupo norte y El Partido con Ángel de la Guarda (W = 0.0002, F18,11 = 12.87, P < 0.0001, n = 13) (configuración 1, tabla 5). La diversidad de dieta y la TSM fueron las variables más importantes para la separación de los cuatro grupos (tendencia: W = 0.002, Wparcial = 10.86, P = 0.021 y TSM: W = 0.009, Wparcial = 60.12, F18,11 = 60.12, P = 0.0008), obteniendo una clasificación correcta del 100%. Al agregar la variable Leptospira a las anteriores, se corrobora la clasificación encontrada, ya que fue la más significativa (W = 0.00001, F21,3 = 10.59, P = 0.038, n = 11) con un agrupamiento correcto del 100%.
Con base en la regionalización planteada y los análisis discriminantes, se proponen los siguientes cuatro grupos regionales (fig. 3):
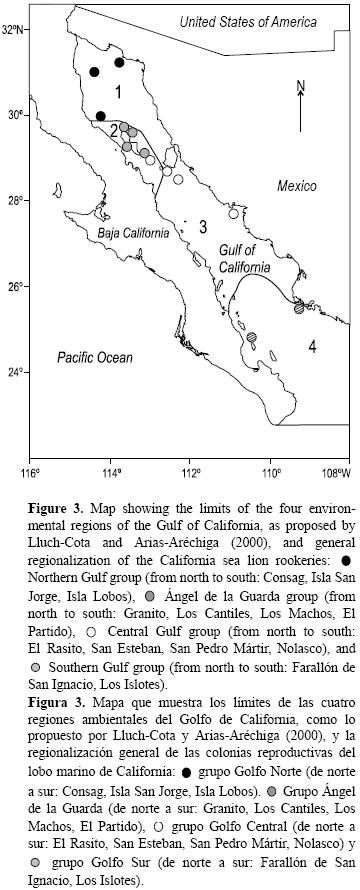
1. Golfo Norte: Consag, San Jorge e Isla Lobos, caracterizado por tendencias poblacionales crecientes en general, TSM alta, concentraciones de clorofila a altas, ausencia de As, Co bajo, Hg y Ni altos, diversidad de dieta baja, δ15N alto y δ13C de medio a alto.
2. Ángel de la Guarda: Granito, Los Cantiles, Los Machos y El Partido, con tendencias poblacionales decrecientes, TSM alta, concentraciones de clorofila a bajas, concentración alta de Hg y Ni, δ13C bajo, diversidad de dieta de baja a media e incidencia alta de osteoartritis.
3. Golfo Central: San Esteban, San Pedro Mártir, Nolasco y El Rasito, con tendencias poblacionales fluctuantes o en aumento, TSM de media a baja, concentraciones de clorofila a de medias a altas, concentración alta de As y Co, Ni medio y Hg bajo, niveles de δ15N bajos y de δ13C altos, diversidad de dieta alta e incidencia de osteoartritis de baja a media.
4. Golfo Sur: Farallón de San Ignacio y Los Islotes, caracterizado por TSM alta, concentraciones de clorofila a bajas, concentraciones de As y Ni altas, Hg bajo, Co medio, δ15N alto, δ13C de medio a bajo, diversidad de dieta alta e incidencia de osteoartritis baja.
La figura 4 muestra el resultado del análisis canónico asociado con el análisis discriminante entre los cuatro grupos propuestos usando las siguientes variables: tendencia poblacional, diversidad de dieta, δ15N, δ13C, TSM y clorofila a.

DISCUSIÓN
El presente análisis de regionalización, usando una variedad de variables biológicas, ecológicas, físicas y biogeoquímicas, resultó en un agrupamiento geográfico de las colonias reproductivas del lobo marino de California en el Golfo de California que consistió en cuatro grupos. Es posible que cada grupo corresponda a diferentes áreas de alimentación, a las cuales las hembras, cuya dispersión está restringida por la necesidad de regresar a la colonia, se han adaptado durante un periodo lo suficientemente largo como para crear los actuales patrones de variación geográfica. Para mantener a la población de lobo marino del Golfo de California como parte funcional de su ecosistema y preservar su potencial evolutivo, estos grupos deberían ser considerados al establecer prioridades de conservación. Los estudios previos que agruparon las colonias de lobo marino usando variables individuales llegaron a resultados similares usando datos de censos (González–Suárez et al. 2006, Ward et al. 2010). En el presente estudio dos variables adicionales, diversidad de dieta y TSM, fueron las más importantes para la definición de las regiones.
La caracterización multivariada ha sido usada con otras especies y ha mostrado ser una herramienta útil para la conservación y el manejo. Por ejemplo, en Alaska, se realizó una clasificación ecológica de las colonias de colonias del lobo marino de Steller y se encontró que diferentes regiones asociadas con las principales corrientes oceánicas se distinguían por diferencias en profundidad y temperatura (Call y Loughlin 2005). Esa clasificación, basada en similitudes ecológicas entre los parámetros, tomó en cuenta varias características del hábitat: profundidad, TSM, tipo de sustrato y su orientación, dieta y tendencia poblacional.
Dentro de la estructura genética reportada por Schramm et al. (2009) para seis colonias del Golfo de California, su grupo Norte (representado por la colonia San Jorge) coincide con el arreglo ecológico propuesto en este estudio. Desafortunadamente, dicho estudio genético no incluyó El Partido, El Rasito, San Pedro Mártir o Nolasco, lo que hubiera ayudado a correlacionar la estructura genética y variables ecológicas relacionadas con la población de lobo marino. El grupo Central delineado en el estudio genético de Schramm et al. (2009) incluyó Isla Lobos, Los Cantiles, Granito y San Esteban, que se agruparon diferente en nuestro estudio (Los Cantiles y Granito con Ángel de la Guarda, e Isla Lobos con el grupo Norte). También fue difícil la ubicación de Isla Lobos. El grupo Sur de Schramm et al. (2009) incluyó sólo Los Islotes porque la colonia en Farallón de San Ignacio no fue muestreada. En nuestra estructura, esta colonia está conectada estrechamente con Los Islotes, dado que ambas están geográficamente cerca.
La clasificación ecológica planteada en el presente estudio también concuerda con las regionalizaciones oceanográficas del Golfo de California (Lluch–Cota 2004). El golfo norte y la zona de las Grandes Islas presentan características oceanográficas particulares que difieren de la zona centro del golfo. Por lo tanto, no es sorprendente hallar similitudes en la TSM, la clorofila a, la diversidad de dieta y los isótopos estables entre las colonias situadas dentro de estas regiones oceanográficas. Las características únicas de la zona de las Grandes Islas han sido sujeto de varios estudios (e.g., Maluf 1983, Lluch–Cota y Arias–Aréchiga 2000, Lluch–Cota 2004, Lluch–Cota et al. 2007). Nuestra separación de las colonias del grupo Ángel de la Guarda del grupo Central también puede explicarse por diferencias en las condiciones oceanográficas. Las colonias del grupo Central comparten una zona que se caracteriza por la presencia de especies presa de los lobos marinos que tienen una distribución bien definida en el centro–sur del golfo. Éstas incluyen el calamar gigante Dosidicus gigas (Morales–Bojórquez et al. 2001) y el mictófido Benthosema panamense (Aceves–Medina et al. 2004); ambos son fuentes de alimento importante para el lobo marino de California (García–Rodríguez y Aurioles–Gamboa 2004). La frecuencia y abundancia de estos ítem presa en la dieta fueron variables que se incluyeron en la base de datos utilizada en este estudio.
La dificultad de asociar a la colonia El Partido ya sea en el grupo Ángel de la Guarda o con el grupo Central se puede explicar por la dinámica particular del ecosistema donde se localiza. Esta región está influenciada por flujos elevados de nutrientes que provenien del Canal de Ballenas y se dirigen al sur de las Grandes Islas (Santamaría–del–Ángel et al. 1994), pero en algunos periodos del año o bajo ciertas condiciones oceanográficas estas colonias responden diferente. Con relación al ambiente, es más similar a las colonias de Ángel de la Guarda, aunque los isótopos estables, la dieta y la ocurrencia de osteoartritis la asociaron con el grupo Central.
Estructura poblacional y filopatría
Varios factores extrínsecos tales como las diferencias regionales en las presas, los patrones de circulación oceánica, la discontinuidad del hábitat, el aislamiento por distancia y la vicarianza histórica (Riginos y Nachman 2001) pueden promover la adaptación a condiciones ambientales y subsecuentemente, la diferenciación de las poblaciones. En el caso del lobo marino de California, las diferentes variables analizadas en conjunto fueron útiles para producir un patrón de estructura geográfica.
La fidelidad al sitio se sustenta para hembras y machos no solamente por datos genéticos (Schramm et al. 2009), sino también por estudios etológicos (Hernández–Camacho et al. 2008). La fidelidad al sitio caracteriza a las hembras adultas de lobo marino, ya que deben regresar al mismo sitio para amamantar a sus crías por lo menos durante un año, y es común que den a luz al siguiente año y durante varios años subsiguientes (Hernández–Camacho et al. 2008). Además, varias especies de pinnípedos muestran preferencia por las colonias donde nacieron (e.g., la foca gris, Pomeroy et al. 2000; el lobo fino del norte, Baker et al. 1995; el león marino de Nueva Zealanda, Chilvers y Wilkinson 2008; el león marino de Australia, Campbell et al. 2008; el león marino de Galápagos, Wolf y Trillmich 2007; el lobo fino Antártico, Hoffman et al. 2006b). La alternancia entre periodos de lactancia y de alimentación en el mar fuerza a las hembras a restringir su búsqueda de alimento espacial y temporalmente, de manera que las principales limitantes para las hembras lactantes son el tiempo y la energía invertidos (Costa et al. 1989, Costa y Gales 2000, Bailleul et al. 2005). Como resultado, también existe una fidelidad a los sitios de alimentación. Esto ha sido documentado para otras especies de otáridos, como el lobo fino del norte (Robson et al. 2004), el lobo marino de Steller (e.g., Hoffman et al. 2006a) y el lobo fino Antártico (e.g., Bonadonna et al. 2001).
La proximidad geográfica podría promover un mayor grado de intercambio de animales y solapamiento de las áreas de alimentación. Debido a que una gran proporción de las colonias está compuesta por hembras adultas (40–50%) y la recolección de heces se realizó en la zona reproductiva donde las hembras son muy abundantes y los machos adultos generalmente no se alimentan, se puede suponer que la mayoría de la información de dieta probablemente provenga de hembras, reflejando los hábitos alimentarios locales. Dado que las hembras del lobo marino de California se alimentan en las proximidades de su colonia (Durán–Lizárraga 1998, Kuhn 2006), no es sorprendente encontrar que colonias cercanas (a veces dentro del radio de 20 a 40 km) reflejen un patrón común entre variables ecológicas tales como dieta, isótopos estables y condiciones ambientales. Sin embargo, colonias vecinas como El Partido y El Rasito podrían hacer un uso diferencial de los recursos dentro de la misma región geográfica o utilizar áreas de alimentación diferentes (Porras–Peters et al. 2008), de acuerdo con el análisis de heces y con los isótopos estables. Con base en esto, se ha sugerido que algunos grupos de colonias en el Golfo de California explotan zonas con diferentes condiciones oceanográficas y/o diferentes sitios de alimentación (García–Rodríguez y Aurioles–Gamboa 2004). Además, la concentración de algunos metales traza podría asociarse con el tipo de alimento, lo que reforzaría la estructuración geográfica (Elorriaga y Aurioles–Gamboa 2008). Las similitudes en las serovariedades de L. interrogans, que es transmitida por contacto directo, mostraron una fuerte correlación con la distancia geográfica (Pedernera 2004). Finalmente, la incidencia de osteoartritis, que presenta una variación regional, puede mostrar una estructuración geográfica en función de algún factor genético, ambiental, o ambos (Simonet 2002).
En conclusión, la regionalización que emerge del presente estudio se deriva de una combinación de una diversidad de variables que influencian en conjunto la asociación de las colonias de lobo marino en la agrupación resultante. Las cuatro regiones indican que las colonias de lobo marino en el Golfo de California exhiben diferencias en la dieta, las razones de isótopos estables y las concentraciones de metales (entre otras), que a su vez son influenciadas por condiciones oceanográficas locales que podrían estar relacionadas con un tipo específico de alimento. La estrecha fidelidad de las hembras adultas, debido a la extensión del periodo de lactancia y a la continua fertilidad, probablemente determine las áreas de alimentación limitadas y el intercambio de individuos, al menos entre las regiones del Golfo de California. Esto podría explicar la estructuración genética de la población de lobo marino en tres regiones dentro del golfo (Schramm et al. 2009, González–Suárez et al. 2009). Se identificó que en el Golfo de California los lobos marinos muestran fidelidad a las áreas de alimentación. Esto se sospechaba sobre la base de estudios con variables individuales; sin embargo, este estudio provee evidencia que vincula la filopatría con áreas de crianza y de alimentación. Estos datos son importantes para el monitoreo y manejo de los lobos marinos como partes funcionales de su ecosistema.
Recomendaciones de manejo
La regionalización aquí presentada resultará muy útil para fines de manejo en comparación con estudios previos que propusieron grupos de colonias de lobo marino sobre la base de variables individuales. Se sugiere que estas unidades deberían ser consideradas en una reevaluación del estatus poblacional del lobo marino de California en México.
El eliminar el escenario de una única población homogénea para el Golfo de California facilitará futuros esfuerzos para focalizar acciones de conservación y manejo, tales como áreas de conservación prioritaria en el Golfo de California. En particular, se sugiere focalizar esfuerzos de conservación en el grupo Ángel de la Guarda y en el grupo Norte. La diversidad genética encontrada en el norte y centro del golfo no se encontró en el Pacífico. Se recomienda realizar manejo precautorio en la zona norte hasta que exista más información disponible que permita evaluar la tendencia poblacional en la colonia Consag. Adicionalmente, todas las colonias en el grupo Ángel de la Guarda presentan tendencias poblacionales decrecientes y tamaños poblacionales relativamente bajos. Ambos grupos tienen alta incidencia de osteoartritis y baja diversidad de dieta, por lo tanto el decrecimiento de una especie presa preferida podría impactar la población.
Sería importante completar la investigación de la estructura poblacional genética a lo largo del Golfo de California incluyendo las 13 colonias reproductivas para poder comparar completamente los patrones de regionalización ecológicos y genéticos. Además, dado que las colonias alrededor de la Isla Ángel de la Guarda están declinando, se debería realizar un esfuerzo para comprender las causas.
Con respecto al grupo Central, la base de datos de San Pedro Mártir necesita ser expandida para entender sus fluctuaciones poblacionales. La colonia El Rasito se considera vulnerable debido a la baja abundancia y a que sufre grandes fluctuaciones poblacionales. Los datos de abundancia poblacional de Nolasco deberían también ser actualizados, ya que el último censo se realizó en 1997. Finalmente, se recomienda realizar estudios para estimar el movimiento de los animales entre las colonias, usando programas de marcaje, telemetría satelital, y/o análisis genéticos. Adicionalmente, los estudios futuros deberían evaluar el estado de salud de las colonias usando indicadores no invasivos, tales como los empleados por Green et al. (2010).
AGRADECIMIENTOS
Este trabajo fue apoyado por proyectos de SEP–CONA–CYT (400302–5–3371–N, 26430–N y 2004–C01–46806), SEMARNAT–CONACYT (2002–C01–1230) y CGPI–IPN (20030385, 20040084 y 20050113) durante diferentes etapas del estudio. Agradecemos a la SEMARNAT (Instituto Nacional de Ecología, Dirección General de Vida Silvestre) por los permisos de investigación: 240996–213–03 (1996), DOO.750–4172/97 (1997), DOO.750–4443/98 (1998), DOO.02–327O (1999), DOO.02–3345 (2000), SGPA/DGVS– 0579 (2002), SGPA/DGVS–03473 (2003), y SGPA/DGVS– 04160(2004). La primera autora agradece a LASPAU–OEA Academic and Professional Programs for the Americas la beca recibida (2004–2006) para desarrollar los estudios doctorales. Además, Oak Foundation Mini–Grants in Marine Conservation y Duke University (Center for Marine Conservation), EUA, otorgaron un financiamiento para apoyar el desarrollo del proyecto. Se agradecen los aportes realizados por los tres revisores, los cuales contribuyeron significativamente a mejorar la calidad del artículo.
REFERENCIAS
Aceves–Medina G, Jiménez–Rosenberg SPA, Hinojosa–Medina A, Funes–Rodríguez R. 2004. Fish assemblages in the Gulf of California. J. Fish Biol. 65: 832–847. [ Links ]
Álvarez–Borrego S. 1983. Gulf of California. In: Ketchum BH (ed.), Ecosystems of the World, 26. Estuaries and Enclosed Seas. Elsevier, Amsterdam, pp. 427—449. [ Links ]
Arancibia H. 1988. Cluster Analysis. The use of a simple statistical method in the identification of groups. ICES Council Meeting (Collected Papers), Copenhagen, Denmark, 18 pp. [ Links ]
Aurioles D, Trillmich F. 2008. Zalophus californianus. In: 2008 IUCN Red List of Threatened Species <http://www.iucnredlist.org>. Downloaded on 6 April 2009. [ Links ]
Aurioles–Gamboa D, Camacho–Ríos FJ. 2007. Diet and feeding overlap of two otariids, Zalophus californianus and Arctocephalus townsendi: Implications to survive environmental uncertainty. Aquat. Mamm. 33: 315–326. [ Links ]
Aurioles–Gamboa D, Sinsel F, Fox C, Alvarado E, Maravilla O. 1983. Winter migration of subadult male California sea lions (Zalophus californianus) in the southern part of Baja California. J. Mammal. 64: 513–518. [ Links ]
Bailleul F, Luque S, Dubroca L, Arnould JP, Guinet C. 2005. Differences in foraging strategy and maternal behaviour between two sympatric fur seal species at the Croset Islands. Mar. Ecol. Prog. Ser. 293: 273–282. [ Links ]
Baker JD, Antonelis GA, Fowler CW, York A. 1995. Natal site fidelity in northern fur seals, Callorhinus ursinus. Anim. Behav. 50: 237–247. [ Links ]
Bonadonna F, Lea MA, Dehorter O, Guinet C. 2001. Foraging ground fidelity and route–choice tactics of a marine predator: The Antarctic fur seal (Arctocephalus gazella). Mar. Ecol. Prog. Ser. 223: 287–297. [ Links ]
Bowen L, Aldridge BM, DeLong R, Melin S, Godinez C, Zavala A, Gulland F, Lowenstine L, Stott JL, Johnson ML. 2006. MHC gene configuration variation in geographically disparate populations of California sea lions (Zalophus califorianus). Molec. Ecol. 15: 529–533. [ Links ]
Call KA, Loughlin TR. 2005. An ecological classification of Alaskan Steller sea lion (Eumetopias jubatus) rookeries: A tool for conservation/management. Fish. Oceanogr. 14: 212–222. [ Links ]
Campbell RA, Gales NJ, Lento GM, Baker CS. 2008. Islands in the sea: Extreme female natal site fidelity in the Australian sea lion, Neophoca cinerea. Biol. Lett. 4: 139–142. [ Links ]
Chilvers BL, Wilkinson IS. 2008. Phylopatry and site fidelity of New Zealand sea lions (Phocarctos hookety). Wildl. Res. 35: 463–470. [ Links ]
Costa DP, Gales NJ. 2000. Foraging energetics and diving behavior of lactating New Zealand sea lions, Phocarctos hookeri. J. Exp. Biol. 203: 3655–3665. [ Links ]
Costa DP, Croxall JP, Duck C. 1989. Foraging energetics of Antarctic fur seals, Arctocephalus gazella, in relation to changes in prey availability. Ecology 70: 596–606. [ Links ]
Díaz–Guzmán CF. 2003. Estudio de algunas patologías y traumas craneales del lobo marino de California Zalophus californianus californianus (Lesson 1828). B.Sc. dissertation, Universidad Jorge Tadeo Lozano, Bogotá, Colombia, 36 pp. [ Links ]
Durán–Lizárraga ME. 1998. Caracterización de los buceos de alimentación del lobo marino Zalophus californianus y su relación con variables ambientales en la Bahía de La Paz. M.Sc. thesis, CICIMAR, Instituto Politécnico Nacional, La Paz, México, 82 pp. [ Links ]
Elorriaga F, Aurioles–Gamboa D. 2008. Trace metal concentrations in the hair of Zalophus californianus pups and their relation to feeding habits. Biol. Trace Elem. Res. 126: 148–164. [ Links ]
García–Rodríguez FJ, Aurioles–Gamboa D. 2004. Spatial and temporal variation in the diet of the California sea lion (Zalophus californianus) in the Gulf of California, Mexico. Fish. Bull. 102: 47–62. [ Links ]
González–Suárez M, McCluney K, Aurioles–Gamboa D, Gerber LR. 2006. Incorporating uncertainty in spatial structure for viability predictions: A case study of California sea lions (Zalophus californianus californianus). Anim. Conserv. 9: 919–227. [ Links ]
González–Suárez M, Flatz R, Aurioles–Gamboa D, Hedrick PW, Gerber LR. 2009. Isolation by distance among California sea lion populations in Mexico: Redefining management stocks. Mol. Ecol. 18: 1088–1099. [ Links ]
González–Suárez M, Aurioles–Gamboa D, Gerber LR 2010. Past exploitation of California sea lions did not lead to a genetic bottleneck in the Gulf of California. Cienc. Mar. 36: 199–211. [ Links ]
Green DS, Young JK, Hernández–Camacho CJ, Gerber LR. 2010. Developing a non–invasive indicator of pinniped health: Neonate behaviour and growth in California sea lions (Zalophus californianus). Cienc. Mar. 36: 311–321. [ Links ]
Hernández–Camacho CJ, Aurioles–Gamboa D, Gerber LR. 2008. Age–specific birth rates of California sea lions, Zalophus californianus, in the Gulf of California, Mexico. Mar. Mamm. Sci. 24: 664–676. [ Links ]
Hobson KA, Schell DM, Renouf D, Noseworthy E. 1996. Stable carbon and nitrogen isotopic fractionation between diet and tissues of captive seals: Implications for dietary reconstructions involving marine mammals. Can. J. Fish. Aquat. Sci. 53: 528–533. [ Links ]
Hoffman JI, Matson CW, Amos W, Loughlin TR, Bickham W. 2006a. Deep genetic subdivision within a continuously distributed and highly vagile marine mammal, the Steller's sea lion (Eumetopias jubatus). Mol. Ecol. 15: 2821–2832. [ Links ]
Hoffman JI, Trathan PN, Amos W. 2006b. Genetic tagging reveals extreme site fidelity in territorial male Antarctic fur seals Arctocephalus gazella. Mol. Ecol. 15: 3841–3847. [ Links ]
Kuhn CE. 2006. Measuring at sea feeding to understand the foraging behavior of pinnipeds. Ph.D. thesis, University of Califrona, Santa Cruz, 129 pp. [ Links ]
Le Boeuf BJ, Croker DE. 2005. Ocean climate and seal condition. BMC Biology 3: 9. [ Links ]
Lluch–Cota SE. 2004. Gulf of California. In: Marine Ecosystems of the North Pacific. PICES Spec. Publ. No. 1, 1280 pp. [ Links ]
Lluch–Cota SE, Arias–Aréchiga JP. 2000. Sobre la importancia de considerar la existencia de centros de actividad biológica para la regionalización del océano: El caso del Golfo de California. In: Lluch–Belda D, Elorduy–Garay J, Lluch–Cota SE, Ponce–Díaz G (eds.), BAC Centros de Actividad Biológica del Pacífico Mexicano. CIB, CICIMAR, CONACYT. La Paz, México, pp. 255–263. [ Links ]
Lluch–Cota D, Aragón–Noriega EA, Arreguín–Sánchez F, Aurioles–Gamboa D, Bautista–Romero J, Brusca RC, Cervantes–Duarte R, Cortes–Altamirano R, Del Monte–Luna P, Esquivel–Herrera A, Fernández G, Hendrickx ME, Hernández–Vázquez S, Herrera–Cervantes H, Kahuru M, Lavín M, Lluch–Belda D, Lluch–Cota D, López–Martínez J, Marinote SG, Nevárez–Martínez M, Ortega–García S, Palacios–Castro E, Parés–Sierra A, Ponce–Díaz G, Ramírez–Rodríguez M, Salinas–Zavala C, Schwartzlose RA, Sierra–Beltrán A. 2007. The Gulf of California: Review of ecosystem status and sustainability challenges. Prog. Oceanogr. 73: 1–26. [ Links ]
Lowry MS, Maravilla–Chávez M. 2005. Recent abundance of California sea lions in western Baja California, Mexico, and the United States. Proc. 6th California Islands Symposium, Ventura, California, 1–3 December 2003, pp. 485–487. [ Links ]
Maldonado EJ, Orta–Davila F, Stewart BS, Greffen E, Wayne RK. 1995. Intraspecific genetic differentiation in California sea lions (Zalophus californianus) from southern California and the Gulf of California. Mar. Mamm. Sci. 11: 46–58. [ Links ]
Maluf LY 1983. The physical oceanography. In: Case TJ, Cody ML (eds.), Island Biogeography in the Sea of Cortez, University of California Press, Berkeley, pp. 26–45. [ Links ]
Matthiopoulos J, Harwood J, Thomas L. 2005. Metapopulation consequences of site fidelity for colonially breeding mammals and birds. J. Anim. Ecol. 74: 716–727. [ Links ]
Morales–Bojórquez E, Cisneros–Mata MA, Nevárez–Martínez MO, Hernández–Herrera A. 2001. Review of stock assessment and fishery biology of Dosidicus gigas in the Gulf of California, Mexico. Fish. Res. 54: 83–94. [ Links ]
Morris W, Doak D, Groom M, Kareiva P, Fieberg J, Gerber L, Murphy P, Thompson D. 1999. A Practical Handbook for Population Viability Analysis. The Nature Conservancy, 79 pp. [ Links ]
Newsome SD, Etnier MA, Aurioles–Gamboa D, Koch PL. 2006. Using carbon and nitrogen isotopes to investigate reproductive strategies in Northeast Pacific otariids. Mar. Mamm. Sci. 22: 556–572. [ Links ]
Pedernera C. 2004. Regionalización de la presencia de anticuerpos contra Leptospira spp., niveles de cortisol y valores hemáticos en once colonias de lobos marinos Zalophus californianus californianus en el Golfo de California. M.Sc. thesis, Universidad Nacional Autónoma de México, México, 73 pp. [ Links ]
Peterson RS, Bartholomew GA. 1967. The natural history and behavior of the California sea lion. American Society of Mammalogists, Spec. Publ. No. 1, 79 pp. [ Links ]
Pomeroy PP, Twiss SD, Redman P. 2000. Phylopatry, site fidelity and local kin association within grey seal breeding colonies. Ethology 106: 899–919. [ Links ]
Porras–Peters H, Aurioles–Gamboa D, Cruz–Escalona VH, Koch PL. 2008. Trophic level and overlap of sea lions (Zalophus californianus) in the Gulf of California, Mexico. Mar. Mamm. Sci. 24: 554–576. [ Links ]
Riginos C, Nachman MW. 2001. Population subdivision in marine environments: The contributions of biogeography, geographical distance and discontinuous habitat to genetic differentiation in a blennioid fish, Axoclinus nigricaudus. Mol. Ecol. 10: 1439–1453. [ Links ]
Robson BW, Goebel ME, Baker JD, Ream RR, Loughlin TR, Francis RC, Antonelis GA, Costa DP. 2004. Separation of foraging habitat among breeding sites of a colonial marine predator, the northern fur seal (Callorhinus ursinus). Can. J. Zool. 82: 20–29. [ Links ]
Round FE. 1967. The phytoplankton of the Gulf of California. Part I. Its composition, distribution and contribution to the sediments. J. Exp. Mar. Biol. Ecol. 1: 76–97. [ Links ]
Santamaría–del–Ángel E, Álvarez–Borrego S, Muller–Karger FE. 1994. Gulf of California biogeographic regions based on coastal zone color scanner imagery. J. Geophys. Res. 99: 7411–7421. [ Links ]
Schramm Y, Mesnick SL, de la Rosa J, Palacios DM, Lowry MS, Aurioles–Gamboa D, Snell HM, Escorza–Treviño S. 2009. Phylogeography of California and Galapagos sea lions and present population structure within the California sea lion. Mar. Biol. 156: 1375–1387. [ Links ]
Simonet WS. 2002. Genetics of primary generalized osteoarthritis. Mol. Gen. Metab. 77: 31–34. [ Links ]
Skoch EJ. 1990. Heavy metals in marine mammals. Presence and analytical methods. In: Dierauf LA (ed.), Handbook of Marine Mammal Medicine: Health, Disease, and Rehabilitation. CRC Press, Boca Ratón, Florida, pp. 127–137. [ Links ]
Soto K, Trites AW, Arias–Schreiber M. 2004. The effects of prey availability on pup mortality and the timing of birth of South American sea lions (Otaria flavescens) in Peru. J. Zool. London, 264: 419–428. [ Links ]
Szteren D, Aurioles–Gamboa D, Gerber LR. 2006. Population status and trends of the California sea lion (Zalophus californianus californianus) in the Gulf of California, Mexico. In: Trites AW, Atkinson SK, DeMaster DP, Fritz LW, Gelatt TS, Rea LD, Wynne KM (eds.), Sea Lions of the World. Alaska Sea Grant College Program, Fairbanks, pp. 369–384. [ Links ]
Ward EJ, Chirakkal H, González–Suárez M, Aurioles–Gamboa D, Holmes EE, Gerber LR. 2010. Inferring spatial structure from time–series data: Using multivariate state–space models to detect metapopulation structure of California sea lions in the Gulf of California, Mexico. J. Appl. Ecol. 47: 47–56. [ Links ]
Wolf JBW, Trillmich F. 2007. Beyond habitat requirements: Individual fine–scale site fidelity in a colony of the Galapagos sea lion (Zalophus wollebaeki) creates conditions for social structuring. Oecologia 152: 553–567. [ Links ]
Zavaleta–Lizárraga L. 2003. Variaciones geográficas en morfometría craneal en machos adultos de lobo marino de California (Zalophus californianus) en México. M.Sc. thesis, CICIMAR, Instituto Politécnico Nacional, La Paz, Mexico, 69 pp. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.














