Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.37 no.3 Ensenada Set. 2011
Patrón de distribución de los poliquetos en la costa de la Comunidad Valenciana, Mediterráneo español*
Polychaete distribution pattern on the Valencian Community coast, Spanish Mediterranean**
Y del–Pilar–Ruso*, JA de–la–Ossa–Carretero, F Giménez–Casalduero, JL Sánchez–Lizaso
Departamento de Ciencias del Mar y Biología Aplicada, Universidad de Alicante, Campus de San Vicente del Raspeig, Ap. 99, E–03080, Alicante, España.
*Corresponding author.
E–mail: yoana.delpilar@ua.es
Received April 2010
Accepted April 2011
RESUMEN
Los cambios en la estructura de las comunidades bentónicas están estrechamente relacionados con los factores ambientales. Para poder interpretar los posibles cambios asociados con los impactos antropogénicos, es necesario determinar la influencia de los cambios naturales. El objetivo de este estudio fue caracterizar y clasificar las agrupaciones de poliquetos que habitan los fondos blandos no contaminados del Mediterráneo español, así como su relación con los factores ambientales. Se muestrearon 13 localidades entre los 9 y 31 m de profundidad, de 2004 a 2006. La aplicación de técnicas multivariantes demostró que la estructura de las agrupaciones de poliquetos observada en 2004 fue consistente a lo largo del tiempo, detectándose correlaciones entre los poliquetos y los factores ambientales. El área de estudio comprende cuatro tipos de comunidades que se caracterizan, principalmente, por las agrupaciones de poliquetos, los tipos de sedimentos y la profundidad.
Palabras clave: fondos blandos, agrupación de poliquetos, factores abióticos, Mar Mediterráneo occidental, clasificación del hábitat.
ABSTRACT
Changes in benthic community structure are strongly related to environmental factors, and we need to determine how these natural changes occur in order to interpret the possible changes associated with anthropogenic impacts. The aim of this survey was to characterize and classify the polychaete assemblages inhabiting unpolluted soft bottoms in the Spanish Mediterranean in relation to environmental factors. Thirteen localities were sampled at depths between 9 and 31 m, from 2004 to 2006. Multivariate techniques showed that the structure of polychaete assemblages detected in 2004 was consistent over time and correlations between polychaetes and environmental factors were detected. The study area comprises four kinds of communities mainly characterized by polychaete assemblages, sediment types, and depth.
Key words: soft bottoms, polychaete assemblage, abiotic factors, western Mediterranean Sea, habitat classification.
INTRODUCCIÓN
Desde el punto de vista de la ecología de comunidades, los fondos blandos no han sido tan bien estudiados o entendidos como las costas rocosas y existen escasas descripciones de estos hábitats (Gray 2002, Mair et al. 2009). Se ha prestado particular atención al papel que las variables relacionadas con los sedimentos juegan en la estructura de la infauna (revisión por Gray 1981, Moreira et al. 2006). Una variación de las características de los sedimentos, tal como el tamaño de grano y el contenido orgánico, puede contribuir a una variabilidad de los grupos infaunales, dificultando así la detección de los impactos putativos (Bishop 2005).
Resulta necesario entender el funcionamiento de los sedimentos bentónicos que cubren la mayor parte del fondo marino y que son cada vez más afectados, especialmente los que se encuentran en aguas costeras cercanas a centros de población. En el Mar Mediterráneo occidental, las comunidades de fondos blandos están sujetas a una creciente presión por las actividades humanas (Cardell et al. 1999). Estas comunidades bentónicas son de suma importancia para la supervivencia de los ecosistemas marinos y, para un manejo adecuado, se necesita entender como funcionan (Hutchings 1998). En este contexto, el estudio de la composición y distribución de los grupos bentónicos es de gran interés ya que se consideran un elemento clave de los ecosistemas marinos (Gray y Mirza 1979). Aunque la macrofauna asociada al fondo presenta muchas ventajas como indicadores, las agrupaciones bentónicas son muy complejas. En este caso, el análisis de algunas estructuras taxonómicas parece ser más adecuado (Belan 2004). Los poliquetos juegan un papel importante en el funcionamiento de las comunidades bentónicas en cuanto a la abundancia, el reciclado, la reutilización y la bioturbación de los sedimentos marinos, así como en el enterramiento de materia orgánica (Hutchings 1998). Por lo tanto, pueden ser buenos indicadores de la riqueza de especies y de los patrones de la comunidad de invertebrados bentónicos (Fauchald y Jumars 1979). Varios autores consideran que los poliquetos son el grupo taxonómico que muestra mayor sensibilidad a las alteraciones de los sustratos blandos (Bellan 1984, del–Pilar–Ruso et al. 2008) debido a su extraordinaria capacidad de adaptación a una amplia gama de hábitats y cambios ambientales (Fauchald y Jumars 1979).
Los cambios espaciales y temporales en la estructura de la comunidad bentónica se relacionan con factores ambientales y es necesario determinar como suceden estos cambios naturales para poder entender e interpretar los posibles cambios asociados con los impactos antropogénicos. Por este motivo, el objetivo de este trabajo fue caracterizar las agrupaciones de poliquetos que habitan los fondos blandos no contaminados del Mediterráneo occidental e identificar los principales factores abióticos que se relacionan con la estructura de la comunidad bentónica.
MATERIALES Y MÉTODOS
El estudio se realizó a lo largo de 518 km de la costa de la Comunidad Valenciana, España (fig. 1). Los sitios de estudio se seleccionaron tratando de evitar los posibles factores que pudieran afectar las agrupaciones, tal como la contaminación (aguas residuales, plantas de desalinización, etc.) o las desembocaduras de ríos. La infauna bentónica de fondos blandos se recolectó en 13 localidades y en cada localidad se muestrearon dos sitios. En total se estudiaron 26 estaciones entre los 9 y 31 m de profundidad durante los veranos de 2004 a 2006. En cada sitio se tomaron cuatro réplicas con una draga tipo Van Veen (400 cm2). Tres muestras se tamizaron a través de una malla de 0.5 mm de luz, se fijaron en formalina estabilizada al 10% y se preservaron en formalina al 4% para una posterior clasificación e identificación de la fauna bentónica y en particular de los poliquetos a nivel de familia. La clasificación de los poliquetos en categorías tróficas se realizó según Fauchald y Jumars (1979), siguiendo los supuestos tróficos generales adoptados en investigaciones similares a nivel mundial (Muniz y Pires 1999, Bremec y Giberto 2006).
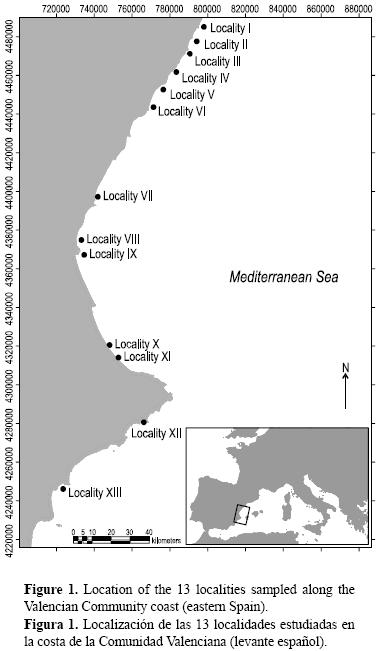
La cuarta muestra se utilizó para caracterizar el sedimento (análisis granulométrico) siguiendo la metodología propuesta por Buchanan (1984).
Se emplearon técnicas multivariantes no paramétricas para clasificar las 13 localidades en cuanto a la fauna bentónica y principalmente las familias de poliquetos, así como los factores ambientales. Todos los análisis multivariantes se realizaron con el paquete estadístico PRIMER–E (Clarke y Gorley 2006). La clasificación de las localidades se realizó a partir de la matriz de similitud de los poliquetos mediante un análisis de conglomerados. Se calcularon matrices de similitud triangulares usando el coeficiente de similitud de Bray–Curtis para los datos de fauna y la distancia euclidiana para las variables ambientales (Clarke y Warwick 2001). Para la representación gráfica de los patrones multivariantes de las agrupaciones de poliquetos se aplicó la técnica de escalamiento multidimensional no métrico (nMDS). Se llevó a cabo un análisis de segunda etapa (2STAGE) para establecer un posible patrón a lo largo del tiempo. Se realizó un análisis de porcentaje de similitud (SIMPER) para determinar la contribución porcentual de cada taxón. La posible relación entre las agrupaciones de poliquetos y los factores abióticos se determinó usando la rutina BEST (opción BIO–ENV). Se determinaron correlaciones de Spearman entre los datos y los factores abióticos (tamaño de grano del sedimento y profundidad) con el procedimiento RELATE (Clarke 1993).
RESULTADOS
El área de estudio se caracteriza por la variabilidad de los sedimentos. El porcentaje de cada tamaño de grano varió entre localidades (tabla 1). Se muestrearon un total de 43,320 especímenes, divididos en 23 grupos taxonómicos diferentes. Los poliquetos dominaron la comunidad infaunal, seguidos por los taxones Amphipoda, Tanaidacea y Bivalvia. Se registraron un total de 14,363 individuos de poliquetos y se agruparon en 45 familias. La familia de poliquetos más abundante fue Nephtyidae (13.91%), seguida por Paraonidae (12.64%), Syllidae (10.20%), Sabellidae (8.60%), Capitellidae (6.60%) y Spionidae (6.10%). Los grupos tróficos más abundantes en el área de estudio fueron los depositívoros no selectivos (23%), los carnívoros (20%), los depositívoros selectivos (18%) y los omnívoros (14%).
En la evaluación de las poblaciones de poliquetos estudiadas en 2004, el dendrograma mostró cuatro grupos principales a un nivel de disimilitud de 50%, con similitudes superiores al 70% dentro de cada grupo (fig. 2, tabla 1), y la gráfica del nMDS mostró una ordenación de las localidades según estos grupos (fig. 3a, tabla 1). Se observó, mediante la rutina 2STAGE, que el patrón detectado en 2004, en donde cada localidad se incluye en uno de los cuatro grupos, fue consistente en el tiempo (fig. 3). Por lo tanto, para caracterizar a cada grupo, se construyó una matriz de datos nueva que incluyó todos los sitios muestreados en cada tiempo, con un total de 78 muestras (13 localidades × 2 sitios × 3 tiempos).
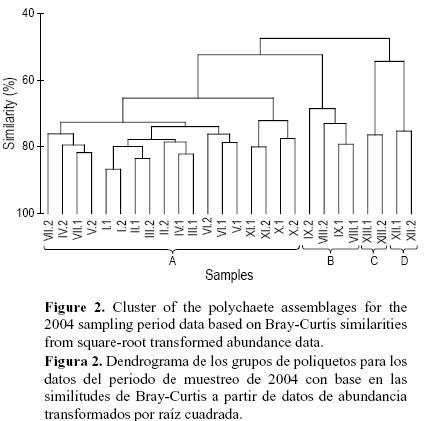
Las familias que caracterizan a cada uno de los cuatro grupos se describen en la tabla 1. El grupo A incluyó la mayoría de las localidades con un nivel de similitud de 56.75%; las categorías tróficas más abundantes en este grupo fueron los depositívoros no selectivos (29.5%), seguidos por los filtradores (fig. 4). El grupo con cuatro sitios dentro de dos localidades (grupo B, similitud de 58.34%) difiere del grupo anterior en cuanto a la composición de sus familias (tabla 1); la categoría trófica dominante fue la de los omnívoros, que representó más del 40% de la abundancia (fig. 4). El grupo C (similitud de 48.21%) sólo incluyó una localidad; las categorías tróficas que caracterizaron este grupo fueron los filtradores (30%) y los depositívoros no selectivos (25%). El grupo D (similitud de 57.75%) también sólo incluyó una localidad, donde la agrupación de poliquetos se caracterizó por una estrategia de alimentación no identificada (32%) y por depositívoros no selectivos (26%) (fig. 4). En la tabla 2 se presentan las familias responsables de las disimilitudes entre grupos. La mayoría de los grupos mostraron valores altos de diversidad de las familias de poliquetos (H' > 3), aunque los valores del grupo B fueron más elevados (3.6 ± 0.17); el grupo C mostró los menores valores de abundancia, riqueza y diversidad (tabla 1).

En la evaluación de las localidades a lo largo de los tres años, se obtuvieron correlaciones entre las variables ambientales seleccionadas y las agrupaciones de poliquetos mediante el procedimiento BIO–ENV; la mejor combinación incluyó grava, arena gruesa, fango y profundidad (correlación = 0.46). El procedimiento RELATE también indicó la relación entre los factores abióticos y la estructura de la agrupación de poliquetos (P = 0.001, p = 0.44). Al analizar cada factor, se observó una correlación positiva entre las agrupaciones de poliquetos y los siguientes factores: fango (P < 0.012, p = 0.188), arena fina (P < 0.001, p = 0.273), arena media (P < 0.032, p = 0.128), arena gruesa (P < 0.001, p = 0.3), grava (P < 0.013, p = 0.159) y profundidad (P < 0.001, p = 0.4). En el área de estudio se clasificaron cuatro hábitats bentónicos principales, definidos por sus sedimentos y la profundidad (tabla 1). Por consiguiente, la segregación de la agrupación de poliquetos en estos cuatro gupos puede estar relacionada con factores abióticos.
DISCUSIÓN
Algunos autores afirman que la distribución de los poliquetos de fondos blandos y de la infauna en general se relaciona con las características del sedimento, la hidrodinámica, la profundidad, la temperatura y/o la salinidad (Gray 1974, Simboura et al. 2000, Moreira et al. 2006). En el presente estudio se observó que la distribución de las agrupaciones de poliquetos en la costa del levante español se relaciona tanto con el tipo de sedimento como con la profundidad, al igual que lo encontrado por Labrune et al. (2007) en el Mar Mediterráneo noroccidental. La relación entre los factores abióticos y las comunidades bentónicas es compleja: el contenido de arena fina y gruesa y la profundidad fueron los factores que mostraron la mayor correlación con las comunidades bentónicas. Por lo tanto, estos parámetros podrían explicar la segregación de las agrupaciones de poliquetos en cuatro grupos diferentes. Además, a pesar de la variabilidad interanual natural que se esperaría, se detectó un patrón que es consistente en el tiempo y el espacio. El área de estudio comprendió cuatro tipos de hábitats determinados por sus sedimentos y la profundidad, que caracterizaron las agrupaciones de poliquetos.
En las localidades estudiadas, el hábitat bentónico dominante entre los 9 y 31 m de profundidad fue el de fondo arenoso (77% de las localidades), donde dominaron los poliquetos depositívoros, lo cual también ha sido documentado por Moreira et al. (2006). Se sabe que los sedimentos más finos son colonizados por depositívoros (Pearson y Rosenberg 1978); sin embargo, es posible que hayamos detectado una versión empobrecida de este hábitat en aguas someras (9 m), caracterizada por los menores valores de abundancia, riqueza y biodiversidad. Este hábitat de fondo arenoso somero (grupo C) se caracterizó por la presencia de algunas familias de poliquetos similares a las encontradas en fondos arenosos más profundos. Los filtradores fueron el grupo trófico más abundante en los fondos arenosos someros principalmente debido a la baja presencia de la fracción de fangos (tabla 1). Estos fondos arenosos presentan cierta similitud con los descrito en la clasificación de hábitats del Sistema Europeo de Información sobre la Naturaleza (EUNIS por sus siglas en inglés, http://eunis.eea.europa.eu/habitats.jsp; Davis et al. 2004), donde se clasifican como "comunidades mediterráneas de arena fina bien clasificada" (A5.236), con base en la clasificación de hábitats del Convenio de Barcelona (111.2.2) (UNEP(OCA)/MED WG.154/7 1999), derivada a partir de la clasificación de hábitats del Mar Mediterráneo (Pérès y Picard 1964), donde se clasifican como "biocenosis de arena fina bien clasificada" (SFBC).
Por otro lado, dos localidades presentan un fondo de arena guijarrosa o grava arenosa. Este hábitat mostró los mayores valores de abundancia, riqueza y biodiversidad, y se caracterizó por la presencia de poliquetos omnívoros (tabla 1). Se sabe que los sedimentos gruesos proporcionan una amplia gama de espacios intersticiales que constituyen un hábitat adecuado para las familias como Syllidae y Hesionidae (Moreira et al. 2006, Guzmán–Alvis et al. 2006). El espacio entre los granos facilita la búsqueda y captura de presas potenciales para las especies carnívoras y omnívoras (Parson et al. 1995). En este caso, no encontramos ninguna relación estrecha entre el hábitat infralitoral detectado en el área de estudio y los hábitats descritos en EUNIS o el Convenio de Barcelona, siendo lo más cercano "sedimento grueso infralitoral" (A5.13, EUNIS) o "biocenosis de arenas gruesas y gravas finas mezcladas por las olas" (111.3.1, Convenio de Barcelona; SGBV, Pérès y Picard 1964); sin embargo, nuestros sitios mediterráneos se localizan a mayor profundidad que los descritos en el Convenio de Barcelona con base en SGBV (Pérès y Picard 1964). Por lo tanto, parece ser que estos hábitats aún carecen de una descripción detallada apropiada para el Mar Mediterráneo.
La localidad más profunda fue la única que presentó un fondo arenoso fangoso con algo de grava. Este hábitat sostiene una variedad de poliquetos (tabla 1), y la familia Paralacydoniidae (Paralacydonia paradoxa) caracterizó esta comunidad. Esta familia no fue asignada una categoría trófica por Fauchald y Jumars (1979), pero tales organismos podrían ser considerados depositívoros ya que se limitan a sustratos blandos y su predominancia aumenta según disminuye el tamaño de partícula (Pearson y Rosenberg 1978). En este caso se observó una similitud con el hábitat A5.26 (EUNIS), "arena fangosa circalitoral", principalmente por el tipo granulométrico y la profundidad. En EUNIS se encuentra otro tipo de hábitat descrito para el Mar Mediterráneo (A5.28, "comunidades mediterráneas de arenas fangosas fangosas superficiales de modo calmo"), con base en el Convenio de Barcelona (III.2.3, "biocenosis de arenas fangosas superficiales de modo calmo"), pero en tales hábitats la profundidad es de 1 m en general y rara vez más de 3 m, mientras que nuestros sitios incluidos en el grupo D se localizan alrededor de 30 m. A la fecha, este hábitat no ha sido bien descrito por EUNIS; por consiguiente, se podría clasificar como "biocenosis de fondos fangosos detríticos" (DE) según Pérès y Picard (1964).
Cabe indicar que tales similitudes se basan principalmente en factores abióticos como el tipo de sedimento y la profundidad. Se detectaron algunas diferencias entre nuestras comunidades y las descritas en otras clasificaciones de hábitats; sin embargo, el mismo tipo de hábitat puede ser habitado por diferentes agrupaciones de especies, representando la variabilidad natural que debería ser cuantificada adecuadamente en otros contextos experimentales pero que, a gran escala, no debería de afectar la apreciación de la distribución de hábitat (Fraschetti et al. 2008). Se requieren de otros estudios que describan las comunidades en detalle. Nuestra contribución a la clasificación de hábitats a nivel familia es básica ya que los cambios observados en la comunidad demuestran que los análisis de altos niveles taxonómicos arrojan resultados interesantes (del–Pilar–Ruso et al. 2007, 2008).
AGRADECIMIENTOS
Esta investigación fue financiada por la Entitat de Sanejament d'Aigües. Se agradece el apoyo brindado por todo el personal del Laboratorio de Biología Marina de la Universidad de Alicante y CONSOMAR, S.A., especialmente A Climent Ballester, así como la revisión del inglés realizada por I Woollard.
REFERENCIAS
Belan TA. 2004. Marine environmental quality assessment using polychaete taxocene characteristics in Vancouver Harbour. Mar. Environ. Res. 57: 89–101. [ Links ]
Bellan G. 1984. Indicateurs et indices biologiques dans le domaine marin. Bull. Ecol. 15: 13–20. [ Links ]
Bishop MJ. 2005. Artificial sampling units: A tool for increasing the sensitivity of tests for impact in soft sediments. Environ. Monit. Assess. 107: 203–220. [ Links ]
Bremec C, Giberto D. 2006. Polychaete assemblages in the Argentinean Biogeographical Province, between 34° and 38° S. Sci. Mar. 70(S3): 249–257. [ Links ]
Buchanan JB. 1984. Sediment analysis. In: Holme NA, McIntyre AD (eds.), Methods for the Study of Marine Benthos. 2nd ed. IBP Handbook No 16, London, 387 pp. [ Links ]
Cardell MJ, Sardá R, Romero J. 1999. Spatial changes in sublittoral soft–bottom polychaete assemblages due to river inputs and sewage discharges. Acta Oecol. 20: 343–351. [ Links ]
Clarke KR. 1993. Non–parametric multivariate analyses of changes in community structure. Aust. J. Ecol. 18: 117–143. [ Links ]
Clarke KR, Warwick RM. 2001. Change in Marine Communities: An approach to statistical analysis and interpretation. 2nd ed. PRIMER–E, Plymouth. [ Links ]
Clarke KR, Gorley RN. 2006. PRIMER v6: User Manual/Tutorial. PRIMER–E, Plymouth, 176 pp. [ Links ]
Davis CE, Moss M, Hill MO. 2004. EUNIS Habitat Classification. Revised 2004. Report to the European Environment Agency. [ Links ]
Del–Pilar–Ruso Y, de–la–Ossa–Carretero JA, Giménez–Casalduero F, Sánchez–Lizaso JL. 2007. Spatial and temporal changes in infaunal communities inhabiting soft bottoms affected by brine discharge. Mar. Environ. Res. 64: 492–503. [ Links ]
Del–Pilar–Ruso Y, de–la–Ossa–Carretero JA, Giménez–Casalduero F, Sánchez–Lizaso JL. 2008. Effects of a brine discharge over soft bottom Polychaeta assemblage. Environ. Pollut. 156: 240–250. [ Links ]
Fauchald K, Jumars PA. 1979. The diet of worms: A study of polychaete feeding guilds. Oceanogr. Mar. Biol. Annu. Rev. 17: 193–284. [ Links ]
Fraschetti S, Terlizzi A, Boero F. 2008. How many habitats are there in the sea (and where)? J. Exp. Mar. Biol. Ecol. 366: 109–115. [ Links ]
Gray JS. 1974. Animal–sediment relationships. Oceanogr. Mar. Biol. Annu. Rev. 12: 223–261. [ Links ]
Gray JS. 1981. The Ecology of Marine Sediments. An Introduction to the Structure and Functions of Benthic Communities. Cambridge Univ. Press, Cambridge, 189 pp. [ Links ]
Gray JS. 2002. Species richness of marine soft sediments. Mar. Ecol. Prog. Ser. 244: 285–297. [ Links ]
Gray JS, Mirza FB. 1979. A possible method for detection of pollution–induced disturbance on marine benthic communities. Mar. Pollut. Bull. 10: 142–146. [ Links ]
Guzmán–Alvis AI, Lattig P, Ruiz JA. 2006. Spatial and temporal characterization of soft bottom polychaetes in a shallow tropical bay (Colombian Caribbean). Bol. Invermar. 35: 19–36. [ Links ]
Hutchings P. 1998. Biodiversity and functioning of polychaetes in benthic sediments. Biodivers. Conser. 7: 1133–1145. [ Links ]
Labrune C, Grémare A, Amouroux JM, Sardá R, Gil J, Taboada S. 2007. Assessment of soft–bottom polychaete assemblages in the Gulf of Lions (NW Mediterranean) based on a mesoscale survey. Est. Coast. Shelf Sci. 71: 133–147. [ Links ]
Mair JM, Cunningham SL, Sibaja–Cordero JA, Guzmán HM, Arroyo MF, Merino D, Vargas R. 2009. Mapping benthic faunal communities in shallow and deep sediments of Las Perlas Archipelago, Pacific Panama. Mar. Pollut. Bull. 58: 375–383. [ Links ]
Moreira J, Quintas P, Troncoso JS. 2006. Spatial distribution of soft–bottom polychaete annelids in the Ensenada de Baiona (Ría de Vigo, Galicia, northwest Spain). Sci. Mar. 70: 217–224. [ Links ]
Muniz P, Pires AMS. 1999. Trophic structure of polychaetes in the Sao Sebastiao Channel (southeastern Brazil). Mar. Biol. 134: 517–528. [ Links ]
Parson TR, Takahashi M, Hargrave B. 1995. Biological Oceanographic Processes. Butterworth–Heinemann, Oxford, 330 pp. [ Links ]
Pearson TH, Rosenberg R. 1978. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment. Oceanogr. Mar. Biol. Annu. Rev. 16: 229–311. [ Links ]
Pérès JM, Picard J. 1964. Nouveau manuel de bionomie benthique de la Mer Mediterranee. Recueil des Travaux de la Station Marine d'Endoume. Bull. No. 34, Fasc. No. 7, 137 pp. [ Links ]
Simboura N, Nicolaidou A, Thessalou–Legaki M. 2000. Polychaete communities of Greece: An ecological overview. P.S.Z.N.I. Mar. Ecol. 21: 129–144. [ Links ]
UNEP(OCA)/MED WG.154/7. 1999. Report of the fourth meeting of national focal points for specially protected areas. Tunis. [ Links ]
Wentworth CK. 1922. A scale of grade and class terms for clastic sediments. J. Geol. 30: 377–392. [ Links ]
*Traducido al español por Christine Harris.
**Descargar versión bilingüe (Inglés–Español) en formato PDF.














