Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.2 Ensenada jun. 2011
Artículos
Tratamiento con baños de oxitetraciclina a jóvenes de abulón azul Haliotis fulgens (Philippi 1845) afectados por el síndrome de deshidratación*
Oxytetracycline water bath treatment of juvenile blue abalone Haliotis fulgens (Philippi 1845) affected by the withering syndrome**
Z García–Esquivel1*, J Cáceres–Martínez2, S Montes–Magallón1
1 Universidad Autónoma de Baja California, Instituto de Investigaciones Oceanológicas, Km. 107 carretera Tijuana–Ensenada, Ensenada 22870, Baja California, México.
2 Centro de Investigación Científica y de Educación Superior de Ensenada, Carretera Ensenada–Tijuana # 3918, Zona Playitas, Ensenada, Baja California, México.
*Corresponding author.
E–mail: sgarcia@uabc.edu.mx
Received June 2010
Accepted February 2011
RESUMEN
La enfermedad mortal conocida como síndrome de deshidratación (SD), causada por un organismo procariota del tipo Rickettsiales clasificado como Xenohaliotis californiensis, ha sido tratada con éxito relativo mediante inyecciones y la administración oral de oxitetraciclina (OTC). Estos tratamientos terapéuticos tienen limitaciones prácticas para su aplicación en instalaciones acuiculturales y experimentales debido a la incapacidad de los organismos severamente enfermos para alimentarse y a la necesidad de incorporar el antibiótico en alimento peletizado, aumentando así los costos de producción. Durante un experimento para determinar el efecto del fotoperiodo y la temperatura sobre el crecimiento de jóvenes del abulón azul Haliotis fulgens, algunos animales mostraron síntomas del SD. Para el tratamiento de los animales enfermos se utilizaron baños de OTC a 400 mg L–1 durante una hora diaria por siete días. También se cuantificó la tasa metabólica de un grupo de estos organismos. El tiempo de recuperación (tiempo para que un organismo volteado recupere su posición correcta) y la talla fueron evaluados a los 0, 14 y 29 días. Al tercer día del tratamiento la mayoría de los animales recuperaron una capacidad limitada de adhesión, y comenzaron a ingerir alimento y a producir heces. Después de una semana, más del 50% de los abulones tratados recuperaron su posición normal en los primeros 10 min después de haber sido volteados. Después de 30 días, todos los organismos mostraron una capacidad fuerte de adhesión. La tasa metabólica disminuyó de 380 (inicial) a 280 µL O2 ind–1 h–1 después de dos semanas de tratamiento. El presente estudio abre la puerta para realizar investigaciones posteriores sobre el uso y manejo práctico de baños de OTC en el cultivo de abulón.
Palabras clave: abulón azul, Haliotis fulgens, síndrome de deshidratación, oxitetraciclina.
ABSTRACT
The fatal abalone disease named withering syndrome (WS), caused by a Rickettsiales–like prokaryote classified as Xenohaliotis californiensis, has been treated by injections and oral administration of oxytetracycline (OTC) with relatively successful results. These therapeutic treatments have practical limitations for their application in aquacultural and experimental facilities due to the inability to eat of severely ill organisms, and the need to incorporate the antibiotic in pelletized food, increasing production costs. During an experiment to determine the effect of photoperiod and temperature on the growth of juvenile blue abalone Haliotis fulgens, some animals showed overt symptoms of WS. Oxytetracycline baths at 400 mg L–1 were used for one hour daily during seven days to treat diseased animals. The metabolic rate of one group of these organisms was also assessed. Recovery time (time for an organism to regain the upright position) and size were assessed on days 0, 14, and 29. By the third day of treatment, most treated animals regained a limited adhesion capacity, and began to ingest food and to produce feces. After one week, more than 50% of the treated abalone were capable of regaining the upright position within the first 10 min of being turned upside down. After 30 days all organisms showed strong adhesion to the substrate. Metabolic rate declined from 380 (initially) to 280 µL O2 ind–1 h–1 after two weeks of treatment. This study opens the door for further research on the use of OTC baths for practical use in abalone culture and management.
Key words: blue abalone, Haliotis fulgens, withering syndrome, oxytetracycline.
INTRODUCCIÓN
En el transcurso de un experimento para determinar el efecto del fotoperiodo y la temperatura sobre el crecimiento de jóvenes del abulón azul Haliotis fulgens (ver García–Esquivel et al. 2007), algunos animales mostraron síntomas del síndrome de deshidratación (SD), una enfermedad infecciosa mortal de las especies de abulón de la costa Pacífica de Norte América (Friedman y Finley 2003, Cáceres–Martínez y Tinoco–Orta 2001, Alvarez et al. 2002). Los síntomas clínicos del SD son debilidad, letargo, reducción del músculo del pie, retracción del manto, desarrollo gonadal pobre, incapacidad de adherirse firmemente al sustrato y muerte (Haaker etal. 1992, VanBlaricom et al. 1993). Gardner et al. (1995) sugirieron una fuerte relación entre patógeno y enfermedad. Se describió el patógeno como un organismo procariota del tipo Rickettsiales (RLP, por sus siglas en inglés) que infecta las células epiteliales que recubren el intestino y las células secretoras de enzimas del divertículo digestivo. La asociación entre estas bacterias intracelulares y el SD se determinó a partir de estudios indirectos en los cuales se administraron inyecciones de antibióticos a abulones infectados y su posterior recuperación (Friedman et al. 2003, Moore et al. 2000). Friedman et al. (2000), mediante características antigénicas, fisiológicas y de historia de vida, así como la secuencia del gen 16s rRNA, identificaron la bacteria como Xenohaliotis californiensis. Experimentos para el tratamiento de abulones infectados han mostrado que estas bacterias pueden ser tratadas con inyecciones de oxitetraciclina (OTC) en el músculo del pie (Friedman et al. 2003). La administración oral de este antibiótico también ha resultado relativamente exitoso contra los RLP en aplicaciones a escala tanto piloto como de producción (Friedman et al. 2003, 2007). Los baños de OTC no han sido utilizados previamente para controlar esta enfermedad en abulones, pero sí se han utilizado a nivel experimental para el tratamiento de infecciones en peces, con resultados algo pobres en comparación con la administración oral o inyectada (Marking et al. 1988). Esto se debe principalmente a las altas concentraciones de antibiótico que se requieren para obtener una respuesta inhibitoria significativa (O'Grady et al. 1988). También se han documentado resultados pobres para los tratamientos con baños de OTC de larvas triploides del ostión del Pacífico Crassostrea gigas afectadas con necrosis bacilar (Matsubara et al. 2002) o de larvas de la vieira Pecten maximus (Torkildsen et al. 2002); sin embargo, no se realizó una discriminación entre los efectos del antibiótico y la manipulación en la mortalidad total de estas etapas. A pesar de estos resultados, el uso de baños de agua medicados podría representar una herramienta potencialmente importante en el caso de los moluscos, ya que éstos absorben materia orgánica disuelta con facilidad (Manahan 1990, Wright y Ahearn 1997) y tienen receptores periféricos para captar algunos medicamentos (Betti et al. 2003). Además, su uso podría ser de ventaja práctica en condiciones de cultivo, ya que no es necesario mezclar el medicamento con el alimento, y podría actuar en individuos lo suficientemente afectados con el SD que no pueden consumir alimento medicado. Finalmente, es fácil deshacerse de cualquier OTC no utilizado de los tanques de tratamiento para evitar que el antibiótico o sus residuos sean introducidos en el sistema de cultivo. En el presente trabajo se documenta la respuesta a los baños de OTC del SD en individuos jóvenes del abulón azul H. fulgens.
MÉTODOS
Abulón
Durante un experimento para determinar el efecto de la temperatura y el fotoperiodo sobre el crecimiento y la fisiología alimenticia de jóvenes de H. fulgens en un periodo de seis meses (García–Esquivel et al. 2007), los abulones mantenidos a 25 °C empezaron a mostrar síntomas leves del SD al desprenderse con relativa facilidad de las paredes de los recipientes. Treinta abulones (35.4 ± 0.7 mm, 6.6 ± 0.4 g de peso vivo) fueron seleccionados aleatoriamente y sacrificados, y su músculo y masa visceral se fijaron en el fijador de Davidson (Shaw y Battle 1957) por 24 h. Se procesaron secciones con porciones del tracto digestivo (incluyendo el esófago posterior), riñón, músculo, epipodio, gónadas y branquias para su estudio histológico. Se tiñeron secciones de 5 |am con hematoxilina de hierro y eosina. La intensidad de la infección de RLP se estimó considerando el número de inclusiones de bacterias en cada preparación histológica a una magnificación de 200x (suma de todos los focos sobre el portaobjeto), los cuales se enumeraron usando una modificación de la escala propuesta por Friedman et al. (1997): (0) cero RLP, (1) de 1 a 10 RLP, (2) de 11 a 100 RLP, (3) de 101 a 1000 RLP y (4) >1000 RLP.
La condición general de los organismos empeoró, incrementando la mortalidad en los siguientes cuatro meses. Por tal razón, en septiembre de 2002 se trataron un total de 20 abulones con síntomas severos del SD (incapacidad de ingerir alimento peletizado, pérdida adicional de masa muscular, incapacidad de adherirse a las paredes laterales del recipiente, volteados al revés la mayor parte del tiempo) como se describe a continuación.
Tratamiento antibiótico y evaluación de la recuperación
Se utilizaron de forma simultánea dos grupos de abulones (grupo A, 41.8 ± 1.6 mm, 10.7 ± 1.1 g de peso humedo total; grupo B, 45.4 ± 2.2 mm, 13.7 ± 2.0 g), cada uno con 10 individuos infectados severamente, para el tratamiento experimental con baños de OTC (Terramicina [clorhidrato de oxitetraciclina], Pfizer Inc.). La solución se preparó de antemano diluyendo la OTC con agua de mar filtrada en un recipiente de plástico de 2 L hasta una concentración final de 400 mg OTC L–1 (ca. 3.2 g de cápsulas de Terramicina pulverizadas por litro). El tratamiento inició el día 0 (grupo A) o el día 14 (grupo B). Los organismos enfermos de cada grupo fueron transferidos de un sistema abierto con flujo de agua de mar (20 °C) al baño de OTC, donde permanecieron durante una hora con aireación, pero sin flujo. Al finalizar el tratamiento, los abulones fueron enjuagados con agua de mar antes de ser regresados al sistema de flujo abierto. El tratamiento se repitió diariamente por siete días consecutivos, realizándose observaciones visuales y cualitativas de la fuerza de adhesión a los recipientes durante este periodo.
La capacidad de recuperación, definida aquí, según Aquilina y Roberts (2000), como "el tiempo para que un organismo en posición invertida recupere su posición correcta", se evaluó simultáneamente en ambos grupos los días 0, 14 y 29. Los organismos fueron colocados en el fondo de una bandeja de plástico con agua de mar y volteados. La capacidad de recuperación se registró para cada individuo durante un periodo total de 20 min. Al final de cada ensayo se determinó y graficó el porcentaje acumulativo de los organismos que recuperaron su posición normal.
Tasa metabólica
La tasa metabólica (tasa de consumo de oxígeno, VO2) se midió en los organismos del grupo B justo antes de iniciar el tratamiento con OTC (día 14) y dos semanas después (día 29) mediante respirometría en cámaras cerradas. Estudios anteriores realizados en jóvenes de H. fulgens han mostrado que la tasa metabólica es una variable sensible que refleja la condición fisiológica instantánea de los abulones y cualquier respuesta de estrés producida por medicamentos como los anestésicos (Chacón et al. 2003). Brevemente, se corrieron en paralelo cinco cámaras metabólicas (ca. 1.8 L de capacidad) con dos abulones cada una y tres cámaras vacías (sin abulones) para medir el cambio en la concentración de oxígeno, realizándose lecturas continuas durante un periodo de una hora con sensores polarográficos de oxígeno conectados a dos oxímetros (Strathkelvin Instruments). Se realizaron de dos a tres incubaciones entre 11:00 a.m. y 4:00 p.m., y se utilizó el promedio de todas las incubaciones realizadas en cada fecha para estimar las tasas metabólicas diarias siguiendo el método propuesto por Chacón et al. (2003).
RESULTADOS
Análisis histopatológico
Los RLP se encontraron en todos los abulones con síntomas del SD (prevalencia de 100%) con una intensidad de 1 a 4; el valor promedio de la intensidad media fue de 3.75. Estas bacterias infectaron las células epiteliales del tracto digestivo, incluyendo el esófago posterior, estómago, divertícula digestiva e intestino (fig. 1a, b). Los RLP formaron colonias dentro de una vacuola grande en el citoplasma de las células infectadas. Estas colonias variaron en forma desde redondas hasta elongadas y su tamaño varió de 16.3 × 9.6 a 23 × 11 µm (fig. 1c). El núcleo de la célula huésped fue desplazado al límite del citoplasma; la célula huésped se hipertrofió (fig. 1d) y cuando la glándula digestiva resultó severamente infectada se observó metaplasia epitelial (fig. 1e). Varias células infectadas se observaron rotas y las colonias bacterianas fueron expulsadas hacia el lumen del tracto digestivo (fig. 1f).
Ensayos de recuperación
Los organismos enfermos no respondieron el primer día al tratamiento de 1 h con OTC. No obstante, los baños de OTC tuvieron un efecto terapéutico rápido y consistente en ambos grupos de abulones, y al tercer día del tratamiento los animales recuperaron una capacidad limitada de adhesión a las paredes de los recipientes y comenzaron a ingerir alimento y a producir heces. El efecto terapéutico a corto plazo también fue evidente en los ensayos de recuperación, ya que el 70% de los organismos no tratados de ambos grupos requirieron más de 20 min para voltearse al inicio del experimento, pero dos semanas después del tratamiento, el 100% de los organismos del grupo A y el 90% del grupo B pudieron recuperar su posición normal dentro de los primeros 15 min (tabla 1). Después de 30 días, fue necesario desprender todos los organismos con una espátula debido a su fuerte adhesión a las paredes de los recipientes. Ningún organismo del grupo A murió durante o después del tratamiento con OTC; sin embargo, un organismo del grupo B murió cuatro días después de iniciar el tratamiento.
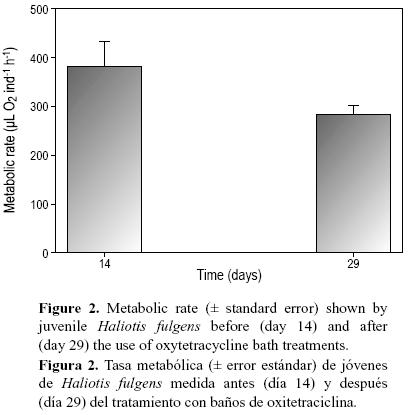
La tasa metabólica medida en los organismos del grupo B presentó una tendencia a disminuir, aunque no significativamente, después del tratamiento con OTC. Esta tasa decreció de 382 ± 52 µL O2 ind–1 h–1 (organismos infectados, no tratados) a 283 ± 20 O2 ind–1 h–1 después de dos semanas de iniciar el tratamiento (fig. 2).
DISCUSIÓN
Se ha documentado que algunas formas de OTC tienen una biodisponibilidad limitada debido a sus propiedades quelantes o porque forman complejos con cationes polivalentes como Ca++, Fe++, Al+++ y Mg++ (Riviere y Spoo 1995); sin embargo, la forma de OTC empleada en el presente trabajo (clorhidrato de OTC) es fácilmente soluble en agua, y la solución se torna turbia por la liberación de la base de OTC en el agua (FDA 2006). Por lo tanto, es de esperarse que mientras el compuesto permanezca en la solución, éste estará disponible para que los animales lo capten por las branquias o lo absorban a través de la superficie corporal. Los resultados preliminares del presente estudio muestran que 1 h de baños de agua con OTC indujo la recuperación de abulones muy enfermos, según lo demuestran: (a) la capacidad de los abulones tratados de readherirse a las paredes de los recipientes tan solo tres días después de su aplicación, (b) la capacidad de reducir el tiempo necesario para voltearse y recuperar su posición normal, y (c) la disminución de la tasa metabólica. Esta capacidad de los abulones para recuperar su posición correcta ya ha sido utilizada como criterio práctico para evaluar el grado de recuperación en organismos postanestesiados (Aquilina y Roberts 2000, Chacón et al. 2003). Los datos obtenidos para ambos grupos A y B dos semanas después del tratamiento son similares a los valores documentados previamente para jóvenes sanos de H. fulgens (ca. 80% de recuperación en 20 min) de tamaño similar (25–35 mm, Chacón et al. 2003), lo que sugiere que los organismos tratados con OTC (este estudio) recuperaron rápidamente su actividad motriz.
La tasa metabólica ha demostrado ser una herramienta sensible para evaluar el grado de recuperación fisiológica postanestesia (Chacón et al. 2003). Se esperaría que cualquier factor pudiese contribuir al cambio en la tasa metabólica a lo largo de dos semanas; sin embargo, nuestros datos de VO2 se obtuvieron con los mismos organismos evaluados dos veces (antes y después del tratamiento con OTC) en las mismas condiciones experimentales, y la única variable conspicua que cambió durante el periodo de dos semanas fue la salud de los organismos. Se piensa que los valores de VO2 que se presentan en la figura 2 reflejaron rápidamente el metabolismo de los abulones, medido antes y después del tratamiento con OTC. Esto se sustenta por el hecho de que las barras de error de nuestros datos son relativamente pequeños, lo cual es indicativo de una respuesta consistente en las cinco cámaras usadas para medir el metabolismo. Asimismo, nuestros datos, cuando se expresan en función del peso, son comparables con los publicados previamente para jóvenes de H. fulgens (Chacón et al. 2003). Si se considera que los abulones enfermos no podían comer antes del tratamiento con OTC, es factible suponer que la alta tasa metabólica observada al principio del tratamiento correspondió a los costos de mantenimiento junto con la condición de estrés de los organismos. Por lo tanto, la disminución de la tasa metabólica después del tratamiento puede ser resultado de la recuperación neta de los organismos enfermos y la consecuente reducción de costo energético y estrés. Se sabe que los humanos fuertemente sedados o paralizados médicamente presentan un metabolismo basal elevado (Frankenfield et al. 1994). También se ha observado un incremento en los costos de mantenimiento en individuos crónicamente estresados del esturión Acipenser medirostris (Lankford et al. 2003), y se ha documentado que el costo de mantenimiento contribuye a una mayor proporción del costo metabólico total de moluscos bivalvos en condiciones de inanición (Widdows y Hawkins 1989, García–Esquivel et al. 2002). Aunque no exhaustivos, los resultados combinados del metabolismo y la actividad motriz del presente estudio indican que los baños de agua con OTC pueden ser herramientas terapéuticas efectivas para tratar abulones con síntomas severos del SD.
Estudios recientes sobre el empleo de OTC con fines profilácticos y terapéuticos han enfatizado el uso de alimentos medicados, actualmente aprobado en los Estados Unidos, en forma de Terramicina para peces, para el control de varias enfermedades en salmónidos y de gafkemia en langostas (National Aquaculture Association 2003). Los estudios más recientes en abulones (Friedman et al. 2003, 2007) muestran que una dieta que contiene 4.2% de OTC reduce las infecciones bacterianas y la mortalidad del abulón rojo Haliotis rufescens cuando se administra durante 14 días, y que el abulón blanco Haliotis sorenseni fue tratado éxitosamente con una dieta medicada con 9% de Terramicina (TM–100 Pfizer) (1.625% de OTC), suministrada a una tasa diaria de 90.82 mg OTC kg–1 de peso corporal durante 20 días; sin embargo, no se intentó utilizar baños de agua como un método alternativo de tratamiento. La concentración de OTC empleada en el presente estudio (400 mg L–1 de agua de mar) no puede ser comparada directamente con la concentración usada por Friedman et al. (2003, 2007), ya que nosotros usamos un baño de 2 L para tratar 10 organismos al mismo tiempo. Se utilizó la misma cantidad de agua medicada (2 L, 400 mg OTC L–1 de agua de mar) para tratar secuencialmente hasta 75 organismos con el mismo éxito (evaluación visual, no un experimento formal). Con base en esto, es factible usar una razón de 800 mg OTC por 800 g de peso vivo como punto de partida para optimizar el empleo de OTC en baños de agua. Esta cantidad es menor que la de 14.5 g OTC kg–1 de abulón propuesta por Friedman et al. (2003) por medio de alimento medicado. Es importante mencionar, sin embargo, que el método empleado por Friedman et al. (2003) y el usado en el presente trabajo son completamente diferentes y es necesario realizar una comparación paralela para obtener una evaluación más confiable. La administración de OTC por inyección ha demostrado ser ineficaz una vez que los síntomas clínicos del SD son evidentes en el abulón y el daño a los tejidos se encuentra en una fase avanzada (Friedman et al. 2003). Los animales usados en el presente estudio estaban muy enfermos y mostraban síntomas del SD. Su elevada capacidad de recuperación después del tratamiento con baños de OTC puede ser por lo menos parcialmente explicada por el tamaño de los animales (metabolismo alto), su capacidad de absorber materia orgánica disuelta (Manahan 1990, Wright y Ahearn 1997), y la existencia de receptores periféricos para captar algunos medicamentos (Betti et al. 2003). A pesar de los resultados positivos del presente estudio, sería recomendable realizar experimentos a mediano y largo plazo a fin de descartar la posibilidad de resistencia antibiótica al utilizar baños de agua con OTC. Tales estudios también deberían incluir pruebas histológicas para la presencia de RLP al final del experimento. Es posible que el uso continuo de antibióticos con fines profilácticos y/o terapéuticos podría resultar en el desarrollo de resistencia en instalaciones comerciales de acuicultura (Hameed et al. 2003). Por otro lado, es importante utilizar y disponer del agua tratada adecuadamente para evitar la dispersión de los residuos de antibióticos en el medio ambiente (Hernández 2005). Ésta es un área sensible que requiere mayores estudios.
Es importante mencionar que se utilizó una sola dosis de antibiótico en el presente estudio para evaluar el uso de baños con OTC. Ensayos preliminares mostraron la incapacidad de los abulones para recuperarse cuando se usaron concentraciones de OTC por debajo de 1 mg L–1, aun después de 10 días consecutivos de tratamiento (observaciones visuales). Estudios previos también han demostrado la ineficacia de los baños con bajas concentraciones de OTC en el tratamiento de enfermedades bacterianas en larvas de P. maximus (Torkildsen et al. 2002) o necrosis bacilar en larvas de C. gigas (Matsubara et al. 2002). Por lo tanto, los resultados obtenidos en el presente trabajo abren la puerta para realizar estudios adicionales sobre curvas de concentración–respuesta específicas en abulón, así como de las concentraciones residuales de OTC en distintos tejidos y su posible efecto en la comercialización.
Según Friedman et al. (1997), las altas temperaturas por si solas no son una causa directa del SD, pero sí aceleran la mortalidad de los animales infectados. Estos autores encontraron que la mortalidad fue mayor y más rápida en el abulón negró Haliotis cracherodii mantenido a 20 °C que a 13 °C. En el presente estudio, Los ejemplares de H. fulgens mantenidos a 20 y 25 °C mostraron la misma prevalencia de infección, pero la intensidad fue ligeramente mayor en los mantenidos a 25 °C. Las diferencias en la respuesta al SD de H. cracherodii y H. fulgens probablemente se relacionan con las diferencias en la preferencia de temperatura específica de cada especie; sin embargo, aún se desconoce el papel exacto de la temperatura en el desarrollo del SD.
AGRADECIMIENTOS
Se agradece la revisión crítica de dos revisores anónimos que ayudó a mejorar significativamente la versión original del manuscrito.
REFERENCIAS
Alvarez TMC, Cáceres–Martínez J, González, AJG. 2002. Histopathological evaluation of the yellow abalone Haliotis corrugata and the blue abalone Haliotis fulgens from Baja California, Mexico. J. Shellfish Res. 21: 825–830. [ Links ]
Aquilina B, Roberts R. 2000. A method for inducing muscle relax–ation in the abalone, Haliotis iris. Aquaculture 190: 403–408. [ Links ]
Betti L, Giannaccini G, Nigro M, Dianda S, Gremigni V, Lucacchini A. 2003. Studies of peripheral benzodiazepine receptors in mussels: Comparison between a polluted and a nonpolluted site. Ecotoxicol. Environ. Saf. 54: 36–42. [ Links ]
Cáceres–Martínez J, Tinoco–Orta G. 2001. Symbionts of cultured red abalone Haliotis rufescens from Baja California, Mexico. J. Shellfish Res. 20: 875–881. [ Links ]
Chacón O, Viana MT, Farías A, Vazquez AC, García–Esquivel Z. 2003. Circadian metabolic rate and short–term response of juvenile green abalone (Haliotis fulgens Philippi) to three anesthetics. J. Shellfish Res. 22: 415–421. [ Links ]
FDA, Food and Drug Administration. 2006. Freedom of Information Summary, Oxytetracycline Hydrochloride. File number ANADA 200–305, Vétoquinol N.–A., Inc., Lavaltrie (PQ), Canada, 6pp (http://www.fda.gov/downloads/AnimalVeterinary/Products/ApprovedAnimalDrugProducts/FOIADrugSummaries/ucm061757.pdf). [ Links ]
Frankenfield DC, Wiles CE, Bagley S, Siegel JH. 1994. Relationships between resting and total energy expenditure in injured and septic patients. Crit. Care Med. 22: 1796–1804. [ Links ]
Friedman CS, Finley CA. 2003. Anthropogenic introduction of the etiological agent of withering syndrome into northern California abalone populations via conservation efforts. Can. J. Fish. Aquat. Sci. 60: 1424–1431. [ Links ]
Friedman CS, Thompson M, Chun C, Haaker PL, Hedrick RP. 1997. Withering syndrome of the back abalone, Haliotis cracherodii (Leach): Water temperature, food availability, and parasites as possible causes. J. Shellfish Res. 16: 403–111. [ Links ]
Friedman CS, Andree KB, Beauchamp K, Moore JD, Robbins TT, Shields JD, Hedrick RP. 2000. "Candidatus Xenohaliotis californiensis", a newly described pathogen of abalone, Haliotis spp., along the west coast of North America. Int. J. Syst. Evol. Microbiol. 50: 847–855. [ Links ]
Friedman CS, Trevelyan G, Robbins TT, Mulder EP, Fields R. 2003. Development of an oral administration of oxytetracycline to control losses due to withering syndrome in cultured red abalone Haliotis rufescens Aquaculture 224: 1–23. [ Links ]
Friedman, CS, Scott BB, Estes RS, Vadopalas B, McCormick TB. 2007. Oxytetracycline as a tool to manage and prevent losses of the endangered white abalone, Haliotis sorenseni, caused by withering syndrome. J. Shellfish Res. 26: 877–885. [ Links ]
García–Esquivel Z, Bricelj VM, Felbeck H. 2002. Metabolic depression and whole–body response to enforced starvation by Crassostrea gigas postlarvae. Comp. Biochem. Physiol. A: Mol. Integra. Physiol. 133A: 63–77. [ Links ]
García–Esquivel Z, Montes–Magallón S, González–Gómez MA. 2007. Effect of temperature and photoperiod on the growth, feed consumption, and biochemical content of juvenile green abalone, Haliotis fulgens, fed on a balanced diet. Aquaculture 262: 129–141. [ Links ]
Gardner GR, Harshbarger JC, Lake JL, Sawyer TK, Price KL, Stephenson MD, Haaker PL, Togstad HA. 1995. Association of prokaryotes with symptomatic appearance of withering syndrome in black abalone Haliotis cracherodii. J. Invertebr. Pathol. 66: 111–120. [ Links ]
Haaker PL, Parker DO, Togstad H, Richards DV, Davis GE, Friedman CS. 1992. Mass mortality and withering foot syndrome in black abalone, Haliotis cracherodii, in California. In: Shepard SA, Tegner MJ, Guzmán del Próo SA (eds.), Abalone of the World: Biology, Fisheries and Culture. Proc. 1st International Symposium on Abalone. Fishing News Books, Cambridge, pp. 214–224. [ Links ]
Hameed ASS, Raham KH, Alagan A, Yoganandhan K. 2003. Antibiotic resistance in bacteria isolated from hatchery–reared larvae and post–larvae of Macrobrachium rosenbergii. Aquaculture 217: 39–48. [ Links ]
Hernández, SP. 2005. Responsible use of antibiotics in aquaculture. FAO Fish. Tech. Pap. 149: 97 pp. [ Links ]
Lankford SE, Cech JJ, Adams TE. 2003. Swimming performance, standard metabolic rate, and metabolic scope for activity as measures of chronic stress in green sturgeon, Acipenser medirostris. FASEB J. 17, Abstract No. 313.13. [ Links ]
Manahan DT. 1990. Adaptation by invertebrate larvae for nutrient acquisition from seawater. Am. Zool. 30: 147–160. [ Links ]
Marking LL, Howe GE, Crowther JR. 1988. Toxicity of erythromycin oxytetracycline and tetracycline administered to lake trout in water baths by injection or by feeding. Prog. Fish. Cult. 50: 197–201. [ Links ]
Matsubara D, Tanaka M, Soumyou Y, Hirakawa K, Doi R, Nakai T. 2002. Therapeutic effects of antimicrobial compounds against bacillary necrosis of larval Pacific oyster. Fish Pathol. 37: 183–188. [ Links ]
Moore JD, Robbins TT, Friedman CS. 2000. Withering syndrome in farmed red abalone, Haliotis rufescens: Thermal induction and association with a gastrointestinal rickettsiales–like prokaryote. J. Aquat. Anim. Health 12: 26–34. [ Links ]
National Aquaculture Association. 2003. Judicious Antimicrobial Use in US Aquaculture: Principles and Practices. 5 pp. Manuscript available at http://www.thenaa.net/downloads/Judicious_Antimicrobial_Use.pdf. [ Links ]
O'Grady P, Moloney M, Smith PR. 1988. Bath administration of the quinoline antibiotic flumequine to brown trout Salmo trutta and Atlantic salmon S. salar. Dis. Aquat. Org. 4: 27–33. [ Links ]
Riviere JE, Spoo JW. 1995. Tetracycline antibiotics. In: Booth NE, McDonald LE (eds.), Veterinary Pharmacology and Therapeutics. Iowa State Univ. Press, Ames, pp. 784–796. [ Links ]
Shaw BL, Battle HI. 1957. The gross microscopic anatomy of the digestive gland of the oyster Crassostrea virginica (Gmelin). Can. J. Zool. 35: 325–346. [ Links ]
Torkildsen L, Coyne R, Samuelsen OB, Magnesen T, Bergh O. 2002. Treatment of the early life stages of scallop (Pecten maximus) with antimicrobial agents; searching for an alternative to chloramphenicol. Aquacult. Int. 10: 399–409. [ Links ]
VanBlaricom GR, Ruediger JL, Friedman CS, Woodard DD, Hedrick RP. 1993. Discovery of withering syndrome among black abalone Haliotis cracherodii Leach, 1814, populations at San Nicolas Island, California. J. Shellfish Res. 12: 185–188. [ Links ]
Widdows J, Hawkins AJ. 1989. Partitioning of rate of heat dissipation by Mytilus edulis into maintenance, feeding and growth components. Physiol. Zool. 62: 764–784. [ Links ]
Wright SH, Ahearn GA. 1997. Nutrient absorption in invertebrates. In: Dantzler WH (Ed.), Comparative Physiology Vol. II. Oxford University Press, pp. 1137–1205. [ Links ]
*Traducido al español por Christine Harris.
**Descargar versión bilingüe (Inglés–Español) en formato PDF.














