Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.2 Ensenada jun. 2011
Artículos
Ictiofauna asociada a las praderas de Cymodocea nodosa en las Islas Canarias (Atlántico centro oriental): Estructura de la comunidad y función de "guardería"
Ichthyofauna associated with Cymodocea nodosa meadows in the Canarian Archipelago (central eastern Atlantic): Community structure and nursery role*, **
F Espino1*, F Tuya1, 2, A Brito3, RJ Haroun1
1 Grupo de Investigación en Biodiversidad y Gestión Ambiental, Departamento de Biología, Facultad de Ciencias del Mar, Universidad de Las Palmas de Gran Canaria, Campus de Tafira, 35017, Las Palmas de Gran Canaria, Gran Canaria, Islas Canarias, España.
2 Laboratory of Coastal Diversity, CIIMAR, Rua dos Bragas 289, 450–123 Porto, Portugal.
3 Grupo de Investigación BIOECOMAC, Unidad de Ciencias Marinas, Departamento de Biología Animal, Facultad de Biología, Universidad de La Laguna, 38206, La Laguna, Tenerife, Islas Canarias, España.
*Corresponding author.
E–mail: fesprod@gobiernodecanarias.org
Received March 2010
Accepted February 2011
RESUMEN
Se realizaron 84 arrastres en 41 praderas marinas de la fanerógama Cymodocea nodosa en tres islas del Archipiélago Canario, de junio a septiembre de 2003, con los objetivos de describir la ictiofauna (composición, riqueza y abundancia) asociada, analizar el papel que puede desempeñar esta comunidad como hábitat para el reclutamiento y la cría de peces, y determinar la posible relación entre la estructura espacial de la pradera y la riqueza y abundancia del poblamiento de peces. Se capturaron 8298 individuos. Las cinco especies más importantes, en términos de abundancia y frecuencia, fueron Spondyliosoma cantharus, Diplodus annularis, Syngnathus typhle, Mullus surmuletus y Pagellus erythrinus. Gran Canaria presentó la mayor riqueza (36 especies) y número medio de especies por muestra (8.69 ± 0.49; media ± error estándar). Lanzarote presentó el mayor número de individuos (64.83% del total registrado) y abundancia total media por muestra (168.39 ± 30.91). Se registró una densidad alta de individuos (95.86 ± 13.5) y el 92.91% de los peces capturados fueron jóvenes. Nuestros datos mostraron que las diferencias en la estructura física de las praderas marinas no afectaron los patrones de riqueza y abundancia del poblamiento de peces. En conclusión, las praderas de C. nodosa en Canarias presentaron una ictiofauna característica, además contribuyen con el mantenimiento de la diversidad de la comunidad de peces litorales; en primavera y verano constituyen un hábitat de "guardería" para los jóvenes de diversas especies de peces, muchas de interés comercial.
Palabras clave: estructura de la comunidad, función de "guardería", Cymodocea nodosa, praderas marinas, Archipiélago Canario.
ABSTRACT
We carried out 84 trawls in 41 seagrass meadows composed of the phanerogam Cymodocea nodosa at three islands of the Canarian Archipelago, during June to September 2003, in order to describe the associated ichthyofauna (composition, richness, and abundance), to analyze the role that this habitat can play in fish recruitment, and to determine the potential relationship between the spatial structure of the seagrass meadow and the patterns of richness and abundance of the fish assemblage. A total of 8298 individuals were captured. The five most relevant species, in terms of abundance and frequency, were Spondyliosoma cantharus, Diplodus annularis, Syngnathus typhle, Mullus surmuletus, and Pagellus erythrinus. Gran Canaria had the largest species richness (36 species) and mean number of species per sample (8.69 ± 0.49; mean ± SE). Lanzarote had the largest number of individuals (64.83% of the total registered) and mean total abundance per sample (168.39 ± 30.91). High densities of individuals were registered (95.86 ± 13.5) and 92.91% of fishes were juveniles. Our data showed that the physical configuration of the seagrass meadows did not significantly affect the patterns of richness and abundance of the associated fish assemblage. In conclusion, the C. nodosa meadows exhibited a singular ichthyofauna and they contribute to the maintenance of the diversity of the coastal fish assemblages in the Canarian Archipelago. This habitat constitutes, during spring and summer, a nursery habitat for juvenile fishes of many species, several of them commercially targeted.
Key words: community structure, nursery habitat, Cymodocea nodosa, seagrass meadows, Canarian Archipelago.
INTRODUCCIÓN
Las praderas de fanerógamas marinas actúan como "ingenieros ecológicos" (Wright y Jones 2006), ya que influyen en los procesos físicos, químicos y ecológicos de las zonas costeras donde se encuentran. Entre sus múltiples funciones ecológicas (Constanza et al. 1997), destacan su alta productividad primaria y secundaria (Hemminga y Duarte 2000), y su alta contribución al mantenimiento de la biodiversidad (Duarte y Gattusso 2008). Una parte importante de esta biodiversidad la constituyen los peces; son numerosos los trabajos que indican una alta abundancia y diversidad de especies (Gillanders 2006). Esto se debe a dos factores principales: la complejidad estructural, que provee de un mayor número de hábitats (Hindell et al. 2000), y la abundancia de recursos tróficos (Bell y Pollard 1989). Estas comunidades también forman un hábitat idóneo para el reclutamiento y la cría de numerosas especies de peces litorales (Pollard 1984, Hannan y Williams 1998). Todos estos servicios y funciones han supuesto su inclusión en distintas legislaciones de conservación de ámbito internacional.
En las Islas Canarias, Cymodocea nodosa forma praderas marinas conocidas como "sebadales" o "manchones" (Afonso–Carrillo y Gil–Rodríguez 1980, Aguilera et al. 1994). Se trata de una especie amenazada en el archipiélago debido a la regresión que han experimentado sus poblaciones en muchas áreas litorales. Determinados aspectos de las praderas de fanerógamas marinas de Canarias han sido objeto de estudio, tales como la distribución geográfica, fenología vegetativa y reproductora, genética, comunidad de epífitos e invertebrados asociados, etc. Sin embargo, los relativos a la comunidad de peces son escasos y han focalizado su atención en la fracción adulta (e.g., Mena et al. 1993; Polifrone et al. 2006; Tuya et al. 2005, 2006). Todos estos estudios aplicaron censos visuales como método de muestreo.
En este estudio se analiza la ictiofauna asociada a las praderas de C. nodosa a una escala espacial mayor (distintas islas y praderas). Existen diversas referencias que señalan a estas comunidades como zonas de cría para peces; sin embargo, los datos existentes en Canarias que avalen esta hipótesis son muy escasos y sólo proceden de la aplicación de los censos visuales. Por tanto, en este trabajo se plantearon los siguientes objetivos: (1) describir la composición, riqueza y abundancia de la ictiofauna asociada a las praderas de C. nodosa durante el periodo de su máximo desarrollo en distintas islas y localidades, utilizando un método de muestreo (arrastre) que permita valorar con garantías la fracción de jovenes y las especies crípticas; (2) analizar el papel que pueden desempeñar las praderas de fanerógamas marinas del Archipiélago Canario como hábitat para el reclutamiento y la cría de peces; y (3) estudiar la posible relación entre la estructura espacial de la pradera y la riqueza y abundancia del poblamiento de peces, a nivel de islas y de praderas. Los resultados podrían contribuir a mejorar significativamente la gestión de este ecosistema en las Islas Canarias.
MATERIALES Y MÉTODOS
Área y periodo de estudio
Se seleccionaron 41 praderas de la fanerógama marina C. nodosa en el sector oriental del Archipiélago Canario, con base en la información disponible sobre la distribución de esta especie en las islas (Reyes et al. 1995a, Pavón–Salas et al. 2000): 15 en Gran Canaria, 15 en Fuerteventura y 11 en Lanzarote (fig. 1). Los muestreos se efectuaron en primavera y verano (junio a septiembre) de 2003. En esta época, las comunidades de fanerógamas marinas presentan los mayores valores de densidad de pies, altura de hojas y biomasa (Reyes et al. 1995a, 1995b; Tuya et al. 2006), y valores máximos de diversos descriptores (riqueza y abundancia) de las comunidades de peces asociadas (Polifrone et al. 2006, Tuya et al. 2006). Durante el periodo primavera–verano, la temperatura media superficial del agua alrededor de las Islas Canarias orientales oscila entre 21 y 22.5 °C, y la salinidad entre 36.3 y 36.7 (Navarro–Pérez y Barton 2001).

Métodos de muestreo
Para capturar los peces se utilizó un chinchorro (red de arrastre) de 6 m de largo, 4 m de ancho y 0.5 m de alto, con luz de malla de 1 mm. Éste fue arrastrado por buceadores en transectos de 25 m, cubriendo un área de 100 m2 por arrastre (8400 m2 área total). Se obtuvieron 26 muestras en Gran Canaria, 27 en Fuerteventura y 31 en Lanzarote (n = 84), con una media de dos réplicas por pradera. Los arrastres se ejecutaron al azar entre 5 y 15 m de profundidad, entre las 10:00 y las 15:00 horas. Esta técnica permite la captura de individuos pequeños con escasa capacidad de natación que se refugian en la bóveda de la pradera, así como especies bentónicas de mayor tamaño. Sin embargo, la mayoría de los individuos de especies pelágicas y adultos de las epibentónicas escapan de este arte de pesca. Los chinchorros se consideran apropiados para capturar peces pequeños (<100 mm longitud total) (Rozas y Minello 1997); los de pequeño tamaño, como el utilizado en este trabajo, han demostrado ser efectivos en el muestreo de peces pequeños y especialmente en praderas marinas someras (Guest et al. 2003). Los peces capturados se contaron e identificaron hasta el nivel de especie según Fischer et al. (1981), Whitehead et al. (1986) y Brito et al. (2002); posteriormente, se midió su longitud total (LT ± 1 mm) y se clasificaron en cinco clases de talla: c1, 0–5 cm; c2, 5–10 cm; c3, 10–15 cm; c4, 15–20 cm; y c5, >20 cm. También, se distinguió entre jóvenes, los ejemplares con escamas ya formadas y que no han alcanzado la talla mínima de primera madurez sexual (TPMm, talla por debajo de la cual es poco probable encontrar individuos maduros), y adultos, aquellos que alcanzan y superan dicha talla (Dulcic et al. 1997). Para esto, se empleó la información disponible para cada especie en Canarias, pero cuando esto no fue posible, se utilizó información de las regiones más próximas o de especies similares (apéndice 1). En el caso de Coris julis, el patrón de coloración de los individuos sirvió para clasificarlos. Para analizar el grupo de edad de los ejemplares de las especies más abundantes (excepto Syngnathus typhle), se consideraron, preferentemente, los trabajos sobre la relación de talla–edad efectuados en Canarias (apéndice 1). Para caracterizar la organización espacial de la comunidad, se siguió la clasificación hecha por Brito et al. (2002) para las especies de peces de Canarias y la empleada por Tuya et al. (2004) para los grupos tróficos.
Para estimar el posible efecto de la estructura espacial de la pradera sobre los patrones de riqueza y abundancia del poblamiento de peces, se cuantificaron los dos elementos estructurales típicamente empleados: la densidad de pies y altura de las hojas. Ambos parámetros se han mostrado como descriptores eficientes de praderas de C. nodosa en el Archipiélago Canario (Reyes et al. 1995a, Barberá et al. 2005). Para estimar la densidad, se contaron los pies de planta en el interior de un cuadrado de 25 × 25 cm (n = 10); posteriormente, esta densidad se convirtió a metros cuadrados. Se midió la longitud de la hoja más vieja en cada pie (n = 30) para estimar la altura del estrato foliar. La cobertura de las plantas fue del 100% en cada punto de arrastre.
Análisis estadístico
Se calcularon la riqueza (S), el índice de diversidad de Shannon–Wiener (H') y el índice de Pielou o equitatividad (J') para cada isla y pradera. Para comprobar las diferencias en la estructura multivariante del poblamiento íctico entre las tres islas, se empleó la rutina multivariante no paramétrica de análisis de similitud (ANOSIM, Clarke 1993). Los patrones de riqueza y abundancia entre islas se compararon empleando la prueba U de Mann–Whitney, ya que la abundancia total no siguió un patrón de distribución normal. Se empleó esta misma prueba para comparar las variables estructurales y las de la comunidad íctica de dos grupos de praderas de Fuerte–ventura (FV): las situadas al noreste y este (FV1: 12 a 18, ver fig. 1) vs las situadas al sureste y sur (FV2: 19 a 26), excluyendo la pradera de Puerto Lajas (14) debido a que presentó valores medios fuera de lo normal para las praderas canarias. Finalmente, se emplearon modelos de regresión múltiple para detectar la posible relación entre la estructura física de las praderas (densidad de pies y altura de hojas) y la riqueza y abundancia de la comunidad íctica.
RESULTADOS
Composición y estructura de la comunidad íctica
El número total de individuos capturados fue de 8298, de los cuales 8052 fueron identificados hasta el nivel de especie. Se registraron 21 familias (2 de condrictios y 19 de osteictios), 34 géneros (2 de condrictios y 32 de osteictios) y 42 especies (2 de condrictios y 40 de osteictios) (tabla 1). La familia más representativa fue Sparidae, ya que presentó la mayor riqueza y abundancia de individuos (10 especies y 75.5% de individuos), seguida de Labridae (5 y 2.5%), Syngnathidae (3 y 9%) y Mullidae (1 y 7.5%). Las especies más importantes, en términos de abundancia y frecuencia, fueron: Spondyliosoma cantharus (con el 36.5% de los individuos y 64.3% de frecuencia en las muestras), Diplodus annularis (31.9% y 66.7%), Syngnathus typhle (8.1% y 89.3%), Mullus surmuletus (7.5% y 57.2%), Pagellus erythrinus (2.6% y 9.6%), Atherina aff. presbyter (2.4% y 1.2%), Diplodus vulgaris (2.1% y 25%), Symphodus trutta (1.9% y 29.8%), Pagellus acarne (1.2% y 8.3%) y Sparisoma cretense (0.95% y 28.6%). Estas 10 especies representan el 94.7% del total de individuos capturados. El 66.7% de las especies registradas tiene interés pesquero de acuerdo con Franquet y Brito (1995).
Estos resultados incrementan el número de especies registradas en el área, de forma que, teniendo en cuenta los datos existentes, esta ictiofauna comprende 62 especies (3 de condrictios y 59 de osteictios), agrupadas en 50 géneros (3 de condrictios y 47 de osteictios) y 31 familias (3 de condrictios y 28 de osteictios). Se observaron especies pertenecientes a cinco categorías de distribución espacial. Las especies demersales dominaron (67%) y se distinguieron dos grupos: las demersales litorales (33%), con un intervalo de distribución entre 0 y 50 m (e.g., D. annularis), y las demersales (34%), con distribución superior a los 50 m (e.g., Dasyatis pastinaca). Seguidamente, se encuentran las especies bentónicas (21%; e.g., Bothus podas), las bentopelágicas (10%; e.g., S. cantharus) y, en último lugar, las especies pelágicas litorales (2%; e.g., A. aff. presbyter). De igual forma, los grupos tróficos detectados fueron cinco: los carnívoros de macroinvertebrados dominaron la comunidad (36%; e.g., M. surmuletus), seguidos de los carnívoros de macroinvertebrados y peces (31%; e.g., Dentex dentex), los carnívoros de microinvertebrados (21%; e.g., S. typhle), los omnívoros (7%; e.g., D. annularis) y los planctófagos (5%; e.g., Boops boops). Para el conjunto de las muestras, el número de individuos por arrastre fue de 95.86 ± 13.5 (media ± error estándar [EE]), oscilando entre 585 y 0. El número medio de especies por arrastre fue de 6.3 ± 0.33, con un mínimo de 0 y máximo de 16. El valor medio del índice de Shannon–Wiener (H') fue de 1.07 ± 0.05, variando entre 2.18 y 0, y el del índice de Pielou (J') de 0.64 ± 0.02.
Diferencias entre islas y praderas
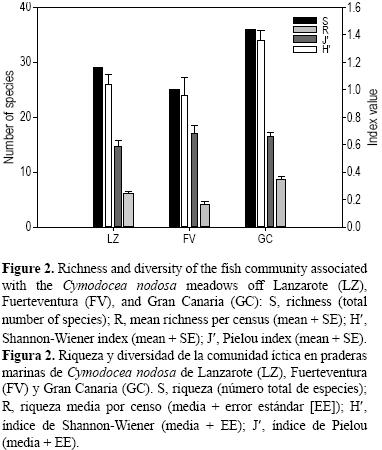
A nivel de estructura de la comunidad (composición y abundancia de las especies), los poblamientos de Gran Canaria y Lanzarote fueron bastante similares (ANOSIM, R = 0.09), mientras que los de Fuerteventura difirieron, en mayor medida, de los de Gran Canaria y Lanzarote (R = 0.24 y R = 0.25, respectivamente). De las 21 familias registradas, Gran Canaria y Lanzarote presentaron 16 y Fuerteventura 12; nueve familias fueron comunes a las tres islas (Bothidae, Gobiidae, Labridae, Mullidae, Scaridae, Sparidae, Syngnathidae, Synodontidae y Tetraodontidae). Gran Canaria presentó la mayor riqueza (36 especies) y número medio de especies por muestra (8.69 ± 0.49), seguida de Lanzarote (29 especies y 6.1 ± 0.41) y Fuerteventura (25 especies y 4.19 ± 0.44) (fig. 2). La riqueza de especies fue inferior en Fuerteventura en comparación con las otras dos islas (P = 0.007 y P = 0.0027) (tabla 2). Del total de especies registradas, 19 aparecieron en las tres islas; cuatro sólo en Lanzarote (Squatina squatina, Myrichthys pardalis, A. aff. presbyter, Uranoscopus scaber); cinco sólo en Gran Canaria (Abudefduf luridus, Aulostomus strigosus, Pomadasys incisus, Parapristipoma octolineatum, Opeatogenys cadenati); y una en Fuerteventura (Lithognathus mormyrus). En Lanzarote se registró el mayor número de individuos (64.83%) y número medio de individuos por muestra (168.39 ± 30.91), seguido de Gran Canaria (25.89% y 80.2 ± 8.6) y Fuerteventura (9.28% y 27.67 ± 5.77) (fig. 3). La abundancia total registrada en Fuerteventura fue inferior a la de las otras islas (P = 0.0004 y P = 0.001) (tabla 2). De las 10 especies más abundantes en cada isla, cuatro son compartidas por las tres (S. cantharus, D. annularis, M. surmuletus y S. typhle). El índice de diversidad de Shannon–Wiener (H') refleja que Gran Canaria (1.36) fue la isla con mayor diversidad, seguida de Lanzarote (1.04) y Fuerteventura (0.96); en este caso fue Gran Canaria la que mostró diferencias respecto a las demás (P = 0.008 y P = 0.025). El índice de Pielou (J') mostró que Fuerteventura (0.68) fue la isla con mayor equitatividad, seguida de Gran Canaria (0.66) y Lanzarote (0.59), si bien no se encontraron diferencias. Finalmente, para los parámetros estructurales, la densidad de pies fue similar en todas las islas, mientras que la altura de hojas en Lanzarote presentó diferencias con respecto a las otras dos (P = 0.0004 y P = 0.0002) (tabla 2).

Los valores de abundancia de peces a nivel de pradera mostraron una variabilidad alta, desde 418 ± 167 (media ± EE) hasta 0 individuos, mientras que la abundancia media para el conjunto de praderas fue de 82.32 ± 13.54 individuos 100 m–2. La riqueza media fue de 8.9 ± 4.42, con un máximo de 21 y mínimo de 0. El número medio de especies fue de 6.33 ± 0.76, oscilando entre 14 ± 2 y 0. El valor medio del índice de diversidad de Shannon–Wiener (H') fue de 1.13 ± 0.06, variando entre 1.93 y 0. El valor medio del índice de Pielou (J') fue 0.65 ± 0.03, con valores entre 0.92 y 0. Los modelos de regresión múltiple indicaron que las diferencias en la estructura física, cuantificada a través de la densidad de pies y la altura de hojas, no afectaron los patrones de riqueza y abundancia (P > 0.05, en todos los casos). En Fuerteventura se observó una diferencia en los patrones de abundancia entre las praderas del grupo FV1 y las del grupo FV2 (P = 0.023), mientras que para la riqueza no se observaron diferencias (P = 0.24). La comparación entre los parámetros estructurales de estos dos grupos mostró diferencias para la densidad de pies (P = 0.016), pero no para la altura de las hojas (P = 0.137) (tabla 3).
Análisis de tallas y función de "guardería"
La talla media registrada para el conjunto de individuos fue de 5.05 ± 0.03 (media ± EE), oscilando entre 1 y 50 cm. La distribución de individuos en las cinco clases establecidas fue de 63.83% (c1), 30.28% (c2), 4.08% (c3), 1.45% (c4) y 0.37% (c5). El 94.11% de los individuos midió menos que 10 cm y en el caso de especies de interés comercial, este porcentaje aumentó hasta un 97.65%. La clasificación entre jóvenes y adultos según la TPMm de cada especie mostró que el 92.91% de los individuos fueron jóvenes (apéndice 1), pero este porcentaje se incrementó a 98.48% en el caso de especies de interés comercial. De las 42 especies registradas en este estudio, 30 presentaron individuos jóvenes. De las 10 especies con mayor abundancia, 9 presentaron un porcentaje de individuos jóvenes > 90%. De hecho, las distribuciones de tallas de estas especies mostraron un predominio de las tallas pequeñas; sólo S. typhle presentó un porcentaje mayor de adultos que de jóvenes y una distribución de tallas más homogénea (fig. 4). Del análisis de la relacion talla–edad de las especies numéricamente importantes (excepto S. typhle) se desprende que la mayoría de los individuos pertenecen a la clase de edad 0. Los porcentajes de individuos de esta clase de edad por especie fueron los siguientes: S. cantharus, 99.76%; D. annularis, 98.67%; D. vulgaris, 100%; M. surmuletus, 100%; S. trutta, 86.87%; S. cretense, 98.68%; P. erythrinus, 100%; P. acarne, 98.88%; y A. aff. presbyter, 100%. Las cohortes de estas especies se caracterizan por estar dominadas por una o dos tallas, excepto S. trutta y S. cretense (fig. 4). Además de estas especies, D. pastinaca, P. octolineatum, P. incisus, Serranus atricauda, Serranus scriba, B. boops, D. dentex, L. mormyrus, Oblada melanura, Pagrus pagrus y S. squatina, aunque no fueron abundantes, mostraron un porcentaje de jóvenes de 100%, mientras que Stephanolepis hispidus un porcentaje de 93.55%, y B. podas y Serranus cabrilla, 50% (apéndice 1).
DISCUSIÓN
Composición y estructura de la comunidad íctica
Nuestros resultados indican que las praderas de C. nodosa en Canarias presentan una ictiofauna característica, dominada por unas pocas familias. Sparidae dominó esta comunidad, en términos de riqueza y abundancia (excluyendo las pelágicas); Mullidae también fue importante y presentó valores de abundancia similares. Lo anterior coincide con estudios anteriores (Mena et al. 1993, Tuya et al. 2006); sin embargo, se observaron diferencias, principalmente, en Labridae y Syngnathidae, las cuales presentaron una abundancia alta en el presente trabajo, pero no en el de Mena et al. (1993), sucediendo lo contrario con Scaridae. Además de las familias citadas, Tetraodontidae fue una de las más frecuentes en los trabajos de Mena et al. (1993) y Tuya et al. (2006), mientras que en este estudio aparece con frecuencia baja. Las diferencias en composición y abundancia se explican por el sesgo en el método de muestreo empleado en cada trabajo (arrastres vs censos visuales); este aspecto se señaló para la comunidad íctica en las praderas de Posidonia oceanica del Mediterráneo por Harmelin–Vivien y Francour (1992). Las especies cuyos individuos son pelágicos o bentopelágicos y los adultos de las demersales son mejor evaluadas mediante censos visuales (e.g., Boops, Atherina, etc.). En cambio, los alevines y jóvenes de especies demersales, así como los individuos de especies bentónicas y otras que habitan la bóveda de la pradera son mejor evaluados por los arrastres, pudiendo pasar inadvertidos o ser subestimados por los censos visuales (e.g., Syngnathus, Bothus, etc.). En el caso de Tetraodontidae, los juveniles (LT = 1 cm) de Canthigaster capistrata se observan en las praderas en invierno (F Espino, obs. pers.), mientras que los adultos escapan en gran medida del arrastre. De las 10 especies más abundantes en este estudio, cuatro (S. cantharus, D. annularis, M. surmuletus y S. cretense) también aparecieron entre las 10 más abundantes en Mena et al. (1993); las tres primeras fueron, también, las más abundantes en Tuya et al. (2005).
La composición de la comunidad de peces de los sebadales canarios no difiere substancialmente de la de algunas praderas marinas de C. nodosa en el Mediterráneo. Guidetti y Bussotti (2000) estudiaron los peces de una pradera mixta de C. nodosa y Zostera noltii, y encontraron que Atherinidae, Sparidae y Labridae dominan numéricamente la comunidad. Al igual que sucede en Canarias, en estas praderas mediterráneas Sparidae presentó la mayor riqueza (nueve especies), seguida de Labridae (siete especies). Precisamente en las especies de esta última familia radica la principal diferencia cualitativa debido, fundamentalmente, a las especies del género Symphodus (hasta siete especies en praderas del Mediterráneo vs dos en las praderas Canarias). Lo mismo sucede en las praderas de C. nodosa localizadas en la laguna de Ría Formosa (sur de Portugal), ya que de las 44 especies registradas por Ribeiro et al. (2006), nueve fueron de la familia Labridae y ninguna de ellas aparece en las praderas de Canarias.
Diferencias entre islas y praderas
La principal diferencia entre islas, tanto en los patrones de abundancia como de riqueza, se observó en el poblamiento íctico de Fuerteventura con respecto a las demás. Esto podría explicarse por el pequeño desfase temporal en los muestreos, ya que en Lanzarote se realizaron en junio, en Gran Canaria en el periodo comprendido entre junio y septiembre, y en Fuerteventura en septiembre. Este desfase se debió a las dificultades y al considerable esfuerzo que implican los muestreos a escalas espaciales grandes (>100 km) (Moranta et al. 2006). Los resultados podrían indicar que los jóvenes de diversas especies utilizan las praderas durante un corto espacio de tiempo o bien que, permaneciendo en ellas, alcanzaron el tamaño suficiente para escapar de los arrastres. Tuya et al. (2006) y Polifrone et al. (2006) demostraron que existe una clara correlación entre el ciclo anual de C. nodosa y la riqueza y abundancia de la comunidad íctica, con valores máximos en primavera–verano y mínimos en otoño–invierno; por tanto, durante el primer periodo los juveniles serían más abundantes en las praderas. Tuya et al. (2006) encontraron los mayores valores de riqueza y abundancia para una pradera de Lanzarote en septiembre. Por tanto, se debería esperar un mayor valor de estos parámetros en Fuerteventura, pero resultó justamente lo contrario. Deben existir otros factores que expliquen la relativa baja abundancia y riqueza en esta isla. Por otra parte, algunas praderas muestreadas en Gran Canaria (e.g., Arinaga y Formas) después de las de Fuerteventura, arrojaron valores superiores de abundancia. Las diferencias de abundancia observadas en Fuerteventura podrían explicarse a nivel de praderas, ya que las del sector sureste–sur (FV2) fueron más pobres en abundancia que las del sector noreste–este (FV1). La riqueza y abundancia de la ictiofauna de praderas de fanerógamas marinas no sólo dependen de la complejidad estructural de la pradera, sino que están muy influenciadas por los hábitats circundantes, tanto por el tipo de hábitat (Dorenbosch et al. 2006) como por la distancia o proximidad a los mismos (Jelbart et al. 2007). El sector sur en la costa de sotavento de Fuerteventura se caracteriza por grandes playas en la línea de costa y amplias extensiones de fondos arenosos en el infralitoral (Ministerio de Medio Ambiente 2006). Por tanto, estas praderas se encontrarían relativamente aisladas de otros tipos de hábitats complejos, como los arrecifes rocosos, donde se encuentran los ejemplares adultos (Tuya et al. 2004) de la mayor parte de las especies ícticas cuyos juveniles son abundantes en las praderas marinas (Aguilera et al. 1994). Por otra parte, las diferencias detectadas en la densidad media de pies de los grupos FV1 y FV2 muestran una menor complejidad estructural en el sector sureste–sur que también contribuye a explicar la diferencia en abundancia de individuos entre las mismas. La mayor riqueza, número medio de especies y diversidad detectadas en Gran Canaria puede deberse a la posición central de esta isla en el Archipiélago Canario. Es bien conocido (ver Brito et al. 2002) que la ictiofauna de las islas más orientales y occidentales de Canarias se diferencia en su mayor composición de especies de afinidad templada o tropical, respectivamente, de manera que algunas de ellas pueden solaparse en el sector central del archipiélago.
La importancia ecológica de las praderas marinas para las especies de peces depende de sus características morfológicas y su complejidad estructural (Hori et al. 2009). Bell y Westoby (1986a) encontraron una relación positiva entre la densidad de la pradera y la abundancia de peces pequeños, en términos de presencia o ausencia de predadores, sugiriendo la posibilidad de que los peces son capaces de discriminar entre praderas más o menos densas, o entre éstas y los fondos adyacentes sin vegetación. En el presente estudio no se encontraron relaciones entre la complejidad estructural y la riqueza y abundancia de la ictiofauna asociada; esto se debe, posiblemente, a la escala espacial del estudio. En escalas espaciales grandes (>100 km), como la empleada aquí, subyacen otros factores que influencian los atributos de estas comunidades ícticas, tales como los tipos de hábitats adyacentes y proximidad a los mismos, el esfuerzo pesquero, la contaminación, etc., y son más difíciles de cuantificar. Para detectar estas relaciones es preciso realizar estudios experimentales de campo a pequeña escala en una pradera, como el llevado a cabo por Bell y Westoby (1986b), o bien seleccionar un número limitado de praderas, como en el de Hori et al. (2009).
Análisis de tallas y función de "guardería"
Tradicionalmente, las praderas marinas han sido consideradas zonas importantes de "guardería" para los jóvenes de muchas especies de peces, en particular aquellos de interés comercial (Pollard 1984, Bell y Pollard 1989). En Canarias, se ha encontrado que, durante el periodo de estudio, la comunidad de peces asociada a las praderas marinas de C. nodosa está dominada por individuos pequeños (<100 mm LT), tratándose en su mayoría de jóvenes (LT < TPMm). Para las especies numéricamente importantes, estos individuos jóvenes pertenecen a la misma clase de edad (excepto S. typhle y S. trutta), formando la cohorte reclutada ese año. Los valores altos de abundancia media registrados indicaron que en primavera–verano estas praderas son muy importantes para la cría de peces. Se confirma que las diferentes especies adaptan su estrategia de desarrollo a la fenología vegetativa de C. nodosa, aprovechando la mayor complejidad estructural de las praderas, como se ha observado en Canarias (Polifrone et al. 2006, Tuya et al. 2006), Atlántico ibérico (Ribeiro et al. 2006) y Mediterráneo (Reina–Hervás y Serrano 1987, Guidetti y Bussotti 2000). Otras especies económicamente importantes y que no fueron abundantes también aparecieron en estado juvenil, por lo que es necesario realizar estudios, de al menos un ciclo anual, para determinar si esas especies pudieran utilizar las praderas marinas como áreas de "guardería" durante otros periodos del año, evitando así posibles fenómenos de competencia interespecífica.
Los estudios realizados, hasta el momento, en el Mediterráneo (Reina–Hervás y Serrano 1987, Guidetti y Bussotti 2000, Verdiell–Cubedo et al. 2007), Atlántico ibérico (Ribeiro et al. 2006) y Canarias (Mena et al. 1993, Aguilera et al. 1994, Polifrone et al. 2006, Tuya et al. 2006) coinciden con nuestros resultados e indican que las praderas de la fanerógama marina C. nodosa desempeñan un papel importante como áreas de "guardería", ya que albergan un gran número de alevines y jóvenes de numerosas especies de peces. Esto implica que las praderas de C. nodosa contribuyen significativamente en la producción de peces y tienen una gran importancia en la conservación de las comunidades ícticas litorales, ya que tras la fase joven los individuos de la mayoría de las especies abandonan las praderas para dirigirse a otros hábitats, como los arrecifes rocosos (Aguilera et al. 1994, Tuya et al. 2004, Polifrone et al. 2006). De las 30 especies que aparecieron en estado juvenil en el presente estudio, 23 son de interés comercial. Alrededor de 80 especies de peces son explotadas por la pesquería artesanal de las Islas Canarias (Franquet y Brito 1995); algunas de ellas pueden ser consideradas como especies objetivo, teniendo en cuenta su abundancia en las capturas y su interés económico. Entre éstas, destacan M. surmuletus, Dentex gibbosus, P. acarne, P. erythrinus, P. pagrus y S. cantharus, las cuales constituyen aproximadamente el 70% de la captura total de peces demersales litorales (Pajuelo 1997). De estas seis especies, de acuerdo con los resultados del presente estudio, cuatro utilizan las praderas de C. nodosa durante sus primeras fases de desarrollo, lo que proporciona una idea de la función que desempeña este ecosistema en la formación de biomasa de especies pesqueras y la importancia que supone para la flota artesanal de Canarias.
En conclusión, este trabajo ha mostrado que: (1) las praderas de C. nodosa en Canarias presentan una ictiofauna particular, caracterizada por especies de fondos rocosos que aparecen ahí con individuos pequeños y por especies exclusivas, y desempeñan un papel importante en el mantenimiento de la diversidad de numerosas especies de peces; (2) en primavera–verano constituyen un hábitat de "guardería" para los individuos alevines y jóvenes de diversas especies, muchas de las cuales son de interés comercial; y (3) a una escala espacial grande, parece que la estructura de las praderas no juega un papel determinante en los patrones de riqueza y abundancia de la comunidad íctica. Se considera que la conservación de las praderas de C. nodosa en las Islas Canarias es importante para el mantenimiento de los procesos ecológicos y productivos litorales; además, es prioritaria para la flota artesanal que explota los recursos demersales litorales.
AGRADECIMIENTOS
Se agradece a la Consejería de Medio Ambiente y Ordenación Territorial del Gobierno de Canarias el soporte económico para el desarrollo del Programa de Seguimiento de Especies Amenazadas (SEGA Cymodocea nodosa 2003). También se agradece a JA González (Instituto Canario de Ciencias Marinas), M Garrido–Sanahuja y R Herrera–Pérez (Consejería de Medio Ambiente y Ordenación Territorial), O Tavío–Cruz (Agencia de Protección del Medio Urbano y Natural), R Ramírez–Cañada (Universidad de Las Palmas de Gran Canaria) y A Boyra (Oceanográfica SL) su colaboración en el desarrollo de este trabajo.
REFERECIAS
Afonso–Carrillo J, Gil–Rodríguez MC. 1980. Cymodocea nodosa (Ucria) Ascherson (Zannichelliaceae) y las praderas submarinas o sebadales en el Archipiélago Canario. Vieraea 8: 365–376. [ Links ]
Aguilera F, Brito A, Castilla C, Díaz A, Fernández–Palacios JM, Rodríguez A, Sabaté F, Sánchez J. 1994. Canarias. Economía, Ecología y Medio Ambiente. Francisco Lemus Editor, La Laguna, 361 pp. [ Links ]
Barberá C, Tuya F, Boyra A, Sánchez–Jerez P, Blanch I, Haroun RJ. 2005. Spatial variation in the structural parameters of Cymodocea nodosa seagrass meadows in the Canary Islands: A multiscaled approach. Bot. Mar. 48: 122–126. [ Links ]
Bell JD, Westoby M. 1986a. Abundance of macrofauna in dense seagrass is due to habitat preference, not predation. Oecologia 68: 205–209. [ Links ]
Bell JD, Westoby M. 1986b. Importance of local changes in leaf height and density to fish and decapods associated with seagrasses. J. Exp. Mar. Biol. Ecol. 104: 249–274. [ Links ]
Bell JD, Pollard DA. 1989. Ecology of fish assemblages and fisheries associated with seagrasses. In: Larkum AWD, McComb AJ, Shepherd SA (eds.), Biology of Seagrasses: A treatise on the biology of seagrasses with special reference to the Australian region. Elsevier, New York, pp. 565–609. [ Links ]
Brito A, Pascual PJ, Falcón JM, Sancho A, González G. 2002. Peces de las Islas Canarias. Catálogo Comentado e Ilustrado. Francisco Lemus Editor, La Laguna, 419 pp. [ Links ]
Clarke KR. 1993. Non–parametric multivariate analysis of changes in community structure. Aust. J. Ecol. 18: 117–143. [ Links ]
Constanza R, D'arge R, De Groot R, Farber S, Grasso M, Hannon B, Limburg K, Naeem S, O'Neill RV, Paruelo J, Raskin RG, Sutton P, Van den Belt M. 1997. The value of the world's ecosystem services and natural capital. Nature 387: 253–260. [ Links ]
Dorenbosch M, Grol MGG, Nagelkerken I, Van der Velde G. 2006. Different surrounding landscape may result in different fish assemblages in East African seagrass beds. Hydrobiologia 563: 45–60. [ Links ]
Duarte C, Gattuso JP. 2008. Seagrass meadows. In: Cleveland CJ (ed.), Encyclopaedia of Earth. Environmental Information Coalition, National Council for Science and the Environment, Washington DC; http://www.eoearth.org/article/seagrassmeadows. [ Links ]
Dulcic J, Kraljevic M, Grbec B, Pallaoro A. 1997. Composition and temporal fluctuations of inshore juvenile fish populations in the Kornati Archipelago, eastern middle Adriatic. Mar. Biol. 129: 267–277. [ Links ]
Fischer W, Bianchi G, Scott WB (eds.). 1981. FAO species identification sheets for fishery purposes. Eastern Central Atlantic; fishing areas 34, 47 (in part). Canada Funds–in–Trust. Ottawa, Department of Fisheries and Oceans Canada, by arrangement with the Food and Agriculture Organization of the United Nations, Vols. 1–7. [ Links ]
Franquet F, Brito A. 1995. Especies de Interés Pesquero de Canarias. Consejería de Pesca y Transportes del Gobierno de Canarias, Tenerife, 143 pp. [ Links ]
Gillanders BM. 2006. Seagrasses, fish, and fisheries. In: Larkum AWD, Orth RJ, Duarte CM (eds.), Seagrasses: Biology, Ecology and Conservation. Springer, Netherlands, pp. 503–536. [ Links ]
Guest MA, Connolly RM, Loneragan NR. 2003. Seine nets and beam trawls compared by day and night for sampling fish and crustaceans in shallow seagrass habitats. Fish. Res. 64: 185–196. [ Links ]
Guidetti P, Bussotti S. 2000. Fish fauna of a mixed meadow composed by the seagrasses Cymodocea nodosa and Zostera noltii in the western Mediterranean. Oceanol. Acta 23: 759–770. [ Links ]
Hannan JC, Williams RJ. 1998. Recruitment of juvenile marine fishes to seagrass habitat in a temperate Australian estuary. Estuaries and Coasts 21: 29–51. [ Links ]
Harmelin–Vivien ML, Francour P. 1992. Trawling or visual censuses? Methodological bias in the assessment of fish populations in seagrass beds. P.S.Z.N.I. Mar. Ecol. 13: 41–51. [ Links ]
Hemminga MA, Duarte CM. 2000. Seagrass Ecology. Cambridge Univ. Press, 298 pp. [ Links ]
Hindell JS, Jenkins GP, Keough MJ. 2000. Evaluating the impact of predation by fish on the assemblage structure of fishes associated with seagrass (Heterozostera tasmanica) (Martens ex Ascherson) den Hartog, and unvegetated sand habitats. J. Exp. Mar. Biol. Ecol. 255: 153–174. [ Links ]
Hori M, Suzuki T, Monthum Y, Srisombat T, Tanaka Y, Nakaoka M, Mukai H. 2009. High seagrass diversity and canopy–height increased associated fish diversity and abundance. Mar. Biol. 156: 1447–1458. [ Links ]
Jelbart JE, Ross PM, Connolly RM. 2007. Fish assemblages in seagrass beds are influenced by the proximity of mangrove forest. Mar. Biol. 150: 993–1002. [ Links ]
Mena J, Falcón JM, Brito A, Rodríguez FM, Mata M. 1993. Catálogo preliminar de la ictiofauna de las praderas de fanerógamas marinas de la isla de Tenerife, islas Canarias. Publ. Esp. Inst. Esp. Oceanogr. 11: 217–222. [ Links ]
Ministerio de Medio Ambiente. 2006. Estudio ecocartográfico del litoral de las islas de Fuerteventura y Lobos (Islas Canarias). Dirección General de Costas, Ministerio de Medio Ambiente, Madrid. [ Links ]
Moranta J, Palmer M, Morey G, Ruiz A, Morales–Nin B. 2006. Multi–scale spatial variability in fish assemblages associated with Posidonia oceanica meadows in the Western Mediterranean Sea. Estuar. Coast. Shelf Sci. 68: 579–592. [ Links ]
Navarro–Pérez E, Barton ED. 2001. Seasonal and interannual variability of the Canary Current. Sci. Mar. 65: 205–213. [ Links ]
Pajuelo JG. 1997. La pesquería artesanal canaria de especies demersales: Análisis y ensayo de dos modelos de evaluación. Ph.D. thesis, Universidad de Las Palmas de Gran Canaria, 347 pp. [ Links ]
Pavón–Salas N, Herrera R, Hernández–Guerra A, Haroun R. 2000. Distributional pattern of seagrasses in the Canary Islands (Central–East Atlantic Ocean). J. Coast. Res. 16: 329–335. [ Links ]
Polifrone M, Abelardo–González A, Quevedo–Díaz A. 2006. Fish community and grazing pressure on meadows of Cymodocea nodosa (Ucria) Ascherson in Gran Canaria (Canary Islands, Spain). Biol. Mar. Medit. 13: 167–169. [ Links ]
Pollard DA. 1984. A review of ecological studies on seagrass–fish communities, with particular references to recent studies in Australia. Aquat. Bot. 18: 3–42. [ Links ]
Reina–Hervás JA, Serrano P. 1987. Structural and seasonal variations of inshore fish populations in Málaga Bay, south–eastern Spain. Mar. Biol. 95: 501–508. [ Links ]
Reyes J, Sansón M, Afonso–Carrillo J. 1995a. Distribution and reproductive phenology of the seagrass Cymodocea nodosa (Ucria) Ascherson in the Canary Islands. Aquat. Bot. 50: 171–180. [ Links ]
Reyes J, Sansón M, Afonso–Carrillo J. 1995b. Leaf phenology, growth and production of the seagrass Cymodocea nodosa at El Médano (south of Tenerife, Canary Islands). Bot. Mar. 38: 457–465. [ Links ]
Ribeiro J, Bentes L, Coelho R, Gonçalves JMS, Lino PG, Monteiro P, Erzini K. 2006. Seasonal, tidal and diurnal changes in fish assemblages in the Ria Formosa lagoon (Portugal). Estuar. Coast. Shelf Sci. 67: 461–474. [ Links ]
Rozas LP, Minello TJ. 1997. Estimating densities of small fishes and decapod crustaceans in shallow estuarine habitats: A review of sampling design with focus on gear selection. Estuaries 20: 199–213. [ Links ]
Tuya F, Boyra A, Sánchez–Jerez P, Barberá C, Haroun R. 2004. Relationships between rocky–reef fish assemblages, the sea urchin Diadema antillarum and macroalgae throughout the Canarian Archipelago. Mar. Ecol. Prog. Ser. 278: 157–169. [ Links ]
Tuya F, Boyra A, Sánchez–Jerez P, Haroun RJ. 2005. Multivariate analysis of the bentho–demersal ichthyofauna along soft bottoms of the eastern Atlantic: Comparison between unvegetated substrates, seagrass meadows and sandy bottoms beneath sea–cage fish farms. Mar. Biol. 147: 1229–1237. [ Links ]
Tuya F, Martín JA, Luque A. 2006. Seasonal cycle of a Cymodocea nodosa seagrass meadow and of the associated ichthyofauna at Playa Dorada (Lanzarote, Canary Islands, eastern Atlantic). Cienc. Mar. 32: 695–704. [ Links ]
Verdiell–Cubedo D, Oliva–Paterna FJ, Torralva–Forero M. 2007. Fish assemblages associated with Cymodocea nodosa and Caulerpa prolifera meadows in the shallow areas of the Mar Menor coastal lagoon. Limnetica 26: 341–350. [ Links ]
Whitehead PJP, Bauchot ML, Hureau JC, Nielsen J, Tortonese E (eds.). 1986. Fishes of the Northeastern Atlantic and the Mediterranean. Vol. I–III. UNESCO, Paris. [ Links ]
Wright JP, Jones CG. 2006. The concept of organisms as ecosystem engineers ten year on: Progress, limitations, and challenges. BioScience 56: 203–209. [ Links ]
*English translation by Christine Harris.
**Descargar versión bilingüe (Inglés–Español) en formato PDF.














