Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.2 Ensenada jun. 2011
Artículos
Composición química y algunas actividades biológicas de algas marinas recolectadas en Túnez
Chemical composition and some biological activities of marine algae collected in Tunisia*, **
F Frikha1, M Kammoun1, N Hammami1, RA Mchirgui1, L Belbahri2, Y Gargouri1, N Miled1, F Ben–Rebah3*
1 Laboratoire de Biochimie et de Génie Enzymatique des Lipases, Ecole Nationale d'Ingénieurs de Sfax, Tunisia.
2 Hepia, 150 Route de Presinge, 1254 Jussy, Switzerland.
3 INSTM–Sfax BP 1035, Sfax 3018, Tunisia.
*Corresponding author.
E–mail: benrebahf@yahoo.fr
Received February 2010
Accepted November 2010
RESUMEN
Se evaluaron la composición química y algunas propiedades biológicas de cuatro especies de algas (Ulva rigida, Codium bursa, Cystoseira barbata y Ceramium diaphanum) que se recolectaron en el Golfo de Gabes (Túnez). Los contenidos de cenizas (11.35–29.08% de peso/peso seco [p/ps]) y azúcares totales (13.20–18.70% p/ps) fueron los más abundantes en estas algas. El contenido de proteínas fue moderado (5.03–14.00% p/ps), y el alga roja C. diaphanum presentó el valor más alto. El contenido de lípidos estuvo dentro del intervalo determinado para algas marinas (<3% p/ps). Los ácidos grasos saturados que se encontraron en mayor proporción fueron C16:0 (24.53–11.37%) y C12:0 (10.37–24.44%). El ácido graso monoinsaturado más abundante fue C18:1n–9 (21.74–54.22%), mientras que el ácido graso poliinsaturado más abundante fue C18:2n–6 (9.57–11.71%). Las variaciones en la composición química se pueden atribuir a diferencias tanto ambientales como genéticas entre las especies. Todos los extractos de algas mostraron actividad antibacteriana contra Escherichia coli y Staphylococcus simulans (diámetro de inhibición: 10–25 mm), actividad antioxidante (actividad secuestrante de radicales libres: 0.8–23%) y actividad antiinflamatoria (48–61% de inhibición de la actividad de la fosfolipasa A2); por lo tanto, las algas marinas estudiadas pueden ser consideradas como un recurso abundante de moléculas bioactivas.
Palabras clave: algas marinas, composición química, actividad antiinflamatoria, actividad antioxidante, actividad antibacteriana.
ABSTRACT
The chemical composition and some biological properties of four algae (Ulva rigida, Codium bursa, Cystoseira barbata, and Ceramium diaphanum) collected from the Gabes Gulf area (Tunisia) were examined. Ash (11.35–29.08% weight/dry weight [w/dw]) and total sugar (13.20–18.70% w/dw) were the most abundant contents in these algae. Protein contents were moderate (5.03–14.00% w/dw), with the red alga (C diaphanum) having the highest value. Lipid contents were within the range mentioned for seaweeds (<3% w/dw). Saturated fatty acids occurring at the highest proportions were C16:0 (24.53–41.37%) and C12:0 (10.37–24.44%). The most abundant monounsaturated fatty acid was C18:1n–9 (21.74–54.22%), whereas the most abundant polyunsaturated fatty acid was C18:2n–6 (9.57–11.71%). Variations in chemical composition can be attributed to both environmental and genetic differences among species. All algal extracts displayed antibacterial activity against Escherichia coli and Staphylococcus simulans (inhibition diameter: 10–25 mm), antioxidant activity (radical scavenging activity: 0.8–23%), and anti–inflammatory activity (48–61% inhibition of the phospholipase A2 activity); therefore, the marine algae examined can be considered abundant resources of bioactive molecules.
Key words: marine algae, chemical composition, anti–inflammatory activity, antioxidant activity, antibacterial activity.
INTRODUCCIÓN
Desde hace mucho tiempo las algas marinas han sido cosechadas en el Extremo Oriente y los países del Pacífico asiático, donde se utilizan en la industria alimenticia, práctica que se ha extendido a tanto América del Norte como Europa (McHugh 2003). Las algas verdes, pardas y rojas contienen varios compuestos orgánicos e inorgánicos que son benéficos para la salud humana (Kuda et al. 2002) por su alto valor nutricional y sus propiedades curativas de muchas enfermedades (tuberculosis, artritis, resfriados e influenza, infestaciones de lombrices y tumores). Las especies de algas estudiadas han mostrado variaciones amplias en la composición química (proteínas, carbohidratos, lípidos, minerales y vitaminas), las cuales se relacionan con factores ambientales como las temporadas estacionales, temperatura, luz, salinidad, localización y condiciones de almacenamiento (Dawes 1998, Fleurence 1999, Marinho–Soriano et al. 2006).
En general, las algas se cosechan y/o cultivan para varios usos (alimentos para humanos y animales, cosméticos, fertilizantes, etc.), y la aplicación industrial se restringe principalmente a la extracción de ficocoloides (agar, carragenina y alginatos) que han alcanzado importancia comercial como aditivos alimentarios (Cardozo et al. 2007). Recientemente, las algas marinas han recibido mucha atención por ser fuentes potenciales de compuestos bioactivos ya que son capaces de producir varios metabolitos secundarios con un amplio espectro de actividades biológicas interesantes, incluyendo propiedades antibacterianas, antifungales, antivirales y antioxidantes (Faulkner 2002; Mayer et al. 2007; Nahas et al. 2007; Zahra et al. 2007; Dubber y Harder 2008; Plaza et al 2008, 2010; Wang et al. 2009; Cox et al. 2010; Zhang et al. 2010). El gran potencial para la explotación de estos compuestos naturales en varias aplicaciones (medicamentos, ingredientes biológicos o farmacológicos, nutracéuticos, ingredientes alimentarios funcionales, etc.) ha estimulado la búsqueda de nuevos compuestos bioactivos de algas cosechadas en varios sitios del mundo. Entre los países que rodean el Mar Mediterráneo, Túnez se caracteriza por una abundancia de biomasa algal; sin embargo, no existen estudios sobre la explotación de la biomasa algal varada en sus aguas costeras. La cosecha y el desarrollo de procesos de tratamiento de algas tunecinas podría contribuir a la concepción de nuevos productos biotecnológicos. Hoy en día, estudios encaminados a elucidar la abundancia, la disponibilidad, la composición química y las propiedades de algas se han vuelto indispensables. Nuestra investigación fue motivada por asuntos tanto económicos como ambientales relacionados con la biomasa de algas marinas varadas en las aguas costeras de Túnez. En este trabajo se presentan la composición proximal, el perfil de ácidos grasos y algunas actividades biológicas de cuatro algas marinas del Golfo de Gabes.
MATERIALES Y MÉTODOS
Muestreo de algas marinas
Durante mayo se recolectaron cuatro algas marinas del Golfo de Gabes (Túnez): dos algas verdes (Ulva rigida y Codium bursa), un alga roja (Ceramium diaphanum) y un alga parda (Cystoseira barbata). Las muestras se lavaron con agua destilada y se secaron durante cinco días a temperatura ambiente. Posteriormente, cada muestra se trituró en un molino y se usó para determinar la composición química y la presencia de actividades biológicas.
Análisis químico
Según los métodos propuestos por la AOAC (1990), se determinó el contenido de agua secando las muestras a 100 °C, el contenido de lípidos mediante extracción Soxhlet, el nitrógen mediante el método de Kjeldahl (el porcentaje de proteína se calculó como el porcentaje de nitrógeno multiplicado por 6.25) y el contenido de cenizas mediante incineración en una mufla a 550 °C. El contenido de azúcares totales se determinó según Miller (1959) usando el método del ácido 3,5–dinitrosalicílico (3,5–DNS).
Para analizar el contenido mineral, las muestras de algas secas se sometieron a una digestión ácida. Se determinaron Fe, K, Ca, Mg, Na, Zn, Mn, Cu, Cd y Pb mediante espectro–fotometría de absorción atómica (AOAC 1990).
Para determinar la composición de ácidos grasos, se extrajo una muestra homogeneizada de cada alga usando el método de metanol/cloroformo (2v/1v). Se prepararon ésteres metílicos de ácidos grasos (FAMEs) según Slover y Lanza (1979). La determinación de ácidos grasos se realizó con un cromatógrafo de gas Shimadzu (GC–2010) equipado con un detector de ionización de llama y una columna capilar DB–Wax (30 m de largo × 0.32 mm de diámetro interno; Agilent J&W Scientific, Folsom, CA). Se utilizó nitrógeno como gas transportador a un flujo de 4 mL min–1. Las temperaturas del inyector y detector se mantuvieron a 200 y 240 °C, respectivamente. La temperatura inicial de la columna fue de 100 °C, luego se incrementó a una tasa de 5 °C min–1 y se mantuvo a 230 °C durante 10 min. La identificación se realizó por comparación de los tiempos de retención con los estándares de FAMEs.
Preparación de los extractos algales
Las muestras de algas marinas secas fueron extraídas con etanol (5 g por 100 mL de etanol) mediante agitación a 37 °C por 24 h. Después de la centrifugación (30 min, 30,000 × g), el sobrenadante se evaporó al vacío a 45 °C. Los extractos orgánicos se disolvieron en etanol (1 mg mL–1) y se utilizaron para los bioensayos.
Medición de la actividad antibacteriana
Se evaluó la actividad antibacteriana in vitro contra Escherichia coli y Staphylococcus simulans. Las cepas bacterianas se mantuvieron en el medio LB. Las placas de agar se inocularon con 100 µL de la suspensión microbiana, y se añadieron 80 µL de cada extracto marino a los pozos en las placas de agar. Después de 24 h de incubación a 37 °C, se evaluó la actividad midiendo el diámetro (en milímetros) de la zona de inhibición.
Medición de la actividad antiinflamatoria
La inhibición de la fosfolipasa A2 (PLA2) por los extractos de algas se determinó siguiendo a Dearujo y Radvanyi (1987). Brevemente, el sustrato consistió de lecitina solubilizada (3.5 mM) en una mezcla de taurodesoxicolato de sodio (3 mM), cloruro de sodio (100 mM), cloruro de calcio (10 mM) y rojo de fenol (0.055 mM) como indicador colorimétrico. Se ajustó el pH de la mezcla de reacción a 7.6. La PLA2 se solubilizó en acetonitrilo al 10% a una concentración de 0.002 µL–1. Luego, se incubaron 10 de la solución de PLA2 pancreática porcina (Sigma, Túnez) con 10 de cada extracto durante 20 min a temperatura ambiente. La reacción enzimática se inició agregando 1 mL del sustrato, midiéndose la absorbancia de la solución a 558 nm. El porcentaje de inhibición enzimática se determinó por comparación con una muestra control donde los extractos algales se sustituyeron con etanol.
Ensayo del secuestro del radical DPPH
La actividad antioxidante de los extractos algales se midió en función del secuestro de radicales libres, usando el método de 2,2–difenil–1–picrilhidrazil (DPPH) según Yen y Chen (1995). Se incubaron 1.5 mL de una solución de DPPH 10–5 M (en etanol) con 1.5 mL de extractos etanólicos. La mezcla se agitó en un mezclador tipo vórtice durante 1 min y se mantuvo en la oscuridad a temperatura ambiente durante 30 min. Se preparó un control con etanol en vez de extracto de etanol como se menciona arriba. La absorbancia de todas las muestras se midió a 517 nm. El efecto secuestrante se calculó con la siguiente ecuación (Duan et al. 2006):

donde Amuestra y Acontrol son la absorbancia a 517 nm de la muestra y el control.
Contenido fenólico total de los extractos algales
El contenido fenólico de los extractos etanólicos se determinó usando el reactivo de Folin–Ciocalteu (Singleton y Rossi 1965). Se disolvieron 50 µL de la muestra en 250 µL del reactivo Folin–Ciocalteu y 1 mL de agua destilada. Después de incubar por 1 min a temperatura ambiente, se añadieron 750 µL de Na2CO3 (20 g por 100 mL) y la mezcla se incubó en la oscuridad durante 2 h a temperatura ambiente. La absorbancia de todas las muestras se midió a 760 nm y se calculó el contenido fenólico total con un estándar de ácido gálico, expresándose como miligramos de equivalentes de ácido gálico por gramo de peso seco del extracto de alga (mg EAG/g de peso seco del extracto etanólico).
RESULTADOS
Composición proximal
La composición proximal de las algas marinas recolectadas del Golfo de Gabes (Túnez) varió entre especies (tabla 1).

Los contenidos de proteína de las dos algas verdes (7.31% y 5.03% de peso/peso seco [p/ps] para Ulva rigida y Codium bursa, respectivamente) y el alga parda Cystoseira barbata (5.60% p/ps) fueron similares; sin embargo, el alga roja Ceramium diaphanum presentó un mayor nivel de proteínas (14.00% p/ps). El contenido de lípidos en todas las especies generalmente fue menor que 3.00% p/ps, y el alga parda presentó el valor más alto (2.51% p/ps); a pesar de que este valor es relativamente bajo, fue mayor que los valores registrados para las dos algas verdes, los cuales fueron menores que 1% (0.80% y 0.95% p/ps para U. rigida y C. bursa, respectivamente). El contenido de cenizas varió entre especies, de 11.35% (para C. diaphanum) a 29.08% p/ps (para C. bursa). El contenido de azúcares totales varió de 10.41% (para C. bursa) a 18.70% p/ps (para C. diaphanum).
Contenido de minerales
Los contenidos de macronutrientes (Na, K, Mg y Ca) y metales pesados (Fe, Zn, Mn, Cd, Cu y Pb) de las algas marinas se presentan en la tabla 2. En las algas verdes, las mayores concentraciones de macronutrientes correspondieron a Mg (8.686% p/ps en el caso de U. rigida) y Ca (2.918% p/ps en el caso de C. bursa); sin embargo, la cantidad de Ca en C. bursa fue comparable con la de C. barbata (2.962% p/ps) y ligeramente mayor que la de C. diaphanum (2.118% p/ps). Las menores concentraciones de macronutrientes correspondieron a Na (0.428% p/ps en U. rigida), Mg (0.491% p/ps en C. bursa) y K (0.493% p/ps en C. diaphanum).
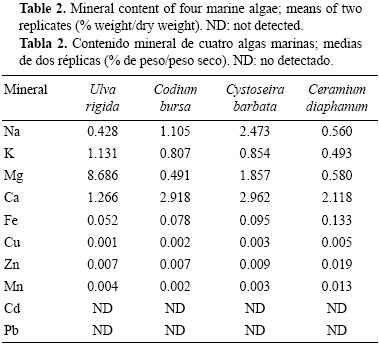
En todos los casos, la abundancia relativa de los metales pesados fue Fe > Zn > Cu. La mayor concentración de Fe se encontró en C. diaphanum (0.133% p/ps). El contenido de Zn varió de 0.007% (para U. rigida y C. bursa) a 0.019% p/ps (para C. diaphanum). Las concentraciones de Cu variaron de 0.001% (para U. rigida) a 0.005% p/ps (para C. diaphanum), mientras que las concentraciones de Mn variaron de 0.002% (para C. bursa) a 0.013% p/ps (para C. diaphanum). Cabe mencionar que no se detectaron Cd y Pb.
Perfil de ácidos grasos
El perfil de ácidos grasos mostró una dominancia de ácidos grasos saturados (SFAs) y monoinsaturados (MUFAs), mientras que las proporciones de ácidos grasos poliinsaturados (PUFAs) fueron bajas en todas las especies de algas examinadas. Según la tabla 3, la composición de ácidos grasos varió de la siguiente manera: 29.99–62.89% de SFAs, 31.64–56.69% de MUFAs y 1.50–13.32% de PUFAs. Para todas las muestras, se observaron diferentes patrones de ácidos grasos. El contenido de SFAs fue mayor en C. diaphanum que en C. barbata, y viceversa en cuanto a los contenidos de ácidos grasos insaturados (MUFAs y PUFAs). También se observaron diferencias entre las dos algas verdes (U. rigida y C. bursa).

Entre los SFAs, los que se encontraron en mayor proporción fueron el ácido palmítico (C16:0, con valores de 24.53% a 41.37%) y el ácido láurico (C12:0, con 24.44% en C. bursa y 10.37% en C. diaphanum). Entre los MUFAs, el más abundante fue el ácido oleico (C18:1n–9), que varió de 21.74% (en C. bursa) a 54.22% (en C. barbata). En cuanto a los PUFAs, los mayores niveles de ácido linoleico (C18:2n–6) se observaron en U. rigida, C. bursa y C. barbata, con valores de 9.57%, 10.74% y 11.71%, respectivamente; sin embargo, el contenido de ácido alfa–linolénico (C18:3n–3) no excedió 1.61% (en C. barbata).
Ensayos de bioactividad
Los resultados de los bioensayos se resumen en la tabla 4. Todos los extractos de algas exhibieron una importante actividad antibacteriana contra S. simulans y E. coli, con diámetros de inhibición que variaron de 10 a 15 mm para S. simulans y de 14 a 25 mm para E. coli. Se evaluaron los efectos inhibitorios potenciales de los extractos de algas sobre la PLA2 humana, una enzima inflamatoria. Las tasas de inhibición variaron de 48% (para C. barbata) a 61% (para U. rigida). Es interesante notar que los extractos de U. rigida, C. barbata y C. diaphanum mostraron actividad antioxidante (medida en función de la actividad secuestrante del radical DPPH), con valores de 23%, 2.4% y 0.8%, respectivamente (tabla 4). La actividad antioxidante y la antibacteriana pueden estar correlacionadas con la presencia de compuestos fenólicos. El contenido fenólico total (fig. 1) varió entre los extractos de algas, de 4.23 (para C. bursa) a 10.77 mg EAG/g de extracto algal (para C. barbata).

DISCUSIÓN
En la primera parte de este estudio, enfocado a las cuatro algas marinas recolectadas del Golfo de Gabes (Túnez), se muestra claramente que la composición química varió entre las especies examinadas. El contenido de proteína cruda obtenido para U. rigida (7.31% p/ps) fue menor que el documentado para otras especies de Ulva (10–26% p/ps) por Fleurence (1999) y similar al registrado para Ulva lactuca (7.06% p/ps) por Wong y Cheung (2000). En el caso de C. barbata y C. diaphanum, los contenidos de proteína cruda estuvieron dentro de los intervalos registrados para las algas pardas (5–15% p/ps) y rojas (10–30% p/ps), respectivamente (Fleurence 1999). El mayor contenido de proteína en C. diaphanum concuerda con otros trabajos (Mabeau y Fleurence 1993, Fleurence 1999, Wong y Cheung 2000). Las variaciones en el contenido de proteína de algas marinas pueden atribuirse a diferentes factores tales como la especie, las temporadas estacionales, la localización geográfica y las condiciones de almacenamiento (Fleurence 1999, Sánchez–Machado et al. 2004).
En el presente trabajo, todas las especies de algas tuvieron contenidos de lípidos menores que 3% p/ps, coincidiendo esto con otros resultados (Mabeau y Fleurence 1993, Wong y Cheung 2000, Aguilera–Morales et al. 2005, Marsham et al. 2007, Polat y Ozogul 2008). Los contenidos lipídicos de C. diaphanum, U. rigida y C. bursa fueron comparables con los obtenidos para algunas algas rojas (Hypnea charoides y Hypnea japonica) y verdes, pero resultaron menores que el obtenido para el alga café C. barbata en trabajos anteriores (Wong y Cheung 2000, Marsham et al. 2007). Al igual que el contenido de proteínas, las variaciones en el contenido de lípidos entre especies están relacionadas con varios factores (especie, hábitat, temporada estacional, etc.) (Fleurence 1999).
El análisis de cenizas mostró altos contenidos de minerales que pueden ser resultado de la absorción de sales inorgánicas del agua de mar o de la asociación entre cationes y polisacáridos algales (Lahaye 1991). La variación del contenido de cenizas entre las algas examinadas se relacionó con la capacidad de cada especie de acumular minerales según las condiciones ambientales (Polat y Ozogul 2008), la temporada y la localización geográfica (Kaehler y Kennish 1996). La distribución de metales pesados observada (Fe > Zn > Cu) también ha sido documentada para otras algas marinas (Malea y Haritonidis 2000, Caliceti et al. 2002). En general, los contenidos de metales pesados varían dependiendo de varios factores tanto metabólicos (variaciones en el crecimiento de algas) como ambientales (variaciones en la concentración de metales en agua, interacción entre metales y otros elementos, salinidad, pH, etc.) (Villares et al. 2002). Los contenidos de minerales pesados en las algas estuvieron por debajo del límite máximo permisible para algas marinas comestibles (Mabeau y Fleurence 1993).
En cuanto al perfil de ácidos grasos, la predominancia de SFAs y MUFAs observada en este trabajo varió entre las algas marinas. Esta propiedad, que se determina primero por la posición sistemática de las algas, estuvo de acuerdo con otros estudios (Hossain et al. 2003, Venkatesalu et al. 2004, Shanmugam y Palpandi 2008). El contenido de SFAs fue mayor en C. diaphanum que en C. barbata, mientras que el caso contrario se observó para el contenido de MUFAs. Asimismo, el contenido de PUFAs fue mayor en C. barbata que en C. diaphanum. Sánchez–Machado et al. (2004) obtuvieron resultados similares. También se encontró que los ácidos grasos más abundantes fueron C16:0 y C18:1, lo que concuerda con otros estudios (Hossain et al. 2003). En general, las variaciones en los contenidos de ácidos grasos se pueden atribuir a diferencias tanto ambientales (localización, temperatura del agua, luz, concentraciones de nitrógeno y otros compuestos en el agua) como genéticas entre las especies (Pohl y Zurheide 1979, Khotimchenko 1998, Nelson et al. 2002).
Los niveles más altos de PUFAs se encontraron en U. rigida, C. bursa y C. barbata, siendo C18:2n–6 y C18:3n–3 los únicos ácidos grasos principales, lo cual también ha sido documentado para algas del sur de Yemen (Banaimoon 1992). Es importante mencionar, sin embargo, que nuestro muestreo se realizó en mayo, periodo durante el cual el contenido de PUFAs en algas es generalmente menor que en el invierno debido al incremento de temperatura (Pohl y Zurheide 1979, Khotimchenko 1998). Además, en nuestro estudio se usaron muestras de algas secas que contienen menos PUFAs debido a la oxidación. El grado de oxidación depende de varios factores (especie; textura; tiempo de exposición al aire, sol o temperaturas altas; y condiciones y tiempo de almacenamiento) (Xu et al. 1998).
El análisis bioquímico mostró que la composición de las algas examinadas (proteínas, lípidos, cenizas, minerales y ácidos grasos) es comparable con la de varias algas marinas tradicionalmente utilizadas en la alimentación humana y animal (Fleurence 1999, Galland–Irmouli et al. 1999). Por lo tanto, las cuatro algas recolectadas del Golfo de Gabes parecen ser una fuente potencial de alimento saludable. Se encontró que contienen concentraciones altas de minerales y azúcares totales, una concentración moderada de proteínas y un contenido bajo de lípidos. También pueden ser consideradas como una fuente valiosa de PUFAs esenciales, los cuales tienen efectos benéficos en humanos y animales.
Además de su valor nutricional, las algas marinas han recibido mucha atención como fuentes potenciales de compuestos bioactivos. En la segunda parte de este trabajo, nuestra evaluación de las propiedades biológicas se enfocó en los efectos de extractos algales etanólicos en bacterias (propiedad antibacteriana) y en la PLA2 humana (propiedad antiinflamatoria), así como en sus actividades antioxidantes potenciales. Todos los extractos algales examinados mostraron una importante actividad antibacteriana contra E. coli y S. simulans, con variaciones de los efectos de inhibición (diámetros de inhibición de 10 a 15 mm para S. simulans y de 14 a 25 mm para E. coli). Estas variaciones sugieren que los efectos de inhibición en las dos cepas bacterianas pueden ser causados por diferentes compuestos en las especies de algas, como se ha mencionado en otros trabajos (Vairappan et al. 2001, 2010; Xu et al. 2003; Venkateswarlu et al. 2007). Los estudios de defensas químicas en organismos marinos sugieren que estos organismos varían ampliamente en la producción de metabolitos secundarios y que tal producción puede estar relacionada con factores físicos (luz, temperatura, etc.) y biológicos (composición de la comunidad, etapa biológica, etc.), la temporada estacional y la localización geográfica (Marechal et al. 2004). Muchos trabajos han encontrado varias tasas de inhibición de extractos algales contra microbios patogénicos, según el disolvente usado en la extracción (agua, metanol, n–hexano, acetato de etilo, cloroformo, benceno, etc.) (Moreau et al. 1988, Sastry y Rao 1994, Lima et al. 2002, Taskin et al. 2007). Por ejemplo, extractos metanólicos de C. barbata y U. rigida presentaron diámetros de inhibición de 10.33 a 22.30 mm contra varios microbios patogénicos (Staphylococcus aureus, Micrococcus luteus, Enterobacter aerogenes, Enterococcus faecalis, Escherichia coli y E. coli O157:H7) (Taskin et al. 2007). Consecuentemente, las diferencias entre nuestros y otros resultados pueden atribuirse a varios factores (variaciones estacionales, periodo y localización de muestreo, y protocolo para la preparación y extracción de algas: algas frescas o secas, solvente, etc.) (Moreau et al. 1988, Lima et al. 2002, Tuney et al. 2007).
Es interesante notar que todos los extractos algales examinados mostraron importantes tasas de inhibición de la PLA2 (48–61% de inhibición). De forma similar, se han aislado muchos compuestos con tasas de inhibición de la PLA2 mayores que 50% de varias especies de algas (Mayer et al. 1993). Por lo tanto, las algas pueden ser una fuente útil de compuestos que presentan propiedades de inhibición de la PLA2, los cuales pueden emplearse para desarrollar fármacos antiinflamatorios alternativos. Además, todos los extractos de algas (excepto el de C. bursa) exhibieron actividades antioxidantes. Ulva rigida presentó el mayor efecto secuestrante de radicales libres (23%) y puede ser utilizada como suplemento en la industria alimentaria y farmacéutica.
La tasa de las actividades biológicas generalmente depende de la naturaleza y cantidad de los compuestos activos en los extractos de algas. Por lo tanto, nuestros resultados requieren de mayor investigación a fin de aislar (mediante cromatografía de capa fina y cromatografía líquida de alta eficacia) e identificar (mediante espectroscopía infrarroja y de resonancia magnética nuclear y espectrometría de masa por impacto electrónico) los compuestos bioactivos de los extractos crudos de algas marinas.
Como se menciona arriba, los compuestos de varias clases químicas pueden ser responsables de las actividades biológicas. Entre ellos, se ha indicado que el contenido de polifenol es responsable de las propiedades antioxidantes en extractos de algas (Karawita et al. 2005, Kuda et al. 2005). No obstante, los extractos de C. barbata y C. diaphanum presentaron un contenido fenólico similar al de U. rigida y menor actividad secuestrante de radicales libres. Este resultado sugiere la presencia de otros factores antioxidantes aparte de los compuestos fenólicos, como ha sido informado anteriormente (Wang et al. 2009). La variación de los contenidos fenólicos entre los extractos algales también ha sido documentado para extractos metanólicos de otras especies (Gracilaria edulis y Acanthophora spicifera; Ganesan et al. 2008). Sin embargo, se informó que los solventes empleados para la extracción podrían tener un efecto significativo en los compuestos químicos (Kumar et al. 2008) y, para aumentar el rendimiento de los compuestos bioactivos, el agua y los disolventes orgánicos fueron sustituidos por digestión enzimática (Heo et al. 2003). Por lo tanto, resulta necesario optimizar el protocolo para la preparación y extracción de algas.
CONCLUSIÓN
Los resultados obtenidos en este estudio muestran claramente que la composición química de Ulva rigida, Codium bursa, Ceramium diaphanum y Cystoseira barbata del Golfo de Gabes (Túnez) variaron ligeramente en comparación con otras algas marinas. Las algas estudiadas presentaron un contenido alto de minerales y azúcares totales, un contenido moderado de proteínas, un contenido bajo de lípidos y una cantidad apreciable de PUFAs, lo cual las convierte en una fuente potencial de alimento saludable. Nuestros resultados también confirman el hecho de que las algas marinas son una fuente rica en moléculas bioactivas. Estas algas marinas podrían ser una fuente potencial de moléculas antibacterianas, antifosfolipasa y antioxidantes. Ya que éste es un estudio preliminar, resulta necesario realizar una investigación detallada de la composición de cada extracto algal para identificar y caracterizar los compuestos bioactivos responsables de estas actividades biológicas.
AGRADECIMIENTOS
Este trabajo forma parte de la tesis doctoral de F Frikha, que se realizó con apoyo del Ministerio de Educación Superior e Investigación Científica de Túnez a través de una subvención al Laboratorio de Bioquímica e Ingeniería Enzimática de Lipasas de la Escuela Nacional de Ingeniería de Sfax (ENIS). Agradecemos a F Ayedi (ENIS) y MJ Makni (ONH, Sfax) su apoyo.
REFERENCIAS
Aguilera–Morales M, Casas–Valdez M, Carrillo–Domínguez B, González–Acosta B, Pérez–Gil F. 2005. Chemical composition and microbiological assays of marine algae Enteromorpha spp. as a potential food source. J. Food Compos. Anal. 18: 79–88. [ Links ]
AOAC. 1990. Official Methods of Analysis of the Association of Analytical Chemists. 15th ed. Association of Official Analytical Chemists, Gaithersburg, USA. [ Links ]
Banaimoon SA. 1992. Fatty acids in marine macroalgae from southern Yemen (Hadramout) including occurrence of eicosatetraenoic (20/4) and eicosapentaenoic (20/5) acids. Bot. Mar. 35: 165–168. [ Links ]
Caliceti M, Argese E, Sfriso A, Pavoni B. 2002. Heavy metal contamination in the seaweeds of the Venice lagoon. Chemosphere 47: 443–454. [ Links ]
Cardozo KH, Guaratini T, Barros MP, Falcao VR, Tonon AP, Lopes NP, Campos S, Torres MA, Souza AO, Colepicolo P, Pinto E. 2007. Metabolites from algae with economical impact. Comp Biochem. Physiol. C 146: 60–78. [ Links ]
Cox S, Abu–Ghannam N, Gupta S. 2010. An assessment of the antioxidant and antimicrobial activity of six species of edible Irish seaweeds. IFRJ 17: 205–220. [ Links ]
Dawes CJ. 1998. Marine Botany. John Wiley, NewYork, 480 pp. [ Links ]
Dearaujo AL, Radvanyi F. 1987. Determination of phospholipase A2 activity by a colorimetric assay using a pH indicator. Toxicon 25: 1181–1188. [ Links ]
Duan XJ, Zhang WW, Li XM, Wang BG. 2006. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata. Food Chem. 95: 37–43. [ Links ]
Dubber D, Harder T. 2008. Extracts of Ceramium rubrum, Mastocarpus stellatus and Laminaria digitata inhibit growth of marine and fish pathogenic bacteria at ecologically realistic concentrations. Aquaculture 274: 196–200. [ Links ]
Faulkner DJ. 2002. Marine natural products. Nat. Prod. Rep. 19: 1–48. [ Links ]
Fleurence J. 1999. Seaweed proteins: Biochemical, nutritional aspects and potential uses. Trends Food Sci. Technol. 10: 25–28. [ Links ]
Galland–Irmouli AV, Fleurence J, Lamghari R, Lucon M, Rouxel C, Barbaroux O, Bronowicki JP, Villaume C, Gueant JL. 1999. Nutritional value of proteins from edible seaweed Palmaria palmata (Dulse). J. Nutr. Biochem. 10: 353–359. [ Links ]
Ganesan P, Kumar CS, Bhaskar N. 2008. Antioxidant properties of methanol extract and its solvent fractions obtained from selected Indian red seaweeds. Bioresour. Technol. 99: 2717–2723. [ Links ]
Heo SJ, Lee KW, Song CB, Jeon YJ. 2003. Antioxidant activity of enzymatic extracts from brown seaweeds. Algae 18: 71–81. [ Links ]
Hossain Z, Kurihara H, Takahashi K. 2003. Biochemical composition and lipid compositional properties of the brown alga Sargassum horneri. Pakistan J. Biol. Sci. 6: 1497–1500. [ Links ]
Kaehler S, Kennish R. 1996. Summer and winter comparisons in the nutritional value of marine macroalgae from Hong Kong. Bot. Mar. 39: 11–17. [ Links ]
Karawita R, Siriwardhana N, Lee KW, Heo MS, Yeo IK, Lee YD, Jeon YJ. 2005. Reactive oxygen species scavenging, metal chelation, reducing power and lipid peroxidation inhibition properties of different solvent fractions from Hizikia fusiformis. Eur. Food Res. Technol. 220: 363–371. [ Links ]
Khotimchenko SV. 1998. Fatty acids of brown algae from the Russian Far East. Phytochemistry 49: 2363–2369. [ Links ]
Kuda T, Taniguchi E, Nishizawa M, Araki Y. 2002. Fate of water–soluble polysaccharides in dried Chorda filum, a brown alga, during water washing. J. Food Compos. Anal. 15: 3–9. [ Links ]
Kuda T, Tsunekawa M, Hishi T, Araki Y. 2005. Antioxidant properties of dried 'kayamo–nori', a brown alga Scytosiphon lomentaria (Scytosiphonales, Phaeophyceae). Food Chem. 89: 617–622. [ Links ]
Kumar KS, Ganesan K, Rao PVS. 2008. Antioxidant potential of solvent extracts of Kappaphycus alvarezii (Doty) Doty, an edible seaweed. Food Chem. 107: 289–295. [ Links ]
Lahaye M. 1991. Marine algae as sources of fibers: Determination of soluble and insoluble dietary fiber contents in some sea vegetables. J. Sci. Food Agr. 54: 587–594. [ Links ]
Lima JVM, Carvalho A, Freitas SM, Melo VMM. 2002. Antibacterial activity of extracts of six macroalgae from the northeastern Brazilian coast. Braz. J. Microbiol. 33: 311–313. [ Links ]
Mabeau S, Fleurence J. 1993. Seaweed in food products: Biochemical and nutritional aspects. Trends Food Sci. Technol. 4: 103–107. [ Links ]
Malea P, Haritonidis S. 2000. Use of the green alga Ulva rigida C Agardh as an indicator species to reassess metal pollution in the Thermaikos Gulf, Greece, after 13 years. J. Appl. Phycol. 12: 169–176. [ Links ]
Marechal JP, Culioli G, Hellio C, Thomas–Guyon H, Callow ME, Clare AS, Ortalo–Magne A. 2004. Seasonal variation in antifouling activity of crude extracts of the brown alga Bifurcaria bifurcata (Cystoseiraceae) against cyprids of Balanus amphitrite and the marine bacteria Cobetia marina and Pseudoalteromonas haloplanktis. J. Exp. Mar. Biol. Ecol. 313: 47–62. [ Links ]
Marinho–Soriano E, Fonseca PC, Carneiro MA, Moreira WS. 2006. Seasonal variation in the chemical composition of two tropical seaweeds. Bioresour. Technol. 97: 2402–2406. [ Links ]
Marsham S, Scott GW, Tobin ML. 2007. Comparison of nutritive chemistry of a range of temperate seaweeds. Food Chem. 100: 1331–1336. [ Links ]
Mayer AMS, Paul VJ, Fenical W, Norris JN, Decarvalho MS, Jacobs RS. 1993. Phospholipase A(2) inhibitors from marine algae. Hydrobiologia 260/261: 521–529. [ Links ]
Mayer AMS, Rodriguez AD, Berlinck RGS, Hamann MT. 2007. Marine pharmacology in 2003–4: Marine compounds with anthelmintic antibacterial, anticoagulant, antifungal, anti–inflammatory, antimalarial, antiplatelet, antiprotozoal, antituberculosis, and antiviral activities, affecting the cardiovascular, immune and nervous systems, and other miscellaneous mechanisms of action. Comp. Biochem. Physiol. C 145: 553–581. [ Links ]
McHugh DJ. 2003. A guide to the seaweed industry. FAO Fish. Tech. Pap. 441. [ Links ]
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31: 426–428. [ Links ]
Moreau J, Pesando D, Bernard P, Caram B, Pionnat JC. 1988. Seasonal variations in the production of antifungal substances by some dictyotales (brown algae) from the French Mediterranean coast. Hydrobiologia 162: 157–162. [ Links ]
Nahas R, Abatis D, Anagnostopoulou MA, Kefalas P, Vagias C, Roussis V. 2007. Radical–scavenging activity of Aegean Sea marine algae. Food Chem. 102: 577–581. [ Links ]
Nelson MM, Phleger CF, Nichols PD. 2002. Seasonal lipid composition in macroalgae of the northeastern Pacific Ocean. Bot. Mar. 45: 58–65. [ Links ]
Plaza M, Cifuentes A, Ibáñez E. 2008. In the search of new functional food ingredients from algae. Trends Food Sci. Technol. 19: 31–39. [ Links ]
Plaza M, Santoyo S, Jaime L, García–Blairsy RG, Herrero M, Senorans FJ, Ibáñez E. 2010. Screening for bioactive compounds from algae. J. Pharmaceut. Biomed. 51: 450–455. [ Links ]
Pohl P, Zurheide F. 1979. Fatty acids and lipids of marine algae and the control of their biosynthesis by environmental factors. In: Hoppe HA, Levring T, Tanaka Y (eds.), Marine Algae in Pharmaceutieal Science. Walter de Gruyter, Berlin, pp. 473–523. [ Links ]
Polat S, Ozogul Y. 2008. Biochemical composition of some red and brown macroalgae from the northeastern Mediterranean Sea. Int. J. Food Sci. Nutr. 59: 566–572. [ Links ]
Sánchez–Machado DI, López–Cervantes J, López–Hernández J, Paseiro–Losada P. 2004. Fatty acids, total lipid, protein and ash contents of processed edible seaweeds. Food Chem. 85: 439–444. [ Links ]
Sastry V, Rao GRK. 1994. Antibacterial substances from marine algae: Successive extraction using benzene, chloroform and methanol. Bot. Mar. 37: 357–360. [ Links ]
Shanmugam A, Palpandi C. 2008. Biochemical composition and fatty acid profile of the green alga Ulva reticulata. Asian J. Biochem. 3: 26–31. [ Links ]
Singleton VL, Rossi JA. 1965. Colorimetry of total phenolics with phosphomolybdic–posphotungustic acid reagent. Am. J. Enol. Vitic. 16: 144–158. [ Links ]
Slover HT, Lanza E. 1979. Quantitative analysis of food fatty acids by capillary gas chromatography. J. Am. Oil Chem. Soc. 56: 933–943. [ Links ]
Taskin E, Ozturk M, Taskin E, Kurt O. 2007. Antibacterial activities of some marine algae from the Aegean Sea (Turkey). Afr. J. Biotechnol. 6: 2746–2751. [ Links ]
Tuney I, Cadirci BH, Unal D, Sukatar A. 2007. Locational and organic solvent variation in antimicrobial activities of crude extracts of marine algae from the coast of Izmir (Turkey). Fresen. Environ. Bull. 16: 428–434. [ Links ]
Vairappan CS, Daitoh M, Suzuki M, Abe T, Masuda M. 2001. Antibacterial halogenated metabolites from the Malaysian Laurencia species. Phytochemistry 58: 291–7. [ Links ]
Vairappan CS, Ishii T, Lee TK, Suzuki M, Zhaoqi Z. 2010. Antibacterial activities of a new brominated diterpene from Borneon Laurencia spp. Mar. Drugs 8: 1743–1749. [ Links ]
Venkatesalu V, Sundaramoorthy P, Anantharaj M, Gopalkriopalakrishnan M, Chandrasekaran M. 2004. Studies on the fatty acid composition of marine algae of Rameswaram coast. Seaweed Res. Util. 26: 83–86. [ Links ]
Venkateswarlu S, Panchagnula GK, Gottumukkala AL, Subbaraju GV. 2007. Synthesis, structural revision, and biological activities of 4'–chloroaurone, a metabolite of marine brown alga Spatoglossum variabile. Tetrahedron 63: 6909–6914. [ Links ]
Villares R, Puente X, Carballeira A. 2002. Seasonal variation and background levels of heavy metals in two green seaweeds. Environ. Pollut. 119: 79–90. [ Links ]
Wang BG, Zhang WW, Duan XJ, Li XM. 2009. In vitro antioxidative activities of extract and semi–purified fractions of the marine red alga, Rhodomela confervoides (Rhodomelaceae). Food Chem. 113: 1101–1105. [ Links ]
Wong KH, Cheung PCK. 2000. Nutritional evaluation of some subtropical red and green seaweeds. Part I. Proximate composition, amino acid profiles and some physico–chemical properties. Food Chem. 71: 475–482. [ Links ]
Xu N, Fan X, Yan X, Li X, Niu R, Tseng CK. 2003. Antibacterial bromophenols from the marine red alga Rhodomela conferoides. Phytochemistry 62: 1221–1224. [ Links ]
Xu XQ, Tran VH, Kraft G, Beardall J. 1998. Fatty acids of six Codium species from southeast Australia. Phytochemistry 48: 1335–1339. [ Links ]
Yen GC, Chen HY. 1995. Antioxidant activity of various tea extracts in relation to their antimutagenicity. J. Agr. Food Chem. 43: 27–32. [ Links ]
Zahra R, Mehrnaz M, Farzaneh V, Kohzad S. 2007. Antioxidant activity of extract from a brown alga, Sargassum boveanu. Afr. J. Biotechnol. 6: 2740–2745. [ Links ]
Zhang Z, Wang F, Wang X, Liu X, Hou Y, Zhang Q. 2010. Extraction of the polysaccharides from five algae and their potential antioxidant activity in vitro. Carbohyd. Polym. 82: 118–121. [ Links ]
*Traducido al español por Christine Harris.
**Descargar versión bilingüe (Inglés–Español) en formato PDF.














