Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.37 no.1 Ensenada Mar. 2011
Edad y crecimiento del conejo (Caulolatilus affinis) en la región central del Golfo de California*
Age and growth of Pacific golden–eye tilefish (Caulolatilus affinis) in the central region of the Gulf of California
JS Ramírez–Pérez1*, FN Melo–Barrera2, LE Ayala–Bobadilla1
1 Universidad Autónoma de Sinaloa, Facultad de Ciencias del Mar, Paseo Claussen s/n, Col. Los Pinos, Mazatlán, Sinaloa, México.
2 Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional, Ave. Instituto Politécnico Nacional s/n, Col. Playa Palo de Santa Rita, La Paz, Baja California Sur, México.
*Corresponding author.
E–mail: jsramirezp@gmail.com; jsramirezp@prodigy.net.mx
Received March 2010
Accepted December 2010
RESUMEN
Se estimó la edad, el crecimiento y la relación longitud–peso del conejo Caulolatilus affinis capturado por la pesca artesanal en la región central del Golfo de California. La estructura de tallas y pesos fue diferente entre sexos, siendo los machos más grandes y más pesados que las hembras; sin embargo, no se detectaron diferencias en la relación longitud–peso y el valor de la pendiente (b = 2.66) indicó que ésta es una relación alométrica negativa. Los organismos más jóvenes y más grandes fueron de 3 y 21 años, respectivamente. Se detectaron diferencias en la estructura de edad entre sexos, siendo los machos más abundantes a edades mayores y las hembras a edades menores. El grupo de edad dominante para las hembras fue de 11 años, mientras que para los machos fue de 16 años. El modelo de crecimiento de von Bertalanffy se ajustó adecuadamente a los datos de talla promedio a la edad; los parámetros del modelo para los machos fueron L∞ = 432.32 mm longitud total, k = 0.232 mm año–1 y t0 = 0.164 año, y para las hembras, L∞ = 422.99 mm longitud total, k = 0.245 mm año–1 y t0 = –0.095 año. No se detectaron diferencias en el crecimiento individual, ni en la tasa de crecimiento entre machos y hembras. Según la estructura de edades y el patrón de crecimiento, C. affinis es una especie de crecimiento lento y longevidad media. Los resultados obtenidos sugieren que C. affinis se encuentra subexplotado en la región central de Golfo de California debido a que no es una especie objetivo.
Palabras clave: edad, crecimiento, longitud–peso, Golfo de California, Caulolatilus affinis.
ABSTRACT
Age, growth, and the length–weight relationship were estimated for the Pacific golden–eye tilefish Caulolatilus affinis captured by the artisanal fishery in the central region of the Gulf of California. The size and weight structure differed between sexes, males being larger and heavier than females; however, differences in the length–weight relationship were not detected and the slope value (b = 2.66) showed that it was a negative allometric relationship. The youngest and oldest organisms were 3 and 21 years old, respectively. The age structure showed differences between sexes, males being more abundant at older ages and females at younger ones. The dominant age group for females was 11 years old and for males, 16 years old. The von Bertalanffy growth model fitted adequately the mean size and age data; the model parameters were L∞ = 432.32 mm total length, k = 0.232 mm yr–1, and t0 = 0.164 yr for males, and L∞ = 422.99 mm total length, k = 0.245 mm yr–1, and t0 = –0.095 yr for females. Differences in individual growth and growth rate between males and females were not detected. According to the age structure and growth pattern, C. affinis is a slow–growing, medium–lived species. Our results suggest that C. affinis is underexploited in the central Gulf of California because it is a non–target species.
Key words: age, growth, length–weight, Gulf of California, Caulolatilus affinis.
INTRODUCCIÓN
Las pesquerías artesanales se caracterizan por capturar una gran diversidad de especies con una amplia variedad de artes de pesca. En comparación con las pesquerías industriales, las cuales manejan elevados volúmenes de captura con un alto valor comercial (e.g., sardina, atún y camarón), las pesquerías artesanales están poco organizadas y pobremente tecnificadas (Berkes et al. 2001). Sin embargo, la pesca artesanal provee una gran cantidad de empleos y una fuente de alimento con alto valor proteico a precios accesibles. A pesar de que el conejo Caulolatilus affinis Gill 1865 y la pierna C. princeps (Jenyns 1840) no son especies objetivo de las pesquerías mexicanas y se capturan como pesca incidental, los volúmenes de captura en el Golfo de California han sobrepasado las 1000 t anuales, lo que representa hasta el 7% de la producción pesquera de algunos estados (SAGARPA 2004).
Caulolatilus affinis es un miembro de la familia Malacanthidae, subfamilia Latilinae (Nelson 2006); sin embargo, Dooley (1978) incluyó a esta especie en la familia Branchiostegidae. Es un pez demersal que se encuentra entre 20 y 240 m de profundidad (comúnmente entre 80 y 165 m) y habita fondos arenosos y lodosos (Dooley 1978). Su distribución geográfica incluye el Golfo de California, hasta Cabo San Lucas (Baja California Sur, México), y el Océano Pacífico oriental, desde Costa Rica hasta Pisco (Perú), incluyendo las islas Galápagos (Dooley 1978).
La estimación de la edad es uno de los elementos clave para entender la dinámica poblacional de las especies, ya que permite estimar parámetros como el crecimiento, la longevidad, la estructura por edades y la tasa de mortalidad (Morales–Nin 1992, Ramos–Miranda et al. 2009). En la mayoría de las estimaciones de edad para teleósteos se usan los otolitos, ya que crecen en forma continua, registran diferentes eventos en la vida de los peces y no presentan procesos de reabsorción, además de su bajo costo de extracción y preparación (Popper y Lu 2000, Campana y Thorrold 2001).
Existen numerosos reportes sobre la historia de vida y pesquerías de las especies de malacántidos en la costa este de los Estados Unidos de Norteamérica, así como estudios detallados sobre su edad y crecimiento (Ross y Huntsman 1982, Ross y Merriner 1983, Turner et al. 1983, Harris y Grossman 1985, Ericksson y Grossman 1986, Harris et al. 2004). Sin embargo, en las costas del Pacífico los estudios sobre estas especies son relativamente escasos.
En el Golfo de California, se ha abordado la edad y el crecimiento de C. princeps (Elorduy–Garay et al. 2005). Las investigaciones hechas sobre C. affinis se restringen a la Bahía de La Paz (BLP), en la parte sur del golfo (fig. 1). Elorduy–Garay y Peláez–Mendoza (1996) describieron los hábitos alimenticios de esta especie, mientras que Ceballos–Vázquez y Elorduy–Garay (1998) abordaron su biología reproductiva. Elorduy–Garay y Díaz–Uribe (1994) validaron las estimaciones de edad hechas con otolitos, concluyendo que la formación de los anillos de crecimiento es anual. Por su parte, Elorduy–Garay y Ruiz–Córdova (1998) estimaron la edad y el crecimiento individual del conejo en BLP y encontraron hasta 15 grupos de edad, indicando que es una especie de longevidad media con una tasa de crecimiento lenta (L∞ = 387.97 mm longitud estándar, k = 0.17 mm año–1, t0 = –2.226 años).
El presente trabajo tiene como objetivo estimar la edad y describir el crecimiento, así como analizar la estructura por edades y tallas de C. affinis capturado en la parte central del Golfo de California (CGC) con la finalidad de evaluar el potencial pesquero de este recurso. Esta investigación de manera conjunta con otros estudios, como hábitos alimenticios y reproductivos, son necesarios para el manejo adecuado y la sustentabilidad del recurso. Cabe destacar que éste es el primer trabajo biológico para la especie en CGC.
MATERIALES Y MÉTODOS
Se realizaron muestreos mensuales de C. affinis, de diciembre de 2006 a abril de 2007, de la pesca artesanal en el área de la Bahía de Lobos, Sonora, México (27°20' N, 110°35' O; fig. 1). En total, se obtuvieron 320 ejemplares. El conejo se captura entre 40 y 80 m de profundidad con una red de monofilamento (red agallera) cuyas dimensiones varían entre 800 y 1500 m de longitud y de 2 a 3 m de caída. El paño está compuesto por secciones de diferente luz de malla, siendo las de 8.89–10.16 cm (3.5–4") las que obtienen la mayor captura. Se registraron la longitud total (LT), la longitud estándar (LE), el peso total (PT) y el sexo (a través de inspección macroscópica) de cada organismo. Los otolitos se recolectaron para la estimación de la edad.
Relación longitud–peso
La estructura de tallas y pesos se obtuvo agrupando a los organismos (machos y hembras) en intervalos de 10 mm LT y 100 g PT. Para evaluar si el sexo afecta la estructura de tallas o pesos, se utilizó la prueba de Kolmogorov–Smirnov (K–S).
La relación entre LT y PT se estimó para machos, hembras y sexos combinados a través del modelo potencial (PT = a (TLb)), utilizando datos transformados a log10. Para determinar si hubo diferencias en esta relación debidas al sexo, se utilizó un análisis de covarianza (ANCOVA).
El valor de la pendiente (b) nos indica el tipo de relación que existe entre LT y PT, la cual puede ser de tipo alométrica o isométrica. Se utilizó una prueba t (Zar 1999) para contrastar las hipótesis: H0, b = 3, la relación es isométrica; Ha, b ≠ 3, la relación es alométrica.
Relación radio del otolito–longitud total
Para eliminar los restos de grasa y tejido de los otolitos, éstos se lavaron con agua corriente y jabón libre de fosfatos. Los otolitos se digitalizaron a través de una cámara de video (Sony CCD–IRIS) adaptada a un microscopio estereoscópico de baja resolución (10x). Se midió el radio total (RT), desde el foco o primordio hasta el borde posterior del otolito (fig. 2a).

Para evaluar la proporcionalidad entre el crecimiento somático y el otolito, se estimó la relación RT–LT. El RT se agrupó en intervalos de 0.1 mm y el promedio de la talla se obtuvo por intervalo de radio (Smale y Taylor 1987, Ehrhardt 1992, Elorduy–Garay y Díaz–Uribe 1994, Melo–Barrera y Félix–Uraga 2003).
Preparación de los otolitos para la estimación de la edad
Una de las principales dificultades para estimar la edad es la claridad de las marcas de crecimiento presentes en las estructuras. Las observaciones iniciales de los otolitos de C. affinis mostraron que las marcas no eran lo suficientemente claras (fig. 2a), lo que dificultó su interpretación. Para mejorar la lectura de los otolitos, éstos se quemaron en una mufla utilizando diferentes combinaciones de temperatura y tiempo (fig. 2b).
Estructura por edades
La lectura de las marcas de crecimiento fue realizada por dos lectores de manera independiente, sin conocer la fecha de captura ni la talla del individuo, utilizando un microscopio estereoscópico (10x) con luz reflejada y sumergiendo los otolitos quemados en glicerina. Al observar los otolitos se pudieron identificar bandas claras (banda opaca) y oscuras (banda hialina); el conjunto de una banda clara y una hialina se consideró una marca de crecimiento. Para determinar la precisión de las lecturas de edad, se calculó el porcentaje de error promedio propuesto por Beamish y Fournier (1981).
Crecimiento individual
El modelo de crecimiento de von Bertalanffy (MCVB) se ajustó a los datos de longitud promedio a la edad, de acuerdo con :

donde LT es la longitud total promedio a la edad, LT∞ es la longitud asintótica, k es el coeficiente de crecimiento, t es la edad en años y t0 es la edad hipotética cuando LT = 0.
Se utilizó el intercepto biológico propuesto por Campana (1990), el cual corresponde a la talla de eclosión del pez, asignándose la talla de la larva más pequeña a la edad de 0.01. Los parámetros del modelo se ajustaron a través de métodos no lineales (algoritmo de Levenberg–Marquardt) para machos, hembras y sexos combinados, utilizando la paquetería Statistica 8.0. La bondad de ajuste del modelo se estimó mediante el coeficiente de determinación (r2). Para establecer si existen diferencias en el patrón de crecimiento individual debidas al sexo, se utilizó la prueba propuesta por Chen et al. (1992), la cual analiza la suma de cuadrados residual que resultan del proceso de ajuste no lineal de los parámetros del MCVB. Además, se analizó la tasa de crecimiento individual de machos y hembras mediante una prueba chi–cuadrada. La tasa de crecimiento individual (ΔLT) se obtuvo mediante:
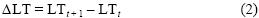
donde LTt+1 es la longitud total a la edad t + 1 y LTt es la longitud total a la edad t.
RESULTADOS
Durante el periodo de muestreo se midieron y pesaron 320 ejemplares de C. affinis (149 hembras, 150 machos y 21 no sexados) y se obtuvieron 209 otolitos. Todas las tallas de captura estuvieron representadas proporcionalmente en la muestra. El intervalo de tallas fue de 240 a 460 mm LT (LTprom = 378 ± 36.6 mm); los individuos <310 y >440 mm LT fueron muy escasos, representando el 4.5% y 3% de la muestra, respectivamente (fig. 3a). Por otro lado, el intervalo de PT fue de 200 a 1900 g; los individuos <400 y >1500 g PT aportaron menos del 1.5% y el 1.6% de la muestra, respectivamente (fig. 3b). Tanto en la estructura de tallas como en la de pesos fue posible observar la presencia de dos modas. En ambos casos la primera moda se asoció con las hembras (360 mm LT y 700 g PT) y la segunda con los machos (400 mm LT y 1000 g PT), por lo que las estructuras de tallas y pesos para machos, hembras y sexos combinados no presentaron una distribución normal (K–S, P < 0.05). La prueba K–S demostró que las diferencias observadas en la estructura de tallas y de pesos debidas al sexo fueron significativas (tallas: Dmax = –0.24, P < 0.01; pesos: Dmax = –0.33, P < 0.01); los machos fueron más abundantes a tallas y pesos mayores que las hembras, a pesar de que el intervalo de talla para ambos sexos fue muy similar (fig. 3a, b).

Relación longitud–peso
El modelo potencial mostró que la relación entre la talla y el peso fue significativa (F(1, 318) = 1674, P < 0.05), explicando más del 90% de la varianza. Los parámetros del modelo ajustado para machos, hembras y sexos combinados se muestran en la tabla 1. El ANCOVA no detectó diferencias significativas en la relación LT–PT de C. affinis debidas al sexo (a: F(1,296) = 0.014, P > 0.05; b: F(1 296) = 0.006, P > 0.05). Se determinó que el conejo presenta una relación de tipo alométrica negativa entre la talla y el peso para los intervalos de longitud y peso analizados, ya que el valor de la pendiente (b = 2.66) fue significativamente diferente de 3 (t = 4.61, P <0.05).
Relación radio del otolito–longitud total
Se estableció la relación RT–LT utilizando la LT promedio por intervalo de 0.1 mm de RT. La agrupación de los datos puede afectar la estimación de los parámetros del modelo, por lo que se utilizó un ANCOVA para probar este efecto. No se detectaron diferencias en esta relación cuando se utilizaron los datos agrupados y sin agrupar (a: F(1,228) = 0.21, P > 0.05; b: F(1, 228) = 0.44, P > 0.05). El modelo lineal se ajustó significativamente a los datos RT–LT, indicando que existe una proporcionalidad (P < 0.05) entre estas dos variables (tabla 1). No se detectaron diferencias significativas en esta relación debidas al sexo de los organismos (a: F(1, 37) = 2.91, P > 0.05; b: F(1, 37) = 3.54, P > 0.05), estableciéndose la relación común. Esta relación justifica la utilización del otolito para describir el crecimiento de C. affinis.
Preparación de los otolitos para la estimación de la edad
Para evidenciar las marcas de crecimiento, los otolitos se quemaron utilizando diferentes combinaciones de temperatura y tiempo. El primer tratamiento consistió en 2 min a 200 °C, obteniéndose una coloración café muy tenue de las bandas hialinas. El segundo tratamiento fue de 3 min a 300 °C, donde las bandas hialinas adquirieron una tonalidad café más oscura, pero aún no eran evidentes las bandas en el borde del otolito. Los mejores resultados se obtuvieron con el tercer tratamiento a 320 °C durante 4 min, ya que las bandas opacas se distinguieron con una coloración más clara que las hialinas y las bandas en el borde de los otolitos se apreciaron claramente (fig. 2b).
Estructura por edades
De los 209 otolitos recolectados para la estimación de la edad, 196 (93.7%) se leyeron satisfactoriamente. El conjunto de una banda opaca y una banda hialina se consideró como una marca de crecimiento o un año de edad, según la validación de edad para C. affinis en el sur del Golfo de California (Elorduy–Garay y Díaz–Uribe 1994).
A través del conteo de las marcas de crecimiento en los otolitos se identificaron 19 grupos de edad, correspondientes a los grupos de 3 a 21 años de edad. El grupo de edad 11 predominó en las capturas, seguido por los grupos 13 y 12. No se recolectaron organismos con menos de tres marcas de crecimiento (fig. 4). La estructura de edades mostró diferencias significativas entre sexos. La moda de las hembras (grupo de edad 11) y la de los machos (grupo de edad 16) correspondieron a las modas presentes en las distribuciones de longitud y peso en ambos sexos, siendo los machos, como se esperaba, más abundantes en edades avanzadas (tabla 2). La precisión de las lecturas entre los lectores fue elevada, quedando de manifiesto por el valor del porcentaje de error promedio (2.18%), el cual fue estimado sólo con los otolitos leídos (n = 196).

Crecimiento individual
Los parámetros del MCVB ajustados a los datos de talla a la edad tomando en consideración el intercepto biológico se muestran en la tabla 1. Los coeficientes de regresión para hembras, machos y sexos combinados mostraron un elevado ajuste entre los datos y el MCVB, explicando el 98% de la varianza. No se observaron diferencias significativas en el crecimiento debidas al sexo (F(1, 34) = 0.22, P > 0.05); esto se comprobó evaluando de manera estadística el MCVB por sexos a través de la prueba de suma de cuadrados residual (fig. 5). De acuerdo con el MCVB, durante el primer año de vida C. affinis alcanza el 24% de la L∞ y al finalizar el quinto año alcanza el 71% de esta talla. Después de la edad 12, el incremento en talla es menor al 1.5%. Para confirmar la igualdad en el crecimiento entre machos y hembras se evaluó la tasa de crecimiento individual (ΔLT) y no se encontraron diferencias significativas debidas al sexo (χ2 = 0.025, P > 0.05).

DISCUSIÓN
En la pesca ribereña que se desarrolla en la parte norte y central del Golfo de California C. affinis y C. princeps son capturadas como especies secundarias en la pesca de la baqueta Epinephelus acanthistius, el extranjero Paralabrax auroguttatus y varias especies de tiburones. Por lo tanto, su producción es escasa con respecto a otras zonas del golfo, como BLP, donde son especies objetivo y representan hasta el 7% de la producción pesquera de Baja California Sur (SAGARPA 2004).
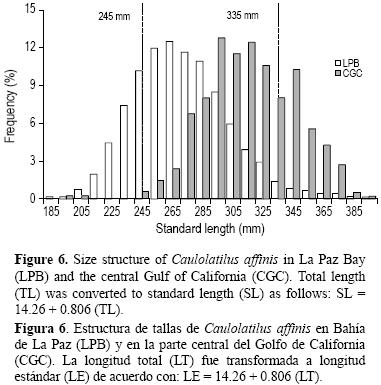
En general, la estructura de tallas de las especies capturadas comercialmente tiende a tener una baja representatividad de organismos pequeños (jóvenes), debido a la selectividad del arte de pesca (selectividad filo de cuchillo) o a que estos organismos no están disponibles o accesibles al arte de pesca, y consecuentemente éstos no se reclutan completamente a la pesquería (Sparre y Venema 1997, Elorduy–Garay y Ruiz–Córdova 1998). El intervalo de tallas de C. affinis reportado para BLP (185–485 mm LE, Elorduy–Garay y Ruiz–Córdova 1998) es mayor que el reportado en el presente trabajo (240–460 mm LT = 195–395 mm LE; LE = 14.26 + 0.806 (LT)). Sin embargo, en CGC hubo un sesgo hacía individuos de mayor tamaño, ya que los individuos menores que 245 mm LE representaron el 25% del total en BLP y tan sólo el 1.25% en el presente trabajo, mientras que los individuos mayores que 335 mm LE representaron el 32% del total de nuestros resultados y sólo el 5.9% en BLP (fig. 6). Respecto al peso de los individuos, los organismos menores que 450 g PT representaron el 11% del total de muestras en CGC, mientras que en BLP representaron más del 60%. En ambos sitios el conejo es capturado entre 50 y 90 m de profundidad. Estas diferencias pueden ser causadas por el periodo de muestreo, debido a que las muestras utilizadas por Elorduy–Garay y Ruiz–Córdova (1998) se obtuvieron entre 1986 y 1987, mientras que las utilizadas en el presente estudio se obtuvieron 20 años después (2006–2007). Se cree que las diferencias en la frecuencia de tallas y pesos se deben principalmente a las artes de pesca utilizadas en ambas zonas. En CGC los pescadores utilizan redes de enmalle dirigidas a la baqueta, la cual alcanza tallas mucho mayores que el conejo. Por otra parte, en BLP C. affinis y C. princeps son especies objetivo y son capturados con líneas de mano, con anzuelos adecuados a estas especies (anzuelo noruego 6 y 7). Turner et al. (1983) mostraron la selectividad de los palangres en la pesquería de Lopholatilus chamaeleonticeps en la región de Nueva Inglaterra (EUA).
Las diferencias en las tallas y pesos debidas al sexo encontradas en CGC parecen ser una característica común de los malacántidos. Las hembras son más abundantes a tallas menores que los machos, lo cual parece estar asociado con el hermafroditismo protogínico de la especie (Ross y Hunstman 1982, Elorduy–Garay y Ruiz–Córdova 1998, Harris et al. 2004).
Relación peso–longitud
La relación entre la longitud y el peso es de gran importancia en la biología pesquera (Sparre y Venema 1997). Las estimaciones de biomasa hechas con modelos analíticos, como el de población virtual, requieren del cálculo del peso promedio de individuos por edad o clase de longitud (Frota et al. 2004). A pesar de las diferencias entre sexos en la estructura de tallas y pesos de C. affinis, en la relación LT–PT no se observaron dichas diferencias, indicando que hembras y machos de tallas similares presentan pesos similares; esto también fue reportado para L. chamaeleonticeps (Turner et al. 1983). A pesar de que Elorduy–Garay y Ruiz–Córdova (1998) y Elorduy–Garay et al. (2005) no evaluaron estadísticamente esta relación para C. affinis en BLP, es posible suponer que no hay diferencias, pues los parámetros de la relación LT–PT son similares para hembras y machos.
La relación alométrica negativa de C. affinis en CGC (b = 2.66) fue diferente a la de Elorduy–Garay y Ruiz–Córdova (1998) para el conejo en BLP. Estos autores obtuvieron un valor de b = 3.25, lo cual no necesariamente implica diferencias biológicas, ya que los peces pueden variar hasta dentro de una misma muestra de manera considerable (Schneider et al. 2000). Se han reportado variaciones así de amplias (2.66–3.25) en el parámetro de alometría para otros malacántidos (Frota et al. 2004). Las variaciones en la relación LT–PT pueden deberse al intervalo de tallas utilizado (Rodrigues y Araujo 2003), a la zona y época de muestreo, a la condición de los organismos y al método de estimación de los parámetros (Frota et al. 2004). El desarrollo gonadal también es una variable muy importante en esta relación (Schneider et al. 2000).
Relación radio del otolito–longitud del pez
La proporcionalidad entre la estructura dura (otolito) y el crecimiento del pez fue observada en el conejo, quedando de manifiesto en el ajuste lineal del modelo, lo cual es un patrón común para la familia (Elorduy–Garay y Díaz–Uribe 1994, Elorduy–Garay et al. 2005).
A pesar de que la forma de los otolitos de C. affinis en BLP y CGC es muy similar, existen diferencias evidentes en la relación RT–LT; el otolito de un pez de 305 mm LE mide 4 mm de largo en BLP, mientras que el de un pez de la misma talla en CGC mide 3.5 mm de largo. La forma del otolito es específica de la especie y está determinada genéticamente (Lombarte y Lleonart 1993); sin embargo, existen diferencias en el tamaño, las cuales pueden deberse a una multitud de factores que afectan la tasa de crecimiento del otolito, como la temperatura y la profundidad del agua y la disponibilidad de alimento y minerales (Lombarte y Lleonart 1993).
Los datos agrupados utilizados para la estimación de la relación RT–LT disminuyen la alta variabilidad que presentan los datos crudos de otolitos (Elorduy–Garay y Díaz–Uribe 1994), conchas de moluscos (Smale y Taylor 1987) y espinas de peces (Ehrhardt 1992, Melo–Barrera y Félix–Uraga 2003). En el presente estudio no se observaron diferencias en la relación RT–LT con los datos agrupados y sin agrupar, lo cual también fue reportado por Elorduy–Garay et al. (2005). Los datos agrupados presentan un menor error estándar y explican una mayor varianza, de allí la utilidad de esta metodología.
Preparación de los otolitos para la estimación de la edad
El quemado de los otolitos ha demostrado ser un buen método para evidenciar las marcas de crecimiento en varias especies (Hippoglossus stenolepis, Blood 2003; Mullus barbatus ponticus, Polat et al. 2005), incluyendo los mala–cántidos (Elorduy–Garay y Díaz–Uribe 1994, Elorduy–Garay y Ruiz–Córdova 1998, Elorduy–Garay et al. 2005). Esto se debe a que el otolito está compuesto por una porción de materia inorgánica (carbonato de calcio) y una orgánica en forma de proteína (otolina). La porción orgánica se quema al momento de ser sometida a altas temperaturas, tornando su coloración a diferentes tonalidades de café. Este proceso tiene varias ventajas sobre el corte y el pulido, ya que se pueden quemar varios otolitos a la vez, reduciendo el tiempo de proceso; además, el corte y el pulido requieren equipo especializado y un manejo cuidadoso de las estructuras.
Estructura por edades
La estimación de la edad se basa en el registro de la historia de vida grabada en las estructuras duras de los organismos. La preferencia del uso de los otolitos sobre otras estructuras (escamas, espinas o huesos) se debe a que el otoito crece continuamente. Aun cuando el crecimiento somático se disminuye, el otolito no se pierde (como las escamas) ni se reabsorbe (como los huesos y las espinas), y además, registra las condiciones del medio donde se desarrolla el individuo. También se ha demostrado que las estimaciones hechas con base en otolitos son más precisas que las hechas con otras estructuras (Campana y Thorrold 2001).
El porcentaje de otolitos que no fue posible leer (6%) fue similar al reportado para otros malacántidos: 8% para C. affinis (Elorduy–Garay y Ruiz–Córdova 1998), 12% para C. princeps (Elorduy–Garay et al. 2005) y 10% para L. chaemaeleonticeps (Turner et al. 1983). Los otolitos de C. affinis obtenidos en CGC presentan marcas más evidentes que los provenientes de BLP (Elorduy–Garay com. pers. 2006).
Los individuos de C. affinis menores de dos años no se reclutaron, mientras que los de tres a cinco años estuvieron parcialmente reclutados. La estructura de edades mostró una longevidad de 21 años. Los individuos mayores que 12 años fueron relativamente abundantes, a diferencia de lo reportado para BLP por Elorduy–Garay y Ruiz–Córdova (1998), quienes no observaron ejemplares mayores de 12 años presentes en las capturas (fig. 4). La captura de peces más grandes y viejos de una misma especie en diferentes áreas de pesca puede atribuirse a condiciones más favorables para el crecimiento y la longevidad, pero también puede deberse a una exposición menos intensa a presiones pesqueras (Ross y Huntsman 1982). También, se ha demostrado que las estructuras de talla y edad truncadas en las tallas o edades mayores son el resultado de la presión de pesca (Craig et al. 1999, Harris et al. 2004), lo que pudiera ser el caso para BLP y CGC.
En CGC, C. affinis se captura incidentalmente durante cinco meses del año, mientras que en BLP es una especie objetivo que se captura a lo largo del año y, por lo tanto, está sometida a un nivel de explotación elevado; esto último tiene como consecuencia la disminución de los individuos más grandes y viejos.
Crecimiento individual
Se han observado diferencias en el crecimiento entre hembras y machos para varias especies de malacántidos. En algunas especies los machos crecen más rápido y alcanzan tallas más grandes que las hembras, pero éstas viven más tiempo (L. chamaeleonticeps, Turner et al. 1983; Branchiostegus japonicus, Hayashi 1976; Caulolatilus chrysops y C. intermedius, Ross y Huntsman 1982). Por el contrario, los machos de C. microps alcanzan tallas más grandes y son más abundantes a edades mayores que las hembras, a pesar de que alcanzan las mismas edades (Harris et al. 2004). Estas divergencias en las tasas de crecimiento están correlacionadas con la madurez sexual en las hembras, probablemente como resultado del costo energético tan alto y temprano de la reproducción (Turner et al. 1983). A pesar de que se han reportado estas diferencias para C. affinis en BLP (Elorduy–Garay y Ruiz–Córdova 1998), en CGC no se encontraron y, por lo tanto, fue posible utilizar el MCVB ajustado con los datos combinados.
El crecimiento de C. affinis estuvo representado adecuadamente por el MCVB, con un elevado ajuste entre los datos observados y el modelo; las mayores discrepancias se observaron hacia las tallas de los individuos menores que 5 y mayores que 17 años, las cuales pudieron ser originadas por la selectividad del arte de pesca, sobrestimando dichas tallas. Los valores de la tasa de crecimiento de C. affinis se encuentran dentro del intervalo reportado por otros autores para especies de la misma familia: C. microps, k = 0.137 mm año–1 (Ross y Hunstman 1982) y k = 0.15 mm año–1 (Harris et al. 2004); B. japonicus, k = 0.304 mm año–1 y k = 0.297 mm año–1 (machos y hembras, respectivamente; Hayashi 1976); L. chamaeleonticeps k = 0.162 mm año–1 (Turner et al. 1983). Sin embargo estos valores son mayores que los reportados para C. affinis en el sur del Golfo de California (SL∞, = 422.87 mm, k = 0.1327 mm año–1, t0 = 2.713 años; Elorduy–Garay y Ruiz–Córdova 1998), lo que da como resultado diferencias en el crecimiento. Estas diferencias pueden ser ocasionadas, entre otras causas, por el intervalo de talla y edad analizado, así como por los métodos de estimación utilizados, ya que estos últimos autores utilizaron métodos gráficos (Ford–Walford, Tomlinson y Abramson) y una regresión no lineal de mínimos cuadrados (algoritmo de Marquardt) para calcular k y t0.
La ventaja de utilizar un valor inicial de la curva de crecimiento (definido como la talla de la larva al momento de la eclosión) es que el valor de la tasa de crecimiento puede ser más real, ya que valores muy negativos de t0 ocasionan una subestimación de k y una sobreestimación de L∞ (López–Veiga 1979). Lo anterior se debe a que el utilizar un valor de talla cercana al inicio del desarrollo ontogénico incrementa la pendiente, con una subsecuente disminución de la talla asintótica.
Los miembros de la familia Malacanthidae se consideran como especies de lento crecimiento y longevidad media o alta: L. chamaeleonticeps es la especie de talla más grande, alcanzando 1150 mm de longitud furcal, y una de las de alta longevidad, alcanzando hasta 35 años (Turner et al. 1983); C. microps es la especie más longeva de la familia, con individuos que alcanzan 40 años de edad y 800 mm LT (Harris et al. 2004); B. japonicus es la especie más pequeña, con 322 mm LT y 8 años de edad (Hayashi 1976). El crecimiento lento y la longevidad alta parecen ser características comunes de las especies que habitan en aguas profundas (Pilling et al. 2000, Cailliet et al. 2001, Andrews et al. 2007).
CONCLUSIONES
A pesar de que los machos son más abundantes a mayores edades, tallas y pesos que las hembras, no se observaron diferencias en el crecimiento individual, ni en la relación peso–longitud debidas al sexo. De acuerdo con los resultados, C. affinis presenta un crecimiento lento y una longevidad media. Debido a la presencia de organismos de mayor edad (14 a 21 años) y a la ausencia de jóvenes en las capturas, es posible suponer que la explotación del recurso está por debajo de los niveles óptimos en CGC.
AGRADECIMIENTOS
El primer autor agradece las becas recibidas a través del CONACYT, PIFI–IPN y el programa de doctores jóvenes de la Universidad Autónoma de Sinaloa. El segundo autor recibió apoyo a través de COFAA y EDI del Instituto Politécnico Nacional. Se agradece el apoyo de los pescadores de la Bahía de Lobos (Sonora, México) para la obtención de las muestras, a JP Partida la traducción al inglés y a los dos revisores anónimos sus valiosos comentarios.
REFERENCIAS
Andrews AH, Kerr LA, Cailliet GM, Brown TA, Lundstrom CC, Stanley RD. 2007. Age validation of canary rockfish (Sebastes pinniger) using two independent otolith techniques: lead–radium and bomb radiocarbon dating. Mar. Freshwat. Res. 58: 531–541. [ Links ]
Beamish RJ, Fournier DA. 1981. A method for comparing the precision of a set of age determinations. Can. J. Fish. Aquat. Sci. 38: 233–236. [ Links ]
Berkes F, Mahon R, McConney P, Pollnac R, Pomeroy R. 2001. Managing small–scale fisheries: Alternative directions and methods. International Development Research Centre, Ottawa 285 pp. [ Links ]
Blood CL. 2003. Age validation of Pacific halibut. Comparison of surface and break and burn otolith methods of ageing Pacific halibut. Inter. Pac. Halibut Comm. Tech. Rep. 47:1–32. http://www.iphc.int/pubs/techrep/tech0047.pdf. [ Links ]
Cailliet GM, Andrews AH, Burton EJ, Watters DL, Kline DE, Ferry–Graham LA. 2001. Age determination and validation studies of marine fishes: Do deep–dwellers live longer? Exp. Gerontol. 36: 739–764. [ Links ]
Campana SE. 1990. How reliable are growth back–calculations based on otoliths? Can. J. Fish. Aquat. Sci. 47: 2219–2227. [ Links ]
Campana SE, Thorrold SR. 2001. Otoliths, increments, and elements: Keys to a comprehensive understanding of fish populations? Can. J. Fish. Aquat. Sci. 58: 30–38. [ Links ]
Ceballos–Vázquez BP, Elorduy–Garay JF. 1998. Gonadal development and spawning of the golden–eyed tilefish Caulolatilus affinis (Pisces: Branchiostegidae) in the Gulf of California, Mexico. Bull. Mar. Sci. 63: 469–479. [ Links ]
Chen Y, Jackson DA, Harvey HH. 1992. A comparison of von Bertalanffy and polynomial functions in modelling fish growth data. Can. J. Fish. Aquat. Sci. 49: 1228–1235. [ Links ]
Craig MT, Pondella DJ, Hafner JC. 1999. Analysis of age and growth in two eastern Pacific groupers (Serranidae: Epinephelinae). Bull. Mar. Sci. 65: 807–814. [ Links ]
Dooley JK. 1978. Systematic and biology of tilefishes (Perciformes: Branchiostegidae and Malacanthidae), with description of two new species. NOAA Tech. Rep. NMFS Circ. 411:1–79. [ Links ]
Ehrhardt NM. 1992. Age and growth of swordfish Xiphias gladius, in the northwestern Atlantic. Bull. Mar. Sci. 50: 299–301. [ Links ]
Elorduy–Garay JF, Díaz–Uribe JG. 1994. Age validation of Caulolatilus affinis, Gill 1865 (Pisces: Branchiostegidae) from the Gulf of California using otoliths. Sci. Mar. 58: 277–287. [ Links ]
Elorduy–Garay JF, Peláez–Mendoza AK. 1996. Hábitos alimentarios de Caulolatilus affinis, Gill 1865 (Perciformes: Branchiostegidae) en la Bahía de La Paz, Baja California Sur, México. Rev. Biol. Trop. 44: 241–249. [ Links ]
Elorduy–Garay JF, Ruiz–Córdova SS. 1998. Age, growth, and mortality of Caulolatilus affinis (Osteichthyes: Branchiostegidae) from the southern Gulf of California. Pac. Sci. 52: 259–272. [ Links ]
Elorduy–Garay JF, Ruiz–Córdova SS, Díaz–Uribe JG. 2005. Age, growth, and mortality of Caulolatilus princeps (Pisces: Malacanthidae) from the southern Gulf of California. Hidrobiológica 15: 289–297. [ Links ]
Erickson DL, Grossman GD. 1986. Reproductive demography of tilefish from the South Atlantic Bight with a test for the presence of protogynous hermaphroditism. Trans. Am. Fish. Soc. 114: 837–846. [ Links ]
Frota LO, Costa PAS, Braga AC. 2004. Length–weight relationships of marine fishes from the central Brazilian coast. NAGA 27: 20–26. [ Links ]
Hayashi Y. 1976. Studies on the growth of the red tilefish in the East China Sea. A fundamental consideration for age determination from otoliths. Bull. Jap. Soc. Sci. Fish. 42: 1237–1242. [ Links ]
Harris MJ, Grossman GD. 1985. Growth, mortality and age composition of a lightly exploited tilefish substock off Georgia. Trans. Am. Fish. Soc. 114: 837–846. [ Links ]
Harris PJ, Wyanski DM, Mikell P. 2004. Age, growth, and reproductive biology of blueline tilefish along the southeastern coast of the United States, 1982–1999. Trans. Am. Fish. Soc. 133: 1190–1204. [ Links ]
Lombarte A, Lleonart J. 1993. Otolith size changes related to body growth, habitat depth and temperature. Environ. Biol. Fish. 37: 297–306. [ Links ]
López–Veiga EC. 1979. Fitting von Bertalanffy growth curves in short–lived fish species. A new approach. Invest. Pesq. 43: 179–186. [ Links ]
Melo–Barrera FN, Félix–Uraga R. 2003. Estructura de tallas y edad del marlin rayado Tetrapturus audax (Pisces: Xiphidae), en Cabo San Lucas, Baja California Sur, México. Rev. Biol. Trop. 52: 981–989. [ Links ]
Morales–Nin B. 1992. Determination of growth in bony fishes from otolith microstructure. FAO Fish. Tech. Paper. No. 322, Rome, 51 pp. [ Links ]
Nelson, JS. 2006. Fishes of the World. 4th ed. John Wiley & Sons, Hoboken, New Jersey, 601 pp. [ Links ]
Pilling GM, Millner RS, Easey MW, Mees CC, Rathacharen S, Azemia R. 2000. Validation of annual growth increments in the otoliths of the lethrinid Lethrinus mahsena and the lutjanid Aprion virescens from sites in the tropical Indian Ocean, with notes on the nature of growth increments in Pristipomoides filamentosus. Fish. Bull. 98: 600–611. [ Links ]
Polat N, Bostanci D, Yilmaz S. 2005. Differences between whole otolith and broken–burn otolith ages of red mullet (Mullus barbatus ponticus Essipov 1927) sampled from the Black Sea (Samsun, Turkey). Turk. J. Vet. Anim. Sci. 29: 429–433. [ Links ]
Popper AN, Lu Z. 2000. Structure–function relationships in fish otolith organs. Fish. Res. 46: 15–25. [ Links ]
Ramos–Miranda J, Bejarano–Hau K, Flores–Hernández D, Ayala–Pérez LA. 2009. Growth, mortality, maturity, and recruitment of the star drum (Stellifer lanceolatus) in the southerm Gulf of Mexico. Cienc. Mar. 35: 245–251. [ Links ]
Rodrigues CM, Araujo FC. 2003. Length–weigth relationship and condition factor of Micropogonias furnieri (Desmarest) (Perciformes, Scianidae) in Sepetiba Bay, Rio de Janeiro, Brazil. Rev. Brasil. Zool. 20: 685–690. [ Links ]
Ross JL, Huntsman GR. 1982. Age, growth and mortality of blueline tilefish from North Carolina and South Carolina. Trans. Am. Fish. Soc. 111: 585–592. [ Links ]
Ross JL, Merriner JV. 1983. Reproductive biology of the blueline tilefish Caulolatilus microps off North Carolina and South Carolina. NMFS Fish. Bull. 81: 553–56. [ Links ]
SAGARPA. 2004. Carta Nacional Pesquera. Diario Oficial de la Federación, México, 15/03/2004. [ Links ]
Schneider JC, Laarman PW, Gowing H. 2000. Length–weight relationships. In: Schneider JC (ed.), Manual of Fisheries Survey Methods II, with periodic updates. Fisheries Special Report 25, Michigan Department of Natural Resources, Ann Arbor, pp. 1–18. [ Links ]
Smale MA, Taylor WW. 1987. Sources of back–calculation error in estimating growth of lake whitefish. In: Summerfelt RC, Hall GE (eds.), Age and Growth of Fish. Iowa State Univ. Press, Ames, pp. 189–202. [ Links ]
Sparre P, Venema SC. 1997. Introducción a la Evaluación de Recursos Pesqueros Tropicales. Parte 1. Manual. FAO, Rome, 525 pp. [ Links ]
Turner SC, Grimes CB, Able KW. 1983. Growth, mortality and age size structure of the fisheries for tilefish Lopholatilus chamaeleonticeps in the middle Atlantic–southern New England region. NMFS Fish. Bull. 81: 751–763. [ Links ]
Zar JH. 1999. Biostatistical Analysis. 4th ed. Prentice Hall, New Jersey, 663 pp. [ Links ]
*Descargar versión bilingüe (Inglés–Español) en formato PDF.














