Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.36 n.4 Ensenada Dec. 2010
Artículos
Diversidad de macroalgas asociada con un manto de rodolitos tropical de Brasil*
Seaweed diversity associated with a Brazilian tropical rhodolith bed**
GM Amado–Filho1*, GW Maneveldt2, GH Pereira–Filho1, 3, RCC Manso1, RG. Bahia1, MB Barros–Barreto3, SMPB Guimarães4
1 Instituto de Pesquisas Jardim Botânico do Rio de Janeiro, Diretoria de Pesquisa Científica, Rua Pacheco Leao 915, 22460–030, Rio de Janeiro, RJ, Brazil. *E–mail: gfilho@jbrj.gov.br
2 Department of Biodiversity and Conservation Biology, University of the Western Cape, P. Bag X17, Bellville 7535, South Africa.
3 Departamento de Botânica, Universidade Federal Rural do Rio de Janeiro, Rodovia Rio São Paulo Km 47, 23851–970, Seropédica, RJ, Brazil.
4 Instituto de Botânica, Av. Miguel Estefano 3687, 04301–902, São Paulo, SP, Brazil.
Received May 2010
Accepted September 2010
RESUMEN
Se describen las poblaciones de las macroalgas submareales predominantemente tropicales que crecen sobre rodolitos entre 4 y 18 m de profundidad en la parte sur del estado de Espirito Santo (Brasil). Muestreos cualitativos y cuantitativos revelaron comunidades ricas en especies de algas, incluyendo 167 especies. Tres especies de rodofitas son nuevas adiciones a la flora marina de Brasil (Lithothamnion muelleri, Scinaia aborealis y Mesophyllum engelhartii). Las marcadas diferencias estacionales en la composición y abundancia de especies de algas carnosas se relacionaron con la inestabilidad causada por el disturbio de tormentas invernales sobre los mantos de rodolitos. En cuanto a la profundidad, la densidad de rodolitos parece ser un factor importante para la variación en la abundancia de algas carnosas. La comunidad de rodolitos está formada por al menos siete especies de algas coralinas no geniculadas. Se demostró que los mantos de rodolitos, en un área de 150 km2, proporcionan un hábitat importante para las comunidades bentónicas, manteniendo 25% de la riqueza de especies de macroalgas conocidas para la costa brasileña.
Palabras clave: rodolitos, algas marinas de Brasil, comunidad algal bentónica, estado de Espirito Santo, algas coralinas incrustantes.
ABSTRACT
This study describes the predominantly tropical, subtidal seaweed populations growing on rhodoliths between 4 and 18 m depth in the southern part of Espirito Santo State (Brazil). Qualitative and quantitative sampling revealed species–rich algal communities, comprising 167 species. Three species of rhodophytes represent new records for the Brazilian marine flora (Lithothamnion muelleri, Scinaia aborealis, and Mesophyllum engelhartii). Marked seasonal differences in fleshy algal species composition and abundance were related to seasonal instabilities caused by winter–storm disturbance over the rhodolith beds. In relation to depth, rhodolith density appears to be an important factor for the variation in the abundance of fleshy algae. The rhodolith community is composed of at least seven nongeniculate crustose coralline algal species. Rhodolith beds in southern Espírito Santo State, in an area of 150 km2, provide an important habitat for epibenthic communities, supporting 25% of the known macroalgal species richness along the Brazilian coast.
Key words: rhodoliths, marine algae of Brazil, benthic algal community, Espirito Santo State, crustose coralline algae.
INTRODUCCIÓN
Las algas marinas, especialmente las especies grandes, longevas y de morfología compleja, pueden proporcionar mucha de la diversidad de hábitats de comunidades bénticas, actuando como especies fundamentales (Foster et al. 2007). Se reconoce que el talo grande de Laminaria y los ejes ramificados de las algas coralinas geniculadas son ejemplos de especies formadoras de hábitats (e.g., Norderhaug et al. 2002; Christie et al. 2003, 2007; Kelaher 2002; Kelaher et al. 2004; Liuzzi y Gappa 2008). Crain y Bertness (2006) sugirieron que las especies fundamentales son "ingenieros dominantes" y las funciones de tales especies son similares a las de los "ingenieros de ecosistemas". Consecuentemente, las especies fundamentales deben considerarse elementos importantes en los procesos de conservación de la diversidad (Boogert et al. 2006, Foster et al. 2007).
Los rodolitos, las formas de vida libre de varios géneros de algas coralinas no geniculadas, también han sido reconocidos como especies fundamentales (Amado–Filho et al. 2007, Foster et al. 2007, Steller et al. 2007). La diversidad de los organismos que viven sobre los rodolitos probablemente sea resultado de que proporcionan superficies duras para la fijación (Foster et al. 2007). Se ha encontrado que la diversidad de los organismos asociados con los rodolitos se relaciona con el tamaño y la complejidad del talo, asi como su dureza en las formas ramificadas. Algunos factores ambientales, tales como el movimiento del agua, la disponibilidad de luz, la sedimentación y la profundidad, afectan el tamaño, la morfologia, la estabilidad y la distribución de los rodolitos (Steller y Foster 1995, Harris et al. 1996, Basso 1998). La diversidad en los sedimentos circundantes probablemente esté relacionada con la complejidad estructural proporcionada por las densas agregaciones de los rodolitos y sus fragmentos (Kamenos et al. 2003, Steller et al. 2003, Foster et al. 2007).
Los mantos de rodolitos no se desarrollan si el movimiento del agua es tan fuerte que causa la fragmentación y tasas insostenibles de pérdida de talos, o si el movimiento del agua es tan leve que los mantos quedan cubiertos de sedimento (Foster 2001). El movimiento del agua más bien tiene que ser lo suficiente para permitir las rotaciones periódicas necesarias para recibir luz en todos los lados y evitar la bioincrustación (Steneck 1986). La rotación de los rodolitos representa un evento de pertubación potencial para las algas asociadas a ellos ya que pueden ser arrancadas, rotas o sepultadas por el movimiento (Hinojosa–Arango et al. 2009). Por lo tanto, la ocurrencia de disturbios es importante (van der Maarel 1993) para los mantos de rodolitos y sus comunidades asociadas, y su importancia para la diversidad ha sido afirmada y comprobada frecuentemente (van der Maarel 1993). La bien conocida hipótesis del disturbio intermedio predice el mantenimiento de niveles altos de diversidad para hábitats tanto terrestres como acuáticos (Poff 1992, Giller 1996, Lake 2000).
Según Fujii et al. (2008), en los ecosistemas marinos brasileños se han encontrado 774 taxones infragenéricos de macroalgas, restringiéndose los registros conocidos a las zonas intermareales y submareales someras. Son pocos los estudios que se han enfocado en las comunidades bentónicas por debajo de los 5 m de profundidad (Guimaraes 2003), a pesar de que los mantos de rodolitos se consideran uno de los hábitats submareales más favorables para realizar muestreos de la diversidad marina de Brasil (Horta et al. 2001).
La región que comprende el estado de Espirito Santo (18.35° a 21.30° S) se conoce como una zona transicional entre la costa brasileña tropical y subtropical. Con una gran diversidad de macroalgas marinas, la región es considerada la más rica de Brasil (Guimaraes 2003, 2006). Su gran diversidad ha sido asociada, en parte, con la presencia de mantos de rodolitos (fig. 1a) que se extienden de la zona intermareal hasta los 100 m de profundidad (Horta et al. 2001, Guimarães 2006, Amado–Filho et al. 2007). En un estudio reciente, Amado–Filho et al. (2007) observaron un aumento en la talla de rodolitos individuales (fig. 1b) entre 4 y 55 m de profundidad en la costa sur de Espirito Santo, asi como una reducción en su densidad de las zonas más someras a las más profundas; sin embargo, se requieren estudios para determinar como esta distribución de rodolitos afecta las comunidades algales asociadas. En general, la tasa de degradación de los sistemas naturales es mayor que la de las iniciativas de conservación (Crowder et al. 2000, Brodie et al. 2009). Para poder implementar las estrategias de manejo e iniciativas de conservación adecuadas en los sistemas marinos, es necesario conocer y entender la estructura y la dinámica de las comunidades (temporales y espaciales) y poblaciones marinas. El objetivo del presente trabajo fue probar la hipótesis de que los mantos de rodolitos del estado de Espirito Santo son de los mantos más diversos registrados, respaldando la suposición de que contribuyen a la alta diversidad de algas marinas del estado (Guimaraes 2003, 2006).
MATERIALES Y MÉTODOS
El área de estudio se localiza en la parte sur del estado de Espirito Santo, Brasil (20°55'27" S, 40°45'22" W; 21°01'57" S, 40°40'54" W), a una distancia de 2 a 20 km de la costa (fig. 2). Se encuentra en una región intertropical que tipicamente presenta dos estaciones: un verano lluvioso y un invierno seco. La costa sudoriental de Brasil está expuesta a Agua Tropical de la Corriente de Brasil, con temperaturas alrededor de 20°C y salinidad >36; sin embargo, entre octubre y marzo, Agua Central del Atlántico Sur (ACAS), sujeta a procesos de surgencia, puede alcanzar el área de estudio. La ACAS presenta temperaturas tipicas de 6°C a 20°C y salinidades entre 34.6 y 36 (Silveira et al. 2000). Se observan dos condiciones abióticas muy distintas: (1) un verano lluvioso, con vientos del NE y E (Niemer 1977, Vera et al. 2002) y el arribo de aguas frias de surgencia; y (2) un invierno seco, cuando las tormentas frecuentes del S y SE (Niemer 1977, Vera et al 2002) llegan a la región y la temperatura del agua superficial del mar puede ser mayor que durante el verano.
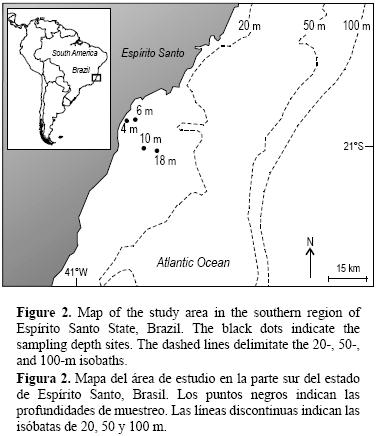
Las muestras se obtuvieron mediante buceo autónomo en cuatro sitios localizados a profundidades de 4, 6, 10 y 18 m (fig. 2). Los sitios se escogieron para representar, lo más posible, las diferentes caracteristicas fisionómicas generales del área. Se realizaron muestreos cualitativos en marzo de 2004 (verano), agosto de 2004 (invierno), noviembre de 2004 (primavera) y abril de 2005 (otoño), recolectando especimenes de material algal para obtener el máximo número de especies en el área. En cada sitio, durante marzo y agosto de 2004, se establecieron dos lineas de transecto de 20 m de largo en el sustrato, posicionadas en forma paralela y a una distancia de aproximadamente 1500 m entre si. La unidad de muestreo fue un cuadrante de 0.0625 m2 (Amado–Filho et al. 2006, 2007; Peña y Bárbara 2008). A lo largo de cada linea, se colocaron aleatoriamente cuatro cuadrantes (n = 8 para cada profundidad). Todo el material (superficie a 15 cm) recolectado en cada cuadrante, incluyendo los rodolitos, fue colocado en bolsas. En el laboratorio, todas las muestras se fijaron con formol al 4% en agua de mar. Las macroalgas se separaron y se identificaron bajo un microscopio estereoscópico y un microscopio óptico. Las muestras se secaron en un horno a 60°C durante 48 h y posteriormente se pesaron en una balanza analitica para determinar el peso seco. La densidad de rodolitos se determinó mediante el conteo individual de rodolitos en los cuadrantes, expresándose los resultados como individuos de rodolitos por metro cuadrado.
Todos los rodolitos recolectados en cada profundidad fueron numerados. Se escogieron aleatoriamente 50 individuos y se midieron sus dimensiones (diámetros más ancho, intermedio y más angosto).
La identificación de las especies coralinas que forman los rodolitos se realizó de acuerdo con Woelkerling y Harvey (1993), Wilks y Woelkerling (1995), Harvey et al. (2003, 2006), Harvey y Woelkerling (2007) y Villas–Boas et al. (2009). Los especimenes conservados en formol fueron descalcificados en ácido nitrico al 10% y luego sumergidos sucesivamente en soluciones de etanol al 70%, 90% y 100% durante un minimo de 30 min en cada una. Posteriormente se sumergieron en medio de filtración Leica Historesin (Leica Microsystems, Wetzlar, Alemania) y una vez completamente infiltrados, se agregó una solución endurecedora (Leica Historesin Hardner). Todos los especimenes se seccionaron (12–15 nm de espesor) con un microtomo Bright 5030 (Bright Instrument Co. Ltd., Inglaterra). Cada sección se retiró de la cuchilla del microtomo usando un cepillo de pelo de sable fino, se transfirió a un portaobjetos cubierto con agua destilada y se colocó sobre un plato caliente hasta secarse. Los portaobjetos se tiñieron con azul de toluidina al 1%.
Para las otras especies de algas, los portaobjetos se prepararon montando secciones cortadas a mano con hojas de afeitar de un solo filo o, en el caso de las especies gelatinosas, fragmentos seleccionados. Estas preparaciones fueron teñidas con una solución de anilina azul al 1% más HCl 1N. Se depositaron especimenes de referencia de todas las algas en los herbarios del Instituto Botánico de Sao Paulo (SP) y del Jardin Botánico de Rio de Janeiro (RB), Brasil. La clasificación de los nombres de las macroalgas sigue a Wynne (2005) y Schneider y Wynne (2007). Los aspectos cualitativos de la flora asociada con el manto rodolitico se determinaron mediante los indices de riqueza y Serensen entre las profundidades y entre las estaciones del año. Se compararon las densidades y las dimensiones de los rodolitos entre profundidades y estaciones (después de evaluar la homogeneidad de varianzas, prueba de Cochran) mediante un análisis de varianza (ANOVA) de dos vias, realizándose la prueba post hoc de Tukey cuando era necesario (Zar 1999).
Para determinar los aspectos cuantitativos de las algas asociadas a los mantos de rodolitos, se utilizó un ANOVA de dos vias para evaluar las variaciones de biomasa entre profundidades y entre estaciones. El peso seco se transformó en arcoseno √X. Se realizó una prueba post hoc de Tukey para comparaciones múltiples de medias (Zar 1999). La técnica de escalamiento multidimensional (MDS) se utilizó para resumir las similitudes (Bray–Curtis) entre profundidades y estaciones, realizándose un análisis de similitud (ANOSIM) de dos vias para evaluar las diferencias significativas entre ellas (Clarke y Warwick 1994). El análisis estadistico univariado se llevó a cabo usando la paqueteria Statistica (versión 6.0), mientras que para el análisis estadistico multivariado se utilizó la paqueteria Primer (versión 6.0).
RESULTADOS
Se encontraron un total de 167 especies, incluyendo algunos taxones infraespecificos y especies de algas coralinas formadoras de rodolitos (ver apéndice). De éstas, 126 pertenecen a la división Rhodophyta, 21 a Phaeophyceae y 20 a Chlorophyta. Tres especies de algas rojas resultaron ser nuevas adiciones a la flora marina de Brasil (Lithothamnion muelleri, Mesophyllum engelhartii y Scinaia aborealis). A continuación se presentan las descripciones taxonómicas y unos comentarios sobre estos nuevos registros.
Lithothamnion muelleri Lenormand ex Rosanoff
Planta de vida libre (fig. 3a) con forma de crecimiento incrustante, grumoso a fruticoso. Construcción interna monómera, filamentos adyacentes conectados por fusiones celulares, células epitaliales en forma de taza, células iniciales subepitaliales igual o más largas que la célula inmediatamente subyacente (fig. 3b, c). Conceptáculos tetrasporangiales multiporados, elevados en relación con la superficie del talo vegetativo circundante; cámaras de 150–190 µm de alto y 350–500 µm de diámetro (fig. 3d). Los techos de los conceptáculos formados por 5–6 capas de células. Los filamentos bordeando los conductos de los poros del conceptáculo tetrasporangial compuestos de células que no difieren en tamaño y forma de las células en otros filamentos del techo (fig. 3e). El poro del conceptáculo tetrasporangial, 13–14 µm de diámetro, rodeado de 6–7 células (fig. 3f). No se observaron muestras gametangiales.
Los caracteres vegetativos y reproductivos del material de Espirito Santo concuerdan con las descritas para L. muelleri por Wilks y Woelkerling (1995), excepto que en este último caso, en Australia la especie generalmente se encuentra fija y no en vida libre, mientras que los especimenes de Espirito Santo se encontraron en vida libre (rodolito). Esta caracteristica, sin embargo, concuerda con lo observado por Foster et al. (2007), quienes también encontraron L. muelleri en forma rodolitica.
Material examinado: Espirito Santo (GM Amado Filho, iii.2004, RB 502220; GM Amado Filho, viii.2004, RB 502221).
Mesophyllum engelhartii (Foslie) Adey
Plantas de vida libre (fig. 4a) con forma de crecimiento incrustante a verrucoso. Construcción interna monómera, filamentos adyacentes conectados por fusiones celulares, células epitaliales redondeadas o aplanadas pero no en forma de taza, células iniciales subepitaliales igual o más largas que la célula inmediatamente subyacente (fig. 4b). Conceptáculos tetrasporangiales multiporados, elevados en relación con la superficie del talo vegetativo circundante; cámaras de 130–200 µm de alto y 250–400 µm de diámetro; techos monticulados o aplanados formados por 5–7 capas de células (fig. 4c, d). Los conductos de los poros del conceptáculo tetrasporangial forrados por células de tamaño y forma similar que las otras células del techo (fig. 4d). No se encontró material gametangial.
Los caracteres encontrados para el material de Espirito Santo corresponden a M. engelhartii descrita por Woelkerling y Harvey (1993).
Material examinado: Espirito Santo (GM Amado Filho, iii.2004, RB 502255).
Scinaia aborealis Huisman
Plantas de 18 cm de alto. Talos con 5–10 ramificaciones dicótomas, con constricciones regulares a irregulares en la base de las ramas (fig. 5). Segmentos alargados, 8–10 mm de largo y 1–2 mm de ancho. Corteza compuesta casi en su totalidad de utriculos distalmente aplanados de tamaño relativamente uniforme, 25–30 de largo y 15–20 de diámetro. Células hipóginas con tres ramas estériles: una rama tricelular (normalmente con una célula lateral separada de su célula basal), una rama bicelular y una rama unicelular. Cistocarpos maduros de 90–150 µm de diámetro. No se observaron estructuras masculinas.

La morfologia vegetativa y los caracteres reproductivos del material de Espirito Santo concuerdan con los de S. aborealis de Sorrento, Australia occidental (Huisman 1986); sin embargo, nuestros especímenes difieren del material australiano ya que este último es monoico, mientras que sólo se encontraron plantas hembras en Espírito Santo.
Material examinado: Espírito Santo (GM Amado Filho, 18.ii.2004, RB 481804; GM Amado Filho, 09.xi.2004, RB 481809; GM Amado Filho, 03.iii.2004, RB 481810).
En cuanto a la flora algal asociada, la composición de especies mostró fuertes cambios estacionales. Se observaron solamente 38 especies durante todo el año y se encontraron 66 especies (39% del total) en una sola estación (apéndice).
La mayoría de las especies fueron anuales o efímeras, 131 fueron residentes en verano, mientras que en invierno, primavera y otoño se encontraron 89, 87 y 63 taxones, respectivamente. El índice de similutud de Serensen varió de 0.57 (invierno y primavera) a 0.67 (verano y otoño).
La distribución de especies también mostró un marcado patrón zonal, encontrándose sólo 24 especies en todas las profundidades de muestreo (apéndice). La mayor riqueza de especies se observó a los 6 m (123 especies) y 18 m (100 especies); estas dos profundidades también presentaron el mayor número de taxones exclusivos (6 m, 26 taxones; 18 m, 28 taxones). El mayor valor de Serensen fue 0.65 (entre 6 y 10 m) y el menor fue 0.41 (entre 4 y 18 m). Las clorofitas (Chlorophyta) se restringieron a profundidades específicas y ninguna se encontró en todas las profundidades muestreadas.
Se identificaron siete especies de algas coralinas no geniculadas como formadoras de rodolitos: dos de la familia Hapalidiaceae (Mesophyllum engelhartii y Lithothamnion muelleri) y cinco (observadas con mayor frecuencia, obs. pers.) de la familia Corallinaceae (Hydrolithon cf. onkodes, Lithophyllum corallinae, L. johansenii, L. stictaeforme y Neogoniolithon cf. brassica–florida).
La densidad de rodolitos varió de 12.4 a 162.5 ind m–2. El ANOVA de dos vías indicó que la densidad rodolítica fue significativamente diferente entre las profundidades de muestreo pero no entre las estaciones del año. Las profundidades de 4 m (verano = 20.5 ± 8.07 ind m–2, invierno = 42.5 ± 14.6 ind m–2) y 10 m (verano = 12.4 ± 3.3 ind m–2, invierno = 43.1 ± 14.1 ind m–2) presentaron cantidades significativamente menores de rodolitos por metro cuadrado que las observadas a 6 m (verano = 155.6 ± 53.1 ind m–2, invierno = 130.4 ± 56.2 ind m–2) y 18 m (verano = 162.5 ± 45 ind m–2, invierno = 148.1 ± 53 ind m–2) (P < 0.05, ANOVA seguido por la prueba de Tukey) (fig. 6a). No se encontraron diferencias en el diámetro de los rodolitos entre profundidades, los ejes más ancho, intermedio y más angosto variando en diámetro de 2.0 a 9.5 cm (media = 5.7), 2.0 a 8.0 cm (media = 4.2) y 1.5 a 7.0 cm (media = 3.4), respectivamente. La media de los tres ejes arrojó un diámetro rodolítico de 4.5 ± 1.3 cm para el área de estudio.

La biomasa media total (peso seco) de las macroalgas (excluyendo los rodolitos) osciló entre 1.88 g m–2 (menor) en invierno a 18 m de profundidad y 17.38 g m–2 (mayor) en verano a 4 m de profundidad. El ANOVA de dos vías mostró diferencias significativas tanto entre estaciones como entre profundidades. Las muestras recolectadas en verano presentaron una mayor biomasa que las de invierno y se observó una tendencia de mayor biomasa a 4 y 10 m (fig. 6b).
Según el MDS con base en el índice de similitud de Bray–Curtis, se pueden distinguir cinco grupos al nivel de similitud de 52%. Las unidades de muestras obtenidas a los 6, 10 y 18 m de profundidad durante el invierno constituyeron un grupo, mientras que las obtendidas en el verano constituyeron tres grupos distintos según la profundidad. Las muestras de 4 m de profundidad constituyeron un grupo distinto independientemente de la estación del año (fig. 7).

Las comunidades asociadas con los mantos rodolíticos fueron significativamente diferentes en cuanto a profundidad y estación del año (ANOSIM, R = 0.745, P < 0.01; R = 0.514, P < 0.01, respectivamente). Entre las profundidades, sólo a 4 m no se encontraron diferencias entre estaciones (R = 0.249, P > 0.05). El valor de tensión asociado con la gráfica final de MDS (0.19) indicó que la solución final resultó útil para explicar la relación entre estaciones y profundidades (Clarke y Warwick 1994).
Las especies que contribuyeron mayormente a la biomasa algal en cada profundidad de muestreo se muestran en la tabla 1. A 4 m, las algas pardas Sargassum spp., Zonaria tournefortii, Lobophora variegata y Stypopodium zonale presentaron los mayores porcentajes de importancia (Pi). La importancia de las algas rojas carnosas incrementó con la profundidad: Halymenia spp. (18.8% a 6 m), Solieria filiformis (31.3% a 6 m) y Aghardiella floridana (34.7% a 18 m) en verano; y Cryptonemia seminervis (19.4% a 6 m, 18.5% a 10 m), Peyssonnelia spp. (8.4% a 6 m, 6.4% a 10 m, 34.5% a18 m) y Plocamium brasiliense (15.2% a 6 m, 19.4% a 10 m, 20.9% a 18 m) en invierno. La alga coralina geniculada Jania adhaerens también alcanzó una importancia alta alrededor de 10 m de profundidad (19.7% en verano, 17.9% en invierno). Durante el verano, Dictyopteris jolyana mostró el valor más alto de Pi a 10 m (30.1%) y 18 m (40.9%). Durante el invierno, a 10 m el mayor valor de Pi correspondió a Zonaria tournefortii (20.5%), mientras que a 18 m el mayor valor correspondió a Peyssonnelia spp. (34.5%).
Las especies que mostraron diferencias significativas (ANOVA, P < 0.05) entre estaciones fueron Cryptonemia seminervis, Peyssonnelia spp., Plocamium brasiliense (mayor en invierno) y Amphiroa rigida (mayor en verano), mientras que las que presentaron diferencias significativas (P < 0.05) entre profundidades fueron Lobophora variegata, Sargassum hystrix, Stypopodium zonale (mayor a 4 m), Solieria filiformis (mayor a 6 m) y Jania adhaerens (mayor a 10 m) (fig. 8). Solamente Amphiroa beauvoisii, Dictyurus occidentalis y Dictyopteris jolyana mostraron diferencias tanto entre profundidades como estaciones.
DISCUSIÓN
Los nuevos registros encontrados en este estudio fueron Lithothamnion muelleri, Scinaia aborealis (citado por primera vez para el Océano Atlántico) y Mesophyllum engelhartii (citado por primera vez para el Océano Atlántico occidental), según Guiry y Guiry (2010). Lithothamnion muelleri ha sido citada previamente para el sur de Australia (Wilks y Woelkerling 1995), Korea (Lee y Kang 2001), el Golfo de California (Foster et al. 2007) y Chile (Ramírez y Santelices 1991). Scinaia aborealis ha sido registrada para Australia (Huisman 1986) y Fiji (South y Skelton 2003). Mesophyllum engelhartii ha sido registrada para Australia (Woelkerling y Harvey 1993), Nueva Zelanda (Harvey et al. 2005), Namibia (John et al. 2004) y Sudáfrica (Chamberlain y Keats 1995).
Los rodolitos de este estudio comprendieron siete especies coralinas crustosas pertenecientes a cinco géneros (Hydrolithon, Lithophyllum, Lithothamnion, Mesophyllum y Neogoniolithon), una alta riqueza de algas rojas coralinas en comparación con otros mantos rodolíticos tropicales y templados (e.g., Steller et al. 2003, Goldberg 2006, Konar et al. 2006, Harvey y Bird 2008, Peña y Bárbara 2008, Basso et al. 2009). Esta diversa comunidad de algas coralinas no geniculadas (ver Amado–Filho et al. 2007) es en gran parte responsable de la construcción de la estructura rodalítica y, por lo tanto, actúa como ingeniero de ecosistemas.
La flora algal local es predominantemente tropical con afinidades caribeñas. La división Rhodophyta presenta la mayor riqueza, siguiendo un patrón similar al observado en el Atlántico occidental subtropical y tropical (desde Carolina del Norte hasta Brasil) (Taylor 1960). No obstante, muchas especies de algas verdes de Bryopsidales y Cladophorales que son comunes en el Atlántico subtropical y tropical estuvieron ausentes en nuestros sitios de muestreo, encontrándose en las colecciones sólo unos cuantos especímenes pequeños y poco comunes (e.g., Caulerpa spp. y Cladophora spp.). Nuestros registros de las algas asociadas con los mantos de rodolitos en la parte sur del estado de Espírito Santo agregan 66 especies (55 Rhodophyta, 4 Ochrophyta y 7 Chlorophyta) a la lista presentada por Amado–Filho et al. (2007), incrementando el total a 190 especies conocidas en el área de estudio. Esto representa aproximadamente 25% de las especies de macroalgas registradas para toda la costa de Brasil (774 taxones, Fujii et al. 2008). Estos resultados apoyan la suposición de que los mantos de rodolitos contribuyen a la alta diversidad de algas marinas en el estado de Espírito Santo (Guimaraes 2003, 2006), así como la importancia del área de estudio para las iniciativas de conservación. En uno de los pocos estudios realizados sobre las comunidades bénticas asociadas con rodolitos en Brasil, Riul et al. (2009) identificaron 67 especies de algas en un manto rodolítico entre 10 y 20 m de profundidad en la costa nororiental.
Figueiredo et al. (2008) recientemente resumieron las algas marinas bénticas de arrecifes coralinos de Brasil, y la mayor riqueza registrada a la fecha es menor que la encontrada en el presente estudio, con la riqueza de especies oscilando entre 51 taxones en la Parque Marino Recife de Fora (estado de Bahía) y 122 taxones en el Parque Nacional Fernando de Noronha (estado de Pernambuco). Una característica importante de algunos arrecifes coralinos brasileños es que se componen principalmente de algas coralinas no geniculadas (Kikuchi y Leao 1997). Aunque la formación de rodolitos puede atribuirse a la erosión de arrecifes coralinos (Piller y Rasser 1996), la mayoría de las especies de algas rojas coralinas que se encuentran en los arrecifes coralinos de Brasil no son las mismas que se encontraron en el presente estudio. Además, los arrecifes coralinos y los mantos rodolíticos son estructuras distintas. Al igual que los arrecifes coralinos, los mantos de rodolitos tienen un hábitat y una diversidad de organismos asociados particular y, por lo tanto, también requieren de atención por parte de las autoridades para una estrategia adecuada de conservación.
Se observaron relativamente pocas especies (20 Rhodophyta, 4 Phaeophyceae) a lo largo del intervalo vertical de este estudio, entre ellas, Plocamium brasiliense, la fase esporofítica filamentosa de Asparagopsis taxiformis, Jania adhaerens como una epifita en la base de algas más grandes y pequeños manojos de Haliptilon subulatum. Éstas son especies cosmopolitas en aguas templadas a tropicales, ampliamente distribuidas en el trópico y subtrópico (Joly 1965, Taylor 1960, Huisman y Walker 1990). Otra especie común fue Periphykon delesserioides, la cual probablemente sea endémica de la región ya que no se ha registrado en otras partes desde que fue descrita por primera vez (Joly et al. 1967).
A 18 m de profundidad se presentó un cambio en la composición de especies, observándose una comunidad de algas rojas (Rhodophyta) gelatinosas, chicas a medianas, creciendo en las cavidades o grietas de los rodolitos. Éstas incluyeron Acrosymphyton caribaeum, Platoma sp., Predaea feldmannii y plantas muy pequeñas (<2 cm de largo) de Dudresnaya crassa y Naccaria corymbosa. Con excepción de P. feldmannii, todas las demás especies estuvieron representadas por pocos individuos. Se encontraron D. crassa y P. feldmannii en otros muestreos de verano, pero las otras especies se recolectaron en una sola muestra en noviembre de 2004. Según Guimaraes y Amado–Filho (2008), estas algas representan un elemento efímero primaveral y estival de las macroalgas asociadas con los mantos de rodolitos.
Las diferencias en la biomasa de algas entre las estaciones del año (fig. 6b) pueden explicarse por el alto grado de inestabilidad sobre los mantos rodolíticos relacionado con la frecuencia de los típicos disturbios de tormentas en la costa sudoriental de Brasil, los cuales son mayores en invierno que en verano (Niemer 1977, Vera et al. 2002). Debido a su forma esférica, los rodolitos son estructuras móviles capaces de rotar cuando el movimiento del agua es fuerte (Marrack 1999). Tal movimiento representa una forma de disturbio que puede dañar los invertebrados epibénticos así como arrancar las algas asociadas (Steneck 1986, Hinojosa–Arango et al. 2009), promoviendo así las condiciones para el establecimiento de nuevas especies efímeras y/o anuales.
La inestabilidad del sustrato puede explicar las diferencias detectadas por el análisis multivariado. En invierno, cuando la riqueza de especies y la biomasa decrecieron, las unidades de muestras recolectadas a 6, 10 y 18 m de profundidad se agruparon. En verano, cuando la riqueza de especies y la biomasa incrementaron, las unidades de muestras se agruparon de acuerdo con la profundidad. Las especies responsables de las diferencias entre profundidades en el verano fueron las algas carnosas que pueden desprenderse o romperse durante la rotación del rodolito (Dictyopteris jolyana, Solieria filiformis, Jania adhaerens y Amphiroa rigida; fig. 8). En invierno, sólo las especies con talos pequeños (Cryptonemia seminervis, Peyssonnelia spp. y Plocamium brasiliense; fig. 8) permanecen unidos a los rodolitos y, por lo tanto, no se oberva una zonación. El sitio de recolección a 4 m de profundidad se localiza en una zona más protegida de las tormentas invernales que los otros sitios. Esto podría explicar el hecho de que no se observaran diferencias entre las estaciones del año a 4 m, caracterizadas por la presencia y abundancia de Stypopodium zonale, Sargassum hystrix y Lobophora variegata (fig. 8).
Hinojosa–Arango y Riosmena–Rodríguez (2004) observaron que la densidad de rodolitos es un factor importante que contribuye a la abundancia de la fauna asociada, y sugirieron que la densidad rodolítica es mayor cuando el movimiento del agua es menor, proporcionando condiciones más estables para el establecimiento de la fauna invertebrada. En el presente estudio, sin embargo, se encontró que la biomasa de las algas carnosas asociadas fue mayor en las profundidades donde la densidad de rodolitos era menor, lo cual sugiere que hay otros factores ambientales que pueden ser más efectivos. En las dos profundidades donde la densidad rodolítica fue menor (4 y 10 m), el lecho marino consiste principalmente de un continuo sustrato duro de carbonato, mientras que en las dos profundidades donde la densidad rodolítica fue mayor (6 y 18 m), el sustrato está compuesto principalmente de grava (5 cm de diámetro). El sustrato duro continuo justo debajo de la capa de rodolitos probablemente proporcionó un sustrato más estable para la fijación de las algas carnosas. Littler y Littler (2008) arguyen que la inestablidad/movilidad de las esferas rodolíticas impide el desarrollo de las comunidades macroalgales o macrofaunales muy estructuradas. Por otro lado, los rodolitos proporcionan un refugio de sustrato duro tridimensional para las algas más pequeñas de la intensa herbivoría de lapas, quitones, erizos de mar y peces.
En conclusión, se ha demostrado que los mantos de rodolitos del estado de Espírito Santo son de los mantos más diversos que se han registrado (Bordehore et al. 2003, Peña y Bárbara 2008), manteniendo una comunidad abundante y diversa de macroalgas. Esta información permite formular recomendaciones mejor sustentadas para la conservación de estas regiones tan diversas.
AGRADECIMIENTOS
Este trabajo fue parcialmente apoyado por el Consejo para el Desarrollo Científico y Tecnológico de Brasil (CNPq), con becas a SMPBG y GMAF, así como por las fundaciones brasileñas FAPERJ y FAPESP. GWM agradece el apoyo brindado por la Universidad del Cabo Occidental y la Fundación Nacional para la Investigación de Sudáfrica. GHPF recibió una beca posdoctoral (PRODOC) de CAPES.
REFERENCIAS
Amado–Filho GM, Horta PA, Brasileiro PS, Barros–Barreto MB, Fujii MT. 2006. Subtidal benthic marine algae of the marine state park of Laje de Santos (São Paulo, Brazil). Braz. J. Oceanogr. 54: 225–234. [ Links ]
Amado–Filho GM, Maneveldt G, Manso RCC, Marins–Rosa BV, Pacheco MR, Guimaraes SMPB. 2007. Structure of rhodolith beds from 4 to 55 meters deep along the southern coast of Espírito Santo State, Brazil. Cienc. Mar. 33: 399–410. [ Links ]
Basso D. 1998. Deep rhodolith distribution in the Pontian Islands, Italy: A model for the paleoecology of a temperate sea. Palaeogeogr., Palaeoclimatol., Palaeoecol. 137: 172–187. [ Links ]
Basso D, Nalin R, Nelson CS. 2009. Shallow–water Sporolithon rhodoliths from North Island (New Zealand). Palaios 24: 92–103. [ Links ]
Boogert NJ, Paterson DM, Laland KN. 2006. The implications of niche construction and ecosystem engineering for conservation biology. Bioscience 56: 570–578. [ Links ]
Bordehore C, Ramos–Espala AA, Riosmena–Rodríguez R. 2003. Comparative study of two maerl beds with different otter trawling history, SE Iberian Peninsula. Aquat. Conserv.: Mar. Freshwat. Ecosyst. 13: S43–S54. [ Links ]
Brodie J, Andersen RA, Kawachi M, Millar AJK. 2009. Endangered algal species and how to protect them. Phycologia 48: 423–438. [ Links ]
Chamberlain YM, Keats DW. 1995. The melobesioid alga Mesophyllum engelhartii (Rhodophyta, Corallinaceae) in South Africa. S. Afr. J. Bot. 61: 134–146. [ Links ]
Christie H, Jorgensen NM, Norderhaug KM, Waage–Nielsen E. 2003. Species distribution and habitat exploitation of fauna associated with kelp (Laminaria hyperborea) along the Norwegian coast. J. Mar. Biol. Assoc. UK 83: 687–699. [ Links ]
Christie H, Jorgensen NM, Norderhaug KM. 2007. Bushy or smooth, high or low; importance of habitat architecture and vertical position for distribution of fauna on kelp. J. Sea Res. 58: 198–208. [ Links ]
Clarke KR, Warwick RM. 1994. Change in Marine Communities: An approach to statistical analysis and interpretation. Plymouth Marine Laboratory, Plymouth, 144 pp. [ Links ]
Crain CM, Bertness MD. 2006. Ecosystem engineering across environmental gradients: Implication for conservation and management. Bioscience 56: 211–218. [ Links ]
Crowder LB, Lyman SJ, Figueira WF, Priddy J. 2000. Source–sink population dynamics and the problem of sitting marine reserves. Bull. Mar. Sci. 66: 799–820. [ Links ]
Figueiredo MAO, Horta PA, Pedrini AG, Nunes JMC. 2008. Benthic marine algae of the coral reefs of Brazil: A literature review. Oecol. Bras. 12: 258–269. [ Links ]
Foster MS. 2001. Mini–review: Rhodoliths, between rocks and soft places. J. Phycol. 37: 659–657. [ Links ]
Foster MS, McConnico LM, Lundsten L, Wadsworth T, Kimball T, Brooks LB, Medina–López M, Riosmena–Rodríguez R, Hernández–Carmona G, Vásquez–Elizondo RM, Johnson D, Steller DS. 2007. Diversity and natural history of a Lithothamnion muelleri–Sargassum horridum community in the Gulf of California. Cienc. Mar. 33: 367–384. [ Links ]
Fujii MT, Barata D, Chiracava S, Guimaraes SMPB. 2008. Cenário Brasileiro da diversidade de algas marinhas bentônicas e sua contribuição para a política de conservação dos recursos naturais e do meio ambiente. In: Loiola MIB, Baseia IG, Lichston JE (eds.), Atualidades, Desafios e Perspectivas da Botânica no Brasil. Sociedade Botânica do Brasil, 59°. Congresso Nacional de Botânica, Natal, pp. 375–377. [ Links ]
Giller PS. 1996. Floods and droughts: The effects of variation in water flow on streams and rivers. In: Giller P, Myers A (eds.), Disturbance and Recovery of Ecological Systems. Royal Irish Academy Seminar Series, Dublin, pp. 1–19. [ Links ]
Goldberg N. 2006. Age estimates and description of rhodoliths from Esperança Bay, western Australia. J. Mar. Biol. Assoc. UK 86: 1291–1296. [ Links ]
Guimarães SMPB. 2003 Uma análise da diversidade da flora marinha bentónica do estado do Espírito Santo, Brasil. Hoehnea 30: 11–19. [ Links ]
Guimarães SMPB. 2006. A revised checklist of benthic marine Rhodophyta from the State of Espírito Santo, Brazil. Bol. Inst. Bot. 17: 143–194. [ Links ]
Guimarães SMPB, Amado–Filho GM. 2008. Deep–water gelatinous rhodophytes from southern Espírito Santo State, Brazil. Bot. Mar. 51: 378–387. [ Links ]
Guiry MD, Guiry GM. 2010. AlgaeBase. World–wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; searched on 02 January 2010. [ Links ]
Harris PT, Tsuji Y, Marshall JF, Davies PJ, Honda N, Matsuda H. 1996. Sand and rhodolith–gravel entrainment on the mid– to outer–shelf under a western boundary current: Fraser Island continental shelf, eastern Australia. Mar. Geol. 129: 313–330. [ Links ]
Harvey AS, Woelkering WJ. 2007. A guide to nongeniculate coralline red algal (Coralline, Rhodophyta) rhodolith identification. Cienc. Mar. 33 : 411–426. [ Links ]
Harvey AS, Bird FL. 2008. Community structure of a rhodolith bed from cold–temperate waters (southern Australia). Aust. J. Bot. 56: 437–450. [ Links ]
Harvey AS, Woelkerling WJ, Millar AJK. 2003. An account of the Hapalidiaceae (Corallinales, Rhodophyta) in southeastern Australia. Aust. Syst. Bot. 16: 647–698. [ Links ]
Harvey AS, Woelkerling WJ, Farr TJ, Neill KF, Nelson WA. 2005. Coralline algae of central New Zealand: An identification guide to common "crustose" species. NIWA Info. Ser. No. 57, Wellington, New Zealand, 145 pp. [ Links ]
Harvey AS, Phillips LE, Woelkerling WJ, Millar AJK. 2006. The Corallinaceae, subfamily Mastophoroideae (Corallinales, Rhodophyta) in southeastern Australia. Aust. Syst. Bot. 19: 387–429. [ Links ]
Hinojosa–Arango G, Riosmena–Rodríguez R. 2004. Influence of rhodolith–forming species and growth–form on associated fauna of rhodolith beds in the central–west Gulf of California, Mexico. PSZN Mar. Ecol. 25: 109–127. [ Links ]
Hinojosa–Arango G, Maggs CA, Mark PJ. 2009. Like a rolling stone: The mobility of maerl (Corallinaceae) and the neutrality of the associated assemblages. Ecology 90: 517–528. [ Links ]
Horta PA, Amâncio CE, Coimbra CS, Oliveira EC. 2001. Considerações sobre a distribuição e origem da flora de macroalgas marinhas brasileiras. Hoehnea 28: 243–265. [ Links ]
Huisman JM. 1986. The red algal genus Scinaia (Galaxauraceae, Nemaliales) from Australia. Phycologia 25: 271–296. [ Links ]
Huisman JM, Walker DI. 1990. A catalogue of the marine plants of Rottnest Island, western Australia, with notes on their distribution and biogeography. Kingia 1: 349–459. [ Links ]
John DM, Prud'homme van Reine WF, Lawson GW, Kostermans TB, Price JH. 2004. A taxonomic and geographical catalogue of the seaweeds of the western coast of Africa and adjacent islands. Nova Hedwigia Beih. 127: 1–339. [ Links ]
Joly AB. 1965. Flora marinha do litoral norte do Estado de São Paulo e regiões circunvizinhas. Bol. Fac. Fil. Ciênc. Letras USP, 21: 1–393. [ Links ]
Joly AB, Ugadim Y, Oliveira EC. 1967. The structure and reproduction of Periphykon delesserioides a new member of the Rhodomelaceae. Sellowia 19: 71–78. [ Links ]
Kamenos NA, Moore PG, Hall–Spencer JM. 2003. Substratum heterogeneity of dredged vs un–dredged maerl grounds. J. Mar. Biol. Assoc. UK 83: 411–413. [ Links ]
Kelaher BP. 2002. Influence of physical characteristics of coralline turf on associated macrofaunal assemblages. Mar. Ecol. Prog. Ser. 232: 141–148. [ Links ]
Kelaher BP, Castilla JC, Seed R. 2004. Intercontinental test of generality for spatial patterns among diverse molluscan assemblages in coralline algal turf. Mar. Ecol. Prog. Ser. 271: 221–231. [ Links ]
Kikuchi RKP, Leão ZMAN. 1997. Rocas (southwestern equatorial Atlantic, Brazil): An atoll built primarily by coralline algae. Proc. 8th International Coral Reef Symposium, pp. 731–736. [ Links ]
Konar B, Riosmena–Rodríguez R, Iken K. 2006. Rhodolith bed: A newly discovered habitat in the North Pacific Ocean. Bot. Mar. 49: 355–359. [ Links ]
Lake PS. 2000. Disturbance, patchiness, and diversity in streams. J. N. Am. Benthol. Soc. 19: 573–592. [ Links ]
Lee Y, Kang S. 2001. A Catalogue of the Seaweeds in Korea. Jeju University Press, Jeju, Korea, 662 pp. [ Links ]
Littler MM, Littler DS. 2008. Coralline algal rhodoliths form extensive benthic communities in the Gulf of Chiriqui, Pacific Panama. Coral Reefs 27: 553. [ Links ]
Liuzzi MG, Gappa JL. 2008. Macrofaunal assemblages associated with coralline turf: Species turnover and changes in structure at different spatial scales. Mar. Ecol. Prog. Ser. 363: 147–156. [ Links ]
Marrack EC. 1999. The relationship between water motion and living rhodolith beds in the southwestern Gulf of California, Mexico. Palaios 14: 159–171. [ Links ]
Niemer E. 1977. Climatologia da região sudeste do Brasil. Rev. Bras. Geogr. 34: 3–48. [ Links ]
Norderhaug KM, Christie H, Rinde E. 2002. Colonisation of kelp imitations by epiphyte and holdfast fauna; a study of mobility patterns. Mar. Biol. 141: 965–973. [ Links ]
Peña V, Bárbara I. 2008. Maërl community in the northwestern Iberian Peninsula: A review of floristic studies and long–term changes. Aquat. Conserv.: Mar. Freshwat. Ecosyst. 18: 339–366. [ Links ]
Piller WE, Rasser M. 1996. Rhodolith formation induced by reef erosion in the Red Sea, Egypt. Coral Reefs 15: 191–198. [ Links ]
Poff NL. 1992. Why disturbances can be predictable: A perspective on the definition of disturbance in streams. J. N. Am. Benthol. Soc. 11: 86–92. [ Links ]
Ramírez ME, Santelices B. 1991. Catálogo de las algas marinas bentónicas de la costa temperada del Pacífico de Sudamérica. Monogr. Biol. 5: 1–437. [ Links ]
Riul P, Lacouth P, Pagliosa PR,Christoffersen ML, Horta PA. 2009. Rhodolith beds at the easternmost extreme of South America: Community structure of an endangered environment. Aquat. Bot. 90: 315–320. [ Links ]
Schneider CW, Wynne MJ. 2007. A synoptic review of the classification of red algal genera a half century after Kylin's ''Die Gattungen der Rhodophyceen''. Bot. Mar. 50: 197–249. [ Links ]
Silveira ICA, Schmidt ACK, Campos EJD, Godoi SS, Ikeda Y. 2000. A corrente do Brasil ao largo da costa leste brasileira. Rev. Bras. Oceanogr. 48: 171–183. [ Links ]
South GR, Skelton PA. 2003. Catalogue of the marine benthic macroalgae of the Fiji Islands, South Pacific. Aust. Syst. Bot. 16: 699–758. [ Links ]
Steller DL, Foster MS. 1995. Environmental factors influencing distribution and morphology of rhodoliths in Bahía Concepción, BCS, Mexico. J. Exp. Mar. Biol. Ecol. 194: 201–212. [ Links ]
Steller DL, Riosmena–Rodríguez R, Foster MS, Roberts C. 2003. Rhodolith bed diversity in the Gulf of California: The importance of rhodolith structure and consequences of anthropogenic disturbances. Aquat. Conserv.: Mar. Freshwat. Ecosyst. 13: S5–S20. [ Links ]
Steller DL, Hernández–Ayón M, Riosmena–Rodríguez R, Cabello–Pasini A. 2007. Effect of temperature on photosynthesis, growth and calcification rates of the free–living coralline alga Lithophyllum margaritae. Cienc. Mar. 33: 441–456. [ Links ]
Steneck RS. 1986. The ecology of coralline algal crusts: Convergent patterns and adaptive strategies. Ann. Rev. Ecol. Syst. 17: 273–303. [ Links ]
Taylor WR. 1960. Marine Algae of the Eastern Tropical and Subtropical Coasts of the Americas. University of Michigan Press, Ann Arbor, pp. 870. [ Links ]
Van der Maarel E. 1993. Some remarks on disturbance and its relations to diversity and stability. J. Veg. Sci. 4: 733–736. [ Links ]
Vera CS, Vigliarolo PK, Berbery EH. 2002. Cold season synoptic–scale waves over subtropical South America. Mon. Weather Rev. 130: 684–699. [ Links ]
Villas–Boas AB, Riosmena–Rodríguez R, Amado–Filho GM, Maneveldt GW, Figueiredo MAO. 2009. Taxonomy of rhodolith–forming species of Lithophyllum (Corallinales; Rhodophyta) from Espírito Santo State, Brazil. Phycologia 48: 237–248. [ Links ]
Wilks KM, Woelkerling WJ. 1995. An account of southern Australian species of Lithothamnion (Corallinaceae, Rhodophyta). Aust. Syst. Bot. 8: 549–583. [ Links ]
Woelkerling WJ, Harvey A. 1993. An account of southern Australian species of Mesophyllum (Corallinaceae. Rhodophyta). Aust . Syst . Bot. 6: 571–637. [ Links ]
Wynne MJ. 2005. A checklist of benthic marine algae of tropical and subtropical western Atlantic. 2nd revision. Nova Hedwigia 129: 1–151. [ Links ]
Zar JH. 1999. Biostatistical Analysis. 4th ed. Prentice–Hall, New Jersey, pp. 718. [ Links ]
* Traducido al español por Christine Harris.
** Descargar versión bilingüe (Inglés–Español) en formato PDF .














