Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.36 no.4 Ensenada dic. 2010
Artículos
Talla de madurez y relación peso–talla del tiburón de profundidad Etmopterus bigelowi (Squaliformes: Etmopteridae) capturado en el sudeste de Brasil*
Size at maturity and length–weight relationships of the blurred lantern shark Etmopterus bigelowi (Squaliformes: Etmopteridae) caught off southeastern Brazil**
BL Mourato1, 2, R Coelho3, 4, AF Amorim5, FC Carvalho3, FHV Hazin1, G Burgess3
1 Universidade Federal Rural de Pernambuco, Departamento de Pesca e Aquicultura, Rua Dom Manoel de Medeiros s/n, Dois Irmãos, 52171–900, Recife, PE, Brasil.
2 Universidade Federal de Pernambuco, Departamento de Oceanografia, Cidade Universitária, 50670–901, Recife, PE, Brasil. E–mail: bruno.pesca@gmail.com
3 Florida Program for Shark Research, Florida Museum of Natural History, University of Florida, Dickinson Hall, Museum Road, PO Box 117800, Gainesville, FL 32611, USA.
4 Centre of Marine Sciences, University of Algarve, Campus de Gambelas, 8005–139 Faro, Portugal.
5 Instituto de Pesca, Av. Bartolomeu Gusmão 192, Ponta da Praia, Santos, São Paulo 11030–906, Brasil.
Received March 2010
Accepted August 2010
RESUMEN
El tiburón de profundidad Etmopterus bigelowi se distribuye globalmente en aguas templadas y tropicales; sin embargo, hay poca información disponible sobre su biología ya que raramente se captura y existe confusión taxonómica con su especie hermana Etmopterus pusillus. Los ejemplares utilizados en este trabajo se obtuvieron de julio a diciembre de 2004 como captura incidental de la pesca comercial de arrastre de aguas profundas dirigida al camarón rojo Aristaeomorpha foliacea en el Atlántico sudoccidental. Se examinaron 55 ejemplares (22 machos y 33 hembras) de 31.5 a 73 cm de longitud total (LT) y de 103 a 1600 g de peso total. Se analizó la relación peso–talla para ambos sexos, observándose diferencias significativas en las pendientes de las regresiones, tanto de hembras como de machos. La talla de madurez para cada sexo se evaluó ajustando una regresión logística. La talla de primera madurez de las hembras (56.0 cm LT) fue mayor que la de los machos (45. 1 cm LT). El presente trabajo aporta información preliminar esencial sobre E. bigelowi que puede ser incorporada en modelos de evaluación de riesgo y evaluación de la población, cruciales para prácticas de gestión dirigidas a evitar la sobreexplotación de estos vulnerables tiburones de aguas profundas.
Palabras clave: Etmopterus bigelowi, tiburones de aguas profundas, talla de madurez, relación peso–talla, Atlántico sudoccidental.
ABSTRACT
The blurred lantern shark Etmopterus bigelowi, a deep–water squaloid shark, is globally widespread in temperate and tropical waters, but there is little available information about its biology owing to its relative rarity of capture and taxonomic confusion with its sibling species Etmopterus pusillus. Specimens used in this study were collected from July to December 2004 as by–catch in the commercial deep–water trawl fishery targeting red shrimp Aristaeomorpha foliácea in the southwestern Atlantic. We examined 55 specimens (22 males and 33 females) ranging in total length (TL) from 31.5 to 73 cm and in total weight from 103 to 1600 g. Length–weight relationships were explored for each sex and significant differences were found in the slope coefficients of the male and female regressions. The size at maturity for each sex was evaluated fitting a logistic regression. Females matured at larger sizes than males, with estimated sizes at first maturity of 56.0 cm TL for females and 45.1 cm TL for males. The present study provides important preliminary information about E. bigelowi that can be incorporated in risk assessment and stock assessment models, essential for efficient management practices aimed at avoiding overexploitation of these vulnerable deep–sea sharks.
Key words: Etmopterus bigelowi, deep–sea sharks, size at maturity, length–weight relationship, southwest Atlantic Ocean.
INTRODUCCIÓN
La familia Etmopteridae es la familia más grande de tiburones escuálidos, con más de 50 especies distribuidos en cinco géneros. El género Etmopterus es el género más diverso de esta familia, con al menos 31 especies descritas (Compagno et al. 2005) y varias otras formas no descritas. El tiburón de profundidad, Etmopterus bigelowi Shirai y Tachikawa 1993, es un tiburón de tamaño pequeño y de amplia distribución mundial, encontrándose en aguas templadas y tropicales. Es una especie bentopelágica de aguas profundas que ha sido capturada principalmente a profundidades de 160 m a mayores que 1000 m sobre plataformas continentales e insulares, taludes y cordilleras submarinas; sin embargo, también se ha observado en la zona epipelágica, cerca de la superficie de aguas profundas del mar abierto.
En el Océano Atlántico occidental, E. bigelowi se distribuye desde el Golfo de México hasta el sur de Brasil y Argentina (Shirai y Tachikawa 1993, Soto 2000) y en el Atlántico oriental, desde África central hasta Sudáfrica (Compagno et al. 2005). En la región del Indo–Pacífico, se encuentra en aguas de Sudáfrica (Compagno et al. 2005), Australia (Shirai y Tachikawa 1993), Taiwán (aunque los registros de aquí podrían referirse a una especie relacionada no descrita, D Ebert com. pers.), y del Pacífico norcentral y suroriental (Compagno et al. 2005). La descripción de E. bigelowi por Shirai y Tachikawa (1993) pone en duda varios registros nominales previos de Etmopterus pusillus Lowe 1839, que anteriormente se designaba a todos los Etmopterus de dientes dérmicos cóncavos. Por ejemplo, los registros iniciales de Krefft (1968) de E. pusillus de aguas brasileñas y uruguayas han sido referidas a E. bigelowi (Shirai y Tachikawa 1993), aunque también se ha registrado E. pusillus en aguas brasileñas, al igual que sus congéneres Etmopterus gracilispinis Krefft 1968 (Sadowsky et al. 1986), Etmopterus granulosus Gunther 1880 (Soto 2001) y Etmopterus lucifer Jordan y Snyder 1902 (Krefft 1968). Éstos y otros estudios (Bernardes et al. 2005, Gianetti 2005, Gianetti y Vooren 2008) sobre Etmopterus en aguas de Brasil se restringen principalmente a registros distribucionales y descripciones morfológicas.
Hay poca información biológica disponible de tiburones de aguas profundas (Kyne y Simpfendorfer 2007). Aunque unos cuantos trabajos han abordado la biología de otras especies de Etmopterus en el Atlántico Norte (e.g., Jakobsdottir 2001; Coelho y Erzini 2005, 2007, 2008a; Neiva et al. 2006), actualmente se sabe muy poco de la biología de E. bigelowi de cualquier parte del mundo. Se conoce que los tiburones escuálidos, por sus características de historia de vida, son particularmente susceptibles a la mortalidad por pesca (Kyne y Simpfendorfer 2007, Coelho y Erzini 2008b) y, por lo tanto, es de suma importancia mejorar el conocimiento actual de la biología e historia de vida de estos tiburones vulnerables.
El presente estudio representa la primera contribución sobre la biología de E. bigelowi en el Océano Atlántico sudoccidental, incluyendo estimaciones de la talla de primera madurez y la relación peso–talla, los cuales son importantes parámetros de historia de vida. Los resultados se podrán incorporar en modelos de evaluación de riesgo y dinámica poblacional para poder determinar el estatus, la vulnerabilidad y las tendencias de la especie en la región.
MATERIALES Y MÉTODOS
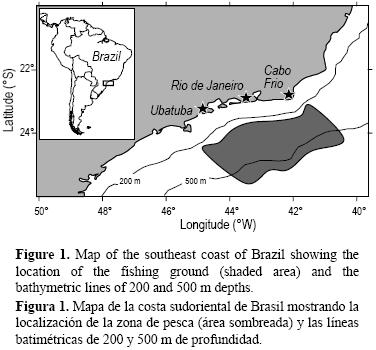
Se capturaron especímenes de E. bigelowi entre julio y diciembre de 2004 como captura incidental de la pesca comercial de arrastre de fondo dirigida al camarón rojo Aristaeomorpha foliacea Risso 1827. Los barcos de arrastre comercial operaron en los fondos arenosos de las costas de los estados de Río de Janeiro (ciudad de Cabo Frío) y Sao Paulo (ciudad de Ubatuba) a profundidades de 245 a 745 m (fig. 1). La captura incidental de la fauna demersal que carece de valor comercial, incluyendo E. bigelowi, generalmente se descarta. Se transportaron los especímenes de E. bigelowi al laboratorio donde se les midió la longitud total (LT, al milímetro más cercano), en línea recta desde la punta del hocico hasta la punta de la aleta caudal en su posición natural, así como el peso total (PT, al gramo más cercano). Además, se utilizó un vernier electrónico para medir la longitud interior del clasper (desde el inicio del clasper hasta la punta distal) en machos, y el ancho de la glándula oviductal y el diámetro de los ovocitos (al 0.01 mm más cercano) en hembras.
Posteriormente se definieron los estados de madurez para machos y hembras con base en observaciones macroscópicas del crecimiento relativo de los órganos reproductivos. Los especímenes fueron clasificados como maduros (adultos) o inmaduros (jóvenes) de acuerdo con los estados de madurez propuestos por Coelho y Erzini (2007). Se estimó la longitud a la cual 50% de los individuos alcanzan la madurez sexual (L50) mediante un modelo logístico (King 1995), usando el procedimiento no lineal de mínimos cuadrados, descrito como:
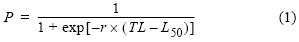
donde P es la proporción de individuos maduros dentro de la clase de talla (intervalos de 5 cm de longitud), r es la pendiente de la curva que describe la tasa de cambio en P de 0 a 1, y L50 es la LT a la cual 50% de los especímenes se encuentran sexualmente maduros. Este modelo logístico se ajustó a machos y hembras por separado y se utilizó la prueba de razón de verosimilitud (Kimura 1980) para determinar las diferencias entre sexos.
Se ajustaron regresiones no lineales entre peso y longitud para ambos sexos separadamente. Se realizó un análisis de covarianza (ANCOVA) de los datos transformados logarítmicamente para comparar estas regresiones entre machos y hembras. Asimismo, el coeficiente de determinación (r2) se calculó y presentó para cada regresión.
RESULTADOS
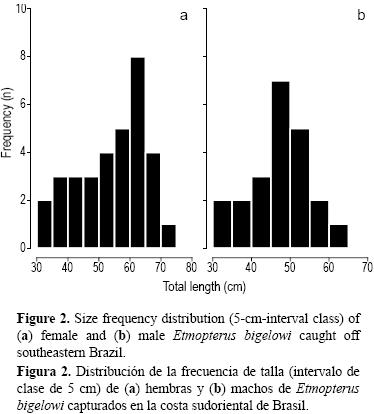
Se examinaron 55 especímenes (22 machos y 33 hembras). La LT de las hembras varió de 33 a 73 cm (media = 54.6 cm, DE = 11.2 cm) y la de los machos de 31.5 a 61.6 cm (media = 47.3 cm, DE = 7.5 cm) (fig. 2). El PT de las hembras varió de 1140 a 1600 g (media = 711.1 g, DE = 451.3 g) y el de los machos de 103 a 726 g (media = 368.3 g, DE = 171 g).
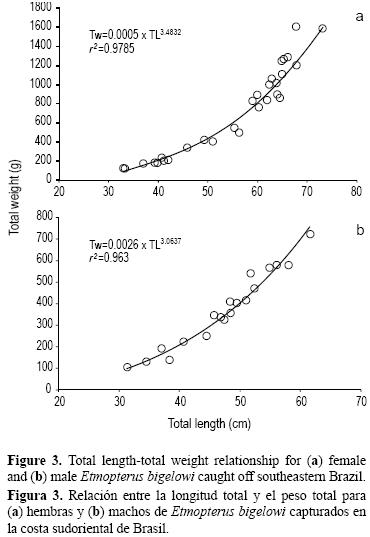
La relación peso–talla desarrollada para cada sexo mostró diferencias significativas en los coeficientes de las regresiones lineales de los datos de LT–PT transformados logarítmicamente para machos (LnPT = 3.0637 LnLT – 5.9910, r2 = 0.963) y hembras (LnPT = 3.4832 LnLT – 7.5566, r2 = 0.9785) (ANCOVA: F = 0.88; P < 0.05). Por tanto, se calcularon dos regresiones por separado: PT = 0.0026 × LT3.0637 (r2 = 0.963) para machos y PT = 0.0005 × LT3.4832 (r2 = 0.9785) para hembras (fig. 3).
Durante la disección, aproximadamente la mitad (16) de las hembras se clasificaron como adultas y la mitad (17) como jóvenes. El peso de los ovarios de las hembras adultas osciló entre 6 y 277 g, mientras que el de los ovarios traslúcidos, no desarrollados de las hembras jóvenes osciló entre 0.1 y 3 g (fig. 4a). El ancho de las glándulas oviductales varió de 3.6 a 11 mm en hembras adultas y de 1 a 3.6 mm en jóvenes; en estas últimas se observaron no desarrolladas, resultando difícil distinguirlas de los úteros (fig. 4b). El diámetro del folículo ovárico de mayor tamaño varió de 3.8 a 29 mm en hembras adultas, mientras que en hembras jóvenes los folículos ováricos aún no desarrollados fueron delgados y ligeros, y variaron en diámetro de 0.8 a 3.9 mm (fig. 4c).
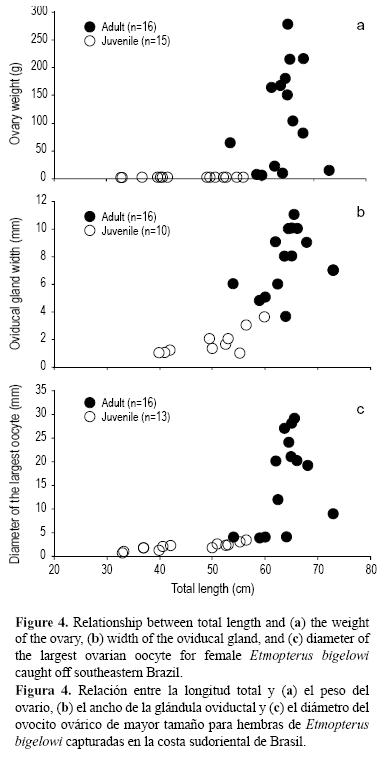
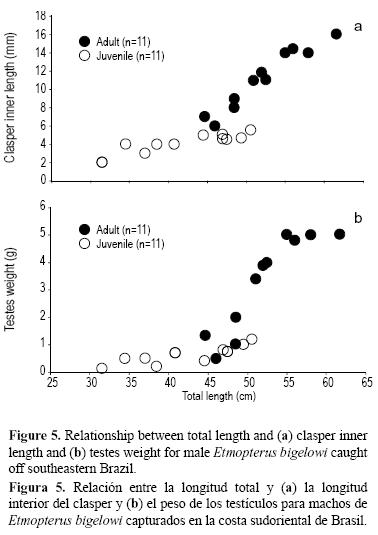
De forma similar, la mitad (11) de los machos se clasificaron como adultos y la mitad (11) como jóvenes. En los adultos, la longitud del clasper varió de 6 a 16 mm y el peso de los testículos de 0.5 a 5 g (fig. 5). En los jóvenes, la longitud del clasper varió de 2 a 5.5 mm y el peso de los testículos no desarrollados fue de 0.1 a 1.2 g (fig. 5).
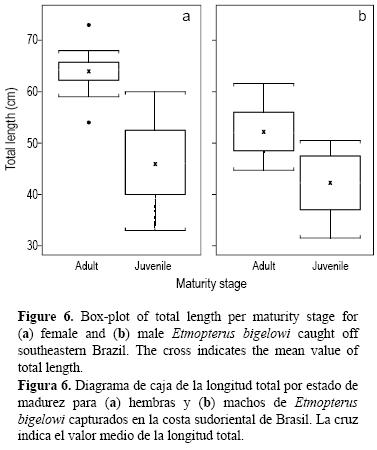
La hembra inmadura de mayor tamaño midió 60 cm LT y la hembra madura de menor tamaño, 54 cm LT (fig. 6). El macho inmaduro de mayor tamaño midió 50.5 cm LT y el macho maduro de menor tamaño, 44.7 cm LT (fig. 6). La LT promedio de hembras adultas fue de 63.9 cm (DE = 4.24, n =16) y la de machos adultos de 52.1 cm (DE = 5.17, n =11) (fig. 6).
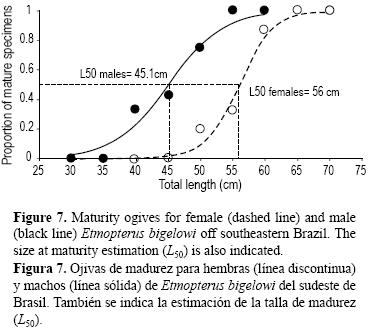
Las hembras maduraron a tallas mayores que los machos, la talla de primera madurez siendo 56 cm LT para las hembras (DE = 0.47) y 45.1 cm LT para los machos (DE = 0.85) (fig. 7); sin embargo, resultó interesante observar que ambos sexos maduraban a tallas proporcionalmente similares en relación con la longitud máxima observada. Específicamente, las hembras maduraron a 76.7% y los machos a 73.2% de las LTs observadas. Se encontraron diferencias significativas en cuanto a la talla de madurez entre ambos sexos (prueba de razón de verosimilitud: χ2 = 36.39; P < 0.05). Para ambos sexos, los modelos logísticos proporcionaron buenos ajustes a los datos observados con valores altos de r2: 0.987 para hembras y 0.972 para machos.
DISCUSIÓN
Krefft (1968) observó E. pusillus (posiblemente identificaciones erróneas de E. bigelowi según Shirai y Tachikawa 1993) en aguas del Atlántico sudoccidental, y registró una LT de 16.9 a 66.6 cm para machos y de 19.4 a 64.6 cm para hembras. Más recientemente, Gianetti y Vooren (2008) analizaron 88 especímenes de E. bigelowi capturados en aguas del sur de Brasil, con una LT de 7.4 a 66.6 cm. Según Compagno et al. (2005), las hembras de E. bigelowi pueden alcanzar tallas mayores que 67 cm LT; en el presente estudio, la hembra de mayor tamaño fue de 73 cm LT. En nuestra muestra, las hembras alcanzaron mayores tallas que los machos, un patrón de dimorfismo sexual que parece ser común en tiburones escuálidos (e.g., Yano y Tanaka 1988, Coelho y Erzini 2008a).
Desafortunadamente, en este estudio no se encontraron neonatos, el espécimen más pequeño siendo un macho de 31.5 cm LT. Esto se podría atribuir a que la mayoría de las muestras se obtuvieron de arrastres realizados a profundidades de 500 a 600 m y sólo unos cuantos se realizaron en zonas más someras del talud continental superior. Varios trabajos han mostrado que las especies del orden Squaliformes habitan diferentes niveles de profundidad según su desarrollo ontogenético (Yano y Tanaka 1988, Yano 1991, Wetherbee 1996, Jakobsdottir 2001, Coelho y Erzini 2010), con las zonas de crianza de algunas especies localizadas ya sea en aguas más profundas (e.g., Yano y Tanaka 1988, Girard y DuBuit 1999) o más someras (e.g., Coelho y Erzini 2010) que las frecuentadas por adultos. A pesar de que en el presente trabajo no se obtuvieron suficientes muestras para determinar si los jóvenes de E. bigelowi se encontraban en aguas más profundas o someras, se puede hipotetizar que, al igual que otros tiburones escuálidos, E. bigelowi muestra una segregación de la población relacionada con la profundidad en cuanto a su ciclo de reproducción y crecimiento.
Se encontró que los machos pesaron significativamente menos que las hembras de la misma talla, probablemente debido a los mayores requerimientos de biomasa para el proceso reproductivo de las hembras (gónadas, úteros y embriones) y, posiblemente, a un incremento en el peso del hígado en adultos como almacenamiento energético para la reproducción. Gianetti (2005), sin embargo, no observó diferencias entre sexos en las relaciones peso–talla de E. bigelowi en aguas del sur de Brasil y proporcionó una sola relación para machos y hembras. Una posible razón para esta discrepancia puede ser las diferencias en los intervalos de talla analizados en cada estudio, ya que la mayoría de los especímenes examinados por Gianetti (2005) fueron jóvenes mientras que en el presente estudio se analizó una mayor proporción de especímenes adultos y de mayor tamaño.
La talla de primera madurez de E. bigelowi en aguas sudorientales de Brasil se estimó en 56.0 cm para hembras y 45.1 cm para machos con base en las ojivas de madurez. Estos valores fueron corroborados con observaciones macroscópicas del desarrollo de los órganos reproductivos, tal como el aumento rápido del peso ovárico y el diámetro de los ovocitos en hembras mayores que 60 cm LT, y el crecimiento relativo de los claspers y el agrandamiento de los testículos en machos mayores que 45 cm LT. Se encontraron diferencias significativas entre sexos y este tipo de dimorfismo sexual en cuanto a la talla de madurez es común en peces elasmobranquios, con las hembras generalmente madurando después y a tallas mayores que los machos (Springer y Gold 1989). Esto ya ha sido descrito para otras especies del género Etmopterus, tal como E. princeps (Jakobsdottir 2001), E. baxteri (Irvine et al. 2006), y E. spinax y E. pusillus (Coelho y Erzini 2005). Aun así, fue interesante notar que a pesar de que la talla de madurez fue significativamente diferente entre machos y hembras, ambos sexos maduraron a alrededor de 75% de las tallas máximas observadas, un valor que parece ser común para peces elasmobranquios (Cortés 2000).
Existe poca información sobre la talla de primera madurez de E. bigelowi; sin embargo, de acuerdo con Shirai y Tachikawa (1993), tanto los machos como las hembras alcanzan la madurez a 42 cm LT, aunque estos autores sólo encontraron huevos fertilizados en hembras mayores que 50 cm LT. En contraste, Gianetti (2005) propuso una talla de primera madurez de 63.7 cm LT para hembras y de 60 cm LT para machos. Las diferencias en la talla de madurez de E. bigelowi entre nuestras estimaciones y las de Gianetti (2005) podrían atribuirse simplemente al número y tamaño de los tiburones analizados, aunque también podrían existir diferencias poblacionales entre las dos áreas de estudio.
Los tiburones escuálidos de aguas profundas son muy vulnerables a la sobrepesca ya que, en comparación con otras especies de tiburones de aguas someras, presentan algunos parámetros de historia de vida que son limitantes, como son una madurez tardía, gestación prolongada, baja fecundidad y bajas tasas de crecimiento (Yano y Tanaka 1988). A pesar de que es esencial contar con información sobre la dinámica poblacional (e.g., edad, crecimiento y biología reproductiva) para el manejo apropiado de las poblaciones, aún existe poca información sobre los tiburones de aguas profundas (Kyne y Simpfendorfer 2007). El presente trabajo proporciona información preliminar importante sobre la talla de madurez y la relación peso–talla de E. bigelowi de aguas sudorientales de Brasil. Tal información puede ser incorporada en modelos de evaluación de riesgo y dinámica poblacional, los cuales son esenciales para proponer medidas de manejo dirigidas a evitar la sobrepesca de estos vulnerables tiburones de profundidad.
AGRADECIMIENTOS
El primer autor fue apoyado con una beca del Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq, Brasil). Los autores agradecen al capitán del barco de arrastre comercial Capitão Lucas su colaboración en la recolección de especímenes para este trabajo, a M Queiroz Santiago y MB Alonso su asistencia en los procedimientos de muestreo y laboratorio, y a CA Arfelli sus comentarios valiosos durante los procedimientos de laboratorio.
REFERENCIAS
Bernardes RA, Figueiredo JL, Rodrigues AR, Fischer LG, Vooren CM, Haimovici M, Rossi–Wongtschwski CLDB. 2005. Peixes da Zona Econômica Exclusiva da região sudeste–sul do Brasil: Levantamento com armadilhas, pargueiras e rede de arrasto de fundo. 1st ed. EDUSP Press, São Paulo. [ Links ]
Coelho R, Erzini K. 2005. Length at first maturity of two species of lantern sharks (Etmopterus spinax and Etmopterus pusillus) of southern Portugal. J. Mar. Biol. Assoc. UK 85: 1163–1165. [ Links ]
Coelho R, Erzini K. 2007. Population parameters of the smooth lantern shark, Etmopterus pusillus, in southern Portugal (NE Atlantic). Fish. Res. 86: 42–57. [ Links ]
Coelho R, Erzini K. 2008a. Life history of a wide–ranging deepwater lantern shark in the north–east Atlantic, Etmopterus spinax (Chondrichthyes: Etmopteridae), with implications for conservation. J. Fish Biol. 73: 1419–1443. [ Links ]
Coelho R, Erzini K. 2008b. Effects of fishing methods on deep–water shark species caught as by–catch off southern Portugal. Hydrobiologia 606: 187–193. [ Links ]
Coelho R, Erzini K. 2010. Depth distribution of the velvet belly, Etmopterus spinax, in relation to growth and reproductive cycle: The case study of a deep–water lantern shark with a wide ranging critical habitat. Mar. Biol. Res. 6: 381–389. [ Links ]
Compagno LJV, Dando M, Fowler S. 2005. Sharks of the World. 1st ed. Collins Press, London. [ Links ]
Cortés E. 2000. Life history patterns and correlations in sharks. Res. Fish. Sci. 8: 299–344. [ Links ]
Gianetti MD. 2005. Distribuição espacial e composifao das populações de tubaroes do gênero Etmopterus do talude continental do sul do Brasil. M.Sc. thesis, Fundação Universidade Federal do Rio Grande, Rio Grande, Brazil. [ Links ]
Gianetti MD, Vooren CM. 2008. Identification of the sharks of the genus Etmopterus Rafinesque, 1810 (Elasmobranchii: Etmopteridae) from the upper slope of southern Brazil, with comparison between the species E. bigelowi Shirai and Tachikawa, 1993 and E. pusillus Lowe, 1839. Braz. J. Oceanogr. 56: 139–143. [ Links ]
Girard M, DuBuit MH. 1999. Reproductive biology of two deep–water sharks from the British Isles, Centroscymnus coelolepis and Centrophorus squamosus (Chondrichthyes: Squalidae). J. Mar. Biol. Assoc. UK 79: 923–931. [ Links ]
Irvine SB, Stevens JD, Laurenson LJB. 2006. Comparing external and internal dorsal–spine bands to interpret the age and growth of the giant lantern shark, Etmopterus baxteri (Squaliformes: Etmopteridae). Environ. Biol. Fish. 77: 253–264. [ Links ]
Jakobsdottir KB. 2001. Biological aspects of two deep–water squalid sharks: Centroscyllium fabricii (Reinhardt 1825) and Etmopterus princeps (Collett 1904) in Icelandic waters. Fish. Res. 51: 247–265. [ Links ]
Kimura DK. 1980. Likelihood methods for the von Bertalanffy growth curve. Fish. Bull. 77: 765–776. [ Links ]
King M. 1995. Reproduction and recruitment. In: King M (ed.), Fisheries Biology, Assessment and Management. Fishing News Books, Oxford, pp. 151–165. [ Links ]
Krefft G. 1968. Neue und erstmalig nachagewiesene Knorpelfishe aus dem Archibenthal des Südwestatlantiks, einschlie lich einer Diskussion einiger Etmopterus. Arten südlicher Meere. Arch. Fischereiwiss. 19: 42 pp. [ Links ]
Kyne PM, Simpfendorfer CA. 2007. A collation and summarization of available data on deepwater Chondrichthyans: Biodiversity, life history and fisheries. IUCN and Marine Conservation Biology Institute, 165 pp. [ Links ]
Neiva J, Coelho R, Erzini K. 2006. Feeding habits of the velvet belly lanternshark Etmopterus spinax (Chondrichthyes: Etmopteridae) off the Algarve, southern Portugal. J. Mar. Biol. Assoc. UK 86: 835–841. [ Links ]
Sadowsky V, Arfelli CA, Amorim AF. 1986. First record of broad–banded lanternshark, Etmopterus gracilispinis Krefft, 1968 (Squalidae), in Brazilian waters. Bol. Inst. Pesca. 13: 1–4. [ Links ]
Shirai S, Tachikawa H. 1993. Taxonomic resolution of the Etmopterus pusillus species group (Elasmobranchii, Etmopteridae), with a description of E. bigelowi, n. sp. Copeia 2: 483–495. [ Links ]
Soto JMR. 2000. Revisão da ocorrência de tubarões etmopteríneos na costa brasileira, com dois novos registros de Etmopterus bigelowi Shirai and Tachikawa, 1993 (Chondrichtyes, Dalatiidae, Etmopiterinae). Biotemas 13: 167–178. [ Links ]
Soto JMR. 2001. First record of southern lanternshark Etmopterus granulosus (Günther 1880) (Squaliformes, Dalatiidae), on the Brazilian coast. Mare Magnum 1: 7–10. [ Links ]
Springer VG, Gold JP. 1989. Sharks in Question: The Smithsonian Answer Book. Smithsonian Institution Press, Washington. [ Links ]
Yano K. 1991. Catch distribution, stomach contents and size at maturity of two squaloid sharks, Deania calceus and D. crepidalbus, from the southeast Atlantic of Namibia. Bull. Jap. Soc. Fish. Oceanogr. 55: 189–196. [ Links ]
Yano K, Tanaka S. 1988. Size at maturity, reproductive cycle, fecundity, and depth segregation of the deep sea Squaloid sharks Centroscymnus owstoni and C. coelolepis in Suruga Bay, Japan. Nippon Suisan Gakk. 54: 167–174. [ Links ]
Wetherbee BM. 1996. Distribution and reproduction of the southern lantern shark from New Zealand. J. Fish Biol. 49: 1186–1196. [ Links ]
* Traducido al español por Christine Harris.
** Descargar versión bilingüe (Inglés–Español) en formato PDF.














