Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.36 no.1 Ensenada mar. 2010
Artículos
Crecimiento comparativo, condición y supervivencia de juveniles de los ostiones Crassostrea gigas y C. corteziensis cultivados en verano e invierno*
Comparative growth, condition, and survival of juvenile Crassostrea gigas and C. corteziensis oysters cultivated in summer and winter**
A Castillo–Durán1, J Chávez–Villalba1*, A Arreola–Lizárraga1, R Barraza–Guardado2
1 Centro de Investigaciones Biológicas del Noroeste (CIBNOR), Unidad Sonora, Apartado postal 349, Guaymas, Sonora 85454, México. * E–mail: jechavez04@cibnor.mx
2 Departamento de Investigación Científica y Tecnológica, Universidad de Sonora, Apartado postal 1819, Hermosillo, Sonora 83000, México.
Recibido en julio de 2009
Aceptado en enero de 2010
ABSTRACT
We report differences in growth, condition, and survival of the Pacific oyster Crassostrea gigas and the Cortez oyster C. corteziensis cultivated in a semi–arid lagoon in northwestern Mexico (Las Guásimas, Sonora) during summer and winter, periods corresponding to juvenile development at the production sites. Three sampling stations were established to determine variations in temperature, salinity, seston, chlorophyll a content, oxygen concentration, and pH at the coastal system. Growth rates and condition indices were higher during winter and cumulative mortality was higher in summer. This was the pattern for both species though significant differences were noted only for C. gigas. The Pacific oyster showed faster growth in winter and slower in summer than the Cortez oyster. While food availability was not a limiting factor in any season, differences in growth, condition, and survival were related to temperature, which ranged from a maximum of 32.7°C in summer to a minimum of 12.7°C in winter. Low temperatures are propitious for C. gigas, since high temperatures cause physiological stress. The Cortez oyster has the ability to adapt its metabolic functions to variations in temperature with no differences in growth and condition during the extreme seasons. The Pacific oyster exhibited better adaptation to variations in conditions at sites like Las Guásimas, but high temperature is a limiting factor for cultivation. Autumn is a propitious period to begin cultivating C. gigas, while the native C. corteziensis can be cultivated year–round.
Key words: Crassostrea gigas, Crassostrea corteziensis, growth, condition, temperature.
RESUMEN
Se reportan las diferencias en crecimiento, condición y supervivencia del ostión japonés Crassostrea gigas y el ostión de placer nativo del Mar de Cortés C. corteziensis cultivados en una laguna semiárida del noroeste de México (Las Guásimas, Sonora) durante el verano y el invierno, que corresponden a periodos de desarrollo juvenil en los sitios de producción. Se establecieron tres estaciones de muestreo para determinar las variaciones de temperatura, salinidad, seston, clorofila a, concentración de oxígeno y pH en el ecosistema costero. En ambas especies las tasas de crecimiento e índices de condición fueron mayores en invierno y la mortalidad acumulada fue mayor en verano, aunque las diferencias entre estaciones resultaron significativas sólo para C. gigas. El crecimiento de esta última especie fue mayor en invierno y menor que el de C. corteziensis en verano. En tanto que la disponibilidad de alimento no fue limitante en ninguna temporada, las diferencias en crecimiento, condición y supervivencia estuvieron relacionadas con la temperatura, que varió entre un máximo de 32.7°C en verano y un mínimo de 12.7°C en invierno. Las temperaturas bajas resultan propicias para C. gigas, ya que las altas parecen causarle estrés fisiológico; en cambio, C. corteziensis tiene la capacidad de adaptar sus funciones metabólicas a las variaciones de temperatura sin mostrar variaciones en su crecimiento ni condición durante temporadas extremas. El ostión japonés mostró una mayor capacidad de adaptación a variaciones en las condiciones de sitios como Las Guásimas, pero las temperaturas altas constituyen una limitante para su cultivo. El otoño es propicio para iniciar el cultivo de C. gigas, mientras que el nativo C. corteziensis puede ser cultivado todo el año.
Palabras clave: Crassostrea gigas, Crassostrea corteziensis, crecimiento, condición, temperatura.
INTRDUCCIÓN
La producción de ostiones en la costa del Pacífico mexicano comenzó con el cultivo del ostión japonés Crassostrea gigas (Thunberg 1793), una especie introducida, y la extracción y cultivo del ostión de placer C. corteziensis (Hertlein 1951), una especie nativa. La producción anual de C. gigas es de ~800 t y la actividad acuicultural de C. corteziensis rinde ~300 t anualmente (Maeda–Martínez 2008). La industria depende totalmente de la producción de postlarvas de C. gigas y la mayor parte de la producción en esta región proviene de un criadero comercial (CREMES). Esta institución cultiva un 10% de larvas diploides y un 90% de larvas importadas de ostiones triploides de Oregon (EUA), y produce ~80 millones de semillas anualmente (Hoyos–Chairez 2004). El criadero recibe las larvas de C. gigas en abril y septiembre, que se fijan en trozos de concha y luego se transfieren a un criadero en tierra hasta alcanzar un tamaño de 2–7 mm, para su posterior venta para la engorda. Las semillas se llevan a los sitios de engorda en mayo/junio y octubre/noviembre. Los productores reportan una alta mortandad de juveniles en el verano, probablemente a causa del estrés causado por las altas temperaturas, y muertes masivas en el invierno. Los reportes de mortandades existen desde 1997 (Cáceres–Martínez et al. 2004).
La mayoría de las actividades relacionadas con el cultivo de C. corteziensis consisten en la recolección de semillas en conchas vacías, las cuales se colocan en sartas que se cuelgan de postes de madera de mangle hasta que los ostiones adquieren el tamaño adecuado para su consumo (60–70 mm; Chávez–Villalba et al. 2005). Esta práctica se ha visto afectada por la explotación intensiva de la especie, que aunada a la reducción del aporte de agua dulce a las lagunas, ha mermado fuertemente los bancos naturales y la recolección de semilla natural. Consecuentemente, las semillas se han tenido que producir en criaderos. Por primera vez se obtuvieron juveniles de C. corteziensis para fines experimentales a finales de la decada de los noventa. Posteriormente los juveniles provenían de criaderos, pero su producción resultaba intermitente (Mazón–Suástegui et al. 2002). Desde entonces la producción de larvas y semillas ha mejorado (Cáceres–Puig et al. 2007, Rivero–Rodríguez et al. 2007, Ojeda–Ramírez et al. 2008, Pérez–Enríquez et al. 2008, Arcos et al. 2009, Hurtado et al. 2009) y actualmente la especie se produce comercialmente.
El cultivo de C. corteziensis es considerado una alternativa para compensar las considerables pérdidas de C. gigas en los cultivos comerciales. El sistema de cultivo propuesto para C. corteziensis es el mismo que el utilizado para C. gigas: canastas de plástico agrupadas en módulos y suspendidas en un sistema de cultivo conocido como línea madre. Los cultivos experimentales de C. corteziensis mediante este sistema han mostrado tasas satisfactorias de crecimiento y supervivencia (Chávez–Villalba et al. 2005, 2008). Para promover el cultivo de esta especie nativa, CREMES produce cinco millones de semillas diploides por año a partir de organismos diploides cuyo cultivo larval se realiza en paralelo con el de larvas de C. gigas, para así ofrecer semillas de ambas especies al mismo tiempo. Las semillas de la especie nativa y la introducida son transportadas a los cultivos comerciales durante los mismos periodos, pero no se han hecho estudios en que se hayan comparado directamente crecimiento, rendimiento y supervivencia de ambas especies. Sorprendentemente, existe poca información sobre los efectos de las variaciones ambientales de factores abióticos y bióticos sobre el crecimiento y la supervivencia que considere las extremas variaciones de temperatura en las lagunas de la región, sujetas a grandes cambios estacionales (Arreola–Lizárraga 2003). La variable principal es la temperatura, la cual oscila entre ~34°C a finales del verano y ~11°C en el invierno (Chávez–Villalba et al. 2005). Dado que el crecimiento de los juveniles en los sitios de producción coincide con las temperaturas extremas, el equilibrio fisiológico de los ostiones puede verse amenazado. Además, las variaciones de temperatura a su vez afectan otras variables hidrológicas estacionales, especialmente la biomasa fitoplanctónica (Valdez–Holguín 1994). No se sabe con precisión la importancia relativa de la temperatura y la disponibilidad de alimento sobre el crecimiento y la condición de los ostiones, en particular durante las etapas juveniles (Barraza–Guardado et al. 2008).
El objetivo de este trabajo fue comparar las tasas de crecimiento, el índice de condición y la supervivencia de C. gigas y C. corteziensis cultivados en un sitio típico (la laguna costera de Las Guásimas, Sonora, México) durante las temporadas contrastantes de verano e invierno, que coinciden con los periodos de desarrollo juvenil en los sitios de producción.
MATERIALES Y MÉTODOS
Diseño experimental y muestreo
Se cultivaron postlarvas (semillas) de C. gigas y C. corteziensis en un criadero comercial (CREMES) en el estado de Sonora, México, en mayo de 2005 para el ensayo de verano y en octubre del mismo año para el de invierno. Las semillas de ambas especies fueron transferidas a una granja ostionera en Las Guásimas para una fase de engorda intermedia, la cual consistió en mantener las semillas en bolsas de malla plástica de 2 mm de luz (~1000 juveniles por bolsa) en canastas de plástico sujetas a una línea madre hasta alcanzar una altura de >20 mm. Los juveniles fueron transportados al sitio de estudio (fig. 1) para los ensayos y se colocaron a una densidad inicial de 100 ostiones por canasta. Cada 15 días se limpiaron y cambiaron las canastas, reduciendo la densidad en 10%, y se retiraron y contaron las conchas vacías para estimar la mortalidad. Para los ensayos se utilizaron cuatro grupos de 1000 juveniles cada uno, dos en el verano (C. gigas, 41 ± 0.3 mm; C. corteziensis, 35 ± 0.3 mm) y dos en el invierno (C. gigas, 29.7 ± 2.3 mm; C. corteziensis, 23.9 ± 2.2 mm).

Cada temporada se recolectaron cinco muestras, empezando el 7 de julio en verano y el 21 de diciembre en invierno. Cada 15 días se transportaban 30 ostiones por especie al laboratorio, donde se limpiaron y se midieron su altura y peso seco. Se utilizaron los tejidos y las conchas de 15 especímenes para calcular el índice de condición (IC) descrito por Walne y Mann (1975). Los tejidos blandos fueron secados en un horno a 80°C por 48 h y luego se midió el peso seco. El IC se calculó como IC = P1 x 1000/P2, donde P1 es el peso seco del tejido blando y P2 es el peso seco de la concha.
Parámetros ambientales
Se establecieron tres estaciones de muestreo para determinar las variaciones de los parámetros ambientales: una estación se localizó en el sitio de cultivo y las otras dos a cada lado del sitio (fig. 1). Durante cada muestreo (cada 15 días) se realizaron mediciones de temperatura superficial del agua, salinidad, oxígeno disuelto y pH con una sonda multiparamétrica (YSI, Yellow Springs, Ohio). Al mismo tiempo se recolectaron 4 L de agua de mar para medir la concentración de clorofila a según lo descrito por Parsons et al. (1984) y la concentración de seston de acuerdo con Chávez–Villaba et al. (2005). Se estimó la productividad primaria acuática mediante el análisis de la demanda bioquímica de oxígeno (botellas claras y oscuras) según lo descrito por Strickland y Parsons (1972), a partir de datos tomados de la estación 2. Con excepción de este último análisis, los datos se expresan como el promedio de las tres estaciones.
Estadística
Se probó la normalidad y homogeneidad de varianza de los datos. El análisis de varianza se realizó entre las variables ambientales y el IC, el crecimiento y la mortalidad para identificar diferencias entre las estaciones del año y las especies. Se llevaron a cabo comparaciones post hoc entre medias con la prueba de Tukey. La significancia estadística se fijó en P <0.05.
RESULTADOS
Parámetros ambientales
La temperatura media del mar resultó muy diferente entre temporadas en todas las estaciones de muestreo, variando de 30.4°C a 32.6°C en verano y de 13.3°C a 19.3°C en invierno (fig. 2). El promedio de salinidad fue mayor en verano, de 38.8 a 41.1, que en invierno, de 35.8 a 37.6 (fig. 2), con diferencias significativas en las estaciones 1 y 2. Las concentraciones medias de oxígeno en verano variaron de 4.5 a 7.8 mg L–1, y fueron menores que las de invierno, que oscilaron entre 5.6 y 8.8 mg L–1. El promedio de pH fue similar en ambas temporadas, de 8.2 a 8.5 en verano y de 8 a 8.4 en invierno (fig. 2). Se observaron diferencias significativas entre temporadas en la estación 3 en cuanto a oxígeno, y en las estaciones 1 y 3 en cuanto a pH.

Las concentraciones de materia orgánica particulada (MOP) y materia inorgánica particulada (MIP) mostraron tendencias similares durante ambas temporadas (fig. 3). La concentración media de MOP varió de 32.9 a 46 mg L–1 en verano y de 24 a 34.3 mg L–1 en invierno, y la de MIP de 140 a 169.3 mg L–1 en verano y de 134 a 198 mg L–1 en invierno.

Se observaron diferencias significativas en la estación 1 en cuanto a MOP y en la estación 3 en cuanto a MIP. La clorofila a mostró dos máximos en verano, el mayor en julio (19.5 µg L–1) y uno menor en agosto (17.6 µg L–1); los demás registros fueron bajos (<4.5 µg L–1; fig. 3). La clorofila a presentó menor variación en invierno, de 0.04 a 2.3 µg L–1. La productividad primaria acuática mostró un máximo en julio (41.2 mg C m–3 h–1) y osciló entre 19.2 y 23 mg C m–3 h–1 durante el resto del verano, mientras que en invierno varió de 9.5 mg C m–3 h–1 en diciembre de 2005 a 1 mg C m–3 h–1 en enero de 2006, incrementando rápidamente a principios de febrero con un máximo (35.4 mg C m–3 h–1) hacia el final del mes (fig. 3). No se encontraron diferencias significativas entre temporadas en cuanto a productividad primaria acuática y clorofila a.
Crecimiento e índice de condición
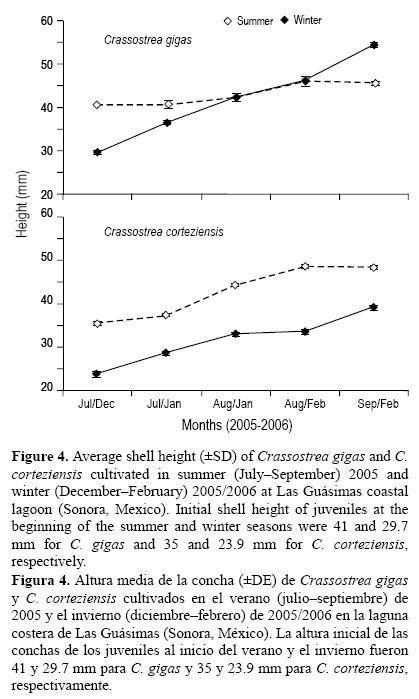
En verano (julio a septiembre de 2005), C. gigas creció de 41 a 46.1 mm y C. corteziensis de 35 a 48 mm, lo que representa una tasa de crecimiento diaria de 0.098 y 0.250 mm d–1, respectivamente. En invierno (diciembre de 2005 a febrero de 2006), C. gigas creció de 29.7 a 54.4 mm y C. corteziensis de 23.9 a 38.9 mm, lo que representa una tasa de crecimiento diaria de 0.441 y 0.268 mm d–1, respectivamente (fig. 4). Los ánalisis estadísticos mostraron que C. gigas creció significativamente más en invierno que en verano, mientras que C. corteziensis no mostró diferencias significativas en crecimiento entre temporadas. El crecimiento de C. gigas fue significativamente mayor en invierno, pero significativamente menor en verano que el de C. corteziensis. La mortalidad acumulada en verano fue de 14% para C. gigas y de 5.3% para C. corteziensis; en invierno ésta fue de 0% para C. gigas y de 0.5% para C. corteziensis (tabla 1). Se encontraron diferencias significativas en mortalidad entre las especies en verano pero no en invierno.

El IC de Walne–Mann para C. gigas mostró poca variación en verano, de 46 a 52.3, mientras que en invierno osciló entre >85 y 104.1 a finales de enero de 2006 pero varió poco hasta el final del ensayo. En verano el IC para C. corteziensis empezó en 70.6 y decreció gradualmente hasta 46 el 12 de septiembre (fig. 5), pero en invierno no presentó un patrón claro, variando de 59.6 a 77.4. El IC de C. gigas fue significativamente mayor en invierno y mayor que el de C. corteziensis en verano e invierno. El IC de C. corteziensis no mostró diferencias significativas entre verano e invierno, pero sus valores fueron significativamente mayores que los del IC de C. gigas en verano.

DISCUSIÓN
Éste es el primer estudio comparativo que determina las diferencias en crecimiento, condición y supervivencia de especímenes juveniles de C. gigas y C. corteziensis durante su cultivo en una laguna del noroeste de México, y que relaciona estas diferencias con variaciones en los factores ambientales prevalecientes en verano e invierno. Trabajos previos han mostrado que diferencias en las tasas de crecimiento de bivalvos reflejan la interacción de factores ambientales, en particular la temperatura y la disponibilidad de alimento (Wallace y Reinsnes 1985, Laing et al. 1987, Rupp et al. 2005). Por ejemplo, la temperatura del agua superficial en Las Guásimas presentó una marcada variación anual de 20°C, similar a las oscilaciones de temperatura en las regiones templadas donde se cultiva C. gigas (Soletchnick et al. 1999, Gangnery et al. 2003), aunque mayor en alrededor de 5°C en sus límites inferior y superior. No obstante, en ambos ambientes 19°C es una temperatura óptima para el balance fisiológico; por arriba o por abajo de este nivel, los ostiones sufren estrés severo (Bougrier et al. 1995, Sicard et al. 2006). Las altas temperaturas de verano propician estrés fisiológico y el crecimiento disminuye. En contraste, el efecto de las temperaturas altas sobre el crecimiento de C. corteziensis es menos evidente; sin embargo, el menor crecimiento observado en el verano podría indicar que la especie nativa también se ve afectada, ya que según Cáceres–Puig et al. (2007) la tolerancia térmica superior de C. corteziensis llega a ~32°C. Estos autores también mencionan que el crecimiento óptimo ocurre a 28–30°C, lo que coincide con los resultados de Chávez–Villalba et al. (2005) en cuanto a mayores tasas de crecimiento en verano, pero contrasta con los resultados encontrados en el presente estudio.
La disponibilidad de alimento es otro factor que afecta el crecimiento. En Las Guásimas la biomasa fitoplanctónica fue similar en ambas temporadas y los niveles de clorofila a estuvieron dentro del intervalo de otras lagunas de Sonora (Castro–Longoria y Grijalva–Chon 1991, Chávez–Villalba et al. 2005), y fueron mayores que en sitios donde las concentraciones de clorofila no son un factor limitante para los bivalvos juveniles (Rupp et al. 2005). Concluimos que la biomasa fitoplanctónica en Las Guásimas no limitó el crecimiento de los ostiones. Lo que si encontramos fueron concentraciones altas de seston durante ambas temporadas (83% de MIP en verano, 85% de MIP en invierno). Paterson et al. (2003) encontraron menores tasas de crecimiento a altas concentraciones de MIP para el ostión de roca de Sydney Saccostrea glomerata. En Las Guásimas C. gigas presentó altas tasas de crecimiento a mayores concentraciones de MIP, lo que indica que la especie puede explotar fuentes de alimento durante el invierno y almacenar y utilizar la energía para su crecimiento. Los mecanismos que podría usar C. gigas para mantener una alta eficiencia de absorción ante concentraciones altas de seston probablemente sean los mismos que los de Mulinia edulis y Mytilus chilensis, que presentan un incremento en acciones compensatorias, selección preingestiva, capacidad estomacal y producción o actividad de las enzimas digestivas (Velasco y Navarro 2003). En nuestro estudio, sin embargo, los altos niveles de MIP asociados con las altas temperaturas estivales parecen haber inhibido el crecimiento de C. gigas, pero éstos tuvieron un menor efecto sobre la alimentación de C. corteziensis a temperaturas altas o bajas. Este resultado necesita comprobarse con experimentos adicionales que midan el crecimiento a diferentes combinaciones de temperatura y concentración de MIP. Las diferencias en crecimiento entre ambas especies, una introducida y la otra nativa, sugieren que la influencia de la variación de temperatura es mayor que la de la disponibilidad de alimento en este cuerpo de agua subtropical.
Existe poca información sobre las tasas de mortalidad de C. gigas en las áreas de producción en México; no obstante se ha informado de una mortalidad de 40–60% durante el ciclo de cultivo. Los datos disponibles para los métodos experimentales de cultivo (ostiones fijos a conchas suspendidas, canastas suspendidas de una línea madre y costales de malla plástica sobre camas de fierro) muestran una mortalidad acumulada de 15–52% (Gallo–García et al. 2001 y sus referencias). La mortalidad de C. corteziensis en cultivo experimental (sistema de línea madre) varía de 2–12% (datos no publicados) a 30% (Chávez–Villalba et al. 2005, 2008). Nuestros resultados indican niveles similares de mortalidad en ambas especies. Según los productores generalmente se presentan eventos de alta mortandad entre juveniles de C. gigas en otoño e invierno. En este estudio no se observaron altas tasas de mortalidad en invierno y las diferencias en las tasas de verano (14%) parecen estar relacionadas con las temperaturas altas, esto es, con el estrés térmico. Las tasas de mortalidad de C. corteziensis indican que la especie es afectada por temperaturas altas, pero en menor grado, y que las condiciones invernales favorecen su metabolismo.
Varios autores reconocen la importancia de medir el IC para evaluar el estado nutricional de los bivalvos y su calidad comercial, así como para determinar diferentes contaminantes o enfermedades (Bodoy et al. 1986, Crosby y Gale 1990, Mason y Nell 1995, Baghurst y Michell 2002). Boscolo et al. (2003) mostraron que las variaciones en el IC se originaron de las interacciones complejas de muchos factores, pero que el ciclo gametogénico sigue siendo la causa principal, seguido por la disponibilidad de alimento. Dado que la biomasa fitoplanctónica y MOP no presentaron variación temporal en Las Guásimas, las diferencias en el IC, al menos en el caso de C. gigas, parecen estar relacionadas con otros factores más que con la alimentación; por ejemplo, con baja temperatura los ostiones pudieron utilizar la energía disponible para su crecimiento y almacenamiento de reservas. En un estudio previo (Chávez–Villalba et al. 2007), se detectó una relación positiva entre el seston y el IC en invierno para C. gigas. Flores–Vergara et al. (2004) mostraron que la alta temperatura estival (en el estado de Baja California) es una importante causa de estrés en C. gigas, incrementando los costos y reduciendo las reservas de energía. Sometido constantemente a altas temperaturas, C. gigas reduce su alimentación y utiliza la energía derivada del fitoplancton y la MOP sólo para mantener su metabolismo. Shumway (1982) afirmó que a los ostiones expuestos a temperaturas altas (>25°C) se les dificulta mantener funciones vitales a una tasa constante. En contraste, el efecto de la temperatura y la disponibilidad de alimento en el IC de C. corteziensis parece ser diferente. En verano, la disponibilidad de alimento fue mayor (menor dilución de MOP por MIP), pero el IC disminuyó; aparentemente la energía que proviene del fitoplancton y otros compuestos orgánicos no se almacena y se utiliza para crecimiento. En invierno, la disponibilidad de alimento fue menor (mayor dilución de MOP por MIP), pero el IC permaneció relativamente alto (>60), con ligeras variaciones que sugieren que la energía, además de sostener el crecimiento, como en el verano, se acumuló y se utilizó para su reproducción. Estudios previos (Chávez–Villalba et al. 2005, 2008) indican que el IC de C. corteziensis comienza a incrementarse en invierno como consecuencia de la gametogénesis de especímenes jóvenes (seis meses de edad).
El presente estudio mostró que la diferencia significativa en temperatura entre verano e invierno en Las Guásimas interfiere con el crecimiento de los ostiones juveniles, pero que la diponibilidad de alimento no es un factor limitante. Es posible que las diferencias en crecimiento estén relacionadas con variaciones locales a pequeña escala y no con la variabilidad de la laguna. Aun a pequeña escala la influencia negativa de las altas temperaturas estivales fue particularmente importante en el caso de C. gigas, ocasionando estrés fisiológico que disminuye el crecimiento, reduce la condición e incrementa la mortalidad, aunque esta última (14%) no parece estar asociada con los eventos de alta mortandad que, según los productores de la región, se han presentado en el verano. El efecto de los cambios temporales de temperatura sobre C. corteziensis resultó menos evidente, con pequeñas variaciones en la mortalidad. En general C. gigas mostró una mejor adaptación a las variaciones en las condiciones de Las Guásimas, pero las altas temperaturas constituyen una limitante para su cultivo. En cuanto a estrategias acuícolas, el otoño representa un periodo favorable para iniciar el cultivo del ostión japonés, mientras que el ostión de placer del Mar de Cortés puede ser cultivado todo el año.
AGRADECIMIENTOS
Este trabajo recibió apoyo financiero del Consejo Nacional de Ciencia y Tecnología (SEMARNAT–CONACYT 2002–C01–0147). El primer autor fue apoyado con una beca del CONACYT. Agradecemos a MR López y A Hernández (CIBNOR) su asistencia en el campo y el laboratorio. Los ostiones fueron donados por el Instituto de Acuacultura del Estado de Sonora.
REFERENCIAS
Arcos FG, Ibarra AM, Rodríguez–Jaramillo C, García–Latorre EA, Vázquez–Boucard C. 2009. Quantification of vitellin/ vitellogenin–like proteins in the oyster Crassostrea corteziensis (Hertlein 1951) as a tool to predict the degree of gonad maturity. Aquacult. Res. 40: 644–655. [ Links ]
Arreola–Lizárraga JA. 2003. Bases de manejo costero: Patrones ecológicos en la laguna costera Las Guásimas, Territorio Yaqui, México. Ph.D. thesis, Centro de Investigaciones Biológicas del Noroeste, La Paz, BCS, México, 61 pp. [ Links ]
Baghurst BC, Mitchell JG. 2002. Sex–specific growth and condition of the Pacific oyster (Crassostrea gigas Thunberg). Aquacult. Res. 33: 1253–1263. [ Links ]
Barraza–Guardado RH, Chávez–Villalba J, Atilano–Silva H, Hoyos–Chairez F. 2008. Seasonal variation of the condition index of Pacific oyster postlarvae (Crassostrea gigas) in a land–based nursery in Sonora, Mexico. Aquacult. Res. 40: 118–128. [ Links ]
Bodoy A, Prou J, Berthome JP. 1986. Etude comparative de differents indices de condition chez l'huitre creuse (Crassostrea gigas). Haliotis 15: 173–182. [ Links ]
Boscolo R, Cornello M, Giovanardi O. 2003. Condition index and air survival time to compare three kinds of Manila clam Tapes philippinarum (Adams and Reeve) farming systems. Aquacult. Int. 11: 243–254. [ Links ]
Bougrier S, Geairon P, Deslous–Paoli JM, Bacher C, Jonquières G. 1995. Allometric relationships and effects of temperature on clearance and oxygen consumption of Crassostrea gigas (Thunberg). Aquaculture 134: 143–154. [ Links ]
Cáceres–Martínez J, Ramírez–Gutiérrez S, Vásquez–Yeomans R, Macías–Montes de Oca P. 2004. Reproductive cycle and mortality of the Japanese oyster Crassostrea gigas cultured in Bahía Falsa, Baja California, Mexico. J. Shellfish Res. 23: 795–801. [ Links ]
Cáceres–Puig JI, Abasolo–Pacheco F, Mazón–Suastegui JM, Maeda–Martínez AN, Saucedo PE. 2007. Effect of temperature on growth and survival of Crassostrea corteziensis spat during late–nursery culturing at the hatchery. Aquaculture 272: 417–422. [ Links ]
Castro–Longoria R, Grijalva–Chon M. 1991. Spatio–temporal variability of nutrients and seston in the coastal lagoon La Cruz, Sonora. Cienc. Mar. 17: 83–97. [ Links ]
Chávez–Villalba J, López–Tapia MR, Mazón–Suástegui JM, Robles–Mungaray M. 2005. Growth of the oyster Crassostrea corteziensis (Hertlein 1951) in Sonora, Mexico. Aquacult. Res. 36: 1337–1344. [ Links ]
Chávez–Villalba J, Villelas–Ávila F, Cáceres–Martínez C. 2007. Reproduction, condition and mortality of the Pacific oyster Crassostrea gigas (Thunberg) along coastal Sonora, Mexico. Aquacult. Res. 38: 268–278. [ Links ]
Chávez–Villalba J, Hernández–Ibarra A, López–Tapia MR, Mazón–Suástegui JM. 2008. Prospective culture of the Cortez oyster Crassostrea corteziensis from northwestern Mexico: Growth, gametogenic activity, and condition index. J. Shellfish Res. 27: 711–720. [ Links ]
Crosby MP, Gale LD. 1990. A review and evaluation of bivalve condition index methodologies with a suggested standard method. J. Shellfish Res. 9: 233–237. [ Links ]
Flores–Vergara C, Cordero–Esquivel B, Cerón–Ortíz A, Arredondo–Vega B. 2004. Combined effects of temperature and diet on growth and biochemical composition of the Pacific oyster Crassostrea gigas (Thunberg) spat. Aquacult. Res. 35: 1131–1140. [ Links ]
Gallo–García MC, García–Ulloa M, Godínez–Sordia D, Rivera–Gómez K. 2001. Estudio preliminar sobre el crecimiento y supervivencia del ostión del Pacífico Crassostrea gigas (Thunberg 1873) en Barra de Navidad, Jalisco, México. Univ. Cienc. 17: 83–91. [ Links ]
Gangnery A, Chabirand JM, Lagarde F, Le Gall P, Oheix J, Bachar C, Buestel D. 2003. Growth model of the Pacific oyster Crassostrea gigas cultured in Thau Lagoon (Méditerranée France). Aquaculture 215: 267–290. [ Links ]
Hoyos–Chairez F. 2004. Ostricultura sonorense. Antecedentes, presente y perspectiva de desarrollo sustentable. Memoria Foro Agricultura y Desarrollo Rural Sustentable, Hermosillo, Sonora, 29–30 April 2004, 11 pp. [ Links ]
Hurtado MA, Ramírez JL, Rodríguez–Jaramillo C, Tovar D, Ibarra AM, Soudant P, Palacios E. 2009. Comparison of continuous and batch feeding systems on maturation, biochemical composition and immune variables of the oyster Crassostrea corteziensis (Hertlein 1951). Aquacult. Res. 40: 464–472. [ Links ]
Laing I, Utting SD, Kilada RWS. 1987. Interactive effect of diet and temperature on the growth of juvenile clams. J. Exp. Mar. Biol. Ecol. 113: 23–38. [ Links ]
Maeda–Martínez AN. 2008. Estado actual del cultivo de bivalvos en México. In: Lovatelli A, Farias A, Uriarte I (eds.), Taller Regional de la FAO sobre el Estado Actual del Cultivo y Manejo de Moluscos Bivalvos y su Proyección Futura: Factores que afectan su sustentabilidad en América Latina. Actas de Pesca de la FAO, No. 12, Rome, pp. 91–100. [ Links ]
Mason CJ, Nell JA. 1995. Condition index and chemical composition of meats of Sydney rock oysters (Saccostrea commercialis) and Pacific oyster (Crassostrea gigas) at four sites in Port Stephens, NSW. Mar. Freshwat. Res. 46: 873–881. [ Links ]
Mazón–Suástegui JM, Robles–Mungaray M, Flores–Higuera F, Avilés–Quevedo A. 2002. Experiencias en la producción de semilla de ostión de placer Crassostrea corteziensis en el laboratorio. IV Simposio Nacional de Acuicultura y Pesca (Book of Abstracts), Antigua, Guatemala, pp. 16–18. [ Links ]
Ojeda–Ramírez JJ, Cáceres–Puig JI, Mazón–Suástegui JM, Saucedo P. 2008. Nutritional value of Pavlova spp. (Prymnesiophyceae) for spat of the Cortez oyster Crassostrea corteziensis during late–nursery culturing at the hatchery. Aquacult. Res. 39: 18–23. [ Links ]
Parsons TR, Maitia Y, Lalli CM. 1984. A Manual of Chemical and Biological Methods for Seawater Analysis. Pergamon Press, Oxford, 173 pp. [ Links ]
Paterson KJ, Schreider MJ, Zimmerman KD. 2003. Anthropogenic effects on seston quality and quantity and the growth and survival of Sydney rock oyster (Saccostrea glomerata) in two estuaries in NSW, Australia. Aquaculture 221: 407–426. [ Links ]
Pérez–Enríquez R, Ávila S, Ibarra AM. 2008. Population genetics of the oyster Crassostrea corteziensis in the Gulf of California. Cienc. Mar. 34: 479–440. [ Links ]
Rivero–Rodríguez S, Beaumont AR, Lora–Vilchis MC. 2007. The effect of microalgal diets on growth, biochemical composition, and fatty acid profile of Crassostrea corteziensis (Hertlein) juveniles. Aquaculture 263: 199–210. [ Links ]
Rupp GS, Parsons GJ, Thompson RJ, de Bem MM. 2005. Influence of environmental factors, season and size at deployment on growth and retrieval of postlarval lion's paw scallop Nodipecten nodosus (Linnaeus 1758) from a subtropical environment. Aquaculture 243: 195–216. [ Links ]
Shumway SE. 1982. Oxygen consumption in oysters: An overview. Mar. Biol. Lett. 3: 1–23. [ Links ]
Sicard MT, Maeda–Martínez AN, Lluch–Cota SE, Lodeiros C, Roldán–Carrillo LM, Mendoza–Alfaro R. 2006. Frequent monitoring of temperature: An essential requirement for site selection in bivalve aquaculture in tropical–temperate transition zones. Aquacult. Res. 37: 1040–1049. [ Links ]
Soletchnick P, Le Moine O, Faury N, Razet D, Geairon P, Goulletquer P. 1999. Mortalité de l'huitre Crassostrea gigas dans le bassin de Marennes–Oléron: Étude de la variabilité spatiale de son environnement et de sa biologie par un système d'informations géographiques (SIG). Aquat. Living Resour. 12: 131–143. [ Links ]
Strickland JDH, Parsons TR. 1972. A Practical Handbook of Seawater Analysis. Fish. Res. Bd. Canada, Bull. 167, 310 pp. [ Links ]
Valdez–Holguín JE. 1994. Daily variations of temperature, salinity, dissolved oxygen and chlorophyll a in a hypersaline lagoon of the Gulf of California. Cienc. Mar. 20: 123–137. [ Links ]
Velasco LA, Navarro JM. 2003. Energetic balance of infaunal (Mulinia edulis King 1831) and epifaunal (Mytilus chilensis Hupé 1854) bivalves in response to wide variations in concentration and quality of seston. J. Exp. Mar. Biol. Ecol. 296, 79–92. [ Links ]
Wallace JC, Reinsnes TG. 1985. The significance of various environmental parameters for growth of the Iceland scallop, Chlamys islandica (Pectinidae), in hanging culture. Aquaculture 44: 229–242. [ Links ]
Walne PR, Mann R. 1975. Growth and biochemical composition in Ostrea edulis and Crassostrea gigas. In: Barnes H (ed.), 9th European Marine Biology Symposium. Aberdeen Univ. Press, Scotland, pp. 587–607. [ Links ]
* Traducido al español por Christine Harris.














