Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.35 n.4 Ensenada Dec. 2009
Artículos de investigación
Clearance rate of the mussel Mytilus galloprovincialis. I. Response to extreme chlorophyll ranges*
Tasa de aclaramiento del mejillón Mytilus galloprovincialis. I. Respuesta a intervalos extremos de clorofila
R Filgueira, MJ Fernández–Reiriz*, U Labarta
Consejo Superior de Investigaciones Científicas (CSIC), Instituto de Investigaciones Marinas, C/ Eduardo Cabello 6, 36208 Vigo, Spain. * E–mail: mjreiriz@iim.csic.es
Recibido en abril de 2008.
Aceptado en noviembre de 2009.
Abstract
Clearance rate (CR) measurements in Mytilus galloprovincialis were determined over 16 experiments in which the mussels were exposed to diets characterized by variable chlorophyll content (0.28–104.88 µg Chla L–1) in order to: (1) establish the lower trigger level and the saturation reduction, (2) elucidate whether these thresholds were controlled by an on/off switch or by a progressive response, and (3) determine whether the experimental time exerted an effect on the CR measurement under extreme conditions, quantified in terms of chlorophyll content. The results demonstrated that time exerted a significant effect on CR, which varied throughout the experiment in different diets. The CR response differed fundamentally in the significant reduction of CR after prolonged exposure to low and high chlorophyll–content diets compared with the medium ones. Taking into account the data from the sixth hour onwards, a sharp lower trigger level threshold was established at 2.08 µg Chla L–1, showing an on/off CR response. The threshold for saturation reduction was about 26.91 µg Chla L–1 and showed a progressive response to chlorophyll concentration.
Key words: Mytilus galloprovincialis, clearance rate, chlorophyll, seston quantity and quality.
Resumen
Se realizaron 16 experimentos en los que se determinó la tasa de aclaramiento (TA) en Mytilus galloprovincialis sometido a dietas con distinto contenido de clorofila (0.28–104.88 µg Chla L–1) con objeto de: (1) establecer su umbral de activación y de saturación, (2) dilucidar si estos umbrales están regidos por una respuesta de tipo encendido/apagado o bien por una respuesta progresiva, y (3) determinar el efecto del tiempo de experimentación en la medida de la TA en condiciones extremas, cuantificadas en términos de contenido en clorofila. Los resultados del presente trabajo pusieron de manifiesto que el tiempo de experimentación ejerce un efecto significativo sobre el comportamiento de la TA, la cual varió a lo largo del experimento con diferentes dietas. La respuesta de la TA difirió fundamentalmente en su reducción significativa tras de una exposición prolongada a dietas con alto o bajo contenido de clorofila en comparación con dietas con contenido medio. Teniendo en cuenta los datos a partir de la sexta hora de experimentación, se observó un abrupto umbral de activación a una concentración de clorofila de 2.08 µg L–1, mostrando una respuesta de tipo encendido/apagado. En el caso del umbral de saturación, la concentración de clorofila a partir de la cual se apreció una reducción de la TA se situó en torno a 26.91 µg Chla L–1, mostrando una reducción progresiva con la concentración de clorofila de la dieta.
Palabras clave: Mytilus galloprovincialis, tasa de aclaramiento, clorofila, cantidad y calidad de seston.
Introducción
El conocimiento actual del proceso de filtración de los bivalvos ha estado precedido por gran controversia científica. Por una parte se consideraba que este proceso era regulado fisiológicamente (Hawkins et al. 1996; Bayne 1998, 2001) con el propósito de maximizar la asimilación de energía (Bayne et al. 1993). Otros estudios han indicado que la filtración es un proceso automático (Jergensen et al. 1988) en el que, en condiciones óptimas, el sistema de filtración está diseñado para funcionar a su máxima capacidad (Riisgård 2001a). Este argumento dio origen a varios estudios que revisaron la respuesta alimenticia de los bivalvos a cambios ambientales (Jergensen 1996, Bayne 1998, Riisgård 2001a, b), y que condujeron al acuerdo general de que la filtroalimentación en los bivalvos es regulada fisiológicamente (Pascoe et al. 2009), según los indicadores de esta regulación sugeridos por Riisgård (2001a, b).
La regulación fisiológica implica una gran flexibilidad en la respuesta de la tasa de aclaramiento (TA) en los bivalvos para compensar los cambios cuantitativos y cualitativos del alimento disponible con el propósito de maximizar la asimilación energética. La exposición a condiciones adversas (e.g. alimento de mala calidad) podría inducir una respuesta extrema en los bivalvos, específicamente el cese de la filtración debido a la reducción de la apertura natural de las valvas y la retracción de los bordes del manto (Jergensen et al. 1988). En términos del alimento disponible, el espectro de condiciones bajo las cuales se lleva a cabo el proceso de filtración a su máxima capacidad se encuentra limitado por un umbral inferior y uno superior.
El umbral superior que causa la reducción de la TA se denomina "umbral de saturación" y se interpreta como un efecto secundario en mejillones en condiciones subóptimas o, más específicamente, como una sobrecarga de su sistema de filtración y/o digestivo (Riisgård 2001a). La teoría fisiológica sustenta la noción de que la reducción de la TA es consecuencia de un ajuste fisiológico para maximizar la asimilación energética (Winter 1978, Bayne et al. 1993, Velasco y Navarro 2002). Este ajuste a condiciones adversas involucra mecanismos de regulación, previos a la ingesta, como la selección y el rechazo de material alimenticio a nivel del ctenidio y palpos labiales (Bayne et al. 1993, Ward y Shumway 2004).
El umbral inferior por debajo del cual el organismo no activa su mecanismo de filtración se denomina "umbral de activación". Thompson y Bayne (1972) observaron ausencia de actividad filtradora antes de la adición del alimento, pero a partir de ésta la TA incrementó rápidamente. Otros autores también han notado la existencia de este umbral (Winter 1978, ver la revisión de Dolmer 2000). Bernard (1983) estudió la TA en condiciones alimenticias pobres e identificó un "umbral de activación" que describió como de tipo "encendido/apagado" más que un mecanismo de control progresivo. La exposición prolongada a condiciones alimenticias pobres puede también ocasionar el cierre de las valvas y la reducción de la TA (Thompson y Bayne 1972). Esto podría interpretarse como una respuesta fisiológica para reducir el transporte de agua a través de las branquias y la cavidad paleal, reduciendo así la respiración y la tasa metabólica (Jergensen et al. 1988).
En este trabajo se estudió la TA de Mytilus galloprovincialis bajo un amplio espectro de dietas definidas en términos de clorofila, materia orgánica particulada y material particulado total, que son elementos que juegan un papel importante en el desarrollo de los mejillones (Freites et al. 2003). Los experimentos se realizaron durante nueve horas para: (1) establecer los umbrales de activación y saturación, (2) dilucidar si estos umbrales son controlados por un mecanismo de tipo encendido/apagado o por una respuesta progresiva, y (3) determinar si el tiempo de experimentación ejerce algún efecto en la medida de TA bajo condiciones extremas de concentración de clorofila.
Material y métodos
Aclimatación de los mejillones experimentales
Se utilizaron M. galloprovincialis (Lamarck 1819) recolectados de una batea de cultivo en la Ría de Arousa (Galicia, NO de España), seleccionando individuos de 60 mm de longitud (60 ± 2.1 mm de largo y 1.3 ± 0.39 g de peso seco de la carne) a los que se retiraron los epibiontes (fig. 1). Los mejillones se mantuvieron durante 7 días antes del experimento en tanques de 19 L con 20 a 25 individuos por tanque. Los tanques eran de flujo abierto y contenían agua de mar filtrada (cartucho CUNO Super Micro–Wynd de 10 µm) a 15–16°C y 35.5 de salinidad. El agua de mar fue enriquecida con una mezcla de microalgas (Isochrysis aff. galbana de Tahiti, T–ISO) y sedimento pulverizado (liofilizado, molido y tamizado para garantizar un tamaño de 3–30 µm) del lecho marino bajo las bateas (40:60 microalgas:sedimento en peso). El flujo se mantuvo constante mediante una bomba peristáltica, de manera que la carga de material particulado se mantuviera en 1.2 mg L–1 con 50% de contenido orgánico simulando la dieta de los mejillones en la Ría de Arousa, en promedio.

Dietas experimentales
Las dietas experimentales se prepararon mezclando proporciones variables de microalgas y sedimento (tabla 1). El agua de mar en el tanque del alimento era filtrada por un sistema de cartucho (CUNO Super Micro–Wynd de 10, 5 y 1 µm; CUNO Betapure de 0.5 µm) con un tamaño de poro efectivo de 0.5 µm, y tratada con luz UV. El tanque con la dieta se mantuvo con aereación intensa para mantener la homogeneidad y evitar la sedimentación de partículas.
El material particulado total (MPT) y la materia orgánica particulada (MOP) de las dietas se determinó por gravimetría en filtros Whatman GF/C de 25 mm, preincinerados (450°C, 4 h). Tras filtrar por triplicado 1 L de cada dieta, se eliminaron las sales lavando con 100 mL de una solución isotónica de formato de amonio (0.5M). A continuación los filtros se secaron a 110°C por 24 h y se pesaron para determinar el MPT. La MOP se determinó tras incinerar los filtros durante 4 h a 450°C, por medio de una balanza analítica (Sartorius Micro M3P).
La clorofila de las dietas se determinó por espectrofotometría. Se filtró, por triplicado, 1 L de cada dieta a través de filtros Whatman GF/F de 25 mm, congelados a –20°C para propiciar la ruptura celular y facilitar la extracción de clorofila. La extracción se realizó agregando 5 mL de acetona al 90% y dejando reposar la solución por 12 h (a 4°C). Entonces la solución se centrifugó a 4500 rpm, a 10°C y por 10 min, para separar el extracto de los restos del filtro. La clorofila se cuantificó mediante la siguiente ecuación para algas cromofitas (Jeffrey y Welschmeyer 1997):
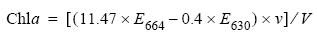
donde Chla es la concentración de clorofila (µg L–1), E664 y E630 las absorbancias a 664 y 630 nm respectivamente, v el volumen de acetato usado en la extracción (mL) y V el de la dieta filtrada (mL). También se midió la absorbancia a 750 nm para determinar si los restos del filtro afectaban las mediciones de absorbancia.
Diseño experimental
En la tabla 1 se muestran las características (MPT, MOP, calidad = MOP:MPT y contenido de clorofila) de las 16 dietas estudiadas. Se utilizaron 7 cámaras individuales con un mejillón cada una y una cámara de control sin mejillón para determinar la TA de los mejillones expuestos a cada dieta. En cada tratamiento se usaron diferentes mejillones. La TA se estimó con el método de cámara de flujo continuo (Filgueira et al. 2006), con mediciones cada 1.5 a 2.0 h, en un total de 9 h. Las primeras 1.5 h se consideraron de aclimatación y por lo tanto no se representaron gráficamente. Algunos mejillones desovaron durante el experimento, por lo que fueron descartados de los análisis. La contaminación de uno de los tanques de alimento obligó a la terminación prematura, a las 7 horas, de los experimentos que contenían las dietas de 45.68 y 104.88 µg Chla L–1. Las características de las dietas se determinaron 3 veces a lo largo del experimento.
Estandarización de TA
En todos los casos TA se estandarizó a una longitud del mejillón de 60 mm con la siguiente fórmula:
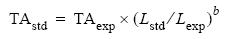
donde TAstd es la tasa de aclaramiento estandarizada, TAexp la tasa de aclaramiento experimental, Lstd la longitud de estandarización, Lexp la longitud del individuo experimental y b el exponente que relaciona la TA con la longitud. Se utilizó un valor de 1.72 como exponente de estandarización de TA respecto a la longitud (Filgueira et al. 2008).
Análisis estadístico
Se buscó la correlación entre las características de las dietas mediante el coeficiente de correlación de Pearson. El efecto del tiempo en la respuesta de TA se evaluó por medio de una regresión lineal. El efecto de las características de las dietas sobre TA se analizó con modelos no lineales que se formularon usando el algoritmo de Levenberg–Marquardt y cuadrados mínimos como función de pérdida. Los análisis estadísticos se realizaron con el paquete de cómputo SPSS 11.5 (SPSS Inc. Chicago).
Resultados
Dietas experimentales
Las características de las dietas experimentales (tabla 1) mostraron una correlación estadística significativa, con coeficientes de correlación de Pearson (CCP) para Chla–TPM = 0.771, P < 0.001; CCP Chla–MOP = 0.983, P < 0.001; y CCP MPT–MOP = 0.871, P< 0.001. Debido a la fuerte correlación entre Chla y MOP los resultados podrían ser explicados por cualquiera de estas variables. Sin embargo, dado que el contenido de clorofila da una buena idea de la calidad del alimento y que la clorofila explicó mejor la varianza de TA que la de MOP (ver más abajo), los resultados fueron descritos en términos de contenido de clorofila.
Cambios en TA en función del tiempo de experimentación
En la figura 2 se muestran los cambios en TA con las diferentes dietas a lo largo del experimento. El análisis de regresión lineal correspondiente a cada dieta mostró pendientes negativas estadísticamente significativas para las dietas con menos de 2.08 µg Chla L–1, a excepción de la dieta con 1.95 µg Chla L–1 (tabla 2), lo que implica que la reducción observada de TA (fig. 2a) es significativa. Para las dietas con entre 2.08 y 26.91 µg Chla L–1, las pendientes de los análisis de regresión lineal no difirieron estadísticamente de 0 (tabla 2), lo que indica que TA fue constante a lo largo del experimento (fig. 2b). Finalmente, los análisis de regresión lineal de las dietas con más de 26.91 µg Chla L–1 mostraron pendientes negativas estadísticamente significativas (tabla 2) resaltando una importante reducción de TA (fig. 2c).


Efecto de la dieta en TA
La respuesta de TA se vio afectada de diferente manera por el tiempo de experimentación dependiendo del contenido de clorofila de cada dieta; esto es, los tratamientos con dietas que contenían entre 2.08 y 26.91 µg Chla L–1 mostraron una TA constante a lo largo del experimento, mientras que los que contenían menos de 2.08 µg Chla L–1 o más de 26.91 µg Chla L–1 mostraron una TA significativamente reducida. Esto resaltó la gran importancia de estudiar la respuesta de TA en función del contenido de clorofila en diferentes momentos del experimento. Con el fin de observar este efecto temporal en la respuesta de TA en función del contenido de clorofila, los resultados se dividieron en tres etapas del tiempo de experimentación: la "inicial" de 0 a 3 h, la "intermedia" de 4 a 6 h y la "final", después de 6 h.
Durante la etapa inicial se observó una relación lineal negativa entre TA y contenido de clorofila (regresión lineal simple, fig. 3a), en la que este último explicó 72% de la varianza de TA. Se observó la misma respuesta en términos de MOP, aunque esta variable explicó un porcentaje menor de varianza (61%). No se observó ninguna relación estadísticamente significativa entre TA y MPT.

Durante la etapa intermedia la relación entre TA y contenido de clofrofila se caracterizó por ser no lineal (James et al. 2001) (fig. 3b), con TA máxima a concentraciones entre 2.08 y 26.91 µg Chla L–1. El contenido de clorofila explicó 77% de la varianza de TA, y aunque MOP mostró el mismo tipo de respuesta sólo explicó 69% de la varianza. Como en la primera etapa, no se observó ninguna relación estadísticamente significativa entre TA y MPT.
En la etapa final, la relación entre TA y contenido de clorofila también se caracterizó por ser no lineal (modelo logístico modificado; Murado et al. 2002) (fig. 3c). La relación mostró un comportamiento inhibitorio en el que TA se incrementó con la clorofila hasta alcanzar un máximo a un nivel intermedio de 2.08–26.91 µg Chla L–1, seguido por una disminución gradual. La varianza explicada por el contenido de clorofila aumentó a 82%. Este mismo patrón se observó para MOP, aunque esta variable sólo explicó 57% de la varianza. De nuevo, no se observó ninguna relación estadísticamente significativa entre TA y MPT.
A lo largo de las tres etapas de la experimentación la relación entre TA y el contenido de clorofila y/o MOP (fig. 3) mostró una respuesta gradual en el tiempo. La tendencia se vio principalmente definida por una disminución de TA con el tiempo de experimentación en las dietas con menos de 2.08 y más de 26.91 µg Chla L–1. Estos análisis de regresión sintetizan los resultados antes descritos para cada dieta (fig. 2, tabla 2).
Discusión
Efecto del tiempo de experimentación en la relación entre TA y Chla
La disminución de TA con el tiempo de experimentación en los tratamientos con dietas con menos de 2.08 µg Chla L–1 (fig. 2a) y más de 26.91 µg Chla L–1 (fig. 2c) resalta la importancia de la variable tiempo en la respuesta de TA. Este mismo patrón de respuesta ha sido observado previamente en M. edulis en estudios cuya síntesis se presenta en la tabla 3. Sin embargo, los resultados de dichos estudios no pueden compararse directamente en términos de contenido de clorofila debido a su gran dependencia de las condiciones de cultivo de las microalgas. En general estos estudios muestran una reducción significativa de TA ante concentraciones extremas de alimento por debajo y por encima de un intervalo óptimo, dentro del cual no se observa reducción alguna. Por lo contrario, Arifin y Bendell–Young (1997) observaron una TA constante independiente del tiempo de experimentación en M. trossulus expuesto a las siguientes combinaciones de dietas: 5, 20 y 150 x 103 cél Thalassiosira pseudonana mL–1, con 0, 5, 20 y 50 mg L–1 de sedimento. Estos autores notaron una excepción con la dieta que contenía 5 x 103 cél mL–1 y 5 mg L–1 de sedimento, con la que se observó una significativa reducción de TA con el tiempo de experimentación.
En las relaciones entre TA y el contenido de clorofila se observó una respuesta diferencial de TA en el tiempo, que dependió de la clorofila. Las diferentes regresiones estadísticas confirman que el tiempo de experimentación ejerce un efecto significativo en TA, que se manifiesta principalmente en su reducción a bajos niveles de clorofila. Los resultados aquí presentados indican que la TA observada en la etapa final del experimento corresponde a un comportamiento de tipo inhibitorio, con un incremento creciente en TA conforme aumenta el contenido de clorofila, hasta llegar a una TA óptima a un nivel intermedio de clorofila. Esto es inmediatamente seguido de un descenso gradual en TA. La relación entre ambas variables en esta etapa es diferente dependiendo del contenido de clorofila, ya que se observa un cambio abrupto en el comportamiento entre 2.08 y 26.91 µg Chla L–1, que a su vez resulta en tres diferentes curvas de respuesta (fig. 4a):
• Aumento exponencial de TA con dietas con un contenido menor a 2.08 µg Chla L–1.
• TA constante con dietas con dietas con un contenido entre 2.08 y 26.91 µg Chla L–1.
• Reducción potencial de TA con dietas con un contenido mayor a 26.91 µg Chla L–1.
Al usar la MOP como variable independiente en lugar del contenido de clorofila se observó el mismo patrón de comportamiento, no obstante la varianza explicada por el modelo de regresión fue menor que para el ajuste con la clorofila. Se observó un aumento exponencial en TA con las dietas con menos de aproximadamente 0.4 mg MOP L–1, la fase constante con dietas con entre 0.4 y 1.7 mg MOP L–1, y la potencial reducción de TA con dietas con más de 1.7 mg MOP L–1. Este patrón de respuesta ha sido explicado teóricamente en términos de MPT por Winter (1978), quien afirma que por encima del umbral de baja concentración, la tasa de filtración se incrementa rápidamente y después se mantiene constante hasta llegar a una concentración de alimento a la cual se alcanza la ingesta alimenticia máxima. Tan pronto como se logra esta máxima tasa de ingestión, la tasa de filtración disminuye de manera continua para que la ingesta alimenticia permanezca constante. Esta explicación es congruente con lo observado por Widdows et al. (1979) en el sentido de que por encima del umbral de producción de pseudoheces, el equilibrio entre TA y la producción de pseudoheces proporciona a M. edulis una tasa de ingestión constante. Este patrón es similar al observado por James et al. (2001) y Hawkins et al. (1999) en Perna canaliculus, por Hawkins et al. (2001) en Chlamys farreri, y recientemente por Pascoe et al. (2009) y Strohmeier et al. (2009) en M. edulis. La respuesta diferencial de TA con la composición de la dieta demuestra su gran flexibilidad de respuesta. A bajas concentraciones de alimento, la regulación de TA puede estar condicionada por el desequilibrio entre el costo y el rendimiento energético del proceso alimenticio (Widdows y Hawkins 1989). Por otra parte, a altas concentraciones de alimento la TA podría estar siendo regulada para mantener una tasa de ingestión constante (Winter 1973, 1978; Widdows et al. 1979; James et al. 2001). Consistentemente, Hawkins et al. (2001) sugieren que el volumen del tracto digestivo podría ser una limitante morfológica que controle esta respuesta. En este contexto, Willows (1992) desarrolló un modelo teórico que supone un tracto digestivo siempre lleno, y por lo tanto sería el equilibrio entre tasa de ingestión y tiempo de residencia en el tracto digestivo el mecanismo que regularía la TA.
Umbral de activación
Thompson y Bayne (1972) observaron la ausencia de actividad filtradora antes de suministrar el alimento a M. edulis, seguida de un súbito incremento en la TA tras la adición del mismo. Esto sugiere la existencia de un umbral por debajo del cual se inactiva la filtración. Winter (1978) y Newell et al. (2001) también sugieren la existencia de este umbral. El umbral de activación de M. edulis ha sido establecido para dietas que contienen de 0.5 a 1.0 µg Chla L–1 (ver revisión de Dolmer 2000, Pascoe et al. 2009). Los resultados del presente estudio no muestran una reducción total de TA con ninguna de las dietas experimentales (fig. 2); sin embargo se observó su disminución significativa con el tiempo de experimentación (tabla 2) cuando se suministró a los mejillones dietas con menos de 2.08 µg Chla L–1 (fig. 2a). En estos tratamientos, el coeficiente de variación de Pearson para TA fue significativamente mayor durante el período final de experimentación (fig. 4b), mostrando una gran variabilidad entre individuos. Este fenómeno es causado por una respuesta de tipo "todo o nada"; es decir, que algunos individuos filtran a su máxima capacidad mientras otros reducen abruptamente su actividad filtradora. Nuestros resultados concuerdan con los de Pascoe et al. (2009), quienes observaron que el número de animales que se alimentaban era menor cuando se suministraban dietas de baja concentración. De la misma manera, su estudio resalta una mayor desviación estándar en la respuesta con dietas de baja concentración. Esta respuesta dicotómica sugiere la existencia de un mecanismo de tipo encendido/apagado en lugar de uno de control progresivo, como lo indica Bernard (1983).
Dada la definición del "umbral de activación" y la ausencia de un cese de la filtración generalizado en todos los individuos con la misma dieta, los resultados del presente estudio no permitieron una cuantificación estricta de dicho umbral; sin embargo, en las condiciones experimentales descritas se podría dar una abrupta reducción en la TA de algunos individuos de M. galloprovincialis ante un contenido de clorofila <2.08 µg Chla L–1. Esta concentración de clorofila podría representar el umbral de activación debajo del cual el costo energético de alimentarse no es compensado por el aporte de energía del alimento ingerido (Widdows y Hawkins 1989). La reducción de TA tras la exposición prolongada a dietas pobres podría ser interpretada como una respuesta fisiológica desarrollada para reducir el transporte de agua a través de las branquias y la cavidad paleal, y así disminuir la respiración y la tasa metabólica (Jergensen et al. 1988). La TA residual observada en algunos individuos podría ser interpretada como una apertura parcial de las valvas que permite disminuir la tasa metabólica y evitar la activación de la fase anaerobia del metabolismo (Widdows et al. 1979).
Umbral de saturación
En diversos estudios se ha observado una disminución de TA en mejillones alimentados con dietas ricas en clorofila. Riisgård (1991) y Clausen y Riisgård (1996) establecieron que la TA de M. edulis disminuye cuando su dieta contiene más de ~19 y 16.25 µg Chla L–1, respectivamente. Recientemente Pascoe et al. (2009) establecieron este umbral a ~6 µg Chla L–1. En el caso de Perna canaliculus, Hawkins et al. (1999) observaron un umbral a 1.11 ± 0.42 µg Chla L–1, mientras que James et al. (2001) reportaron uno a 0.45 µg Chla L–1. Hawkins et al. (2001) observaron una TA máxima en Chlamys farreri alimentada con 5 µg Chla L–1, que disminuyó con concentraciones de clorofila mayores.
Los resultados del presente estudio confirman que, en las condiciones experimentales descritas, las dietas con más de 26.91 µg Chla L–1 causan una disminución de la TA en M. galloprovincialis. Esta reducción se observó en todos los experimentos (fig. 3a). El bajo coeficiente de variación de Pearson para la relación entre TA y contenido de clorofila observado en estos tratamientos durante la etapa final de experimentación (fig. 4b) sugiere una TA homogénea para todos los individuos; es decir, que a altas concentraciones de clorofila no se observa la respuesta de tipo "todo o nada". Este comportamiento homogéneo y la disminución continua de TA con la clorofila (regresión potencial; fig. 4a) podrían estar sugiriendo que la disminución de TA por saturación es más bien controlada por un umbral progresivo que por un mecanismo de tipo "encendido/apagado".
La reducción de TA a altas concentraciones de alimento ha sido estudiada ampliamente; no obstante aún no existe un consenso general para explicar este comportamiento (Widdows et al. 1979; Kierboe et al. 1980; Riisgård 1991; Newell y Shumway 1993; Clausen y Riisgård 1996; Smaal y Twisk 1997; Hawkins et al. 1999, 2001; James et al. 2001; Velasco y Navarro 2002). Los resultados del presente estudio muestran una relación estadísticamente significativa entre TA y contenido de clorofila, sugiriendo que TA es regulada por la concentración de alimento, lo que a su vez significa que ésta no es una simple respuesta a la exposición a condiciones adversas. Este comportamiento podría ser explicado como un ajuste fisiológico para la optimización energética (Winter 1978, Bayne et al. 1993, Velasco y Navarro 2002), un proceso en el que también podrían estar involucrados la selección y el rechazo de alimento a nivel del ctenidio y los palpos labiales (Shumway et al. 1985, Bayne et al. 1993, Ward y Shumway 2004).
En conclusión, los valores de TA reportados en el presente trabajo concuerdan con los observados en Mytilus galloprovincialis en condiciones naturales (Navarro et al. 1991, Iglesias et al. 1996, Babarro et al. 2000). Considerando el cambio de TA a lo largo del experimento, nuestros resultados sugieren que el tiempo tiene un efecto significativo en TA que se manifiesta en su reducción ante contenidos extremos de clorofila. Esta reducción es mayor con dietas de bajo contenido de clorofila que con dietas ricas en clorofila. A pesar de que el umbral de activación no ha podido ser estrictamente definido, la exposición prolongada a dietas con menos de 2.08 µg Chla L–1, o aproximadamente 0.4 mg MOP L–1, dada la fuerte correlación entre los contenidos de clorofila y materia orgánica, causaron el cambio abrupto de la TA en algunos individuos. Esta respuesta es controlada por un mecanismo de tipo "encendido/apagado": individuos que filtran a su máxima capacidad mientas que otros lo hacen a TAs reducidas. A partir de este umbral de clorofila hacia arriba, los mejillones filtran a su máxima capacidad hasta llegar al umbral de saturación, un umbral progresivo que se inicia a alrededor de 26.91 µg Chla L–1, o aproximadamente 1.7 mg MOP L–1. El patrón de comportamiento de TA durante la etapa final de nuestro experimento concuerda con los patrones identificados en otros estudios (Hawkins et al. 1999, 2001; James et al. 2001; Pascoe et al. 2009) y con la teoría (Winter 1978), en el sentido de que la TA de M. galloprovincialis muestra un comportamiento sumamente flexible dependiendo de las características de su dieta.
Agradecimientos
Este estudio fue apoyado por el contrato–proyecto PROINSA código CSIC 2004448, por los proyectos Xunta de Galicia PGDIT03RMA13E y UE MABENE EVK3–2001–00144. R Filgueira fue apoyado por CSIC–Xunta de Galicia y Caixanova con una beca para entrenamiento científico. Agradecemos a L Nieto, B González y R Salgueiro (CSIC–España) su asistencia técnica en el laboratorio.
Referencias
Arifin Z, Bendell–Young LI. 1997. Feeding response and carbon assimilation by the blue mussel Mytilus trossulus exposed to environmentally relevant seston matrices. Mar. Ecol. Prog. Ser. 160: 241–253. [ Links ]
Babarro JMF, Fernández–Reiriz MJ, Labarta U. 2000. Feeding behaviour of seed mussel Mytilus galloprovincialis: Environmental parameters and seed origin. J. Shellfish Res. 19: 195–201. [ Links ]
Bayne BL. 1998. The physiology of suspension feeding by bivalve molluscs: An introduction to the Plymouth "TROPHEE" workshop. J. Exp. Mar. Biol. Ecol. 219: 1–19. [ Links ]
Bayne BL. 2001. Reply to comment by Riisgård HU. Ophelia 54: 211. [ Links ]
Bayne BL, Iglesias JIP, Hawkins AJS, Navarro E, Héral M, Deslous–Paoli JM. 1993. Feeding behaviour of the mussel Mytilus edulis: Responses to variations in quantity and organic content of the seston. J. Mar. Biol. Assoc. UK 73: 813–829. [ Links ]
Bernard FR. 1983. Physiology and mariculture of some northeastern Pacific bivalve molluscs. Can. Spec. Publ. Fish. Aquat. Sci. No. 63, 24 pp. [ Links ]
Clausen IB, Riisgård HU. 1996. Growth, filtration and respiration in the mussel Mytilus edulis: No evidence for physiological regulation of the filter–pump to nutritional needs. Mar. Ecol. Prog. Ser. 141: 37–45. [ Links ]
Dolmer P. 2000. Feeding activity of mussels Mytilus edulis related to near–bed currents and phytoplankton biomass. J. Sea Res. 44: 221–231. [ Links ]
Filgueira R, Labarta U, Fernández–Reiriz MJ. 2006. Flow–through chamber method for clearance rate measurements in bivalves. Design and validation of individual chambers and mesocosm. Limnol. Oceanogr. Methods 4: 284–292. [ Links ]
Filgueira R, Labarta U, Fernández–Reiriz MJ. 2008. Effect of condition index on allometric relationships of clearance rate in Mytilus galloprovincialis Lamarck, 1819. Rev. Biol. Mar. Oceanogr. 43: 391–398. [ Links ]
Freites L, Fernández–Reiriz MJ, Labarta U. 2003. Biochemical composition and energy content of the mussel Mytilus galloprovincialis of subtidal and rocky shore origin: Influence of environmental variables and source of mussel seed. Cienc. Mar. 29: 603–619. [ Links ]
Hawkins AJS, Smith RFM, Bayne BL, Héral M. 1996. Novel observations underlying the fast growth of suspension–feeding shellfish in turbid environments: Mytilus edulis. Mar. Ecol. Prog. Ser. 131: 179–190. [ Links ]
Hawkins AJS, James MR, Hickman RW, Hatton S, Weatherhead M. 1999. Modelling of suspension feeding and growth in the green–lipped mussel Perna canaliculus exposed to natural and experimental variations of seston availability in the Marlborough Sounds, New Zealand. Mar. Ecol. Prog. Ser. 191: 217–232. [ Links ]
Hawkins AJS, Fang JG, Pascoe PL, Zhang JH, Zhang XL, Zhu MY. 2001. Modelling short–term responsive adjustments in particle clearance rate among bivalve suspension–feeders: Separate unimodal effects of seston volume and composition in the scallop Chlamys farreri. J. Exp. Mar. Biol. Ecol. 262: 61–73. [ Links ]
Iglesias JIP, Pérez–Camacho A, Navarro E, Labarta U, Beiras R, Hawkins AJS, Widdows J. 1996. Microgeographic variability in feeding, absorption and condition of mussels (Mytilus galloprovincialis Lmk.): A transplant experiment. J. Shellfish Res. 15: 673–680. [ Links ]
James MR, Weatherhead MA, Ross AH. 2001. Size–specific clearance, excretion, and respiration rates, and phytoplankton selectivity for the mussel Perna canaliculus at low levels of natural food. N.Z. J. Mar. Freshwat. Res. 35: 73–86. [ Links ]
Jeffrey SW, Welschmeyer NA. 1997. Spectrophotometric and fluorometric equations in common use in oceanography. In: Jeffrey SW, Montura RFC, Wright SW (eds.), Phytoplankton Pigments in Oceanography. UNESCO, Paris, pp. 597–615. [ Links ]
Jørgensen CB. 1996. Bivalve filter feeding revisited. Mar. Ecol. Prog. Ser. 142: 287–302. [ Links ]
Jørgensen CB, Larsen PS, Møhlenberg F, Riisgård HU. 1988. The bivalve pump. Mar. Ecol. Prog. Ser. 34: 69–77. [ Links ]
Kiørboe T, Møhlenberg F, Nøhr O. 1980. Feeding, particle selection and carbon absorption in Mytilus edulis in different mixtures of algae and resuspended bottom material. Ophelia 19: 193–205. [ Links ]
Murado MA, González MP, Vázquez JA. 2002. Dose–response relationships: An overview, a generative model and its application to the verification of descriptive models. Enzyme Microb. Technol. 31: 439–455. [ Links ]
Navarro E, Iglesias JIP, Pérez–Camacho A, Labarta U, Beiras R. 1991. The physiological energetics of mussels (Mytilus galloprovincialis Lmk) from different cultivation rafts in the Ría de Arosa (Galicia, NW Spain). Aquaculture 94: 197–212. [ Links ]
Newell CR, Shumway SE. 1993. Grazing of natural particulates by bivalve molluscs: Spatial and temporal perspective. In: Dame RD (ed.), Bivalve Filter Feeders in Estuarine and Coastal Ecosystem Processes. Springer–Verlag, Berlin, pp. 85–148. [ Links ]
Newell CR, Wildish DJ, MacDonald BA. 2001. The effects of velocity and seston concentration on the exhalant siphon area, valve gape and filtration rate of the mussel Mytilus edulis. J. Exp. Mar. Biol. Ecol. 262: 91–111. [ Links ]
Pascoe PL, Parry HE, Hawkins AJS. 2009. Observations on the measurement and interpretation of clearance rate variations in suspension–feeding bivalve shellfish. Aquat. Biol. doi: 10.3354/ab00123. [ Links ]
Riisgård HU. 1991. Filtration rate and growth in the blue mussel, Mytilus edulis Linneaus, 1758: Dependence on algal concentration. J. Shellfish Res. 10: 29–35. [ Links ]
Riisgård HU. 2001a. Physiological regulation versus autonomous filtration in filter–feeding bivalves: Starting points for progress. Ophelia 54: 193–209. [ Links ]
Riisgård HU. 2001b. On measurement of filtration rates in bivalves – the stony road to reliable data: Review and interpretation. Mar. Ecol. Prog. Ser. 211: 275–291. [ Links ]
Riisgård HU, Randløv A. 1981. Energy budgets, growth and filtration rates in Mytilus edulis at different algal concentration. Mar. Biol. 61: 227–234. [ Links ]
Shumway SE, Cucci TL, Yentsch CM. 1985. Particle selection, ingestion, and absortion in filter–feeding bivalves. J. Exp. Mar. Biol. Ecol. 91: 77–92. [ Links ]
Smaal AC, Twisk F. 1997. Filtration and absorption of Phaeocystis cf. globosa by the mussel Mytilus edulis L. J. Exp. Mar. Biol. Ecol. 209: 33–46. [ Links ]
Strohmeier T, Strand Ø, Cranford P. 2009. Clearance rates of the great scallop (Pecten maximus) and blue mussel (Mytilus edulis) at low natural seston concentrations. Mar. Biol. 156: 1781–1795. [ Links ]
Thompson R, Bayne BL. 1972. Active metabolism associated with feeding in the mussel Mytilus edulis L. J. Exp. Mar. Biol. Ecol. 9: 111–124. [ Links ]
Velasco LA, Navarro JM. 2002. Feeding physiology of infaunal (Mulinia edulis) and epifaunal (Mytilus chilensis) bivalves under a wide range of concentrations and qualities of seston. Mar. Ecol. Prog. Ser. 240: 143–155. [ Links ]
Ward JE, Shumway SE. 2004. Separating the grain from the chaff: Particle selection in suspension– and deposit–feeding bivalves. J. Exp. Mar. Biol. Ecol. 300: 83–130. [ Links ]
Widdows J, Hawkins AJS. 1989. Partitioning of rate of heat dissipation by Mytilus edulis into maintenance, feeding and growth components. Physiol. Zool. 62: 764–784. [ Links ]
Widdows J, Fieth P, Worrall CM. 1979. Relationships between seston, available food and feeding activity in the common mussel Mytilus edulis. Mar. Biol. 50: 195–207. [ Links ]
Willows RI. 1992. Optimal digestive investment: A model for filter feeders experiencing variable diets. Limnol. Oceanogr. 37: 829–847. [ Links ]
Winter JE. 1973. The filtration rate of Mytilus edulis and its dependence on algal concentration, measured by a continuous automatic recording apparatus. Mar. Biol. 22: 317–328. [ Links ]
Winter JE. 1978. A review on the knowledge of suspension–feeding in lamellibranchiate bivalves, with special reference to artificial aquaculture systems. Aquaculture 13: 1–33. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF
Traducido al español por Manuel Gardea Ojeda.















