Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.35 n.2 Ensenada Jun. 2009
Nota de investigación
Growth characteristics of skeletons of Montastraea annularis (Cnidaria: Scleractinia) from the northwest coast of Cuba*
Características del crecimiento de los esqueletos de Montastraea annularis (Cnidaria: Scleractinia) de la costa noroccidental de Cuba
JP Carricart–Ganivet1, P González–Díaz2
1 El Colegio de la Frontera Sur, Unidad Chetumal, Av. Centenario Km 5.5, Apdo. Postal 424, Chetumal, Quintana Roo, 77000, México. E–mail: carricart@ecosur.mx
2 Centro de Investigaciones Marinas, Universidad de La Habana, Calle 16 # 114e/1ra y 3ra, Miramar, Playa, C.H., Cuba.
Recibido en abril de 2008.
Aceptado en marzo de 2009.
Abstract
Growth characteristics (extension rate, density, and calcification rate) were determined using annual growth bands in skeletons of the reef–building coral Montastraea annularis, collected at 10 m depth on the northwest coast of Cuba. X–radiography contact prints revealed that the high–density band is formed during the warmest months of the year. Growth characteristics obtained were within the range of values presented by other authors forM. annularis in reefs distributed throughout the Atlantic. The relationships among the measured growth characteristics were similar to those previously described by other authors. The relationship found between calcification rate and sea surface temperature gradient in the Caribbean suggests that populations of M. annularis on the northwest coast of Cuba are related to populations of this species from the Caribbean and not to those from the Gulf of Mexico.
Key words: calcification rate, Cuba, density, extension rate, proxy environmental records.
Resumen
Se determinaron las características del crecimiento (tasa de extensión, densidad y tasa de calcificación) utilizando las bandas de crecimiento anual de ejemplares del coral constructor de arrecifes Montastraea annularis, recolectados a 10 m de profundidad en la costa noroccidental de Cuba. Las bandas de alta densidad se formaron durante los meses más calidos del año. Las características del crecimiento obtenidas estuvieron dentro de los intervalos de valores estimados por otros autores para esta especie en arrecifes del Atlántico. Las relaciones observadas entre las características del crecimiento medidas fueron similares a las descritas previamente por otros autores. La relación observada entre la tasa de calcificación y el gradiente de temperatura del agua superficial en el Caribe sugiere que la población de M. annularis en la costa noroccidental de Cuba está relacionada con las poblaciones de esta especie del Caribe y no con las del Golfo de México.
Palabras clave: Cuba, densidad, tasa de calcificación, tasa de extensión, registros ambientales proxy.
Introducción
Knutson et al. (1972) descubrieron que los esqueletos de algunos corales escleractínios masivos exhiben un patrón de crecimiento anual en forma de pares de bandas de alta y baja densidad, el cual se observa en radiografías tomadas a lajas de esqueleto coralino obtenidas del eje de crecimiento máximo. Como los registros existentes de proxy climáticos de alta resolución en los océanos tropicales son muy escasos, este bandeo ha proporcionado información muy valiosa acerca del crecimiento del esqueleto coralino, las tasas de crecimiento y las condiciones ambientales en las cuales tuvo lugar el crecimiento en estás zonas (e.g., Wórum et al. 2007, Horta–Puga y Carriquiry 2008). Las características del crecimiento anual obtenidas a partir del patrón de bandas de densidad, i.e., la densidad esquelética (g cm–3), incluyen la tasa de extensión anual (cm año–1) y la tasa de calcificación anual (g cm–2 año–1). La tasa de calcificación anual se calcula multiplicando la densidad anual media del esqueleto por la tasa de extensión anual correspondiente (Dodge y Brass 1984).
Los corales masivos del género Montastraea se consideran los constructores arrecifales más importantes del Atlántico tropical (Goreau 1959, Weil y Knowlton 1994). Este género está representado en el Atlántico Occidental por cuatro especies vivientes: M. annularis, M. faveolata, M. franksi y M. cavernosa (Weil y Knowlton 1994, Cairns 1999). Las características del crecimiento de estas especies se han utilizado para estudiar cambios ambientales tanto locales como globales (e.g., Druffel 1982, Dodge and Lang 1983). Sin embargo, existen numerosas localidades en esta región en las que no se ha realizado investigación alguna sobre el crecimiento del género.
Una gran proporción de los 3200 km de costa de Cuba se encuentra bordeada por numerosos bancos arrecifales y arrecifes de franja, de los cuales alrededor del 50% se encuentra separado de tierra firme por cayos o lagunas someras que contienen arrecifes en forma de parches (Lang et al. 1998, Alcolado et al. 2000). Considerando que a la fecha no se ha realizado investigación alguna sobre el crecimiento coralino en esta zona del Atlántico, el propósito de este documento es añadir información acerca de la extensión esqueletal, la densidad y la tasa de calcificación a los bancos de datos de crecimiento esqueletal del coral constructor dominante Montastraea annularis (Ellis y Solander 1786) en dos zonas de la costa noroccidental de Cuba, con el fin de incrementar este tipo de observaciones en el Atlántico tropical y, en general, el conocimiento acerca del crecimiento coralino.
Materiales y métodos
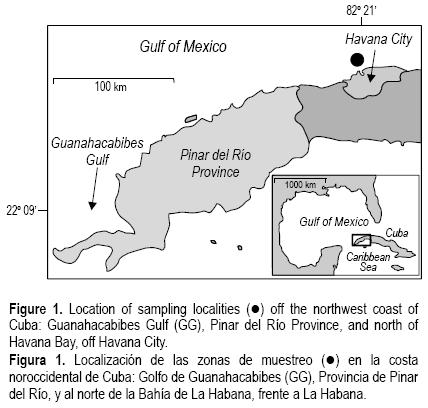
En enero de 2004 se recolectaron 11 colonias de M. annularis de entre 10 y 15 cm de altura, a 10 m de profundidad, en dos arrecifes de la costa noroccidental de Cuba (fig. 1), uno en el Golfo de Guanahacabibes, frente a la Provincia de Pinar del Río (22°09'45" N, 84°46'37" W), y el otro al norte de la Bahía de La Habana (23°07'73" N, 82°25'24" W). Se midió la tasa de extensión (cm año–1) con la técnica radiográfica convencional (Knutson et al. 1972). Posteriormente se cortaron lajas de 0.7 ± 0.1 cm de ancho, paralelas al eje de crecimiento máximo, con una sierra de roca. Las lajas se radiografiaron con una exposición de 38 kVp por 5 mAs (50 mA por 0.10 s), a 1 m de la fuente.
Se imprimieron positivos en blanco y negro de cada una de las radiografías, sobre los que se identificaron y midieron las bandas de crecimiento de mediados del verano de un año a mediados del verano del año siguiente (Hudson et al. 1976), siguiendo el eje de crecimiento máximo, utilizando un vernier digital (0.001 mm de precisión) (Carricart–Ganivet et al. 1994). Para medir la densidad (g cm–3), cada una de las bandas de crecimiento anual se cortó de la laja a lo largo del borde más reciente de la banda de alta densidad. La densidad se midió por triplicado en cada uno de los fragmentos obtenidos siguiendo el método de congelamiento propuesto por Carricart–Ganivet et al. (2000). Cada fragmento fue sumergido en agua destilada por 24 h para asegurar la infiltración en todos los intersticios del esqueleto y se congeló aún sumergido. El hielo sobresaliente de los bordes se retiró utilizando un bisturí; en caso necesario se cortó parte del esqueleto para asegurarse que todo el hielo excedente fuera eliminado. Posteriormente, cada uno de los fragmentos se pesó en una balanza analítica con una precisión de 0.001 g antes de su descongelamiento, y todos se secaron por 48 h en un horno a 80°C antes de pesarlos nuevamente. La densidad de cada banda de crecimiento se calculó usando la formula siguiente:
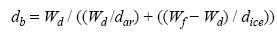
donde db es la densidad de la banda de crecimiento (g cm–3); Wd es el peso seco del fragmento (g); dar es la densidad de la aragonita, 2.93 g cm–3 (Liley y Gambill 1986); Wf es el peso congelado del fragmento (g); y dice es la densidad del hielo, 0.915 g cm–3 (Liley y Gambill, 1986). La tasa anual de calcificación (g cm–2 año–1) se calculó multiplicando la densidad media de cada banda de crecimiento por la tasa de extensión correspondiente.
Se obtuvieron dos grupos de datos de temperatura superficial del agua (SST por su siglas en inglés), cada uno asociado con cada localidad de muestreo (fig. 1) para el periodo de 1991 a 2003, a partir del conjunto de datos HadISST del Met Office Hadley Centre, del Reino Unido (ver Rayner et al. 2003).
Resultados
Se obtuvieron impresiones fotográficas por contacto, de ocho de los ejemplares que presentaron un bandeo claro y sin ambigüedades: seis recolectados de arrecifes al norte de la Bahía de La Habana y dos de arrecifes del Golfo de Guanahacabibes. La banda de crecimiento de baja densidad se observó en el ápice de todos los especímenes (fig. 2).

Se obtuvieron valores de extensión esqueletal, densidad y tasa de calcificación de 42 bandas de crecimiento anual. El número de bandas en promedio por espécimen fue de 7, variando de 3 a 13 en los ocho especímenes. No se observaron diferencias significativas en los tres parámetros de crecimiento entre las dos localidades de muestreo (prueba t para muestras independientes, P > 0.05 en ambos casos). El promedio de la tasa de extensión esqueletal resultó de 0.76 cm año–1 con un mínimo de 0.38 cm año–1 y un máximo de 1.24 cm año–1. La densidad media fue de 1.65 g cm–3, con un mínimo y máximo de 1.36 y 2.08 g cm–3, respectivamente. La tasa media de calcificación fue de 1.26 g cm–2 año–1, y tuvo una variación de 0.65 a 1.91 g cm–2 año–1.
No se observaron relaciones entre densidad y tasa de extensión, ni entre densidad y tasa de calcificación (fig. 3a, b). Los parámetros de crecimiento con mayor variabilidad fueron las tasas de extensión y de calcificación, con un coeficiente de variación de 15.7% y 19.3%, respectivamente. La densidad tuvo un coeficiente de variación de 6.6%.
Finalmente, la tasa de calcificación media obtenida en ambas localidades de recolecta se ajustó a la relación de este parámetro y al gradiente ambiental de temperatura del agua superficial del Caribe observado por Carricart–Ganivet (2004) (fig. 4).

Discusión
Varios autores han asociado la formación de bandas de alta densidad en las especies de Montastraea en el Atlántico tropical con mayores temperaturas del agua superficial (e.g., Hudson 1981; Dodge y Brass 1984; Carricart–Ganivet et al. 1994, 2000; Cruz–Piñón et al. 2003; Carricart–Ganivet 2007). Barnes y Lough (1996) hicieron notar que existen contradicciones entre las fechas de formación de las bandas de baja y alta densidad publicadas, de manera que existen trabajos que registran la formación de la banda de alta densidad durante el verano y otros que aseguran lo contrario.
Sin embargo, para las especies de Montastraea, Carricart–Ganivet (2007) y Dávalos–Dehullu et al. (2008) demostraron que la calcificación se incrementa durante los meses más cálidos del año, dando como resultado estructuras más gruesas y esqueletos más densos que los construidos durante los meses más fríos. En consecuencia y tomando en consideración que todos los especímenes utilizados en el presente trabajo se recolectaron en enero y que en todos los contactos impresos la banda de baja densidad se observa en el ápice de la laja, es razonable pensar que en la costa noroccidental de Cuba, al igual que en otros arrecifes del Atlántico, M. annularis deposita su banda anual de alta densidad durante los meses más cálidos del año.
Los valores obtenidos de los tres parámetros se encuentran dentro del intervalo de valores reportado por otros autores para M. annularis en arrecifes del Océano Atlántico (tabla 1), y esta variabilidad observada puede explicarse en términos de la variabilidad en las condiciones ambientales relacionadas con el crecimiento coralino, como temperatura, profundidad, turbidez, tasa de sedimentación, nutrientes y exposición al oleaje, lo que representa en gran medida el rango de tolerancia de las especies (Carricart–Ganivet 2007). Además, algunos de los trabajos previos sobre el crecimiento de M. annularis no consideraron que esta especie en realidad pertenece a un complejo de especies hermanas (Knowlton et al. 1992, Weil y Knowlton 1994).
Las relaciones observadas entre los tres parámetros de crecimiento (fig. 3) son similares a las descritas previamente para M. annularis cuando crece en un solo arrecife (ver Dodge y Brass 1984, Carricart–Ganivet et al. 2000, Carricart–Ganivet y Merino 2001, Carricart–Ganivet 2004). En la curva de regresión de los valores de crecimiento anual en los dos arrecifes (fig. 3c) se observa una fuerte relación positiva entre las tasas de extensión y de calcificación (los años con una extensión alta son los años de alta calcificación y viceversa), lo que indica que las variaciones en la tasa de calcificación están más estrechamente relacionadas con las variaciones en la tasa de extensión que con las variaciones en la densidad. El que la densidad resultara el parámetro de crecimiento más conservador indica que esta correlación puede ser resultado de la forma en la que se calculó la tasa de calcificación, es decir, como el producto de un parámetro muy variable (tasa de extensión) y un parámetro poco variable (densidad). Adicionalmente, dado que las especies de Montastraea incrementan su calcificación para construir esqueletos más densos, y la calcificación se incrementa con lan la SST (Carricart–Ganivet 2004), esta relación sólo es posible en un mismo arrecife, con pequeñas variaciones de SST.
El hecho de que la tasa media de calcificación obtenida en ambas localidades se ajuste a la relación de este parámetro de crecimiento con el gradiente ambiental de SST observado en el Caribe por Carricart–Ganivet (2004) fue inesperado, ya que la costa noroccidental de Cuba se considera geográficamente como parte del Golfo de México. Este resultado sugiere que las poblaciones de M. annularis en la costa noroccidental de Cuba tienen mayor relación con las del Caribe que con las del Golfo de México, lo que sólo puede explicarse en términos de un pobre transporte de larvas y de aislamiento genético. Carricart–Ganivet (2004) encontró dos relaciones separadas entre tasa de calcificación y SST en el Golfo de México y el Caribe. Con base en las condiciones oceanográficas y las surgencias en la zona norte de la Península de Yucatán (Merino 1997; Zavala et al. 2002, 2003), este autor sugirió que las poblaciones de M. annularis del Golfo de México y del Caribe podrían estar aisladas genéticamente y tener una conectividad de larvas muy pobre como se ha observado en otras especies de corales (Jordán–Dahlgren 1992, 2002).
Agradecimientos
Esta investigación contó con el apoyo de fondos del CONACyT (proyecto U48757–F). Los comentarios de un revisor anónimo mejoraron sustancialmente este manuscrito. Agradecemos a I Rodríguez–Mauri y a C Varela (Centro de Investigaciones Marinas, Universidad de La Habana) por su asistencia en las colectas. AU Beltrán–Torres y FG Pool–Jiménez (ECOSUR) auxiliaron con el trabajo de laboratorio, H Bahena–Basave (ECOSUR) realizó la impresión de los contactos y D Guggenheim (Harte Research Institute) patrocinó parte del trabajo de campo.
Referencias
Alcolado PM, Claro R, Martínez–Daranas B, Menéndez–Macías G, García–Parrado P, Cantelar–Ramos K, Espinosa–Sáez J, del Valle–García R, Martínez–Iglesias JC, Neff T. 2000. Estado general de los arrecifes coralinos de Cuba y propuestas de manejo ambiental. Informe Final del Proyecto. Instituto de Oceanología, La Habana. [ Links ]
Baker PA, Weber JN. 1975. Coral growth rate: Variation with depth. Earth Planet. Sci. Lett. 27: 57–61. [ Links ]
Barnes DJ, Lough JM. 1996. Coral skeletons: Storage and recovery of environmental information. Global Change Biol. 2: 569–582. [ Links ]
Cairns SD. 1999. Species richness of recent Scleractinia. Atoll Res. Bull. 59: 1–16. [ Links ]
Carricart–Ganivet JP. 2004. Sea surface temperature and the growth of the West Atlantic reef–building coral Montastraea annularis. J. Exp. Mar. Biol. Ecol. 302: 249–260. [ Links ]
Carricart–Ganivet JP. 2007. Annual density banding in massive coral skeletons: Result of growth strategies to inhabit reefs with high microborers' activity? Mar. Biol. 153: 1–5. [ Links ]
Carricart–Ganivet JP, Merino M. 2001. Growth responses of the reef building coral Montastraea annularis along a gradient of continental influence in the southern Gulf of Mexico. Bull. Mar. Sci. 68: 133–146. [ Links ]
Carricart–Ganivet JP, Horta–Puga G, Ruiz–Zárate MA, Ruiz–Zárate E. 1994. Tasas retrospectivas de crecimiento del coral hermatípico Montastrea annularis (Scleractinia: Faviidae) en arrecifes al sur del Golfo de México. Rev. Biol. Trop. 42: 517–523. [ Links ]
Carricart–Ganivet JP, Beltrán–Torres AU, Merino M, Ruiz–Zárate MA. 2000. Skeletal extension, density and calcification rate of the reef building coral Montastraea annularis (Ellis and Solander) in the Mexican Caribbean. Bull. Mar. Sci. 66: 215–224. [ Links ]
Cruz–Piñón G, Carricart–Ganivet JP, Espinoza–Avalos J. 2003. Monthly skeletal extension rates of the hermatypic corals Montastraea annularis and Montastraea faveolata: Biological and environmental controls. Mar. Biol. 143: 491–500. [ Links ]
Dávalos–Dehullu E, Hernández–Arana H, Carricart–Ganivet JP. 2008. On the causes of density banding in skeletons of corals of the genus Montastraea. J. Exp. Mar. Biol. Ecol. 365: 142–147. [ Links ]
Dodge RE, Lang JC. 1983. Environmental correlates of hermatypic coral (Montastrea annularis) growth on the East Flower Gardens Bank, northwest Gulf of Mexico. Limnol. Oceanogr. 28: 228–240. [ Links ]
Dodge RE, Brass GW. 1984. Skeletal extension, density and calcification of the reef coral, Montastrea annularis: St. Croix, US Virgin Islands. Bull. Mar. Sci. 34: 288–307. [ Links ]
Druffel EM. 1982. Banded corals: Changes in oceanic carbon–14 during the Little Ice Age. Science 218: 13–19. [ Links ]
Dustan P. 1975. Growth and form in the reef building coral Montastrea annularis. Mar. Biol. 33: 101–107. [ Links ]
Goreau TF. 1959. The ecology of Jamaican coral reefs. I. Species composition and zonation. Ecology 40: 67–90. [ Links ]
Graus RR, Macintyre IG. 1982. Variation in growth forms of the reef coral Montastrea annularis (Ellis and Solander): A cuantitative evaluation of growth response to light distribution using computer simulation. In: Rutzler K, Macintyre IG (eds.), The Atlantic Barrier Reef ecosystem at Carrie Bow Cay, Belize. Scientific Reports I, Smithsonian Contributions to the Marine Sciences, No. 12, Smithsonian Institution Press, Washington DC, pp. 441–464. [ Links ]
Horta–Puga G, Carriquiry JD. 2008. Growth of the hermatypic Montastraea cavernosa in the Veracruz Reef System. Cienc. Mar. 34: 107–112. [ Links ]
Hudson JH. 1981. Growth rates in Montastrea annularis: A record of environmental change in Key Largo Coral Reef Marine Sanctuary, Florida. Bull. Mar. Sci. 31: 444–459. [ Links ]
Hudson JH, Shinn EA, Halley RB, Lidz B. 1976. Sclerochronology: A tool for interpreting past environments. Geology 4: 361–364. [ Links ]
Jordán–Dahlgren E. 1992. Recolonization patterns of Acropora palmata in a marginal environment. Bull. Mar. Sci. 51: 104–117 [ Links ]
Jordán–Dahlgren E. 2002. Gorgonian distribution patterns in coral reef environments of the Gulf of Mexico: Evidence of sporadic ecological connectivity? Coral Reefs 21: 205–215. [ Links ]
Knowlton N, Weil E, Weigt LA, Guzmán HM. 1992. Sibling species in Montastraea annularis, coral bleaching and the coral climate record. Science 255: 330–333. [ Links ]
Knutson DW, Buddemeier RW, Smith SV. 1972. Coral chronometers: Seasonal growth bands in reef corals. Science 177: 270–272. [ Links ]
Lang J, Alcolado P, Carricart–Ganivet JP, Chiappone M, Curran A, Dustan P, Gaudian G, Geraldes F, Gittings S, Smith R, Tunnell JW, Wiener J. 1998. Status of coral reefs in the northern areas of the wider Caribbean. In: Wilkinson C (ed.), Status of Coral Reefs of the World: 1998. Australian Institute of Marine Science, Townsville, pp. 123–134. [ Links ]
Liley PE, Gambill WR. 1986. Sección 3. Datos de Física y Química. In: Perry RH, Chilton CH (eds.), Manual del Ingeniero Químico. Vol. 1. Quinta edición (segunda edición en español). McGraw–Hill, México DF. [ Links ]
Merino M. 1997. Upwelling on the Yucatan Shelf: Hydrographic evidence. J. Mar. Res. 13: 101–121. [ Links ]
Rayner NA, Parker DE, Horton EB, Folland CK, Alexander LV, Rowell DP, Kent EC, Kaplan A. 2003. Global analyses of sea surface temperature, sea ice, and night marine air temperature since the late nineteenth century. J. Geophys. Res. 108: 4407, doi:10.1029/2002JD002670. [ Links ]
Weil E, Knowlton N. 1994. Multi–character analysis of the Caribbean coral Montastraea annularis (Ellis and Solander 1786) and its two sibling species, M. faveolata (Ellis and Solander 1786) and M. franksi (Gregory 1895). Bull. Mar. Sci. 55: 151–175. [ Links ]
Wórum FP, Carricart–Ganivet JP, Benson L, Golicher D. 2007. Simulation and observations of annual density banding in skeletons of Montastraea (Cnidaria: Scleractinia) growing under thermal stress associated with ocean warming. Limnol. Oceanogr. 52: 2317–2323. [ Links ]
Zavala–Hidalgo J, Parés–Sierra A, Ochoa J. 2002. Seasonal variability of the temperature and heat fluxes in the Gulf of Mexico. Atmósfera 15: 81–104. [ Links ]
Zavala–Hidalgo J, Morey SL, O'Brien JJ. 2003. Seasonal circulation on the western shelf of the Gulf of Mexico using a high–resolution numerical model. J. Geophys. Res. 108(C12): 3389, doi:10.1029/2003JC001879. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF














