Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.35 n.2 Ensenada Jun. 2009
Artículos de investigación
Reproductive biology of the cockle Cerastoderma glaucum (Mollusca: Bivalvia) from the north coast of Sfax (Gulf of Gabes, Tunisia)*
Biología reproductiva del berberecho Cerastoderma glaucum (Mollusca: Bivalvia) de la costa norte de Sfax (Golfo de Gabes, Túnez)
A Derbali*, O Jarboui, M Ghorbel
Institut National des Sciences et Technologies de la Mer, BP 1035, 3018 Sfax, Tunisia. * E–mail: derbali09@yahoo.fr
Recibido en diciembre de 2008.
Aceptado en marzo de 2009.
Abstract
The reproductive cycle of the cockle Cerastoderma glaucum from the Gulf of Gabes (southern Tunisia) was studied during a one–year period (January to December 2007). The overall samples presented a balanced sex ratio, with males dominating among smaller individuals and females predominating in larger size classes. Males were found to mature between 12 and 20 mm shell length (SL), whereas females matured between 14 and 21 mm SL. The size at which 50% of the population reached maturity was 15.14 and 16.78 mm SL for males and females, respectively. The seasonal changes assessed through macro– and microscopic properties in the gonads of both sexes indicated a clearly defined annual reproductive cycle. Reproductive activity of C. glaucum was greatest from spring to late autumn, with two reproductive peaks (May and November). Gametogenic activity in both sexes was apparently triggered by the rising seawater temperature during spring and summer. These results support previous findings of latitudinal changes in the reproductive behaviour of C. glaucum. Due to the extensive period of gonadal activity, C. glaucum exhibited a short resting phase that occurred simultaneously in both sexes throughout January and February. Upon inspection for parasitic infections, 15% of C. glaucum were found infected by digenean trematode species. The number of specimens showing digenean infestations differed with size class, with a tendency to increase significantly with cockle size.
Key words : Cerastoderma glaucum, Gulf of Gabes, parasites, reproductive cycle, sex ratio, size at maturity.
Resumen
Se estudió el ciclo reproductivo del berberecho Cerastoderma glaucum del Golfo de Gabes (sur de Túnez) durante un periodo de un año (enero a diciembre de 2007). Las muestras en general presentaron una razón de sexos balanceada, con los machos predominando entre los individuos de menor talla y las hembras entre los de mayor talla. Los machos maduraron al alcanzar entre 12 y 20 mm de longitud de concha (LC) y las hembras entre 14 y 21 mm LC. La talla a la cual 50% de la población alcanzó la madurez fue de 15.14 y 16.78 mm LC para machos y hembras, respectivamente. Los cambios estacionales evaluados a través de propiedades macro y microscópicas de las gónadas de ambos sexos indicaron un ciclo reproductivo anual bien definido. La actividad reproductiva de C. glaucum fue mayor entre primavera y finales de otoño, mostrando dos picos (mayo y noviembre). La actividad gametogénica en ambos sexos aparentemente fue provocada por el incremento en la temperatura del agua de mar durante la primavera y el verano. Estos resultados apoyan lo informado anteriormente en cuanto a cambios latitudinales en el patrón reproductivo de C. glaucum. Debido al extenso periodo de actividad gonádica, C. glaucum presentó una fase corta de descanso, simultánea en ambos sexos durante enero y febrero. Se examinaron los especímenes para detectar infestaciones parasíticas, encontrándose que 15% de aquellos estaban infectados por especies de tremátodos digéneos. El número de especímenes que mostraron tales infestaciones difirió según la clase de talla, con una tendencia a incrementar significativamente con la talla.
Palabras clave: Cerastoderma glaucum, ciclo reproductivo, Golfo de Gabes, parásitos, razón de sexos, talla de madurez.
Introducción
El berberecho Cerastoderma glaucum (Bruguière 1789) es una de las especies de bivalvos más abundantes en los fondos blandos de bahías y lagunas costeras. Esta especie presenta una amplia distribución geográfica, desde los mares Báltico y del Norte hasta el Mar Mediterráneo (Boyden y Russell 1972, Zaouali 1975, Labourg y Lasserre 1980, Brock y Christiansen 1989). Se encuentra a lo largo de las costas del sur de Túnez, las cuales albergan importantes recursos para las pesquerías de almeja. Los berberechos comúnmente se encuentran en zonas donde las condiciones ambientales fluctúan considerablemente. Por tanto, C. glaucum podría ser una especie de interés para cultivar y/o reducir el impacto ambiental de la carga orgánica en sistemas estuarinos (Trotta y Cordisco 1998).
Se han llevado a cabo varios estudios sobre C. glaucum que han versado principalmente sobre aspectos diversos de su biología y condición ecológica, como su gametogénesis, edad, tasa de crecimiento, reproducción, mortandad y estructura poblacional (e.g., Rygg 1970; Boyden 1971; Kingston 1974; Labourg y Lasserre 1980; Wolowicz 1984, 1987; Kobina 1986; Brock 1991; Jonsson y André 1992; Gontikaki et al. 2003). Se ha publicado información sobre su madurez y desove, pero en condiciones de laboratorio y limitada a la población adriática de esta especie (Trotta y Cordisco 1998). A pesar de ser uno de los componentes más importantes de la fauna béntica, existe poca información sobre el ciclo reproductivo de C. glaucum en aguas tunecinas, limitándose a los estudios realizados por Zaouali (1974, 1975, 1980).
El conocimiento de la biología resproductiva de los berberechos es de gran importancia para su cultivo como alimento para peces y/o como indicador ambiental. Se ha registrado su presencia en varias zonas costeras de Túnez, por lo que se requiere información adecuada para facilitar su explotación. En este contexto, el objetivo del presente trabajo es proporcionar información básica sobre la biología reproductiva de C. glaucum mediante la evaluación de su ciclo reproductivo y, por primera vez, su razón de sexos y talla de madurez sexual. Se analizaron el índice de condición y la tasa de tejido en peso, los cuales sirven como índices del estado fisiológico general de los animales. Además se examinaron los especímenes en busca de infecciones.
Materiales y métodos
Muestreo
Durante un periodo de un año (enero de 2007 a diciembre de 2007) se muestrearon mensualmente aproximadamente 200 especímenes de C. glaucum de la costa norte de Sfax (Golfo de Gabes, sur de Túnez; fig. 1). En cada muestreo mensual, al momento de recolectar los especímenes también se registraron la temperatura y la salinidad del agua de mar. Asimismo, al inicio se registraron la longitud de la concha (LC, mm) y el peso total (PT, g) de cada espécimen de C. glaucum, utilizando para ello un calibrador digital (precisión de 0.01 mm) y una balanza digital de plataforma (precisión de 0.001 g), respectivamente. Se estimaron relaciones entre LC y PT por separado para cada sexo.

Análisis reproductivo
Los tejidos blandos de todos los especímenes fueron separados cuidadosamente de las conchas y enjuagados en agua destilada para eliminar la tierra. Se secaron tanto los tejidos blandos como las conchas en un horno a 60°C durante 48 h y se pesaron. El índice de condición (IC) se calculó individualmente como la razón entre el peso seco de los tejidos blandos y el peso seco de la concha (PCi) x 100 (Walne 1976). Con los datos obtenidos también se calculó la tasa de tejido en peso (TTeP): TTeP = TeP (g)/{(TeP (g) + PCi (g))} x 100 (Choi y Chang 2003).
El estado reproductivo de los especímenes se determinó mediante (1) la inspección de la apariencia macroscópica de la gónada y (2) el análisis microscópico de frotis de los productos sexuales (el grado de madurez se explica abajo). Dado que C. glaucum no presenta dimorfismo sexual externo, se separaron las valvas de la concha y se realizó una estimación subjetiva del volumen de la gónada. La masa visceral se desprendió y se examinaron frotis de la pared visceral con restos de gónada a una magnificación de 100x. Se determinó el sexo y la etapa de madurez de cada individuo con base en el tamaño de la gónada, la presencia o ausencia de células germinales maduras o inmaduras y el color de la gónada. Se determinó la razón de sexos (expresada como el número de hembras por macho, H:M) y, para ambos sexos, se calculó el porcentaje de individuos maduros en intervalos de 1 mm. Se ajustó una ojiva logística a los datos para estimar la talla a la que 50% de los individuos (LC50%) se encontraron sexualmente maduros.
Los especímenes de ambos sexos fueron divididos en cinco grupos de madurez de acuerdo con las descripciones de Boyden (1971) y Wolowicz (1987), uno de las cuales incluye la condición de desove.
• Fase I: indiferenciada, inicio de la gametogénesis; gónadas no desarrolladas y el sexo aún no es distinguible.
• Fase II: en desarrollo; las gónadas empiezan a desarrollarse en el tejido del pie y alrededor de la glándula digestiva, y el sexo ya es distinguible.
• Fase III: gónadas desarrolladas, consistentes de tejido compacto, línea alargada de color blanco cremoso en machos e islas granulares de color amarillo cremoso en hembras.
• Fase IV: etapa reproductiva; gónadas infladas y maduras, islas en hembras y línea alargada en machos, derramándose.
• Fase V: en reposo, posreproducción o regresión; masa visceral flácida y gónadas desovadas, frecuentemente con pocos gametos, difíciles de distinguir por la presencia de algunos cuerpos lúteos.
Debido al parasitismo potencial en berberechos, en cada espécimen fue buscada la presencia de tremátodos digéneos con ayuda de un microscopio de disección, determinándose una prevalencia de infestaciones en relación con la talla.
Análisis estadístico
Se realizó una comparación del tamaño de los especímenes (LC y PT) entre sexos mediante una prueba Z, considerando una significancia estadística de P < 0.05 (Zar 1996). Se probó la hipótesis nula de no diferencia entre las pendientes de las relaciones entre LC y PT para machos y hembras, después de la transformación logarítmica de los datos, con una prueba t de Student (Zar 1996).
Se evaluaron las desviaciones estadísticas significativas de una proporción sexual balanceada de 1:1 mediante una prueba χ2, considerando una significancia de P < 0.05 (Zar 1996). Se realizó un análisis de varianza seguido de una prueba post hoc de Tukey (Zar 1996) para confirmar las diferencias críticas en las variables reproductivas (IC y PT) mensuales. Los resultados se presentan como la media (± desviación estándar) y se utilizó un nivel de significancia de P = 0.05 para las pruebas.
Los datos de infestaciones en los berberechos se dan como prevalencia (porcentaje de individuos de la población total infestados con especies de tremátodos), y se evaluaron las diferencias significativas entre los porcentajes de especímenes parasitados y no parasitados dentro de las clases de talla con una prueba χ2 (Zar 1996). El análisis estadístico se realizó usando el paquete Statistica 6.0 para Windows (StatSoft, Inc., 2002).
Resultados
Intervalo de talla y razón de sexos
Entre enero y diciembre de 2007 se analizaron un total de 2208 especímenes de C. glaucum (886 hembras, 817 machos y 505 de sexo indeterminado). Los individuos de ambos sexos presentaron un amplio intervalo de tallas, tanto en cuanto a LC (8.45–31.60 mm) como a PT (0.30–10.01 g), y en general las hembras fueron más grandes y pesadas (22.95 ± 3.83 mm y 3.93 ± 1.81 g, respectivamente) que los machos (21.69 ± 4.21 mm y 3.46 ± 1.74 g, respectivamente) (prueba Z, P < 0.05). Las relaciones entre LC y PT para hembras y machos resultaron estadísticamente diferentes (prueba t, g.l. = 1699, P< 0.001) (fig. 2). Los individuos de sexo indeterminado (n = 505, 22.9%) se presentaron en las muestras de enero, febrero y marzo (durante la fase de reposo o a principios de la gametogénesis).

La razón de sexos en general (H:M = 1.08:1) no difirió significativamente de la paridad (H:M = 1:1; prueba χ2, P < 0.05). Para detectar variaciones en la proporción de sexos en función del tamaño de los individuos, los datos se agruparon en clases de talla (4 mm LC) (fig. 3). Los machos predominaron entre los individuos de talla menor (<16 mm LC), mientras que hubo un balance estadístico de ambos sexos en las clases de talla intermedia (16–24 mm LC), y las hembras predominaron entre los individuos de talla mayor (>24 mm LC) (prueba χ2, P < 0.05). La fuerte correlación positiva (r = 0.952) encontrada en la regresión lineal establecida entre las clases de talla y sus respectivas razones de sexos pone de relieve la reducción de las proporciones de machos por hembras conforme incrementa la talla (fig. 3).

Talla de primera madurez
En la figura 4 se resume la relación entre el porcentaje de C. glaucum maduros y la LC total para ambos sexos. El macho maduro más pequeño midió 12 mm LC y el macho inmaduro más grande midió 20 mm SL, estimándose LC50% en 15.14 mm LC para los machos. La hembra madura más pequeña midió 14 mm LC y la hembra inmadura más grande midió 21 mm LC, estimándose LC50% en 16.78 mm LC para las hembras.

Índice de condición y tasa de tejido en peso
La temperatura del agua en la zona de estudio varió entre 12.3°C y 13.9°C en invierno y entre 21.7°C y 26.8°C en verano, registrándose los valores mayores en julio (26.8°C) y los menores en febrero (12.3°C). La salinidad presentó una fluctuación anual entre 30.6 en invierno y 48 en verano (fig. 5).
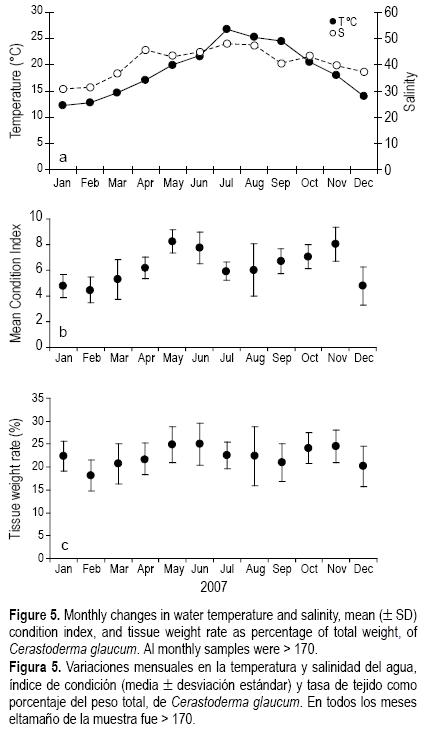
En la figura 5 se muestran los cambios mensuales del IC y la TTeP de C. glaucum. El IC varió significativamente a lo largo del año de estudio, observándose dos picos, uno en mayo y otro en noviembre, en los muestreos con altas proporciones de gónadas maduras. Los análisis estadísticos mostraron que no hubo cambios significativos en los IC de mayo y noviembre. Los valores mínimos del IC registrados en diciembre, enero y febrero fueron significativamente diferentes de los encontrados en mayo y junio, así como de los de otoño (análisis de varianza, post hoc de Tukey, P < 0.05). Este índice presentó una tendencia a decrecer en julio (en la fase de desove parcial), permaneciendo constante en agosto, antes de incrementar gradualmente en septiembre, pero las diferencias entre los valores de septiembre y noviembre no fueron significativas (análisis de varianza, post hoc de Tukey, P < 0.05). Los cambios mensuales observados para la TTeP fueron similares a los del IC.
Cambios gonádicos estacionales
Cerastoderma glaucum presentó un ciclo reproductivo anual en la zona costera de Sfax y la apariencia externa de las gónadas tanto de las hembras como de los machos varió en cuanto a tamaño y color. Las gónadas empezaron a desarrollarse en el tejido del pie y alrededor de la glándula digestiva, alcanzando un tamaño considerable durante la temporada de reproducción y casi desapareciendo durante el periodo de menor actividad reproductiva.
Ambos sexos mostraron proporciones variables de todas las fases gametogénicas a lo largo del año, pero su importancia varió durante el ciclo reproductivo (fig. 6). Los resultados de este estudio indican que una gran proporción de la población desova dos veces al año, en mayo/junio y en octubre/noviembre. La gametogénesis no ocurrió hasta febrero. Posteriormente se registró un desarrollo gametogénico muy rápido (etapa b) para ambos sexos en marzo y principios de abril, resultando en una gran expansión de la masa visceral. En marzo, los individuos de ambos sexos se encontraron en las etapas previtelogénica y de desarrollo temprano; sin embargo, se registraron porcentajes bajos (15% para hembras y 8% para machos) de estas etapas en abril, cuando la mayoría de los machos y hembras alcanzaron la madurez gonádica (etapa c) (86.5% y –80%, respectivamente). La frecuencia de machos y hembras maduros fue alta durante mayo y junio (mayor que 90%). El desove comenzó en julio para ambos sexos, pero la mayoría de las hembras mostraron un periodo de desove relativamente más largo que el de los machos. Después del desove, los individuos permanecieron desovados hasta agosto.
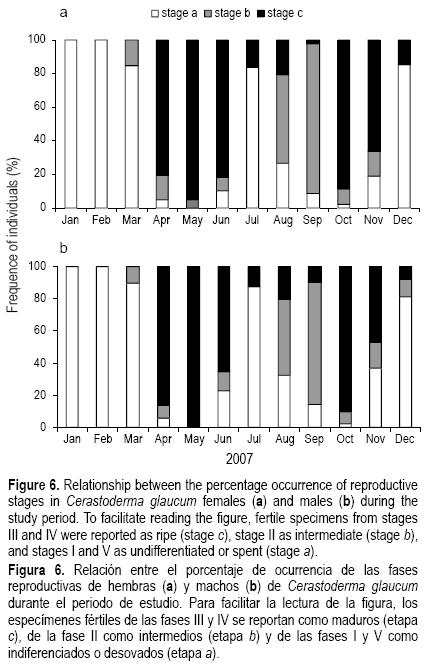
El segundo desarrollo gametogénico de machos y hembras decayó fuertemente en agosto para luego permanecer a un nivel alto en septiembre. Los berberechos aparentemente también experimentaron una gametogénesis rápida, ya que no se encontraron individuos indeterminados en septiembre. La maduración de ambos sexos sucedió de forma muy rápida y el porcentaje de machos y hembras maduras incrementó considerablemente de septiembre a noviembre. En plena madurez, el porcentaje de individuos maduros fue alrededor de 90% para los machos y 88.7% para las hembras. La segunda temporada de desove comenzó a finales de otoño y continuó durante principios de invierno (noviembre/diciembre). En noviembre, la actividad de desove empezó más temprano en los machos (34.7%) que en las hembras (≈16%). Los principales periodos gametogénicos y de desove de ambos sexos durante el año se presentaron de forma casi sincrónica y aparentemente fueron provocados por el incremento en la temperatura del agua de mar. Las gónadas de ambos sexos permanecieron sexualmente inactivas de diciembre a febrero según lo indica la ocurrencia de la etapa posreproductiva en diciembre y la fase de reposo en enero y febrero, durante la cual las gónadas permanecen indiferenciadas. Esta etapa coincide con el periodo de menor temperatura del agua en invierno.
Infestación de berberechos
Al examinar los especímenes de C. glaucum se encontró que 15% estaban infestados por parásitos. Todos los individuos parasitados se encontraban infestados por tremátodos digéneos y la mayoría albergaba más de una especie de parásito. Las especies de tremátodos dominantes, los cuales principalmente se encontraron en adultos, fueron Gymnophallus choledocus, Labratrema minimus, Himasthla elongata y Psilostomum brevicolle. Las metacercarias de estas especies ocupaban gran parte de la masa visceral y las gónadas de los individuos. Los tremátodos mostraron una fuerte especificidad para los tejidos de órganos, encontrándose H. elongata casi exclusivamente en el pie, P. brevicolle y G. choledocus sólo en la masa visceral, y L. minimus en la glándula digestiva y gónada. El número de individuos infestados difirió con la clase de talla, y la prevalencia tendió a incrementar significativamente con el tamaño de los berberechos (prueba χ2, P < 0.05) (fig. 7).

Discusión
Los especímenes de C. glaucum recolectados en este estudio mostraron características similares a las descritas para otras especies de moluscos. Las relaciones entre PT y LC difieren de tal manera que las hembras presentan un mayor peso para una cierta longitud. Las curvas de ambos sexos para estas relaciones coinciden en cuanto a los valores bajos de LC, pero divergen conforme se incrementa la LC. Hexaplex trunculus del sur de Portugal mostró tendencias similares (Paulo et al. 2008).
En el presente trabajo se encontró una razón de sexos balanceada estadísticamente en relación con la clase de talla, lo cual concuerda con estudios similares realizados con otras especies de moluscos como H. trunculus de España (Tirado et al. 2002) y Portugal (Paulo et al. 2008). Los machos predominaron entre los individuos de menor talla, mientras que las hembras lo hicieron entre los de mayor talla. Por lo contrario, Wolowicz (1984) sugirió que la razón de sexos en la población de C. glaucum no varía con la edad. Ansell (1961) también llegó a la misma conclusión al estudiar Venus striatula. Además, una especie de murícido (Bolinus brandaris) de España presentó una población sesgada hacia las hembras, pero la estructura de tallas fue similar para ambos sexos (Ramón y Amor 2002). En general las hembras son más comunes en poblaciones más viejas de moluscos gonocorísticos (Fretter y Graham 1964), y el incremento de esta proporción de hembras con la talla podría explicarse por el crecimiento diferencial entre sexos, en el que las hembras destinan mayor energía al crecimiento que a la reproducción.
La talla de madurez sexual indicó que los machos maduraron a una menor LC que las hembras y alcanzaron una menor LC máxima. No existen más datos para poder realizar una comparación directa con C. glaucum; sin embargo, para otra especie morfológicamente similar, C. edule, de las costas de Francia, se registró una talla de primera madurez de alrededor de 20 mm (Dabouineau y Ponsero 2004), la cual es ligeramente mayor que nuestro registro para C. glaucum.
La madurez sexual de bivalvos se clasifica según sus propiedades microscópicas, tales como la presencia de gametos en las gónadas y el grado de su desarrollo (Kingston 1974, Keck et al. 1975), aunque a veces se puede determinar a través de propiedades macroscópicas, como por la apariencia y el color del tejido del pie. En especies de las familias Pectinidae, Mytilidae y Limidae, se puede determinar tanto el sexo como el grado de desarrollo gonádico por el color de las gónadas (Lubet 1959). Se desarrolló una nueva modificación de la escala de madurez gonádica para bivalvos con base en la clasificación aceptada por Boyden (1971), Wolowicz (1987) y Trotta y Cordisco (1998), tomando en consideración las propiedades macro y microscópicas. Es importante que esta clasificación permita la consideración simultánea de la oogénesis y la espermatogénesis, y permita distinguir la etapa posreproductiva. En caso de dificultades en la determinación del sexo, es común incluir una etapa adicional no identificada.
El ciclo reproductivo de los bivalvos generalmente presenta el siguiente patrón: un desarrollo progresivo de una condición en la cual no es posible diferenciar las gónadas, seguida por la diferenciación de las gónadas (gametogénesis y maduración de los gametos), hasta el desove (con expulsión parcial o completa de gametos), para luego regresar a una de las etapas anteriores (Boyden 1971). En el presente estudio se observó en C. glaucum un ciclo de maduración gonádica similar, comenzando con una proliferación gametogénica de las gónadas a principios de primavera (marzo), después de una fase de indeterminación sexual durante los meses fríos de invierno, y culminando con el desove en verano. Se ha informado de una secuencia de eventos similar en poblaciones de C. glaucum y C. edule de Inglaterra (Boyden 1971), Túnez (Zaouali 1974, 1975, 1980) e Italia (Matozzo y Marin 2007); sin embargo, Creek (1960) encontró que las gónadas inician la gametogénesis más temprano, durante los meses de invierno.
En este estudio, una de las características más evidentes del ciclo gametogénico de C. glaucum fue la ocurrencia simultánea de las distintas fases de desarrollo en ambos sexos durante casi todo el año. Se observaron individuos desarrollados sexualmente a lo largo de todo el año, excepto en enero y febrero (fase de reposo) cuando las gónadas de la mayoría de la población se encuentran inactivas. Se compararon los cambios en la biología reproductiva de C. glaucum entre zonas geográficas. Brock y Wolowicz (1994) mencionan que esta especie entra en la fase de madurez sexual una vez al año en el Mar Báltico y dos veces al año en el norte del Mar Mediterráneo. En C. glaucum de la Laguna de Lesina (sur de Italia), Trotta y Cordisco (1998) encontraron gónadas activas durante todo el año, mientras que en las lagunas de Túnez, Zaouali (1975) observó que esta especie desarrolla gónadas todo el año excepto durante un mes en otoño. Es común observar que una misma especie de una misma zona geográfica puede presentar diferencias en el ciclo reproductivo de un sitio a otro. Esto podría explicarse por la variabilidad ambiental (temperatura, salinidad, disponibilidad de alimento, etc.) relacionada con la definición y el control de la gametogénesis (Lubet y Mann 1987, Lubet 1991).
La actividad gametogénica en la población bajo estudio estuvo relacionada con el incremento en la temperatura del agua. La inactividad sexual podría coincidir con un periodo de baja temperatura en la zona de estudio. En general se sabe que los bivalvos presentan considerable variación en sus hábitos gametogénicos (Stephen 1980, Thorarinsdottir 1993). Las diferencias en cuanto al tiempo en que ocurre la gametogénesis o el desove de una especie a lo largo de un intervalo latitudinal están asociadas con el hecho de que las temperaturas críticas se presentan en diferentes momentos (Hesselman et al. 1989). Según Wada et al. (1995), el ciclo gametogénico de bivalvos puede verse influenciado por variaciones en factores ambientales como la temperatura y la disponibilidad de alimento, especialmente por la primera. Asimismo, Jaramillo y Navarro (1995) sugieren que el desove puede ser inducido por una combinación de factores internos y ambientales, y que su interacción puede cambiar temporalmente, produciendo variaciones anuales en el inicio y la intensidad del desove. Las pequeñas variaciones en la temperatura y disponibilidad de nutrientes podrían explicar las largas fases de madurez y desove, tal y como se ha sugerido en la literatura (Vélez y Epifanio 1981, Bayne y Newel 1983, Joseph y Madhyastha 1984, Fournier 1992, Pouvreau et al. 2000).
Petersen (1958) y Wolowicz (1984) observaron cambios estacionales en el peso corporal de C. glaucum. Las fluctuaciones del IC pueden ser una consecuencia de los cambios en el peso corporal (Giese y Pearse 1974). Los valores más altos se registraron en primavera y otoño, y los más bajos en verano e invierno. Nuestro estudio confirma estas observaciones. El incremento en peso corporal durante la primavera y el otoño estuvo relacionado con el desarrollo de las gónadas. Inmediatamente después de la reproducción se observó una gran reducción en peso corporal. Esto indica que las células reproductivas fueron responsables de las fluctuaciones en el peso corporal.
Varios trabajos han atribuido las infecciones en especies de la familia Cardiidae a infestaciones de tremátodos a lo largo de su área de distribución, incluyendo en Alemania (Lauckner 1971, Thieltges y Reise 2006), Francia (Desclaux 2003, Baudrimont et al. 2006) y Suecia (Jonsson y André 1992). Existe información más detallada sobre el impacto de las infecciones parasíticas en C. edule que en C. glaucum. Tales infecciones restringen su capacidad para excavar (Lauckner 1971) y su crecimiento (Wegeberg y Jensen 2003), e incrementan su mortandad (Jonsson y André 1992, Wegeberg y Jensen 1999, Desclaux et al. 2004, Thieltges 2006). Una característica importante observada en algunos sitios es que la prevalencia de las infecciones resultó mayor en los individuos adultos que en los juveniles (Thieltges y Reise 2006). Esto se vió reflejado en nuestros resultados, ya que el número de especímenes infectados por tremátodos digéneos difirió con la clase de talla, tendiendo a incrementar con la talla. Esta mayor prevalencia podría explicarse debido a que los adultos, de mayor talla y edad, han estado expuestos durante más tiempo a las etapas parasíticas infecciosas que los juveniles.
En este trabajo se ha generado información básica detallada sobre la talla de primera madurez, la razón de sexos, los cambios gonádicos estacionales y las infecciones de C. glaucum. Este estudio de línea base puede servir de referencia para futuras investigaciones sobre invertebrados marinos útiles como indicadores del impacto ambiental de cargas orgánicas en sistemas estuarinos, así como para el futuro cultivo de C. glaucum. Se requieren estudios adicionales para obtener datos cuantitativos de la presencia de parásitos en las gónadas de C. glaucum de la zona de estudio y determinar su impacto en el ciclo reproductivo.
Agradecimientos
Este trabajo recibió apoyo financiero del INSTM (Sfax). Se agradece al personal técnico y de apoyo su ayuda en el campo y el laboratorio, así como a los revisores anónimos cuyas sugerencias y comentarios ayudaron a mejorar el manuscrito sometido.
Referencias
Ansell AD. 1961. Reproduction, growth and mortality of Venus striatula (Da Costa) in Kames Bay, Millport. J. Mar. Biol. Assoc. UK 41: 191–215. [ Links ]
Baudrimont M, De Montaudouin X, Palvadeau A. 2006. Impact of digenean parasite infection on metallothionein synthesis by the cockle (Cerastoderma edule): A multivariate field monitoring. Mar. Pollut. Bull. 52: 494–502. [ Links ]
Bayne BL, Newel RC. 1983. Physiological energetics of marine molluscs. In: Saleuddin ASM, Wilbur KM (eds.), The Mollusca. Academic Press, London, pp. 407–515. [ Links ]
Boyden CR. 1971. A comparative study of the reproductive cycles of the cockles Cerastoderma edule and C. glaucum. J. Mar. Biol. Assoc. UK 51: 605–622. [ Links ]
Boyden CR, Russell PJC. 1972. The distribution and habitat range of a brackish water cockle Cardium (Cerastoderma) in the British Isles. J. Anim. Ecol. 41: 719–734. [ Links ]
Brock V. 1991. An interdisciplinary study of evolution in the cockles Cardium (Cerastoderma) edule, C. glaucum, and C. lamarcki. Vestjydsk Forlag, Vinderup, Denmark. [ Links ]
Brock V, Christiansen G. 1989. Evolution of Cardium (Cerastoderma) edule, C. lamarcki, and C. glaucum: Studies of DNA–variation. Mar. Biol. 102: 505–511. [ Links ]
Brock V, Wolowicz M. 1994. Comparisons of European populations of the Cerastoderma glaucum/C. lamarcki complex based on reproductive physiology and biochemistry. Oceanol. Acta 17: 97–103. [ Links ]
Choi YH, Chang YJ. 2003. Gametogenic cycle of the transplanted–cultured pearl oyster, Pinctada fucata martensii (Bivalvia: Pteriidae) in Korea. Aquaculture 220: 781–790. [ Links ]
Creek GA. 1960. The development of the lamellibranch (Cardium edule). Proc. Zool. Soc. Lond. 135: 243–260. [ Links ]
Dabouineau L, Ponsero A. 2004. Synthèse sur la biologie des coques Cerastoderma edule. Réserve Naturelle Baie de St–Brieuc, 16 pp. [ Links ]
Desclaux C. 2003. Interactions hôtes–parasites: Diversité, mécanismes d'infestation et impact des trématodes digénes sur les coques Cerastoderma edule (mollusque bivalve) en milieu lagunaire macrotidal. Ph.D. thesis, Univ. Bordeaux. [ Links ]
Desclaux C, De Montaudouin X, Bachelet G. 2004. Cockle (Cerastoderma edule) population mortality: The role of the digenean parasite Himasthla quissetensis. Mar. Ecol. Prog. Ser. 279: 141–150. [ Links ]
Fournier ML. 1992. The reproductive biology of the tropical rocky oyster (Ostrea iridescens) (Bivalvia: Ostreidae) on the Pacific coast of Costa Rica. Aquaculture 101: 371–378. [ Links ]
Fretter V, Graham A. 1964. Reproduction. In: Wilbur KM (ed.), Physiology of Mollusca. Academic Press, New York, pp. 127–164. [ Links ]
Giese AC, Pearse JS. 1974. Introduction: General principles. In: Giese AC, Pearse JS (eds.), Reproduction of Marine Invertebrates. Academic Press, New York, pp. 1–49. [ Links ]
Gontikaki E, Antoniadou C, Chintiroglou CC. 2003. Population structure of Cerastoderma glaucum and Abra ovata in Vouliagmeni Lagoon (Attiki). J. Mar. Biol. Assoc. UK 83: 1095–1097. [ Links ]
Hesselman DM, Barber BJ, Blake NJ. 1989. The reproductive cycle of adult hard clams, Mercenaria spp., in the Indian River Lagoon, Florida. J. Shellfish Res. 8: 43–49. [ Links ]
Jaramillo R, Navarro J. 1995. Reproductive cycle of the Chilean ribbed mussel Aulacomya ater (Molina, 1982). J. Shellfish Res. 14: 165–171. [ Links ]
Jonsson PR, André C. 1992. Mass mortality of the bivalve Cerastoderma edule on the Swedish west coast by infestation with the digenean trematode Cercaria cerastodermae I. Ophelia 36: 151–157. [ Links ]
Joseph MM, Madhyastha MN. 1984. Annual reproductive cycle and sexuality of the oyster Crassostrea madrasensis (Preston). Aquaculture 40: 223–231. [ Links ]
Keck RT, Maurer D, Lind H. 1975. A comparative study of the hard clam gonad development cycle. Biol. Bull. 148: 243–258. [ Links ]
Kingston PF. 1974. Studies on the reproductive cycles of Cardium edule and C. glaucum. Mar. Biol. 28: 317–323. [ Links ]
Kobina Y. 1986. Observations on byssus systems in the spat of Cerastoderma glaucum and C. edule. J. Mar. Biol. Assoc. UK 66: 277–292. [ Links ]
Labourg PJ, Lasserre G. 1980. Dynamique des populations de Cerastoderma glaucum dans une lagune aménagée de la région d'Arcachon. Mar. Biol. 60: 147–157. [ Links ]
Lauckner G. 1971. Zur Trematodenfauna der Herzmuscheln Cardium edule und Cardium Lamarcki. Helgol. Wiss. Meeresunters. 22: 377–400. [ Links ]
Lubet P. 1959. Recherches sur le cycle sexuel et l'émission des gamètes chez les Mytilidés et les Pectinidés (mollusques bivalves). Rev. Trav. Inst. Pêches Marit. 23: 387–548. [ Links ]
Lubet P. 1991. Reproduction des mollusques. In: Barnabé G (coord.), Bases Biologiques de l'Aquaculture. Tec et Doc, Lavoisier, pp. 167–203. [ Links ]
Lubet P, Mann R. 1987. Les différentes modalités de la reproduction chez les mollusques bivalves. Haliotis 16: 181–195. [ Links ]
Matozzo V, Marin MG. 2007. First evidence of altered vitellogenin–like protein levels in clam Tapes philippinarum and in cockle Cerastoderma glaucum from the Lagoon of Venice. Mar. Pollut. Bull. 55: 494–504. [ Links ]
Paulo V, Belisandra L, Margarida C, Miguel BG. 2008. Gametogenic cycle of Hexaplex (Trunculariopsis) trunculus (Gastropoda: Muricidae) in the Ria Formosa lagoon (Algarve coast, southern Portugal). J. Mar. Biol. Assoc. UK 88: 321–329. [ Links ]
Petersen GH. 1958. Notes of the growth and biology of the different Cardium species in Danish brackish water areas. Medd. Danm. Fisk. Havunders. 2: 1–31. [ Links ]
Pouvreau S, Gangnery A, Tiapari J, Lagarde F, Garnier M, Bodoy A. 2000. Gametogenic cycle and reproduction effort of the tropical blacklip pearl oyster (Pinctada margaritifera) (Bivalvia: Pteriidae), cultivated in Taxapoto atoll (French Polynesia). Aquat. Living Resour. 13: 37–48. [ Links ]
Ramón M, Amor MJ. 2002. Reproductive cycle of Bolinus brandaris and penis and genital duct size variations in a population affected by imposex. J. Mar. Biol. Assoc. UK 82: 435–442. [ Links ]
Rygg B. 1970. Studies on Cerastoderma edule (L.) and Cerastoderma glaucum (Poiret). Sarsia 4: 65–80. [ Links ]
Stephen D. 1980. The reproductive biology of the Indian oyster Crassostrea madrasensis (Perston). I. Gametogenic pattern and salinity. Aquaculture 21: 139–146. [ Links ]
Thieltges DW. 2006. Parasite induced summer mortality in the cockle Cerastoderma edule by the trematode Gymnophallus choledocus. Hydrobiologia 559: 455–461. [ Links ]
Thieltges DW, Reise K. 2006. Metazoan parasites in intertidal cockles Cerastoderma edule from the northern Wadden Sea. J. Sea Res. 56: 284–293. [ Links ]
Thorarinsdottir GG. 1993. The Iceland scallop, Chlamys islandica (OF Muller), in Breidafjordur, West Iceland. II. Gamete development and spawning. Aquaculture 110: 87–96. [ Links ]
Tirado C, Rodríguez de la Rúa A, Brusón, MA, López JI, Salas C, Márquez I. 2002. La reproducción de bivalvos y gasterópodos de interés pesquero en Andalucía. Consejería de Agricultura y Pesca, Junta de Andalucía, Huelva. [ Links ]
Trotta P, Cordisco CA. 1998. Gonadal maturation, conditioning, and spawning in the laboratory and maturation cycle in the wild of Cerastoderma glaucum Bruguière. J. Shellfish Res. 17: 919–923. [ Links ]
Vélez A, Epifanio CE. 1981. Effects of temperature and ration on gametogenesis and growth in the tropical mussel (Perna perna L). Aquaculture 22: 21–26. [ Links ]
Wada KT, Komaru A, Ichimura Y, Kurosaki H. 1995. Spawning peak occurs during winter in the Japanese subtropical population of the pearl oyster, Pinctada fucata fucata (Gould 1850). Aquaculture 133: 207–214. [ Links ]
Walne PR. 1976. Experiments on the culture in the sea of the butterfish Venerupis decussata L. Aquaculture 8: 371–381. [ Links ]
Wegeberg AM, Jensen KT. 1999. Reduced survivorship of Himasthla (Trematode, Digenea): Infected cockles (Cerastoderma edule) exposed to oxygen depletion. J. Sea Res. 42: 325–331. [ Links ]
Wegeberg AM, Jensen KT. 2003. In situ growth of juvenile cockles, Cerastoderma edule, experimentally infected with larval trematodes (Himasthla interrupta). J. Sea Res. 50: 37–43. [ Links ]
Wolowicz M. 1984. Cardium glaucum (Poiret 1789) population from Gdansk Bay (Baltic Sea). Pol. Arch. Hydrobiol. 31: 33–44. [ Links ]
Wolowicz M. 1987. A comparative study of a reproductive cycle of cockles Cardium glaucum (Poiret 1789) and C. hauniense (Petersen, Russell 1971) (Bivalvia), from Gdansk Bay. Pol. Arch. Hydrobiol. 34: 91–105. [ Links ]
Zaouali J. 1974. Les peuplements malacologiques dans les biocoenoses lagunaires tunisiennes. Etude de l'espèce pionnière Cerastoderma glaucum Poiret. Ph.D. thesis, University of Caen, France. [ Links ]
Zaouali J. 1975. Etude du cycle sexuel de Cerastoderma glaucum dans les deux lagunes hyperhalines tunisiennes: Lac de Tunis et Mer de Bou Grara. Rapp. Comm. Int. Mer Medit. 23: 79–80. [ Links ]
Zaouali J. 1980. Étude du cycle sexuel de Cerastoderma glaucum (Poiret 1789) (Bivalvia, Eulamellibranchia, Cardiidae) dans la Mer de Bou Ghrara (Tunisie). Arch. Inst. Pasteur Tunis 57: 281–295. [ Links ]
Zar JH. 1996. Biostatistical Analysis. 3rd ed. Prentice–Hall, New Jersey, 662 pp. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF
Traducido al español por Christine Harris.














